-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Asociácia genetických polymorfizmov metyléntetrahydrofolát reduktázy s vrodenými chybami srdca v slovenskej populácii
Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
Background:
Maternal periconceptual folic acid supplementation is associated with decreased risk of congenital heart disease (CHD) in offspring. Methylenetetrahydrofolate reductase (MTHFR) gene 677 C→T and 1298 A→C polymorphisms influence folic acid metabolism and in some studies are associated with increased risk of CHD. We sought to determine periconceptual folic acid supplementation in Slovak mothers of offspring with CHD and to investigate association between MTHFR 677 C→T and 1298 A→C polymorphisms and CHD risk.Methods:
Between 2011 and 2014, 204 children with CHD, 144 mothers of CHD cases and 144 controls were prospectively evaluated for MTHFR 677 C→T and 1298 A→C polymorphisms.Results:
Among cases with CHD, the 677TT genotype tended to occur less frequently than in control group (OR=0.42, 95% CI 0.18–1.01; p=0.06). Analysis revealed reduced prevalence of 1298CT and 1298CC genotypes in mothers of CHD patients when compared to controls (OR=0.51, 95% CI 0.31–0.84; p=0.009 resp. OR=0.78, 95% CI 0.13–1.04; p=0.06).
Periconceptual supplementation of multivitamins with folic acid content was observed in 18.1 % of case mothers. Multivitamins intake increased to 67.4 % in this group after pregnancy was confirmed (p<0.0001). Maternal periconceptual smoking was associated with lower use of multivitamin supplements compared to non-smokers (6.5% vs. 21.8%; p=0.035).Conclusion:
We found no evidence that embryonic or maternal MTHFR gene polymorphisms that directly cause lower levels of plasma folate are associated with increased risk of CHD in Slovak population. On the contrary, some of those polymorphisms occurred less frequently in CHD population. Periconceptual multivitamin supplementation was observed in less than one fifth of mothers.Key words:
folic acid, congenital heart disease, methylenetetrahydrofolate reductase, gene polymorphism, prevention Z.
Autoři: M. Záhorec 1; D. Ilenčíková 2; S. Požgayová 2; P. Olejník 3; P. Škrak 1; Ľ. Kováčiková 1; L. Kovács 2; J. Mašura 3
Působiště autorů: Oddelenie anestéziológie a intenzívnej medicíny, Detské kardiocentrum, Národný ústav srdcových a cievnych chorôb, Bratislava primárka doc. MUDr. Ľ. Kováčiková, PhD. 1; Laboratórium klinickej a molekulovej genetiky, II. detská klinika Lekárskej fakulty Univerzity Komenského a Detskej fakultnej nemocnice s poliklinikou, Bratislava prednosta prof. MUDr. L. Kovács, DrSc., MPH 2; Klinika detskej kardiológie Lekárskej fakulty Univerzity Komenského, Detské kardiocentrum, Národný ústav srdcových cievnych chorôb, Bratislava prednosta prof. MUDr. J. Mašura, CSc. 3
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (5): 267-272.
Kategorie: Původní práce
Souhrn
Ciele:
Perikoncepčné užívanie vitamínových prípravkov s kyselinou listovou je asociované s poklesom prevalencie vrodených chýb srdca (VCHS) u živonarodených detí. Polymorfizmy 677 C→T a 1298 A→C génu pre enzým metyléntetrahydrofolát reduktáza (MTHFR) ovplyvňujú využitie kyseliny listovej v organizme a sú v niektorých prácach asociované so zvýšeným výskytom VCHS. Cieľom štúdie bolo zistiť asociáciu polymorfizmov 677 C→T a 1298 A→C s výskytom VCHS v slovenskej populácii a vyhodnotiť perikoncepčné užívanie vitamínov u slovenských matiek detí s VCHS.Metodika:
V rokoch 2011–2014 bolo prospektívne vyšetrených na polymorfizmy 677 C→T a 1298 A→C génu pre enzým MTHFR 204 pacientov s VCHS, 144 matiek detí s VCHS a 144 kontrolných vzoriek od detí bez vrodených chýb.Výsledky:
V skupine detí s VCHS bol výskyt genotypu 677TT s trendom k nižšiemu výskytu ako v kontrolnej skupine (OR = 0,42, 95% CI 0,18–1,01; p = 0,06). V skupine matiek pacientov boli genotypy 1298CT a 1298CC menej početné ako v kontrolnej skupine (OR = 0,51, 95% CI 0,31–0,84; p = 0,009 resp. OR = 0,78, 95% CI 0,13–1,04; p = 0,06).
Multivitamíny s obsahom folátu užívalo perikoncepčne 18,1 % matiek detí s VCHS, v čase už potvrdenej gravidity bolo užívanie vyššie (67,4 %; p <0,0001). Ženy, ktoré fajčili v čase otehotnenia, užívali vitamíny v perikoncepčnom období menej často ako ženy bez abúzu nikotínu (6,5 % vs. 21,8 %; p = 0,035).Záver:
V slovenskej populácii detí s VCHS a ich matiek nebol dokázaný zvýšený výskyt polymorfizmov MTHFR s rizikom zníženej hladiny kyseliny listovej. Naopak, časť potenciálne rizikových genotypov bola menej početná. Perikoncepčne užívala multivitamíny s obsahom kyseliny listovej menej ako pätina matiek detí s VCHS.Kľúčové slová:
kyselina listová, vývojové chyby srdca, metyléntetrahydrofolát reduktáza, genetický polymorfizmus, prevenciaÚVOD
Prevalencia klinicky významných vrodených chýb srdca (VCHS) dosahuje 0,5–0,9 % u živonarodených detí, pričom ide o najčastejšiu vrodenú vývojovú anomáliu. Anatómia VCHS je vysoko heterogénna a etiológia vzniku VCHS je multifaktoriálna a z veľkej časti ešte neobjasnená. Na vzniku VCHS sa s určitosťou podieľajú genetické faktory (asi u 15 % pacientov s VCHS sú identifikované extrakardiálne postihnutia zaradené do syndrómu s dokázanou genetickou anomáliou) a environmentálne faktory (choroby matky, teratogény, infekčné ochorenia matky a iné). Vo väčšine jednotlivých prípadov nie je možné dokázať kauzalitu vzniku VCHS a predpokladá sa komplexná interakcia vulnerabilného genotypu s environmentálnou záťažou [1].
Kyselina listová (vitamín B9) má špecifický význam v procese zdravého rastu a vývoja embrya. Spolu s ostatnými kofaktormi zabezpečuje efektívny transport a využitie jednouhlíkových zvyškov potrebných pri syntéze nukleotidov, premenu homocysteínu na metionín, alebo metyláciu transferovej ribonukleovej kyseliny [2]. Denná potreba kyseliny listovej je cca 100 µg, ale u tehotnej ženy sa zvyšuje až na 400–800 µg. Štúdie ukázali, že túto zvýšenú potrebu nie je možné pokryť „len“ vyváženou stravou, ale na udržanie normálnych hladín folátu v tehotenstve je potrebná suplementácia výživovými doplnkami [3, 4]. Záujem o vplyv metabolizmu kyseliny listovej na vznik vrodených vývojových chýb vznikol na základe epidemiologickej práce o pozitívnom vplyve perikoncepčnej suplementácie na znížený výskyt rázštepov neurálnej trubice [5]. Následne maďarskí autori analyzovali vplyv tejto intervencie na iné vrodené anomálie a poukázali na 43% redukciu rizika vzniku VCHS, najmä defektov komorového septa a konotrunkálnych anomálií [4].
Efektivita a rovnováha folátového metabolizmu je závislá nielen od dostatočného príjmu a vstrebávania kyseliny listovej a nutričného stavu iných mikronutrientov (najmä vitamíny B6 a B12), ale aj od genotypu jedinca. Metyléntetrahydrofolát reduktáza (MTHFR) je jedným z hlavných regulačných enzýmov metabolizmu kyseliny listovej a homocysteínu, ktorý katalyzuje premenu 10-metyléntetrahydrofolátu na 5-metyltetrahydrofolát. Aktívna forma vitamínu, 5-metyltetrahydrofolát je darcom metylovej skupiny pre remetyláciu homocysteínu na metionín. Nukleotidové polymorfizmy génu MTHFR 677 C→T a 1298 A→C sú spojené so zníženou aktivitou enzýmu. Homozygotný stav 677TT (tzv. „termolabilná forma“, 50% redukcia aktivity enzýmu pri teplote 37 °C), ktorý je pozorovaný asi u 11 % bielej populácie, je asociovaný s nižšími hladinami kyseliny listovej (genotyp 677TT je spojený s o 25 % nižšími hladinami aktívneho folátu ako genotyp 677CC) a vyššími hladinami homocysteínu v plazme. Efekt genotypu nie je aditívny, takže rozdiel v hladinách folátu medzi genotypmi 677CC a 677CT je minimálny [6]. Druhým najčastejším polymorfizmom génu MTHFR, ktorý spôsobuje zníženú aktivitu enzýmu, ale nie je termolabilný, je 1298 A→C [7]. Najväčšie nedávne zahraničné práce študujúce asociáciu polymorfizmov 677 C→T a 1298 A→C s výskytom VCHS dospeli k rozdielnym záverom s potvrdením [8, 9], resp. nedokázaním [10] vplyvu genotypu MTHFR na vznik VCHS.
Cieľom prospektívnej porovnávacej štúdie bolo zistiť asociáciu polymorfizmov 677 C→T a 1298 A→C s výskytom VCHS v slovenskej populácii a vyhodnotiť perikoncepčné užívanie vitamínov s obsahom kyseliny listovej u slovenských matiek detí s VCHS.
METODIKA
Vzorky krvi pre potreby štúdie boli získané v Detskom kardiocentre v Bratislave v rokoch 2011–2014 od hospitalizovaných pacientov s VCHS (n = 204) a ich matiek (n = 144). Po schválení štúdie nemocničnou etickou komisiou v roku 2010 bol získaný informovaný súhlas rodičov so zaradením do štúdie a odberom krvi dieťaťa a súhlas matky s jej odberom krvi. Súčasťou štúdie bolo vyplnenie dotazníka matkou so zameraním na demografické údaje, užívanie multivitamínových prípravkov a niektoré rizikové faktory pre vznik VCHS u plodu. Inklúznymi kritériami boli klinicky významná VCHS s potrebou intervenčnej liečby u dieťaťa a vek dieťaťa do 4 rokov v čase vyplnenia dotazníka z dôvodu získania spoľahlivých odpovedí na otázky o perikoncepčnom a tehotenskom období matky. Deti s trizómiou 21 (n = 29) boli zaradené do štúdie z dôvodu literárnych údajov o možnom súvise polymorfizmov MTHFR génu matiek s výskytom Downovho syndrómu a fenotypovou penetranciou VCHS u týchto detí [11]. Táto skupina pacientov bola vyhodnotená samostatne. Exklúznym kritériom bol dôkaz iného genetického syndrómu zvyšujúceho riziko VCHS u dieťaťa (iné trizómie, Turnerov syndróm, mikrodelécia 22q11 a iné). Kontrolnú skupinu predstavovali deti bez VCHS (n = 144) a bez iných vrodených alebo chronických ochorení, u ktorých sa v rokoch 2011–2012 stanovoval polymorfizmus sledovaných génov v rámci iných štúdií v Detskej fakultnej nemocnici s poliklinikou v Bratislave.
U všetkých členov súboru bola odobratá vzorka krvi (1–2 ml) do skúmavky EDTA. V molekulovo-genetickom laboratóriu II. Detskej kliniky Lekárskej fakulty Univerzity Komenského v Bratislave bola vykonaná izolácia DNA pomocou komerčne dostupného setu (Gentra®, Puregene® Blood Kit; Qiagen, Nemecko). Analýza polymorfizmov 677 C→T a 1298 A→C génu MTHFR bola realizovaná polymerázovou reťazovou reakciou (polymerase chain reaction, PCR) a následným štiepením reštrikčnou endonukleázou s vizualizáciou na gélovej elektroforéze. Pri polymorfizme 677 C→T sa reštrikčným štiepením PCR produktu získali dva fragmenty s veľkosťou 175 párov báz (bp) a 23 bp (mutovaný homozygotný genotyp 677TT), jeden neštiepený fragment s veľkosťou 198 bp (tzv. „divý“ genotyp – „wild type“ 677CC) alebo všetky tri fragmenty 198 bp, 175 bp a 223 bp (heterozygotný genotyp 677CT). Pri polymorfizme 1298 A→C sa štiepením PCR produktu získali dva fragmenty s veľkosťou 204 bp a 37 bp („divý“ genotyp 1298AA), jeden fragment 241 bp (mutovaný homozygot 1298CC) alebo tri fragmenty 241 bp, 204 bp a 37 bp u heterozygota s genotypom 1298AC.
Zozbierané dáta boli počítačovo spracované a následne štatisticky vyhodnotené pomocou programu JMP 4.0.2® (SAS Institute). Kontinuálne dáta sú prezentované ako priemer a smerodajná odchýlka (SD). Nominálne dáta sú prezentované ako percentuálny podiel. Asociácia polymorfizmov s výskytom VCHS bola stanovená výpočtom pomeru rizík (Odds ratio, OR) a 95% intervalu spoľahlivosti.
VÝSLEDKY
Na základe vyhodnotenia 132 dotazníkov matiek detí s VCHS bolo zistené perikoncepčné a tehotenské užívanie multivitamínových doplnkov, resp. kyseliny listovej. V perikoncepčnom období užívalo pravidelne multivitamíny 13,6 % (n = 18) a samostatne kyselinu listovú 4,5 % žien (n = 6). Celkovo v tomto období užívalo pravidelne prípravok s obsahom folátu 18,1 % tehotných. Z matiek detí s trizómiou 21 užívali perikoncepčne vitamíny 4 z 18 (22,2 %), čo je bez rozdielu oproti ostatným matkám (17,5 %; p = 0,64).
Po potvrdení tehotnosti pravidelne užívalo mutivitamíny 60,6 % tehotných a samostatne kyselinu listovú ďalších 6,8 % žien detí s VCHS. Celkové užívanie prípravkov s obsahom kyseliny listovej ženami v čase už preukázanej gravidity bolo 67,4 %, pričom perikoncepčne len 18,1 % (p <0,0001).
Vrodené vývojové chyby srdca u prvostupňových príbuzných uviedlo 8 zo 132 matiek (6,0 %), cukrovkou trpelo 2,3 % matiek. Pri analýze podľa ukončeného najvyššieho vzdelania matiek bolo užívanie vitamínov perikoncepčne nasledovné: 26 % vysokoškolsky vzdelaných, 15 % stredoškolsky vzdelaných a 14 % žien so základným vzdelaním (p = 0,30). Fajčenie v čase otehotnenia uviedlo 23,5 % matiek. Matky so základným vzdelaním fajčili v tomto období častejšie ako vysokoškolsky vzdelané matky (42,9 % vs. 11,9 %; p = 0,04). Ženy, ktoré fajčili v čase otehotnenia, užívali menej často vitamíny v perikoncepčnom období ako ženy bez abúzu nikotínu (6,5 % vs. 21,8 %; p = 0,035). Priemerný index telesnej hmotnosti (Body Mass Index, BMI) bol u matiek v čase otehotnenia 23,4 +/ - 4,15. Nadváhu (BMI 25–30) v čase otehotnenia uviedlo v dotazníku 25 % žien a obezitu (BMI >30) 5,4 % žien.
Polymorfizmy 677 C→T a 1298 A→C génu pre enzým MTHFR boli vyšetrené u 204 pacientov (z toho 29 malo Downov syndróm) a 144 matiek (19 matiek dieťaťa s Downovým syndrómom). Percentuálne zastúpenia jednotlivých genotypov v podskupinách pacientov s VCHS, matiek detí s VCHS, detí s trizómiou 21 a VCHS, matiek detí s trizómiou 21 a VCHS a v kontrolnej skupine (n = 144) sú uvedené v tabuľke 1.
Tab. 1. Zastúpenie jednotlivých genotypov polymorfizmov 677 C‒˃T a 1298 A‒˃C génu MTHFR. 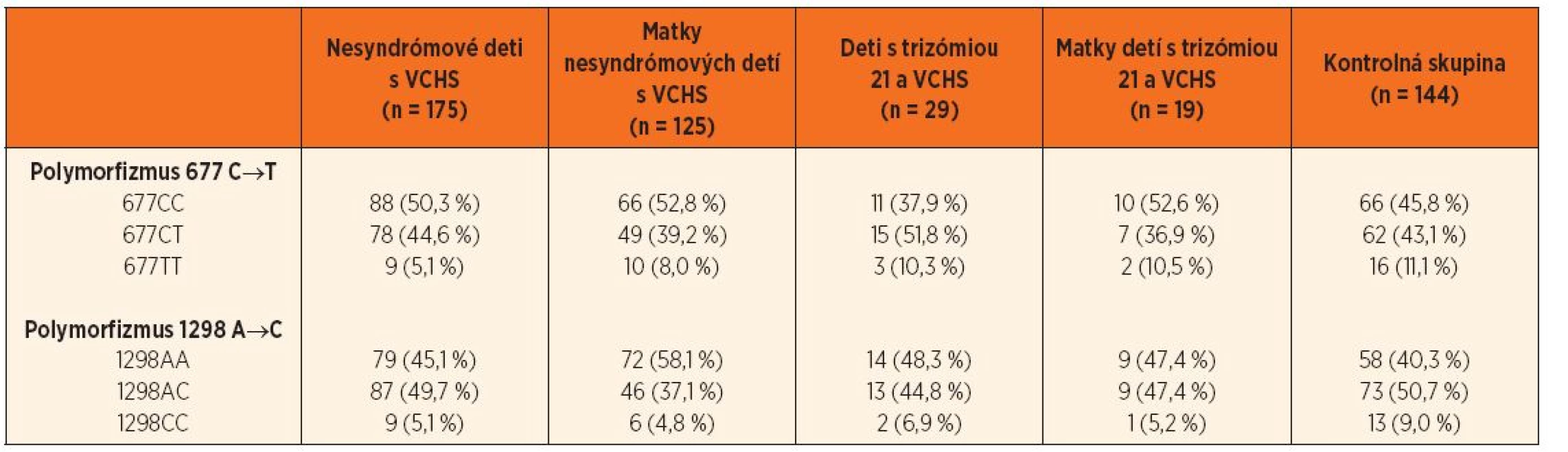
MTHFR – metyléntetrahydrofolát reduktáza, VCHS – vrodené chyby srdca V skupine nesyndrómových detí s VCHS bol výskyt genotypu 677TT hranične menej zastúpený (OR = 0,42, 95% CI 0,18–1,01; p = 0,06) ako v kontrolnej skupine. V skupine matiek nesyndrómových pacientov boli genotypy 1298CT a 1298CC menej početné ako v kontrolnej skupine (OR = 0,51, 95% CI 0,31–0,84; p = 0,009, resp. OR = 0,78, 95% CI 0,13–1,04; p = 0,06) (tab. 2 a 3).
Tab. 2. Pomer rizík (OR; 95% CI) výskytu genetického polymorfizmu 677 C‒˃T u nesyndrómových detí s VCHS a ich matiek, detí s trizómiou 21 a VCHS a ich matiek oproti kontrolnej skupine. 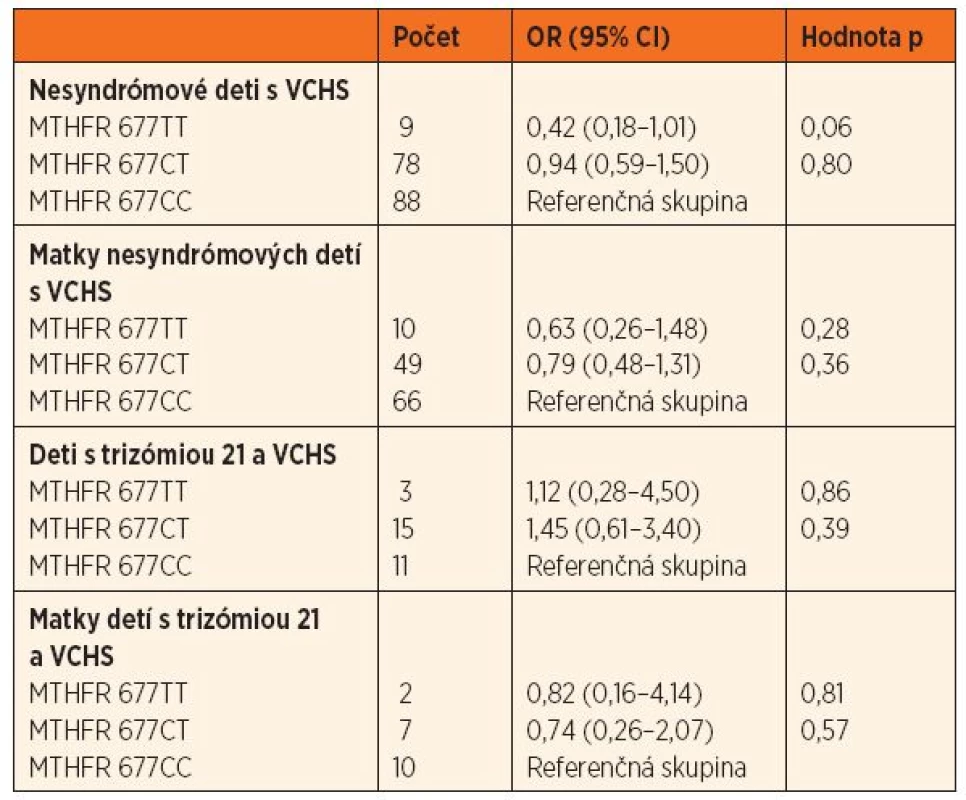
VCHS – vrodené chyby srdca; OR – odds ratio, pomer rizík; CI – confidence interval, interval spoľahlivosti; MTHFR – metyléntetrahydrofolát reduktáza Tab. 3. Pomer rizík (OR; 95% CI) výskytu genetického polymorfizmu 1298 A‒˃C u nesyndrómových detí s VCHS a ich matiek, detí s trizómiou 21 a VCHS a ich matiek oproti kontrolnej skupine. 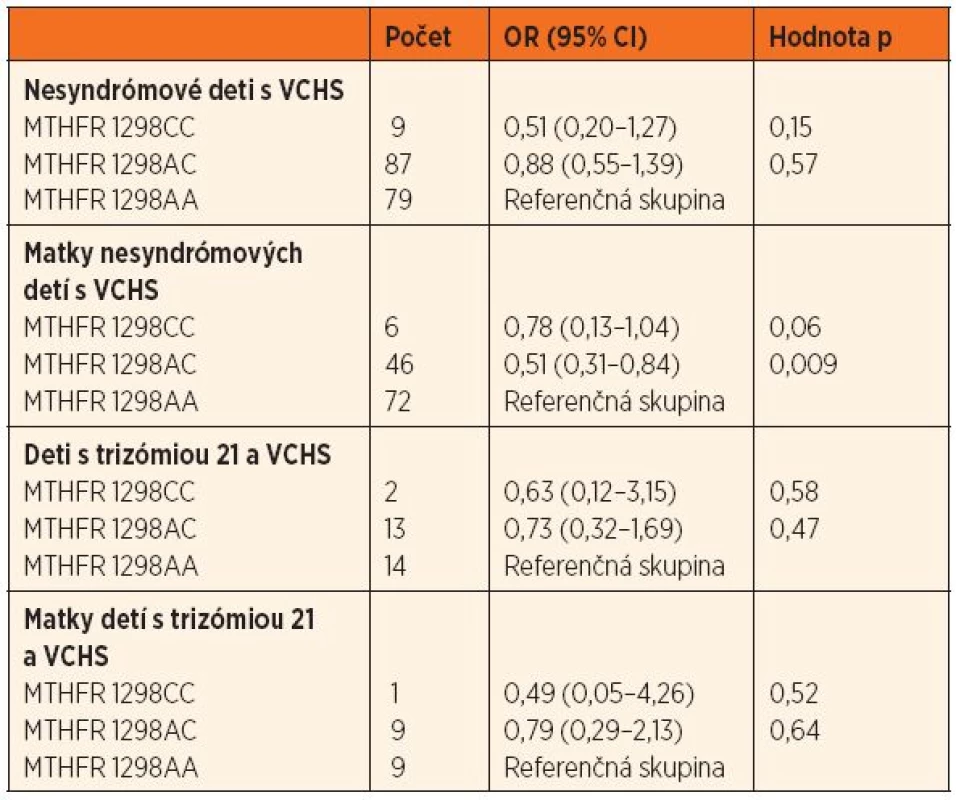
VCHS – vrodené chyby srdca; OR – odds ratio, pomer rizík; CI – confidence interval, interval spoľahlivosti; MTHFR – metyléntetrahydrofolát reduktáza DISKUSIA
Vrodené chyby srdca predstavujú významný zdroj novorodeneckej morbidity a mortality. Postupné objasňovanie komplexnej etiológie VCHS s následnou efektívnejšou primárnou prevenciou je dlhodobým cieľom výskumu v tejto oblasti. Perikoncepčné obdobie je obvykle definované rôzne v rozmedzí 4–14 týždňov pred otehotnením a 8–10 týždňov po ňom [4, 12], pričom je mimoriadne dôležité z hľadiska správnej organogenézy plodu. Štrukturálny a funkčný základ srdca sa vytvára už v najvčasnejšej fáze vývoja plodu a akcia srdca bola zachytená už od konca 1. mesiaca tehotenstva [13].
Nízky príjem kyseliny listovej perikoncepčne pôsobí negatívne na vývoj srdca u laboratórnych zvierat a je asociovaný so zvýšeným výskytom VCHS [14]. Vo väčšine veľkých populačných štúdií autori konštatovali ochranný efekt perikoncepčnej substitúcie multivitamínového prípravku s obsahom kyseliny listovej na vznik VCHS (redukcia rizika o 20–43 %), pričom najvyššia redukcia rizika bola zaznamenaná v skupinách defektov komorového septa a tzv. konotrunkálnych chýb (hlavne Fallotova tetralógia) [4, 15–17]. Naopak, užívanie liekov s antagonistickým účinkom na metabolizmus kyseliny listovej (napr. sulfonamidy) vo včasnom tehotenstve zvyšuje riziko VCHS u plodu [18]. Negatívny vplyv insuficiencie metabolizmu kyseliny listovej pri morfogenéze srdca môže súvisieť so zvýšenou hladinou homocysteínu [19], resp. s poruchou syntézy nukleových kyselín [20]. Globálne je miera perikoncepčného príjmu vitamínových suplementov suboptimálna (1–50 %), a to aj po aktívnych kampaniach v mnohých krajinách [21]. Literárne údaje z industrializovaných krajín pritom udávajú, že okolo 50 % tehotenstiev je plánovaných [4, 21].
V aktuálnej štúdii 18 % slovenských matiek detí s VCHS užívalo vitamíny v čase otehotnenia, čo poukazuje na podobne nízku mieru suplementácie na Slovensku ako v minulosti [22, 23]. V jednej zo štúdií na slovenskej populácii bola miera perikoncepčnej suplementácie kyselinou listovou u matiek zdravých detí 17,8 %. Išlo o tehotenstvá 107 matiek v rokoch 2001–2010 [23]. Dodatočné štatistické porovnanie aktuálneho súboru matiek detí s VCHS (132 tehotenstiev v rokoch 2007–2014) s uvedenou vzorkou matiek detí bez vrodenej chyby neidentifikuje rozdiel v užívaní folátu (p = 0,93), aj keď časové obdobie zberu dát nie je identické.
Koncom 90-tych rokov minulého storočia zaviedli niektoré krajiny na základe uvedených poznatkov fortifikáciu múky vitamínmi skupiny B (kyselina listová, B6, B12). Kanadská epidemiologická štúdia porovnávala prevalenciu komplexných VCHS pred zavedením plošnej fortifikácie (rok 1998) a po nej v provincii Quebec. Výskyt komplexných VCHS (konotrunkálne chyby, defekty atrioventrikulárneho septa, chyby s jednokomorovou fyziológiou) klesol po začatí fortifikácie o 36 % [24]. Podobné plošné obohatenie múky o vitamíny B6, B12 a kyselinu listovú zaviedli postupne aj v USA, Austrálii a iných krajinách. V Európe sa spustil program fortifikácie len v Maďarsku a nedávno aj vo Veľkej Británii [25]. Americká štúdia dokumentovala po intervencii zvýšenie hladiny folátu v krvi obyvateľstva o vyše 100 % [26], avšak výsledky intervencie na prevalenciu VCHS v USA nie sú zatiaľ zverejnené.
Pri absencii fortifikácie na Slovensku a nízkom percente užívania vitamínov tehotnými je pravdepodobné, že priemerné hladiny kyseliny listovej u slovenských matiek sú znížené. Po lekárskom potvrdení otehotnenia (zväčša 2.–3. mesiac gravidity) začína užívať vitamíny s kyselinou listovou viac ako dve tretiny slovenských matiek. V tomto období je však už veľká časť organogenézy rozbehnutá, a preto je prospešnosť užívania suplementov v prevencii vrodených vývojových chýb pravdepodobne obmedzená [4].
Ženy s nižším ukončeným vzdelaním užívajú multivitamíny perikoncepčne menej často ako vzdelanejšie ženy [27]. V slovenskej štúdii nebol rozdiel užívania vitamínov podľa stupňa vzdelania významný zrejme aj v dôsledku nižšieho počtu zúčastnených matiek. Ženy s ukončeným základným vzdelaním fajčili v čase otehotnenia častejšie ako ženy s vysokoškolským vzdelaním. Literárne údaje jednoznačne nepotvrdzujú asociáciu abúzu nikotínu matiek s VCHS u plodu [1], ale naša analýza ukázala, že ženy, ktoré fajčili perikoncepčne, užívali menej často multivitamíny. Môže ísť o dôsledok nižšieho socioekonomického stavu, vyššieho podielu neplánovaných gravidít a z toho vyplývajúcej horšej perikoncepčnej životosprávy v tejto podskupine matiek. Obezita matky je asociovaná s miernym zvýšením výskytu VCHS u plodov [1]. V slovenskej štúdii trpela v čase otehotnenia nadváhou (BMI 25–30) štvrtina matiek detí s VCHS a 5,4 % žien bolo obéznych (BMI >30). Podľa Eurostatu bolo na Slovensku v roku 2009 obéznych 1,3 % žien vo veku 18–24 rokov a 7,8 % žien vo veku 25–44 rokov [28].
Deficit aktívnych metabolitov kyseliny listovej môže byť spôsobený jej nízkym príjmom, ale aj genetickou dispozíciou pre nižšiu efektivitu jednotlivých vetiev jej metabolizmu. Homozygotný stav 677TT u matky alebo plodu je popisovaný ako nezávislý rizikový faktor pre vznik rázštepov nervovej trubice u plodu [29]. Košickí autori nepotvrdili túto asociáciu v slovenskej populácii [30]. Na možný vplyv genetického polymorfizmu 677 C→T enzýmu MTHFR pri vzniku VCHS upozornila ako prvá menšia nemecká štúdia [31]. Genotyp 677TT u detí bol asociovaný s dvojnásobným výskytom VCHS (OR = 2,2; 95% CI 1,2–4,3; p = 0,027). Nasledujúce práce priniesli nejednoznačné výsledky. Holandskí autori dokázali asociáciu genotypu 677TT u matiek detí s VCHS, pokiaľ ženy neužívali perikoncepčne kyselinu listovú [32]. Hraničná významnosť materského polymorfizmu 677TT bola potvrdená aj v práci analyzujúcej vyše 700 triád pacientov s konotrunkálnymi anomáliami a ich rodičov (relatívne riziko, RR = 1,4, 95% CI 0,95–2,04) [9] a v metaanalýze viacerých menších štúdií [33]. Iná metaanalýza dokumentovala zvýšené riziko dieťaťa pre vznik VCHS pri genotype 677TT (OR = 1,610, 95% CI 1,37–1,89), ale len u žltej a nie u bielej rasy [8]. Súborná analýza publikovaných prác do roku 2012 obsahujúca 5814 pacientov s VCHS (z toho 77 % bieleho etnika), 1781 matiek a 10 056 kontrol však nepreukázala asociáciu genotypu 677TT so zvýšeným výskytom VCHS u detí (OR = 0,96; 95% CI 0,87–1,07), ani u ich matiek (OR = 1,13; 95% CI 0,87–1,47) [10].
Asociácii polymorfizmu 1298 A→C s VCHS sa v literatúre venuje výrazne menej pozornosti a výsledky sú taktiež rozporuplné. Dve najväčšie analýzy detí s VCHS a ich rodičov zaznamenali zvýšený prenos A alely na choré dieťa. Deti s najčastejším genotypom 1298AA (spojeným s najvyššou aktivitu enzýmu MTHFR) boli podľa týchto prác štatisticky vo vyššom riziku vzniku VCHS oproti deťom s AC, resp. CC genotypom [9, 20]. Naopak, tureckí autori v nedávnej štúdii zaznamenali asociáciu medzi genotypom 1298CC u detí a výskytom konotrunkálnych chýb (OR = 3,01; 95% CI 1,16–7,83) [34].
V slovenskej populácii bol zaznamenaný trend k nižšiemu výskytu genotypu 677TT u detí s VCHS oproti kontrolnej skupine. Pri polymorfizme 1298 A→C boli materské genotypy 1298AC a CC asociované s nižším výskytom VCHS u detí. V oboch prípadoch ide o formy génov, ktoré sú spojené so zníženou aktivitou enzýmu MTHFR a teda menej efektívnou remetyláciou homocysteínu na metionín. Zvýšené hladiny homocysteínu u matiek sú dokumentované ako jeden z asociovaných faktorov pre vznik VCHS u plodu [19]. Na druhej strane, prednostné nasmerovanie metabolizmu na detoxikáciu homocysteínu môže znižovať využívanie folátu (hlavne pri jeho nedostatočnom príjme) v biochemickej kaskáde syntézy nukleových kyselín. V čase včasnej organogenézy je bezchybná syntéza nukleových kyselín veľmi dôležitá. Ochranný efekt alel 677T a 1298C môže byť potenciovaný dostatočným perikoncepčným príjmom kyseliny listovej, čo ochráni matku pred zvýšenými hladinami homocysteínu, pričom genotyp plodu podporuje bezchybnú syntézu purínov a pyrimidínov [20].
Osobitne bola vyhodnotená skupina detí s trizómiou 21, ktorá je najčastejšou príčinou mentálnej retardácie v detskom veku s prevalenciou 1 : 700–800 živonarodených detí. U detí s trizómiou 21 je výskyt VCHS 40–50 %. V brazílskej štúdii bolo zaznamenané dvojnásobné riziko pre vznik VCHS u dieťaťa s Downovým syndrómom v prípade matkinho genotypu 677TT alebo CT, ak matka neužívala perikoncepčne kyselinu listovú [11]. Výsledky slovenskej štúdie na limitovanej vzorke nepotvrdili žiadnu odchýlku výskytu polymorfizmov 677 C→T alebo 1298 A→C u detí s DS alebo ich matiek v porovnaní s kontrolnou skupinou nesyndrómových detí.
Zo súčasných literárnych údajov vyplýva skôr dôležitosť dostatku substrátov pre efektivitu všetkých metabolických ciest ovplyvnených kyselinou listovou ako význam sledovaných foriem genetického polymorfizmu. Zastúpenie polymorfizmov MTHFR v slovenskej populácii rodín s výskytom VCHS je v súlade s protikladnými výsledkami medzinárodných prác, kde môžu zohrávať úlohu skôr geografické a nutričné špecifiká ako skutočný efekt konkrétneho genotypu.
Prospektívna kontrolovaná štúdia mala niekoľko limitácií. Dotazníkové údaje o perikoncepčnom užívaní vitamínov boli získané len od matiek detí s VCHS, čo bránilo optimálnej analýze vplyvu tejto intervencie na vznik VCHS u živonarodených detí. Počet párov matka-dieťa bol nedostatočný aj pre relevantnú subanalýzu v jednotlivých podskupinách VCHS s predpokladaným spoločným vývojovým mechanizmom (konotrunkálne chyby, defekty komorového septa, chyby ľavého srdca a iné).
ZÁVER
Kyselina listová má špecifický význam pri včasnej organogenéze vrátane vývoja srdca. Na Slovensku perikoncepčne užíva výživové prípravky s obsahom kyseliny listovej menej ako pätina matiek detí s VCHS. V slovenskej populácii detí s VCHS a ich matiek nebol dokázaný zvýšený výskyt polymorfizmov MTHFR s rizikom zníženej hladiny aktívneho folátu. Naopak, časť potenciálne rizikových genotypov bola menej početná. Protichodné výsledky publikovaných štúdií vrátane analýzy slovenského súboru naznačujú skôr význam dostatočného príjmu a perikoncepčnej rovnováhy jednotlivých vetiev metabolizmu kyseliny listovej ako existenciu ochranného, resp. rizikového polymorfizmu na študovaných miestach génu pre MTHFR.
Štúdia bola finančne podporená grantom VEGA 1/0593/11.
Došlo: 20. 5. 2015
Přijato: 7. 8. 2015
MUDr. Martin Záhorec
Oddelenie anestéziológie a intenzívnej medicíny
Detské kardiocentrum
Národný ústav srdcových a cievnych chorôb, a.s.
Limbová 1
833 51 Bratislava
Slovenská republika
e-mail: marzahorec@gmail.com
Zdroje
1. Botto LD. Epidemiology and prevention of congenital heart defects. In: Allen HD, Driscoll DJ et al (eds). Moss´s and Adams Heart Disease in Infants, Children and Adolescents. 8th ed. Philadelphia, USA: Lippincott Williams & Wilkins, 2013 : 577–616.
2. Verkleij-Hagoort AC, de Vries JHM, Ursem NTC, et al. Dietary intake of B-vitamins in mothers born a child with congenital heart defect. Eur J Nutr 2006; 45 : 478–486.
3. Šabová L, Kovács L. Kyselina listová a vrodené vývojové chyby. Pediatr Prax 2008; 1 : 36–38.
4. Czeizel AE, Dudás I, Vereczkey A, et al. Folate deficiency and folic acid supplementation: the prevention of neural-tube defects and congenital heart defects. Nutrients 2013; 5 : 4760–4775.
5. Czeizel AE, Dudás I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation. N Engl J Med 1992; 327 : 1832–1835.
6. Yang QH, Botto LD, Gallagher M, et al. Prevalence and effects of gene-gene and gene-nutrient interactions on serum folate and serum total homocysteine concentrations in the United States: findings from the third National Health and Nutrition Examination Survey DNA Bank. Am J Clin Nutr 2008; 88 : 232–246.
7. van der Put NM, Gabreëls F, Stevens EM, et al. A second common mutation in the methylenetetrahydrofolate reductase gene: an additional risk factor for neural-tube defects? Am J Hum Genet 1998; 62 : 1044–1051.
8. Wang W, Hou Z, Wang C, et al. Association between 5, 10-methylen-etetrahydrofolate reductase (MTHFR) polymorphisms and congenital heart disease: A meta-analysis. Meta Gene 2013; 1 : 109–125.
9. Goldmuntz E, Woyciechowski S, Renstrom D, et al. Variants of folate metabolism genes and the risk of conotruncal cardiac defects. Circ Cardiovasc Genet 2008; 1 : 126–132.
10. Mamasoula C, Prentice RR, Pierscionek T, et al. Association between C677T polymorphism of methylenetetrahydrofolate reductase and congenital heart disease. Circ Cardiovasc Genet 2013; 6 : 347–353.
11. Brandalize APC, Bandinelli E, dos Santos PA, et al. Evaluation of C677T and A1298C polymorphisms of MTHFR gene as maternal risk factors for Down syndrome and congenital heart disease. Am J Med Genet 2009; 149A: 2080–2087.
12. Steegers-Theunissen RP, Twigt J, Pestinger V, et al. The periconceptional period, reproduction and long-term health of offspring: the importance of one-carbon metabolism. Hum Reprod Update 2013; 19 : 640–655.
13. Moorman A, Webb S, Brown NA, et al. Development of the heart: (1) formation of the cardiac chambers and arterial trunks. Heart 2003; 89 : 806–814.
14. Li D, Rozen R. Maternal folate deficiency affects proliferation, but not apoptosis, in embryonic heart. J Nutr 2006; 136 : 1774–1778.
15. Botto LD, Mulinare J, Erickson JD. Do multivitamin or folic acid supplements reduce the risk for congenital heart defects? Evidence and gaps. Am J Med Genet 2003; 121A: 95–101.
16. Van Beynum IM, Kapusta L, Bakker MK, et al. Protective effect of periconceptional folic acid supplements on the risk of congenital heart defects: A registry-based case-control study in the northern Netherlands. Eur Heart J 2010; 31 : 464–471.
17. Goh YI, Bollano E, Einarson TR, Koren G. Prenatal multivitamin supplementation and rates of congenital anomalies: a meta-analysis. J Obstet Gynaecol Can 2006; 28 : 680–689.
18. Hernandez-Diaz S, Werner MM, Walker AM, et al. Folic acid antagonists during pregnancy and the risk of birth defects. N Engl J Med 2000; 343 : 1608–1614.
19. Verkleij-Hagoort A, Bliek J, Sayed-Tabatabaei F, et al. Hyperhomocysteinemia and MTHFR polymorphisms in association with orofacial clefts and congenital heart defects: a meta-analysis. Am J Med Genet A 2007; 143A: 952–960.
20. Hobbs CA, James SJ, Parsian A, et al. Congenital heart defects and genetic variants in the methylenetetrahydrofolate reductase gene. J Med Genet 2006; 43 : 162–166.
21. Ray JG, Singh G, Burrows RF. Evidence for suboptimal use of periconceptional folic acid supplements globally. BJOG 2004; 111 : 399–408.
22. Horn F, Sabova L, Pinterova E, et al. Prevention of neural tube defects by folic acid – awareness among women of childbearing age in Slovakia. Bratisl Lek Listy 2014; 115 : 91–97.
23. Sabova L. Génové polymorfizmy metabolizmu kyseliny listovej v etiológii defektov neurálnej rúry a Downovho syndrómu. Bratislava: Univerzita Komenského, 2010 : 84–87.
24. Ionescu-Ittu R, Marelli AJ, Mackie AS, et al. Prevalence of severe congenital heart disease after folic acid fortification of grain products: time trend analysis in Quebec, Canada. BMJ 2009; 338: b1673.
25. Crider KS, Bailey LB, Berry RJ. Folic acid food fortification – its history, effect, concerns, and future directions. Nutrients 2011; 3 : 370–384.
26. Pfeiffer CM, Johnson CL, Jain RB, et al. Trends in blood folate and vitamin B12 concentrations in the United States, 1988–2004. Am J Clin Nutr 2007; 86 : 718–727.
27. Peyvandi S, Rychik J, Zhang X, et al. Preconceptual folic acid use and recurrence risk counceling for congenital heart disease. Congenit Heart Dis 2014; Jul 24, doi: 10.1111/chd.12206. [Epub ahead of print].
28. Eurostat Press Office: Between 8% and 25% of adults are obese across Member states. [cit. 2014-05-05]. Dostupné na internete: http://ec.europa.eu/eurostat/documents/2995521/5032782/3-24112011-BP-EN.PDF/831f0ca4-7105-4045-9e25-604141ef5108.
29. Behunová J, Podracká Ľ. Rázštepy nervovej trubice – súčasné pohľady na etiopatogenézu a možnosti prevencie kyselinou listovou. Čes-slov Pediat 2008; 63 : 38–46.
30. Behunova J, Klimcakova L, Zavadilikova E, et al. Methylenetetrahydrofolate reductase gene polymorphisms and neural tube defects epidemiology in the Slovak population. Birth Defects Res A Clin Mol Teratol 2010; 88 : 695–700.
31. Junker R, Kotthoff S, Vielhaber H, et al. Infant methylenetetrahydrofolate reductase 677TT genotype is a risk factor for congenital heart disease. Cardiovasc Res 2001; 51 : 251–254.
32. van Beynum IM, Kapusta L, den Heijer M, et al. Maternal MTHFR C>T is a risk factor for congenital heart defects: Effect modification by periconceptional folate supplementation. Eur Heart J 2006; 27 : 981–987.
33. van Beynum IM, den Heijer M, Blom HJ, et al. The MTHFR 677C->T polymorphism and the risk of congenital heart defects: a literature review and meta-analysis. QJM 2007; 100 : 743–753.
34. Sayin Kocakap BD, Sanli C, Cabuk F, et al. Association of MTHFR A1298C polymorphism with conotruncal heart disease. Cardiol Young 2014; 30 : 1–6.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2015 Číslo 5- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Vybrané špecifiká ultrasonografie pľúc v detskom veku
- Asociácia genetických polymorfizmov metyléntetrahydrofolát reduktázy s vrodenými chybami srdca v slovenskej populácii
- Črevná permeabilita a SCORAD u detí s atopickou dermatitídou po 6-týždňovom podávaní Lactobacillus rhamnosus GG (pilotná štúdia)
- Je prognóza solitárnej obličky u detí priaznivá?
- Intrafamiliárna fenotypová variabilita klasického Marfanovho syndrómu
- Vzácný případ DiGeorgeova syndromu s anomáliemi končetin: přínos vyšetření metodou SNP microarrayí?
- XVII. Hradecké pediatrické dny
- Metabolické kostní onemocnění při nezralosti
- Akutní kašel
- Perzistující kašel
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Metabolické kostní onemocnění při nezralosti
- Vybrané špecifiká ultrasonografie pľúc v detskom veku
- Vzácný případ DiGeorgeova syndromu s anomáliemi končetin: přínos vyšetření metodou SNP microarrayí?
- Akutní kašel
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



