-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Změny vybraných systémových cytokinů při závažném plicním postižení u dětí
Changes of selected systemic cytokines in severe pediatric lung disease
Background:
Severe lung diseases leading to respiratory failure are among the most frequent causes of critical conditions in childhood. Pulmonary injury leads to a systemic response of the organism and the response rate should be at the level of cytokines proportional to the degree of lung injury. The study aims to monitor systemic inflammatory response dependence on the degree of pulmonary injury using selected cytokines in pediatric patients.Methods:
Thirty-two patients with severe pulmonary injury and Lung Injury Score >1.0 leading to respiratory failure were included. Mean age of enrolled patients was 39.5 months, weight 14.2 kg. Twenty-nine patients had primary lung disease ALI//ARDS based on aspiration, pulmonary infection, autoimmune process, pulmonary contusion, or pulmonary arterial hypertension, 3 patients secondary ARDS in septic shock and multiorgan failure. Patients were mechanically invasively ventilated. Patients were monitored during the study for 48 hours, laboratory sampling was performed in the 1st, 12th, 24th and 48th hour of experiment.Results:
From observed markers matrix metalloproteinase MMP-9 was extremely high already in 1st hour with subsequent significant decrease. There was counter-regulatory increase of metalloproteinases inhibitor TIMP-1 at 12th hour related to initially high MMP-9. Expression of adhesion molecules was present already at the beginning of observation. ICAM-1 during the study descend insignificantly. VCAM-1 changes over time were statistically very significant with initial high levels and further decreasing the expression.Conclusions:
On the set of critically ill children with severe pulmonary impairment were detected early systemic cytokine response with signs of endothelial activation. Changes in the spectrum of cytokines in severe lung disease may indicate the influence of other organ systems, not only on the level of blood gases exchange alterations resulting in tissue hypoxia.Key words:
ALI, ARDS, adhesion molecules, metalloproteinases
Autoři: L. Šašek; J. Fremuth; K. Pizingerová; J. Kobr
Působiště autorů: Dětská klinika, Univerzita Karlova v Praze, Lékařská fakulta a Fakultní nemocnice v Plzni přednosta prof. MUDr. J. Sýkora, Ph. D.
Vyšlo v časopise: Čes-slov Pediat 2016; 71 (5-6): 251-259.
Kategorie: Původní práce
Souhrn
Úvod:
Těžké plicní postižení vedoucí k respiračnímu selhání patří k nejčastějším příčinám kritických stavů v dětském věku. Plicní postižení vede k systémové odpovědi organismu a míra této odpovědi by měla být na úrovni cytokinů přímo úměrná stupni plicního postižení. Studie si klade za cíl sledovat u dětských pacientů závislost systémové zánětlivé odpovědi na stupni plicního postižení pomocí vybraných cytokinů.Metodika:
Sledovaný soubor tvořilo 32 pacientů s těžkým plicním postižením s Lung Injury Score >1,0 vedoucím k respiračnímu selhání s nutností invazivní umělé plicní ventilace. Průměrný věk zařazených pacientů byl 39,5 měsíce, hmotnost 14,2 kg. Dvacet devět pacientů mělo primárně plicní postižení ALI/ARDS na podkladě aspirace, plicní infekce, autoimunitního procesu, plicní kontuze, či plicní arteriální hypertenze, u 3 pacientů šlo o sekundární ARDS při septickém šoku a multiorgánovém selhání. Pacienti byli invazivně ventilováni. Během studie byli sledováni po dobu 48 hodin se záznamem a laboratorními odběry v 1., 12., 24. a 48. hodině experimentu.Výsledky:
Ze sledovaných markerů byla hladina matrixové metaloproteinázy MMP-9 v 1. hodině extrémně vysoká se statisticky významným snížením v dalším průběhu experimentu. Inhibitor metaloproteináz TIMP-1 se v průběhu statisticky významně neměnil, byl přítomen kontraregulační vzestup ve 12. hodině v souvislosti s časně vysokou hodnotou MMP-9 v 1. hodině. Dále byla přítomna hyperexprese adhezivních molekul již na začátku sledování. ICAM-1 v průběhu studie statisticky nevýznamně klesalo. Oproti tomu změny VCAM-1 v čase byly statisticky velmi významné s vysokou iniciální hladinou a s následným snižováním hladin v dalších hodinách.Závěr:
V souboru kriticky nemocných dětí se závažným plicním postižením byla prokázána přítomnost časné systémové cytokinové odpovědi se známkami endoteliální aktivace. Změny v oblasti spektra cytokinů u závažného plicního postižení mohou signalizovat ovlivnění ostatních orgánových systémů nejen na úrovni alterace výměny krevních plynů s následkem tkáňové hypoxie.KLÍČOVÁ SLOVA:
ALI, ARDS, adhezivní molekuly, metaloproteinázyÚvod
Těžké plicní postižení vedoucí k respiračnímu selhání patří k nejčastějším příčinám kritických stavů v dětském věku. Plíce nejsou schopny dostát metabolickým požadavkům organismu na oxygenaci a/nebo na eliminaci oxidu uhličitého, současně se mění mechanické charakteristiky plic, dochází ke spouštění kompenzatorních mechanismů a k rozvoji typického klinického obrazu respiračního distresu. Hlavními příčinami respiračního selhání u dětí jsou závažné plicní infekce, aspirační postižení a sepse.
Z pohledu léčebného je respirační selhání urgentní situací, vyžadující okamžitá a standardizovaná léčebná opatření. Z prognostického pohledu je klinicky i s pomocí komplementárních vyšetření obtížné určit další vývoj onemocnění, a tím i umožnit nastavení adekvátní terapie. Respirační děje, podobně jako oběhové, jsou pro organismus kritické a jejich selhání se na rozdíl od postižení ostatních orgánových systémů projevuje bezprostředně. U dětí je tento fakt akcentován a akcelerován vysokým metabolickým obratem a malými funkčními rezervami.
Důležitým aspektem léčby respiračního selhání je i minimalizace umělou plicní ventilací indukovaného plicního postižení (Ventilator Induced Lung Injury, VILI). To dále zhoršuje již existující plicní poškození [3, 27].
Další stále studovanou otázkou je vliv plicního postižení na ostatní orgánové systémy, stejně tak jako opačný vliv systémových reakcí na plicní tkáň [12, 24, 26]. Je nepochybné, že plicní postižení vede k systémové odpovědi organismu, a tedy míra této odpovědi by měla být přímo úměrná stupni plicního postižení. Tyto systémové vlivy jsou vždy umocněny i umělou plicní ventilací [27].
Systémovou odpověď na shora uvedené plicní inzulty a jejich intenzitu je možné sledovat s pomocí vybraných cytokinů [2, 24, 30].
Je důležité říci, že patofyziologické mechanismy orgánových interakcí s jejich klinickým významem, využitím, dopady a praktickými výstupy se ve světové literatuře nadále intenzivně studují – jedná se o zdaleka neuzavřený problém, jehož řešení je vysoce aktuální pro kriticky nemocné pacienty, včetně pacientů dětského věku. Literární údaje týkající se této problematiky jsou stran dětských pacientů stále nebohaté a soubory pacientů jsou často nevelké a heterogenní.
Studie je pokračováním předchozích klinických a především experimentálních prací intenzivistického týmu pracoviště a je zaměřena na hodnocení časné systémové cytokinové odpovědi u pacientů se závažným plicním postižením.
Sledované markery
Adhezivní molekuly patří do širší imunoglobulinové rodiny a jedná se o skupinu proteinů, podílejících se na rozpoznávacích, vazebních a adhezivních pochodech. Adhezivní molekuly zprostředkují pevnou adhezi leukocytů na endoteliální buňky, prezentaci antigenů a následnou aktivaci leukocytů.
Adhezivní molekula ICAM-1 (Intercellular Adhesion Molecule 1, CD54), uspořádaná do pěti imunoglobulinům podobných domén, je exprimována na povrchu endoteliálních buněk a dále na leukocytech, epiteliálních buňkách a fibroblastech, či na buňkách respiračního epitelu. Míra exprese významně stoupá po stimulaci cytokiny (interleukin-6, tumor necrosis factor α, interferon-γ), či bakteriálními endotoxiny [4].
Adhezivní molekula VCAM-1 (Vascular Adhesion Molecule 1, CD106) je rovněž cytokiny indukovatelná a exprimovaná na endotelu ve dvou alternativně spojených verzích – v sedmi - a šestidoménové verzi. Exprese VCAM-1 byla detekována i na jiných než endoteliálních buňkách, včetně makrofágů, dendritických buněk, astrocytů, stromálních buněk kostní dřeně a buněk respiračního epitelu. VCAM-1 buňky endotelu mohou být indukovány de novo během několika hodin po expozici interleukinu-1, TNF-α (tumor necrosis factor α), či bakteriálním endotoxinům s maximální úrovní exprese ve 24 až 48 hodinách. Interleukin-1, tumor necrosis factor α a bakteriální endotoxiny způsobují zároveň expresi ICAM-1 a E-selektinu. Naproti tomu interleukin-4 a interleukin-13 indukují selektivní expresi VCAM-1 molekul. Selektivita či synergie působení cytokinů na expresi VCAM-1 se mezi různými částmi endotelu liší [8, 9, 21, 29].
Matrixové metaloproteinázy (MMP) jsou zinek-dependentní endopeptidázy, zavzaté do procesu degradace a přestavby všech druhů extracelulárních matrixových proteinů. MMP-9 se podílí na širokém spektru buněčných pochodů, ať už jde o produkci bioaktivních molekul, expresi apoptotických ligandů, či štěpení buněčných povrchových receptorů. Hraje tak důležitou roli v buněčné proliferaci, migraci a adhezi neutrofilů, jejich diferenciaci, dále angiogenezi, apoptóze i jiných imunitních pochodech. Aktivuje další cytokiny, zejména interleukin-1, a ovlivňuje tak systémovou zánětlivou odpověď organismu. Její deficience má v regulaci zánětlivých kaskád významnou roli ve smyslu rozvoje farmakorezistentního septického šoku [5, 6, 7, 10, 11, 13, 14, 15, 16, 17, 19, 22, 23, 29, 30].
Metaloproteinázy jsou regulačně inhibovány specifickými inhibitory – tkáňovými inhibitory metaloproteináz (TIMP). Jsou známy čtyři typy inhibitorů – TIMP-1, 2, 3, 4. Existují i syntetické inhibitory, vážící se na aktivní katalytický zinkový atom MMP [6, 10, 14, 15, 17, 19].
Fraktalkin (fractalkine, CX3CL1, neurotaktin) je chemokin patřící do skupiny CX3C chemokinů. Jedná se o polypeptid. Tvoří jej vlastní chemokinová doména a mucinu podobný stonek, zodpovědný za vazbu na cirkulující leukocyty. Primárně je exprimován na povrchu endoteliálních buněk. V této původní a výskytem častější vázané formě podporuje pevnou a na integrinu nezávislou adhezi leukocytů na aktivované endoteliální buňky. Vzácnější je jeho solubilní forma. Za odštěpování fraktalkinu od povrchu epiteliálních buněk jsou zodpovědné právě metaloproteinázy. V solubilní formě působí fraktalkin i jako signální molekula – tedy silný chemoatraktant monocytů a T-lymfocytů v průběhu časné zánětlivé odpovědi, a tak má významné antiapoptotické působení především na monocyty [18]. Uplatňuje se například i v patogenezi aterosklerózy.
U MMP-9, TIMP-1 i CX3CL1 genetické polymorfismy ovlivňují individuální intenzitu cytokinových reakcí.
Ve studii jsou dále sledovány v klinické praxi rutinně používané markery zánětu (tumor necrosis factor alpha, interleukin-6 a prokalcitonin) a dále markery myokardiálního a oběhového postižení (kardiální troponin I a N-terminal pro-BNP).
METODIKA
Jednalo se o prospektivní nerandomizovanou klinickou observační studii.
Charakteristika souboru pacientů
Sledovaný soubor tvořilo 32 pacientů hospitalizovaných v období od června 2007 do března 2009 na JIRP Dětské kliniky LF UK a FN Plzeň. Do studie byli zařazeni pacienti kriticky nemocní s těžkým plicním postižením s Lung Injury Score (LIS) >1,0, vedoucím k respiračnímu selhání s nutností invazivní umělé plicní ventilace.
Z celkového počtu pacientů bylo 18 chlapců a 14 dívek. Průměrný věk zařazených pacientů byl 39,5 měsíce, medián 20,0 měsíců, rozmezí 0,0−192,0 měsíců. Průměrná hmotnost pacienta byla 14,2 kg, medián 10,3 kg, rozmezí 1,9−64,0 kg.
Z 32 zařazených pacientů bylo 28 pacientů s primárně plicním postižením Acute Lung Ingury/Acute Respiratory Distress Syndrome (ALI/ARDS) na podkladě aspirace, plicní infekce, autoimunitního procesu, či plicní kontuze, u 1 pacienta se jednalo o plicní arteriální hypertenzi, u 3 pacientů o sekundární ARDS při septickém šoku a multiorgánovém selhání.
Všichni pacienti byli endotracheálně intubováni a invazivně ventilováni, všichni standardně zajištěni invazivními vstupy. Umělá plicní ventilace byla (iniciálně) vedena v tlakově řízených režimech (PCV/AC).
Pacienti byli během studie sledováni po dobu 48 hodin. Nultá hodina byla dána přijetím na oddělení v případě, že byla umělá plicní ventilace zahájena před transportem záchrannou službou (tedy maximálně 1 hodinu před přijetím na oddělení), či časem intubace a zahájením umělé plicní ventilace přímo na oddělení.
V 1., 12., 24. a 48. hodině pak byl zaznamenán klinický stav pacientů, vitální parametry, ventilační parametry a byly provedeny laboratorní odběry.
Sledované hodnoty
Z nastavených a monitorovaných ventilačních parametrů byl zaznamenáván ventilační režim, frekvence dechů (RR [min-1]), použitá koncentrace kyslíku ve vdechované směsi (FiO2), vrcholový ventilační tlak (PIP [cmH2O]), střední tlak v dýchacích cestách (Paw [cmH2O]), end-exspirační tlak v dýchacích cestách (PEEP [cmH2O]), dechový objem (Vt [ml.kg-1]), dále kalkulované indexy, a to hypoxemický index paO2/FiO2 (paO2/FiO2 [mmHg]), oxygenační index (OI = Paw × FiO2 × 100/paO2), arterioalveolární diference (AaDO2 [kPa]).
Laboratorně byla provedena analýza krevních plynů z arteriální krve a především stanovovány sérové hladiny systémových cytokinů: Tumor necrosis factor alpha (TNF-α [pg.ml-1], Luminex), interleukin 6 (IL-6 [pg.ml-1], Luminex), natriuretický peptid B, přesněji řečeno N-terminal pro-BNP (NTProBNP, ale dále označován jako BNP [pg.ml-1], Luminex), kardiální troponin I (cTn-I [pg.ml-1], Dxl), matrixová metaloproteináza 9 (MMP-9 [pg.ml-1], Luminex), tkáňový inhibitor metaloproteinázy 1 (TIMP-1 [ng.ml-1], RD-Elisa), fraktalkin (CX3CL1 [pg.ml-1], Luminex), intercelulární adhezivní molekula 1 (ICAM-1 [ng.ml-1], Luminex), vaskulární adhezivní molekula 1 (VCAM-1 [ng.ml-1], Luminex) a prokalcitonin (PCT [ng.ml-1], Kryptol).
Statistická analýza
Data byla základními statistickými výpočty zpracována, pomocí šikmosti a špičatosti testována normalita rozložení. Významnost změn v čase pak byla hodnocena pomocí neparametrického Friedmanova testu se srovnáním jednotlivých časů Nemenyiho metodou. Za statisticky významné jsme považovali v rámci všech použitých statistických testů hodnoty hladiny významnosti p <0,05.
VÝSLEDKY
LIS zařazených pacientů byl průměrně 2,1, medián 2,0, v rozmezí minimum 1,0 a maximum 3,1, Pediatric Risk of Mortality Score (PRISM III-12) 18,5 s mediánem 17,0, v rozmezí minimum 10,0 a maximum 40,0.
Závažné plicní postižení si u 5 pacientů z celkových 32 vyžádalo konvertování na nekonvenční vysokofrekvenční oscilační ventilaci (HFOV). Důvodem byla progrese plicního postižení ve smyslu těžkého ARDS – u 1 pacienta těžká aspirace s ARDS, u 1 pacienta těžká oboustranná pneumonie se sepsí a rozvojem ARDS, u 1 pacienta akutní RSvirová bronchiolitida s progresí do ARDS a u 2 pacientů septický šok s rozvojem ARDS.
Střední tlaky v dýchacích cestách (Paw) byly v průměru 14,5 kPa s maximem 26,0 kPa. PEEP byl v průměru nastaven na 9 kPa, s maximem 16 kPa a minimem 6 kPa.
Do 24 hodin po ukončení experimentu zemřeli 3 z 32 pacientů, což představuje 9,4 %. Tito pacienti nebyli vyřazeni ze studie.
Hodnocení změn monitorovaných ventilačních parametrů a analýzy krevních plynů
Statisticky významný byl vzestup arteriálního pH v čase (p = 0,002) s normalizací ve 24. hodině, respektive 48. hodině sledování (p = 0,05, respektive 0,01), paO2 a paCO2 se v průběhu statisticky významně neměnilo (tab. 1).
Tab. 1. Hodnoty krevních plynů. 
Z monitorovaných ventilačních parametrů a indexů bylo statisticky významné snížení oxygenačního indexu ve 24. a 48. hodině oproti 1. hodině (p = 0,001, respektive 0,05). Dále bylo přítomno významné snižování AaDO2 v čase (p = 0,001). Index paO2/FiO2 v průběhu statisticky význam-ně stoupal (p = 0,002) z průměrných počátečních hodnot 249,3 mmHg na konečných 309,3 mmHg (tab. 2, graf 1).
Tab. 2. Ventilační indexy a jejich změny v čase. 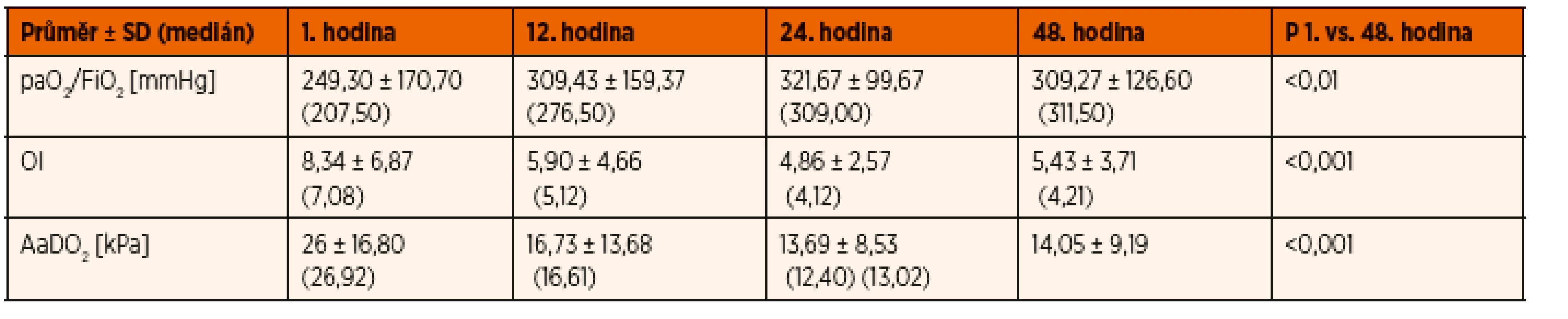
Graf 1. Statisticky významné změny ventilačních indexů v čase. 
Hodnocení změn sledovaných cytokinů
Statistickým testem normality (test šikmosti a špičatosti) byla u všech markerů ve všech sledovaných časových obdobích zavržena hypotéza normality rozložení. Heterogenita rozložení byla bezpochyby ovlivněna i určitou heterogenitou souboru pacientů (tab. 3).
Tab. 3. Důležité sledované cytokinové markery a významnost jejich změn v čase. 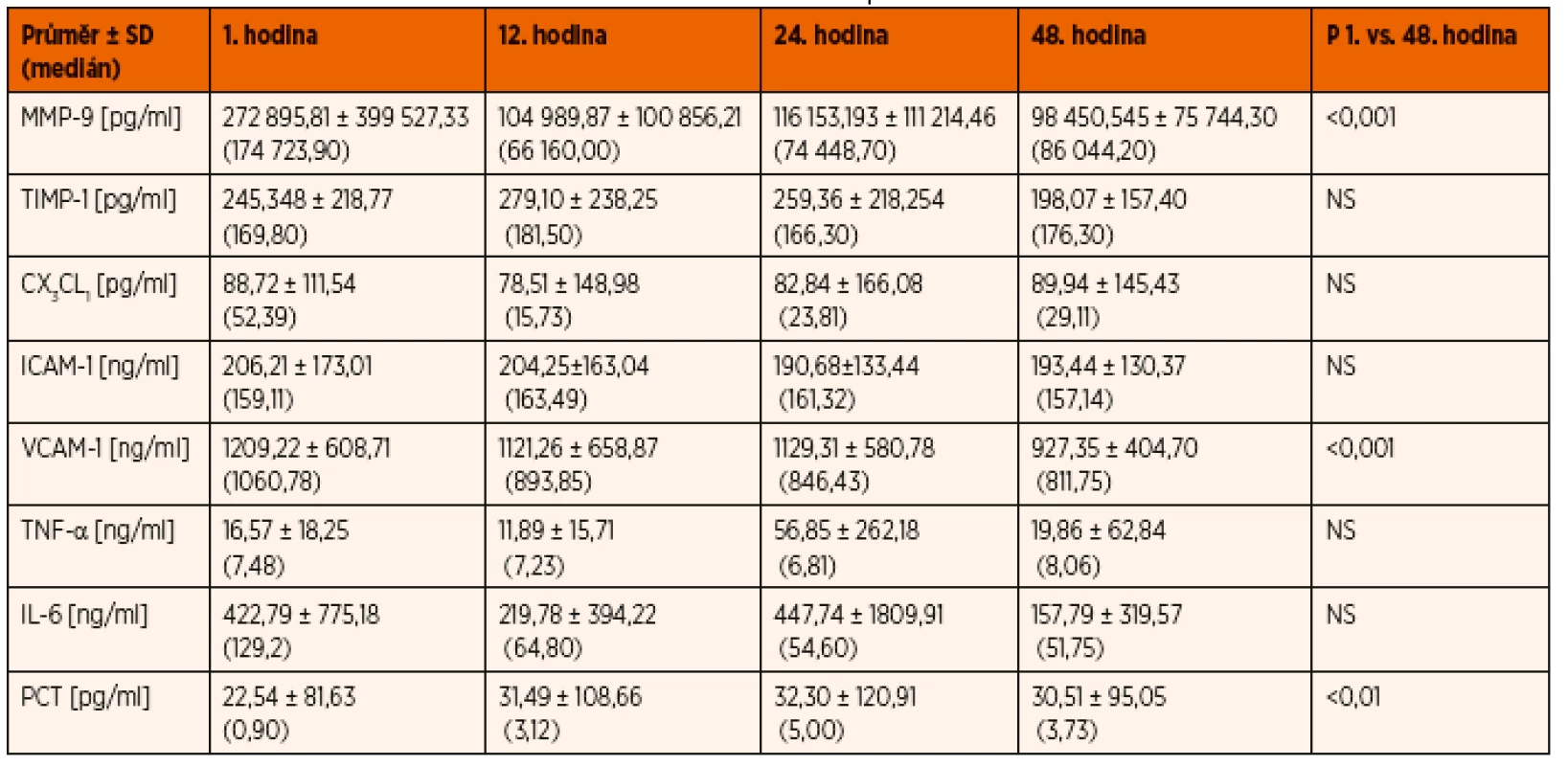
TNF-α a IL-6 se v průběhu statisticky významně neměnily, ale oba markery zůstávaly po celou dobu experimentu vysoce nadnormální. Statisticky významné byly změny PCT v čase (p = 0,01) s významným zvýšením prokalcitoninu mezi 1. a 12. hodinou (p = 0,05) a snížením mezi 12. a 48. hodinou (p = 0,05).
Statisticky významné byly změny BNP v čase (p = 0,04) s dominujícím významným snížením mezi 24. a 48. ho-dinou (p = 0,05). Průměrné hodnoty byly ve všech obdobích studie vysoké, ale zároveň je patrna veliká heterogenita hodnot a jejich rozložení (u jednoho z pacientů s plicní hypertenzí měřeny vysoké hodnoty). Statisticky významné bylo snižování cTn-I v čase (p = 0,05), hodnoty ale v absolutních číslech nebyly vysoké a zůstávaly jen na hranici normy.
Pro studii byla ale především významná dynamika hodnot cytokinů MMP-9, TIMP-1, CX3CL1, ICAM-1 a VCAM-1.
Zřetelně statisticky významné byly změny MMP-9 v čase se statisticky významným snížením matrixové metaloproteinázy ve 12., 24. a 48. hodině oproti 1. hodině (p = 0,01, respektive 0,001, respektive 0,05). TIMP-1 se v průběhu statisticky významně neměnil, včetně předpokládaného reaktivního vzestupu ve 12. hodině v souvislosti s časně vysokou hodnotou MMP-9 v 1. hodině – viz diskuse. Statisticky významný byl pokles CX3CL1 ve 12. hodině (p = 0,02), následný vzestup byl již bez statistické významnosti a fraktalkin se udržoval ve zvýšených hodnotách (grafy 2 a 3).
Graf 2. Statisticky významný pokles MMP-9 s počátečním reaktivním zvýšením TIMP-1. 
Graf 3. Statisticky významný pokles MMP-9 s indukovaným zvýšením CX<sub>3</sub>CL<sub>1</sub>. 
ICAM-1 se v průběhu statisticky významně neměnilo. Statisticky významné byly změny VCAM-1 v čase (p = 0,00), bylo přítomno statisticky velmi významné snížení aktivity VCAM-1 mezi 1. a 48. hodinou (p = 0,001) a dále statisticky významné snížení aktivity VCAM-1 mezi 24. a 48. hodinou (p = 0,01) (graf 4).
Graf 4. Dynamika adhezivních molekul v čase se statisticky významným poklesem VCAM. 
DISKUSE
V úvodu diskuse k výsledkům práce lze konstatovat, že se stanovených cílů práce podařilo dosáhnout, byla především prokázána v čase se významně měnící hyperexprese cytokinů podílejících se na aktivaci endotelu a cytokinů stojících na počátku systémových zánětlivých kaskád.
Studie vychází z předchozích prací týmu Kobra [31–35], kdy klinickým studiím předcházely intervenčně vedené experimentální studie na modelech mláďat prasete domácího. Cílem experimentálních prací bylo zjistit, zda umělá plicní ventilace ovlivňuje mimoplicní orgány a zda má systémové dopady. To bylo prokázáno a kromě jasného ovlivnění srdečních funkcí (měřených echokardiograficky) – s nárůstem ovlivnění s rostoucí agresivitou ventilace – byly z pohledu této nynější klinické studie zajímavé zejména výsledky imunoanalytických metod ve skupině solubilních adhezivních molekul. K signifikantním změnám docházelo časně a jejich dynamika byla zřetelná již v krátkém 12hodinovém trvání experimentu. Agresivně vedená umělá plicní ventilace (dechovými objemy 10 ml.kg-1 a vyššími) adverzní systémové vlivy signifikantně zhoršovala. Již po 2 hodinách takto agresivně vedené umělé plicní ventilace bylo patrné plicní i histopatologické poškození, které bylo zdrojem pro spuštění cytokinových kaskád vedoucích k ventilací indukovanému plicnímu postižení (VILI) a k systémové zánětlivé odpovědi. Umělá plicní ventilace trvalým pozitivním přetlakem aktivovala časnou zánětlivou reakci i u nepoškozených plic. K aktivaci zánětlivé reakce docházelo v menší intenzitě i u protektivně vedené umělé plicní ventilace. Byl to zřetelný apel pro klinickou praxi, aby umělá plicní ventilace u dětí byla vedena strategií nižších dechových objemů s dostatečným pozitivním end-exspiračním přetlakem a aby doba umělé plicní ventilace byla v zájmu snížení morbidity pacientů maximálně zkrácena jen na nezbytně dlouhou dobu. Výsledky experimentálních studií vedly k postavení této čistě klinické studie.
Z monitorovaných ventilačních parametrů a z analýzy krevních plynů je patrné plicní poškození zařazených pacientů. Hodnocení těchto ukazatelů bylo použito k dokumentaci tíže plicního postižení a jeho vývoje v čase. V iniciálních 12 hodinách se vyskytovala ojedinělá minima hluboké hypoxémie pod 7,0 kPa, která se po 24. hodině již neobjevují. Pět z 32 pacientů muselo být během experimentu konvertováno na vysokofrekvenční oscilační ventilaci. Byly měřeny vyšší hodnoty paCO2, dané kombinací těžké plicní patologie a protektivně vedené ventilace nižšími dechovými objemy, splňující kritéria permisivní hyperkapnie. Navíc jsou ve studovaném souboru zařazeny i děti nízkých věkových skupin do 1 roku, u kterých bývá minimalizace mrtvého prostoru s udržením normokapnie v rámci umělé plicní ventilace obecným problémem a při závažných plicních postiženích tento problém ještě více akceleruje. Pediatričtí pacienti ne vždy dobře tolerují strategii nízkých dechových objemů, která je jedním z principů protektivně vedené ventilace.
V měřených indexovaných ventilačních parametrech bylo přítomno statisticky silně významné snížení alveolo-arteriální diference ve 24. a 48. hodině oproti 1. hodině jako známky zlepšování účinnosti výměny krevních plynů v průběhu umělé plicní ventilace. Stejně tak bylo přítomno statisticky významné příznivé snížení oxygenačního indexu ve 24. a 48. hodině oproti 1. hodině. Je nutno říci, že hodnoty oxygenačního indexu odpovídají spíše lehčímu plicnímu postižení, než jaké bychom očekávali podle vstupních kritérií. U paO2/FiO2 hypoxemického indexu bylo v průběhu studie patrno statisticky významné zlepšení. Hodnoty paO2/FiO2 indexu odpovídaly podle Berlínské klasifikace na začátku studie kritériím těžkého ARDS u 3 pacientů, středního u 11 a mírného u 18 z celkových 32 pacientů.
Hodnocení změn hladin cytokinů pak bylo vlastním cílem studie. Použití multiplexní analýzy, tedy detekce změn více cytokinů, bylo použito s ohledem na jejich vzájemné vztahy, jak je uvedeno v úvodu práce a níže v diskusi.
TNF-α jako cytokin iniciální systémové zánětlivé reakce nebyl u našeho souboru pacientů zásadně ovlivněn v čase, ale jeho setrvalé zvýšení se s největší pravděpodobností podílelo na stimulaci dalších zánětlivých kaskád. Tumor necrosis factor α byl mimo jiné studován vzhledem k podílu na indukci exprese adhezivních molekul ICAM-1 a VCAM-1. Rovněž IL-6 se v průběhu rovněž statisticky významně neměnil, jeho hodnoty byly velmi vysoké a zároveň byla patrna velká heterogenita kvůli extrémním maximům měřeným u pacientů se septickým šokem. To odpovídá etiologické heterogenitě souboru pacientů. Prokalcitonin se statisticky významně zvyšoval mezi 1. a 12. hodinou a následně statisticky významně snižoval mezi 12. a 48. hodinou, ale nedocházelo k poklesu k normě. Podobně jako u IL-6 je potřeba říci, že i prokalcitonin byl bezpochyby zásadně ovlivněn probíhající závažnou infekcí u většiny zařazených pacientů.
Z hlediska cílů studie byla stěžejní analýza hladin matrixové metaloproteinázy 9, tkáňového inhibitoru metaloproteináz 1 a fraktalkinu. Hladiny sérové matrixové metaloproteinázy 9 byly vysoké již v první hodině experimentu. Hladina MMP-9 pak v průběhu studie statisticky významně klesala a normalizovala se. Plicní postižení je mohutným stimulem k velmi časné hyperexpresi MMP-9 ovlivňující neutrofilní migraci do plic. Pokles MMP-9 během následujících 48 hodin umělé plicní ventilace lze z hlediska protektivity jejího vedení považovat za íznivý. Hodnoty tkáňového inhibitoru metaloproteináz 1 byly od počátku zvýšené, do 24 hodin však strmě stoupaly. To odpovídá předpokládané inhibiční kontraregulační odpovědi na vzestup MMP-9. Přesto (a pro autory překvapivě) nebyl vzestup statisticky významný. Prognosticky negativní hodnota vysokých a v čase stoupajících hladin MMP-9 bývá nahrazována poměrem MMP-9/TIMP-1. Tento poměr ukazuje na kontraregulační mechanismy a jejich eventuální dysbalanci, přičemž závažnost této dysbalance pozitivně koreluje s výší poměru MMP-9/TIMP-1. V průběhu naší studie poměr MMP-9/TIMP-1 prudce klesal, což je možno považovat za příznivou známku vývoje plicního postižení. U fraktalkinu došlo k statisticky významnému snížení exprese především mezi 1. a 12. hodinou, ale hodnoty zůstávaly během studie zvýšené. Fraktalkin působí ve své volné formě jako signální molekula se silným chemokinovým působením na monocyty a T-lymfocyty v průběhu časné zánětlivé odpovědi a ve své na buňky vázané formě podporuje pevnou adhezi leukocytů na aktivované endoteliální buňky. Za odštěpování vázaného fraktalkinu od endoteliálních buněk do solubilní formy jsou pak zodpovědné metaloproteinázy. Jejich vrchol jsme detekovali již po 1. hodině studie, podobně jako u vrcholu exprese fraktalkinu. Vzestup fraktalkinu by tedy mohl být navázán na vzestup matrixové metaloproteinázy 9, ale toto tvrzení je jen hypotetické.
V rámci systémové odpovědi na plicní postižení bylo dále důležité sledování dynamiky exprese adhezivních molekul ICAM-1 a především VCAM-1. Obě tyto adhezivní molekuly jsou zodpovědné za adhezi leukocytů na endoteliální buňky, aktivaci leukocytů a podílejí se tím i na aktivaci endotelu jako motoru další kaskády pochodů. ICAM-1 se v průběhu statisticky významně neměnila, lze sledovat statisticky nevýznamný setrvalý pokles během experimentu s časovým vrcholem v 1. hodině. To odpovídá, podobně jako u fraktalkinu, velmi časné expresi těchto molekul při nastupujícím plicním postižení. Hladiny VCAM-1 vykazují snižování mezi 1. a 48. hodinou, které je statisticky významné. Vrchol aktivity VCAM-1 je opět velmi časný, již v 1. hodině experimentu. Můžeme předpokládat, že tato aktivita zřetelně odráží rychlou reakci endotelu cévního řečiště v poškozených plicích.
Heterogenitu souboru lze považovat za určitou slabinu studie, když byli zařazení i pacienti se sekundárním plicním postižením. Tyto skupiny navíc nebyly studovány odděleně. Na druhou stranu uniformita cytokinové odpovědi zařazených pacientů základní myšlenku studie obhajuje.
ZÁVĚRY
Ve sledovaném souboru pediatrických pacientů se závažným plicním postižením byla prokázána přítomnost časné systémové odpovědi organismu na úrovni cytokinů.
V průběhu experimentu byly detekovány iniciálně vysoké hodnoty matrixové metaloproteinázy MMP-9 a souběžně se rozbíhající kontraregulační produkce tkáňového inhibitoru metaloproteináz TIMP-1. Dále byla přítomna časně exprese adhezivních molekul, především VCAM-1. Tyto molekuly ovlivňují aktivaci endotelu, migraci a adhezi neutrofilů a produkci dalších systémově působících cytokinů (interleukinů). Přítomnost těchto markerů v krevním oběhu dětských pacientů v prvních desítkách minut těžkého plicního postižení dokládá význam poškození jednoho orgánového systému pro další kaskádu dějů na úrovni celého organismu se všemi negativními důsledky poškození vzdálených orgánových systémů v rámci syndromu multiorgánové dysfunkce. Těžké plicní poškození ovlivňuje ostatní orgánové systémy tedy nejen na úrovni alterace výměny krevních plynů s následkem tkáňové hypoxie.
Práce nemůže mít ambice na jednoznačný klinický výstup ve smyslu identifikace jasného markeru predikujícího následek těžkého poškození plic na celý organismus, ale může být dalším střípkem do našeho poznání těchto vysoce komplikovaných a kaskádovaných vztahů. Vyšetření spektra cytokinů, jejich klinický význam a možnosti jejich využití se nadále hledají a budou předmětem dalších výzkumných studií.
Seznam použitých zkratek
AaDO2 – arterio-alveolární diference
ALI – Acute Lung Injury
ARDS – Acute Respiratory Distress Syndrome
BNP – B-natriuretický peptid
cTn-I – kardiální troponin I
CX3CL1 – fraktalkin (Fractalkine)
ICAM-1 – Intercellular Adhesion Molecule 1
IL-6 – interleukin 6
LIS – Lung Injury Score
MMP-9 – matrixová metaloproteináza 9 (Matrix Metalloproteinase 9)
NTProBNP – N-terminal pro-BNP
OI – oxygenační index
PCT – prokalcitonin
PRISM – Pediatric Risk of Mortality Score
TIMP-1 – tkáňový inhibitor metaloproteináz 1 (Tissue Inhibitor of Metalloproteinases 1)
TNF-α – Tumor Necrosis Factor alpha
VCAM-1 – Vascular Adhesion Molecule 1
Práce byla financována z Výzkumného záměru Lékařské fakulty Univerzity Karlovy v Plzni MSM0021620819-6096 PRVOUK P-36.
Došlo: 30. 6. 2016
Přijato: 28. 7. 2016
MUDr. Lumír Šašek, Ph.D.
Univerzita Karlova v Praze
Lékařská fakulta a FN v Plzni
Dětská klinika
Alej Svobody 80
304 60 Plzeň
e-mail: lumir.sasek@lfp.cuni.cz
Zdroje
1. Dreyfuss DE, Saumon G. Ventilator-induced lung injury. Am J Respir Crit Care Med 1998 Jan; 157 (1): 294–323.
2. de Prost N, Costa EL, Wellman T. Effect of ventilation strategy on distribution of lung inflammatory cell activity. Crit Care 2013; 17 (4): R175.
3. Pierrakos Ch, Vincent JL. Sepsis biomarkers: a review. Crit Care 2010, 14(1): R15.
4. Warre LB, Koyama T, Zhao Z. Biomarkers of lung epithelial injury and inflammation distinguish severe sepsis patients with acute respiratory distress syndrome. Crit Care 2013; 17 (5): R253.
5. Lee, I, Yang Ch. Inflammatory signaling involved in airway and pulmonary diseases. Mediators Inflamm 2013; 791231.
6. Schutte H, Lohmeyer J, Rousseau S. Bronchoalveolar and systemic cytokine profiles in patients with ARDS, severe pneumonia and cardiogenic pulmonary edema. Eur Respir J 1996; 9 (9): 1858–1867.
7. Hsu AT, Barett CD, DeBusk GM, et al. Kinetics and role of plasma matrix metalloproteinase-9 expression in acute lung injury and the acute respiratory distress syndrome. Shock 2015; 44 (2): 128–136.
8. Krueger M, Heinzmann A, Nauck M. Adhesion molecules in pediatric intensive care patients with organ dysfunction syndrome. Intensive Care Med 2007; 33 (2): 359–363.
9. Tabuchi A, Kuebler WM. Endothelium-platelet interactions in inflammatory lung disease. Vasc Pharmacol 2008; 49 (4–6): 141–150.
10. Xing K, Murthy S, Liles CW. Clinical utility of biomarkers of endothelial activation in sepsis - a systematic review. Crit Care 2012; 16 (1): R7.
11. Zonneveld R, Martinelli R, Shapiro NI. Soluble adhesion molecules as markers for sepsis and the potential pathophysiological discrepancy in neonates, children and adults. Crit Care 2014; 18 (1): 204.
12. Fligiel S, Standiford T, Fligiel H, et al. Matrix metalloproteinases and matrix metalloproteinase inhibitors in acute lung injury. Hum Pathol 2006; 37 (4): 422–430.
13. Kim JH, Suk MH, Youn DW, et al. Inhibition of matrix metalloproteinase-9 prevents neutrophilic inflammation in ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol 2006; 291 (4): L580–L587.
14. Greenlee KJ, Werb Z, Kheradmand F. Matrix metalloproteinases in lung. Physiol Rev 2007; 87 (1): 69–98.
15. Lorente L, Martin MM, Labarta L. Matrix metalloproteinase-9,-10, and tissue inhibitor of matrix metalloproteinases-1 blood level as biomarkers of severity and mortality in sepsis. Crit Care 2009; 13 (5): R158.
16. Kong M, Li Y, Gaggar A. Matrix metalloproteinase activity in pediatric acute lung injury. Int J Med Sci 2009; 6 (1): 9–17.
17. Lagente V, Boichot E. Role of matrix metalloproteinases in the inflammatory process of respiratory diseases. J Mol Cell Cardiol 2010; 48 (3): 440–444.
18. Cena, JJ, Lalu MM, Cho WJ, et al. Inhibition of matrix metalloproteinase activity in vivo protects against vascular hyporeactivity in endotoxemia. Am J Physiol Heart Circ Physiol 2010; 298 (1): H45–H51.
19. Lauhio A, Hastbacka J, Pettila V, et al. Serum MMP-8,-9 and TIMP-1 in sepsis. Pharmacol Res 2011, 64 (6): 590–594.
20. Davey A, McAuley DF, O’Kane CM. Matrix metalloproteinases in acute lung injury: mediators of injury and drivers of repair. Eur Respir J 2011; 38 (4): 959–970.
21. Yazdan-Ashoori P, Liaw P, Toltl L, et al. Elevated plasma matrix metalloproteinases and their tissue inhibitors in patients with severe sepsis. J Crit Care 2011; 26 (6): 556–565.
22. Li J, Zhong J, Liu H, et al. Imbalance between tissue inhibitor of metalloproteinase 1 and matrix metalloproteinase 9 after cardiopulmonary resuscitation. Am J Emerg Med 2012; 30 (7): 1202–1209.
23. Teng L, Yu M, Li J. Matrix metalloproteinase-9 as a new biomarkers of severity in multiple organ dysfunction syndrome caused by trauma and infection. Mol Cell Biochem 2012; 360 (1–2): 271–277.
24. Yamamoto Y, Osanai T, Nishizaki F, et al. Matrix metalloprotein-9 activation under cell-to-cell interaction between endothelial cells and monocytes. Heart Vessels 2012; 27 (6): 624–633.
25. Bradley LM, Douglass MF, Chatterjee D, et al. Matrix metalloproteinase 9 mediates neutrophil migration into the airways in response to influenza virus-induced toll-like receptor signaling. PLoS Pathog 2012; 8 (4): e1002641.
26. Herzig DS, Driver BR, Fang G, et al. Therapeutic efficiacy of CXCR3 blockade in an experimental model of severe sepsis. Crit Care 2012; 16 (5): R168.
27. Kobr J, Pizingerova K, Fremuth J, et al. Signaling molecules for early detection of adverse interactions during mechanical ventilation in animal models. In Vivo 2011; 25 (2): 209–217.
28. Kobr J, Fremuth J, Pizingerova K, et al. Total body response to mechanical ventilation of healthy lungs: an experimental study in piglets. Physiol Res 2010; 59 (4): 545–552.
29. Kobr J, Kuntscher V, Molacek K, et al. Diffuse alveolar damage due to inappropriate strategy of mechanical ventilation in an experimental porcine model. In Vivo 2010; 24 (5): 699–704.
30. Kobr J, Kuntscher V, Treska V, et al. Adverse effects of the high tidal volume during mechanical ventilation of normal lung in pigs. Bratisl Lek Listy 2008; 109 (2): 45–51.
31. Kobr J, Fremuth J, Pizingerova K, et al. Vliv ventilace trvalým pozitivním tlakem na stupeň zánětlivé reakce a funkce orgánů – experimentální studie. Anest intenziv Med 2009; 20 (2): 88–95.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2016 Číslo 5-6- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Změny vybraných systémových cytokinů při závažném plicním postižení u dětí
-
Neinvazivní hemodynamický monitoring u kriticky nemocných dětí – USCOM
Prospektivní observační studie - Od naražení palce nohy k diagnostice cystické fibrózy
- Vrodená malformácia vena Galeni u novorodenca
- Spondylodiscitida v dětském věku: Kazuistika a přehled literatury
- Porucha kostného metabolizmu pri mentálnej anorexii
- Nová doporučení pro kardiopulmonální resuscitaci u dětí z roku 2015
- Kardiopulmonální resuscitace novorozenců – pokyny a doporučení 2015
- Abstrakta
- Abstrakta
- Profesor MUDr. Miloš Velemínský, CSc., dr. h. c., osmdesátníkem
- Za primářem MUDr. Miroslavem Malým
- Vzpomínka na MUDr. Olgu Böhmovou
- The Psychological Context of Labour Pain
- Sociální a preventivní pediatrie v současném pojetí
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Vrodená malformácia vena Galeni u novorodenca
- Kardiopulmonální resuscitace novorozenců – pokyny a doporučení 2015
- Spondylodiscitida v dětském věku: Kazuistika a přehled literatury
- Nová doporučení pro kardiopulmonální resuscitaci u dětí z roku 2015
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



