-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hypofosfatázie – onemocnění skeletu, na které musíme myslet
Hypophosphatasia – skeletal disease requiring our attention
Hypophosphatasia is an inborn, severe disorder resulting from loss-of-function of alkaline phosphatase. Typical signs include skeletal demineralisation, recurrent fractures, growth failure, convulsions, respiratory failure. Hypophosphatasia is divided into perinatal, infantile, juvenile and adult forms and odontohypophosphatasia. Treatment rests in enzyme replacement therapy with asfotase alpha, which improves bone mineralisation and overall improvement of the patients. It is necessary to properly diagnose hypophosphatasia, as current treatment is beneficial for the affected children.
Key words:
alkaline phosphatase, bone, asfotase
Autoři: Š. Kutílek 1; Z. Šumník 2
Působiště autorů: Dětské oddělení Klatovské nemocnice a. s., Klatovy 1; Pediatrická klinika 2. lékařské fakulty a Fakultní nemocnice Motol, Praha 2
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (4): 228-231.
Kategorie: Sympozium - Osteologie
Souhrn
Hypofosfatázie je vzácná, těžká a potenciálně fatální genetická porucha způsobená vrozenou ztátou funkce alkalické fosfatázy. Důsledkem je hypomineralizace skeletu, četné fraktury, zástava růstu, křeče, respirační selhání. Rozlišujeme formu perinatální, infantilní, juvenilní, adultní a odontohypofosfatázii. V terapii se v současné době uplatňuje asfotáza alfa, lidský rekombinantní tkáňově nespecifický fúzní protein alkalická fosfatáza, jehož podávání vedlo k významnému zvýšení kostní mineralizace a pozoruhodnému zlepšení zdravotního stavu pacientů. Na hypofosfatázii je třeba pomýšlet a zavčas ji diagnostikovat, protože správně zavedená léčba signifikantně zlepšuje celkový stav i osud nemocných quoad vitam et quoad sanationem.
KLÍČOVÁ SLOVA:
alkalická fosfatáza, kost, asfotázaÚVOD
Hypofosfatázie (HPP) je vzácná, těžká a potenciálně fatální genetická porucha, která je spojena s mnohočetnými kostními projevy, s porušeným metabolismem kalcia a fosfátů, poruchou růstu a pohyblivosti, předčasnou ztrátou dentice, respiračními potížemi a křečemi. Příčinou je mutace genu pro tkáňově nespecifickou alkalickou fosfatázu (TNSALP) [1–4].
HISTORIE
V roce 1945 ošetřoval kanadský lékař dr. John Rathbun kojence s nehojící se rachitidou, respirační insuficiencí, nezvládnutelnými křečemí a nápadně nízkou aktivitou alkalické fosfatázy v séru (S-ALP). Dítě exitovalo ve věku dvou měsíců. Pro uvedený stav použil dr. Rathbun termín hypofosfatázie [5]. V 70. letech byly definovány různé formy hypofosfatázie na základě klinické závažnosti a věku pacientů [1, 2, 4, 6].
V 80. letech byl objeven gen kódující alkalickou fosfatázu (ALP) a jeho mutace a byly učiněny první léčebné pokusy. V roce 2012 byly publikovány první výsledky úspěšné léčby HPP enzymatickou náhradní léčbou (ERT) [1, 2, 4–6].
ALKALICKÁ FOSFATÁZA A JEJÍ FUNKCE
Alkalická fosfatáza (EC 3.1.3.1., ALP) je membránovým metaloenzymem, tvořeným v řadě orgánů (kost, játra, CNS, placenta, střevo, ledviny, nadledviny). Její struktura je podmíněna jak geneticky, tak posttranslační modifikací. Rozlišují se tři „tkáňově specifické“ izoenzymy (intestinální, placentární a placentárnímu podobný „placental-like“) a jeden „tkáňově nespecifický“, ubikvitní izoenzym, zahrnující izoformy jaterní, kostní a renální. Jednotlivé izoenzymy ALP jsou odlišitelné na základě svých fyzikálně-chemických a imunologických vlastností. Jaterní, kostní a ledvinová forma ALP mají identickou primární strukturu bílkovinné molekuly a liší se navzájem obsahem sialové kyseliny. Sacharidová složka způsobuje různou elektroforetickou mobilitu, afinitu k inhibitorům a tepelnou odolnost. Jaterní, kostní a ledvinová forma ALP nejsou pravými izoenzymy, ale izoformami ALP [1–4, 7]. Existují čtyři genové lokusy kódující syntézu proteinových částí molekul ALP. Na krátkém raménku 1. chromozomu se nachází gen determinující bílkovinnou složku tkáňově nespecifické ALP. Na dlouhém raménku 2. chromozomu jsou lokalizovány další 3 geny, které kódují bílkovinnou složku střevního a placentárního izoenzymu a izoenzymu podobného placentárnímu („placental-like“). Při posttranslační modifikaci se naváží sacharidové řetězce na 2–5 vazebných míst na proteinových řetězcích ALP [1–4, 7].
ALP má nezastupitelnou úlohu při mineralizaci kostní tkáně tím, že hydrolýzou z řady molekul odštěpuje fosfor. ALP přeměňuje anorganický pyrofosfát, který je inhibitorem mineralizace, na fosfát s následnou tvorbou hydroxyapatitu. Hydroxyapatit je zodpovědný za mechanickou odolnost kostní tkáně a představuje tím nejdůležitější část kostního minerálu. Podmínkou mineralizace kostní tkáně je přítomnost kolagenu. ALP je aktivní též v tkáních, kde k mineralizaci nedochází (střevo, placenta, ledviny, játra) a má zásadní úlohu při transportu iontů a hydrolýze. ALP defosforyluje vitamin B6 a tím usnadňuje jeho transport hematoencefalickou bariérou. Vitamin B6 poté působí jako neurotransmiter. ALP se též podílí na renální exkreci fosfátů [1–4, 7].
HYPOFOSFATÁZIE – EPIDEMIOLOGIE A DĚDIČNOST
HPP je vzácná, těžká a potenciálně fatální genetická porucha. V Evropě je incidence těžkých forem HPP 1 : 300 000, mírnějších forem 1 : 6300, v Kanadě v populaci Mennonitů je díky příbuzenským sňatkům incidence těžkých forem až 1 : 2500 [1–4].
HPP je způsobená mutací (mutacemi) genu (lokalizovaného na chromozomu 1; lokus 1p36.12) obsahujícího 12 exonů a kódujícího tkáňově nespecifickou ALP s následkem ztráty její funkce. Je popsáno přes 300 mutací uvedeného genu. Dědičnost je u těžkých forem autozomálně recesivní, u lehčích forem autozomálně dominantní. Vyskytují se též mutace de novo, které zatím nebyly popsány u dospělé formy HPP [1–4, 8].
PATOFYZIOLOGIE HPP
Při nedostatečné produkci ALP dochází k akumulaci anorganického pyrofosfátu, který potlačuje růst krystalů hydroxyapatitu a brání tak mineralizaci skeletu. Kost má primitivní strukturu, není přestavována a obraz připomíná těžkou křivici. Osifikace kostí je výrazně omezena. Při snížené mineralizaci skeletu není dostatečné množství vápníku integrováno do kostní tkáně a dochází k rozvoji hyperkalcémie a hyperkalciurie [1–4, 6]. U dětí s těžkými formami je nedostatečně mineralizovaný skelet hrudního koše, který není schopen příslušných dechových exkurzí, a dochází k respiračnímu selhání. V důsledku snížené defosforylace vitaminu B6 a jeho absenci v mozkových buňkách se objevují křeče. Vázne renální exkrece fosfátů s následnou hyperfosfatémií [1–4, 6].
KLINICKÉ PROJEVY HPP
Hypofosfatázie je spojena s řadou klinických projevů: mnohočetným kostním postižením upomínajícím na rachitidu či/osteomalacii, frakturami, porušeným metabolismem kalcia a fosfátů (hyperkalcémie, hyperkalciurie, urolitiáza), poruchou růstu a pohyblivosti, s respiračními potížemi, které mohou vyžadovat ventilaci, a záchvaty reagujícími na vitamin B6. Osteoblasty postrádají známky aktivity alkalické fosfatázy [1–4].
Hypofosfatázie se dělí na několik forem:
Perinatální letální forma HPP, která neléčena má takřka stoprocentní mortalitu. Dědí se autozomálně recesivně. Vzhledem k těžkým deformitám skeletu je možná prenatální ultrasonografická detekce. Skelet je významně demineralizován s deformovanými zkrácenými končetinami a četnými frakturami. Lební kryt je měkký, s výrazně zvětšenou velkou a malou fontanelou. Hrudník je měkký, nedostatečně mineralizovaný, zvonovitého tvaru. Záhy po narození se projeví akutní respirační tíseň. Postižení mívají křeče, apnoické pauzy s cyanózou a intrakraniální krvácení. Na rentgenovém snímku je patrná významná celková demineralizace skeletu (obr. 1). Bez léčby je prognóza infaustní, děti umírají v prvních týdnech či měsících života na respirační selhání [1–4].
Obr. 1. Rentgenogram hrudníku u dítěte s perinatální formou HPP ve věku 3 dnů. Je patrná těžká hypomineralizace skeletu (obrázek z archivu prof. MUDr. Z. Šumníka, Ph.D.). Fig. 1. Chest X-ray of a 3-day-old neonate with perinatal HPP. Extreme skeletal hypomineralization is apparent. 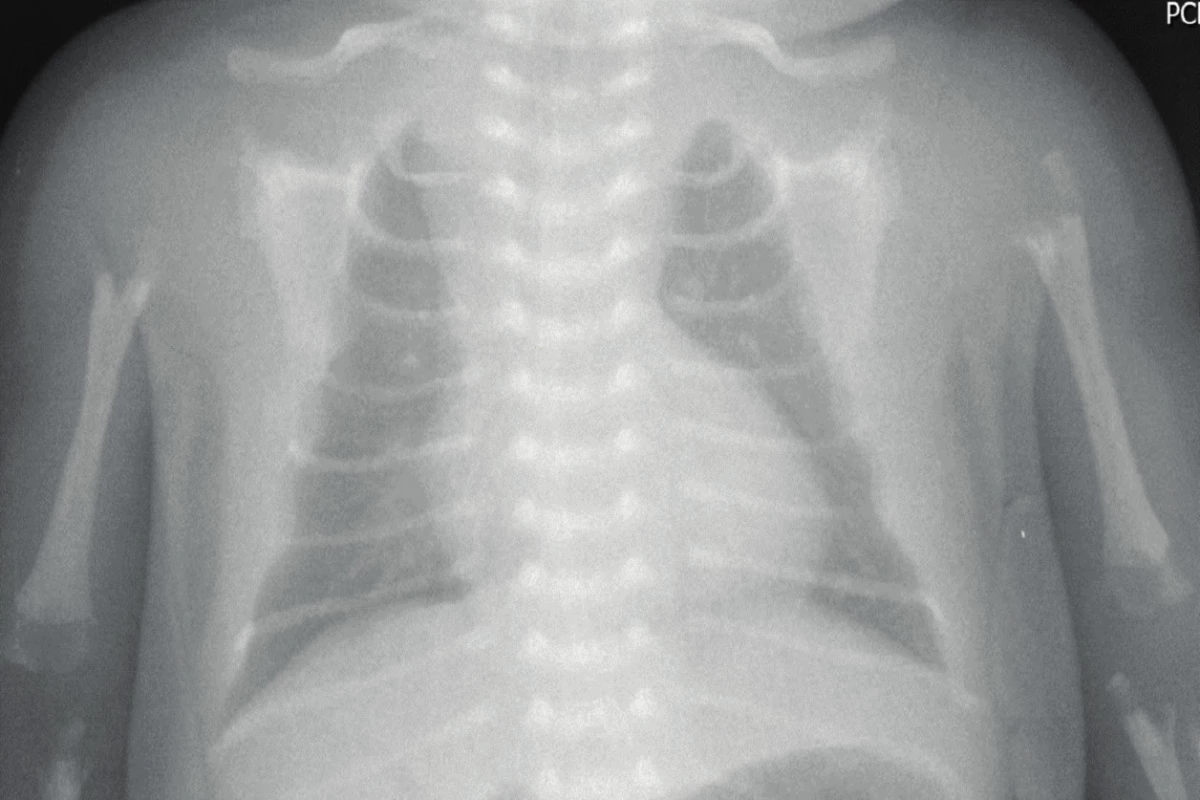
Infantilní forma HPP vykazuje též závažné deformity skeletu. Manifestuje se během prvého půlroku života a připomíná progredující demineralizací skeletu některou z vitamin D dependentních křivic. Dítě je hypotonické, neprospívá, má široce otevřenou fontanelu. Hrudník má rachitický růženec a Harrisonovu rýhu. Rozvíjí se kraniosynostóza (až u 60 % pacientů). Charakteristická je svalová slabost a psychomotorická retardace. U postižených někdy bývá hyperkalcémie s hyperkalciurií. Objevují se pyridoxin-responzivní křeče. Rentgenový nález na skeletu je podobný jako u perinatální formy, je patrná výrazná demineralizace kostní tkáně. Přítomna bývá též tracheomalacie. Dechové obtíže při demineralizaci skeletu hrudníku vedou posléze k úmrtí až poloviny postižených [1–4].
Dětská (juvenilní) forma HPP je patrná po šestém měsíci věku. Pro tuto formu je typická předčasná ztráta mléčného chrupu (před pátým rokem) s intaktními kořeny zubů a hypoplazie až aplazie dentinu. Nemocní jsou typičtí malou postavou, dolichocefalií a kolébavou chůzí, udávají bolesti končetin a trpí na opakované stresové zlomeniny [1–4].
U dospělých se vyskytuje adultní forma onemocnění, manifestující se až ve středním věku bolestivými frakturami a pseudofrakturami a předčasnou ztrátou chrupu [1–4, 6, 9, 10]. V anamnéze může být údaj o prodělané „křivici“ v dětství [1–4].Odontohypofosfatázie je charakterizována poruchou vývoje dentice a předčasnou ztrátou chrupu, která se vyskytne v nepřítomnosti patologických změn na skeletu [1–4, 6, 10].
DIAGNOSTIKA HPP
U perinatální formy je již možná prenatální detekce ultrazvukem [1–4]. U perinatální či infantilní formy je výrazně snížená mineralizace skeletu a patrné zkrácení dlouhých končetin. Na rentgenových snímcích je porucha osifikace klenby lební i dlouhých kostí, objevují se patologické fraktury. Změny v metafýzách upomínají na křivici, tyto rachitické změny progredují. Denzita kostního minerálu je snížena. Na HPP je rovněž nutno pomýšlet u pacientů s předčasnou ztrátou chrupu či poruchou dentice. Konstantním nálezem je výrazně snížená S-ALP pod dolní referenční hranici pro příslušný věk (obvykle až pod 1,0 µkat/l). V moči stoupá koncentrace fosfoetanolaminu (PEA), který je jedním ze substrátů alkalické fosfatázy. V séru je nejcitlivějším ukazatelem vzestup pyridoxal 5-fosfátu (PLP). V molekulárně genetické diagnostice se uplaňuje sekvenční analýza a delečně-duplikační analýza [1–4, 6]. Diferenciálně diagnosticky je třeba odlišit křivici (jakéhokoliv původu), osteogenesis imperfecta, kleidokraniální dysplazii. U rachitidy je ovšem vždy zvýšená hodnota S-ALP, zatímco u osteogenesis imperfecta či kleidokraniální dysplazie je S-ALP v rozmezí referenčních hodnot pro daný věk. U kleidokraniální dysplazie je na rentgenovém snímku hrudníku vždy patrná absence klíčku či jeho hypoplazie.
TERAPIE HPP
Onemocnění bylo do roku 2011 neléčitelné a perinatální a infantilní formy byly tudíž letální. V minulosti byla zkoušena též transplantace buněk kostní dřeně [11]. V terapii se v současné době uplatňuje podávání asfotázy alfa, lidského rekombinantního tkáňově nespecifického fúzního proteinu alkalická fosfatáza, který vykazuje enzymatickou aktivitu a podporuje mineralizaci skeletu. Podává se subkutánně 2 mg/kg 3x nebo 1 mg/kg 6x týdně. Podávání asfotázy vedlo k významnému zvýšení kostní mineralizace a pozoruhodnému zlepšení zdravotního stavu pacientů s perinatální či infantilní formou HPP včetně zlepšení dechových poměrů a snížení nutnosti dechové podpory [12–16] (obr. 2). Ve srovnání s neléčenými historickými kontrolami vedlo podávání asfotázy těmto dětem po průměrnou dobu 3 let k 91% přežití (versus 27 % u neléčených historických kontrol) [13]. Signifikantně se zlepšil růst postižených dětí i jejich psychomotorický vývoj a svalová síla. U perinatální a infantilní formy tudíž zlepšilo podávání asfotázy výrazně životní prognózu pacientů a jejich kvalitu života [12–16]. U dospělé formy se rovněž zkouší terapeutická aplikace antisklerostinových protilátek [17].
Obr. 2. Rentgenogram hrudníku u téhož pacienta ve věku 13 měsíců po léčbě asfotázou alfa. Výrazné zlepšení mineralizace skeletu (obrázek z archivu prof. MUDr. Z. Šumníka, Ph.D.). Fig. 2. Chest X-ray of the same patient at the age of 13 months after asfotase treatment. Note significant skeletal remineralisation. 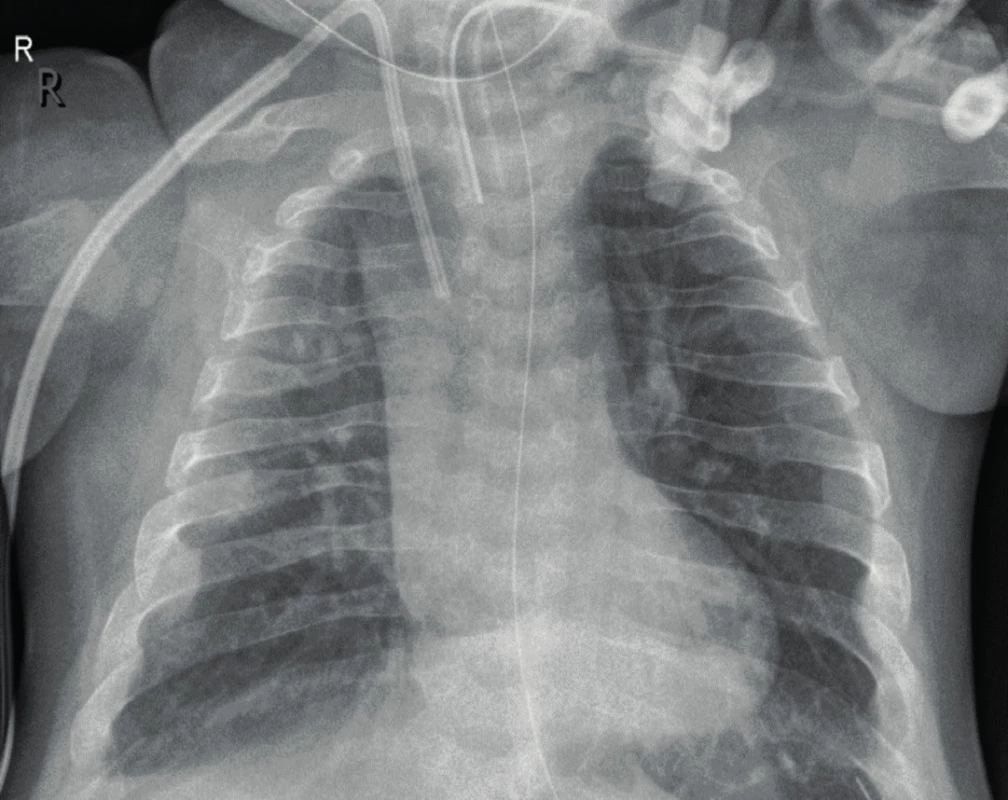
Při bolestech končetin se uplatňují nesteroidní antirevmatika (NSAID). Nutná je též stomatologická péče a kontroly chrupu 2x ročně. Pacienti musí být rovněž sledováni dětským neurologem ve spolupráci s neurochirurgem vzhledem k riziku rozvoje kraniosynostózy [1–4].
CAVE: U pacientů s hypofosfatázií nesmí být v žádném případě podávány bisfosfonáty, neboť tyto léky snižují kostní obrat a v případě HPP zhoršují mineralizaci skeletu a zvyšují riziko fraktury [18].
ZÁVĚR
Na HPP je třeba pomýšlet a zavčas ji diagnostikovat, protože správně zavedená léčba signifikantně zlepšuje celkový stav i osud nemocných quoad vitam et quoad sanationem.
Doc. MUDr. Štěpán Kutílek, CSc.
Dětské oddělení Klatovské nemocnice, a.s.
Plzeňská 929
339 38 Klatovy
e-mail: kutilek@nemkt.cz
Zdroje
1. Whyte MP. Hypophosphatasia and the role of alkaline phosphatase in skeletal mineralization. Endocr Rev 1994; 15 : 439–461.
2. Whyte MP. Hypophosphatasia. In: Scriver CR (ed). The Metabolic Basis of Inherited Disease. McGraw-Hill 1995 : 4095–4111
3. Harris H. The human alkaline phosphatases: what we know and what we don´t know. Clin Chim Acta 1989; 186 : 133–150.
4. Whyte MP. Hypophosphatasia -aetiology, nosology, pathogenesis, diagnosis and treatment. Nat Rev Endocrinol 2016; 12 : 233–246.
5. Rathbun JC. Hypophosphatasia: a new developmental anomaly. Am J Dis Child 1948; 765 : 822–831.
6. Šumník Z, Souček O, Lebl J. Hypopfosfatázie: Kdy na ni myslet a jak ji léčit. Pediatr praxi 2016; 17 : 37–40.
7. Moss DW. Alkaline phosphatase isoenzymes. Clin Chem 1982; 28 : 2007.
8. Fauvert D, Brun-Heath I, Lia-Baldini AS, et al. Mild forms of hypophosphatasia mostly result from dominant negative effect of severe alleles or from compound heterozygosity for severe and moderate alleles. BMC Med Genet 2009; 10 : 51.
9. Schmidt T, Mussawy H, Rolvien T, et al. Clinical, radiographic and biochemical characteristics of adult hypophosphatasia. Osteoporos Int 2017 May 25. doi: 10.1007/s00198-017-4087-z.
10. Hayashi-Sakai S, Numa-Kinjoh N, Sakamoto M, et al. Hypo-phosphatasia: Evaluation of size and mineral density of exfoliated teeth. J Clin Pediatr Dent 2016; 40 (6): 496–502.
11. Whyte MP, Kurtzberg J, McAlister WH, et al. Marrow cell transplantation for infantile hypophosphatasia. J Bone Miner Res 2003; 18 : 624–636.
12. Whyte MP, Greenberg CR, Salman NJ, et al. Enzyme-replacement therapy in life-threatening hypophosphatasia. N Engl J Med 2012; 366 : 904–913.
13. Whyte MP, Rockman-Greenberg C, Ozono K, et al. Asfotase alfa treatment improves survival for perinatal and infantile hypophosphatasia. J Clin Endocrinol Metab 2016; 101 : 334–342.
14. Kitaoka T, Tajima T, Nagasaki K, et al. Safety and efficacy of treatment with asfotase alfa in patients with hypophosphatasia: Results from a Japanese clinical trial. Clin Endocrinol (Oxf) 2017 Apr 4. doi: 10.1111//cen.13343. [Epub ahead of print].
15. Whyte MP. Hypophosphatasia: An overview for 2017. Bone 2017; Feb 24. pii: S8756-3282(17)30056-X. doi: 10.1016/j.bone.2017.02.011.
16. Whyte MP. Hypophosphatasia: Enzyme replacement therapy brings new opportunities and new challenges. J Bone Miner Res 2017 Apr; 32 (4): 667–675. doi: 10.1002/jbmr.3075. Epub 2017 Jan 31.
17. Seefried L, Baumann J, Hemsley S, et al. Efficacy of anti-sclerostin monoclonal antibody BPS804 in adult patients with hypophosphatasia. J Clin Invest 2017; 127 (6): 2148–2158.
18. Whyte MP. Atypical femoral fractures, bisphosphonates, and adult hypophosphatasia. J Bone Miner Res 2009; 24 : 1132–1134.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Seriál o EET
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2017 Číslo 4- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Editorial: Rostoucí skelet – oblast zájmu do budoucna
- Osteogenesis imperfecta – současný pohled na problematiku
- Liečebné stratégie na optimalizáciu kostného metabolizmu pri mentálnej anorexii
- Hypofosfatázie – onemocnění skeletu, na které musíme myslet
- Sezónna variabilita deficitu vitamínu D u detí s nešpecifickým zápalovým ochorením čreva a inými chronickými ochoreniami
- Temperament v raném dětství a jeho popis pomocí IBQR VSF
-
Infantilní hemangiomy.
Současné léčebné postupy - Tolerogenní dendritické buňky a jejich využití v léčbě imunopatologických stavů
- Kvalita života dětských hemofiliků v České republice – zkušenosti jednoho centra
- Následná dlouhodobá intenzivní péče pro děti ve Vojenské nemocnici Olomouc
- Seriál o EET
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Osteogenesis imperfecta – současný pohled na problematiku
-
Infantilní hemangiomy.
Současné léčebné postupy - Hypofosfatázie – onemocnění skeletu, na které musíme myslet
- Následná dlouhodobá intenzivní péče pro děti ve Vojenské nemocnici Olomouc
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



