-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Tranzitórna hypertrofická kardiomyopatia u novorodenca s neonatálnym abstinenčným syndrómom
Transitory hypertrophic cardiomyopathy in newborn with a neonatal withdrawal syndrome
The hypertrophic cardiomyopathy in newborn is very rare. It is often unknown in neonatal age and don´t have to be manifested until infantile age, when the unexpected death is set up. It is the most frequently occuring in newborns, whose mother have suffered from diabetes, in cases of metabolic systems, infectious diseases or as a result of the action of different types of toxins. Taking psychoactive addictive narcotics during pregnancy influents noticeably mother, course of pregnancy, fetus, delivery and newborn as well. Intrauterine exposure to psychoactive addictive substances may cause congenital fetal developmental defects, intrauterine growth restriction, increased risk of premature birth.
In the present case report, we describe the case of transient hypertrophic cardiomyopathy in newborn of a substance abusing mother.
Key words:
phypertrophic cardiomyopathy, neonatal abstinence syndrome, newborn
Autoři: J. Nikolinyová 1; T. Šrámková 1; T. Baška 2
Působiště autorů: Neonatologická klinika SZU, Fakultná nemocnica s poliklinikou F. D. Roosevelta, Banská Bystrica 1; Ústav verejného zdravotníctva, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave 2
Vyšlo v časopise: Čes-slov Pediat 2018; 73 (3): 149-154.
Kategorie: Kazuistika
Souhrn
Hypertrofická kardiomyopatia sa u novorodencov vyskytuje veľmi zriedkavo. Často je však v novorodeneckom veku nepoznaná a môže sa manifestovať až v útlom dojčenskom veku náhlym kardiálnym úmrtím. Najčastejšie sa vyskytuje u novorodencov diabetických matiek, pri metabolických, systémových, infekčných ochoreniach, alebo v dôsledku pôsobenia rôznych toxínov. Užívanie psychoaktívnych návykových látok počas tehotenstva výrazným spôsobom ovplyvňuje matku, priebeh tehotenstva, vyvíjajúci sa plod, pôrod, ako i samotného novorodenca. Intrauterinná expozícia psychoaktívnymi návykovými látkami môže spôsobiť vrodené vývojové chyby plodu, intrauterinnú rastovú reštrikciu (IUGR), zvýšené riziko predčasného pôrodu.
V prezentovanej kazuistike popisujeme prípad výskytu tranzitórnej hypertrofickej kardiomyopatie u novorodenca matky s polyabúzom psychoaktívnych návykových látok.
Klúčové slova:
hypertrofická kardiomyopatia, neonatálny abstinenčný syndróm, novorodenecÚVOD
Podľa Európskej kardiologickej spoločnosti je kardiomyopatia (KMP) definovaná ako štrukturálne a funkčné ochorenie myokardu, ktoré nie je asociované so systémovou hypertenziou, postihnutím koronárnych artérií, s valvulopatiami a kongenitálnymi srdcovými chybami [1]. V prípadoch, keď je etiológia neznáma, hovoríme o primárnej KMP. Môže sa vyskytovať sporadicky, alebo na genetickom podklade. Najčastejšie sa uplatňuje autozomálne dominantný typ dedičnosti. Pri sekundárnych KMP je príčina známa, alebo KMP je súčasťou iného ochorenia. Na základe typických štrukturálnych a funkčných črt rozlišujeme 3 typy KMP: dilatačnú, hypertrofickú a reštrikčnú formu [2].
Hypertrofická KMP je v novorodeneckom veku veľmi zriedkavým ochorením. Prevalencia hypertrofickej KMP sa pohybuje približne 3–5 prípadov/1 milión živonarodených [3]. Prvýkrát bola opísaná v roku 1869 vo Francúzsku patológom Liouville [4]. Pre hypertrofickú formu KMP je typické zväčša asymetrické zhrubnutie interventrikulárneho septa, a (alebo) zhrubnutie myokardu predominantne ľavej komory, alebo aj obidvoch komôr súčasne. V dôsledku tuhosti a nepoddajnosti zhrubnutého myokardu dochádza k poruche diastolického plnenia ľavej komory, prípadne k systolickej obštrukcii pravej alebo ľavej výtokovej komory. V najťažších prípadoch dochádza k obštrukcii výtoku obidvoch komôr. Histologicky je prítomné charakteristické chaotické usporiadanie myocytov a ich rôzny stupeň variability tvaru a veľkosti [1, 2, 3].
Do skupiny heredofamiliárnych hypertofických KMP patrí: sarkomerická forma, hypertrofická KMP pri malformačných syndrómoch (Noonanovej syndróm, LEOPARD syndróm), pri vrodených metabolických poruchách (glykogenózy, Fabryho choroba, mitochondriálne poruchy) a pri neuromuskulárnych ochoreniach [1]. V novorodeneckom veku sa hypertrofická KMP vyskytuje najčastejšie u novorodencov matiek s gestačným diabetes mellitus [1, 2]. Klinická prezentácia ochorenia je rôzna. U novorodencov je často asymptomatická, neskôr sa manifestuje neprospievaním, chudobnou periférnou perfúziou, oligúriou, mramorovanou kožou, studeným potom, edémom. Tachykardia s hepatomegaliou, respiračný distress, ako i galopový rytmus sú klasickými príznakmi kardiálneho zlyhávania novorodenca [2, 5]. Fyzikálny nález je u novorodencov zväčša negatívny, s výnimkou obštrukčnej formy hypertrofickej KMP, kedy sa prezentuje hlučným systolickým šelestom s maximom parasternálne vľavo v dolnej časti a na hrote s propagáciou do axily, prípadne býva rozštiepená druhá ozva.
Zlatým štandardom v diagnostike hypertrofickej KMP je echokardiografické vyšetrenie. Hypertrofickú KMP potvrdíme v prípade prítomnosti asymetrickej hypertrofie interventrikulárneho septa a hypertrofie ľavej komory za predpokladu, že súčasne vylúčime iné ochorenie spôsobujúce hypertrofiu komory. Ľavá komora má typický banánovitý tvar dutiny, hypertrofované sú aj papilárne svaly. V prípade obštrukcie výtokového traktu ľavej komory je prítomný typický systolický dopredný pohyb mitrálnej chlopne, ktorého stupeň je priamo úmerný gradientu vo výtokovom trakte ľavej komory. Častý je rôzny stupeň mitrálnej insuficiencie. Pre hypertrofickú KMP je charakteristická vysoká ejekčná frakcia a nad - merná kontraktilita. EKG zmeny sú v novorodeneckom veku často nešpecifické. Zriedka sú prítomné známky hypertofie ľavej komory, hlboká vlna Q vo V4, predĺženie QT intervalu, časté komorové arytmie a zmeny v repolarizačnej fáze – depresie ST segmentu s výrazne negatívnou T-vlnou. Veľký význam má holterovské vyšetrenie s cieľom vylúčiť závažnú ventrikulárnu tachykardiu, ktorej prítomnosť zvyšuje riziko náhleho kardiálneho úmrtia. Liekom voľby pri hypertrofickej KMP v novorodeneckom veku sú betablokátory. Inotropné látky, diuretiká zvyšujú gradient vo výtokovej časti ľavej komory a môžu zhoršiť celkový stav [1, 2].
KAZUISTIKA
Donosený hypotrofický novorodenec mužského pohlavia, ktorý sa narodil v 40. gestačnom týždni. Plodová voda odtiekla päť hodín pred pôrodom. Pôrod prebehol bez komplikácií, spontánne záhlavím. Pôrodná hmotnosť novorodenca bola 2720 gramov, pôrodná dĺžka 46 cm, obvod hlavičky 33,5 cm. Bezprostredná adaptácia novorodenca primeraná, Apgarovej skóre bolo zhodnotené v prvej i piatej minúte 10 bodov. Matka novorodenca, 28-ročná drogovo závislá druhorodička, s primeranou prenatálnou starostlivosťou, prenatálny skríning negatívny, orálny glukózo-tolerančný test (oGTT) negatívny, HBsAg, RRR, HIV negatívne. Počas tehotenstva užívala heroín, pervitín a marihuanu, analgetiká, benzodiazepíny. Priznala fajčenie a užívanie alkoholu. Počas tehotenstva bola hospitalizovaná štyri mesiace v psychiatrickom zariadení, mesiac pred pôrodom bola prepustená do domácej liečby.
Vzhľadom na anamnézu matky bol novorodenec prijatý na Jednotku intenzívnej starostlivosti. Pri prijatí na spontánnej ventilácii, postupne sa rozvinulo tachypnoe do 75/minút, FiO2 0,21, frekvencia srdca primeraná 125–147/minútu, tlak krvi opakovane v norme. Prítomná kraniofaciálna stigmatizácia v zmysle fetálneho alkoholového syndrómu (FAS): široký koreň nosa s naznačeným hypertelorizmom, nižšie uložené ušnice, úzka horná pera, zmazané philtrum. Na srdci a pľúcach bol primeraný auskultačný nález, bruško v niveau, mäkké, priehmatné. Postnatálne sa postupne rozvinuli symptómy neonatálneho abstinenčného syndrómu (NAS). Úvodné Finneganovej skóre bolo hodnotené 2–4 body. Od 2. dňa Finneganovej skóre 4–8 bodov, novorodenec výrazne nekľudný, vysoko ladený piskľavý plač, pozorovaný hypertonus na horných končatinách, manipulačný tremor a zvýšené sanie. Zahájená liečba barbiturátmi 2,5 mg/kg/dávku každých 6–8 hodín, s postupným možným predlžovaním intervalu podávania každých 12 hodín.
Vo vstupných laboratórnych parametroch normoglykémie, urea, kreatinín v norme, mierne zvýšené hodnoty hepatálnych testov, zvýšená hodnota kyseliny močovej, ľahká metabolická acidóza, kompenzovaná hyperventiláciou. Toxikologickým tenkovrstvovým chromatografickým skríningovým vyšetrením vzorky moča bol zistený pozitívny nález kofeínu, nikotínu a barbiturátov. Benzodiazepíny, tricyklické antidepresíva a tvrdé drogy imunochemickou metodikou boli negatívne. Etanol a kyselina hippurová boli v moči taktiež negatívne. Vzhľadom na elevované zápalové parametre, trombocytopéniu v krvnom obraze bol novorodenec prekrytý štandardnou antibiotickou kombináciou. Ultrasonografické vyšetrenie mozgu bez závažnej patológie a detekcie vrodenej vývojovej chyby, ultrasonografia obličiek s primeraným nálezom s ľahkou dilatáciou dutého systému vľavo.
Od narodenia novorodenec primerane toleroval cumľom ženské mlieko z laktária, s možným zvyšovaním dávok. Od 3. dňa života, po plači a po kŕmení, boli zaznamenané opakované apnoické pauzy, dieťa vyžadovalo kyslík do priestoru inkubátora s FiO2 do 0,25. Dominoval nezáujem o pitie cumľom, kŕmenie realizované prostredníctvom nazogastrickej sondy. Auskultačne bol prítomný jemný systolický šelest intenzity 2/6 s propagáciou do axily, bez hepatomegálie, periférne pulzácie dobre hmatné, na dolných končatinách pozorované diskrétne edémy, pre - a postduktálne saturácie 90–92 %, v acidobáze pretrvávala metabolická acidóza. Na röntgenovej snímke hrudníka bola zväčšená silueta srdca, pľúcne polia bez patologického nálezu. Následne bolo realizované kardiologické vyšetrenie s echokardiografickým nálezom hypertrofickej KMP, s dominantným asymetricky hypertrofovaným interventrikulárnym septom, zhrubnutým myokardom, s významnou redukciou objemu obidvoch komôr, s naznačeným systolickým dopredným pohybom mitrálnej chlopne, bez významnej obštrukcie vo výtokovom trakte ľavej komory. Prítomná nadmerná kontraktilita a reštriktívna diastola (obr. 1, 2).
Obr. 1. Bidimenzionálny echokadiogram, parasternálne dlhá os, obraz hypertrofickej KMP u novorodenca, asymetrická hypertrofia interventrikulárneho septa (IVS) a ľavej komory (LV), konvexita IVS prominuje do dutiny LV.
Fig. 1. Bidimensional echocardiogram showing long axis parasternal views of the left ventricle of a newborn, hypertrophic cardiomyopathy, asymmetrical hypertrophy of the septum and left ventricular hypertophy. There is convexity toward the left ventricular cavity.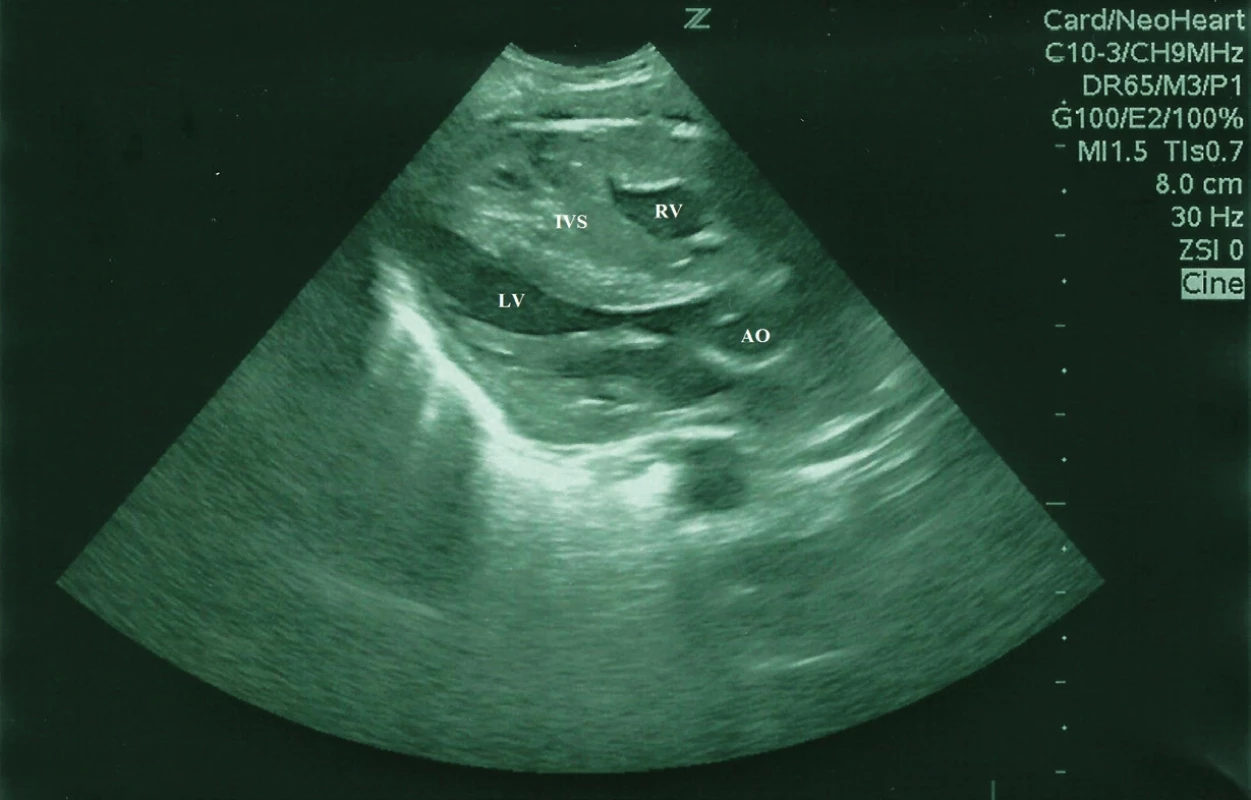
Obr. 2. Bidimenzionálny echokardiogram, parasternálne krátka os, hypertrofická KMP u novorodenca, asymetrická hypertrofia IVS, LV
Fig. 2. Bidimensional echocardiogram showing short axis parasternal views of the left ventricle of a newborn, hypertrophic cardiomyopathy, asymmetrical hypertrophy of the septum and left ventricular hypertrophy.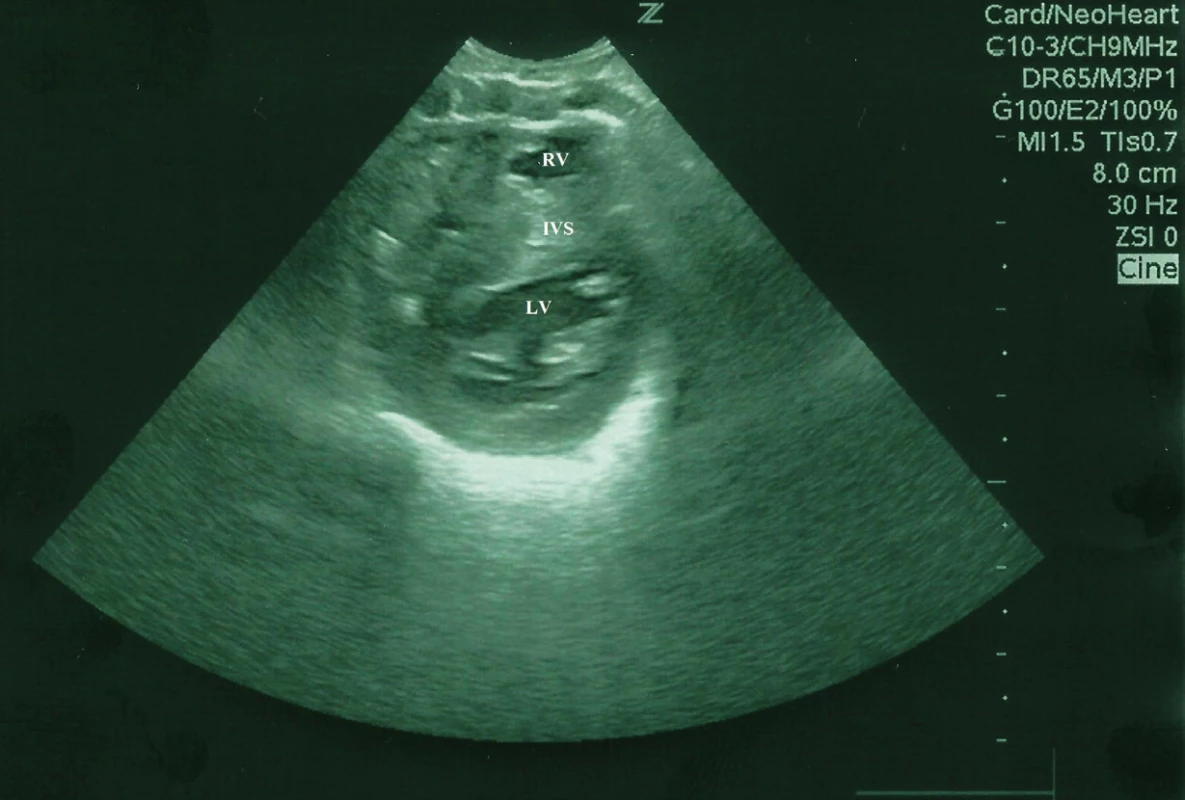
Na EKG rytmus sínusový pravidelný, pravotypový typ krivky, bez známok hypertrofie a preťaženia, repolarizácia a časové intervaly v norme. Vzhľadom na echokardiografický nález sme zahájili liečbu metoprololom 0,5 mg/kg//dávku každých 12 hodín. V 7. dni života bol echokardiografický nález nezmenený, pretrvával obraz hypertrofickej KMP, bez obštrukcie, s dobrou kontraktilitou, prítomná stopová trikuspidálna insuficiencia. Dávky metoprololu boli zvýšené na 1 mg/kg/dávku každých 12 hodín. Holterovské vyšetrenie bolo s primeraným nálezom, bez zachytenej arytmie. V ďalšom priebehu hodnoty hepatálnych testov, kyseliny močovej a zápalové parametre sa upravili do normy, krvný obraz, mineralogram, bielkoviny, albumín, amoniak, železo (Fe), väzbová kapacita Fe, transferín, meď, hormóny štítnej žľazy boli taktiež v medziach normy.
V rámci diferenciálnej diagnostiky hypertrofickej KMP boli odobraté vzorky moča a krvi na možné metabolické ochorenia s negatívnym nálezom, podobne hodnoty C peptidu a glykozylovaného hemoglobínu (HbA1c) v norme. Sérologický panel na možné intrauterínne prebehnuté infekcie (toxoplazmóza, rubeola, chlamýdie, listerióza) boli taktiež negatívne. V rámci kraniofaciálnej stigmatizácie bolo realizované genetické vyšetrenie. Identifikovaný normálny karyotyp 46,XY, bez štruktúrových zmien na cytogenetickej úrovni. Neurológom bola konštatovaná centrálna tonusová porucha, hypertonický syndróm so spomalenými ale výbavnými novorodeneckými reflexami a stigmatizácia v zmysle FAS. Priebeh hospitalizácie bol komplikovaný na 10. deň života septickou komplikáciou (Pseudomonas aeruginosa) s nutnosťou zmeny antibiotickej liečby.
Vo veku 2–3 týždňov začína piť cumľom, striedavo kŕmenie nazogastrickou sondou, od 4. týždňa všetky dávky pije cumľom. Vo veku 1 mesiaca bolo u novorodenca realizované kontrolné echokardiografické vyšetrenie bez nálezu hypertrofickej KMP, metrické parametre a funkcia myokardu v norme, naďalej pretrvávalo otvorené foramen ovale. Na základe regresie nálezu bolo zahájené postupné znižovanie dávok metoprololu až do úplného vysadenia. Vo veku 5 týždňov bol novorodenec prepustený domov s hmotnosťou 2990 g, s odporučením dispenzarizácie v detskej kardiologickej ambulancii a v ambulancii pre deti s perinatálnym rizikom, kde vo veku 10 mesiacov života bolo dieťatko vyšetrené s konštatovaním primeraného psychomotorického vývoja, jemná a hrubá motorika v norme, začínajúca vertikalizácia s oporou, kontakt s dieťatkom primeraný, vážnejšie choré nebolo. Kardiologické kontroly opakovane s primeraným nálezom. Na ďalšie kontroly do ambulancie pre deti s perinatálnym rizikom sa matka s dieťaťom nedostavila.
DISKUSIA
V novorodeneckom veku sa hypertrofická KMP vyskytuje najčastejšie u novorodencov matiek s diabetes mellitus, po perinatálnej asfyxii, pri vrodených metabolických poruchách, pri Noonanovej syndróme [5, 6, 7]. V publikovanej literatúre sa vyskytli prípady tranzitórnej hypertrofickej KMP aj u predčasne narodených novorodencov v súvislosti s dlhodobým podávaním dexametazonu pri bronchopulmonálnej dysplázii [6, 8]. Kale a kol. popísali prípad tranzitórnej hypertrofickej KMP u predčasne narodeného novorodenca už po jednej dávke 0,5 mg/kg dexametazonu [6].
V prípade diagnostikovanej hypertrofickej KMP v novorodeneckom veku je vždy potrebné pátrať po možnosti diabetes mellitus alebo gestačného diabetu u matky. Vznik hypertrofickej KMP sa v tomto prípade vysvetľuje pôsobením samotného inzulínu a rastového faktora, ktorý má inzulínu podobné účinky (insulin-like growth factor-1) [9]. V prezentovanej kazuistike bol oGTT počas tehotenstva negatívny, u novorodenca sme nezachytili žiadne hypoglykémie, hodnoty C peptidu, HbA1c boli v medziach normy. Echokardiograficky sme vylúčili vrodené vývojové chyby srdca. Negatívnym metabolickým skríningom sme z úvah o možnej príčine hypertrofickej KMP vyradili závažné vrodené metabolické ochorenia. Podobne genetický skríning bol negatívny. Vzhľadom na dôsledné anamnestické údaje, prítomnosť symptómov NAS a pomerne rýchlu regresiu echokardiografického nálezu postnatálne, po prerušení prísunu škodlivých psychoaktívnych látok, uvažujeme o etiologickej súvislosti výskytu hypertrofickej KMP u novorodenca s polyabúzom matky.
Je pomerne ťažké určiť alebo dokázať, ktoré z uvedených návykových látok, ktoré matka užívala počas tehotenstva, sa v etiopatogenéze uplatnili najviac. Psychoaktívne návykové látky sú zväčša nízkomolekulové, vo vode rozpustné lipofilné látky. Tieto fyzikálne vlastnosti im umožňujú jednoduchší prechod cez placentárnu bariéru k vyvíjajúcemu sa plodu. Biologický polčas rozpadu týchto látok vo vyvíjajúcom sa plode je v porovnaní s dospelými výrazne predĺžený [9]. Nakumulované psychoaktívne návykové látky v tkanivách plodu a v plodovej vode môžu na vyví - jajúce sa bunky plodu pôsobiť priamo toxicky. Okrem toho môžu ovplyvniť expresiu receptorov a uplatniť sa vo forme falošných neurotransmiterov, spôsobovať vazokonstrikciu a ovplyvniť aj epigenetické vlastnosti plodu [10].
Jednou z teórií, ktoré sa uplatňujú v patogenéze hypertrofickej KMP, je katecholamínová teória, ktorá predpokladá zvýšenú citlivosť myokardiálnych receptorov na cirkulujúce katecholamíny, hlavne noradrenalín, ktorý svojim trofickým účinkom ovplyvňuje rast myocytov. Na druhej strane je potrebné si uvedomiť, že vyvíjajúci sa plod má obmedzené možnosti metabolizovať a eliminovať škodlivé látky, enzýmové detoxikačné systémy v pečeni sú nezrelé, eliminácia škodlivín je výrazne spomalená, rýchlosť eliminácie drogy z plodu je závislá aj od rýchlosti eliminačných mechanizmov matky. Niektoré psychoaktívne návykové látky pôsobia na vyvíjajúci sa plod počas celého tehotenstva, iné sa uplatňujú len v niektorých štádiách tehotnosti. Najcitlivejším obdobím pre uplatnenie sa rôznych nepriaznivých vplyvov je prvý trimester, štádium organogenézy. V prvom trimestri sa uplatňuje vo väčšej miere alkohol. Môže spôsobiť malformácie plodu, vrodené vývojové chyby srdca, končatín, urogenitálneho traktu. Približne po 10. týždni tehotnosti sa plod vyvíja veľmi rýchlo, naberá hmotnosť, rastie. V tejto fáze môžu niektoré drogy poškodiť oči, vyvíjajúce a diferencujúce sa orgánové systémy: urogenitálny, gastrointestinálny systém a hlavne centrálny nervový systém (CNS). Časté je v tomto období ukončenie tehotnosti potratom, alebo predčasným pôrodom. Plody matiek užívajúcich návykové látky počas tehotenstva majú väčšie riziko zásahu do normálneho rastu a hmotnosti vyvíjajúceho sa plodu, IUGR je príčinou nízkej pôrodnej hmotnosti novorodenca [11]. Po pôrode je transplacentárny prenos týchto látok prerušený, čo má za následok rozvoj abstinenčného syndrómu u novorodenca [12].
NAS je definovaný ako súbor abstinenčných symptómov, ktoré sa rozvinú novorodencom matiek, ktoré užívali počas tehotenstva psychoaktívne návykové látky [13, 14]. Prejavuje sa rôznymi kombináciami príznakov a v závislosti od typu užívanej psychoaktívnej návykovej látky sa symptómy objavujú v rôznej časovej perióde a trvaní po prerušení intrauterínnej expozície [15]. Najčastejšou príčinou NAS je užívanie opiátov počas tehotenstva. Heroín je klasickým predstaviteľom skupiny opiátov. Abstinenčné príznaky u novorodenca matky závislej na heroíne sa začínajú manifestovať typicky počas prvých 24 hodín od narodenia [13, 14]. Plody matiek, ktoré užívajú počas tehotenstva heroín, sú vystavené vyššiemu riziku intrauterinného stresu, prematurity, hypotrofie a výskytu vrodených vývojových chýb [9, 14, 16]. Z ďalších škodlivín, ktoré matka novorodenca užívala počas tehotenstva, bola marihuana, sušené listy rastliny Konope siate (Cannabis sativa). Marihuana je vo všeobecnosti považovaná za najčastejšiu užívanú drogu počas tehotenstva [16]. Jej účinky na plod sú prezentované IUGR, poruchami vo vývoji optických dráh, malformáciami končatín. Pervitín patrí medzi stimulačné psychoaktívne návykové látky a dôsledkom jeho užívania počas tehotenstva je hypoxia a hypotrofizácia plodu, ako i vrodené vývojové chyby CNS, urogenitálneho, gastrointestinálneho i kardiovaskulárneho systému. Časté sú aj redukčné deformity končatín. Na vrodených vývojových chybách srdca sa taktiež uplatňujú benzodiazepíny. Často sú pridružené anomálie kraniofaciálnej oblasti a rázštepové chyby [14, 17].
Fajčenie je najrozšírenejšou závislosťou tehotných žien. Cigaretový dym obsahuje veľké množstvo priamych toxických látok, ale i škodlivín ako mutagény, karcinogény. Spôsobuje hlavne IUGR a prematuritu, rôzne vrodené vývojové chyby, hlavne rázštepové chyby [18]. Podobne užívanie alkoholu počas tehotnosti je veľkým rizikom pre plod. Alkohol je považovaný za klasický teratogén. Súbor príznakov v dôsledku prenatálnej expozície plodu alkoholom je súčasťou fetálneho alkoholového syndrómu. Riziko, že žena alkoholička bude mať dieťa s FAS, je pomerne vysoké, predstavuje 35–40 % [9, 19]. Novorodenci matiek užívajúcich alkohol počas tehotnosti sú zväčša predčasne narodení, hypotrofickí, s rôzne vyjadreným stupňom karaniofaciálneho dysmorfizmu (mikrocefalia, mikroftalmia, krátky nos, antevertované nozdrily, úzke očné štrbiny, hypoplastické philtrum, mikroretrogenia). Závažné sú vrodené vývojové chyby CNS (hypoplázia mozgu, agenéza corpus callosum, anomálie cerebella), kardiovaskulárneho, urogenitálneho systému, ako i abnormality skeletu a končatín [14, 17, 19, 20].
ZÁVER
V prezentovanej kazuistike sme opísali prípad výskytu tranzitórnej hypertrofickej KMP u novorodenca matky s polyabúzom psychoaktívnych návykových látok s potvrdeným neonatálnym abstinenčným syndrómom. Výskyt hypertrofickej KMP v súvislosti s užívaním psychoaktívnych návykových látok v tehotenstve doteraz v literatúre publikovaný nebol. Hypertrofická KMP bola diagnostikovaná na 3. deň života a echokardiografický nález sa u novorodenca v pomerne krátkej dobre upravil do normy na liečbe metoprololom. Do akej miery sa uplatnili jednotlivé psychoaktívne návykové látky, ktoré matka užívala počas tehotenstva, je pomerne zložité jednoznačne určiť. Každopádne v súvislosti s užívaním psychoaktívnych návykových látok v tehotenstve je potrebné myslieť v novorodeneckom veku aj na diagnózu hypertrofickej KMP. Na základe dôslednej anamnézy, včasnej diagnostiky a liečby ochorenia môžeme zabrániť možným komplikáciám, ktoré z tejto závažnej diagnózy môžu v budúcnosti vyplynúť.
Skratky:
- IUGR – intrauterinná rastová reštrikcia
- KMP – kardiomyopatia
- oGTT – orálny glukózo-tolerančný test
- NAS – neonatálny abstinenčný syndróm
- FiO2 – inspiračná frakcia kyslíka
- Fe – železo
- HbA1c – glykozylovaný hemoglobín
- CNS – centrálny nervový systém
- FAS – fetálny alkoholový syndróm
- IVS – interventrikulárne septum
- LV – ľavá komora
- RV – pravá komora
Došlo: 27. 11. 2017
Přijato: 23. 1. 2018
MUDr. Jana Nikolinyová
Neonatologická klinika SZU
Fakultná nemocnica s poliklinikou F. D. Roosevelta
Námestie L. Svobodu 1
975 17 Banská Bystrica
Slovenská republika
e-mail: jnikolinyova@gmail.com
Zdroje
1. Alday LE, Moreyra E. Hypertrophic cardiomyopathy in infants and children. http://cdn.intechweb.org/pdfs/27266.pdf.
2. Freedom RM, et al. Neonatal Heart Disease. Springer Science & Business Media, 2012 : 695–722.
3. Pober BR. Williams-Beuren syndrome. N Engl J Med 2010; 362 : 239–252.
4. Marian AJ. Hypertrophic cardiomyopathy. In: Cardiovascular Genetics and Genomics for the Cardiologist. Dzau Liew. Malden, Massachusetts: Blackwell Futura, 2007 : 30–54.
5. Moser-Bracher A, Meinhold A, Hug MI, et al. Severe neonatal hypertrophic obstructive cardiomyopathy. http://www.neonet.ch/files/2214/0628/8754/Cotm-March-2013.pdf.
6. Kale Y, Aydemir O, Ceylan O, et al. Hypertrophic cardiomyopathy after a single dose of dexamethasone in a preterm infant. Pediatrics & Neonatology 2015; 56 (4): 268–270.
7. Magner M, Ješina P, Klement P, et al. Význam časné diagnostiky dědičných metabolických poruch s manifestací v novorozeneckém věku. Čes-slov Pediat 2013; 68 (1): 3–11.
8. Celik M, Tuzun H, Aldudak B, et al. Transient isolated right ventricular hypertrophy in a neonate, Int J Clin Cardiol 2015; 2 : 6.
9. Gomella TL, Cunningham MD, Eyal F, et al. Neonatology. 7th ed. UK: McGraw-Hill, 2013 : 715–724.
10. Füssiová M, Demová K, Lelovská R, Bauer F. Neonatálny abstinenčný syndróm – stále aktuálny problém v neonatológii. Lek Obz 2016; 12 : 341–348.
11. Kliment M. Rizikové správanie rodičov počas tehotenstva a po narodení dieťaťa. Via Pract 2007; 4 (7/8): 360–362.
12. Macmullen NJ, Dulsko LA, Blobaum P. Evidence-based interventions for neonatal abstinence syndrome. Pediatric Nurs 2014; 40 (4): 165–172.
13. Jansson LM. Neonatal abstinence syndrome, commentary. Acta Paediatrica 2008; 97 (10): 1321–1323.
14. Hudak ML, Tan R. The Committee On Drugs; The Committee On Fetus And Newborn; American Academy of Pediatrics. Neonatal drug withdrawal. Pediatrics 2012; 129 (2): e540–e560.
15. Peychl I. Neonatální abstinenční syndrom. Čes-slov Pediat 2001; (11): 663–666.
16. Binder T. Drogy, alkohol a kouření v těhotenství. In: Hájek Z, et al. Rizikové a patologické těhotenství. Praha: Grada Publishing, 2004 : 223–231.
17. Poláčková R. Abstinenční syndrom. In: Janota J, Straňák Z, et al. Neonatologie. Praha: Mladá fronta, 2013 : 16–23.
18. Minnes S, Lang A, Singer L. Prenatal tobacco, marijuana, stimulant, and opiate exposure: outcomes and practice implications. Addict Sci Clin Pract 2011; 6 : 57–70.
19. Watkins RE, Elliott EJ, Wilkins A, et al. Recommendations from a consensus development workshop on the diagnosis of fetal alcohol spectrum disorders in Australia. BMC Pediatrics 2013; 13 : 156–165.
20. Wilson J, Thorp JR. Substance Abuse in Pregnancy. Global Library of Women‘s Medicine. http://www.glowm.com/section_view/heading/Substance%20Abuse%20in%20Pregnancy/item/115.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2018 Číslo 3- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Editorial: Průduškové astma v dětském věku
- Současný pohled na diagnostiku a léčbu astmatu u dětí
- Malý zahradník
- Retrospektivní analýza tupých traumat lbi v letech 2010-2014 na Dětské klinice FN a LF UK Plzeň
- C3 glomerulopatie – nově definovaná klinická jednotka
- Makro AST jako příčina asymptomatické elevace aspartátaminotransferázy
- Tranzitórna hypertrofická kardiomyopatia u novorodenca s neonatálnym abstinenčným syndrómom
- Alternujúca liečba horúčky zvyšuje riziko vedľajších účinkov antipyretík
- Diagnostika, léčba a prognóza vrozené hypotyreózy
- Nízká porodní hmotnost a další rizikové faktory pro pozdější onemocnění u dětí a dospělých (prenatální a postnatální programming)
- Novinky v kardiopulmonální resuscitaci – „guidelines 2018“
- 100 let od narození pediatrických radiologů Antonína Rubína a Oldřicha Šnobla
- 10 ročníkov Festivalu kazuistík z pediatrie
- Zemřel prof. MUDr. Karel Křepela, CSc.
- Za MUDr. Rudolfem Stříteckým
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- C3 glomerulopatie – nově definovaná klinická jednotka
- Současný pohled na diagnostiku a léčbu astmatu u dětí
- Novinky v kardiopulmonální resuscitaci – „guidelines 2018“
- Makro AST jako příčina asymptomatické elevace aspartátaminotransferázy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



