-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Uveitida asociovaná s juvenilní idiopatickou artritidou
Juvenile idiopatic arthritis associated uveitis
Chronic anterior uveitis is the most common extraarticular manifestation of juvenile idiopathic arthritis (JIA). It is a serious eye disease, potentially threatening the patient with irreversible visual damage to vision loss. Exact pathogenetic mechanism leading to the intraocular inflammation development is not known, but it is likely to be an interaction of the individual's genetic disposition and external environmental factors. The most common manifestation is chronic anterior uveitis, usually asymptomatic, therefore systematic screening and long-term follow-up of patients at risk is absolutely fundamental.
Recently, the spectrum of therapeutic possibilities for JIA associated uveitis is expanding. In addition to topical treatment, systemic corticosteroids and conventional synthetic disease modifying antirheumatic drugs (csDMARDs), also biological drugs (bDMARDs) are increasingly used.
The objective of this article is to provide an up-to-date overview of this area and recent information on the recommendations for diagnosis and treatment of JIA-associated chronic uveitis.
Key words:
JIA, uveitis, screening, treatment
Autoři: H. Malcová 1; T. Dallos 2; R. Horváth 1; P. Doležalová 3; M. Macků 4; D. Němcová 3; E. Říhová 5; P. Svozílková 5; M. Brichová 5; B. Kostolná 6; prof. MUDr. Jarmila Heissigerová, Ph.D., MBA 5
Působiště autorů: Oddělení revmatologie dětí a dospělých, Fakultní nemocnice Motol, Praha 1; Detská klinika Lekárskej fakulty Univerzity Komenského a Národného ústavu detských chorôb, Bratislava 2; Centrum dětské revmatologie a autoinflamatorních onemocnění, Klinika dětského a dorostového lékařství 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha 3; Pediatrická klinika, Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity, Brno 4; Oční klinika 1. lékařské fakulty Univerzity Karlovy a Všeobecné fakultní nemocnice, Praha 5; Klinika detskej oftalmológie Lekárskej fakulty Univerzity Komenského a Národného ústavu detských chorôb, Bratislava 6
Vyšlo v časopise: Čes-slov Pediat 2018; 73 (4): 189-197.
Kategorie: Sympozium: dětská revmatologie
Souhrn
Nejčastější extraartikulární manifestací juvenilní idiopatické artritidy (JIA) je přední uveitida. Jedná se o závažné oční onemocnění, které potenciálně ohrožuje pacienta ireverzibilním poškozením až ztrátou zraku. Přesné patogenetické mechanismy, které vedou k rozvoji nitroočního zánětu, nejsou známé, pravděpodobně se však jedná o interakci genetické dispozice jedince a faktorů zevního prostředí. Nejčastěji se onemocnění projevuje jako chronická přední uveitida a vzhledem k faktu, že na počátku bývá zpravidla asymptomatická, je systematický screening a dispenzarizace rizikových pacientů zcela zásadní.
V současné době se spektrum terapeutických možností uveitidy asociované s JIA rozšiřuje, a kromě lokální léčby, systémových kortikoidů a konvenčních syntetických chorobu modifikujících léků (csDMARDs), se stále častěji používají také léky biologické (bDMARDs).
Cílem autorského kolektivu bylo poskytnout aktuální přehled v této oblasti a podat recentní informace o doporučeních pro diagnostiku a léčbu chronické přední uveitidy asociované s JIA.
Klíčová slova:
JIA, uveitida, screening, léčba
ÚVOD
Uveitida asociovaná s juvenilní idiopatickou artritidou (JIA) se vyskytuje přibližně u jedné třetiny pacientů a je tedy nejčastější mimokloubní manifestací tohoto onemocnění [1–5]. K jejímu rozvoji může dojít kdykoli v průběhu choroby, dokonce asi u 6 % případů oční zánět předchází samotnému postižení pohybového aparátu artritidou [6]. Tento fakt, v kombinaci s často asymp-tomatickým průběhem očního zánětu, komplikuje správnou a časnou diagnózu a terapeutické intervence. Na složitosti problému se nemalou mírou podílí i věk pacientů, často se jedná o předškolní děti, které jsou jen omezeně schopné popsat své obtíže. Klíčovou roli proto hraje pravidelná oftalmologická dispenzarizace.
Léčebné možnosti uveitidy asociované s JIA se v posledních letech významně zlepšily, a to především s nástupem biologických chorobu modifikujících léků (bDMARDs), zejména ze skupiny inhibitorů tumor nekrotizujícího faktoru (TNF) α. I díky těmto změnám v posledním období probíhají intenzivní diskuse odborníků z řad revmatologů a oftalmologů se snahou optimalizovat doporučení pro management a léčbu uveitid asociovaných s JIA.
EPIDEMIOLOGIE
Chronická uveitida obecně postihuje především dospělé, v celkovém počtu uveálních pacientů děti představují pouze 5–10 % [7]. Přesto rizika spojená s pozdní diagnózou a vznikem zrak ohrožujících komplikací v dětství zůstávají významným klinickým problémem. Udávaná prevalence uveitidy asociované s JIA je velmi variabilní, v Evropě se pohybuje v intervalu od 12 do 38 % [1, 7–10]. Tyto markantní rozdíly ve výskytu jsou patrně podmíněné rozdílností jednotlivých populací, ale také mohou souviset se způsobem a frekvencí oftalmologické dispenzarizace pacientů s JIA v jednotlivých zemích. Publikované údaje o incidenci uveitidy u JIA ve Skandinávii jsou 18 %, tedy významně vyšší než v Asii, kde se udává incidence méně než 5 % [3]. V Německu aktuální údaje z registru uvádějí, že přibližně u 12 % všech pacientů s JIA se rozvine v průběhu sledování nějaká forma uveitidy [11]. Recentní data poukazují na klesající trend výskytu uveitidy asociované s JIA [11]. Vysvětluje to agresivnější přístup k léčbě JIA za časného zahájení DMARDs, zejména methotrexátu (MTX) [12]. Přesné údaje o výskytu uveitidy asociované s JIA v České a Slovenské republice zatím nejsou k dispozici.
Riziko rozvoje uveitidy závisí na podtypu artritidy. Nejvyšší mají děti s oligoartikulární formou JIA, ať už extendovanou nebo perzistující, naopak u systémové formy a séropozitivní polyartritidy se uveitida vyskytuje jen velmi vzácně [13]. Další rizikové faktory spojované na základě údajů z velkých národních registrů s rozvojem uveitidy u dětí s JIA jsou pohlaví a věk při manifestaci artritidy, přítomnost antinukleárních protilátek (ANA) nebo antigenu HLA B27 [3, 14, 15]. S chronickou přední uveitidou se setkáváme častěji u dětí předškolního věku, ženského pohlaví a pozitivitou ANA. Naopak chlapci s HLA B27 pozitivitou a entezopatickou formou JIA mají vyšší riziko rozvoje akutní přední uveitidy.
Interakce mezi jednotlivými rizikovými faktory je komplexní a její interpretace není jednoduchá. Starší studie nepotvrzovaly souvislost rizika s etnikem [16], avšak novější práce ukazují vyšší riziko u pacientů evropského původu [17]. Informace z registrů dále ukazují, že k manifestaci uveitidy dojde nejčastěji v průběhu prvních 4 let po stanovení diagnózy JIA (90 %), přičemž největší část uveitid (70 %) se projeví již v průběhu prvního roku po manifestaci artritidy [18]. U části pacientů (3–10 %) může manifestace uveitidy dokonce předcházet projevům artritidy [6]. Na základě těchto poznatků je vhodné každé dítě s nově diagnostikovanou přední uveitidou poslat na revmatologické vyšetření [13].
KLINICKÉ PROJEVY A KOMPLIKACE
Průběh uveitidy může být akutní, subakutní, nebo chronický či recidivující. Podle lokalizace rozeznáváme přední, intermediální, zadní uveitidu, nebo postižení předního i zadního segmentu oka označované jako panuveitida. Postižení oka zánětem může být jednostranné, nebo oboustranné. V rámci JIA se setkáváme nejčastěji s chronickou přední uveitidou negranulomatózního charakteru, která je v 80 % oboustranná a asymptomatická. Vyskytuje se především u oligoartikulární, séronegativní polyartikulární a psoriatické formy. Jen u některých subtypů JIA (entezopatická, HLA B27 asociovaná) je charakteristický výskyt akutní, symptomatické přední uveitidy, doprovázené zarudnutím oka, bolestí a fotofobií.
Typickou komplikací jsou zadní synechie, srůsty mezi duhovkou a přední stranou čočky, které akcelerují rozvoj katarakty. Ta je nejčastější komplikací (19–81 %), ovlivňující zrakovou ostrost a tím i dlouhodobou prognózu pa-cienta. Je následkem jak perzistující zánětlivé aktivity, tak prolongované léčby lokálními či systémovými kortikoidy [12]. Další ze závažných, zrak ohrožujících komplikací je zvýšení nitroočního tlaku (≥22 mmHg), resp. sekundární glaukom s poškozením zrakového nervu a defektem zrakového pole až v 10–40 % případů [13]. Dlouhodobé podávání lokálních i systémových kortikoidů se opět významně podílí na rozvoji této komplikace.
Ačkoli zánětlivé postižení oka u uveitidy asociované s JIA se týká téměř výhradně předního segmentu, můžeme se setkat i s komplikacemi na zadním segmentu, způsobenými postižením hemato-retinální bariéry zánětem, např. makulární edém či edém terče zrakového nervu. Díky vyšetření optickou koherenční tomografií (OCT) je nyní možné detekovat tyto nálezy dříve, než to bylo v minulosti. Mezi další komplikace patří zonulární keratopatie, těžký zánět ciliárního tělesa, který může způsobit zákaly sklivce, hypotonii bulbu nebo jeho ftízu [3]. Za zmínku stojí také riziko rozvoje deprivační tupozrakosti – amblyopie na těžce postiženém oku se zákaly v optických médiích u velmi malých dětí (obr. 1).
Obr. 1. Uveitida se zonulární keratopatií, zadními synechiemi a kataraktou.
Fig. 1. Complicated uveitis with band kerathopathy, posterior synechiae and cataract.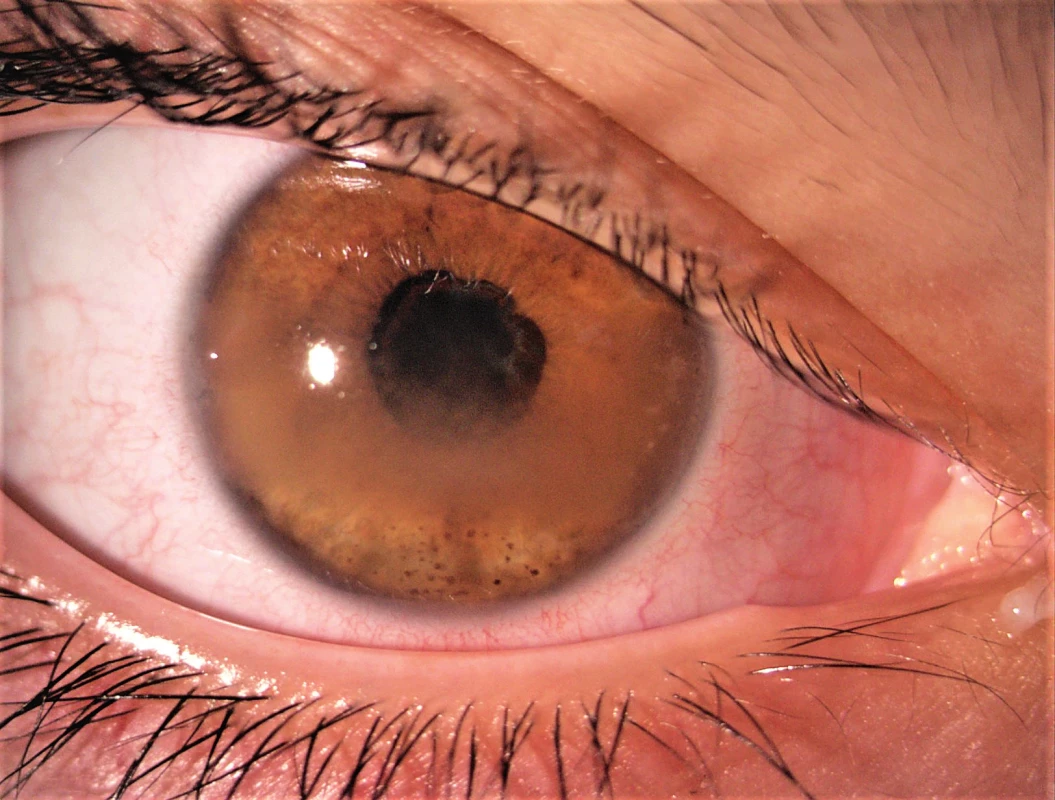
Údaje o četnosti výskytu jednotlivých komplikací uveitidy se významně liší a souvisejí také s typem artritidy a délkou trvání onemocnění. Vzhledem k asymptomatickému průběhu chronické přední uveitidy a časnému vzniku ireverzibilních komplikací je potřeba klást důraz na pravidelné oftalmologické vyšetřování pacientů se stanovenou diagnózou JIA a/nebo s podezřením na tuto diagnózu, aby případný oční zánět byl odhalen co nejdříve a nedošlo k progresi do stadia komplikací.
DIAGNOSTIKA A DISPENZARIZACE
Diferenciální diagnostikou by měla být u všech pacientů s uveitidou nejprve vyloučena infekční příčina a tzv. „maskující syndrom“, kam patří některá maligní onemocnění nebo cévní anomálie. Pro JIA je typická chronická negranulomatózní přední uveitida. Primárně zánět postihuje přední segment oka, až sekundárně vede k poruše hemato-okulární bariéry [19]. Diagnóza uveitidy asociované s JIA je proto založená na nálezu zánětlivých změn v přední komoře při biomikroskopickém vyšetření tzv. štěrbinovou lampou. Známky zánětu zahrnují přítomnost buněk v přední komoře [19] a průnik bílkovin do přední komory na základě poruchy hemato-okulární bariéry (flare, tj. zkalení předněkomorové tekutiny) [20]. Ke stanovení rozsahu a závažnosti uveitidy se obecně používá standardizovaná nomenklatura uveitidy (SUN – Standardization of Uveitis Nomenclature) (tab. 1) [21, 22]. Tato nomenklatura umožnuje monitorovat průběh choroby a srovnávat nálezy jednotlivých vyšetření.
Tab. 1. Skórovací schéma podle počtu buněk v přední komoře
Standardizovaná nomenklatura uveitidy – kritéria aktivity (SUN – Standardization of Uveitis Nomenclature, Jabs et al. Am J Ophtalmol 2005; 140: 509–516).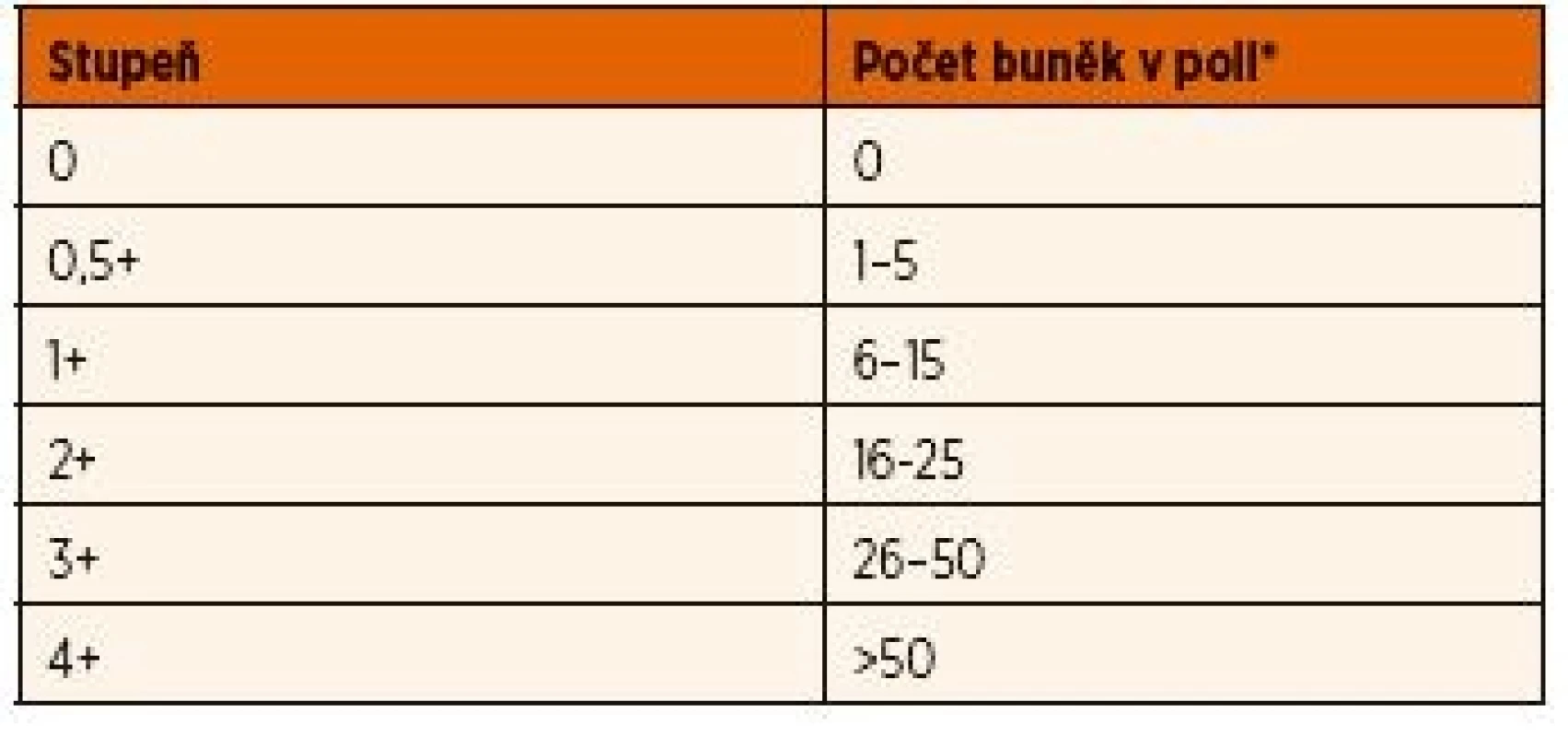
Skórovací schéma podle „flare“ (zkalení tekutiny v přední komoře oka v důsledku zánětu) 
Skórovací schéma tvorby synechií 
Aktivita uveitidy 
*Velikost hodnoceného pole je 1x1 mm ve štěrbinové lampě Hodnocení aktivity uveitidy zohledňuje především počet zánětlivých buněk v přední komoře a intenzitu flare (viz výše). Přítomnost zadních synechií nebo zbytky po synechiích na přední ploše čočky v kombinaci s klidným nálezem jsou známkou proběhlé ataky přední uveitidy v minulosti. Dalším možným klinickým projevem přední uveitidy jsou precipitáty, tj. přítomnost shluků zánětlivých buněk na endotelu rohovky. V případě přední uveitidy asociované s JIA bývají jemné a negranulomatózní. Vzhledem ke zpravidla asymptomatickému průběhu chronické přední uveitidy a nepřítomnosti makroskopicky viditelných známek zánětu se můžeme setkat u pacientů s JIA už při prvním biomikroskopickém vyšetření s komplikacemi (cca 20–45 % pacientů) [18]. Z tohoto důvodu by první oční vyšetření u pacientů s nově stanovenou diagnózou JIA nebo podezřením na JIA mělo proběhnout co nejdříve a další kontroly by měly být systematicky prováděny v pravidelných intervalech bez ohledu na absenci subjektivních potíží.
Doporučené intervaly pro oftalmologickou dispenzarizaci pacientů s JIA jsou založené většinou na podtypu JIA, věku při manifestaci, délce trvání onemocnění a přítomnosti ANA, čímž zohledňují rozdílné riziko rozvoje uveitidy u jednotlivých skupin pacientů. Z důvodu možného relapsu uveitidy anebo její nové manifestace je vhodné intervaly oftalmologického vyšetření zkrátit i během snižování dávek a po vysazení celkové protizánětlivé terapie. Národní doporučení pro oftalmologickou dispenzarizaci pacientů s uveitidou a JIA jsou k dispozici v řadě evropských zemí, např. ve Velké Británii [23], Německu [18] a Španělsku [24].
Součástí pravidelného očního sledování pacientů s JIA je: stanovení nejlepší korigovatelné zrakové ostrosti (vyšetření vizu), biomikroskopie předního segmentu, tj. vyšetření štěrbinovou lampou, měření nitroočního tlaku (NOT) a fundoskopie (vyšetření očního pozadí v mydriáze). Následkem uveitidy i její léčby může dojít ke zvyšování nitroočního tlaku a rozvoji glaukomu, proto je pravidelné měření NOT důležité. Riziko zvyšování NOT trvá i po dosažení inaktivity očního zánětu [25]. V případě průkazu uveitidy či podezření na komplikace mohou být indikována i některá další speciální oftalmologická vyšetření, jako optická koherenční tomografie (OCT) nebo méně často fluorescenční angiografie sítnice při podezření na edém makuly nebo zrakového nervu, event. vyšetření perimetru či tloušťky vrstvy nervových vláken s pomocí OCT vyšetření (OCT-RNFL) při podezření na glaukom [18, 26].
LÉČBA
Základem správného managementu uveitidy je včasná diagnóza a správné posouzení aktivity zánětu. To vyplývá z efektivní komunikace mezi dětským revmatologem a oftalmologem v rámci spolupráce interdisciplinárního týmu. Cílem léčby je dosažení minimálního či žádného počtu zánětlivých buněk v přední komoře (stupeň 0–0,5 podle SUN klasifikace) u obou očí [22]. V poslední době bylo publikováno několik protokolů na léčbu uveitidy. Jedná se především o doporučení britské [27], španělské [24] a německé pracovní skupiny [26], léčebný protokol má vždy několik úrovní podle stupně aktivity zánětu hodnocené klasifikačními kritérii SUN. Lokální kortikoidy se užívají v léčbě akutní i chronické přední uveitidy, systémová léčba je vyhrazena pro zrak ohrožující chronickou přední uveitidu.
Léčba by měla být zahájena co nejdříve, pokud aktivita buněk v přední komoře odpovídá stupni >0,5+ [27]. Imunosupresivní terapie by měla být posílena vždy v případě, že nedojde ke zlepšení na stávající léčbě nebo při manifestaci projevů spojených se špatnou prognózou. Jedná se o snížení vizu iniciálně na úroveň <0,3, hypotonii bulbu (≤6 mmHg), kataraktu, glaukom, makulární edém, hustý zákal sklivce. Pokud je však přítomna katarakta, glaukom, synechie nebo zonulární keratopatie bez známek aktivní uveitidy, většinou není důvod zahajovat či pokračovat v protizánětlivé léčbě [27].
Lokální a systémové kortikoidy
Lokální kortikoidy jsou prvním krokem v léčbě akutní i chronické přední uveitidy [24–27]. Nejlepší efekt mají silné preparáty s obsahem prednisolon-acetátu 1 % nebo dexamethason-fosfátu 0,1 % používané v různých intervalech podle stupně zánětlivé aktivity. Prolongovaná léčba lokálními kortikoidy zvláště při krátkých intervalech podávání vede k rozvoji glaukomu a katarakty. Proto jsou pravidelné kontroly nitroočního tlaku u pacientů na této léčbě nezbytné. Bylo prokázáno až o 87 % vyšší riziko rozvoje katarakty při podávání >3 kapek lokálního kortikoidu denně; dvě kapky a méně se považuje za bezpečnou dávku při dlouhodobé aplikaci [28].
Systémové kortikoidy se v indikaci uveitidy asociované s JIA uplatňují spíše výjimečně, ve velmi závažných případech hrozících ztrátou zraku, kdy je nezbytné dosáhnout rychlé kontroly zánětlivé aktivity, nebo jako „přemosťovací“ léčba do nástupu účinku jiné protizánětlivé terapie, tzv. DMARDs. Podáváme je u dětí v perorální podobě (prednison 1–2 mg/kg/den) nebo jako intravenózní pulzy (methylprednisolon 20–30 mg/kg//den 1–3x, max. denní dávka 1 g) [24, 27, 29]. Evidence pro použití systémových kortikoidů je extrapolací ze studií u dospělých pacientů [30], ale jsou zmiňovány jako terapeutická možnost i v doporučeních pro děti. Nežádoucí účinky systémově podávaných kortikoidů (např. porucha růstu, zvyšování systémového i nitro-očního tlaku, rozvoj katarakty, váhový přírůstek, hyperglykémie a osteoporóza) jsou velmi dobře známy. Je proto vhodné jejich dávku snižovat, jak nejrychleji je to z hlediska očního nálezu možné, a v případě trvající a závažné aktivity uveitidy současně zahájit steroidy šetřící imunosupresivní léčbu [31]. V případě potřeby dlouhodobější systémové kortikoterapie je vhodná suplementace vitaminem D a vápníkem a také antiulcerózní medikace (omeprazol 10–20 mg/d).
Výjimečně, pokud nedojde v případě závažné uveitidy (počet buněk v PK 3+ a 4+) ke zlepšení po 2 týdnech léčby perorálními kortikoidy, anebo v přítomnosti rizikových faktorů, se používají lokální aplikace kortikoidů periokulárně (betamethason, triamcinolon) [32]. Rizikem periokulární kortikoterapie je zvýšení nitroočního tlaku, subkonjuktivální krvácení, nekróza spojivky, periokulární atrofie a kožní hyperpigmentace [24]. K ovlivnění makulárního edému při uveitidě se kortikoid (dexamethason, triamcinolon-acetát) aplikuje intraokulárně (intravitreálně). V randomizované studii (Multicenter Uveitis Steroid Treatment Trial) byla incidence katarakty 91 % a glaukomu 17 % po 2 letech léčby steroidním implantátem. Méně časté komplikace intravitreální aplikace jsou endoftalmitida a pseudoendoftalmitida [33].
Mydriatika a cykloplegika
Používají se lokálně v podobě kapek k uvolnění svalů duhovky a ciliárního aparátu (cykloplegii) a k dilataci zornice jako prevence tvorby synechií. Lékem volby jsou krátkodobě účinné kapky s tropikamidem nebo cyclopentolatem 0,5–1 % [24, 27], v některých případech jsou pro léčbu nevyhnutelné preparáty s delším působením (homatropin 2–4 % či atropin 0,5–1 %), podávané několikrát denně. Mezi nežádoucí účinky patří únava, porucha akomodace (rozmazané vidění, fotofobie) a amblyopie.
Konvenční syntetické chorobu modifikující protirevmatické léky (csDMARDs)
Primární indikací k zavedení systémové imunosupresivní léčby je neadekvátní kontrola zánětlivé aktivity po 3 měsících terapie lokálními kortikoidy v dávce >2 kapky denně [27], nebo relaps aktivity uveitidy po snížení dávky lokálně aplikovaných kortikoidů. Seznam syntetických imunosupresivních léků, které lze používat v léčbě uveitidy asociované s JIA, a jejich dávkování je uvedeno v tabulce 2.
Tab. 2. Seznam csDMARDs používaných v léčbě chronické přední uveitidy asociované s JIA. 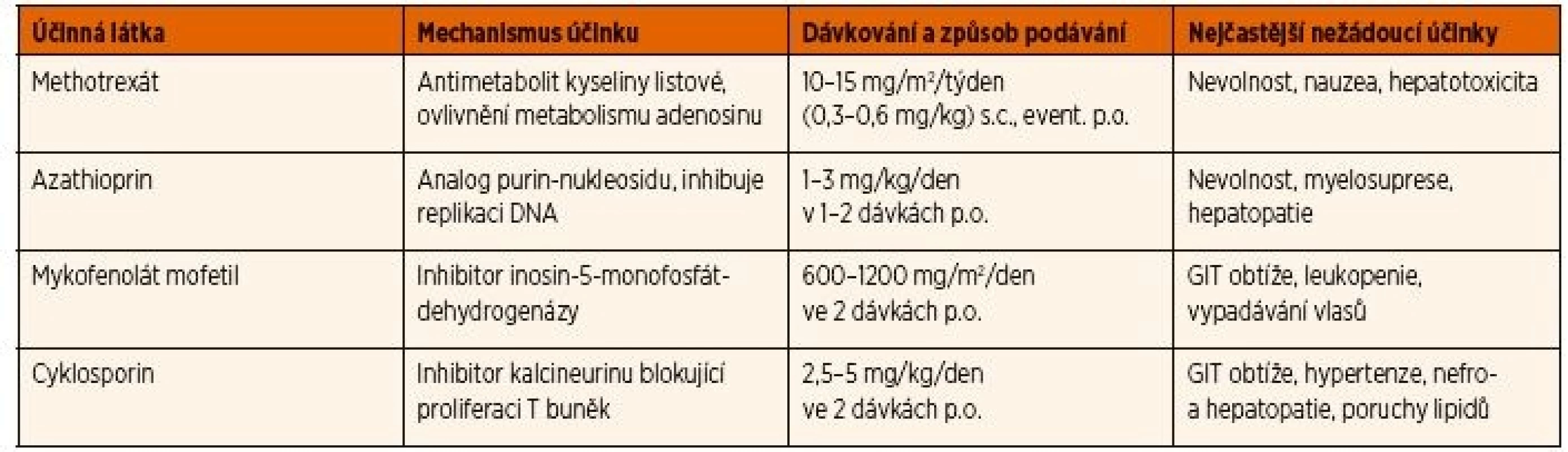
cs DMARDs: konvenční syntetické chorobu modifikující protirevmatické léky, p.o.: perorálně, s.c.: subkutánně, GIT: gastrointestinální Methotrexát (MTX) je v současných doporučeních jednoznačně lékem první volby pro terapii uveitidy spojené s JIA po selhání lokálních kortikoidů. Současně je to i základní lék pro léčbu JIA bez uveitidy, kterým se u většiny postižených daří dosáhnout remise onemocnění. V případě uveitidy je jeho zahájení indikováno, pokud po 12 týdnech lokální léčby nedojde ke zlepšení zánětlivé aktivity (aktivita >0,5+ hodnocení podle počtu buněk v přední komoře) nebo i dříve, pokud pacient vyžaduje >2 kapky denně, či dochází ke zhoršování očního nálezu, nebo se vyvinou komplikace [24, 26, 27]. Je publikováno několik studií prokazujících efekt MTX u neinfekční uveitidy [34–36]. Nejčastěji se používá dávka 15 mg/m2 jednou týdně, maximum 20 mg perorálně nebo 25 mg v subkutánní injekci [35]. Průměrná doba k dosažení remise na léčbě MTX byla 4,3 měsíců s dobou trvání remise 10,3 měsíců. Ke zlepšení uveitidy na léčbě MTX došlo u 73 % pacientů [35]. Jako nejčastější nežádoucí účinky byly popsány gastrointestinální obtíže, nauzea, elevace jaterních parametrů (19,6 % pacientů) [34], přičemž profil a četnost vedlejších účinků se příliš neliší při perorální a subkutánní formě podávání [37]. Riziko katarakty bylo u pacientů na MTX nižší (29 %) než u pacientů, kteří nikdy nebyli léčeni MTX (64 %) [38]. Jedna ze studií se zabývala rizikem relapsu uveitidy po vysazení MTX. U 59 % pacientů s JIA a uveitidou léčených MTX mohla být léčba vysazena (při inaktivním nálezu průměrně 1,5 let) po celkové době léčby průměrně 3,1 let [39]. Faktory, které významně prodlužovaly délku remise, byly: trvání léčby déle než 3 roky, věk nad 8 let a doba inaktivity delší než 2 roky při ukončení terapie MTX.
Na základě těchto poznatků je součástí léčebných doporučení pokračovat v podávání MTX minimálně dalších 12 měsíců po dosažení inaktivity uveitidy, u pacientů s horší prognózou až 24 měsíců [26, 27]. Během léčby MTX je většinou podávána suplementace kyselinou listovou v jedné týdenní dávce 10 mg užívané den po podání MTX. Ačkoliv se objevily i práce, které zpochybňují dostatek evidence pro tuto suplementaci [40], přesto články z poslední doby stále podávání kyseliny listové doporučují z důvodu redukce toxicity a nevolnosti v souvislosti s podáváním MTX [41]. Zahájení léčby MTX by mělo předcházet laboratorní vyšetření jaterních parametrů a sérologie hepatitid. Laboratorní kontroly by pak měly následovat minimálně měsíc po zahájení léčby a poté v tříměsíčních intervalech při stabilním dávkování. V případě selhání nebo intolerance léčby MTX může být zvážena i léčba jinými csDMARDs, jako azathioprin nebo cyklosporin A, je však třeba počítat s tím, že jejich efekt na aktivitu artritidy je zpravidla minimální. Zůstávají tedy v současné době vyhrazeny většinou pro případy kontraindikace či nesnášenlivosti MTX a terapie TNFα inhibitory.
Z dalších imunosupresivních léků se v léčbě uveitidy používá mykofenolát mofetil (MMF), který je v současnosti považován i za přijatelnou alternativu biologické léčby v případech, kdy dominuje v klinickém obraze aktivita uveitidy nad aktivitou artritidy [27]. Leflunomid, který se někdy používá v léčbě artritidy u JIA, byl v jedné studii asociován s častější frekvencí relapsů uveitidy ve srovnání s MTX [42]. V některých těžších případech špatně odpovídajících na léčbu byla zkoušena i kombinace dvou imunosupresiv, jako MTX a MMF. Přidání dalšího imunosupresiva však již bylo spojeno s vysokým rizikem infekce ve srovnání s jen omezeným zvýšením účinku [43]. Současná doporučení tedy upřednostňují při zhoršení aktivity uveitidy nebo nedostatečném efektu MTX zahájení biologické léčby (když není dosaženo stupně 0–0,5 počtu buněk v přední komoře) po 3–4 měsících léčby MTX [24, 26, 27] s výjimkou situace, kdy je pacient bez aktivní artritidy, pak je možná alternativa v podobě podávání MMF [27].
Biologické chorobu modifikující protirevmatické léky (bDMARDs)
Indikací k zahájení biologické léčby je přetrvávající aktivita uveitidy, nebo výskyt nové zánětlivé komplikace na léčbě MTX, či jeho intolerance. Z biologických léků se používají pro léčbu uveitidy asociované s JIA především inhibitory TNFα, přičemž efekt monoklonálních protilátek je jednoznačně lepší než solubilního receptoru etanerceptu (tab. 3) [36].
Tab. 3. Seznam bDMARDs používaných v léčbě chronické přední uveitidy asociované s JIA. 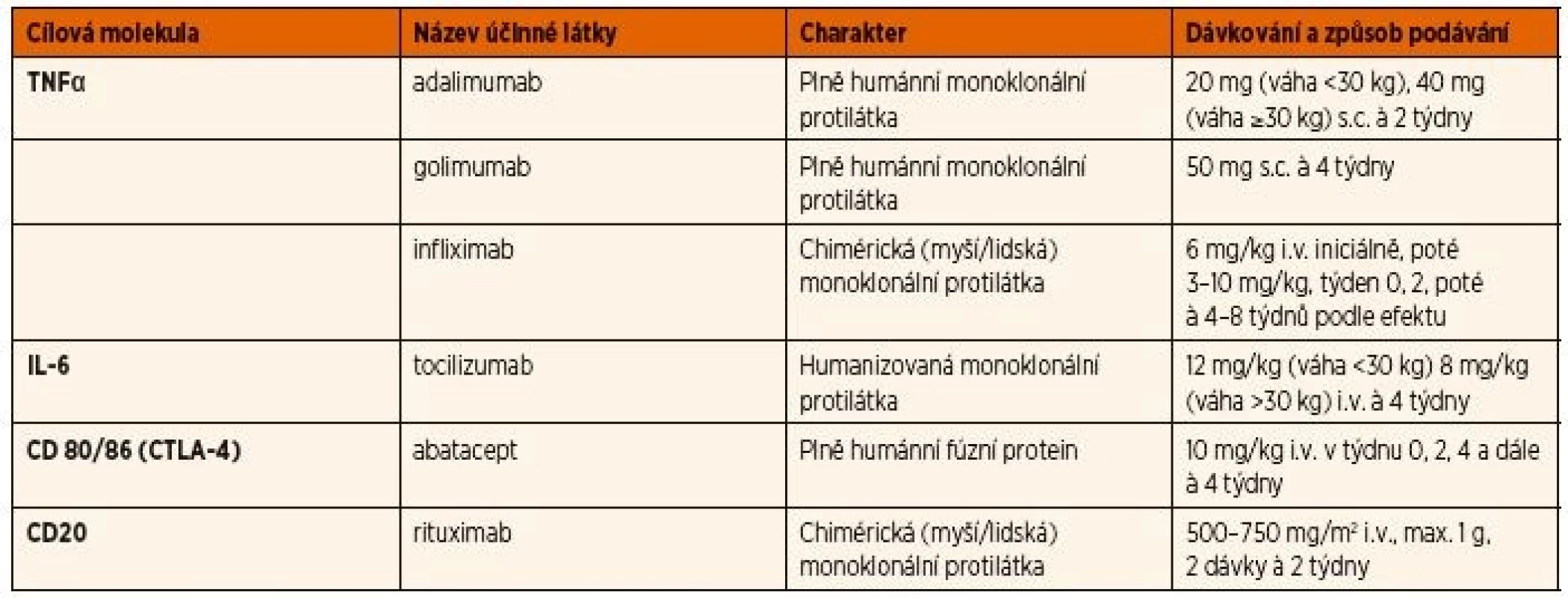
bDMARDs: biologické chorobu modifikující protirevmatické léky, CTLA-4: antigen 4 asociovaný s cytotoxickými T lymfocyty, IL: interleukin, i.v.: intravenózně, s.c.: subkutánně, TNF: tumor nekrotizující faktor Několik studií popsalo relapsy nebo manifestaci uveitidy během léčby etanerceptem [44–46]. Údaje z národních registrů podporují poznatek, že etanercept je spojen s vyšším rizikem uveitidy než adalimumab nebo infliximab [47, 48]. Dvojitě zaslepená randomizovaná studie s etanerceptem u 12 pacientů s JIA a uveitidou neprokázala rozdíl mezi lékem a placebem [49], a proto není etanercept doporučován jako lék volby pro uveitidu. V současné době se k léčbě JIA asociované uveitidy z biologických léků na prvním místě používá adalimumab, pro který máme nejvíce důkazů o účinnosti na základě randomizovaných studií [49–51]. Nejnovější publikovaná prospektivní studie SYCAMORE prokázala jednoznačně příznivý efekt adalimumabu v kombinaci s MTX na aktivitu uveitidy u pacientů s nedostatečným efektem MTX či intolerancí ve srovnání s pacienty na kombinaci MTX + placebo [50]. Zklidnění aktivity uveitidy a snížení dávek kortikoidů bylo dosaženo u ≥75 % pacientů s JIA po 4–12 týdnech léčby adalimumabem [50]. Podávání adalimumabu se doporučuje kombinovat s MTX z důvodu prevence imunogenicity, rizika tvorby neutralizačních protilátek, které mohou vést ke ztrátě efektu léčby, jak dokazují studie u dospělých pacientů s revmatoidní artritidou (RA) [52, 53]. Nejčastějším nežádoucím účinkem léčby adalimumabem byly infekce. Na Slovensku i v České republice byl adalimumab v roce 2017 registrován v indikaci chronické přední uveitidy u dětí po selhání léčby csDMARDs [50].
Při nedostatečném efektu či sekundárním selhání adalimumabu se jako alternativa doporučuje léčba jinými inhibitory TNFα – infliximab a golimumab [29]. Infliximab nemá však schválenou indikaci pro léčbu JIA ani uveitidy, zatímco golimumab nově získal v České republice registraci a úhradu pro léčbu polyartikulární JIA u dětí s hmotností nad 40 kg [24, 54, 55]. U pacientů s primárním nebo sekundárním selháním léčby inhibitory TNFα byl popsán příznivý efekt biologik s jiným mechanismem účinku, především tocilizumabu [56, 57]. Menší kazuistické práce popisují i dobrý účinek dalších bDMARDs, jako jsou abatacept [58] a rituximab [24, 59], zatím však neproběhly s těmito léky žádné rozsáhlejší studie. Tocilizumab i abatacept mají schválenou indikaci pro léčbu aktivní JIA s polyartikulárním postižením, jejich úloha v léčbě aktivní uveitidy však bude muset být ještě dále zkoumána. Doporučená délka udržovací terapie biologiky po dosažení inaktivity uveitidy je minimálně 12, resp. 24 měsíců, v případě nepříznivých prognostických faktorů [27, 29]. Riziko relapsů po vysazení terapie však bývá poměrně vysoké. Retrospektivní studie s 50 pacienty popisuje reaktivaci uveitidy během 12 měsíců po ukončení léčby adalimumabem (n = 45) a infliximabem (n = 5) u 63,8 % pacientů, kteří předtím dosáhli remise. Průměrná doba od vysazení biologika do relapsu byla 3,9 měsíce, přičemž délka remise uveitidy před vysazením inhibitoru TNFα nehrála roli. Průměrná doba od dosažení remise do vysazení léčby byla 1,7 roku [60].
Optimální strategie při ukončování terapie u pacientů v remisi je tedy stále předmětem diskuse a musí být definována na základě dalších studií a zkušeností. Zásadní je v tomto případě i mezioborová domluva mezi oftalmologem a revmatologem, a léčbu je třeba vysadit až při konsenzu obou odborností. Jak bylo uvedeno výše, chronická přední uveitida se může rozvinout někdy i řadu let před kloubní manifestací JIA. Vzhledem k asymptomatickému průběhu může dojít k nálezu uveitidy již v pokročilé fázi, mnohdy s rozvinutými komplikacemi. U těchto pacientů je indikována celková imunosuprese včetně biologické léčby na základě stejných kritérií, jako u dětí s přítomnými kloubními projevy onemocnění.
Chirurgické zákroky
Chirurgickou intervenci vyžadují především komplikace vyplývající z chronicky probíhající aktivní uveitidy nebo následky léčby, jako jsou katarakta a glaukom, event. zonulární keratopatie. Katarakta, která vede k poškození zraku, se řeší odstraněním čočky fakoemulzifikací [61]. Implantace nitrooční čočky u pacientů s uveitidou a JIA je stále kontroverzní. Lepší výsledky jsou popisovány u pacientů, u kterých byl oční zánět minimálně 3 měsíce před operací inaktivní [62, 63], proto je vhodná příprava pacienta podáváním topických a systémových kortikoidů pre-, peri - a postoperačně [27]. K pozitivním výsledkům přispívá i hydrofobní materiál nitrooční čočky a vyšší věk operovaného dítěte. Glaukom, který neodpovídá dostatečně na farmakologickou léčbu, se řeší chirurgickou intervencí, metodou volby jsou goniotomie, trabekulotomie s mitomycinem či ologenem, nebo využití drenážních implantátů [64–66]. Zonulární keratopatii je možné odstranit alespoň částečně chelací či laserovým ošetřením rohovky v celkové anestezii, často ale dochází k jejím recidivám.
PROGNÓZA
Chronická přední uveitida asociovaná s JIA může ohrozit pacienta komplikacemi s následkem ztráty zraku, ať už na podkladě vlastního očního zánětu, nebo v důsledku komplikací léčby. Důležitým prediktorem závažnosti uveitidy je krátký interval mezi vzplanutím artritidy a manifestací uveitidy [67]. Horší prognózu mají pacienti, u kterých jsou přítomny komplikace, například zadní synechie, již v době stanovení diagnózy uveitidy. Dalšími nepříznivými faktory jsou mladší věk v době manifestace uveitidy a mužské pohlaví [18], oboustranné postižení, delší doba trvání uveitidy, zvýšení NOT a anamnéza předchozího chirurgického zákroku na oku [67].
Jedním z klíčových parametrů hodnocení dlouhodobé prognózy je riziko poškození zraku. Porucha vizu může být přítomna již při prvním vyšetření pacienta, jak ukazuje studie popisující zrakovou ostrost ≤20/50 u 40,3 % a ≤ 20/200 u 24,2 % pacientů při manifestaci uveitidy [68]. Systematická analýza publikovaných dat ukazuje poruchu zraku (zraková ostrost <20/40 na obou očích dohromady) u 9,2 % pacientů s uveitidou [69]. V nedávno publikované holandské práci bylo ve věku 18 let pouze 8 % pacientů s JIA asociovanou uveitidou v remisi, 54 % pacientů mělo známky aktivní uveitidy, 73 % zůstávalo stále na imunomodulační terapii pro uveitidu a 4 % pacientů oslepla na obě oči v důsledku uveitidy či jejích komplikací [70]. Na druhou stranu je potřeba zdůraznit, že výskyt uveitidy a komplikací z ní vyplývajících v posledních letech významně poklesl. Prospektivní německá studie zahrnující 18 555 pacientů s JIA v letech 2002 až 2013 prokázala signifikantní pokles prevalence uveitidy z 13 na 11,6 % [11]. Došlo i k významnému poklesu komplikací uveitidy z 33,6 na 23,9 %. Ve stejné době vzrostl počet pacientů léčených syntetickými (z 39,8 na 47,2 %) a zejména biologickými (z 3,3 na 21,8 %) DMARDs. V současné době se intenzivně diskutuje otázka, zda časné zahájení efektivní protizánětlivé léčby pro JIA může snížit riziko rozvoje uveitidy. Data z německého registru obsahujícího přes 3500 pacientů s JIA dokumentují protektivní efekt časné léčby MTX v monoterapii nebo v kombinaci s inhibitorem TNFα [12].
ZÁVĚR
Uveitida asociovaná s JIA je nejčastější mimokloubní manifestací u dětí a počet pacientů s komplikacemi poškozujícími zrak zůstává stále vysoký. Základem pro včasnou diagnózu je spolupráce mezi dětským revmatologem a oftalmologem a pravidelná oftalmologická dispenzarizace diferencovaná podle rizika, většinou v intervalu 2 až 6 měsíců. Vzhledem k narůstající evidenci o účinnosti syntetických i biologických DMARDs v léčbě uveitidy asociované s JIA je součástí aktuálních léčebných doporučení časné zahájení systémové imunosupresivní léčby. Tento účinný terapeutický postup umožňuje kontrolu očního zánětu a předchází nežádoucím účinkům dlouhodobé terapie kortikoidy.
U pacientů, kteří nedostatečně odpovídají na léčbu MTX nebo ho netolerují, je vhodné zavést do terapie biologickou léčbu, především v podobě monoklonálních protilátek proti TNFα. Systematická dispenzarizace pacientů a jednoduchý odstupňovaný léčebný protokol založený na závažnosti uveitidy by měl pomoci sjednotit a zefektivnit péči o dětské pacienty s uveitidou a JIA a zajistit časnou diagnózu a adekvátní terapii.
Souhrnně:
- Uveitida je nejčastější extraartikulární manifestací JIA postihující až 30 % dětí v případě oligoartikulární formy, často bývá asymptomatická a může být i prvním projevem onemocnění.
- Diagnostika a léčba uveitidy asociované s JIA probíhá v úzké spolupráci oftalmologa a dětského revmatologa.
- Bezprostředně po stanovení diagnózy JIA musí být provedeno první screeningové oftalmologické vyšetření následované pravidelnou dispenzarizací v doporučených intervalech podle typu artritidy a věku pacienta. Aktivní uveitida vyžaduje léčbu lokálními kortikoidy, při trvající aktivitě methotrexátem. Při jeho selhání či intoleranci je vhodné nasazení monoklonální protilátky proti TNFα (nejčastěji adalimumabu).
- V případě nedostatečného efektu či intolerance adalimumabu je možno použít v léčbě jiné TNFα blokující protilátky, v případě primárního selhání adalimumabu je možno použít biologika s jiným mechanismem účinku, především tocilizumab.
- V případě aktivní uveitidy bez aktivní artritidy je alternativou k adalimumabu mykofenolát mofetil.
- Cílem léčby uveitidy je dosažení remise zánětlivé aktivity, předcházení recidivám a komplikacím ohrožujícím zrak za minimalizace nežádoucích účinků léčby.
Podpořeno MZ ČR – RVO, FN v Motole 00064203
MUDr. Hana Malcová, Ph.D.
Oddělení revmatologie dětí a dospělých
Fakultní nemocnice Motol
V Úvalu 84
150 06 Praha 5
e-mail: hana.malcova@fnmotol.cz
Zdroje
1. Holland GN, Stiehm ER. Special considerations in the evaluation and management of uveitis in children. J Ophthalmology 2003; 135 : 867–878.
2. Cuningham ET Jr. Uveitis in children. Ocul Immunol Inflamm 2000; 8 : 251–261.
3. Heiligenhaus A, Heinz C, Edelsten C, et al. Review of disease of the year: epidemiology of juvenile idiopathic arthritis and its associated uveitis: the probable risk factors. Ocul Immunol Inflamm 2013; 21 : 180–191.
4. Tugal-Tutkun I, Havrlikova K, Power WJ, Foster CS. Changing patterns of uveitis of childhood. Ophthalmology 1996; 103 : 375–383.
5. Oray M, Tugal-Tutkun I. Treatment of juvenile idiopathic arthritis-associated uveitis. Turk J Ophtalmol 2016; 46 : 77–82.
6. Hoeve M, Kalinina Ayuso V, Schalij-Delfos NE, et al. The clinical course of juvenile idiopathic arthritis-associated uveitis in childhood and puberty. Br J Ophthalmol 2012; 96 (6): 852–856.
7. Edelsten C, Reddy MA, Stanford MR, Graham EM. Visual loss associated with pediatric uveitis in english primary and referral centers. Am J Ophthalmol 2003; 135 (5): 676–680.
8. de Boer J, Wulffraat N, Rothova A. Visual loss in uveitis of childhood. Br J Ophthalmol 2003; 87 (7): 879–884.
9. BenEzra D, Cohen E, Maftzir G. Uveitis in children and adolescents. Br J Ophthalmol 2005; 89 (4): 444–448.
10. Kump LI, Cervantes-Castañeda RA, Androudi SN, Foster CS. Analysis of pediatric uveitis cases at a tertiary referral center. Ophthalmology 2005; 112 (7): 1287–1292.
11. Tappeiner C, Klotsche J, Schenck S, et al. Temporal change in prevalence and complications of uveitis associated with juvenile idiopathic arthritis:data from a cross-sectional analysis of a prospective nationwide study. Clin Exp Rheumatol 2015; 33 (6): 936–944.
12. Tappeiner C, Schenck S, Niewerth M, et al. Impact of anti-inflammatory treatment on the onset of uveitis in juvenile idiopathic arthritis: Longitudinal analysis from a nation-wide paediatric rheumatological database. Arthritis Care Res 2016; 68 (1): 46–54.
13. Heiligenhaus A, Minden K, Foll D, et al. Uveitis in juvenile idiopathic arthritis. Dtsch Arztebl Int 2015; 112 : 92–100.
14. Angeles-Han ST, Pelajo CF, Vogler LB, et al. Risk markers of juvenile idiopathic arthritis-associated uveitis in the Childhood Arthritis and Rheumatology Research Alliance (CARRA) Registry. J Rheumatol 2013; 40 (12): 2088–2096.
15. Moradi A, Amin RM, Thorne JE. The role of gender in juvenile idiopathic arthritis-associated uveitis. J Ophthalmol 2014; 2014 : 461078.
16. Saurenmann RK, Rose JB, Tyrrell P, et al. Epidemiology of juvenile idio-pathic arthritis in a multiethnic cohort: ethnicity as a risk factor. Arthritis Rheum 2007; 56 (6): 1974–1984.
17. Julián K, Terrada C, Quartier P, et al. Uveitis related to juvenile idiopathic arthritis: familial cases and possible genetic implication in the pathogenesis. Ocul Immunol Inflamm 2010; 18 (3): 172–177.
18. Heiligenhaus AI, Niewerth M, Ganser G, et al. Prevalence and complications of uveitis in juvenile idiopathic arthritis in a population-based nation-wide study in Germany: suggested modification of the current screening guidelines. Rheumatology 2007; 46 : 1015–1019.
19. Sen ES, Dick AD, Ramanan AV. Uveitis associated with juvenile idiopathic arthritis. Nat Rev Rheumatol 2015; 11 (6): 338–348.
20. Tappeiner C, Heinz C, Roesel M, Heiligenhaus A. Elevated laser flare values correlate with complicated course of anterior uveitis in patients with juvenile idiopathic arthritis. Acta Ophthalmol 2011; 89 (6): 521–527.
21. Deschenes J, Murray PI, Rao NA, Nussenblatt RB, International Uveitis Study Group. International Uveitis Study Group (IUSG): clinical classification of uveitis. Ocul Immunol Inflamm 2008; 16 (1): 1–2.
22. Jabs DA, Nussenblatt RB, Rosenbaum JT, Standardization of Uveitis Nomenclature (SUN) Working Group. Standardization of uveitis nomenclature for reporting clinical data. Results of the First International Workshop. Am J Ophthalmol 2005; 140 (3): 509–516.
23. British Society for Paediatric and Adolescent Rheumatology, Royal College of Ophthalmology. Guidelines for Screening for Uveitis in Juvenile Idiopathic Arthritis. 2006.
24. Bou R, Adan A, Borras F, et al. Clinical management algorithm of uveitis associated with juvenile idiopathic arthritis: interdisciplinary panel consensus. Rheumatol Int 2015; 35 (5): 777–785.
25. Heinz C, Schumacher C, Roesel M, Heiligenhaus A. Elevated intraocular pressure in uveitis associated with juvenile idiopathic arthritis-associated uveitis, often detected after achieving inactivity. Br J Ophthalmol 2012; 96 (1): 140–141.
26. Heiligenhaus A, Michels H, Schumacher C, et al. Evidence-based, interdisciplinary guidelines for anti-inflammatory treatment of uveitis associated with juvenile idiopathic arthritis. Rheumatol Int 2012; 32 (5): 1121–1133.
27. Clarke SLN, Sen ES, Ramanan AV. Juvenile idiopathic arthritis-associated uveitis. Pediatr Rheumatol 2016; 14 : 27.
28. Thorne JE, Woreta FA, Dunn JP, Jabs DA. Risk of cataract development among children with juvenile idiopathic arthritis-related uveitis treated with topical corticosteroids. Ophthalmology 2010; 117 (7): 1436–1441.
29. Heiligenhaus A, Tappeiner C, Walscheid K, et al. Uveitis associated with juvenile idiopathic arthritis: optimization of immunomodulatory therapy. Ophtalmologe 2016; 113 : 391–397.
30. Charkoudian LD, Ying GS, Pujari SS, et al. High-dose intravenous corticosteroids for ocular inflammatory diseases. Ocul Immunol Inflamm 2012; 20 (2): 91–99.
31. Ramanan AV, Dick AD. Blinded by lack of evidence. Rheumatology 2013; 52 (5):765–766.
32. Ferrante P, Ramsey A, Bunce C, Lightman S. Clinical trial to compare efficacy and side - effects of injection of posterior sub-tenon triamcinolone versus orbital floor methylprednisolone in the management of posterior uveitis. Clin Exp Ophtalmol 2004; 32 : 563–568.
33. The Multicenter Uveitis Steroid Treatment (MUST) Trial Research Group, Kempen JH, Altaweel MM, et al. Randomized comparison of systemic anti-inflammatory therapy versus fluocinolone acetonide implant for intermediate, posterior and panuveitis: The multicenter uveitis steroid treatment trial. Ophthalmology 2011; 118 (10): 1916–1926.
34. Simonini G, Paudyal P, Jones GT, et al. Current evidence of methotrexate efficacy in childhood chronic uveitis: a systematic review and meta-analysis approach. Rheumatology 2013; 52 (5): 825–831.
35. Foeldvari I, Wierk A. Methotrexate is an effective treatment for chronic uveitis associated with juvenile idiopathic arthritis. J Rheumatol 2005; 32 (2): 362–365.
36. Foeldvari I, Becker I, Horneff G. Uveitis events during Adalimumab, Etnercept, and Methotrexate therapy in juvenile idiopathic arthritis: data from the biologics in pediatric rheumatology registry. Arthritis Care Res 2015; 67 : 1529–1535.
37. Van Dijkhuizen EH, Pouw JN, Scheuern A, et al. Methotrexate intolerance in oral and subcutaneous administration in patients with juvenile idiopathic arthritis: a cross-sectional, observational study. Clin Exp Rheumatol 2016; 34 : 148–154.
38. Sijssens KM, Rothova A, Van De Vijver DA, et al. Risk factors for the development of cataract requiring surgery in uveitis associated with juvenile idiopathic arthritis. Am J Ophthalmol 2007; 144 (4): 574–579.
39. Kalinina Ayuso V, van de Winkel EL, Rothova A, de Boer JH. Relapse rate of uveitis post-methotrexate treatment in juvenile idiopathic arthritis. Am J Ophthalmol 2011; 151 (2): 217–222.
40. Amarilyo G, Rullo OJ, Mccurdy DK, et al. Folate usage in MTX-treated juvenile iiopathic arthritis (JIA) patients is inconsistent and highly variable. Rheumatology Int 2013; 33 : 2437–2440.
41. Falvey S, Shipman L, Ilowite N, Beukelman T. Methotrexate-induced nauzea in the treatment of juvenile idiopathic arthritis. Pediatr Rheumatol Online J 2017; 15 : 52.
42. Bichler J, Benseler SM, Krumrey-Langkammerer M, et al. Leflunomide is associated with a higher flare rate compared to methotrexate in the treatment of chronic uveitis in juvenile idiopathic arthritis. Scand J Rheumatol 2015; 44 (4): 280–283.
43. Little JA, Sen ES, Strike H, et al. The safety and efficacy of noncorticosteroid triple immunosuppressive therapy in the treatment of refractory chronic noninfectious uveitis in childhood. J Rheumatol 2014; 41 (1): 136–139.
44. Tynjälä P, Lindahl P, Honkanen V, et al. Infliximab and etanercept in the treatment of chronic uveitis associated with refractory juvenile idiopathic arthritis. Ann Rheum Dis 2007; 66 (4): 548–550.
45. Schmeling H, Horneff G. Etanercept and uveitis in patients with juvenile idiopathic arthritis. Rheumatology 2005; 44 (8): 1008–1011.
46. Saurenmann RK, Levin AV, Feldman BM, et al. Risk of new-onset uveitis in patients with juvenile idiopathic arthritis treated with anti-TNFalpha agents. J Pediatr 2006; 149 (6): 833–836.
47. Lim LL, Fraunfelder FW, Rosenbaum JT. Do tumor necrosis factor inhibitors cause uveitis? A registry-based study. Arthritis Rheum 2007; 56 (10): 3248–3252.
48. Verazza S, Davi S, Consolaro A, et al. Disease status, reasons for discontinuation and adverse events in 1038 Italian children with juvenile idiopathic arthritis treated with etanercept. Pediatr Rheumatol Online J 2016; 14 : 68.
49. Simonini G, Druce K, Cimaz R, et al. Current evidence of anti-tumor necrosis factor – treatment efficacy in childhood chronic uveitis: a systematic review and meta-analysis approach of individual drugs. Arthritis Care Res 2014; 66 (7): 1073–1084.
50. Ramanan AV, Dick AD, Jones AP, et al. Adalimumab plus Methotrexate for uveitis in juvenile idiopathic arthritis. N Engl J Med 2017; 376 : 1637–1646.
51. Zannin ME, Birolo C, Gerloni VM, et al. Safety and efficacy of infliximab and adalimumab for refractory uveitis in juvenile idiopathic arthritis: 1-year followup data from the Italian Registry. J Rheumatol 2013; 40 : 74–79.
52. Felis-Giemza A, Moots RJ. Measurement of anti-drug antibodies to biologic drugs. Rheumatology (Oxford) 2015; 54 : 1941–1943.
53. Krieckaert CL, Nurmohamed MT, Wolbink GJ. Methotrexate reduces immunogenicity in adalimumab treated rheumatoid arthritis patients in dose dependent manner. Ann Rheum Dis 2012; 71 : 1914–1915.
54. Borras-Basco J, Castera DE, Cortes X, et al. Effectiveness of infliximab, adalimumab and golimumab for non-infectious refraktory uveitis in adults. Int J Clin Pharmacol Ther 2015; 53 (5): 377–390.
55. Calvo-Rio V, Blanco R, Santo-Gomez M, et al. Golimumab in refractory uveitis related to spondyloarthritis. Multicenter study of 15 patients. Semin Arthritis Rheum 2016; 46 (1): 95–101.
56. Calvo-Rio V, Santos-Gomez M, Calvo I, et al. Anti-interleukin-6 receptor tocilizumab for severe juvenile idiopathic arthritis-associated uveitis refractory to anti-tumor necrosis factor therapy: A multicenter study of twenty-five patients. Arthritis Rheumatol 2017; 69 (3): 668–675.
57. Tappeiner C, Mesquida M, Adan A, et al. Evidence for tocilizumab as a treatment option in refractory uveitis associated with juvenile idiopathic arthritis. J Rheumatol 2016; 43 (12): 2183–2188.
58. Tappeiner C, Miserocchi E, Bodaghi B, et al. Abatacept in the treatment of severe, longstanding, and refractory uveitis associated with juvenile idiopathic arthritis. J Rheumatol 2015; 42 : 706–711.
59. Miserocchi E, Modorati G, Berchicci L, et al. Long-term treatment with rituximab in severe juvenile idiopathic arthritis-associated uveitis. Br J Ophtalmol 2016; 100 : 782–786.
60. Lerman MA, Lewen MD, Kempen JH, Mills MD. Uveitis reactivation in children treated with tumor necrosis factor alpha inhibitors. Am J Ophthalmol 2015; 160 (1): 193–200.
61. Angeles-Han S, Yeh S. Prevention and management of cataracts in children with juvenile idiopathic arthritis-associated uveitis. Curr Rheumatol Rep 2012; 14 (2): 142–149.
62. Quiñones K, Cervantes-Castañeda RA, Hynes AY, et al. Outcomes of cataract surgery in children with chronic uveitis. J Cataract Refract Surg 2009; 35 (4): 725–731.
63. Grajewski RS, Zurek-Imhoff B, Roesel M, et al. Favourable outcome after cataract surgery with IOL implantation in uveitis associated with juvenile idiopathic arthritis. Acta Ophthalmol 2012; 90 (7): 657–662.
64. Freedman SF, Rodriguez-Rosa RE, Rojas MC, Enyedi LB. Goniotomy for glaucoma secondary to chronic childhood uveitis. Am J Ophthalmol 2002; 133 (5): 617–621.
65. Kafkala C, Hynes A, Choi J, et al. Ahmed valve implantation for uncontrolled pediatric uveitic glaucoma. J AAPOS 2005; 9 (4): 336–340.
66. Bohnsack BL, Freedman SF. Surgical outcomes in childhood uveitic glaucoma. Am J Ophthalmol 2013; 155 (1): 134–142.
67. Zannin ME, Buscain I, Vittadello F, et al. Timing of uveitis onset in oligoarticular juvenile idiopathic arthritis (JIA) is the main predictor of severe course uveitis. Acta Ophthalmol 2012; 90 : 91–95.
68. Gregory AC, Kempen JH, Daniel E, et al. Risk factors for loss of visual acuity among patients with uveitis associated with juvenile idiopathic arthritis: the systemic immunosuppressive therapy for eye diseases study. Ophthalmology 2013; 120 (1): 186–192.
69. Carvounis PE, Herman DC, Cha S, Burke JP. Incidence and outcomes of uveitis in juvenile rheumatoid arthritis, a synthesis of the literature. Graefes Arch Clin Exp Ophthalmol 2006; 244 (3): 281–290.
70. Haasnoot AJ, Vernie LA, Rothova A, et al. Impact of juvenile idiopathic arthritis associated uveitis in early adulthood. PLoS ONE 2016; 11 (10): e0164312
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek EditorialČlánek Key note lecture
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2018 Číslo 4- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Editorial: Dětská revmatologie 21. století
- Uveitida asociovaná s juvenilní idiopatickou artritidou
- Idiopatické zápalové myopatie u detí v Čechách a na Slovensku
- Péče o pacienty s autoinflamatorními onemocněními: Česko-slovenská adaptace překladu evropských doporučení SHARE*
- Před 110 lety se narodil vynikající pediatr prof. MUDr. Antonín Mores
- Editorial
- Key note lecture
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Uveitida asociovaná s juvenilní idiopatickou artritidou
- Idiopatické zápalové myopatie u detí v Čechách a na Slovensku
- Péče o pacienty s autoinflamatorními onemocněními: Česko-slovenská adaptace překladu evropských doporučení SHARE*
- Před 110 lety se narodil vynikající pediatr prof. MUDr. Antonín Mores
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



