-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
How and when to perform pulmonary function testing in infants
This article deals with practical aspects of infant pulmonary function testing (iPFT). In its first part we discuss methods of iPFT including information on the preparation of patients for testing, its course and way of procedural sedation. The second part of the article summarises indications and contraindications of iPFT. We present clinical applications and significance of iPFT in four distinct diseases (cystic fibrosis, bronchial asthma/recurrent wheeze, interstitial lung disease of infancy and bronchopulmonary dysplasia).
Keywords:
Cystic fibrosis – Infants – bronchopulmonary dysplasia – infant pulmonary function testing (iPFT) – lung function testing – recurrent wheeze – interstitial lung disease in infants – chronic lung disease of immaturity/infancy
Autori: V. Koucky 1,2; J. Šulc 3,4; D. Megvinet-Chucesov 1; P. Pohunek 1
Pôsobisko autorov: Pediatrická klinika 2. LF UK a FN Motol, Praha 1; Olivova dětská léčebna, o. p. s., Říčany 2; První plicní ambulance, s. r. o., Praha 3; Centrum pohybové medicíny Pavla Koláře, a. s., Praha 4
Vyšlo v časopise: Čes-slov Pediat 2020; 75 (7): 410-415.
Kategória:
Súhrn
Předkládaný článek pojednává o praktických aspektech vyšetření funkce plic nespolupracujících dětí (iPFT). V první části se věnuje metodice vyšetření iPFT, jsou uvedeny základní informace o přípravě dítěte na vyšetření a jeho průběhu. Diskutovány jsou i způsoby procedurální sedace využívané pro iPFT. Druhá část článku se zabývá obecnými indikacemi a kontraindikacemi vyšetření. U čtyř modelových onemocnění (cystická fibróza, asthma bronchiale/opakované obstrukční epizody, intersticiální plicní onemocnění kojeneckého věku a bronchopulmonální dysplazie) je probrán význam vyšetření pro běžnou klinickou praxi.
Klíčová slova:
vyšetření funkce plic nespolupracujících dětí (iPFT) – kojenci – funkční vyšetření plic – cystická fibróza – opakované obstrukční epizody – intersticiální plicní proces kojeneckého věku – bronchopulmonální dysplazie – chronické plicní onemocnění z nezralosti
ÚVOD
Vyšetření funkce plic (PFT = pulmonary function testing) patří mezi základní neinvazivní diagnostické nástroje v dětské pneumologii. Lze ho použít i pro dlouhodobé sledování pacientů s chronickým plicním postižením, event. i pro posudkové účely. Standardně je toto vyšetření k dispozici pro děti ve věku od 4–6 let, které jsou schopny dobré spolupráce a provedení specifických dechových manévrů. Nicméně již řadu let neplatí představa mnohých pneumologů, že funkci plic lze vyšetřit jen u dobře spolupracujícího dítěte. Od počátku tohoto tisíciletí jsou v České republice k dispozici přístrojové metody, které umožňují vyšetřit i nespolupracující děti během klidového dýchání ve spánku. Metody vyšetření funkce plic nespolupracujících dětí (iPFT = infant pulmonary function testing) jsou od roku 2005 dostupné na 2 pracovištích v ČR (v plném spektru na Pediatrické klinice 2. LF UK a FN Motol a v užším spektru i na Klinice pediatrie a dědičných poruch metabolismu Všeobecné fakultní nemocnice v Praze) a v jasně definovaných případech mohou poskytnout důležité informace pro diagnostiku i léčbu řady respiračních onemocnění malých dětí.
Cílem tohoto přehledového článku je poskytnout stručnou informaci o metodice vyšetření se zaměřením na praktické informace pro indikující lékaře a rodiče a dále pak shrnout informace o indikacích tohoto vyšetření a jeho přínosu pro klinickou praxi. Vzhledem ke klinicky prokázaným interakcím mezi respiračním systémem a dalšími orgánovými systémy (kardiovaskulárním, gastrointestinálním, pohybovým atd.) mají údaje získané pomocí iPFT význam i pro jiné medicínské specializace než pouze pneumologie.
METODIKA iPFT
Vyšetření funkce plic nespolupracujících dětí je prováděno ve spánku, buď přirozeném nebo arteficiálně navozeném. Přirozený spánek využíváme téměř výhradně u novorozenců; u starších dětí probíhá naprostá většina vyšetření v sedaci. V ČR je standardně používán chloralhydrát aplikovaný p.r. nebo p.o., event. v kombinaci s midazolamem. Chloralhydrát patří mezi bezpečná sedativa. Od roku 1894 je používán u dětských pacientů a popisováno je jen malé množství nežádoucích účinků (zvracení, iritace gastrointestinálního traktu, paradoxní reakce, kožní reakce, přechodné desaturace, dysrytmie atd.). Americká pediatrická akademie stále považuje chloralhydrát za akceptovatelnou volbu pro krátkodobou procedurální sedaci (např. různá zobrazovací vyšetření, echokardiografie, iPFT a další), nicméně v posledních 10 letech jsou diskutována i novější sedativa (dexmedetomidin, propofol a další) [1, 2]. Zásadním problémem v případě užití těchto novějších sedativ je skutečnost, že jejich vliv na dechové centrum a potenciál pro zkreslení výsledků iPFT nebyl dostatečně studován. V mezinárodních doporučeních pro metodiku iPFT je proto stále uváděn chloralhydrát (či triclofos) jako sedativum volby. Jeho použití podporují i zkušenosti z našeho centra, kdy v průběhu 126 vyšetření provedených u 95 pacientů v období mezi únorem 2014 a únorem 2019 bylo zaznamenáno pouze 5 epizod desaturace; epizody bradykardie, hypoventilace či apnoická pauza nebyly v našem souboru zaznamenány [3].
Navození sedace představuje časově nejnáročnější část vyšetření iPFT. V průměru je třeba počítat s 30–45 minutami potřebnými k navození kvalitního spánku. Zhruba ve 12 % se sedaci nepodaří navodit ani při maximálních dávkách sedativ [3]. Po dosažení dostatečně klidného spánku trvá vlastní vyšetření dalších 30 minut v závislosti na rozsahu vyšetření (počet metod, provedení bronchomotorického testu atd.). Následně je pacient zhruba 30 minut observován (monitorace pulzu, saturace, event. i ventilace), aby mohl být propuštěn do domácí péče. U pacientů s nezávažnou anamnézou lze tedy vyšetření provádět ambulantně. Jako příprava na vyšetření je pacientům doporučeno lačnění alespoň 1–2 hod před vyšetřením – z důvodu určitého rizika aspirace při provedení metody rychlé thorakoabdominální komprese (viz dále). Vhodné je též podání glycerinového čípku k vyprázdnění konečníku a lepší toleranci chloralhydrátu p.r.
Vyšetření iPFT umožňuje hodnotit řadu aspektů ventilační funkce plic. Standardně zahrnuje vyšetřovací protokol 5 metod:
- test vícedechového vyplavování inertního plynu z plic (MBW),
- bodypletysmografii (BP),
- analýzu klidového dechového vzoru (Tidal),
- měření pružných vlastností dýchacího traktu (RC) a
- měření usilovných výdechových průtoků (rychlá thorakoabdominální komprese) – RTC,
které hodnotí různé parametry – např. objemové charakteristiky plic, pružné vlastnosti dýchacího traktu (poddajnost a odpor), charakteristiky průchodnosti dýchacích cest na různých úrovních bronchiálního stromu atd. (tab. 1). Pomocí těchto metod lze provádět i různé bronchomotorické testy (např. bronchodilatační test s beta-2-agonistou či bronchoprovokační test s hypertonickým roztokem NaCl).
Tab. 1. Přehled parametrů funkce plic z různých metod iPFT. 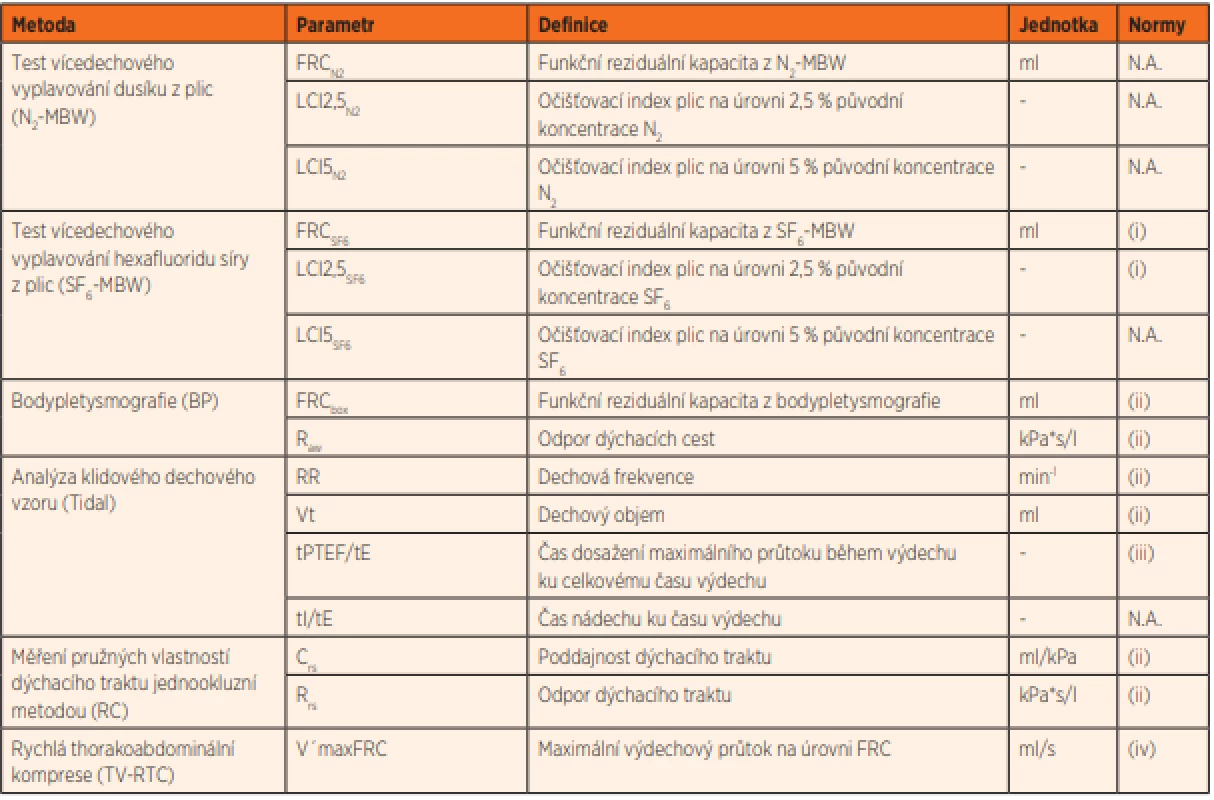
N.A. – normy pro kojenecký věk nedostupné
(i) Lum S, Stocks J, Stanojevic S, et al. Age and height dependence of lung clearance index and functional residual capacity. Eur Respir J 2013 Jun; 41 (6): 1371–1377.
(ii) Nguyen TT, Hoo AF, Lum S, et al. New reference equations to improve interpretation of infant lung function. Pediatr Pulmonol 2013 Apr; 48 (4): 370–380.
(iii) Godfrey S, Springer C, Bar-Yishay E. Evaluating the lung function of infants. Isr Med Assoc J 2009 Aug; 11 (8): 492–497.
(iv) Hoo AF, Dezateux C, Hanrahan JP, et al. Sex-specific prediction equations for Vmax(FRC) in infancy: a multicenter collaborative study. Am J Respir Crit Care Med 2002 Apr 15; 165 (8): 1084–1092.Způsob provedení jednotlivých metod iPFT se řídí mezinárodními doporučeními [např. 4–8]. Přesné dodržení metodiky vyšetření je nezbytné nejen pro dostatečnou reprodukovatelnost a validitu výsledků, ale i pro možnost využití publikovaných referenčních norem, ke kterým jsou získané výsledky vztahovány. Je totiž známo, že technické aspekty měření významným způsobem ovlivňují absolutní hodnoty měřených parametrů, a proto se musí metodika měření shodovat s metodikou použitou při stanovení referenčních hodnot. Technické detaily provedení jednotlivých metod jsou mimo rámec tohoto článku, v české literatuře jsou k dispozici např. v pracích dr. Šulce [9–12] nebo autora [3]. Detailněji se jim tedy věnovat nebudeme.
INDIKACE iPFT
Obdobně jako vyšetření funkce plic spolupracujících dětí (spirometrie, bodypletysmografie atd.) má i iPFT řadu indikací. Z obecného hlediska je můžeme rozdělit do následujících skupin:
- diferenciální diagnostika nejasných respiračních příznaků (perzistující tachypnoe a dyspnoe, chronický kašel, nejasné stavy dušnosti, opakované obstrukční epizody);
- stanovení tíže postižení dýchacího traktu a míry funkčního omezení – význam pro rozhodnutí o intenzitě léčby;
- dlouhodobé sledování pacientů s chronickým onemocněním (cystická fibróza, bronchopulmonální dysplazie, vrozené vývojové vady – brániční kýla, hypoplazie plic, srdeční vady apod.);
- výzkumné účely – výstupní parametr v epidemiologických studiích, hodnocení růstu, vývoje a fyziologie plic v nejútlejším věku atd.
Vzhledem k technické náročnosti a omezené dostupnosti tohoto vyšetření je třeba podotknout, že na rozdíl od klasických metod (spirometrie) se v případě iPFT jedná o vyšetření druhé linie, které provádíme v situaci, kdy nebyla přínosná základní vyšetření jako rtg hrudníku, echokardiografie atd. Dále je třeba zdůraznit relativně nízkou specificitu iPFT – tzn. spíše než stanovit přesnou diagnózu nám pomohou stanovit okruh onemocnění, ve kterém je třeba dále pátrat (např. restrikční vzor postižení plicních funkcí směřuje k diagnóze intersticiálního plicního procesu, naopak obstrukční nález může svědčit pro obliterující bronchiolitidu, neuroendokrinní celulární hyperplazii kojenců (NEHI), bronchopulmonální dysplazii (BDP), cystickou fibrózu apod.).
Hlavní kontraindikace vyšetření iPFT byly shrnuty v doporučení Americké asociace pro respirační péči (AARC) [13]. Mezi hlavní absolutní kontraindikace patří:
- aktivní plicní krvácení, nezhojená hrudní rána, tenzní pneumothorax;
- netolerance sedace či anamnéza nežádoucí reakce v souvislosti s ní;
- hemodynamicky významná srdeční vada;
- významná faciální deformita znemožňující nasazení masky či významná obstrukce horních cest dýchacích;
- neodpovídající velikost dítěte (v případě bodypletysmografie – délka do cca 90 cm a hmotnost do 13 kg).
Relativní kontraindikace zahrnují:
- akutní či doznívající infekce (zejména dýchacího traktu), k eliminaci vlivů respirační infekce na výsledky iPFT je doporučována 14denní rekonvalescence;
- těžký gastroezofageální reflux;
- riziko či přítomnost hypoventilace, pre-existující deprese centrálního nervového systému.
Využití iPFT v běžné praxi omezuje i řada dalších okolností. V dotazníkové studii provedené v roce 2010 v rámci Evropské respirační společnosti [14] udávali respondenti řadu omezení (shrnuta v grafu 1). Význam některých z nich v souvislosti s pokračujícím výzkumem klesá (např. nedostatek referenčních dat a nedostatek longitudinálních vývojových dat), a proto klinická využitelnost iPFT narůstá. Z dat uvedených v grafu 1 vyplývá, že za hlavní limitaci iPFT je považována nutnost sedace během provedení iPFT; dlužno připomenout, že sedace je v kojeneckém a batolecím věku používána i u jiných vyšetřovacích metod (echokardiografie, výpočetní tomografie plic atd.).
Graf 1. Hlavní limitace klinického využití iPFT (podle [14]). ![Hlavní limitace klinického využití iPFT (podle [14]).](https://pl-master.mdcdn.cz/media/image_pdf/ed01cdb400a1585626db7041986d3dcf.jpeg?version=1606482063)
PŘÍKLADY VYUŽITÍ iPFT V BĚŽNÉ PRAXI
V následujícím textu uvedeme několik diagnóz, u nichž je vyšetření iPFT v České republice prováděno na základě klinické indikace a má dosah do běžné praxe.
Cystická fibróza
Kojenci s cystickou fibrózou (CF) představují v současné době nejčastěji vyšetřovanou skupinu pacientů. Ročně je v ČR především na základě novorozeneckého screeningu diagnostikováno cca 15 kojenců s CF. Většina z nich podstoupí v rámci edukačního pobytu či následujících kontrol na Pediatrické klinice 2. LF UK a FN Motol vyšetření iPFT. Na základě dosud publikovaných studií se jako nejvýznamnější metody jeví test vícedechového vyplavování inertního plynu z plic a metoda thorakoabdominální komprese [15]. Pomocí iPFT lze detekovat poruchu funkce plic již v nejútlejším věku (kolem 3 měsíců věku), někteří kojenci do té doby neprodělali žádnou respirační exacerbaci, resp. byli zcela bez respiračních příznaků [16, 17]. Otázka dalšího vývoje funkce plic během prvních let života zůstává zatím nezodpovězena. Data londýnské a australské skupiny autorů jsou poněkud v rozporu, kdy londýnští autoři popisují trend k normalizaci funkce plic během prvních dvou let života [18], zatímco australští autoři zdokumentovali progresi plicního postižení [17].
V našem souboru 55 vyšetřených kojenců s CF jsme detekovali poruchu funkce plic u 41,7 % pacientů ve věku do 6 měsíců, u pacientů starších 6 měsíců to bylo v 75 %. Lze tedy usuzovat na určitou progresi plicního postižení v kojeneckém věku navzdory zavedené standardní léčbě. Naopak u podskupiny našich 12 pacientů, kteří byli považováni za vysoce rizikové a byli intenzivně léčeni (i.v. antibiotika, diagnosticko-terapeutická bronchoskopie, inhalace DNázy…) jsme opakovanými vyšetřeními prokázali zlepšení některých parametrů funkce plic [19]. Toto nepřímo dokládá efektivitu současných léčebných intervencí. Zároveň tato zjištění dokládají klinický význam iPFT u pacientů s CF.
Asthma bronchiale/opakované obstrukční epizody
Opakované obstrukční epizody s vazbou nebo bez vazby na respirační infekci představují častý problém batolecího věku. Někteří pacienti jsou však symptomatičtí již od kojeneckého věku. Pouze menší část z nich vyvine v pozdějším věku klasický obraz bronchiálního astmatu s typickou bronchiální hyperreaktivitou. Pro identifikaci pacientů v riziku pozdějšího rozvoje asthma bronchiale byly vytvořeny různé prediktivní nástroje – např. klinický index rizika podle Castro-Rodríqueze [20]. Úloha samotného iPFT v predikci rizikových pacientů zatím není plně objasněna. V současné době je známo, že pacienti s opakovanými obstrukčními epizodami mají horší funkci plic – periferní obstrukci podle metody RTC [21, 22] a vyšší nehomogenitu ventilace podle MBW [23]. Informace o pozdějším vývoji funkce plic a rozvoji asthma bronchiale u těchto pacientů jsou zatím omezené [21].
Naše předběžná data od 28 kojenců s opakovanými obstrukčními epizodami sledovanými do věku 3 let ukazují, že senzitivita a specificita zvýšené nehomogenity ventilace v kojeneckém věku (definováno jako očišťovací index plic z metody MBW vyšší než 10,0) pro potřebu medikace inhalačními kortikosteroidy ve věku 3 let je obdobná jako v případě klinického indexu rizika podle Castro-Rodríqueze [24]. To naznačuje, že neinvazivní metody iPFT mohou představovat účinný nástroj pro identifikaci pacientů v riziku časného rozvoje asthma bronchiale.
Intersticiální plicní onemocnění (chILD) kojenců
Intersticiální plicní onemocnění kojeneckého věku patří mezi vzácná onemocnění vyskytující se s frekvencí přibližně 1 : 100 000. Jejich diagnostika je náročná, v řadě případů opožděná a vyžaduje zvláštní diagnostické nástroje (např. výpočetní tomografie plic s vysokým rozlišením – HRCT, bronchoskopie, plicní biopsie). Úloha iPFT v rámci diagnostického algoritmu kojeneckých chILD není tak jednoznačná jako úloha spirometrie a dalších funkčních vyšetření v případě chILD starších dětí. Nicméně v doporučeních Americké hrudní společnosti [25] jsou metody iPFT uváděny jako jeden z diagnostických nástrojů.
Na základě malých souborů pacientů a kazuistických sdělení máme informace o typických vzorech postižení funkce plic u různých typů chILD. Ventilační porucha restrikčního charakteru se typicky vyskytuje u dětí s plicní intersticiální glykogenózou (PIG), defektem surfaktantového proteinu C (histologicky chronická pneumonitis kojenců) a histiocytózou z Langerhansových buněk s plicním postižením (u malé části těchto pacientů může být přítomna i obstrukce). Naopak s obstrukční ventilační poruchou a hyperinflací plic se setkáváme u kojenců s obliterující bronchiolitidou (nejčastěji postinfekční) a hyperplazií neuroendokrinních buněk (NEHI). Právě v případě NEHI je ventilační porucha natolik významná, že v kombinaci s typickým klinickým a HRCT obrazem lze tuto diagnózu stanovit bez nutnosti plicní biopsie (pak hovoříme o NEHI syndromu). V případě NEHI jsou k dispozici i longitudinální data, která ukazují, že iPFT mohou predikovat pozdější funkci plic (včetně spirometrie v předškolním a školním věku) [26]. Význam klinického využití jednotlivých metod funkční plicní diagnostiky u pacientů s různými typy chILD shrnuje nedávno sepsaný přehledový článek [27].
Bronchopulmonální dysplazie a prematurita
Snížená funkce plic oproti zdravým kontrolám byla prokázána jak u pacientů předčasně narozených [28], tak i u kojenců s bronchopulmonální dysplazií (BPD). U pacientů s BPD byla zjištěna obstrukce dýchacích cest (snížené usilovné exspirační průtoky) a hyperinflace plic. U 35 % z nich byla přítomna i signifikantní odpověď na albuterol [29]. Tyto defekty funkce plic měly tendenci perzistovat v prvních 3 letech života [30]. Míra plicního postižení nesporně závisí na dosaženém vývojovém stupni (prenatální stáří plicní tkáně), ve kterém došlo k funkčnímu zapojení respiračního systému. Toto je velmi pravděpodobně důvodem pro značnou diferencovanost abnormálního obrazu funkce plic [31]. Klinická relevance iPFT u pacientů s BPD však zůstává nejistá.
Bylo zjištěno, že parametry klidového dechového vzoru (Tidal) predikují morbiditu v průběhu následujícího roku (obstrukční epizody) [32], avšak jejich prediktivní potenciál je srovnatelný s jinými klinickými nástroji (např. „Clinical risk index for babies“ [33] a „ATS Jobe-Bancalari BPD severity classification“ [34]). Schopnost iPFT rozlišit mezi nedonošenými pacienty ty, kteří BPD mají, resp. vyvinou chronickou plicní nemoc z nezralosti (CLDI – chronic lung disease of infancy/immaturity), též nebyla prokázána. Dlouhodobější data o vývoji zdravotního stavu v souvislosti s nálezem iPFT v útlém věku chybí, lze se však domnívat, že určitý fenomén „směřování plicních funkcí“ [35–37] přítomen bude i v tomto případě.
ZÁVĚR
Metody iPFT v současné době představují neinvazivní, bezpečné, technicky standardizované a dobře proveditelné vyšetření, které může přispět k diagnostickému procesu řady chronických respiračních onemocnění kojeneckého věku. Jeho využitelnost je omezena technickou náročností metodiky a menší dostupností, nicméně doklady o jeho klinickém významu stále narůstají. Očekáváme též detailnější informace o jeho prediktivním potenciálu pro pozdější zdravotní stav pacienta.
Poděkování
Autoři děkují sestrám Jarmile Věcovské a Petře Vančurové za asistenci při vyšetření iPFT, dále děkujeme MUDr. Janu Zikánovi za sedaci pacientů.
Práce je součástí řešení projektu COST Action CA16125 – European Network for Translational Research in Children‘s and Adult Interstitial Lung Disease.
Práce byla podpořena Ministerstvem zdravotnictví České republiky (koncepční rozvoj výzkumné organizace, Fakultní nemocnice v Motole; grant 00064203).
Práce byla podpořena z prostředků grantu GAUK č. 750120.
MUDr. Václav Koucký, Ph.D.
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: vaclav.koucky@fnmotol.cz
Zdroje
1. Sulton C, McCracken C, Simon HK, et al. Pediatric procedural sedation using dexmedetomidine: A report from the Pediatric Sedation Research Consortium. Hosp Pediatr 2016; 6 (9): 536–544.
2. McMorrow SP, Abramo TJ. Dexmedetomidine sedation: uses in pediatric procedural sedation outside the operating room. Pediatr Emerg Care 2012; 28 (3): 292–296.
3. Koucký V. Detekce časných patofyziologických změn dýchání u dětí s chronickým respiračním onemocněním. Dizertační práce. Praha: Univerzita Karlova, 2. lékařská fakulta, Pediatrická klinika 2. LF UK a FN Motol, 2020 : 1–132.
4. Hulskamp G, Pillow JJ, Dinger J, et al. Lung function tests in neonates and infants with chronic lung disease of infancy: functional residual capacity. Pediatr Pulmonol 2006; 41 (1): 1–22.
5. Gappa M, Pillow JJ, Allen J, et al. Lung function tests in neonates and infants with chronic lung disease: lung and chest-wall mechanics. Pediatr Pulmonol 2006; 41 (4): 291–317.
6. Baldwin DN, Pillow JJ, Stocks J, et al. Lung-function tests in neonates and infants with chronic lung disease: tidal breathing and respiratory control. Pediatr Pulmonol 2006; 41 (5): 391–419.
7. Lum S, Hülskamp G, Merkus P, et al. Lung function tests in neonates and infants with chronic lung disease: forced expiratory maneuvers. Pediatr Pulmonol 2006; 41 (3): 199–214.
8. Pillow JJ, Frerichs I, Stocks J. Lung function tests in neonates and infants with chronic lung disease: global and regional ventilation inhomogeneity. Pediatr Pulmonol 2006; 41 (2): 105–121.
9. Šulc J. Vyšetření funkce plic u nespolupracujících pacientů. Čs Pediat 1994; 49 : 228–232.
10. Šulc J, Zikán J, Kredba V, et al. Funkční vyšetření plic u nespolupracujících dětí. Část I. Kazuistiky v alergologii, pneumologii a ORL 2011; 8 (1): 26–34.
11. Šulc J, Zikán J, Kredba V, et al. Funkční vyšetření plic u nespolupracujících dětí. Část II. Kazuistiky v alergologii, pneumologii a ORL 2011; 8 (2): 17–25.
12. Šulc J, Zikán J, Kredba V, et al. Funkční vyšetření plic u nespolupracujících dětí. Část III. Kazuistiky v alergologii, pneumologii a ORL 2011; 9 (1): 4–15.
13. AARC Clinical Practice Guideline, Infant/Toddler Pulmonary Function Tests, 1995, update 2008. Respir Care 1995 40 (7): 761–768.
14. Peterson-Carmichael SL, Rosenfeld M, Ascher SB, et al. Survey of clinical infant lung function testing practices. Pediatr Pulmonol 2014; 49 (2): 126–131.
15. Lum S, Gustafsson P, Ljungberg H, et al.; London Cystic Fibrosis Collaboration. Early detection of cystic fibrosis lung disease: multiple-breath washout versus raised volume tests. Thorax 2007; 62 (4): 341–347.
16. Nguyen TT, Thia LP, Hoo AF, et al.; London Cystic Fibrosis Collaboration (LCFC). Evolution of lung function during the first year of life in newborn screened cystic fibrosis infants. Thorax 2014; 69 (10): 910–917.
17. Pillarisetti N, Williamson E, Linnane B, et al.; Australian Respiratory Early Surveillance Team for Cystic Fibrosis (AREST CF). Infection, inflammation, and lung function decline in infants with cystic fibrosis. Am J Respir Crit Care Med 2011; 184 (1): 75–81.
18. Davies G, Stocks J, Thia LP, et al.; London Cystic Fibrosis Collaboration (LCFC). Pulmonary function deficits in newborn screened infants with cystic fibrosis managed with standard UK care are mild and transient. Eur Respir J 2017; 50 (5): 1700326.
19. Koucký V, Skalická V, Bartošová J, et al. Funkce plic souboru českých kojenců a batolat s cystickou fibrózou. Čes-slov Pediat 2019; 74 (7): 392–400.
20. Castro-Rodríguez JA, Holberg CJ, Wright AL, et al. A clinical index to define risk of asthma in young children with rec urrent wheezing. Am J Respir Crit Care Med 2000; 162 (4 Pt 1): 1403–1406.
21. Borrego LM, Stocks J, Leiria-Pinto P, et al. Lung function and clinical risk factors for asthma in infants and young children with recurrent wheeze. Thorax 2009; 64 : 203–209.
22. Keklikian E, Sanchez-Solis M, Bonina AJ, et al. Do risk factors for persistent asthma modify lung function in infants and young children with recurrent wheeze? Pediatr Pulmonol 2010; 45 (9): 914–918.
23. Lu Z, Foong RE, Kowalik K, et al. Ventilation inhomogeneity in infants with recurrent wheezing. Thorax 2018; 73 (10): 936–941.
24. Koucky V, Rihova R, Pohunek P. Predictive value of nitrogen multiple breath washout in wheezy infants: a prospective pilot study. Abstract for CIPP 2020.
25. Kurland G, Deterding RR, Hagood JS, et al.; American Thoracic Society Committee on Childhood Interstitial Lung Disease (chILD) and the child Research Network. An official American Thoracic Society clinical practice guideline: classification, evaluation, and management of childhood interstitial lung disease in infancy. Am J Respir Crit Care Med 2013; 188 (3): 376–394.
26. Lukkarinen H, Pelkonen A, Lohi J, et al. Neuroendocrine cell hyperplasia of infancy: a prospective follow-up of nine children. Arch Dis Child 2013; 98 (2): 141–144.
27. Ring A, Carlens J, Bush A, et al. Pulmonary function testing in children’s interstitial lung disease (chILD). Eur Respir Rev 2020 Sep 21; 29 (157).
28. Friedrich L, Stein RT, Pitrez PM, et al. Reduced lung function in healthy preterm infants in the first months of life. Am J Respir Crit Care Med 2006; 173 : 442–447.
29. Robin B, Kim YJ, Huth J, et al. Pulmonary function in bronchopulmonary dysplasia. Pediatr Pulmonol 2004; 37 : 236–242.
30. Filbrun AG, Popova AP, Linn MJ, et al. Longitudinal measures of lung function in infants with bronchopulmonary dysplasia. Pediatr Pulmonol 2011; 46 (4): 369–375.
31. Šulc J, et al. Funkce plic u batolat s chronickou plicní nemocí (BPD etiologicky pocházející z perinatálního období). Stud Pneumol Phtiseol 2011; 71 (6): 238–245.
32. Proietti E, Riedel T, Fuchs O, et al. Can infant lung function predict respiratory morbidity during the first year of life in preterm infants? Eur Respir J 2014; 43 (6): 1642–1651.
33. The International Neonatal Network. The CRIB (clinical risk index for babies) score: a tool for assessing initial neonatal risk and comparing performance of neonatal intensive care units. Lancet 1993; 24; 342 (8865): 193–198.
34. Ehrenkranz RA, Walsh MC, Vohr BR, et al. Validation of the National Institutes of Health consensus definition of bronchopulmonary dysplasia. Pediatrics 2005; 116 : 1353–1360.
35. Martin TR, Feldman HA, Fredberg JJ, et al. Relationship between maximal expiratory flows and lung volumes in growing humans. J Appl Physiol (1985) 1988; 65 (2): 822–828.
36. McGeachie MJ, Yates KP, Zhou X, et al. Patterns of growth and decline in lung function in persistent childhood asthma. N Engl J Med 2016; 12; 374 (19): 1842–1852.
37. Berry CE, Billheimer D, Jenkins IC, et al. A distinct low lung function trajectory from childhood to the fourth decade of life. Am J Respir Crit Care Med 2016; 194 (5): 607–612.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2020 Číslo 7- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Dětská pneumologie v Česku a na Slovensku
- Dlouhodobé dopady předčasného porodu na respirační systém u dětí
- Kdy pomýšlet na řasinkové dysfunkce?
- Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
- C-reaktívny proteín vo vzťahu k fenotypom obštrukčného spánkového apnoe u detských pacientov
- Děti závislé na technické podpoře dýchání
- Transplantace kmenových buněk krvetvorby u dětí s Fanconiho anémií po selhání krvetvorby v České republice a na Slovensku (2005–2016)
- Vplyv chorioamnionitídy na morbiditu predčasne narodených novorodencov a možné terapeutické intervencie
- Úsmevné príhody z Martinskej nemocnice – obytná budova
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kdy pomýšlet na řasinkové dysfunkce?
- Jak a kdy vyšetřovat funkci plic u nespolupracujících dětí
- Dlouhodobé dopady předčasného porodu na respirační systém u dětí
- Dětská pneumologie v Česku a na Slovensku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



