-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
The current view of the diagnosis and management of amebiasis in the light of the authors’ own case reports
This comprehensive review is focused on a serious protozoan disease, amebiasis. This disease is caused by the human parasite Entamoeba histolytica (E. histolytica), the second leading cause of mortality due to protozoan disease worldwide (the leading cause is malaria).
The incidence of amebiasis in the Czech Republic is very low, but it may be underreported as the disease often escapes diagnosis.
Intestinal colonisation by E. histolytica may be asymptomatic. The clinical picture ranges from diarrhea to colitis or fulminant colitis when the parasite progresses to the trophozoite stage. Secondary dissemination in the blood or lymph system may induce systemic signs of the disease. Liver abscess is the most common extraintestinal form of amebiasis.
The diagnosis of intestinal amebiasis is based on the clinical picture and parasitological examination of the stool. To diagnose extraintestinal amebiasis, serology tests are used to detect antibodies in the blood. Recently, molecular methods have been increasingly used for the detection of the nucleic acids of the pathogen in biological specimens.
The first line therapy for amebiasis are 5-nitroimidazole drugs, currently available in the Czech Republic.
However, surgical intervention should also be considered in patients with a severe course of the disease. Included in the review are the case reports of patients with severe concomitant intestinal and extraintestinal amebiasis.Keywords:
Entamoeba histolytica – amoebiasis – intestinal and extraintestinal amebiasis – liver abscess
Autoři: M. Voldřich 1; P. Novotný 1; T. Tyll 1; J. Rudiš 2; T. Belšan 3; D. Hedlová 4; M. Stefanová 5
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 1; Chirurgická klinika, 2. LF UK a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 2; Radiodiagnostické oddělení, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 3; Oddělení nemocniční hygieny, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 4; Interní oddělení Nemocnice Na Františku, Praha 5
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 226-231
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Autoři předkládají ve formě souborného referátu ucelený pohled na problematiku závažného protozoárního onemocnění, amébózy. Jedná se o infekční onemocnění způsobené patogenním prvokem Entamoeba histolytica (E. histolytica), které se v celosvětovém měřítku řadí na druhé místo v mortalitě protozoárních infekcí za malárii. V České republice je výskyt sporadický, incidence a prevalence onemocnění však může být pravděpodobně podhodnocena [1]. Osídlení tlustého střeva E. histolytica může být asymptomatické, v případě konverze neinvazivního stadia v invazivní trofozoity se manifestuje intestinální formou, jejíž tíže zaujímá širokou škálu od prostého průjmu až po fulminantně probíhající kolitidu. Sekundárně může dojít k rozsevu krevní cestou a k orgánové manifestaci. Nejčastější extraintestinální formou amébózy je jaterní absces.
Diagnostika intestinální amébózy je mimo klinického obrazu založena na parazitologickém vyšetření stolice. U extraintestinální formy je průkazné sérologické vyšetření protilátek v krvi. V poslední době se k diagnostice stále častěji využívají i metody molekulární detekce nukleových kyselin patogenu v biologickém materiálu.
V terapii amébózy jsou zásadní 5-nitroimidazolové preparáty, které jsou běžně dostupné i v České republice. V případě komplikovaného průběhu může být indikována chirurgická léčba.
Součástí referátu je i vlastní kazuistická zkušenost autorů se souběžně probíhající intestinální a extraintestinální těžkou formou amébózy.Klíčová slova:
Entamoeba histolytica – intestinální forma – extraintestinální forma – jaterní abscesÚVOD, EPIDEMIOLOGIE
Amebóza je celosvětově rozšířené infekční onemocnění způsobené anaerobním protozoárním parazitem Entamoeba histolytica. Promořenost populace je vysoká, uvádí se, že v lidské populaci je asi 10 % nosičů uvedeného prvoka s nejvyšší prevalencí nosičství (20–30 %) v tropech a subtropech (vlhké a teplé klima).
Celosvětově představuje amébóza třetí nejvýznamnější parazitární infekci, hned po malárii a schistosomóze. Klinicky se manifestuje cca u 50 milionů osob ročně, až 100 tisíc z nich na nákazu umírá, čímž se amébóza řadí v mortalitě protozoárních infekcí na druhé místo za malárii [2, 3].
Nejvyšší prevalence onemocnění je v rozvojových zemích, především z důvodu nedostatečné hygieny a nedostatku pitné vody. U dětí je invazivní infekce relativně vzácná, avšak o to nebezpečnější (fulminantní průběh) [4].
V České republice je záchyt amébózy sporadický. V posledních letech nebylo při vyšetřeních stolice zaznamenáno více než 50 záchytů Entamoeba histolytica/dispar/moshkovskii ročně (hlášeno přímo laboratořemi), klinicky manifestních případů střevní amébózy s dourčením E. histolytica bylo jen minimum. Většina diagnostikovaných případů se u nás projevuje jako extraintestinální forma (graf 1, tab. 1). Skutečný výskyt střevní formy onemocnění ale může být vzhledem k velké variabilitě klinických projevů (viz dále) a relativně malé zkušenosti řady kliniků s tímto onemocněním vyšší.
V trávicím traktu člověka bylo popsáno sedm druhů améb – E. histolytica, E. dispar, E. moshkovski, E. hartmanni, E. coli, Jodamoeba bütschlii a Endolimax nana [5]. Pouze E. histolytica je považována za patogenní, napadá stěnu tlustého střeva, případně může sekundárně dojít k jejímu rozsevu mimo lumen střeva. E. histolytica se přenáší fekálně-orální cestou, požitím infekční cystické formy protozoa. Cysty jsou značně odolné, v zevním prostředí (fekálně znečištěná půda, voda) přežívají týdny až měsíce. Nákaza je nejčastěji alimentární z kontaminovaných potravin nebo vody, případně přenosem z rukou. K přenosu může dojít také při používání análních sexuálních praktik [6].
V životním cyklu E. histolytica se střídají dvě stadia, infekční cysta (klidové stadium) a metabolicky aktivní trofozoit (vegetativní stadium). Cysty jsou neinvazivní a nepohyblivé, zajišťují však přenos infekce. Trofozoiti jsou pohyblivé améby, které mohou existovat jen velmi krátkou dobu mimo organismus hostitele, v případě požití navíc nepřežijí pasáž horní částí gastrointestinálního traktu, proto nejsou na rozdíl od cyst infekční.
Po požití cysty tato putuje díky své odolnosti vůči žaludečním šťávám do tenkého střeva, kde excystuje. K excystaci dochází zejména v terminálním ileu, výsledkem jsou trofozoiti, kteří se množí dělením v kolonu. Většina améb (forma minuta) žije jako komenzál v lumen tlustého střeva, živí se bakteriemi, encystuje a ve formě cyst je vylučována stolicí. Tato forma není invazivní. Forma minuta se za ne zcela jasných podmínek může transformovat ve větší invazní trofozoit (forma magna), který napadá a destruuje sliznici, je schopen vyvolat amébovou dyzenterii a po rozsevu krevním oběhem i extraintestinální amébózu. Forma magna je jakousi slepou linií ve vývoji améb, která nemá schopnost encystace ani zpětné konverze na formu minuta, etiologie vzniku je pravděpodobně multifaktoriální („stresová“ přeměna na invazivní formu).
Tab. 1. Počet případů klinicky manifestní amébózy v České republice v letech 1994–2013 Table 1. Cases of clinically manifest amebiosis in the Czech Republic in 1994–2013 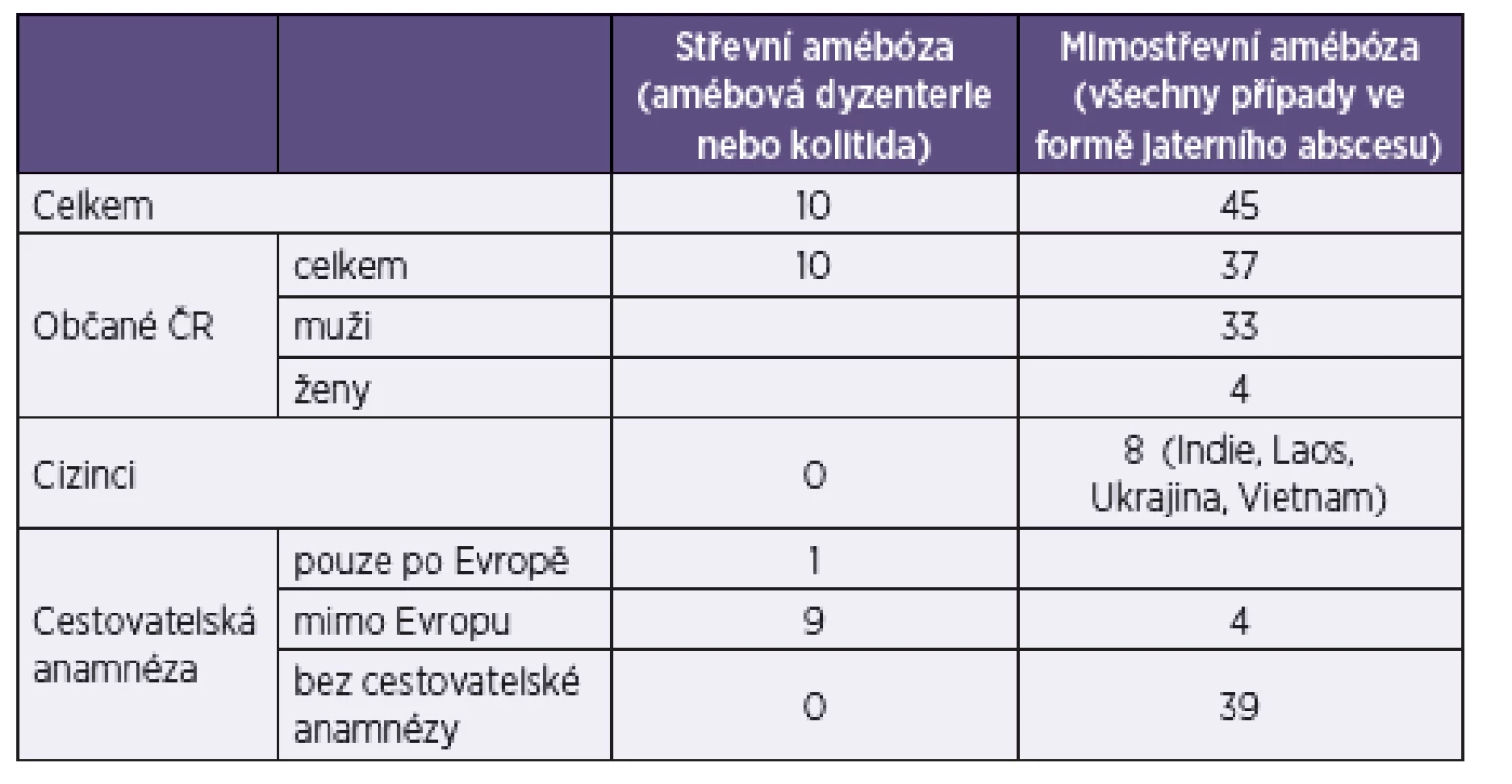
(Zdroj: NRL pro laboratorní diagnostiku tropických parazitárních infekcí, RNDr. Eva Nohýnková, Ph.D.) (Source: National Reference Laboratory for the Diagnosis of Tropical Parasitic Infections, Eva Nohýnková, MSc, PhD) PATOGENEZE
Amébóza je výsledkem kolonizace střeva a následného přímého poškození buněk invazivní formou parazita (formou magna), při kterém se uplatňují dva mechanismy, tj. kontaktní cytolýza zodpovědná za destrukci buněk (epitelií, neutrofilních leukocytů a dalších buněk) a sekrece proteolytických enzymů vedoucí k rozrušení vaziva. Po překonání přirozených obranných mechanismů střeva hostitele (mucinová vrstva na sliznici) dosahuje prvok luminálního povrchu enterocytů, adheruje k buňkám v nejzranitelnějších místech (mezi Lieberkühnovými kryptami), destruuje epiteliální buňky, fragmenty fagocytuje a intracelulárně degraduje. V pokročilejších fázích infekce dochází k interakci proteináz s tkáněmi hostitele, k narušení mezibuněčného vaziva a ke tvorbě pro intestinální amébózu typických podminovaných vředů tvaru široké láhve s úzkým hrdlem (malým vyústěním na povrchu) [7].
Sekundárně může dojít k šíření infekce mimo střevní trakt (extraintestinální amébóza), a to i bez předchozí střevní symptomatologie. Šíření probíhá hematogenní cestou, nejčastěji do jater. Systémový průnik je provázen tvorbou specifických protilátek, které mají vzhledem k velmi rychlé antigenní obměně plazmatické membrány améby pouze diagnostický význam, nikoli protektivní. Prodělaná infekce pak není prevencí dalšího onemocnění amébózou, rovněž potenciální možnost vývoje vakcíny je značně limitována. Studie u dětí naznačila, že strategie dalšího výzkumu v oblasti vakcinace by měla směřovat spíše k ovlivnění slizniční imunity (střevní IgA antilektinové protilátky) [8].
KLINICKÝ OBRAZ
V 90% případů je osídlení střeva E. histolytica asymptomatické, jde o tzv. asymptomatickou střevní amébózu. U 4–10 % případů asymptomatické střevní amébózy dochází během 1 roku k rozvoji klinicky manifestní infekce (intestinální či extraintestinální) [2].
Při střevní formě amébózy se můžeme setkat hned s několika nozologickými jednotkami, s formou akutní i chronickou. Nejčastěji je postiženo cékum a vzestupný tračník, méně často sigmoideum, vzácně příčný tračník, někdy se infekce může dostat i do terminálního ilea. Na rozvoj symptomatické infekce má vliv nutriční stav pacienta, složení bakteriální střevní flory, teplotní stres a těhotenství [9].
Nejčastěji se vyskytuje (90 % případů symptomatické intestinální amébózy) amébová dyzenterie, která odpovídá akutní kolitidě. Typickými příznaky jsou krvavý průjem s hlenem a bolestivost břicha trvající i několik týdnů. Pouze u 10–30 % pacientů je přítomná horečka, obvykle není popisována ani alterace celkového stavu. Při delším trvání může docházek k hmotnostnímu úbytku. Endoskopický nález je nespecifický, bývají viditelné povrchové ulcerace, pablány lokalizované fokálně nebo segmentálně. Mortalita amébové kolitidy je 1–9 %. Diferenciálně diagnosticky padá do úvahy především bacilární dyzenterie, ischemická kolitida, divertikulida.
Neléčená amébová infekce střeva může rezultovat do chronického stavu (chronická nedyzenterická kolitida) s občasnými krvavými průjmy, degenerací stěny střevní, eventuálně s tvorbou píštělí [10]. Diferenciálně diagnosticky je nutné tuto formu odlišit od tuberkulózy a zejména nespecifických střevních zánětů (IBD), recipročně je třeba myslet na možnost amébózy při podezření na IBD (Crohnova choroba, ulcerózní kolitida).
Velmi obávanou, avšak méně častou variantou střevní amébózy, je fulminantní nebo nekrotizující kolitida, která se manifestuje jako těžký krvavý průjem s tenesmy, bolestmi břicha až peritoneálního charakteru. Tlusté střevo je postiženo v celém rozsahu nekrotickými lézemi a vředy. V 75 % případů dochází k perforaci střeva a rozvoji peritonitidy [11]. Je přítomna těžká alterace celkového stavu s vysokou horečkou a šokovou cirkulací. Letalita pod obrazem multiorgánového selhání je vysoká (40–50 %). Predisponujícími faktory pro fulminantní kolitidu jsou malnutrice, těhotenství, léčba kortikoidy a raný dětský věk.
Extraintestinální forma amébózy je vždy sekundární. Nejčastěji postiženým orgánem jsou játra, až v 80 % pravý jaterní lalok. Abscesy mohou být vícečetné. Klinicky se jaterní amébové abscesy projevují jako intermitentní horečnaté onemocnění septického charakteru doprovázené zimnicí a třesavkou [9]. Typické jsou profusní noční poty, neustupující bolestivost v pravém horním břišním kvadrantu. Subakutní forma je provázena pozvolnou ztrátou hmotnosti a anorexií. Bývá přítomen kašel, žloutenka je naopak neobvyklá. Diferenciálně diagnosticky může jít o echinokokovou cystu, bakteriální absces, arteriovenózní malformaci, komplikovanou cholangoitidu či cholecystitidu nebo hepatocelulární karcinom.
Náhlý, prudký nástup peritoneálních příznaků může být způsoben intraperitoneální rupturou abscesu. Kolitidu nemá 60–70 % pacientů s amébovým abscesem, ačkoliv anamnéza dyzenterie v uplynulém roce může být pozitivní. „Latentní perioda” není známá, absces se může manifestovat i několik let po cestě do endemické oblasti. Mortalita amébových jaterních abscesů je 1–3%, při náhlé intraperitoneální ruptuře stoupá na 2–7%, při penetraci do pleurální dutiny nebo perikardu na 15–40% [12].
Vzácnější „neabdominální“ manifestace amébózy, pulmonální či mozkový absces jsou spojeny s velmi vysokou letalitou.
DIAGNOSTIKA
Diagnostika amébové infekce vychází z klinického obrazu (viz výše) a endoskopického, ultrazvukového či CT nálezu. Potvrzena je cíleným laboratorním vyšetřením.
Kolonoskopické vyšetření není u intestinální formy nezbytně nutné, získaný obraz kolitidy je totiž nespecifický. Diagnostickým přínosem může být v případě záchytu améb v submukóze při histologickém vyšetření bioptovaného materiálu. Fulminantně probíhající kolitida je relativní kontraindikací kolonoskopie vzhledem ke zvýšenému riziku perforace střeva. Ultrazvukové a CT vyšetření je průkazné při detekci orgánového postižení, etiologicky však neodliší bakteriální absces od amébového.
Laboratorní diagnostika je odlišná u intestinální a extraintestinální amébózy, kdy zásadní je (až na výjimky) absence specifických protilátek v krvi při střevním postižení a častá absence přítomnosti améb ve stolici při extraintestinální symptomatologii. Základní laboratorní metody jsou parazitologické (mikroskopické) vyšetření stolice a sérologie.
U intestinálních forem se provádí klasické parazitologické (koprologické) vyšetření stolice (ať ve formě „standardního parazitologického vyšetření“ osob bez cestovatelské anamnézy nebo specializovaného parazitologického vyšetření u cizinců a osob s cestovatelskou anamnézou) které má ale určité limity (viz dále). Jednorázové mikroskopické vyšetření stolice má senzitivitu pouze 35–60%, ta se zvýší na 85–95% při vyšetření 3 vzorků stolice v průběhu maximálně 10 dní (optimálně tři vzorky stolice odebrané s časovým odstupem 24–48 hodin) [13]. Pro výsledek vyšetření je přitom velmi důležité načasování odběru a management preanalytické fáze. U vyšetření průjmovité stolice, kde v případě amébové dyzenterie očekáváme výskyt trofozoitů, musí být vzorek dopraven do laboratoře do 2 hodin od odběru a ihned zpracován. Nesmí být vystaven chladu (cca pod 15 °C), který by způsobil destrukci trofozoitů. U formované stolice, ve které můžeme detekovat spíše cystické stadium améby, je režim volnější, vzorek uchováván v chladničce (nesmí však být vystaven mrazu) a jeho zpracování by mělo proběhnout do 48 hodin po odběru.
Mikroskopický nález erytrocytů a leukocytů ve stolici, spolu s průkazem trofozoitů, které obsahují fagocytované erytrocyty, je signifikantní pro infekci E. histolytica. Při záchytu cyst Entamoeba je nutná druhová identifikace, která vzhledem ke shodné morfologii patogenních i nepatogenních cystických stadií vyžaduje složitější laboratorní analýzu v podobě PCR vyšetření vzorku [14, 15].
Další možností, jak diagnostikovat amébózu, je vyšetření stolice na přítomnost antigenů E. histolytica (komerční ELISA testy/ rapid testy s využitím monoklonálních protilátek). Vyšetření lze využít v situacích, když není dostupné mikroskopické vyšetření, Z výsledků studií vyplývá, že spolehlivost vyšetření antigenů není absolutní, senzitivita je udávána podle různých studií v rozmezí 70–95 % v závislosti na srovnávací metodě (mikroskopie, PCR atd.). Specificita vyšetření antigenů je vysoká (přes 90 %). Detekce antigenů v krvi nebo punktátech má senzitivitu nízkou (literárně okolo 30 %), uvedené biologické materiály proto nejsou k tomuto vyšetření vhodné [16].
Kultivační záchyt améb z čerstvé stolice či bioptického materiálu za použití speciálních kultivačních medií je náročná metoda s omezenou výtěžností, navíc není v běžných podmínkách dostupná, a proto není v současnosti běžně využívána.
Sérologické vyšetření protilátek proti E. histolytica u intestinálních forem amébózy bývá negativní. U extraintestinálních forem je naopak průkaz protilátek E. histolytica v krvi zcela zásadní. Abscesy se vyvíjejí v řádu týdnů až měsíců, což je typicky doprovázeno tvorbou protilátek. Klinicky latentní stadium je pak z časového hlediska velmi variabilní (i roky).
V případě vyšetření materiálu získaného punkcí abscesu je základní metodou PCR průkaz fragmentů DNA E. histolytica. Mikroskopický nález živých trofozoitů v punktátu je raritní, neboť živé trofozoity jako „kontaktní parazit“ (viz patogeneze) perzistují pouze na pomezí zdravé tkáně a abscesové dutiny.
Z nespecifických biochemických ukazatelů můžeme u amébózy často pozorovat různě vyjádřenou elevaci zánětlivých markerů, leukocytózu, anémii (většinou lehkou). Eozinofílie není u amébózy přítomna. U amébového jaterního abscesu může být elevace jaterních testů (zejména alkalické fosfatázy).
LÉČBA
V léčbě amébózy využíváme dvě základní skupiny amébocidních léků – luminální (nevstřebávají se ze střevního lumen) a tkáňové.
Asymptomatická intestinální kolonizace E. histolytica (nosičství cyst) může být léčena pouze luminálními léčivy (diloxanid furoát, paronomycin, jodochinol), která však nejsou v ČR registrována. Pro eliminaci nosičství tak u nás používáme 5-nitroimidazolové preparáty (metronidazol po dobu 10 dnů) v kombinaci s tetracyklinovými antibiotiky II. generace (doxycyklin prvních 5 dnů) a cloroxinem (Endiaron následujících 5 dnů). Monoterapie 5-nitroimidazoly vzhledem k nedostatečné koncentraci léku v lumen tlustého střeva (vstřebávají se v tenkém střevě) a značné odolnosti cyst nepostačuje. Úspěšnost léčby se kontroluje parazitologickým vyšetřením stolice dva a čtyři týdny po ukončení terapie.
U symptomatické intestinální amébózy jsou lékem volby 5-nitroimidazolové léky (v ČR metronidazol), které se po per os podání velmi dobře vstřebávají a pronikají do většiny tkání i abscesových dutin, proto je používáme i u extraintestinálních forem onemocnění. V případě střevní amébózy trvá léčba 7–10 dnů, kontrolní vyšetření stolice se provádí během léčby a bezprostředně po jejím ukončení.
Léčba extraintestinálních forem infekce metronidazolem je perorální nebo intravenózní podle stavu pacienta, po dobu minimálně 14 dnů. U závažných forem lze účinek potencovat kombinací s tetracyklinovými antibiotiky či chlorochinem (Delagil) [17]. Účinnost léčby odráží klinický stav pacienta a regrese nálezu při kontrolním zobrazovacím vyšetření. Léčba kortikoidy není indikována a zhoršuje klinický výsledek [18].
Většina pacientů s amébózou může být léčena ambulantně, léčba bývá po nasazení příslušné farmakoterapie rychle efektivní. Hospitalizace je nutná u pacientů s těžkou kolitidou a hypovolémií vyžadující náhradu tekutin, jaterními abscesy nejasné etiologie nebo nereagujícími na léčbu a samozřejmě při potřebě chirurgické intervence.
Léčba amébového jaterního abscesu je konzervativní, punkce či drenáž jaterních abscesů se primárně nedoporučuje. Chirurgická nebo radiologická intervence (punkce, drenáž, evakuace abscesu) je obvykle indikována v případě nejasné diagnózy k vyloučení bakteriálního abscesu nebo při podezření na bakteriální superinfekci amébového jaterního abscesu, dále při selhání léčby metronidazolem (> 4 dny léčby) nebo v případě velkých abscesů (zejména levého jaterního laloku), kde hrozí ruptura či penetrace do pleurální dutiny nebo perikardu.
Rychlé chirugické řešení je nutné při fulminantním průběhu kolitidy s perforací či rozvojem toxického megakolon, stejně tak při známkách ruptury jaterního abscesu.
Perkutánní drenáž zlepšuje výsledek při léčbě amébového hrudního empyému a je život zachraňujícím výkonem u amébové perikarditidy.
KAZUISTIKA
Muž (37 let) byl přeložen z jiného zdravotnického zařízení na Chirurgickou kliniku 2. LF UK a Ústřední vojenské nemocnice (ÚVN) pro septický stav s ložiskovým postižením jater charakteru abscesu. Anamnesticky šlo o pacienta s lehkou formou astma bronchiale (v léčbě pouze inhalační bronchodilatancia, bez kortikoidní složky), s hypotyreózou na substituci (levothyroxin), který před několika lety prodělal plicní tuberkulózu (TBC) a byl abuzérem pervitinu. Pro TBC byl dále dispenzarizován, bez známek recidivy onemocnění, drogy více neužíval. Recentně (před dvěma měsíci) bylo u pacienta zjištěno zánětlivé postižení terminálního ilea, byla stanovena diagnóza Crohnovy choroby a nasazena léčba mesalazinem.
Aktuální onemocnění se projevilo bolestmi v pravé polovině břicha a horečkami, stav byl uzavřen jako akutní pyelonefritida a pacient byl hospitalizován na standardním oddělení jiného zdravotnického zařízení. Přes empirickou antibiotickou léčbu symptomy během několika dnů progredovaly, objevily se známky peritoneálního dráždění a celková alterace. Bylo doplněno ultrazvukové (UZ) vyšetření, které prokázalo abscesovou dutinu v pravém jaterním laloku, po dohodě byl pacient přeložen k další léčbě na naše pracoviště.
Při přijetí byl pacient v septickém stavu, febrilní, schvácený, hypertenzní, měl silné bolesti v pravém podžebří, laboratorně byla přítomna elevace zánětlivých parametrů (leukocyty 17000 a CRP 263) a jaterních testů (ALT 1,8, AST 2,66, GMT 2,76).
Ihned bylo provedeno CT vyšetření s nálezem 2 objemných abscesů (o průměru 10 a 11 cm) v pravém jaterním laloku (obr. 1). Pod CT navigací byly do obou abscesových dutin zavedeny drény kalibru 8 French (F; 1 F = 0,3mm), aspirací byla získána hemoragicko-hnisavá tekutina, materiál byl odeslán ke kultivačnímu vyšetření.
Obr. 1. CT obraz jaterních abscesů – vstupní nález (zdroj: NRL pro diagnostiku střevních parazitóz, RNDr. Zuzana Hůzová) Fig. 1. Baseline CT scan of liver abscesses (source: National Reference Laboratory for the Diagnosis of Intestinal Parasitoses, Zuzana Hůzová, MSc) 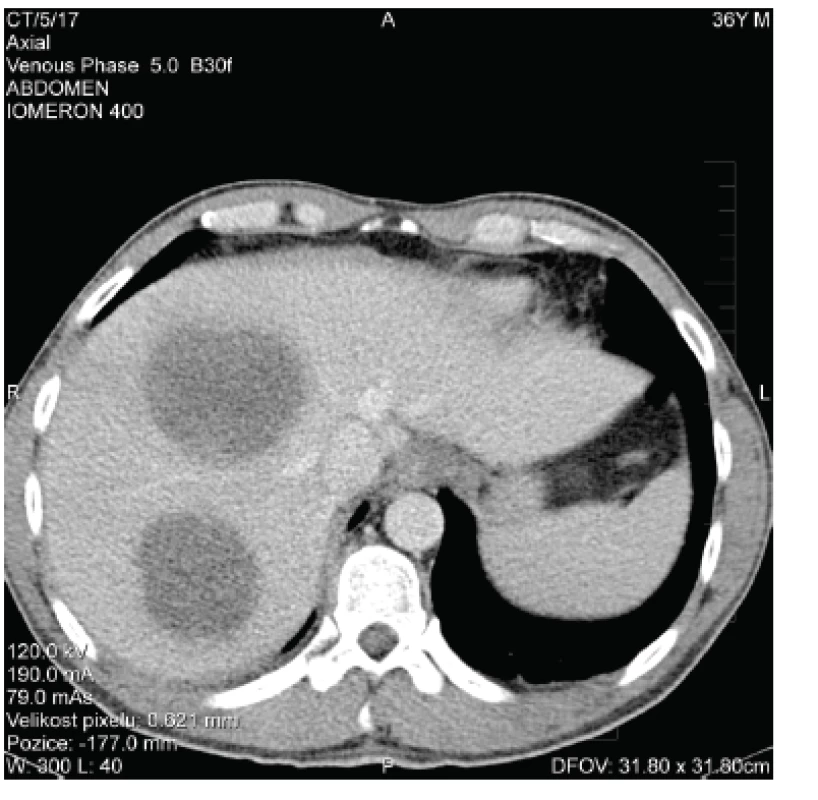
Na Chirurgické klinice byl pacient dále léčen kombinací ATB z předchozího pracoviště (amoxilin/klavulanát + ciprofloxacin), rehydratován infuzemi, byla podávána analgetika.
Během 48 hodin po perkutánní drenáži abscesů se stav nezlepšoval, došlo k další elevaci zánětlivých parametrů (leukocyty 20 000, CRP 327), bolesti břicha přetrvávaly. Na kontrolním CT vyšetření byla patrná progrese velikosti abscesů, proto byla provedena výměna obou drénů za silnější (12 F). Ani tato intervence nepřinesla efekt, přes korektní polohu drénů nedošlo k evakuaci abscesů, při progredujícím septickém stavu byla proto indikována operační revize dutiny břišní k eliminaci infekčního fokusu.
Po provedení laparotomie byla chirurgem popsána zvětšená, steatoticky změněná játra, makroskopicky nebyl ložiskový proces v játrech patrný. Po provedení vynucené cholecystektomie (neevakuovatelný objemný žlučník) byla pooperační sonografií verifikována obě abscesová ložiska, pod UZ navigací bylo proniknuto do povrchněji uloženého většího ložiska a evakuováno množství nekrotických hmot a hnisu (materiál byl odeslán na mikrobiologické vyšetření), dutina byla opakovně vypláchnuta a zadrénována silným kulatým drénem. Výkon byl komplikován krvácením v místě vstupu do jater s potřebou zabalení jater rouškami. Hlouběji uložené ložisko, podle UZ v intimní souvislosti s větvením portální žíly, již nebylo pro riziko dalšího krvácení ošetřeno.
Vzhledem k plánovanému reviznímu výkonu při ponechání roušek v dutině břišní byl pacient po výkonu přijat na lůžkové resuscitační oddělení, na umělé plicní ventilaci (UPV) s pokračující analgosedací. ATB léčba byla při dosud negativních kultivačních nálezech z abscesů empiricky změněna a posílena o antimykotika (nasazen piperacilin/tazobactam, amikacin, flukonazol).
Během plánované druhé chirurgické revize byly odstraněny břišní roušky, krvácení již nebylo patrné, chirurgem byly ve shodě s CT vyšetřením nalezeny nespecifické zánětlivé změny na terminálním ileu a ileocekálním přechodu. Další CT kontrolní vyšetření břicha bylo s nálezem částečné regrese chirurgicky drénovaného abscesu (obr. 2), při perzistenci hlubšího abscesu (chirurgicky neošetřeného) byla znovu pod CT provedena drenáž tohoto ložiska, zároveň byl pod CT kontrolou perkutánně drénován pravostranný fluidothorax.
Obr. 2. CT obraz jaterních abscesů po chirurgické drenáži Fig. 2. CT scan of liver abscesses after surgical drainage 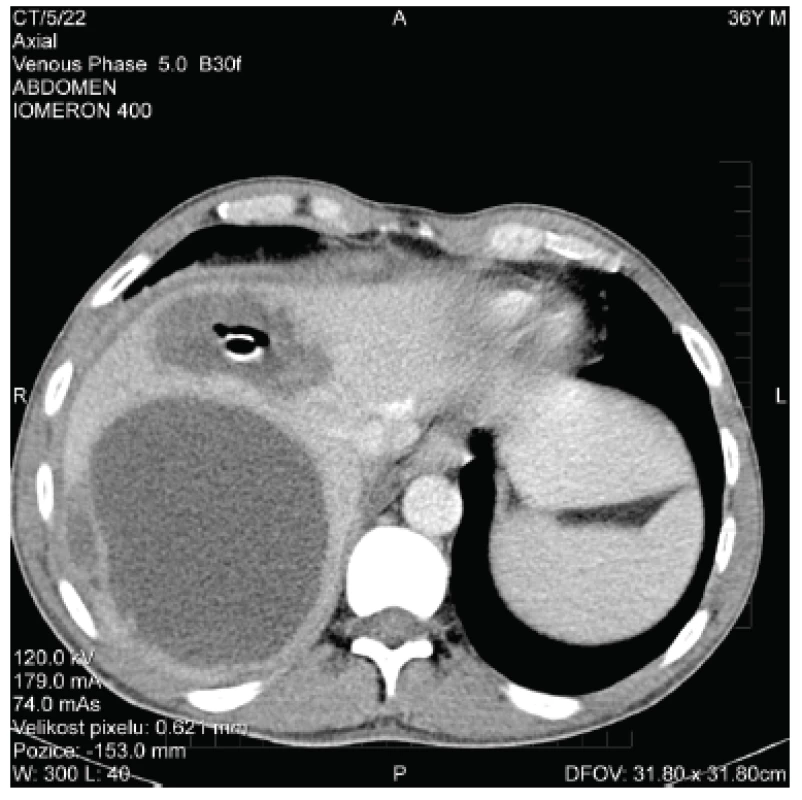
U pacienta dále přetrvával septický stav, pro poruchu plicních funkcí a závažný břišní nález byla nutná sedace a UPV. Etiologické agens stále nebylo známé, kultivační nálezy z abscesů i pleurálního výpotku byly opakovaně negativní. I vzhledem k anamnéze (intravenozní abúzus pervitinu, stav po prodělané plicní tuberkulóze) byl proto zahájen širší screening, byly provedeny odběry na TBC, HIV, hepatitidy a protozoa. Výsledek byl překvapivý, u pacienta byl v krvi prokázán vysoký titr protilátek Entamoeba histolytica. Diagnóza pyogenního abscesu byla ve světle tohoto nálezu přehodnocena na amébový jaterní absces a ihned byla zahájena příslušná léčba chemoterapeutiky (tj. metronidazolem), stalo se tak 12. den hospitalizace na našem pracovišti (v ÚVN).
Po nasazení metronidazolu došlo k rychlému zlepšení klinického stavu i poklesu zánětlivých markerů. Léčba na resuscitačním lůžku byla završena dekanylací tracheostomie, celková doba UPV byla 25 dní. Po překladu z resuscitačního lůžka byl pacient ještě 10 dnů hospitalizován na Chirurgické klinice, postupně byly extrahovány drény, v dobrém klinickém stavu byl přeložen zpět do „mateřského“ zdravotnického zařízení. Zde byla přehodnocena původní diagnóza Crohnovy choroby, když po léčbě metronidazolem došlo k vymizení klinických symptomů i normalizaci endoskopického nálezu na střevě, byl stav zpětně klasifikován jako chronická nedyzenterická amébová kolitida.
Pacient měl negativní cestovatelskou anamnézu („v životě neopustil ČR…“), šlo tedy o autochtonní amébovou infekci. Za podstatný lze považovat fakt (rizikový faktor), že se jednalo o jedince s nízkým sociálním zázemím a hygienickým standardem ve špatném nutričním stavu, po prodělané tuberkulóze a s abúzem drog v minulosti.
ZÁVĚR
Amébóza, zejména pak její intestinální forma, je v České republice vzácná, a proto mnohdy opomíjená diagnóza. V diferenciální diagnostice může být snadno zaměněna za nespecifický střevní zánět. Její výskyt je kosmopolitní, negativní cestovatelská anamnéza tedy v žádném případě nevylučuje možnost onemocnění.
Uvedená kazuistika popisuje případ souběhu intestinální a extraintestinální formy amébózy, navíc s velmi těžkým průběhem. Crohnova choroba, která byla diagnostikovaná dva měsíce před vznikem septického stavu a jaterních abscesů, byla ve skutečnosti chronickou formou amébové kolitidy. Kazuistika potvrzuje, že samotná perkutánní ani chirurgická drenáž amébových abscesů není kurabilní, a že jedinou kauzální léčbou je podání 5-nitroimidazolvých preparátů, jejichž toxicita je nízká, dobře pronikají do abscesových dutin a doposud nebyla popsána rezistence vůči těmto preparátům.
Na infekci E. histolytica je třeba myslet, a to nejen u pacientů se sterilními jaterními abscesy.
U pacientů s nově diagnostikovanými střevními záněty by měla být E. histolytica vyloučena, stejně tak u pacientů s nedostatečnou odpovědí na standardní léčbu, ještě před případným nasazením imunosupresivní nebo biologické léčby [9].
Poděkování
Autoři děkují RNDr. Zuzaně Hůzové a RNDr. Evě Nohýnkové, Ph.D., za poskytnutá data a cenné odborné informace.
Do redakce došlo dne 18. 11. 2014. ???
Adresa pro korespondenci:
MUDr. Martin Voldřich
Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
16902 Praha 6
e-mail: martin.voldrich@uvn.cz
Zdroje
1. Čermáková Z, Valenta Z, Voxová B, Roučková V, et al. Entamoeba histolytica – nebezpečný střevní prvok (II. část). Folia Gastroenterol Hepatol, 2008;6(3):108–111.
2. Leder K, Weller PF. Intestinal and extraintestinal Entamoeba histolytica amebiasis. UpToDate [online] 2012-[cit.2012-09-11]. Available from: http://www.uptodate.com/patients/content/topic.do?topicKey=parasite/84-35
3. Ximénez C, Morán P, Rojas L, Valadez A, et al. Novelties on Amoebiasis: A Neglected Tropical Disease. J Glob Infect Dis, 2011;3 : 166–174.
4. Anzurez LB. Pediatría general. Rev Med Hosp Gen Mex, 2005; 68 : 106–114.
5. Rodriguez-Morales AJ (ed.). Current Topics in Tropical Medicine [online]. InTech, 2012, 564 s. [cit. 2014-04-09]. Available from: <http://www.intechopen.com/books/current-topics-in-tropical-medicine>. ISBN 978-953-51-0274-8.
6. Salit IE, Khairnar K, Gough K, Pillai DR. A possible cluster of sexually transmitted Entamoeba histolytica: genetic analysis of a highly virulent strain. Clin Infect Dis, 2009;49 : 346.
7. Ackers JP, Mirelman D. Progress in reserch on Entamoeba histolytica pathogenesis. Curr Opin Microbiol, 2006;9(4):367–373.
8. Stanley SL, Jr. Protective immunity to amebiasis: new insights and new challenges. J Infec Dis, 2001;184 : 504.
9. Stejskal F, Nohýnková E. Amébóza. Sanquis, 2003;29 : 20–24.
10. Salles JM, Salles MJ, Moraes LA, Silva MC. Invasive amebiasis: an update on diagnosis and management. Expert Rev Anti Infect Ther, 2007;5(5):893–901.
11. McGregor A, Brown M, Thway K, Wright SG. Fulminant amoebic colitis following loperamide use. J Travel Med, 2007;14(1):61–62.
12. Fang D, Shu D. Entamoeba histolytica liver abscess. Canadian Medical Association Journal, 2010;16 : 1758.
13. DiMiceli L. Distinguishing between pathogenic and non-pathogenic species of Entamoeba. Lab Med, 2004;35(10):613–616.
14. Hamzah Z, Petmitr S, Mungthin M, et al. Development of multiplex real-time polymerase chain reaction for detection of Entamoeba histolytica, Entamoeba dispar, and Entamoeba moshkovskii in clinical specimens. Am J Trop Med Hyg, 2010; 83 : 909.
15. Liang SY, Hsia KT, Chan YH, et al. Evaluation of a new single-tube multiprobe real-time PCR for diagnosis of Entamoeba histolytica and Entamoeba dispar. J Parasitol, 2010;96 : 793.
16. Fotedar R, Stark D, Beebe N, et al. Laboratory diagnostic techniques for Entamoeba species. Clin Microbiol Rev, 2007;20 : 511.
17. Stejskal F. Terapie autochtonních parazitárních infekcí. Postgraduální medicína, 2013;8 : 55.
18. Gonzales ML, Dans LF, Martinez EG. Antiamoebic drugs for treating amoebic colitis. Cochrane Database Syst Rev, 2009.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2014 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Věnování doc. MUDr. Heleně Hupkové, Ph.D. in memoriam
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



