-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
Antibiofilm activity of agents for disinfection of skin, mucosa, and wound on microorganisms isolated from patients with catheter-related infections
Aim of the study:
To evaluate the activity of four disinfectious agents used for skin, mucosa and wound disinfection (chlorhexidine digluconate, povidone-iodine, octenidine hydrochloride, super oxygenated water) on the biofilm of Staphylococcus aureus, Escherichia coli and Candida sp. strains, isolated from patients with catheter-related infections.Material and methods:
The tested agents were applied on 24-hours biofilm in the microtiter plate wells. After 20-minutes exposition, the wells were washed, and the microbial vitality was tested by regrowth method after 24-hours cultivation in fresh culture medium. Biofilm formation was confirmed in a parallel microtiter plate; the quantity of produced biofilm was measured after crystal violet staining spectrophotometrically at 570 nm.Results:
All four tested disinfectious agents inactivated the biofilm of all S. aureus, E. coli, C. albicans, C. krusei and C. glabrata strains, without respect to the intensity of biofilm production. Three strains of C. tropicalis with intensive biofilm production partially preserved their vitality after exposition to chlorhexidine and povidone-iodine, and 2 strains to octenidine. Super oxygenated water had no effect on yeasts associated with massive biofilm of one C. tropicalis strain, and only partially decreased the vitality of additional two strains.Conclusions:
The tested disinfectious agents proved in-vitro antibiofilm activity on all microbial strains from catheter-related infections, with exception of three C. tropicalis strains with intensive biofilm production. Octenidine was found to be the most active agent. The results enable to assume, that the tested disinfectious agents, when applied to patients, will inactivate not only the individual microorganisms not protected by biofilm, but also the biofilm on the catheter surfaces approachable by local application. However, C. tropicalis strains producing massive biofilm, protecting them partially from effects of disinfectious agents tested in the present study, still remain a challenge.Keywords:
disinfectious agents – biofilm – Staphylococcus aureus – Escherichia coli – Candida sp. – catheter-related infections
Autoři: L. Slobodníková; Hupková H. †; J. Koreň; M. Záborská
Působiště autorů: Mikrobiologický ústav LF UK a UNB v Bratislave
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 3, s. 168-172
Kategorie: Souhrnná sdělení, původní práce, kazuistiky
Souhrn
Cieľ práce:
Overiť aktivitu štyroch dezinfekčných látok určených na dezinfekciu kože, slizníc a rán (chlórhexidín diglukonát, jódpovidon, oktenidín hydrochlorid, superoxidovaná voda) na biofilmovú formu rastu kmeňov Staphylococcus aureus, Escherichia coli a Candida sp. izolovaných od pacientov s infekciami spojenými s prítomnosťou katétra.Materiál a metódy:
Testované látky sa aplikovali na 24-hodinový biofilm v jamkách mikrotitračnej platničky; po 20-minútovej expozícii a premytí jamiek sa životnosť mikroorganizmov zisťovala následnou 24-hodinovou kultiváciou v čerstvo pridanom kultivačnom médiu. Tvorba biofilmu sa konfirmovala v paralelnej mikrotitračnej platničke a intenzita vytvoreného biofilmu sa stanovila po jeho zafarbení kryštálovou violeťou spektrofotometricky pri 570 nm.Výsledky:
Všetky štyri testované dezinfekčné látky inaktivovali mikroorganizmy v biofilme všetkých kmeňov S. aureus, E. coli, C. albicans, C. krusei a C. glabrata bez ohľadu na intenzitu jeho tvorby. Tri kmene C. tropicalis, tvoriace biofilm veľmi intenzívne, si čiastočne zachovali schopnosť rastu po pôsobení chlórhexidínu a jódpovidónu a 2 kmene po pôsobení oktenidínu. Superoxidovaná voda neovplyvnila vitalitu kvasiniek v masívnom biofilme 1 kmeňa C. tropicalis a mala len čiastočný efekt v prípade ďalších 2 kmeňov.Závery:
Testované dezinfekčné látky preukázali in vitro aktivitu na biofilmovú formu rastu všetkých sledovaných mikroorganizmov z katétrových infekcií okrem troch kmeňov C. tropicalis s intenzívnou tvorbou biofilmu. Najúčinnejšou dezinfekčnou látkou v štúdii bol oktenidín. Získané výsledky umožňujú predpokladať, že testované dezinfekčné látky budú u pacientov inaktivovať nielen samostatné mikroorganizmy, ktoré nie sú chránené biofilmom, ale aj mikroorganizmy v lokálne dostupnom biofilme na povrchu katétrov. Problémom zostávajú kmene C. tropicalis, tvoriace na umelých povrchoch hrubú vrstvu biofilmu, ktorá ich čiastočne chráni pred účinkami dezinfekčných látok, testovaných v tejto práci.Kľúčové slová:
dezinfekčné prípravky – biofilm – Staphylococcus aureus – Escherichia coli – Candida sp. – katétrové infekcieÚVOD
Čoraz častejšie používanie zdravotníckych pomôcok implantovaných, alebo inzertovaných do organizmu pacienta má za následok zvyšovanie počtu infekcií spojených s prítomnosťou cudzieho telesa a vznikom mikrobiálneho biofilmu [1]. Organizované spoločenstvo mikroorganizmov v biofilme je v porovnaní s ich planktonickou formou rezistentnejšie voči imunitným reakciám hostiteľa aj voči antimikrobiálnym látkam. Mikroorganizmy tu môžu mať zmenenú metabolickú aktivitu, vykazovať odlišné fenotypové vlastnosti, môžu sa pomalšie množiť, dostať sa do stacionárnej fázy rastu a môžu vznikať perzistujúce formy, mimoriadne odolné voči antibiotickej terapii [2, 3, 4]. Infekcie spojené s prítomnosťou cudzieho telesa predstavujú z týchto dôvodov ohnisko, z ktorého môžu mikroorganizmy uniknúť, dostať sa do krvi a zapríčiniť sepsu, alebo vytvoriť metastázujúce infekčné ložiská [1, 5].
Rezervoár mikroorganizmov, vyvolávajúcich infekcie spojené s cudzím telesom, je prevažne endogénny (mikroflóra kože a slizníc) [6]. Patria sem v prvom rade koaguláza-negatívne stafylokoky a Staphylococcus aureus [1, 5, 6]. Rastie aj význam kvasiniek z rodu Candida, v prvom rade u pacientov so zníženou imunitou [6, 7], ale aj nemocničných polyrezistentných gramnegatívnych paličiek [1, 6, 8, 9]. Dôležitú úlohu pri prevencii infekcií spojených s cudzím telesom majú predovšetkým správne ošetrovateľské techniky, vrátane účinnej dezinfekcie kože, slizníc a rán [6, 10, 11]. V súčasnosti je k dispozícii široká škála dezinfekčných prípravkov. Tieto preparáty majú mať dostatočne široké spektrum a majú mať cídne pôsobenie. Ďalším benefitom má byť ich pôsobenie na mikroorganizmy v biofilme, vďaka ktorému by dokázali likvidovať aj už vytvorený biofilm, minimálne v jeho skorších fázach vývoja.
K dezinfekčným prípravkom, ktoré sa už mnoho rokov používajú v zdravotníctve na dezinfekciu kože, rán a slizníc, patrí jódpovidon a chlórhexidín [12, 13, 14]. Jódpovidon patrí medzi organické zlúčeniny jódu, kde je jód (mikrobicídny komponent) viazaný na syntetický organický polymér polyvinylpyrolidón. Jeho antimikrobiálna aktivita sa zakladá na substitúcii kovalentne viazaného vodíka v molekulách obsahujúcich -OH, -NH, -SH alebo -CH skupiny jódom, ktorý je postupne uvoľňovaný z organického nosiča [13]. Chlórhexidín je syntetický kationický bis-guanid, ktorý sa elektrostaticky viaže na negatívne nabité miesta na povrchu mikroorganizmov. Poškodzuje osmotickú stabilitu cytoplazmatickej membrány s následným uvoľňovaním intracelulárneho obsahu a po prieniku do cytoplazmy precipituje a koaguluje proteíny, pravdepodobne následkom vzniku krížových väzieb [14].
Medzi novšie preparáty používané na dezinfekciu kože, slizníc a rán patrí oktenidín a superoxidovaná voda [15, 16]. Oktenidín dihydrochlorid [N,N'-(1,10 decanediyldi-1[4H]-pyridinyl-4-ylidén)bis(1-octanamín)dihydrochlorid] patrí medzi bipyridíny a dvoma kationickými aktívnymi centrami. Táto amfipatická molekula má mikrobicídny účinok založený na interakcii s bunkovou stenou a lipidickými membránami mikroorganizmov. V preparáte Octenisept® sa oktenidín nachádza v 0,1% koncentrácii v 2 % fenoxyetanole, ktorý slúži ako prezervačné činidlo a predpokladá sa, že má aj synergistický antimikrobiálny účinok [15, 17].
Superoxidovaná voda vzniká elektrolýzou vody obsahujúcej nízke koncentrácie NaCl (1–2 % roztoky). Výsledkom elektrolýzy sú reaktívne zlúčeniny chlóru (HClO, NaOCl,ClO2) prítomné v nízkych koncentráciách, ktoré poškodzujú mikroorganizmy oxidačnými procesmi. Roztok nemá korozívne účinky a je netoxický pre biologické systémy [16, 18].
Cieľom našej štúdie bolo overenie aktivity chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilm kmeňov Staphylococcus aureus, Escherichia coli a Candida sp., izolovaných z intravenóznych, ranových a odsávacích katétrov od pacientov s infekciami spojenými s prítomnosťou katétra.
MATERIÁL A METÓDY
Testované mikrobiálne kmene a ich charakteristika
Do štúdie sa zaradilo 16 klinických a 2 zbierkové kmene S. aureus (tab. 1), 12 klinických a 1 zbierkový kmeň E. coli (tab. 2) a 12 klinických a 1 zbierkový kmeň kandíd (tab. 3). Klinické kmene sa izolovali z materiálov pacientov Univerzitnej nemocnice v Bratislave a identifikovali sa štandardnými laboratórnymi postupmi [19]. Zbierkové kmene pochádzajú z Českej zbierky mikroorganizmov. Rezistencia stafylokokov na meticlín/oxacilín sa testovala skríningovou metódou podľa EUCAST [20] a konfirmovala detekciou PBP2a latexovou aglutinačnou metódou (OXOID, Veľká Británia). Tvorba betalaktamáz s rozšíreným spektrom sa zisťovala diskovou difúznou metódou a dilučnou metódou podľa kritérií EUCAST [20].
Tab. 1. Aktivita chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilmovú formu rastu kmeňov Staphylococcus aureus z katétrových infekcií Table 1. Aktivita chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilmovú formu rastu kmeňov Staphylococcus aureus z katétrových infekcií 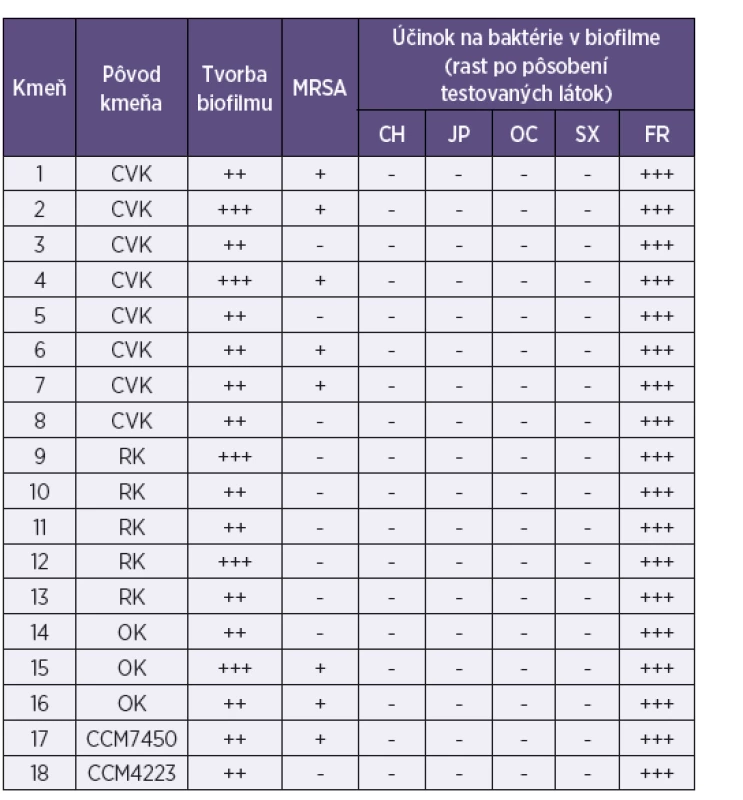
Legenda: MRSA – S. aureus rezistentný na meticilín/oxacilín; CH – chlórhexidín; JP – jódpovidon; OC – oktenidín; SX – superoxidovaná voda; FR – fyziologický roztok; CVK – centrálny venózny katéter; RK – ranový katéter; OK – odsávací katéter; Tvorba biofilmu: + slabá, ++ priemerná, +++ intenzívna; Rast mikroorganizmov: – neprítomný, + stopy rastu, ++ prítomný, +++ masívny Legenda: MRSA – S. aureus rezistentný na meticilín/oxacilín; CH – chlórhexidín; JP – jódpovidon; OC – oktenidín; SX – superoxidovaná voda; FR – fyziologický roztok; CVK – centrálny venózny katéter; RK – ranový katéter; OK – odsávací katéter; Tvorba biofilmu: + slabá, ++ priemerná, +++ intenzívna; Rast mikroorganizmov: – neprítomný, + stopy rastu, ++ prítomný, +++ masívny Tab. 2. Aktivita chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilmovú formu rastu kmeňov Escherichia coli z katétrových infekcií Table 2. Aktivita chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilmovú formu rastu kmeňov Escherichia coli z katétrových infekcií 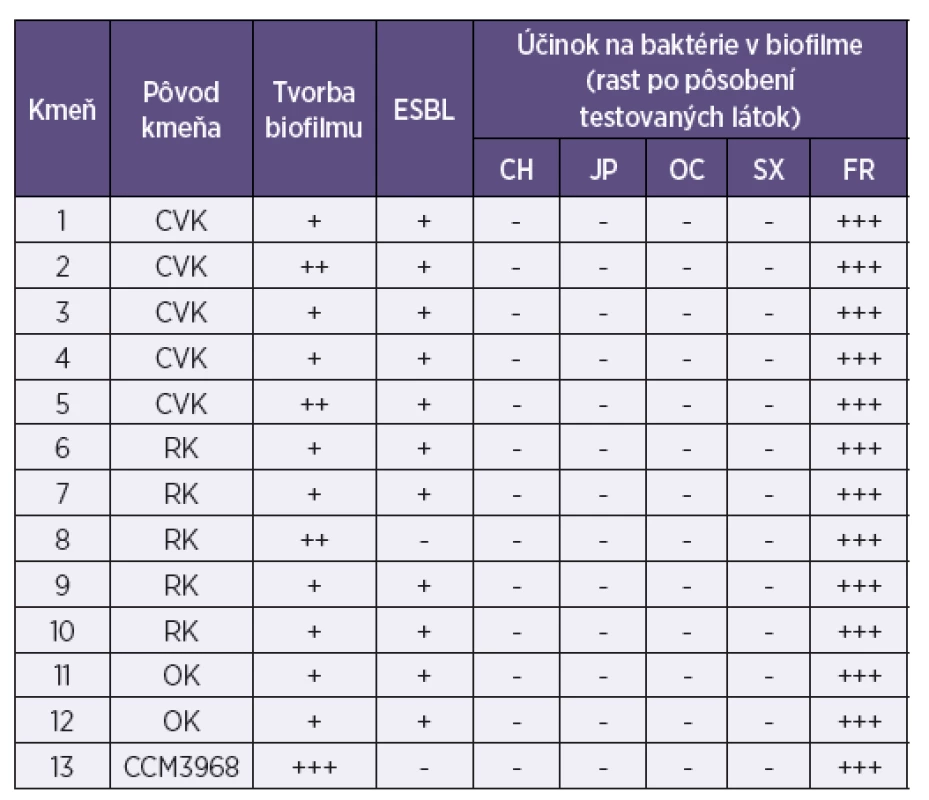
Legenda: ESBL – tvorba betalaktamáz s rozšíreným spektrom; CH – chlórhexidín; JP – jódpovidon; OC – oktenidín; SX – superoxidovaná voda; FR – fyziologický roztok; CVK – centrálny venózny katéter; RK – ranový katéter; OK – odsávací katéter; Tvorba biofilmu: + slabá, ++ priemerná, +++ intenzívna; Rast mikroorganizmov: -neprítomný, + stopy rastu ,++ prítomný, +++ masívny Legenda: ESBL – tvorba betalaktamáz s rozšíreným spektrom; CH – chlórhexidín; JP – jódpovidon; OC – oktenidín; SX – superoxidovaná voda; FR – fyziologický roztok; CVK – centrálny venózny katéter; RK – ranový katéter; OK – odsávací katéter; Tvorba biofilmu: + slabá, ++ priemerná, +++ intenzívna; Rast mikroorganizmov: -neprítomný, + stopy rastu ,++ prítomný, +++ masívny Tab. 3. Aktivita chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilmovú formu rastu kmeňov Candida sp. z katétrových infekcií Table 3. Aktivita chlórhexidínu, jódpovidonu, oktenidínu a superoxidovanej vody na biofilmovú formu rastu kmeňov Candida sp. z katétrových infekcií 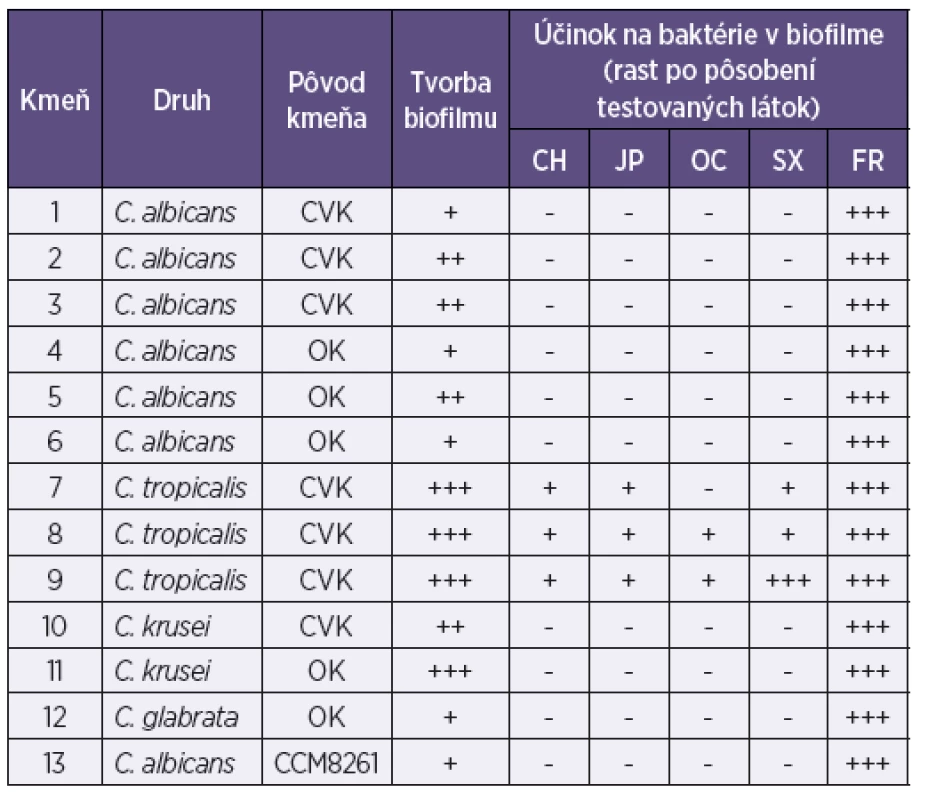
Legenda: CH – chlórhexidín; JP – jódpovidon; OC – oktenidín; SX – superoxidovaná voda; FR – fyziologický roztok; CVK – centrálny venózny katéter; RK – ranový katéter; OK – odsávací katéter; Tvorba biofilmu: + slabá, ++ priemerná, +++ intenzívna; Rast mikroorganizmov: -neprítomný, + stopy rastu, ++ prítomný, +++ masívny Legenda: CH – chlórhexidín; JP – jódpovidon; OC – oktenidín; SX – superoxidovaná voda; FR – fyziologický roztok; CVK – centrálny venózny katéter; RK – ranový katéter; OK – odsávací katéter; Tvorba biofilmu: + slabá, ++ priemerná, +++ intenzívna; Rast mikroorganizmov: -neprítomný, + stopy rastu, ++ prítomný, +++ masívny Testované dezinfekčné prípravky
Otestoval sa vplyv štyroch dezinfekčných látok, určených na dezinfekciu kože, slizníc a rán: chlórhexidín diglukonátu (Sigma Aldrich) pripraveného v 2% koncentrácii (Nemocničná lekáreň); jódpovidonu v koncentrácii 100 mg/ml, čo zodpovedá 10 mg/ml voľného aktívneho jódu (Betadine®, EGIS PHARMACEUTICALS PLC Budapešť v licencii IMUNOPHARMA AG-Bazilej); oktenidín dihydrochloridu v 0,1 % koncentrácii v 2% fenoxyetanole (Octenisept®, Schülke & Mayr) a superoxidovanej vody vo forme prípravku Aquitox® – D (Polopharma), ktorý obsahuje < 0,03 % HClO; < 0,03 % NaOCl; 0,0001 % ClO2 a 0,1 % NaCl [16]. Dezinfekčné prípravky sa neriedili a ich konečná koncentrácia vo vzorkách zodpovedala koncentráciám uvedeným vyššie.
Postup testovania
V jamkách mikrotitračných doštičiek typu P sterilizovaných gama žiarením (ROLL, sas, Piove di Sacco) sa pripravil 24-hodinový biofilm kmeňov S. aureus a E. coli v tryptózovom sójovom bujóne (OXOID) s 1 % glukózy podľa Stepanoviča et al. [21] a 24-hodinový kandidový biofilm v Sabouraudovom bujóne (Imuna) s 8 % glukózy podľa Růžičku et al. [22]. Inokulum pre formovanie biofilmu sa v prípade baktérií zhotovilo z 18–24-hodinových kultúr na krvnom agare. Najprv sa pripravila bakteriálna suspenzia zodpovedajúca stupňu 0,5 McFarlandovej zákalovej stupnice, ktorá sa zriedila 1 : 100 v testovacom médiu pre baktérie; z tejto suspenzie sa aplikovalo do jamiek mikrotitračnej doštičky po 200 µl [21]. V prípade kvasiniek sa zo 48-hodinovej kultúry na Sabouraudovom agare pripravila suspenzia zodpovedajúca stupňu 3 McFarlandovej zákalovej stupnice, z ktorej sa po zriedení 1 : 100 v testovacom médiu pre kvasinky prenieslo do jednotlivých jamiek mikrotitračnej doštičky po 200 µl [22]. Po 24-hodinovej kultivácii sa voľné bunky odstránili premytím sterilným PBS a pridali sa testované dezinfekčné prípravky v objeme 240 µl na jamku. Negatívnou kontrolou bol fyziologický roztok. Po 20-minútovom pôsobení testovaných dezinfekčných prípravkov pri laboratórnej teplote a opätovnom premytí jamiek sterilným PBS sa pridalo príslušné čerstvé kultivačné médium a neinaktivované mikroorganizmy sa detegovali ďalšou kultiváciou [23]. Rast mikroorganizmov sa vyhodnotil vizuálne na druhý deň a porovnával sa s kontrolnou vzorkou, na ktorú pôsobil namiesto testovaného dezinfekčného prípravku fyziologický roztok. Intenzita rastu sa vyjadrila semikvantitatívne ako neprítomný rast, stopy rastu, prítomný rast a masívny rast. Tvorba biofilmu sa potvrdila v paralelnej mikrotitračnej doštičke a intenzita vytvoreného biofilmu sa stanovila po jeho zafarbení kryštálovou violeťou [21, 22] spektrofotometricky pri 570 nm (MRX Microplate Reader, Dynex). Každá vzorka sa testovala v troch paralelných jamkách.
VÝSLEDKY
Zo 16 testovaných klinických kmeňov S. aureus bolo 7 kmeňov rezistentných na meticilín/oxacilín. Päť kmeňov sa vyznačovalo intenzívnou tvorbou biofilmu; ostatné boli priemernými producentmi biofilmu (viď tab. 1). Z 12 testovaných klinických kmeňov E. coli iba jeden netvoril betalaktamázu s rozšíreným spektrom účinku. Tri kmene boli priemernými producentmi biofilmu a ostatné tvorili biofilm len so slabou intenzitou (viď tab. 2). Zo 6 kmeňov C. albicans 3 tvorili biofilm s priemernou intenzitou a 3 iba slabo; všetky 3 kmene C. tropicalis tvorili biofilm veľmi intenzívne, podobne ako jeden z dvoch kmeňov C. krusei. Druhý kmeň C. krusei tvoril biofilm s priemernou intenzitou. Jediný kmeň C. glabrata zaradený do štúdie tvoril biofilm so slabou intenzitou (viď tab. 3).
Všetky štyri testované dezinfekčné prostriedky inaktivovali baktérie v biofilme všetkých kmeňov S. aureus, E. coli a väčšiny kmeňov kandíd bez ohľadu na intenzitu jeho tvorby (viď tab. 1, 2). Tri kmene C. tropicalis, tvoriace biofilm veľmi intenzívne, si čiastočne zachovali schopnosť rastu po pôsobení chlórhexidínu a jódpovidónu, dva kmene po pôsobení oktenidínu, dva kmene po pôsobení superoxidovanej vody a úplnú vitalitu si zachoval jeden kmeň C. tropicalis po účinku superoxidovanej vody (viď tab. 3).
DISKUSIA
Jódpovidon a chlórhexidín sa vybrali do štúdie ako referenčné antiseptiká, ktorých antimikróbna účinnosť je overená dlhoročnou klinickou praxou, pričom chlórhexidín sa môže používať aj u pacientov alergických na jód [12, 13, 14]. Oktenidín a superoxidovaná voda sú novšie, a preto v súčasnosti menej využívané antiseptiká. Oktenidín v prípravku Octenisept® je podľa výrobcu určený na dezinfekciu kože, slizníc a rán (vrátane operačných, chronických a popáleninových), a vlhké krytie rán, podobne ako Aquitox®. Oba prípravky sú deklarované výrobcami ako netoxické a nedráždivé [15, 16]. Koncentrácie jódpovidonu, oktenidínu a aktívnych zložiek superoxidovanej vody stanovili výrobcovia testovaných preparátov. V prípade chlórhexidínu sa na základe údajov v literatúre a v súlade s klinickou praxou volil 2% roztok, ktorý sa používa pri dezinfekcii okolia miesta inzercie katétrov [6, 11]. Expozičný čas sa stanovil na 20 minút, pretože je známa vyššia rezistencia biofilmu na pôsobenie vonkajších faktorov v porovnaní s planktonickou formou rastu a dlhšie expozičné časy je možné využívať aj v klinickej praxi pri ošetrovaní miesta inzercie katétrov [6, 11, 24].
I keď sa v literatúre vyskytuje viacero údajov o antimikrobiálnej aktivite nami testovaných dezinfekčných prípravkov na planktonickú formu mikroorganizmov, údajov o ich pôsobení na mikroorganizmy v biofilme je menej. Najčastejšie sa sledovala ich aktivita na biofilmovú formu rastu v súvislosti s biofilmom v stomatologickej praxi [25, 26, 27], prívodov vody v zubárskych ambulanciách [28], na povrchu lekárskych prístrojov [18], alebo v potravinárskom priemysle [29].
Niektoré práce sa zamerali na testovanie účinku dezinfekčných prípravkov na baktérie v biofilme v podobnom modeli, ako sa použil v našej štúdii [30, 31]. Detekcia vitality baktérií v biofilme po pôsobení dezinfekčných prípravkov sa však uskutočnila metabolickým testom tetrazóliovou soľou, elektrónovým mikroskopom, alebo kultiváciou mikroorganizmov uvoľnených z biofilmu ultrazvukom [31], prípadne sa zmerala optická denzita biofilmov bezprostredne po pôsobení dezinfekčných prípravkov [30]. V našich testoch sa životaschopnosť mikroorganizmov zisťovala 24-hodinovou kultiváciou v médiu bez antimikrobiálnych látok, ktorú sme považovali za citlivejšiu.
Podľa výsledkov doteraz publikovaných štúdií sa účinok dezinfekčných preparátov na 24-hodinový alebo ešte starší biofilm vytvorený mikroorganizmami s intenzívnou tvorbou biofilmu obvykle prejavil až po dlhšom pôsobení. Chlórhexidín mal v modeli zubného plaku lepšiu aktivitu na mladý biofilm než na úplne vyzretý biofilm s obmedzeným množstvom živín [25] a malá časť populácie Candida spp. v zubnom plaku bola schopná prežiť pulznú expozíciu chlórhexidínu [32]. Superoxidovaná voda, oktenidín, jódpovidon aj chlórhexidín preukázali väčší, alebo menší účinok na viacero baktérií v biofilmovej forme rastu (Pseudomonas aeruginosa, stafylokoky, enterokoky, anaeróbne baktérie orálnej flóry, listérie [18, 25, 26, 27, 28, 29, 30, 31]. V našej štúdii preukázali tieto dezinfekčné prípravky výbornú in vitro aktivitu proti biofilmovej forme rastu všetkých testovaných klinických kmeňov S. aureus, E. coli a väčšiny kmeňov kandíd (C. albicans, C. krusei a C. glabrata). Výnimkou boli kmene C. tropicalis, kvasinky, ktorá je druhým až tretím najčastejším pôvodcom kandidémie [33]. I keď tvorba biofilmu je aj u kvasiniek závislá od vlastností jednotlivých kmeňov a faktorov prostredia, tento druh vykazuje v porovnaní s ostatnými druhmi kandíd niektoré odlišnosti. Je výborne vybavený adhezínmi [34], po iniciálnej adhézii tvorí mikrokolónie a v nutrične bohatých médiách tvorí masívny biofilm zložený z kvasinkovitých aj vláknitých foriem bez bazálnej vrstvy blastospór s matrixom odlišného chemického zloženia a odlišných fyzikálno-chemických vlastností ako C. albicans, C. krusei a C. glabrata, a tento biofilm úspešne vytvára na viacerých typoch abiotických povrchov aj počas statickej kultivácie [35, 36, 37]. Na konečný výsledok interakcie s testovanými dezinfekčnými prípravkami mohli preto okrem veľkej hrúbky biofilmu vytvoreného našimi klinickými kmeňmi C. tropicalis na polystyrénovom povrchu jamiek mikrotitračnej doštičky vplývať aj uvedené vlastnosti.
ZÁVERY
Testované dezinfekčné prípravky eradikovali v in vitro testoch mikroorganizmy v biofilmovej forme rastu v prípade všetkých sledovaných kmeňov S. aureus, E. coli, C. albicans, C. krusei a C. glabrata z katétrových infekcií. Najúčinnejším dezinfekčným prípravkom v štúdii bol oktenidín. Najväčšiu odolnosť voči testovaným dezinfekčným prípravkom preukázali kmene C. tropicalis s intenzívnou tvorbou biofilmu.
V našej štúdii sme použili 24-hodinový biofilm na stenách jamiek polystyrénových mikrotitračných doštičiek. Podobný biofilm sa tvorí aj na povrchu katétrov, použitých v organizme pacienta. Na základe našich výsledkov predpokladáme, že nami testované dezinfekčné prostriedky budú u pacientov inaktivovať nielen samostatné mikroorganizmy, ktoré nie sú chránené biofilmom, ale aj lokálne dostupný biofilm na povrchu katétrov. Problémom zostávajú kmene C. tropicalis, tvoriace na umelých povrchoch hrubú vrstvu biofilmu, ktorá ich čiastočne chráni pred účinkami dezinfekčných prípravkov, testovaných v tejto práci.
Poďakovanie
Projekt bol finančne podporený grantom MŠ SR VEGA 1/0564/11
Autori vyslovujú úprimné poďakovanie pani Viere Augustovičovej a pani Gizele Skýpalovej za technickú spoluprácu.
Do redakce došlo dne 17. 2. 2014.
Adresa pro korespondenci:
RNDr. Lívia Slobodníková, CSc.
Mikrobiologický ústav LF UK a UNB
Sasinkova 4
811 08 Bratislava
Slovenská Republika
e-mail: livia.slobodnikova@fmed.uniba.sk
Zdroje
1. Donlan RM. Biofilms and device-associated infections. Emerg Infect Dis, 2001;7 : 277–281.
2. Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev, 2002;15 : 167–193.
3. Leid JG. Bacterial biofilms resist key host defenses. Microbe, 2009;4 : 66–70.
4. Kotulová D, Slobodníková L. Citlivosť kmeňov Staphylococcus aureus rastúcich v biofilme na vankomycín, gentamicín a rifampicín. Epidemiol Mikrobiol Imunol, 2010;59 : 80–87.
5. Cramton SE, Götz F. Biofilm development in Staphylococcus in: Ghannoun M, O`Toole GA (eds) Microbial biofilms, Washington, DC: ASM Press, 2004, 64–84. ISBN 1-55581-294-295.
6. Abad CL, Safdar N. Catheter-related bloodstream infections. Infectious disease special edition, 2011 : 84–98 [online] [cit. 2014-22-01]. Dostupný na: www.idse.net/download/BSI_IDSE11_WM.pdf
7. Dominic RM, Shenoy S, Baliga S. Candida biofilms in medical devices: Evolving trends. Kathmandu Univ Med J, 2007;5 : 431–436.
8. Holá V, Růžička F. Biofilmové infekce močových katétrů. Epidemiol Mikrobiol Imunol, 2008;57 : 47–52.
9. Olejníčková K, Holá V. Porovnání produkce vybraných faktorů virulence Pseudomonas aeruginosa izolovaných z katétrů. Epidemiol Mikrobiol Imunol, 2012;61 : 21–28.
10. Longmate AG, Ellis KE, Boyle L, Maher S, et al. Elimination of central-venous-catheter-related infections from the intensive care unit. BMJ Qual Saf, 2011;20 : 174–180.
11. O’Grady NP, Alexander M, Burns LA, Dellinger P, et al. Guidelines for the prevention of intravascular catheter-related infections, 2011. Atlanta (GA): Centers for Disease Control and Prevention (CDC); 2011, 83 s.[online] [cit. 2014-22-01]. Dostupný na http://www.cdc.gov/hicpac/pdf/guidelines/bsi-guidelines-2011.pdf
12. Kováč J, Kováč D. Mikrobiálna dekontaminácia koreňových kanálikov devitálnych zubov. Epidemiol Mikrobiol Imunol, 2012;61 : 87–97.
13. Sunil KP, Raja BP, Jagadish RG, Uttam A. Povidone Iodine -Revisited. Indian J Dent Advancements, 2011;3 : 617–620.
14. McDonnell G, Russell AD. Antiseptics and disinfectants: activity, action and resistance. Clin Microbiol Rev, 1999;12 : 147–179.
15. Octenidine dihydrochloride. A new topical antimicrobial for local treatment of skin, mucous membranes and wounds [online] [cit. 2014-16-01]. Dostupný na www.oktal_pharma.hr/hr/zastupstva/file/421/603/
16. Aquitox D - ošetrenie rán [online] [cit. 2014-16-01]. Dostupný na http://www.aquasystem.sk/stranky/3.Aqvitox_D___Osetrenie_ran).
17. Hübner NO, Siebert J, Kramer A. Octenidine dihydrochloride, a modern antiseptic for skin, mucous membranes and wounds. Skin Pharmacol Physiol, 2010;23 : 244–258.
18. Thorn RM, Lee SW, Robinson GM, Greenman J, Reynolds DM. Electrochemically activated solutions: evidence for antimicrobial efficacy and applications in healthcare environments. Eur J Clin Microbiol Infect Dis, 2012;31 : 641–653.
19. Murray PR, et al. Manual of clinical microbiology. 9th ed., Washington, DC: American Society for Microbiology, 2007, 1267 s. ISBN 1-555581-371-2
20. EUCAST guideline for the detection of resistance mechanisms and specific resistances of clinical and/or epidemiological importance [online] [cit. 2014-16-01]. Dostupný na http://www.eucast.org/resistance_mechanisms/
21. Stepanovic S, Vukovic D, Hola V, di Bona Ventura G, et al. Quantification of biofilm in microtiter plates: overview of testing conditions and practical recommendations for assessment of biofilm production by staphylococci. Acta Pathol Microbiol Imunol Scand [B], 2007;115 : 891–899.
22. Růžička F, Holá V, Votava M, Tejkalová R. Detekce a význam tvorby biofilmu u kvasinek izolovaných z hemokultur. Klin Mikrobiol Inf Lek, 2006;12 : 150–153.
23. Černohorská L, Votava M. Determination of minimal regrowth concentration (MRC) in clinical isolates of various biofilm-forming bacteria. Folia Microbiol, 2004;49 : 75–78.
24. Timsit JF, Schwebel C, Bouadma L, Geffroy A, et al. Chlorhexidine-impregnated sponges and less frequent dressing changes for prevention of catheter-related infections in critically ill adults: a randomized controlled trial. JAMA, 2009;301 : 231–241.
25. Shen Y, Stojicic S, Haapasalo M. Antimicrobial efficacy of chlorhexidine against bacteria in biofilms at different stages of development. Journal of Endodontics, 2011;37 : 657–661.
26. Murad CF, Sassone LM, Souza MC, Fidel RAS, et al. Antimicrobial activity of sodium hypochlorite, chlorhexidine and MTAD® against Enterococcus faecalis biofilm on human dentin matrix in vitro. RSBO, 2012;9 : 143–150.
27. Torres-Capetillo E, Carrillo-Fuentevilla R, De la Garza-Ramos MA, Hernández RM, et al. Antimicrobial efficacy of neutral super-oxidized electrolyzed gel versus chlorhexidine digluconate 0.12% in biofilm formation on orthodontic miniimplants: An in vitro study. J Pharmacognosy Phytother, 2013;5 : 64–71.
28. Walker JT, Bradshaw, DJ, Fulford, MR, Marsh, PD. Microbiological evaluation of a range of disinfectant products to control mixed-species biofilm contamination in a laboratory model of a dental unit water system. Appl Environ Microbiol, 2003;69 : 3327–3332.
29. Amalaradjou MA, Norris CE, Venkitanarayanan K. Effect of octenidine hydrochloride on planktonic cells and biofilms of Listeria monocytogenes. Appl Environ Microbiol, 2009;75 : 4089–4092.
30. Presterl E, Suchomel M, Eder M, Reichmann S, et al. Effects of alcohols, povidone-iodine and hydrogen peroxide on biofilms of Staphylococcus epidermidis. J Antimicrob Chemother, 2007;60 : 417–420.
31. Junka A, Bartoszewicz M, Smutnicka D, Secewicz A, Szymczyk P. Efficacy of antiseptics containing povidone-iodine, octenidine dihydrochloride and ethacridine lactate against biofilm formed by Pseudomonas aeruginosa and Staphylococcus aureus measured with the novel biofilm-oriented antiseptics test. Int Wound J, 2013;in press. (doi: 10.1111/iwj.12057)
32. Lamfon H, Al-Karaawi Z, McCullough M, Porter SR, Pratten J. Composition of in vitro denture plaque biofilms and susceptibility to antifungals. FEMS Microbiol Lett, 2005;242 : 345–351.
33. Kothavade RJ, Kura MM, Valand AG, Panthaki MH. Candida tropicalis: its prevalence, pathogenicity and increasing resistance to fluconazole. J Med Microbiol, 2010;59 : 873–880.
34. Hoyer LL, Fundyga R, Hecht JE, Kapteyn JC, et al. Characterization of agglutinin-like sequence genes from non-albicans Candida and phylogenetic analysis of the ALS family. Genetics, 2011;157 : 1555–1567.
35. Bizerra FC, Nakamura CV, de Poersch C, Estivalet Svidzinski TI, et al. Characteristics of biofilm formation by Candida tropicalis and antifungal resistance. FEMS Yeast Res, 2008;8 : 442–450.
36. Silva S, Negri M, Henriques M, Oliveira R, et al. Adherence and biofilm formation of non-Candida albicans Candida species. Trends Microbiol, 2011;19 : 241–247.
37. Al-Fattani MA, Douglas LJ. Biofilm matrix of Candida albicans and Candida tropicalis: chemical composition and role in drug resistance. J Med Microbiol, 2006;55 : 999–1008.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2014 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Věnování doc. MUDr. Heleně Hupkové, Ph.D. in memoriam
- Klinická a mikrobiologická charakteristika závažných infekcií spôsobených streptokokmi skupiny A
- Vplyv prípravkov určených na dezinfekciu kože, slizníc a rán na životaschopnosť biofilmovej formy rastu mikroorganizmov izolovaných od pacientov s katétrovými infekciami
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Rezistence k erytromycinu, ciprofloxacinu a k tetracyklinu u humánních izolátů Campylobacter spp. v České republice, vyšetřená standardní metodou EUCAST
- Výskyt a vlastnosti baktérií Staphylococcus aureus ve vepřovém mase
- Identifikace izolátů Mycobacterium spp. pomocí MALDI-TOF hmotnostní spektrometrie
- Profesionálna TBC na Slovensku a v Českej republike
- Infekce vyvoláné lidskými alfa herpetickými viry
- Protikladný vývoj trendů incidence kapavky a syfilis ve východočeském regionu – 30 let surveillance
- Avidita antifosfolipidových protilátek – naše současné znalosti
- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Výskyt a charakteristika termotolerantních kampylobakterů v potravinovém řetězci člověka
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
- Význam očkování proti chřipce u osob s kardiovaskulárním onemocněním
- Zhodnocení významu ready-made spaceru s gentamicinem ve vztahu k bakteriologickým nálezům u pacientů s infekcí kloubní náhrady
- Q-horečka jako profesionální onemocnění vedoucí k invaliditě – kazuistika
- Návrat spalniček do Ústeckého kraje
- Vzpomínka na nedožité 90. narozeniny MUDr. Miroslava Přívory, CSc.
- Vzpomínka na nedožité 90. narozeniny prof. MUDr. Bohumila Ticháčka, DrSc.
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný pohled na diagnostiku a léčbu amébózy ve světle vlastní kazuistické zkušenosti
- Infekce vyvoláné lidskými alfa herpetickými viry
- Enterohemoragické Escherichia coli jako původci průjmu v České republice (1965–2013)
- Real time RT-PCR panel pro identifikaci dvanácti virů hemoragických horeček
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



