-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Syndrom toxického šoku
Toxic shock syndrome
The authors present an up-to-date review of toxic shock syndrome (TSS) – a life-threatening condition where toxins of the Gram-positive bacteria Staphyloccocus aureus and Streptococcus pyogenes play a key role in the pathogenesis. The authors provide insight into the epidemiology and pathogenesis of the disease and point out the relevant patient history data and clinical signs and symptoms that may indicate progression of TSS. Last but not least, the state of the art diagnostic and therapeutic approaches to early and full blown TSS are summarized. Case reports are presented to illustrate two different etiological forms of this relatively rare nosological entity.
Keywords:
toxic shock syndrome – toxigenic strain – toxin – superantigen
Autoři: T. Tyll 1; M. Bílková 1; A. Revinová 1; M. Müller 1
; M. Čurdová 2; M. Zlámal 3; M. Holub 3
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 1; Oddělení klinické mikrobiologie, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 2; Klinika infekčních nemocí, 1. LF UK a Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 4, s. 210-220
Kategorie: Souhrnné sdělení
Souhrn
Autory je předložen přehled aktuálně dostupných informací o syndromu toxického šoku (TSS – toxic shock syndrome) – život ohrožujícím onemocnění, v jehož patogenezi sehrávají klíčovou úlohu toxiny grampozitivních bakterií Staphylococcus aureus a Streptococcus pyogenes. Autoři se věnují epidemiologii a patogenezi onemocnění, upozorňují na důležitá anamnestická data i klinické známky, které by mohly na rozvoj TSS poukazovat. V neposlední řadě zmiňují současný pohled na adekvátní diagnostiku a terapii v případě rozvíjejícího se či již rozvinutého syndromu. Pro názornost je referát doplněn popisem vlastních klinických případů, které demonstrují dvě etiologicky odlišné formy této poměrně vzácné nozologické jednotky.
Klíčová slova:
syndrom toxického šoku – toxigenní kmen – toxin – superantigenÚVOD
Syndrom toxického šoku (TSS, toxic shock syndrome) je život ohrožující, akutně probíhající onemocnění, které se manifestuje nespecifickými příznaky, jež mohou záhy vyústit v rozvoj syndromu multiorgánové dysfunkce (MODS, multiple organ dysfunction syndrome). Vysoká horečka, refrakterní hypotenze a promptní elevace zánětlivých parametrů zpočátku imitují septický šok. Na možnost TSS nás mohou upozornit symptomy, které v případě šoku septického většinou nepozorujeme – skarlatiniformní exantém, olupování pokožky na ploskách a dlaních, průjem, zvracení, těžká myalgie či neurologické abnormality.
Příčinou onemocnění je produkce toxinů toxigenními kmeny Staphylococcus aureus (TSST-1 a/nebo stafylokokové enterotoxiny, především A, B, C a D) a Streptococcus pyogenes (pyrogenní exotoxin) při infekci či kolonizaci hostitele. Při kolonizaci dochází k průniku těchto toxinů do oběhu a u pacientů, kteří nemají vytvořené protektivní protilátky, vzniká systémová zánětlivá odpověď organismu s charakteristickými poruchami mikrocirkulace a rozvojem klinických známek hypoperfuze orgánů nebo i šokového stavu. Reakce organismu je o to bouřlivější, že bakteriální toxiny působí jako superantigeny. Oproti konvenčním antigenům působí změny v organismu rychleji, jelikož nejsou předem zpracovávány antigen-prezentujícími buňkami, a navíc mají za následek masivnější aktivaci T-lymfocytů (5–30 % populace T lymfocytů, oproti 0,01–0,1 % u konvenčního antigenu) [1]. Tato hyperaktivace vede k dysregulované a nadměrné produkci cytokinů, které jsou vlastním mediátorem efektu bakteriálních toxinů.
Poprvé byl TSS popsán v roce 1978 americkým pediatrem Jamesem Toddem, který zaznamenal sedm případů onemocnění u dětí. Popsal charakteristický příznakový soubor zahrnující horečku, vyrážku, zmatenost, průjem až rozvoj šoku a u přeživších charakteristické olupování kůže dlaní, chodidel a trupu [2]. Případy spojil s infekcí zlatým stafylokokem produkujícím do té doby neznámý toxin, který byl v roce 1984 označen jako TSST-1 (toxic shock syndrome toxin 1). Další formy tohoto onemocnění byly v 80. letech minulého století pozorovány u menstruujících žen užívajících vysokoabsorpční tampóny [3–5]. U většiny z nich byl též vykultivován S. aureus. Již v té době se ale začaly vyskytovat případy TSS u pacientů bez souvislosti s menstruací. Došlo tedy k rozlišení menstruální a nemenstruální formy TSS a posléze i k popisu streptokokové formy syndromu toxického šoku, a to v roce 1987 Conem [6].
EPIDEMIOLOGIE
TSS je nozologickou jednotkou poměrně vzácnou. V ČR bylo v období 1983–2014 Národní referenční laboratoří pro stafylokoky (NRL) zaznamenáno 190 případů, z toho u 62 se jednalo o menstruální formu [Petráš P., osobní sdělení]. Podle databáze EPIDAT se počet nahlášených případů v ČR v období 2004–2014 pohybuje mezi 0 a 13 případy za rok (tab. 1) [7].
Tab. 1. Absolutní počet diagnostikovaných případů TSS v ČR v jednotlivých letech 2004–2014 Table 1. Absolute numbers of TSS cases diagnosed annually in the Czech Republic in 2004–2014 
Zdroje: EPIDAT – Infekce v České republice, 2015 (RNDr. Petr Petráš, CSc., Státní zdravotní ústav – Národní referenční centrum pro stafylokoky) Sources: EPIDAT – Infections in the Czech Republic, 2015 (RNDr. Petr Petráš, CSc., National Institute of Public Health – National Reference Laboratory for Staphylococci) Vzhledem k tomu, že ve třetině až polovině případů se jedná o formu menstruální, je relativně vyšší výskyt TSS u mladých žen. Nemenstruální forma se vyskytuje u obou pohlaví rovnoměrně. V případě streptokokové formy (StrTSS) se výskyt posouvá do vyšších věkových kategorií, což souvisí i s vyšším výskytem rizikových faktorů, jakými jsou např. chirurgické výkony, diabetes mellitus, nádorová onemocnění, alkoholismus, snížení obranyschopnosti organismu ať už přirozeně, či navozené farmakologicky nebo chronickým onemocněním [1, 3].
Téměř všechny menstruální formy a polovina forem nemenstruálních je patogeneticky spojována se stafylokokovým TSST-1, a to buď samostatně, nebo v kombinaci s některým typem enterotoxinu. Zejména u nemenstruálních forem je jako původce uváděno vyšší procento kmenů produkujících některý typ enterotoxinu (druhým nejčastějším toxinem způsobujícím TSS po TSST-1 je stafylokokový enterotoxin B). Ostatní toxiny (streptokokový pyrogenní exotoxin) se uplatňují v menším počtu případů. Celosvětovou raritou je v ČR dokumentovaný menstruální TSS způsobený kmenem S. aureus s izolovanou produkcí enterotoxinu H (PCR detekce genu kódujícího produkci enterotoxinu H při současné absenci genů pro ostatní enterotoxiny i TSST-1) [8]. Objevují se i případy onemocnění způsobené bakteriemi ze skupiny non A beta hemolytických streptokoků, viridujících streptokoků, či koaguláza-negativních stafylokoků [19].
Stafylokokový syndrom toxického šoku (StafTSS) je tedy nejčastější formou TSS. Nejedná-li se o menstruální formu, která se vyvíjí v souvislosti s používáním vaginálních tampónů, může se jednat o případy vzniklé na podkladě používání bariérových kontraceptivních pomůcek, pooperační či poporodní rané infekce, fokální kožní či podkožní léze. K TSS může dojít i v průběhu sinusitidy, osteomyelitidy, artritidy či peritonzilárního abscesu [1, 3, 10].
Streptokokový syndrom toxického šoku vzniká nejčastěji v souvislosti s rozvojem invazivních streptokokových onemocnění, především infekce měkkých tkání – nekrotizující fasciitidy, myozitidy či celulitidy. Stejně jako v případě stafylokokové formy se na jeho vzniku může podílet operační výkon. Mezi nejrizikovější operační výkony vzhledem k incidenci TSS řadíme ORL operace, např. septoplastiku, s níž je navíc spojena nosní tamponáda – jeden z rizikových faktorů onemocnění. Incidence v ORL po nosních operacích dosahuje až 16,5/100 000 výkonů [11]. Vstupní branou pro streptokoky mohou být i ostatní operační rány (s vyšší incidencí u určitých výkonů – liposukce, hysterektomie), poranění způsobená vaginálním porodem, ale i malé lokální trauma či virová infekce (varicella, influenza) [1, 3].
Mortalita onemocnění je vysoká. V případě StafTSS je udávána v rozmezí 3–8 %, u streptokokové formy (někdy též nazývané Toxic shock-like syndrome) a/nebo v případě rozvoje multiorgánového selhání se pohybuje mezi 30–70 % [1, 3].
PATOGENEZE
Zásadní úlohu v patogenezi onemocnění sehrávají toxiny, které spouštějí systémovou zánětlivou odpověď organismu, jež může rychle progredovat do MODS, který je spojen s vysokou mortalitou. V případě zlatého stafylokoka je nejvýznamnějším toxinem TSST-1. V případě streptokoka skupiny A bylo izolováno několik typů exotoxinů, nejvýznamnější v patogenezi TSS se zdá být pyrogenní exotoxin A. Jeho produkce je často spojena se skupinou streptokoků vybavených membránovým proteinem M3. M protein je u streptokoků důležitým faktorem virulence, který má antifagocytární aktivitu. Určité M typy streptokoků – M 1, 3, 12, 28 – jsou spojeny s vyšší četností StrTSS [1, 3]. Vzhledem k tomu, že dříve prováděná sérotypizace kmenů byla nahrazena genetickými metodami sekvenční typizace, setkáváme se dnes spíše s označením emm.
Toxigenní bakterie mohou způsobit manifestní infekci, nebo pouze kolonizovat pacienta. Charakteristickou vlastností těchto bakterií je produkce toxinů, které mají schopnost působit na imunitní systém jako superantigeny. Poté, co se superantigeny vstřebají do oběhu, dochází k jejich interakci s T lymfocyty. Interakci ovšem nepředchází zpracování toxinu antigen-prezentující buňkou, která by jej T-lymfocytu předkládala v komplexu s molekulami hlavního histokompatibilního komplexu II. třídy (MHC, major histocompatibility complex), jak je obvyklé v případě běžného antigenu. Superantigen se v nezměněné podobě naváže přímo na MHC II. třídy na straně jedné a na T lymfocytární receptor mimo obvyklé rozpoznávací místo na straně druhé. Superantigen tak vlastně funguje jako nespecifický bypass klasické antigenní stimulace. Důsledkem této abnormální vazby je několikanásobně silnější aktivace T lymfocytu, stimulace až 3000krát vyššího počtu T lymfocytů vedoucí k dysregulované produkci cytokinů, tzv. cytokinové bouři [1, 3]. Tento proces je zachycen na obrázku 1.
Obr. 1. Ve výřezu klasická antigenní stimulace. Zdroj autoři, malíř Jiří Hlaváček. T-lymfocyt: receptor s α, b podjednotkou; CD28 (cluster of differentiation 28) – koreceptor TSST-1 na povrchu T-lymfocytu; CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) Antigen prezentující buňka: MHC (major histocompatibility komplex) – molekula hlavního histokompatibilního komplexu II. třídy; B7 (CD80, CD86) protein antigen prezentující buňky B7 molekuly (CD80 s CD86) na aktivovaných B-buňkách a monocytech/(makrofázích) pracují v tandemu jako ligandy pro dva různé proteiny na povrchu T-buněk (CD 28 a CTLA-4). Po navázání superantigenu a stimulaci imunitní kaskády vazbou B7 na koreceptor CD28 (kostimulace je nezbytná) dochází k proliferaci lymfocytů. (Pozn. CTLA-4 je protein-receptor, který naopak downreguluje imunitní systém, působí jako off-spínač = vysílá inhibiční signál). Figure 1. Stimulation of T-cells by exotoxin (superantigen) The small figure picture in the right bottom corner: the classical antigenic stimulation. Source: authors, Jiří Hlaváček, painter. T-lymphocyte: receptor subunit a, b; CD28 (cluster of differentiation 28) – co-receptor TSST-1 on the surface of a T-lymphocyte; CTLA-4 (cytotoxic T-lymphocyte-associated protein 4). Antigen presenting cell: MHC (major histocompatibility komplex) – a molecule of MHC class II; B7 (CD80, CD86) a protein of antigen presenting cell. B7 molecules (CD80 s CD86) on the activated B-cells and monocytes/(macrophages) act in tandem as ligands for the two different types of proteins on the surface of T-cells (CD 28 a CTLA-4). Superantigen binding and stimulation of the immune cascade by binding of receptor B7 to co-receptor CD28 (co-stimulation is essential) lead to the proliferation of lympocytes. (Note: CTLA-4 on its own is a protein – receptor that downrgulates the immune system, it acts as an off switch = sending inhibitory signals.) 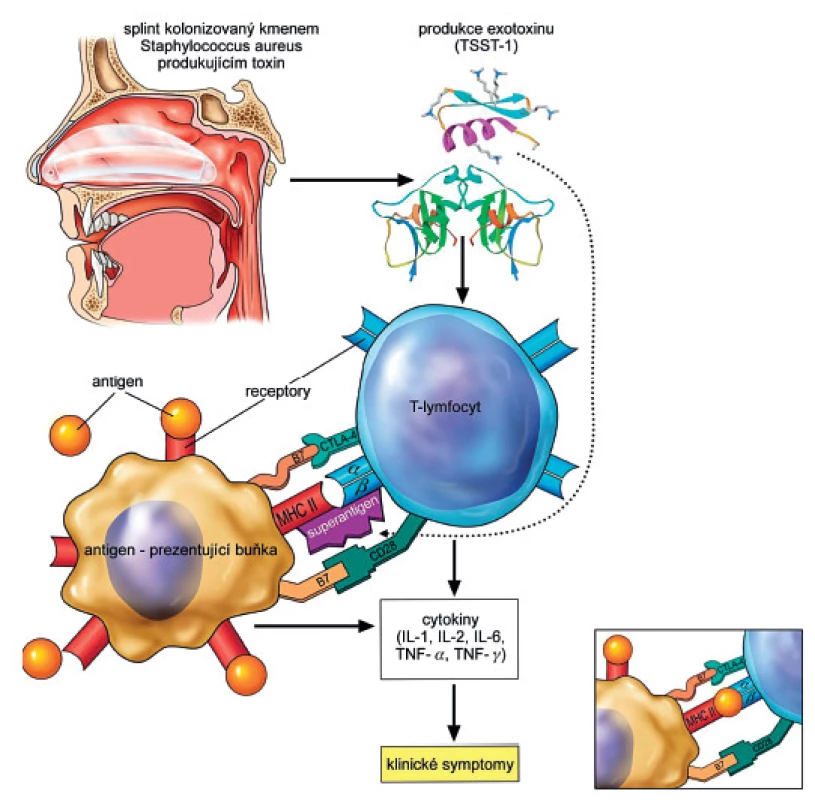
Mezi nejvýznamnější cytokiny podílející se na rozvoji TSS patří interleukin 1 (IL-1), IL-2, IL-6 a faktor nekrotizující tumory alfa (TNF-α). U pacientů s infekcí virem lidské imunodeficience byla popsána i vysoká aktivace buněčné imunity [12]. Nadprodukce cytokinů vede ke generalizované poruše mikrocirkulace, tzv. capillary leak syndromu. Dochází k úniku tekutin skrze cévní stěnu, vznikají edémy a výpotky jak v hrudní, tak v peritoneální dutině, s únikem bílkovin se navíc prohlubuje hypoalbuminémie [1, 3, 9]. Souběžně se rozvíjí šokový stav, který může vyústit až v multiorgánové selhání organismu. Renální dysfunkce různého stupně vzniká u všech pacientů s TSS a v některých případech může i předcházet refrakterní hypotenzi, která je spolu s horečkou dominujícím příznakem v prvních hodinách TSS.
V patogenezi onemocnění sehrává důležitou roli absence specifických protilátek proti bakteriálním toxinům. Preformované protilátky proti TSST-1 jsou vytvořeny až u 95 % dospělé populace [1, 13], což ze zbývajících 5 % populace vytváří rizikovou skupinu pro rozvoj StafTSS. Zajímavým fenoménem je vysoké procento rekurence onemocnění, a to až v 50 % případů, většinou do 2 měsíců po první epizodě [2, 5]. Tento fakt bývá vyvětlován tím, že v rámci dysregulované aktivace T lymfocytů dochází v organismu k produkci interferonu gama (INF-γ), který následně inhibuje polyklonální produkci imunoglobulinů. U části pacientů nejsou vytvořeny postinfekční protilátky ani po prodělaném onemocnění [3]. Rekurence je popisována pouze u stafylokové formy TSS.
KLINICKÝ OBRAZ
Manifestace onemocnění závisí jednak na etiologickém agens, jednak na individuální vnímavosti a imunitní výbavě pacienta. Důležitou roli sehrává absence či přítomnost specifických protilátek (viz výše), stejně jako možná existence geneticky podmíněné imunitní nedostatečnosti vůči bakteriálním toxinům [10]. Určitou roli sehrávají i lokální faktory jako pH, glykémie a magnezémie [1].
Součástí klinického obrazu je manifestace základního onemocnění, tedy infekce (faryngitida, osteomyelitida, kožní léze, postižení měkkých tkání atd.). K rozvoji TSS však může dojít i v případě, že se žádná infekce neprojevila. Jde o případy vzniklé na podkladě pouhé kolonizace. Může se jednat o kolonizaci přirozenou (např. kolonizace nosu či vaginy zlatým stafylokokem), nebo spojenou s operačním výkonem či přítomností cizích předmětů (tampóny, osteosyntetický materiál, ženské bariérové kontraceptivní pomůcky). Jestliže ke vzniku TSS dochází v souvislosti s proběhlým operačním výkonem, symptomy se objevují obvykle druhý pooperační den (POD), ale až ve 40 % případů rána nevykazuje známky pooperační komplikace [4]. V těchto případech může být původ toxémie neznámý a mnohdy těžko odhalitelný.
Všeobecně akceptovaná diagnostická kritéria Centra pro kontrolu nemocí v Atlantě (Centers for Diseases Control and Prevention – CDC) byla naposledy revidována v roce 2010 (StrTSS), respektive 2011 (StaTSS), tato reflektují nejčastější příznaky onemocnění. Jak již bylo zmíněno, mnohé symptomy TSS se mohou překrývat se symptomy septického šoku, za nějž můžeme TSS často mylně považovat. Diagnostická kritéria obou forem TSS a septického šoku jsou přehledně porovnána v tabulce 2 [3, 14, 15]. U TSS si lze povšimnout několika symptomů, které se u septického šoku většinou neobjevují. Je pravděpodobné, že souvisejí s přímým účinkem konkrétního toxinu. Mezi takové symptomy řadíme např. průjem, zvracení a jiné gastrointestinální, především dyspeptické příznaky, ale i úpornou bolest vznikající v rámci streptokokové formy onemocnění, nebo charakteristický kožní exantém či pozdní, v průběhu 1.–2. týdne onemocnění se objevující olupování pokožky dlaní a chodidel.
Nejčastěji se TSS manifestuje jako horečnaté onemocnění s časným, v řádu několika hodin se rozvíjejícím nástupem, vznikem hypotenze a šokového stavu, nereagujícího na tekutinovou resuscitaci a vyžadujícího vazopresorickou podporu oběhu. Iniciální symptomy se mohou lišit i v závislosti na etiologii TSS.
U StafTSS se asi u 20 % postižených v časné fázi onemocnění mohou objevit chřipce podobné symptomy, které zahrnují kromě horečky i třesavku, bolesti kloubů a svalů, nauzeu, zvracení, průjem, velmi časně může vznikat také exantém [1]. Tento mívá podobu makulopapulózních, skarlatiniformních nebo petechiálních splývajících eflorescencí.
Streptokokové formě TSS dominuje bolest. Rozvoj šokového stavu bývá mnohdy dramatičtější než v případě stafylokokové etiologie. Bolest obvykle souvisí se souběžně se vyskytující myozitidou nebo fasciitidou, bývá lokalizovaná, ale i generalizovaná, a může být zcela inadekvátní vzhledem k minimálnímu objektivnímu nálezu. Až 80 % nemocných má lokalizovaný edém či erytém, který nakonec může progredovat až do nekrózy měkkých tkání vyžadující radikální chirurgickou intervenci. Skarlatiniformní exantém je popisován pouze u 10 % případů, většinou se nevyskytují ani gastrointestinální příznaky. Hlavní rozdíly mezi stafylokokovou a streptokokovou formou TSS uvádí tabulka 2. Ve 20 % případů se může StrTSS rozvinout i bez přítomné infekce měkkých tkání, např. při vzniku myokarditidy, peritonitidy, endoftalmitidy, ale i streptokokové faryngitidy [1, 4].
Tab. 2. Porovnání klinických příznaků a diagnostických kriterií syndromu stafylokokového a streptokokového toxického šoku se šokem septickým Table 2. Comparison of clinical signs and symptoms of and diagnostic criteria for staphylococcal and streptococcal toxic shock syndrome and septic shock 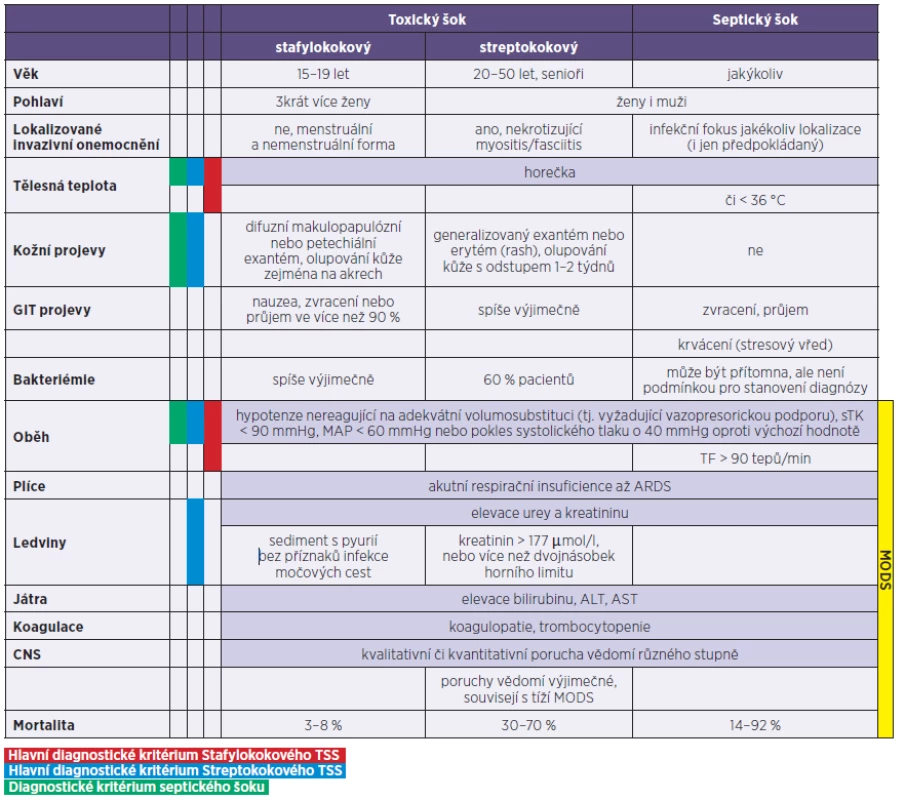
sTK – systolický krevní tlak, ALT – alaninaminotransferáza, AST – aspartátaminotransferáza, ARDS – syndrom akutní respirační insuficience, MODS – syndrom multiorgánové dysfunkce Zdroje: SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions 2001; CDC – Streptococcal toxic-shock syndrome, 2010 Case Definition; CDC – Toxic shock syndrome (other than Streptococcal), 2011 Case Definition; Táborská J. Syndrom toxického šoku. Interní Med, 2009;11(9):405–409. Poznámka autorů: Tabulka neobsahuje úplný výčet všech diagnostických kriterií jednotlivých nozologických jednotek, tento je k dohledání v citovaných zdrojích. Sources: SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions 2001; CDC – Streptococcal toxic-shock syndrome, 2010 Case Definition; CDC – Toxic shock syndrome (other than Streptococcal), 2011 Case Definition; Táborská J. Syndrom toxického šoku (Toxic shock syndrome). Interní Med, 2009;11(9):405–9. Comments of the authors: Table doesn’t include a list of all diagnostic standards of component nosologic units, it is in cited sources. Právě výše zmíněné symptomy doprovázející nespecifické známky rychle se rozvíjejícího šokové stavu by nás měly upozornit na možnost probíhajícího TSS. Významně pomoci nám mohou i anamnestické údaje o užívání vysokoabsorpčních vaginálních tampónů, o proběhlé operaci, o nedávném traumatu spojeném s porušením kožního krytu či pohmožděním měkkých tkání.
Stupeň multisystémového poškození se v rámci progrese šokového stavu zvyšuje a může dospět až do stadia orgánového selhání. Mezi první orgány, jejichž funkce bývá v průběhu TSS postižena, patří ledviny. Dochází k rozvoji renální insuficience, která může progredovat až do stadia anurického renálního selhání s nutností hemodialýzy. Až u 55 % pacientů vzniká syndrom akutní respirační insuficience (ARDS, acute respiratory distress syndrome), jenž může těsně navazovat na vznik oběhové nestability v časné fázi onemocnění [1, 3]. Často se též setkáváme s diseminovanou intravaskulární koagulací. Poruchy funkce CNS ve formě zmatenosti, agitace či dokonce kómatu se vyskytují asi u poloviny pacientů [1].
Diferenciální diagnóza je vzhledem k multisystémovému charakteru postižení a široké škále příznaků velice rozsáhlá. Chřipce podobné symptomy mohou zpočátku navádět k běžnějším infekcím respiračního traktu bakteriální i nebakteriální etiologie (viry, mykoplazmata), přídatný exantém může chybně nasměrovat k diagnóze spály. Gastrointestinální příznaky iniciálně imitují gastroenteritidu, mohou být vyjádřeny i symptomy charakteristické pro náhlou příhodu břišní [16]. Rychlá progrese onemocnění spojená s prohlubující se oběhovou nestabilitou a elevací zánětlivých parametrů svádí k diagnóze septického šoku, přičemž někdy těžko identifikovatelný fokus infekce může vést ke zvažování bakteriální endokarditidy či meningitidy [17]. Nespecifické multiorgánové postižení s kožními příznaky může také svědčit ve prospěch systémových onemocnění pojiva. Diferenciální diagnostika TSS je uvedena v tabulce 3 [18].
Tab. 3. Diferenciální diagnóza TSS Table 3. Differential diagnosis of toxic shock syndrome 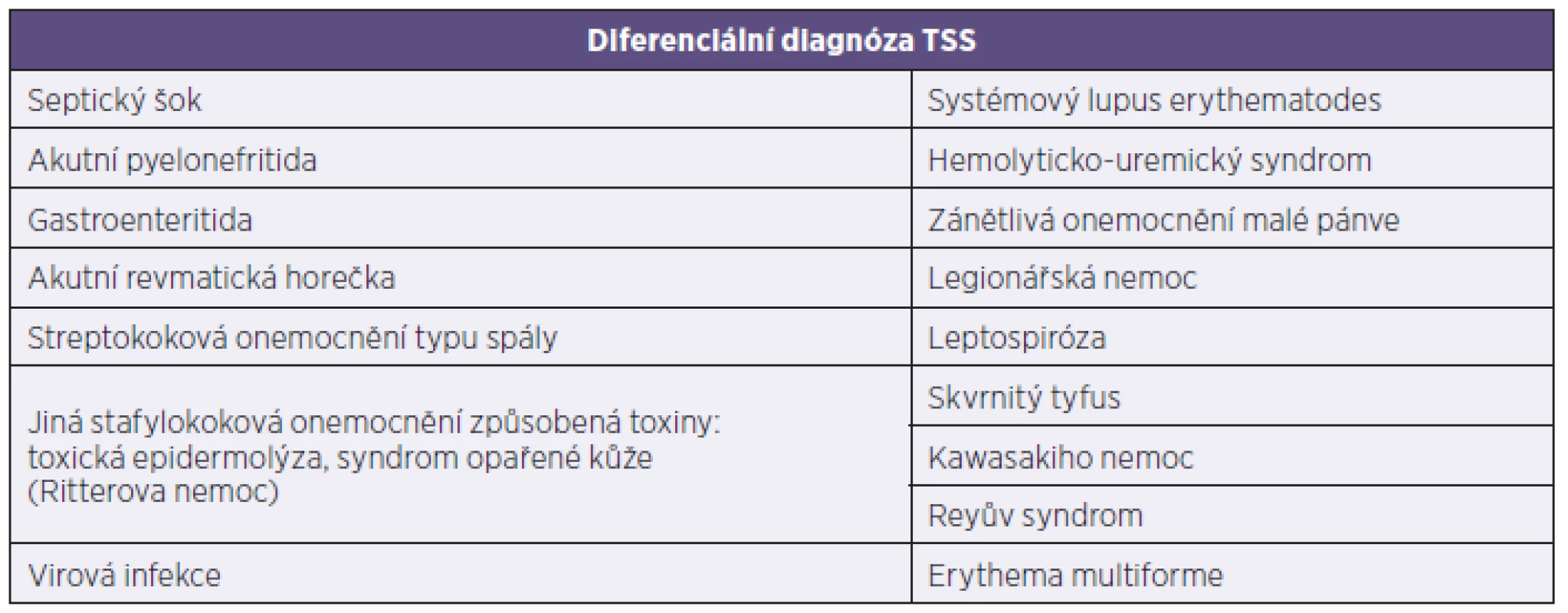
Zdroj: Tintinalli’s Emergency Medicine: A Comprehensive Study Guide, seventh edition. Source: Tintinalli’s Emergency Medicine: A Comprehensive Study Guide, seventh edition. DIAGNOSTIKA
Na TSS je třeba pomyslet již na základě anamnestických dat o výskytu rizikových faktorů v kombinaci s iniciálními příznaky onemocnění. Souhrn rizikových faktorů vzniku TSS je uveden v tabulce 4. Při podezření na TSS je laboratorní diagnostika založena na mikroskopickém a kultivačním průkazu bakteriálního agens z biologického materiálu a následně na ověření produkce toxinů vykultivovanými kmeny (v ČR provádí Státní zdravotní ústav – Národní referenční laboratoř pro stafylokoky) [4, 5].
Tab. 4. Souhrn rizikových faktorů vzniku TSS Table 4. Summary of risk factors for toxic shock syndrome 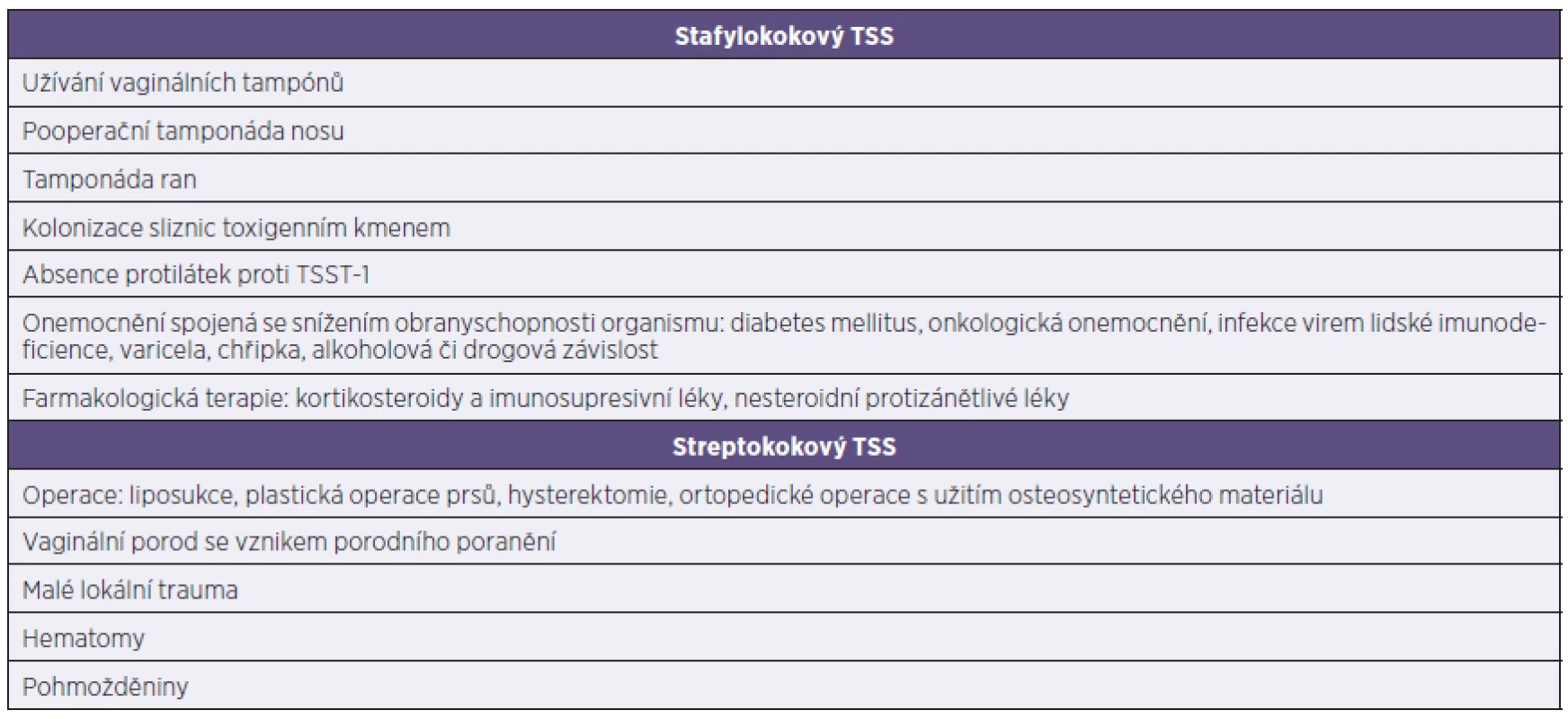
V klinické diagnostice využíváme již zmíněných diagnostických kritérií definovaných CDC. Diagnostická kritéria streptokokové formy TSS jsou oproti formě stafylokokové mírně modifikována. Základními klinickými kritérii zůstává hypotenze a multiorgánové poškození alespoň 2 orgánů, k němuž je nutný kultivační průkaz S. pyogenes. Je-li streptokok vykultivován z míst fyziologicky sterilních (krev, likvor, kloubní, perikardiální, hrudní výpotek), je diagnóza považována za potvrzenou, je-li vykultivován z míst běžně nesterilních, můžeme ji pokládat za pravděpodobnou [14].
V laboratorním vyšetření ihned od počátku dominuje obraz závažné bakteriální infekce (tj. elevace C reaktivního proteinu [CRP] a prokalcitoninu [PCT], leukocytóza s posunem doleva v diferenciálním rozpočtu leukocytů, vysoká sedimentace). Dále se přidává elevace renálních parametrů a jaterních enzymů při prohlubující se orgánové hypoperfuzi. V rámci konsumpce koagulačních faktorů a trombocytů při narušení koagulační rovnováhy při systémovém zánětu lze pozorovat koagulopatii s prodloužením protrombinového a aktivovaného parciálního tromboplastinového času. Pokles počtu trombocytů je považován za jedno z klinických kritérií onemocnění. Při analýze moči může být přítomna myoglobinurie, hemoglobinurie či sterilní pyurie, v biochemickém vyšetření krve lze zachytit hypoalbuminémii, hypokalcémii či hypoglykémii [1]. Nezbytnou součástí diagnostického procesu je odběr odpovídajícího biologického materiálu ke kultivačnímu a mikroskopickému vyšetření, a to v době před zahájením antibiotické (ATB) terapie. Hemokultury bývají v případě stafylokokové etiologie často negativní, u forem spojených se streptokokem skupiny A jsou pozitivní asi v 60 % případů [1, 3]. Jedná-li se o menstruální formu TSS, až u 90 % případů lze vykultivovat zlatého stafylokoka z vaginálního stěru i přes absenci klinických známek vaginální infekce.
Nemalý význam v diagnostice, ale též sledování progrese či regrese onemocnění mají moderní zobrazovací metody, jako je počítačová tomografie a magnetická rezonance, jejíž hlavní výhodou je přehledné zobrazení měkkých tkání.
TERAPIE
Fulminantní začátek a rychlá progrese TSS vyzývá ke stejně rychlé reakci ze strany ošetřujícího lékaře. Podobně jako v případě septického šoku je nutné razantní terapii zahájit ihned při podezření na rozvoj tohoto syndromu. Základní principy terapie se shodují s managementem terapie septického šoku. Je nezbytné zahájit co nejdříve ATB léčbu a odhalit, případně chirurgicky sanovat, zdroj infekce. Současně musí být zajištěna komplexní podpůrná léčba šoku s cílem udržení adekvátní tkáňové perfuze.
Kontrola zdroje infekce může spočívat v pouhém vynětí cizorodého materiálu z organismu (odstranění vaginálních tampónů, tamponád z nosu, roušek z operačních ran apod.) nebo v drenáži abscesů, případně vyčištění ran. Může si však vyžádat i agresivní chirurgický výkon spojený s rozsáhlým debridement infikovaných či nekrotických tkání – zejména v případě invazivní streptokokové infekce měkkých tkání. Agresivní chirurgické řešení neohraničené streptokokové infekce měkkých tkání není akceptováno všeobecně [19].
Empirickou antibiotickou terapii zahajujeme ihned po odběru vzorků k mikrobiologickým vyšetřením, v úvodu se při identickém klinickém obrazu obvykle postupuje jako při terapii těžké sepse s nejasným zdrojem, tj. podáním širokospektrého antibiotika. Pokud je vysloveno podezření na toxický šok, je tato léčba rozšířena o klindamycin, který je nezbytnou součástí jak empirické, tak později cílené ATB terapie TSS. Ten můžeme iniciálně podávat i v trojkombinaci spolu s antistafylokokovým a krystalickým penicilinem. V momentě identifikace původce TSS je doporučeno pokračovat v cílené terapii dvojkombinací antibiotik. Pokud je původcem onemocnění S. pyogenes, podáváme klindamycin v dávce 2,4–4,8 g denně, rozděleně ve 3–4 dílčích dávkách v kombinaci s krystalickým penicilinem v dávce 18–24 milionů jednotek denně rozděleně po 4 hodinách. V případě stafylokokové etiologie je třeba sáhnout mezi antistafylokokové peniciliny, v našich podmínkách kombinujeme léčbu klindamycinem nejčastěji s oxacilinem v dávkách 12–18 g denně, aplikovaných v dílčích dávkách nejlépe každé 4 hodiny [20]. Alternativou u pacientů s alergií na peniciliny jsou cefalosporiny 1. generace, u MRSA pozitivních pacientů pak vankomycin nebo linezolid. Podávání antibiotik je v případě TSS striktně nitrožilní, kombinovaná léčba je indikována alespoň v prvních dnech onemocnění. Potlačení syntézy toxinů klindamycinem je nezbytné především v počátku antibiotické terapie též z toho důvodu, že lýza bakterií způsobená baktericidními beta-laktamovými antibiotiky může náhle zvýšit koncentraci toxinů v oběhu pacienta [1].
Klindamycin patří mezi linkosamidová antibiotika, jejichž mechanismus účinku spočívá ve vazbě na 50S podjednotku ribozomů citlivých bakterií, čímž inhibuje proteosyntézu. Účinek klindamycinu není ovlivněn velikostí bakteriálního inokula, ani růstovou fází bakteriální populace. Všeobecná inhibice proteosyntézy v bakteriálním agens je spojena s inhibicí tvorby patogeneticky velmi důležitých substancí – je suprimována syntéza toxinů a antifagocytárních M-proteinů, syntéza PBPs (penicillin binding protein), které též hrají úlohu v tvorbě buněčné stěny bakterie a v neposlední řadě je potlačena indukovaná syntéza TNF-α monocyty, čímž je komplexně ovlivněna aktivita prozánětlivých cytokinů [19, 21]. In vitro bylo v případě zlatého stafylokoka produkujícího TSST-1 pozorováno snížení množství toxinu po aplikaci klindamycinu až o 90 % [4, 14]. Klindamycin oproti penicilinu vykazuje také delší postantibiotický efekt. Linezolid má na syntézu toxinů analogické působení jako klindamycin [22].
Penicilin je baktericidní beta-laktamové antibiotikum. Beta-laktamová ATB brzdí syntézu bakteriální buněčné stěny vazbou na významné enzymy (transpeptidázy a karboxypeptidázy) účastnící se syntézy peptidoglykanu. Zřejmě též nepřímo aktivují autolyziny, enzymy, které způsobují bakteriální smrt. Penicilin je základním antibiotikem v terapii streptokokových infekcí. Přestože rezistence vůči makrolidovým a linkosamidovým antibiotikům u streptokoků roste, jejich citlivost na penicilin je trvale vysoká [23]. U cílené antibiotické léčby mohou, na rozdíl od inhibitorů proteosyntézy, beta-laktamová ATB v léčbě toxin-produkujících grampozitivů selhat. Jsou efektivní jen u rychle rostoucích organismů, ve stacionární fázi dochází k down-regulaci PBP cílové struktury jejich působení. Je třeba myslet také na to, že neinhibují produkci toxinů, poškození buněčné stěny bakterií vede k uvolnění intracelulárně uložených toxinů [24]. Subinhibiční koncentrace beta-laktamových ATB by dokonce mohly zvyšovat expresi exotoxinových genů [25].
Od samého počátku TSS se rozvíjejí identické poruchy mikrocirkulace jako u septického šoku. Pro udržení adekvátní perfuze tkání za účelem minimalizace tkáňového poškození v průběhu rozvíjejícího se šokového stavu můžeme využít algoritmu terapie septického šoku. Tkáňová hypoxie je časně indikována elevací krevního laktátu. Stoupá-li jeho hladina, je indikována tekutinová resuscitace, jejímž cílem je udržet střední arteriální tlak nad 65 mm Hg a diurézu nad 0,5 ml/kg/hod. Dodávku kyslíku lze zvýšit i podáním erytrocytární masy. Cílové hodnoty hemoglobinu by se měly pohybovat mezi 70 a 90 g/l. Agresivní tekutinová resuscitace je vhodná především v akutní fázi TSS, měla by však být vystřídána konzervativnějším postupem v následujících dnech. Speciální skupinou jsou pacienti s ARDS, u nichž je indikována spíše konzervativní tekutinová strategie. Nejsme-li schopni dosáhnout hemodynamické stabilizace tekutinami, je nutné podpořit oběh farmakologicky. Lékem volby je noradrenalin [26].
Do komplexní podpůrné terapie se kromě restaurace funkce kardiovaskulárního aparátu řadí i prostředky orgánové podpory, jakými jsou umělá plicní ventilace při respiračním selhání v rámci rozvoje ARDS, hemodialýza při renálním selhání a samozřejmostí je i adekvátní nutriční podpora.
Terapie kortikosteroidy je sporná podobně jako v případě septického šoku. Jejich užití však může mít příznivý efekt na hemodynamiku v situaci, kdy se nedaří zvrátit šokový stav přes adekvátní terapii. V tomto případě se jako prospěšná ukazuje tzv. stresová dávka kortikosteroidů (hydrokortison v dávce cca 200 mg/den intravenózně), která představuje substituci ve stavu jejich relativního nedostatku. Zmiňována bývá i terapie pomocí hyperbarické oxygenoterapie, její užití však není součástí běžné klinické praxe a její přínos je nejasný, podobně jako v případě využití eliminačních metod za účelem odstranit toxin z organismu.
Jedním z možných terapeutických postupů je též podání intravenózních imunoglobulinů (IVIG). V souvislosti s jejich využitím v léčbě TSS bylo provedeno několik studií. Jednou z nich, která mluví ve prospěch jejich užití, je kanadská studie prezentovaná v roce 1999, v níž byly IVIG použity v dávce 2 g/kg u 21 pacientů se StrTSS a bylo srovnáno jejich 30denní přežití s kontrolní skupinou 32 pacientů, které bylo u pacientů léčených IVIG 67 % oproti 34 % u pacientů v kontrolní skupině [27]. IVIG se zdají být prospěšné i u těžkých případů StafTSS. Na mechanismu jejich působení se podílí neutralizace exotoxinů, opsonizace bakterií, ochrana proti lipopolysacharidům, inhibice složek C5b-C9 membrány atakujícího komplexu a inhibice T lymfocytární produkce IL-6 a TNF-α [28]. Závěrem další z provedených studií bylo, že režim využívající v terapii IVIG může minimalizovat nutnost invazivních výkonů u pacientů s těžkou streptokokovou infekcí měkkých tkání. Existují však i studie, které nezjistily signifikantní rozdíl v mortalitě a délce pobytu v nemocnici u pacientů léčených IVIG oproti kontrolní skupině. Současný názor na použití IVIG je tedy ten, že mohou být doplňkem adekvátní antimikrobiální, chirurgické a komplexní podpůrné terapie, jestliže tyto postupy nevedou ke zlepšování klinického stavu pacienta [28]. Doporučenou iniciální dávkou v léčbě TSS je 2 g/kg IVIG, která je následována dávkou 400 mg/kg po dobu prvních pěti dnů. Příznivé ovlivnění stavu pacienta je však pozorováno pouze v případě, jsou-li IVIG použity v časné fázi onemocnění [29]. Vzhledem k tomu, že diagnóza TSS bývá často pozdní, je význam tohoto terapeutického postupu omezený.
V současné době probíhají experimentální studie, které se snaží najít další možnosti, jak TSS příznivě terapeuticky ovlivnit. Ve stadiu in vitro testování nebo pokusů na zvířatech je vývoj monoklonálních protilátek proti TSST-1 či peptidů, jež by zabraňovaly exotoxinům aktivovat T lymfocyty, a tudíž bránily přemrštěné cytokinové produkci odpovědné za většinu příznaků TSS. Karauzumem et al. [30] byla prezentována studie, která zkoumala efekt protilátek proti stafylokokovému enterotoxinu B (SEB). Metodami genového inženýrství, s využitím kmene Escherichia coli, byly vytvořeny antigen-vázající fragmenty zamířené proti SEB, které byly zabudovány do molekuly imunoglobulinu G produkovaného savčími buňkami. Tím byly získány anti-SEB protilátky, jež byly testovány na myších modelech. Tyto protilátky poskytly myším plnou ochranu před letální dávkou enterotoxinu a navíc byla v jejich krvi prokázána nižší koncentrace IFN-γ a IL-2. Další zvažovanou možností je blokáda molekuly označované CD28, která je důležitým koreceptorem TSST-1 na povrchu T lymfocytu [31]. Zdá se tedy, že již nyní máme k dispozici kandidáty pro preklinické a později případně klinické testování na poli léčby TSS.
KAZUISTIKY
Kazuistika 1
38letá žena bez interních komorbidit, s anamnestickým údajem o úrazu nosu v dětství byla vyšetřována na ORL pro omezené dýchání nosem. Pacientce bylo diagnostikováno posttraumatické vybočení nosní přepážky a byla indikována septoplastika. Operační výkon proběhl u pacientky nekomplikovaně v celkové anestezii, podle zvyklostí byla provedena fixace nosního septa silikonovými splinty.
Během 1. POD se u pacientky objevily průjmovité, zelené zapáchající stolice a pacientka několikrát zvracela. Na trupu se vytvořil kožní erytém, který se šířil po celém těle. Pro teploty až 40 °C byla pacientce odebrána krev na hemokultivaci. Začala se rozvíjet oběhová nestabilita s refrakterní hypotenzí a nutností vazopresorické podpory.
Za 2. POD přetrvávaly horečky, průjem a došlo k elevaci zánětlivých ukazatelů. Při podezření na enterokolitidu byla pacientce nasazena střevní dezinficiencia a iniciální empirická antibiotická terapie (kombinace amoxicilin/klavulanát + metronidazol). Před nasazením ATB byl proveden rentgen plic a odběr dostupných materiálů k mikrobiologickému vyšetření (výtěry krk, nos, rektum, stolice). Veškeré výsledky těchto pomocných vyšetření byly negativní. Pro progresivní zhoršování stavu, který byl uzavřen jako septický šok s MODS, byla pacientka přeložena na lůžko resuscitačního oddělení. Primární fokus byl nejasný, empiricky byla změněna antibiotická léčba (nasazen piperacilin/tazobactam) a pokračovalo se v podpůrné léčbě (volumoterapie, vazopresory, oxygenoterapie, kortikoidy).
Během 3. POD progredovala u pacientky respirační insuficience s nutností intubace a zahájení umělé plicní ventilace (UPV). Kromě zvýšených zánětlivých parametrů byla dalším nálezem v laboratoři trombocytopenie, koagulopatie, elevace transamináz a amyláz. V hemokulturách odebraných 1. POD byl vykultivován S. aureus. Při snaze o lokalizaci infekčního ložiska bylo provedeno CT hlavy s nálezem odpovídajícím provedenému operačnímu výkonu. Na CT hrudníku byl patrný oboustranný fluidothorax, na CT břicha pak výrazná hepatomegalie. Echokardiografické vyšetření zcela nevyloučilo přítomnost vegetace na mitrální chlopni při její lehké insuficienci, proto bylo vysloveno podezření na infekční endokarditidu. Vzhledem k nálezu S. aureus v hemokultuře byla ATB terapie při stále neznámé citlivosti posílena o vankomycin.
Lokální nález při ORL vyšetření (septum, stejně tak i sliznice nosu a nazofaryngu byly klidné, bez známek infekce či hematomu) ve shodě s CT obrazem nesvědčil pro komplikaci v souvislosti s provedeným operačním výkonem. Během vyšetření byly extrahovány silikonové splinty z přední části nosního septa a odeslány na mikrobiologické vyšetření. Následně byla kultivačně prokázána kolonizace splintů S. aureus. V dalších dnech po extrakci splintů se stav pacientky postupně zlepšoval, orgánové funkce se stabilizovaly, kožní erytém regredoval a po 6 dnech byla pacientka extubována. Kontrolní echokardiografické vyšetření bylo s negativním nálezem. Vzhledem ke shodnému kultivačnímu nálezu z hemokultury a z extrahovaných nazálních splintů byl jako etiologické agens označen S. aureus. Pro podezření na TSS byl tento kmen odeslán do Národní referenční laboratoře (NRL) pro stafylokoky. Potvrzení pozitivity TSST-1 a enterotoxinu A ověřilo diagnózu StafTSS, jehož zdrojem byly kolonizované nazální splinty. Pacientka byla doléčena na Interní klinice, kde proběhla cílená deeskalace ATB terapie (klindamycin + gentamicin a později klindamycin v monoterapii). 16. POD byla pacientka propuštěna domů.
Kazuistika 2
36letá pacientka bez interních komorbidit byla přijata na ORL kliniku pro týdenní bolesti na krku vlevo nejprve s pocitem „namoženého svalu“, které se rozvinuly do intenzivní tlakové bolesti, pocitu sevření a obtížného nadechnutí. Anamnestickým údajem byla recentně proběhlá hnisavá afekce v pubické krajině a na prstu pravé ruky, zároveň léčila vulvovaginitidu preparátem Macmiror a manžel pacientky prodělal v nedávné době streptokokovou anginu.
Objektivním nálezem při příjmu pacientky bylo prosáknutí, zarudnutí a palpační bolestivost měkkých tkání na krku s maximem podél levého sternokleidomastoideu propagující se až na horní část hrudníku. Pacientka byla hypotenzní, tachykardická a subfebrilní. Vstupně byla v laboratoři pouze mírně zvýšená hodnota CRP, ostatní vyšetření provedená při příjmu (ORL, SONO krku, CT hrudníku) neprokázala patologický nález.
Během 1. hospitalizačního dne (HOD) se u pacientky rozvinuly gastrointestinální příznaky (říhání, řídká stolice, vzedmutí břicha s obleněním peristaltiky). RTG a SONO břicha ani echokardiografické vyšetření neozřejmily žádnou patologii. Otok krku a bolestivost se rozšiřovaly až na stěnu hrudní a levou horní končetinu. V laboratoři došlo k prudké elevaci zánětlivých ukazatelů, kdy se hodnota CRP od příjmu zdvojnásobila a hodnota PCT dokonce dosáhla až stonásobku normy. Byla zahájena empirická antibiotická terapie (amoksiklav + ciprofloxacin). Pro rychlou progresi oběhové nestability s nedostatečnou reakcí na podávané tekutiny a nutností vazopresorické podpory noradrenalinem byla pacientka přeložena na lůžko resuscitační péče. Stav byl uzavřen jako septický šok s neznámým fokusem, za suspektní ložisko infekce byla považována myozitida a flegmóna na krku, jako další zdroje přicházely v úvahu hnisavé afekce pacientky a angina v rodině.
Pacientka byla po celou dobu při vědomí, přes refrakterní hypotenzi měla zachovanou diurézu, dominovala bolest na krku a hrudníku. 2. HOD pokračovala terapie šokového stavu. Na RTG hrudníku byl již patný oboustranný fluidothorax, který byl pro výraznou symptomatologii pod CT kontrolou evakuován bilaterální drenáží. V získané zkalené žluté tekutině byly mikroskopicky zjištěny grampozitivní koky. Na CT břicha byla patrná hepatomegalie s drobným ascitem. Vzhledem k závažnosti stavu byla empiricky změněna ATB terapie (nově monoterapie meropenemem). Ke kultivačnímu vyšetření bylo odesláno několik biologických materiálů (punktát z hrudníku, z podkoží v jugulární oblasti, hemokultury a stěr z afekce na prstu). Ze stěru z prstu byl později vykultivován S. pyogenes, veškeré ostatní kultivační nálezy byly negativní.
Vzhledem k významné progresi lokálního nálezu na hrudníku doprovázené výraznou bolestivostí v této lokalizaci byla 2. HOD indikována revize krčních prostor s kolární mediastinotomií vlevo. Peroperačním nálezem bylo prosáknutí měkkých tkání serózní nazelenalou tekutinou, jejíž mikroskopické i kultivační vyšetření bylo však negativní.
Následující den po operační revizi byla pacientka extubována, další průběh hospitalizace pokračoval příznivě, stav pacientky se postupně zlepšoval, orgánové funkce se normalizovaly, v laboratoři nastal příznivý trend zánětlivých ukazatelů. Vzhledem k průběhu a mikrobiologickému nálezu byl stav pacientky uzavřen jako StrTSS. Po stanovení diagnózy proběhla deeskalace ATB terapie (ampicilin* + klindamycin). Dále již kardiopulmonálně stabilní pacientka byla doléčena na standardních odděleních nemocnice. Její hospitalizace se prodloužila až na 30 dnů z důvodu nutnosti dlouhodobé rehabilitace při polymyopatii kriticky nemocných.
*Ampicilin byl nasazen pro výpadek krystalického G Penicilinu v nemocnici (pozn. autorů).
Kazuistika 3
39letý muž s astma bronchiale v anamnéze byl pro chronickou sinusitidu a slizniční polypy indikován k elektivnímu ORL výkonu a byla mu provedena oboustranná FESS (functional endoscopic sinus surgery) pod CT navigací. Operační výkon v celkové anestezii proběhl nekomplikovaně, 3. POD byl pacient propuštěn domů v dobrém celkovém stavu. 8. POD byly při ambulantní kontrole extrahovány longety, sliznice nosu i nazofaryngu byly klidné, bez známek komplikací. Následné ambulantní kontroly (11. a 15. POD) rovněž neprokázaly žádnou patologii.
16. POD se u pacienta projevil otok nosohltanu, bolest v krku při polykání, měl pocit zvýšené teploty. Stav progredoval zvětšením otoku nosohltanu a manifestací nesvědivého exantému v obličeji, který se šířil dále na trup i končetiny. Pro progresi stavu s celkovou slabostí vyhledal pacient 18. POD lékařskou pohotovost. Klinický obraz spolu s vysokou hodnotou CRP vedl k podezření na spálu a pacientovi byla nasazena empirická antibiotická perorální terapie preparátem Ospen (fenoxymetylpenicilin). 19. POD se stav pacienta dále zhoršoval, celkovou slabost a schvácenost provázely myalgie, artralgie, objevily se průjmy a došlo k rozvoji hlenohnisavé sekrece z nosních dutin. Bylo opět provedeno ambulantní ORL vyšetření, kde lékař zhodnotil lokální nález na sliznicích jako komplikaci ORL výkonu a pacient byl hospitalizován na infekčním oddělení.
Objektivním nálezem při příjmu pacienta bylo prosáknutí a zarudnutí hrdla, edematózní patrové oblouky a nepřehledné tonzily, dominoval skarlatiniformní exantém na povrchu celého těla s maximem v tříslech a na trupu. Na dlaních byl patrný erytém s mírným edémem podkoží. Pacient byl hypotenzní, tachykardický, febrilní a velmi schvácený. V laboratoři byl významně zvýšen CRP, PCT, leukocyty i další parametry (renální, jaterní, ionty) byly v mezích normy, RTG plic neozřejmil žádnou patologii. Laboratorní vyšetření sekretu z nosohltanu vyloučilo hypotetickou možnost likvorey. Bylo odesláno několik biologických materiálů ke kultivačnímu vyšetření (výtěr z krku, hemokultury, sekret z nosu) a byla nasazena kombinovaná empirická antibiotická intravenózní terapie (penicilin G + klindamycin). 2. HOD došlo k poklesu teplot, regresi exantému, snížení CRP a k subjektivnímu zlepšení celkového stavu pacienta. Kultivační vyšetření prokázalo S. aureus (kmen citlivý na penicilin G), Klebsiella oxytoca a Haemophillus parainfluenzae v sekretu z nosu. Ostatní kultivační nálezy byly negativní. Pro podezření na StafTSS byl vykultivovaný stafylokokový kmen odeslán do NRL pro stafylokoky, která potvrzením pozitivity enterotoxinu C diagnózu ověřila. Opakovaně proběhlo kontrolní ORL vyšetření s regredujícím nálezem na sliznicích. 7. HOD byl vysazen penicilin G a dále bylo pokračováno v monoterapii klindamycinem v perorální formě. 8. HOD byl pacient v dobrém celkovém stavu propuštěn domů. Následně byl pacient sledován ambulantně na ORL klinice a bez dalších komplikací došlo k úplnému zhojení.
Shrnutí
TSS je onemocnění poměrně vzácné, avšak nechvalně známé svým mnohdy dramatickým průběhem a vysokým procentem závažných zdravotních komplikací, které mohou vyústit až ve smrt pacienta. Pacientem v tomto případě může být i mladý, jinak zcela zdravý člověk. Nejdůležitějšími faktory ovlivňujícími úspěšnost léčby a výsledný stav nemocného je včasnost a adekvátnost terapie, což zároveň vyžaduje časnou diagnózu tohoto syndromu. Právě rychlá a přesná diagnostika se zdá být stěžejním bodem v celém terapeutickém procesu. Je však velice obtížná vzhledem k tomu, že symptomy onemocnění jsou z většiny nespecifické a diagnostická rozvaha často obšírná.
Mnoho případů TSS dokonale imituje rozvoj septického šoku, jelikož projevy, jež dominují klinickému stavu pacienta, jsou až na pár výjimek téměř identické. Naštěstí i základní principy terapie septického a toxického šoku se shodují, což nám umožňuje pacienta efektivně léčit i v době, kdy je tzv. pracovní diagnóza mylná. Logicky tak vyvstává otázka, zda je vůbec nezbytné tyto dvě nozologické jednotky odlišovat. Existuje něco pro TSS natolik specifického, co by nás mohlo navést na jeho diagnózu? A má tato správná diagnóza klinický význam?
Léčba pacientů v septickém stavu tvoří velkou část práce na odděleních intenzivní medicíny. Infekční fokus je někdy zřejmý, jindy po něm dlouho, nebo dokonce marně pátráme. Specifikem TSS nepochybně je skutečnost, že k jeho rozvoji není nezbytná existence manifestního infekčního ložiska. K průniku toxinů či bakterií do řečiště postačuje pouhé nahromadění (pomnožení) toxigenních bakterií. K tomu může dojít i na povrchu sliznic, které jsou pro dané bakterie přirozeným prostředím výskytu, zejména v souvislosti s přítomností cizorodého materiálu nebo poruchou přirozeného očišťování sliznic. Pro TSS jistým způsobem charakteristická je i zarážející rychlost nástupu příznaků a rozvoje orgánového selhání, která patogeneticky pravděpodobně souvisí s jedinečnou vlastností bakteriálních toxinů působit jako superantigeny, a tedy promptně vyvolat přemrštěnou imunologickou reakci organismu.
Stěžejním bodem léčby a zlomem v dosavadním průběhu onemocnění může být zdánlivě nevýznamný krok (odstranění nosních splintů, seškrábnutí zaschlého stroupku z kůže), který však odstraní zdroj produkce toxinů, jenž ač je přímo před očima, může být dokonale skryt pod nenápadnost svého vzhledu. Důležitým krokem je nepochybně i volba odpovídající ATB terapie, jejíž neodmyslitelnou součástí by měl být bez ohledu na etiologii TSS klindamycin. Ať už pro schopnost inhibovat tvorbu toxinu, nebo pro své imunomodulační schopnosti. Kombinace klindamycinu s baktericidním antibiotikem navíc dokáže redukovat náhlé zvýšení hladiny toxinů v krvi pacienta sledující lýzu bakterií na počátku ATB terapie.
Zamyslíme-li se nad možností jak předejít TSS, jsou zřejmá některá preventivní opatření všeobecná (dodržování pravidel asepse, běžná hygiena zdravotnických pracovníků) i opatření, která by byla zaměřena na jednotlivé rizikové skupiny pacientů. Některé operace jsou spojeny se zvýšeným rizikem vzniku tohoto syndromu. Jde především o operace v prostředí, kde se mohou toxigenní kmeny přirozeně vyskytovat, aniž by dosud působily svému hostiteli potíže. Je otázkou, zda by jedním z preventivních opatření neměla být eradikace nosičství (např. nazálního) lokálním ATB, nabízí se i možnost fágové terapie z téže indikace. Preventivní význam má také poučení pacientek užívajících vysokoabsorpční tampóny o jejich časté výměně. Vzhledem k závažnosti invazivních streptokokových onemocnění se pracuje i na vývoji vakcíny zaměřené proti M proteinu či ostatním složkám bakteriálních buněčných těl. Většina těchto pokusů je však zatím na experimentální úrovni [3].
ZÁVĚR
Aerobně rostoucí grampozitivní bakterie, mezi něž patří původci TSS, jsou úzce vázané na člověka. Žijí jako komenzálové na povrchu sliznic, zároveň však disponují řadou patogenních faktorů, jimiž jsou schopny způsobit jak exogenní, tak endogenní infekci organismu. Dlouhodobá koexistence těchto mikrobů a člověka je zodpovědná za diferenciaci v jejich antigenní a imunitní výbavě. Důsledkem těchto dlouho se vyvíjejících změn je fakt, že bakterie téže skupiny mohou způsobovat klinicky velmi rozdílná onemocnění a současně každý člověk může na tutéž bakterii reagovat zcela odlišným způsobem. Tato skutečnost je jednou z příčin široké variability klinického obrazu TSS. Záměrem tohoto textu bylo vytvořit ve čtenáři ucelenou představu o tom, co všechno, s čím se v praxi setkáváme, se dokáže skrýt do jedné velmi bohaté nozologické jednotky a především upozornit na určité „indicie“, které by mohly přispět k časné diagnóze a léčbě tohoto velice závažného onemocnění, které není až tak vzácné, aby si nezasloužilo odpovídající pozornost lékařů rozličných specializací.
Poděkování
Práce byla podpořena projektem Ministerstva obrany ČR MO 1012.
Poděkování Státnímu zdravotnímu ústavu – Národní referenční laboratoři pro stafylokoky.
Do redakce došlo dne 27. 4. 2015.
Adresa pro korespondenci:
MUDr. Tomáš Tyll, Ph.D.
KARIM 1. LF UK a ÚVN
Ústřední vojenská nemocnice
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: tomas.tyll@uvn.cz
Zdroje
1. Ramesh V, Sat S. Toxic Shock Syndrome [online]. 2015-06-06 [cit. 2015-07-14]. Dostupný na www: http://emedicine.medscape.com/article/169177-overview.
2. Todd J, Fishaut M, Kapral F, Welch T. Toxic-shock syndrome associated with phage-group-I Staphylococci. Lancet Lond Engl, 1978;2(8100):1116–1118.
3. Táborská J. Syndrom toxického šoku. Interní Med, 2009;11(9):405–409.
4. Issa NC, Thompson RL. Staphylococcal toxic shock syndrome. Suspicion and prevention are keys to control. Postgrad Med, 2001;110(4):55–56, 59–62.
5. Beneš J, Petráš P, Kabelková M. Syndrom toxického šoku: souborná práce a kazuistika. Klin Mikrobiol Inf Lék, 1998;4(4):120–125.
6. Cone LA, Woodard DR, Schlievert PM, Tomory GS. Clinical and Bacteriologic Observations of a Toxic Shock-like Syndrome Due to Streptococcus pyogenes. N Engl J Med, 1987;317(3):146–149.
7. Infekce v České republice – EPIDAT [online]. 2015 [cit. 2015-06-25].
Dostupné na www: http://www.szu.cz/publikace/data/infekce-v-cr.
8. Petráš P, Machová I, Ryšková L, Prášil P. Případy menstruální formy syndromu toxického šoku v České republice v letech 1997–2011. Epidemiol Mikrobiol Imunol, 2011;60(4):161–166.
9. Pajerek J, Přibíková R, Petráš P. Syndrom toxického šoku. Pediatr Prax, 2006;7(6):324–326.
10. Que Y, Moreillon PH. Staphylococcus aureus (including staphylococcal toxic shock). In: Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases. Philadelphia: Elsevier Churchill Livingstone; 2009 : 2543–2578.
11. Jacobson JA, Kasworm EM. Toxic shock syndrome after nasal surgery.: Case reports and analysis of risk factors. Arch Otolaryngol Head Neck Surg, 1986;112(3):329–332.
12. Holub M, Arientová S, Jilich D, Davidová A, Beran O, Rozsypal H. Toxic shock syndrome and persistent immune activation in an HIV-positive patient. Curr HIV Res, 2013;11(4):321–325.
13. Bonventre PF, Linnemann C, Weckbach LS, et al. Antibody responses to toxic-shock-syndrome (TSS) toxin by patients with TSS and by healthy staphylococcal carriers. J Infect Dis, 1984;150(5):662–666.
14. Current and Historical Conditions | NNDSS [online]. 2015-05-06 [cit. 2015-06-25]. Dostupné na www: http://wwwn.cdc.gov/nndss/conditions.
15. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med, 2003(4);31 : 1250–1256.
16. Petráš P. Dva případy stafylokokového syndromu septického šoku. 2. Původní diagnóza appendicitida. Zprávy Cent Epidemiol Mikrobiol, 2004;13(2):76.
17. Petráš P, Džupová O, Beneš J. Dva případy stafylokokového syndromu septického šoku. 1. Původní diagnóza meningitida. Zprávy Cent Epidemiol Mikrobiol, 2004;13(1):24–25.
18. Perry SJ, Reid RD. Toxic Shock Syndrome and Streptococcal Toxic Shock Syndrome. In: Tintinalli JE. Tintinalli´s Emergency Medicine: A Comprehensive Study Guide. 7th ed. McGraw-Hill;2010 : 999–1002.
19. Low DE. Toxic Shock Syndrome. Crit Care Clin, 2013;29(3):651–675.
20. Jindrák V, Chmelík V, Nyč O. Syndrom toxického šoku. In: Jindrák V, Hedlová D, Urbášková P, et al. Antibiotická politika a prevence infekcí v nemocnici. Praha: Mladá fronta a.s.; 2014 : 228–230.
21. Kalyan S, Chow AW. Staphylococcal toxic shock syndrome toxin-1 induces the translocation and secretion of high mobility group-1 protein from both activated T cells and monocytes. Mediators Inflamm, 2008;2008 : 512196.
22. Burnham JP, Kollef MH. Understanding toxic shock syndrome. Intensive Care Med [online]. 2015-05-14 [cit. 2015-07-14]. Dostupné na www: http://icmjournal.esicm.org/index.html.
23. Urbášková P. Někteří významní původci bakteriálních infekcí a pozice antibiotik. In: Jindrák V, Hedlová D, Urbášková P, et al. Antibiotická politika a prevence infekcí v nemocnici. Praha: Mladá fronta a.s.;2014 : 158–186.
24. Stevens DL, Ma Y, Salmi DB, et al. Impact of antibiotics on expression of virulence-associated exotoxin genes in methicillin-sensitive and methicillin-resistant Staphylococcus aureus. J Infect Dis, 2007;195(2):202–211.
25. Ohlsen K, Ziebuhr W, Koller KP, et al. Effects of subinhibitory concentrations of antibiotics on alpha-toxin (hla) gene expression of methicillin-sensitive and methicillin-resistant Staphylococcus aureus isolates. Antimicrob Agents Chemother, 1998;42(11):2817–2823.
26. Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Critical Care Med, 2013;41(2):580–637.
27. Kaul R, McGeer A, Norrby-Teglund A, et al. Intravenous immunoglobulin therapy for streptococcal toxic shock syndrome – a comparative observational study. The Canadian Streptococcal Study Group. Clin Infect Dis, 1999;28(4):800–807.
28. Raithath AH, Bryden, DC. Use of intravenous immunoglobulin therapy in the treatment of septic shock, in particular severe invasive group A streptococcal disease. Indian J Crit Care Med, 2012;16(1):37–40.
29. Darenberg J, Soderquist B, Normark BH, Norrby-Teglund A. Differences in potency of intravenous polyspecific imunoglobulin G against streptococcal and staphylococcal superantigens: implications for therapy of toxic shock syndrome. Clin Infect Dis, 2004;38(6):836–842.
30. Karauzum H, Chen G, Abaandou L, et al. Synthetic human monoclonal antibodies toward staphylococcal enterotoxin B (SEB) protective against toxic shock syndrome. J Biol Chem, 2012;287(30):25203–25215.
31. Holub M. Novinky u sepse – zpráva z 23. kongresu klinické mikrobiologie a infekčního lékařství. Klin Mikrobiol Inf Lék, 2013;19(2):74–75.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článek Rejstříky
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2015 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Úloha Streptococcus mutans v orálnom biofilme
- Onemocnění člověka způsobená hantaviry – stále opomíjené zoonózy?
- Imunitní odpověď v patogenezi infekce virem hepatitidy C
- Patogeneze klíšťové encefalitidy a možnosti antivirové terapie
- Syndrom toxického šoku
- Detekce DNA Neisseria meningitidis, Haemophilus influenzae a Streptococcus pneumoniae v klinickém materiálu metodou real-time PCR
- Fekální bakterioterapie v léčbě rekurentní kolitidy způsobené Clostridium difficile na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2010–2014 – prospektivní studie
- Benigní akutní myozitidy u dětí jako komplikace chřipky B a jejich diferenciální diagnostika
- Epidemie příušnic v Plzeňském kraji v roce 2011
- Daniel Růžek a kolektiv: Klíšťová encefalitida
- Rejstříky
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Benigní akutní myozitidy u dětí jako komplikace chřipky B a jejich diferenciální diagnostika
- Onemocnění člověka způsobená hantaviry – stále opomíjené zoonózy?
- Syndrom toxického šoku
- Úloha Streptococcus mutans v orálnom biofilme
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



