-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diabetes a demence – co je známo o jejich vztahu?
Diabetes and dementia – what is known about their relationship?
Prevalence of both diseases is increasing. Diabetes as well as dementia are not homogenous disorders. The main characteristic feature of all diabetes types is hyperglycaemia. Progressive cognitive impairment is typical for all forms of dementia. A patient suffering from type 2 diabetes has higher risk of developing dementia in comparison with a person of similar age and sex who has normal glucose tolerance. Is there any relationship? In this article insulin function in brain, consequences of central insulin resistance for our cognitive abilities as well as for psyche and other possible molecular link between impaired glucose homeostasis and dementia are described. The situation in two most prevalent forms of diabetes is compared. Connection between diabetes and dementia certainly exists but has not been fully uncovered yet. One common important feature of diabetes and dementia seems to be insulin resistance. Higher dementia occurrence in diabetic patients can be the result of diabetes related vascular changes and the episodes of serious hypoglycaemia events as well. Both diseases have a serious negative impact on a patient as well as on entire society so their connection analysis is a very important research topic nowadays.
KEYWORDS:
diabetes – dementia – insulin – insulin resistance – hyperglycaemia – hypoglycaemia – glycaemic variability – signalling cascade
Autori: K. Štechová
Vyšlo v časopise: Geriatrie a Gerontologie 2016, 5, č. 4: 190-195
Kategória: Přehledové články
Súhrn
Prevalence obou těchto chorob narůstá. Diabetes, stejně jako demence, není homogenní choroba. Všem formám diabetu je společná hyperglykemie. Všechny formy demence spojuje progredující kognitivní deteriorace. Pacient s diabetem 2. typu má významně vyšší riziko vzniku demence než osoba stejného věku a pohlaví, která má normální glukózovou homeostázu. Je zde nějaká souvislost? Článek se zaměřuje na funkce inzulinu v mozku, na dopady centrální inzulinové rezistence na naše kognitivní schopnosti a psychiku a na hledání dalších molekulárních souvislostí mezi porušenou glukózovou homeostázou a vznikem demence. Srovnána je přitom situace u dvou nejčastějších forem diabetu, tj. diabetu 1. a 2. typu. Vztah mezi diabetem a demencí ještě zdaleka není jasný, ale zdá se, že důležitým společným jmenovatelem diabetu i demence bude inzulinová rezistence. Na častějším vzniku demence u diabetiků se dále jistě podepisují s diabetem související vaskulární změny a závažnější hypoglykemie. Vzhledem k negativnímu dopadu obou chorob na postiženého jedince i celou společnost se jedná o téma, kterým je potřeba se intenzivně zabývat.
Klíčová slova:
diabetes – demence – inzulin – inzulinová rezistence – hyperglykemie – hypoglykemie –glykemická variabilita – signalizační kaskádaÚvod
Mezi největší světové medicínské problémy současnosti patří diabetes a demence. Jejich výskyt významně narůstá, a navíc dochází k posunu jejich manifestace do mladších věkových kategorií(1). Uvádí se, že ve věkové skupině osob starších 65 let je prevalence diabetu (konkrétně diabetu 2. typu, viz dále) 26 % a prevalence demence 11 %(2). Tyto choroby mají navíc přímý dopad nejen na postiženého jedince a jeho rodinu. V důsledku socioekonomické zátěže, kterou přináší, negativně ovlivňují celou společnost. Na první pohled by se mohlo zdát, že tyto stavy spolu nesouvisejí, ale opak je pravdou. Alespoň v některých případech může být provázanost velmi těsná a nejen jednosměrná. Hledání společného jmenovatele (jmenovatelů) obou chorobných stavů přitahuje nyní stále větší vědeckou pozornost. Je to logické, pouze podrobné poznání patofyziologického pozadí nemoci umožní její účinnou léčbu a v optimálním případě i prevenci. Souvislosti mezi diabetem a demencí jsou si vědomi nejen odborníci, kteří se zabývají kognitivními problémy, ale i diabetologové. O tom svědčí i to, že na letošním největším evropském diabetologickém kongresu (kongres EASD – European Association for the Study of Diabetes), který se konal v září v bavorském Mnichově, byla tomuto tématu věnována opravdu značná pozornost. V tomto přehledovém článku se pokusím přiblížit informace, které tam byly prezentovány, jakož i ty, které na toto téma byly publikovány v recentní odborné literatuře.
Diabetes mellitus
Článek není primárně určen diabetologům, proto si zde dovolím uvést několik poznámek k samotnému diabetu.
V České republice se počet pacientů léčených s diagnózou diabetu již zvolna začíná blížit magickému číslu jeden milion. Konkrétně podle posledních dat ÚZIS (Ústav zdravotnických informací a statistiky) je u nás pro diabetes sledováno 862 tisíc osob(3). Nejvíce zastoupeným typem je diabetes mellitus 2. typu (DM2, 91,7 % případů), na druhém místě je pak diabetes 1. typu (6,8 % všech diabetiků)(3). Podle současně platné klasifikace diabetu rozeznáváme ještě další dvě skupiny diabetu: „ostatní specifické formy diabetu“ (do této skupiny patří například monogenně vázaný diabetes, diabetes vzniklý v souvislosti s cystickou fibrózou, diabetes navozený užíváním léků – typicky se jedná o steroidy a některé další, spíše již raritní podtypy diabetu) a poslední skupinu představuje gestační diabetes(4). Ten by se vzhledem k našemu základnímu tématu mohl zdát být irelevantní. Takříkajíc pro pořádek je ho ale v rámci připomenutí současné klasifikace diabetu nutné zmínit. Navíc u pacientek s touto dočasnou formou diabetu je zhruba 50% riziko rozvoje zejména DM2 v jejich dalším životě.
Hyperglykemie
Všem formám diabetu je společná hyperglykemie. Glykemie je za fyziologických okolností udržována ve velmi úzkém rozmezí. Lačná glykemie se pohybuje za fyziologických podmínek pod hranicí 5,6 mmol/l, neklesá ale přitom do pásma hypoglykemie (tj. pod 3,3 mmol/l). Po zátěži (jídlo, zátěžový test glukózou) nepřesáhne její hodnota 7,8 mmol/l (měřeno ve venózní plazmě)(4). Příčina vzniku hyperglykemie se mezi jednotlivými formami diabetu liší. V případě DM1, který vzniká spíše u mladších a neobézních jedinců, je příčinou vzniku hyperglykemie autoimunitní zánět, který zničí beta-buňky slinivky břišní. Není pak jiná léčebná alternativa než inzulinoterapie. Situace u pacienta s DM2 je odlišná. Typický pacient s DM2 je starší jedinec s nadváhou nebo obezitou, u kterého nejprve dominuje zvýšená inzulinová rezistence. Tu beta-buňky nějakou dobu zvládají kompenzovat zvýšenou produkcí inzulinu. K manifestaci diabetu pak dochází, když již produkce inzulinu přestává dostačovat.
První příznak DM2 – komplikace
Pacient s DM2 může mít již v době stanovení diagnózy přítomné chronické diabetické komplikace a obvykle jsou přítomné i další komponenty metabolického syndromu. Chronické diabetické komplikace nejsou nikdy přítomné v době stanovení diagnózy u pacientů s DM1.
Pacient s DM2 může i dlouho unikat diagnóze. Dlouho trvající hyperglykemie u pacientů s DM2 obvykle totiž tedy nevede k nápadnému metabolickému rozvratu, a to díky tomu, že zbytková sekrece inzulinu potlačuje ketogenezi a tím i rozvoj diabetické ketoacidózy. Vede však k rozvoji chronických diabetických komplikací a není výjimečná situace, kdy na možnou přítomnost DM2 upozorní například oftalmolog. Problémem v případě DM2 je, jak jsem se již zmínila, posun manifestace diabetu i ostatních komponent metabolického syndromu do mladšího věku. To jistě souvisí s nárůstem nadváhy a obezity mezi mladšími jedinci(4).
Pro pochopení dále uvedených souvislostí je potřeba si připomenout, jak vypadá transport glukózy přes buněčnou membránu a jak vypadá energetický metabolismus v našem mozku.
Transport glukózy přes buněčnou membránu
Glukóza může být transportována přes buněčnou membránu buď facilitovanou difuzí pomocí GLUT (GLUcose Transporter) přenašečů nebo sekundárně aktivním transportem (prostřednictvím tzv. SGLT transportérů). Z transportérů GLUT (známe GLUT 1–7) pouze GLUT 4 závisí na inzulinu. Inzulin po navázání na svůj receptor zvyšuje počet GLUT 4 transportérů v membráně příslušných buněk. GLUT 4 je transportérem glukózy v tzv. inzulin-dependentních tkáních (kosterní sval, myokard a tuková tkáň). GLUT 1 a 3 slouží k udržení bazálního vychytávání glukózy tkáněmi, jejichž metabolismus je na glukóze závislý (mozek, erytrocyty, ale také ledviny a placenta)(5). Je přitom již dlouho známo, že hyperglykemie vede k downregulaci GLUT 1 přenašečů v mozku(6).
Energetický metabolismus CNS
I když mozek tvoří jen 2 % tělesné hmotnosti, jeho metabolické nároky jsou vysoké. Jedná se o 20 % celkové spotřeby kyslíku a 25 % celkové spotřeby glukózy. Největší podíl této spotřeby se využije na průběžné udržování membránového potenciálu prostřednictvím Na+/K+-ATPázy a na další děje související s přesunem iontů přes buněčnou membránu. Hodnota respiračního kvocientu mozku se velmi blíží 1. To znamená, že metabolismus mozku využívá téměř výhradně sacharidové zdroje, konkrétně glukózu. Za den ji náš mozek spotřebuje asi 120 g a na její nedostatek je, podobně jako na nedostatek kyslíku, velmi citlivý. Co se týká jiných energetických zdrojů, mozek (na rozdíl od většiny periferních tkání) nevyužívá mastné kyseliny, protože jsou v krvi transportovány ve vazbě na albumin, a tak je pro ně hematoencefalická bariéra nepropustná. Mozek se při dlouhotrvajícím hladovění umí metabolicky adaptovat na spotřebu ketolátek(5).
Inzulin a mozek
Z těchto informací by se mohlo zdát, že inzulin není pro mozek důležitý, že glukóza může do mozkových buněk vstoupit i bez inzulinu. To sice ano, inzulin ale plní v mozku důležitou funkci. O tom svědčí i to, že v mozku najdeme poměrně hojně exprimované inzulinové receptory, a to v oblastech, jako jsou hypothalamus, hippocampus a mozková kůra. Inzulin hraje roli v našem jídelním chování, v udržení optimální tělesné hmotnosti, ale i ve vývoji neuronů či v kognitivních funkcích. Je důležitý pro tvorbu a udržování neuronálního spojení, jakož i pro vlastní přežití neuronů. Z tohoto důvodu se jeho účinek promítá do našich paměťových procesů a schopnosti učit se(7-9).
Velmi účinným vědeckým způsobem vedoucím ke zjištění, jaký má daná látka (v našem případě inzulin) účinek v konkrétní tkáni, je vyřadit ji u experimentálního zvířete z činnosti. Pokud u pokusné myši tedy vyřadíme inzulinové receptory v mozku, vede to u ní ke vzniku obezity, hyperfagie a ke zhoršení citlivosti na inzulin v celém těle(10). Aktivace inzulinové kaskády v mozkových buňkách se promítá do periferie, a to prostřednictvím modulace autonomního nervového systému(11-12). V hypothalamu pokusných zvířat, která měla obezitu navozenou buď geneticky, nebo dietou, byly nalezeny odchylky v inzulinové signalizační kaskádě, které jsou nalézány i u periferní inzulinové rezistence (jedná se o odchylky v proximální části této dráhy)(13-14).
Inzulin a hematoencefalická bariéra
Logicky se nabízí otázka – jak inzulin překonává hematoencefalickou bariéru (HEB)? Existuje pro něj saturovatelný transportní systém, díky kterému inzulin proniká do určitých oblastí mozku (do hypothalamu, pontomedulární oblasti, hippocampu, striata, parietálního a frontálního kortexu)(15). Je ale velice zajímavé, že jsou oblasti mozku, kam se inzulin takto nedostává. Konkrétně se jedná o střední mozek, thalamus a okcipitální kůru (16). Ze zvířecích studií je známo, že poruchu tohoto transportního systému přes HEB můžeme nalézt například u inzulinové rezistence navozené obezitou, ale například i v případě hladovění či u zvířat, která hibernují. Pro to, že transport inzulinu přes HEB je u inzulinové rezistence porušen, existují i data z humánních studií, kdy osoby s inzulinovou rezistencí měly poměr koncentrace inzulinu v mozkomíšním moku ve vztahu k inzulinemii snížený oproti osobám s normální citlivostí na inzulin(17). Objevily se dokonce i zprávy, že inzulin může být v mozku syntetizován, ale tato informace je stále poněkud sporná(18).
Obr. 1. Mechanismy podporující vznik demence u pacienta s diabetem a možnosti, jak se jí bránit 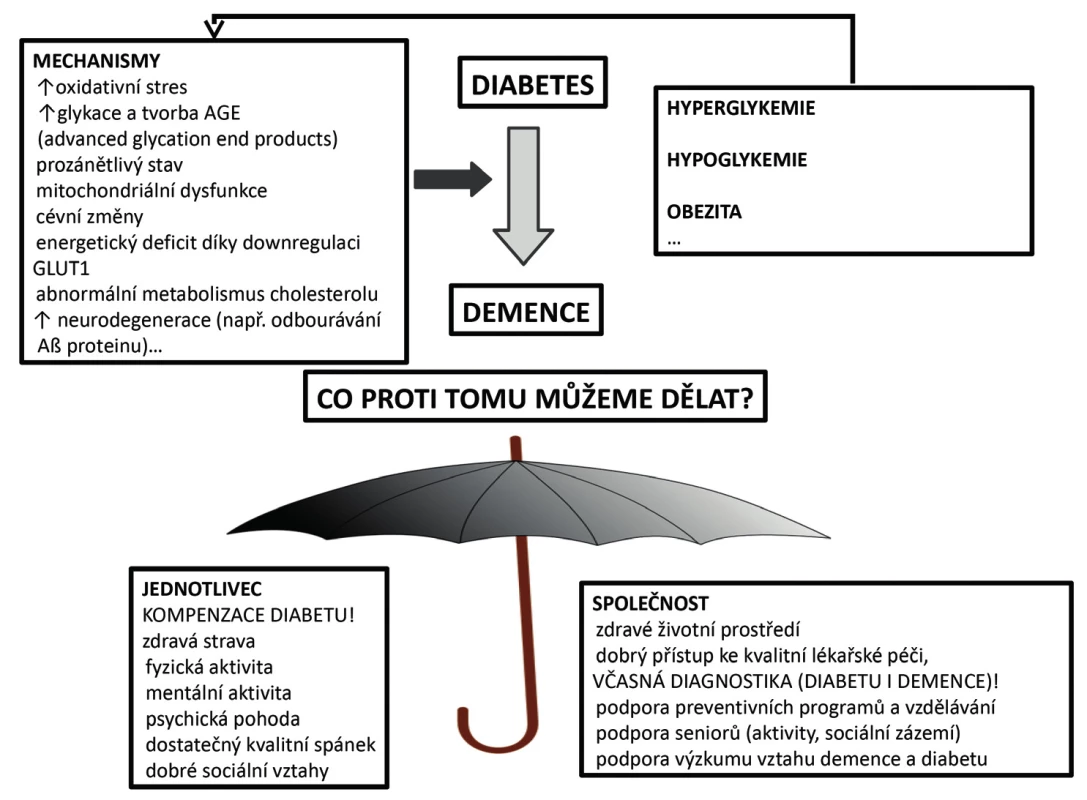
Inzulin a psychika
Vliv inzulinu v mozku na energetickou homeostázu je myslím logický. Hůře uchopitelný může být pro nás vztah inzulinu ke kognitivním funkcím a psychice. Dnes je již známo, že zvýšená inzulinová rezistence v mozku se podílí na vytvoření dopaminergní dysfunkce, která se podílí na vzniku úzkosti a poruch chování(19). Myšlenka změnit mentální stav člověka pomocí inzulinu je přitom téměř stejně stará jako vlastní objev inzulinu. Takzvaný inzulinový šok se používal například u pacientů s deliriem tremens nebo při léčbě závislosti na morfin či u psychóz(20). Tato idea byla sice z dnešního pohledu (pato)fyziologicky ne zcela scestná, ale tento postup byl naprosto nehumánní a s příchodem nových léků byl naštěstí opuštěn. Stejně jako existuje dále rozebíraný vztah diabetu a demence, existuje i souvislost mezi diabetem a depresí, kde spojení mezi nimi představuje inzulinová rezistence, dysregulace osy hypothalamus-hypofýza-nadledviny a prozánětlivý stav organismu(21).
Zvýšené riziko demence
Osoby léčené pro DM2 mají obecně zvýšené relativní riziko vzniku demence, a to 2 - až 2,5násobně oproti nediabetické věkově srovnatelné populaci se srovnatelným zastoupením obou pohlaví. V lednu 2016 byly publikovány výsledky velké studie, kde byla k dispozici data z 2365 sekčních nálezů. Autoři uveřejnili závěr, že přítomnost diabetu je asociována s vaskulárně podmíněnou demencí, ale že nejsou přítomné významně častěji neuropatologické nálezy typické pro Alzheimerovu demenci (AD)(22). To, že demence u diabetiků vzniká častěji na vaskulárním podkladě, bylo prezentováno i na EASD, kdy v přednášce prof. Biesselse z Holandska zaznělo, že RR (relativní riziko) pro vznik jakékoliv demence je u pacienta s diabetem 1,7; vaskulární demence 2,3 a RR pro AD je 1,6(23). Uvádí se též, že i u osob s DM2, které nevyvinou demenci, je možné pozorovat mírné progresivní zhoršování kognitivních funkcí, a to zejména ve složkách, jako jsou paměť, učení se, rychlost zpracování informací a exekutivní funkce(24). Tyto funkční změny mají svůj morfologický korelát, který lze ozřejmit pomocí zobrazovacích metod. Jedná se především o mozkovou atrofii, kdy je postižena šedá i bílá hmota. Nejvýraznější změny lze pozorovat v oblastech frontálního a temporálního kortexu. Další patrnou změnou může být postižení malých cév(25). Změny v podstatě odpovídají změnám spojeným se stárnutím, s tím ale, že celý proces je zhruba o 5 let urychlen oproti skutečnému kalendářnímu věku jedince. Dalším zajímavým faktem je, že tyto změny dokonce mohou předcházet vlastní manifestaci diabetu(26). Uvádí se, že u pacientů s DM je až o 40 % vyšší výskyt MCI (tj. mírného kognitivního deficitu, MCI – mild cognitive impairment). Amnestického i neamnestického. Toto tvrzení platí zejména, pokud diabetes vznikl před 65. rokem věku a/nebo trvá déle než 10 let. Přídatné rizikové faktory přitom představují léčba inzulinem a přítomnost chronických diabetických komplikací(27-29). Na EASD byl též prezentován specifický termín „DM associated cognitive decrements“, což bych přeložila jako „ s diabetem asociované horšení kognitivních funkcí“ (23). Přítomnost diabetu také zvyšuje riziko progrese MCI do klinicky zjevné demence(30). Riziko vzniku demence se zvyšuje už ve fázi prediabetu, a to dokonce i pokud nedojde k progresi do diabetu(31). Též se uvádí, že až 80 % jedinců s AD má porušenou glukózovou toleranci nebo mají již přímo diabetes(32).
Inzulinová rezistence a Alzheimerova choroba
Demence u pacienta s diabetem má obvykle znaky demence kombinované etiologie, byť například již výše zmíněná recentní studie nepotvrdila častější nález pro AD typických neuropatologických změn u zemřelých diabetiků(22). Jiná práce ale uvádí, že změny typické pro Alzheimerovu demenci lze pozorovat v hypothalamu a tyto změny předchází vzniku zjevných kognitivních problémů. Postižení hypothalamu může přitom dále vést k porušení homeostatických funkcí řídících energetickou bilanci a periferní metabolismus(33).
Nikdo ale dnes již myslím nezpochybňuje, že na patofyziologii AD se podílí inzulinová rezistence. Zdá se, že fosforylace serinu v molekule IRS1 (insulin receptor substrate 1) může být společným znakem AD i diabetu. Výraznější fosforylace IRS1 je pozitivně korelována s větší přítomností Ab plaků a logicky negativně s kognitivními schopnostmi a pamětí. Navíc je zde spojitost s přehnanou aktivací dalšího enzymu, konkrétně GSK-3b (glycogen synthase kinase), což dále vede k hyperfosforylaci s mikrotubuly asociovaného proteinu tau(34-36). Oligomery Ab zase stimulují signalizaci zprostředkovanou prozánětlivým TNF-a, a to přes další molekulární změny vede k porušení inzulinové signalizace. Navíc tyto plaky mají přímou schopnost navozovat ztrátu inzulinových receptorů na povrchu neuronů a inhibují tak odpověď neuronů na inzulin. Děje se tak zejména v hippocampu. Je tedy jasné, že vztah mezi AD a diabetem (inzulinovou rezistencí) je určitě obousměrný. Pozitivně v pokusech na zvířatech tento „bludný kruh“ ovlivnila určitá antidiabetika – jednak to byl rosiglitazon a jednak pak vildagliptin (tj. inhibitor dipeptidylpeptidázy 4)(37).
Intranazální inzulin
Vědecká pozornost se v poslední době stále více obrací k ovlivnění učení a paměti pomocí inzulinu podávaného intranazálně. Inzulin podávaný touto cestou má navíc možná potenciál upravovat dysbalanci osy hypothalamus-hypofýza-nadledviny a pozitivně ovlivňovat psychické ladění (náladu). Pokusné osoby měly po intranazálně podaném inzulinu a po vystavení stresové situaci nižší hladinu kortizolu, nižší tepovou frekvenci i krevní tlak(38). Jednoduše řečeno – lépe tolerovaly stresovou situaci. Přímý vstup inzulinu do mozku při intranazálním podání je umožněn tím, že bulbus olfactorius patří mezi ta místa mozku, kde není přítomná hematoencefalická bariéra(39). Je to velmi zajímavý nápad, že by se takto podávaný inzulin mohl uplatňovat v léčbě demence (možná i deprese) či k ovlivnění jídelního chování. Situace ale není tak jednoduchá, jak by se mohla na první pohled zdát. Je sice pravda, že u pokusných osob snižuje takto podávaný inzulin zájem o potravu, ale jen u štíhlých jedinců, ne u obézních. U nich však zůstal zachován příznivý dopad na kognici (konkrétně deklarativní paměť), náladu a na osu hypothalamus-hypofýza-nadledviny(40). To je samozřejmě příznivé. Tato oblast si tedy zaslouží další výzkum, není například jasné, jaké dávky jsou ideální, zda je bezpečné dlouhodobé podávání, zda je nutné při volbě dávky zohledňovat pohlaví, protože je rozdíl v reakci na intranazální inzulin mezi muži a ženami,atd.
DM1 a demence
Psala jsem zejména o DM2. Jaká je situace u druhého nejčastějšího typu, tj. u DM1? Otázka je to logická zejména vzhledem k tomu, že se DM1 manifestuje častěji u mladších jedinců a byl pozorován významný nárůst počtu nových případů především u předškolních dětí. Ty mají pak před sebou celý život, tj. mnoho desítek let života, s diabetem. Je známo, že kognitivní schopnosti mohou být porušeny u osob (dětí) s DM1. Jedná se zejména o kognitivní flexibilitu, vizuální percepci, psychomotorické tempo a pozornost. Mentální zpomalení je přitom uváděno jako dominující projev(28). Rovněž jsou popisovány negativní změny nálady (depresivita). Je též známo, že mladší věk (méně než 7 let) v době manifestace DM1 představuje vyšší riziko vzniku kognitivního poškození(41). Očekávaná doba dožití se u pacientů s DM1 s příchodem nových terapeutických možností (inzulinové pumpy, glukózové senzory, nové typy inzulinu) prodlužuje. Zatím ale nemáme dostatek dat o situaci (výskyt demence) u pacientů s DM1, kteří by byli nyní starší 65 let a přitom by byli od mládí léčeni pro tuto chorobu. Musíme si uvědomit, že dnes pětašedesátiletý diabetik 1. typu, který by byl pro DM1 léčen řekněme od 4 let věku, byl diagnostikován v roce 1955. Terapie DM1 v té době byla opravdu nesrovnatelná s dnešní situací a zlom přišel až na konci 80. let minulého století s výsledky studie DCCT (Diabetes Control and Complication Trial), která jasně ukázala na nutnost intenzifikovat inzulinový režim u pacientů s DM1 (42). Situace se tedy změnila a lze říci, byť to vyznívá poněkud ironicky, že dítě, které dnes onemocní diabetem ve svých 4 letech, má šanci se dožít své demence. Otázkou ale zůstává, zda se tak stane dříve, než kdyby toto dítě diabetem netrpělo. Úmyslně jsem si vybrala jako příklad tuto nízkou věkovou kategorii, kde, stejně jako u seniorů, představuje z hlediska funkce mozku těžší hypoglykemie větší riziko než akutní hyperglykemie. Je známo, že u pacientů s DM1 denzita šedé kůry mozku koreluje s glykovaným hemoglobinem a přítomností těžkých hypoglykemií(28, 43).
Komplikace v nižším věku
Glykovaný hemoglobin je marker dlouhodobé kompenzace, který odráží průměrnou glykemii za poslední tři měsíce. Neodráží ale glykemické fluktuace, které jsou u diabetiků podstatně výraznější než u osob bez diabetu. Posuzování této tzv. glykemické variability (jejím nejjednodušším vyjádřením je směrodatná odchylka glykemií z glykemických profilů) se stalo dalším důležitým prvkem hodnocení kompenzace diabetu a s příchodem kontinuální monitorace koncentrace glukózy (navíc i v reálném čase) můžeme opravdu zlepšit kompenzaci našich spolupracujících pacientů. Je známo, že prudké glykemické fluktuace jsou nezávislým rizikovým faktorem rozvoje kognitivní dysfunkce i u osob s DM2(44). Pacient s diabetem mellitem 1. typu v době manifestace choroby má samozřejmě hyperglykemii, zvýšená inzulinová rezistence ale není přítomná. Je tedy důležité zabránit jejímu rozvoji u pacienta s DM1 v budoucnu. Proto je potřeba, aby si pacient s DM1 udržel normální hmotnost a byl dostatečně fyzicky aktivní. Pacienti s DM1 nejsou samozřejmě ušetřeni epidemie obezity. Na rozvoji nadváhy či obezity a zvýšené inzulinové rezistence se u pacientů s DM1 mohou navíc výrazně podílet i subklinické poruchy jídelního chování, které jsou v diabetické populaci podstatně častější než v nediabetické populaci. Pokud má pacient s DM1 nadváhu nebo je přímo obézní, může tak vlastně získat i rysy pacienta s DM2. To je pak problém, protože se rizikové faktory pro další zdravotní komplikace sdružují.
Tělo při exogenním přívodu inzulinu je navíc vystaveno suprafyziologickým koncentracím inzulinu, protože v případě aplikace inzulinu do periferních tkání odpadá tzv. efekt prvního průchodu inzulinu játry, kdy je značná část vyprodukovaného inzulinu degradována. Hyperinzulinemie inhibuje periferní degradaci Ab proteinu, protože inzulin má vyšší afinitu k jednomu z enzymů degradujících Ab protein(45).
U pacientů s DM1 se také objevuje hypertenze, dyslipidemie, rozvíjejí se mikro - a makrovaskulární komplikace. Makrovaskulární komplikace, které jsou důsledkem akcelerované aterosklerózy, tj. ICHS a cévní mozkové příhody (CMP), dále pak zvyšují riziko vzniku demence. Rozvoj všech těchto přidružených komplikací (ICHS, CMP) můžeme u pacienta s DM1 čekat v nižším věku než u nediabetika.
V experimentu měly diabetické myši navíc kvůli poškozenému neuroplastickému mechanismu nižší pravděpodobnost, že se zotaví po cévní mozkové příhodě(46).
Diabetes a obezita
Na závěr bych uvedla několik zajímavých údajů, které ukazují, jak je důležitá správná výživa. Přesto, že se to může zdát divné, potenciálním modulátorem fyziologické funkce mikroglie se zdá být střevní mikrobiom(47). Obezita sama o sobě (i bez diabetu) zvyšuje riziko demence, objevuje se mozková atrofie, postiženy jsou exekutivní funkce a paměť. Platí to ale pouze, pokud postihuje osoby středního věku, u starších 60 let tento vztah podle našich dosavadních znalostí již neplatí. U nich bylo ale popsáno, že hmotnostní redukce má potenciál zlepšit neurokognitivní funkce(48). Bohužel ale, jak jsem již psala, přibývá mladších osob, které mají nadváhu nebo jsou přímo obézní. Také narůstá počet obézních těhotných, což představuje velký problém pro další generace. Vnitřní prostředí a metabolismus matky totiž mechanismem epigenetických změn mění genovou expresi u dítěte. Existují informace, že dítě obézní matky bude mít s větší pravděpodobností již v dětství neurokognitivní problémy(2). V roce 2015 byla publikována velká analýza více než 11 tisíc osob, která rozděluje podle různých znaků včetně genetických DM2 do 3 podtypů, kde právě pro podtyp 3 je charakteristickou známkou přítomnost neurologického postižení, kardiovaskulární onemocnění, ne ale rozvoj nefro-a/nebo retinopatie(49).
Závěrem
Inzulin, glykemie a další metabolické faktory jistě funkci našeho mozku ovlivňují(50). Zatím se zdá být nejlepší prevencí rozvoje demence zdravý životní styl a dostatek intelektuální stimulace. U pacientů s již manifestovaným diabetem je to pak snaha o co nejvyrovnanější glykemie. Přitom je potřeba vyvarovat se těžších hypoglykemií. Zvlášť u malých dětí, seniorů a také u pacientů s porušeným vnímáním hypoglykemie není vhodné trvat na příliš těsné kompenzaci diabetu, kdy stoupá riziko hypoglykemie. Pokud se u pacienta s diabetem léčeným inzulinem či obecně léky s hypoglykemizujícím účinkem začíná rozvíjet kognitivní deficit, je potřeba pomoci vyřešit pacientovi situaci i z hlediska ošetřovatelského. Vyšší dávka inzulinu (hypoglykemizujícího antidiabetika), záměna inzulinu či vynechání jídla po aplikaci inzulinu – to vše může vyústit ve fatální hypoglykemii. Takový pacient s kognitivním deficitem vyžaduje komplexní dohled a pomoc.
Pokud má pacient s diabetem nadváhu nebo je obézní, je potřeba mu vysvětlit komplexní negativní dopady tohoto stavu, které zahrnují i oblast našeho myšlení.
doc. MUDr. Kateřina Štechová, Ph.D.
Interní klinika 2. LF UK a FN Motol Praha
doc. MUDr. Kateřina Štechová, Ph.D.
e-mail: katerina.stechova@lfmotol.cuni.cz
Pracuje na Interní klinice 2. LF UK a FN v Motole jako diabetolog-endokrinolog. Věnuje se rovněž výuce pre - i postgraduálních studentů. Má široký medicínský přehled, postupně získala specializaci v oborech: pediatrie (I. st.), klinická alergologie a imunologie, lékařská genetika, endokrinologie a diabetologie. V minulosti se věnovala výzkumu diabetu na molekulární úrovni. Diabetes zůstává i nadále středem jejího odborného zájmu, nyní ale spíše z klinického úhlu pohledu. Je autorkou řady článků v českém i zahraničním odborném tisku, několika monografií a kapitol v dalších publikacích.
Zdroje
1. Goldwaser EL, Acharya NK, Sarkar A, et al. Breakdown of the Cerebrovasculature and Blood-Brain Barrier: A Mechanistic Link Between Diabetes Mellitus and Alzheimer‘s Disease. J Alzheimers Dis 2016; 54(2): 445–456.
2. Stoeckel LE, Arvanitakis Z, Gandy S, et al. Complex mechanisms linking neurocognitive dysfunction to insulin resistance and other metabolic dysfunction. Version 2. F1000Res. 2016; 5 : 353.
3. http://www.uzis.cz/rychle-informace/cinnost-oboru-diabetologie-pece-diabetiky-roce-2013. Staženo 14. 10. 2016
4. Pelikánová T. Klasifikace a diagnostika diabetu a poruch glukózové homeostázy. In: Pelikánová T, Bartoš V a kol. Praktická diabetologie. Praha: Maxdorf 2011; 58–70.
5. http://fblt.cz/skripta/regulacni-mechanismy-2-nervova-regulace/3-energeticky-metabolismus-nervove-tkane/ Staženo 14. 10. 2016
6. Matthaei S, Horuk R, Olefsky JM. Blood-brain glucose transfer in diabetes mellitus. Decreased number of glucose transporters at blood-brain barrier. Diabetes 1986; 35(10): 1181–1184.
7. Plum L, Schubert M, Brüning JC. The role of insulin receptor signaling in the brain. Trends Endocrinol Metab 2005; 16(2): 59–65.
8. Choi K, Kim YB. Molecular mechanism of insulin resistance in obesity and type 2 diabetes. Korean J Intern Med 2010; 25(2): 119–129.
9. Havrankova J, Roth J, Brownstein M. Insulin receptors are widely distributed in the central nervous system of the rat. Nature 1978; 272(5656): 827–829.
10. Brüning JC, Gautam D, Burks DJ, et al. Role of brain insulin receptor in control of body weight and reproduction. Science. 2000;289(5487):2122-2125.
11. Obici S, Zhang BB, Karkanias G, et al. Hypothalamic insulin signaling is required for inhibition of glucose production. Nat Med 2002; 8(12): 1376–1382.
12. Scherer T, O‘Hare J, Diggs-Andrews K, et al. Brain insulin controls adipose tissue lipolysis and lipogenesis. Cell Metab 2011; 13(2): 183–194.
13. Clegg DJ, Gotoh K, Kemp C, et al. Consumption of a high-fat diet induces central insulin resistance independent of adiposity. Physiol Behav 2011; 103(1): 10–16.
14. Niswender KD, Morrison CD, Clegg DJ, et al. Insulin activation of phosphatidylinositol 3-kinase in the hypothalamic arcuate nucleus: a key mediator of insulin-induced anorexia. Diabetes 2003; 52(2): 227–231.
15. Banks WA, Jaspan JB, Kastin AJ. Selective, physiological transport of insulin across the blood-brain barrier: novel demonstration by species-specific radioimmunoassays. Peptides. 1997; 18(8): 1257–1262.
16. Banks WA, Kastin AJ. Differential permeability of the blood-brainbarrier to two pancreatic peptides: insulin and amylin. Peptides 1998; 19(5): 883–889.
17. Heni M, Schöpfer P, Peter A, et al. Evidence for altered transport of insulin across the blood-brain barrier in insulin-resistant humans. Acta Diabetol 2014; 51(4): 679–681.
18. Ghasemi R, Haeri A, Dargahi L et al. Insulin in the brain: sources, localization and functions. Mol Neurobiol 2013; 47(1): 145–171.
19. Kleinridders A, Cai W, Cappellucci L, et al. Insulin resistance in brain alters dopamine turnover and causes behavioral disorders. Proc Natl Acad Sci U S A. 2015; 112(11): 3463–3468.
20. James FE. Insulin treatment in psychiatry. History of Psychiatry 1992; 3 : 221–235.
21. Silva N, Atlantis E, Ismail K. A review of the association between depression and insulin resistance: pitfalls of secondary analyses or a promising new approach to prevention of type 2 diabetes? Curr Psychiatry Rep 2012; 14(1): 8–14.
22. Abner EL, Nelson PT, Kryscio RJ, et al. Diabetes is associated with cerebrovascular but not Alzheimer‘s disease neuropathology. Alzheimers Dement 2016; 12(8): 882–889.
23. Biessels GJ. Diabetes and dementia: more than a chance finding. Přednáška. 14. 9. 2016, kongres EASD, Mnichov, Německo.
24. Biessels GJ, Strachan MW, Visseren FL, et al. Dementia and cognitive decline in type 2 diabetes and prediabetic stages: towards targeted interventions. Lancet Diabetes Endocrinol 2014; 2(3): 246–255.
25. Biessels GJ, Reagan LP. Hippocampal insulin resistance and cognitive dysfunction. Nat Rev Neurosci 2015; 16(11): 660–671.
26. Brundel M, Kappelle LJ, Biessels GJ. Brain imaging in type 2 diabetes. Eur Neuropsychopharmacol 2014; 24(12): 1967–1981.
27. Luchsinger JA, Reitz C, Patel B, et al. Relation of diabetes to mild cognitive impairment. Arch Neurol 2007; 64(4): 570–575.
28. McCrimmon RJ, Ryan CM, Frier BM. Diabetes and cognitive dysfunction. Lancet 2012; 379(9833): 2291–2299.
29. Roberts RO, Geda YE, Knopman DS, et al. Association of duration and severity of diabetes mellitus with mild cognitive impairment. Arch Neurol 2008; 65(8): 1066–1073.
30. Saedi E, Gheini MR, Faiz F, et al. Diabetes mellitus and cognitive impairments. World J Diabetes 2016; 7(17): 412–422.
31. Kravitz E, Schmeidler J, Schnaider Beeri M. Type 2 diabetes and cognitive compromise: potential roles of diabetes-related therapies. Endocrinol Metab Clin North Am 2013; 42(3): 489–501.
32. Janson J, Laedtke T, Parisi JE, et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes 2004; 53(2): 474–481.
33. Ishii M, Iadecola C. Adipocyte-derived factors in age-related dementia and their contribution to vascular and Alzheimer pathology. Biochim Biophys Acta 2016; 1862(5): 966–974.
34. Liu Y, Liu F, Grundke-Iqbal I, et al. Deficient brain insulin signalling pathway in Alzheimer‘s disease and diabetes. J Pathol 2011; 225(1): 54–62.
35. Deng Y, Li B, Liu Y, et al. Dysregulation of insulin signaling, glucose transporters, O-GlcNAcylation, and phosphorylation of tau and neurofilaments in the brain: Implication for Alzheimer‘s disease. Am J Pathol 2009; 175(5): 2089–2098.
36. Takashima A. GSK-3 is essential in the pathogenesis of Alzheimer‘s disease. J Alzheimers Dis 2006; 9(3 Suppl): 309–317.
37. Pipatpiboon N, Pintana H, Pratchayasakul W, et al. DPP4-inhibitor improves neuronal insulin receptor function, brain mitochondrial function and cognitive function in rats with insulin resistance induced by high-fat diet consumption. Eur J Neurosci 2013; 37(5): 839–849.
38. Bohringer A, Schwabe L, Richter S, et al. Intranasal insulin attenuates the hypothalamic-pituitary-adrenal axis response to psychosocial stress. Psychoneuroendocrinology 2008; 33(10): 1394–1400.
39. Born J, Lange T, Kern W, et al. Sniffing neuropeptides: a transnasal approach to the human brain. Nat Neurosci 2002; 5(6): 514–516.
40. Hallschmid M, Benedict C, Schultes B, et al. Obese men respond to cognitive but not to catabolic brain insulin signaling. Int J Obes (Lond) 2008; 32(2): 275–282.
41. Ryan CM. Diabetes and brain damage: more (or less) than meets the eye? Diabetologia 2006; 49(10): 2229–2233.
42. The DCCT Research Group: DCCT the Diabetes Control and Complications Trial). Design and methodologic considerations for the feasibility phase. Diabetes 1986; 35(5): 530–545.
43. Musen G, Lyoo IK, Sparks CR, et al. Effects of type 1 diabetes on gray matter density as measured by voxel-based morphometry. Diabetes 2006; 55(2): 326–333.
44. Rizzo MR, Marfella R, Barbieri M, et al. Relationships between daily acute glucose fluctuations and cognitive performance among aged type 2 diabetic patients. Diabetes Care 2010; 33(10): 2169–2174.
45. Verdile G, Fuller SJ, Martins RN. The role of type 2 diabetes in neurodegeneration. Neurobiol Dis 2015; 84 : 22–38.
46. Sweetnam D, Holmes A, Tennant KA, et al. Diabetes impairs cortical plasticity and functional recovery following ischemic stroke. J Neurosci 2012; 32(15): 5132–5143.
47. Erny D, Hrabě de Angelis AL, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015; 18(7): 965–977.
48. Horie NC, Serrao VT, Simon SS, et al. Cognitive Effects of Intentional Weight Loss in Elderly Obese Individuals With Mild Cognitive Impairment. J Clin Endocrinol Metab 2016; 101(3): 1104–1112.
49. Li L, Cheng WY, Glicksberg BS, et al. Identification of type 2 diabetes subgroups through topological analysis of patient similarity. Sci Transl Med. 2015; 7(311): 311–174.
50. Lee SH, Zabolotny JM, Huang H, et al. Insulin in the nervous system and the mind: Functions in metabolism, memory, and mood. Mol Metab 2016; 5(8): 589–601.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2016 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Editorial
- Můžeme předpovědět úmrtí geriatrických pacientů na klostridiovou infekci?
- Může sérová hladina vitaminu D ovlivnit délku hospitalizace seniora?
- Diabetes a demence – co je známo o jejich vztahu?
- Akutní a pozdní komplikace diabetu – představují významný problém ve vyšším věku?
- Specifika tuberkulózy u seniorů dnes
- Obstipace ve stáří
- Antikoagulační léčba ve stáří
- Kožní lymfomové onemocnění u geriatrického pacienta
- Závěrem
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Obstipace ve stáří
- Diabetes a demence – co je známo o jejich vztahu?
- Akutní a pozdní komplikace diabetu – představují významný problém ve vyšším věku?
- Kožní lymfomové onemocnění u geriatrického pacienta
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




