-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mobilita jako klíčový faktor zdravého stárnutí
Mobility as a key factor for healthy ageing
Topinková E. Mobility as a key factor for healthy ageing
With advancing age older people shift their attention to health and physical fitness. Maintaining physical capacity including safe walking and mobility contribute significantly to overall health and wellbeing. In this context, professional community is using terms such as intrinsic capacity, frailty, sarcopenia but also wellbeing, fitness, and resilience. Limited mobility is an early sign of declining physical performance and fitness in older people. Mobility limitations increase with advancing age. About 35 % of persons in their 7th decade and majority of octogenarians report limited mobility in their own social environment – apartment and its nearby surroundings. Limited or even lost mobility is a complex multifactorial process that not only worsens quality of life but also increases risk of falling, fall-related injuries, hospitalization, and overall mortality.
In this narrative review we provide the definition of mobility, describe age-related changes and risk factors including cognitive, neuromuscular, psychological, and behavioural factors contributing to mobility limitations. Also, we summarize mobility assessment tools, recognition of the early manifestation and potential approaches to prevent mobility disorders. Exercise training programs involve aerobic exercise (walking), strength and balance training that show the highest effectiveness in improving mobility and gait, increase muscle mass and strength, decrease falls rate, and improve performance in daily activities.
Keywords:
mobility – mobility limitations – Physical fitness – Physical activity – frailty – healthy ageing
Autori: Eva Topinková
Pôsobisko autorov: Geriatrická klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Geriatrie a Gerontologie 2021, 10, č. 1: 15-22
Kategória: Přehledový článek
Súhrn
Topinková E. Mobilita jako klíčový faktor zdravého stárnutí
Se zvyšujícím se věkem se pozornost seniorů zaměřuje na jejich zdravotní stav a fyzickou zdatnost. Udržení fyzických schopností včetně bezpečné chůze a pohybu významně přispívá k pocitu zdraví ve stáří. V této souvislosti se stále více mezi odbornou veřejností diskutují termíny jako například vnitřní kapacita (intrinsic capacity), křehkost, sarkopenie, ale i pocit pohody, fitness a odolnost. Jedním z časných projevů ubývající zdatnosti či fitness je omezená mobilita staršího člověka. Omezení v mobilitě narůstají se zvyšujícím se věkem. Kolem 35 % sedmdesátiletých a většina osmdesátiletých osob udává omezení pohyblivosti v sociálním prostředí bytu a jeho blízkém okolí. Omezení, nebo dokonce ztráta mobility je komplexní multifaktoriálně podmíněný proces, který starého člověka činí náchylnějšího k pádům, úrazům, hospitalizacím, zhoršuje kvalitu života i celkovou mortalitu.
V tomto přehledovém článku se pokusíme podat definici mobility, zaměříme se na věkově podmíněné změny a rizikové faktory včetně kognitivních poruch, neuromuskulární, psychologické a behaviorální faktory přispívající k omezení mobility. Stručně shrneme vyšetřovací nástroje ke zhodnocení mobility, k rozpoznání časných poruch a možné směry v prevenci. Tréninkové cvičební programy zahrnující aerobní cvičení (chůze), posilovací a rovnovážná cvičení mají největší účinnost pro zlepšování mobility a chůze, zvyšují svalovou hmotu i svalovou sílu, snižují výskyt pádů a zlepšují výkonnost v provádění běžných denních činností.
Klíčová slova:
mobilita – omezení mobility – fyzická zdatnost – fyzická aktivita – Frailty – zdravé stárnutí
Úvod
V dokumentu World report on ageing and health z roku 2015 zdůrazňuje Světová zdravotnická organizace (WHO) význam zdravého stárnutí a hlavní zásady pro jeho dosažení shrnuje ve strategickém dokumentu Globální strategie a akční plán pro stárnutí a zdraví (Global strategy and action plan on ageing and health) 2016–2020.(1) Současná dekáda 2020–2030 byla vyhlášena dekádou zdravého stárnutí – Healthy Ageing Decade.(2) Zdravé stárnutí definuje WHO jako proces nabývání a udržování funkčních schopností, které umožňují životní pohodu (wellbeing) ve vyšším věku. Funkční schopnosti jedince závisejí na všech jeho fyzických a duševních schopnostech označovaných WHO jako vnitřní kapacita (intrinsic capacity), na faktorech prostředí a jejich vzájemné interakci. Faktory prostředí jsou chápány v širším kontextu od fyzického prostředí přes vztahy s ostatními lidmi po systém a organizaci služeb, kulturní, společenské a politické uspořádání, sociální postoje a hodnotový systém.
Významnou determinantou funkčních schopností seniora je mobilita – schopnost pohybu, pohyblivost. Omezená schopnost pohybovat se je častou stížností starších lidí. Kolem 35 % lidí starších 70 let a většina osob starších 85 let udává problémy nebo omezení při chůzi nebo při zdolávání schodů.(3) Omezení pohyblivosti nejenže zhoršuje kvalitu života a psychosociální zdraví, ale je spojeno se zvýšeným rizikem pádů a poranění, zdravotním postižením – disabilitou a také zvýšenou mortalitou.(4) Proto je nezbytné porozumět mechanismům a rizikům rozvoje omezené mobility. Nízká fyzická aktivita přispívá ke zhoršování mobility, má ale i další negativní dopady na celkové zdraví, kardiovaskulární, metabolické a další chronické choroby. Bylo potvrzeno, že u starších osob je nízký stupeň fyzické aktivity spojen se sarkopenií a poruchou mobility.(5) Je také známo, že většina populace nad 65 let v rozvinutých zemích nedosahuje doporučené úrovně fyzické aktivity.(6) Proto je nezbytné omezovat sedavý způsob života a inaktivitu do nejvyššího věku a udržet mobilitu jako jednu z cest k dosažení nezávislosti, soběstačnosti, zdraví a prevence předčasného úmrtí seniorů. Podle některých gerontologů je mobilita, respektive dysmobilita a omezení pohybu jednou z hlavních charakteristik stárnutí a měla by být při klinickém vyšetření pacienta sledována jako další vitální funkce.(7) Z uvedeného vyplývá důležitost posuzování a monitorování mobility v klinické praxi geriatra a potřeba včasného vyhledávání osob, které mají mobilitu omezenou nebo jsou dysmobilitou ohrožené. Je také třeba ověřit a zavést do praxe postupy a programy, které by umožnily prevenci poruch mobility u ohrožených osob a udržení, zlepšení a kompenzaci již přítomného postižení.
Jak definujeme mobilitu
V současnosti není jednotná definice mobility. Základní koncept chápe mobilitu jako „schopnost jedince pohybovat se nezávisle ve svém prostředí“.(8) V podrobnější definici Webbera et al. se pod pojmem mobilita rozumí „schopnost jedince pohybovat se (buď samostatně, nebo s použitím pomůcek nebo transportních prostředků) v prostředí, které kromě vlastního domova zahrnuje i nejbližší okolí a oblasti mimo ně“.(9) Tato definice lépe odráží komplexnost termínu mobilita a zahrnuje víceré determinanty mobility – nejenom fyzické, kognitivní, finanční, psychosociální, ale i kulturní, environmentální a infrastrukturální. Pokud chápeme mobilitu v tomto širším kontextu, je zřejmé, že při posuzování mobility seniora musíme uplatňovat holistický přístup. Je také třeba zaměřit se na mobilitu v průběhu celého života, nejen ve stáří – jde o celoživotní perspektivu, tzv. life course přístup, doporučovaný WHO. V kontextu již zmíněné vnitřní kapacity ovlivňují mobilitu fyzické schopnosti, tj. především chůze, rovnováha a svalová síla, dále neuromuskulární funkce, kognitivní schopnosti, psychosociální a behaviorální faktory.
Rovnováha a chůze jsou klíčové pro udržení mobility
Posturální kontrola zahrnuje statickou fázi (rovnováhu) a dynamickou fázi (chůze). V klidové, statické fázi zůstává těžiště těla nad opěrnou bází, zatímco při chůzi se jak těžiště, tak opěrná báze dynamicky pohybují.
Rovnováha. Pro udržení rovnováhy za klidových podmínek jsou potřebné intaktní zrak, propriocepce a vestibulární systém. S věkem se zhoršují senzorické funkce, udržení rovnováhy se stává obtížnějším. Senzorické systémy poskytují zpětnou vazbu a omezují drobné oscilační pohyby okolo těžiště za klidových podmínek a za situace, kdy je funkce některého systému vyřazena (například když v místnosti zhasne světlo a vyřadí se zraková kontrola). Vyřazení jednoho senzorického systému obvykle nevede k zásadnímu omezení mobility. Pokud však je postižení vícečetné (hodnocené poklesem skóre globálního senzorického indexu), dochází již k negativnímu ovlivnění mobility.(10)
Chůze a její změny během stárnutí. Podle většiny studií je pro postižení či omezení mobility charakteristická změna chůze. Hodnocení chůze a její poruchy jsou využívány jako důležitý parametr při posuzování fyzické zdatnosti. Bylo prokázáno, že rychlost chůze je také parametr, který predikuje zdravotní komplikace, například pády, ale i celkovou mortalitu. V analýze 9 kohortových studií zahrnujících 34 485 osob nad 65 let (průměrný věk 73,5 roku ± 5,9), kteří byli sledováni 6–21 let, byla rychlost chůze spolu s věkem a pohlavím ukazatelem predikujícím délku dožití.(11) Graf na obrázku 1 zachycuje průměrný počet let očekávaného přežití u mužů a žen v jednotlivých věkových skupinách ve vztahu k rychlosti chůze. Nejdelší přežití měly osoby, které byly schopny chodit rychlostí 1,6 m/s, a to u obou pohlaví a v každé věkové skupině. Průměrná rychlost chůze v celém souboru byla 0,92 ± 0,27 m/s.
Obr. 1. Rychlost chůze u mužů a žen ve vztahu k mortalitě (upraveno podle Studenski et al., 2011)11 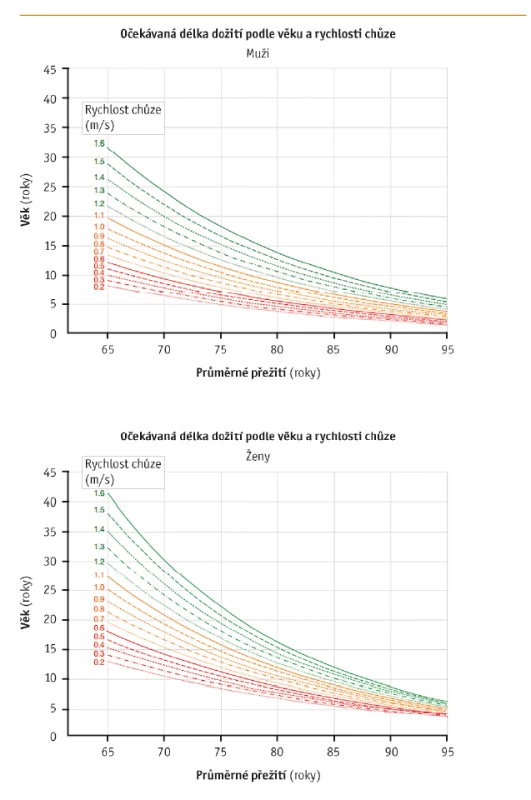
Chůze je však vysoce komplexní proces, který je výsledkem intaktní funkce muskuloskeletálního systému a také centrálního (bazální ganglia a motorický kortex) a periferního nervového systému.(12) Jedním z nejčastěji měřených parametrů v gerontologickém výzkumu je rychlost chůze za běžných podmínek. Jde o chůzi, kdy vyšetřovaný jde určenou trasu svým obvyklým tempem, obvyklou rychlostí. Označuje se také jako normální/obvyklá rychlost chůze tzv. usual gait speed.(11) Rychlost chůze určuje v tomto případě vyšetřovaný. Naproti tomu rychlá chůze nebo chůze v časovém limitu – kdy je vyšetřovaný instruován, aby prošel trasu maximální možnou rychlostí – umožňuje odhalit i funkční rezervu testovaného. Kromě rychlosti se při vyšetření chůze zaměřujeme i na další charakteristiky, například na délku a výšku kroku a na jejich kadenci a změny poměru mezi statickou a dynamickou fází kroků. Klesající délka i výška kroku s věkem vedou ke zpomalení chůze.(13) Ukazuje se, že zpomalování rychlosti chůze bez ohledu na příčinu, je nepříznivým prognostickým znakem. Metaanalýza 9 observačních studií zahrnujících více než 12 000 osob nad 65 let prokázala u osob s nejpomalejší chůzí riziko úmrtí zvýšené o 89 % oproti nejrychlejší skupině.(14) Pro jednoznačný vztah chůze s celkovou mortalitou bylo vyšetření chůze navrhováno jako další vitální parametr pro geriatrii.(7) Z praktického hlediska je důležité, že schopnost rychlé chůze poklesá dříve než obvyklá rychlost v klidových podmínkách.(15) To je důležité například při přecházení silnice se světelným semaforem, kdy rychlost potřebná k bezpečnému překonání musí být větší než 1,2 m/s. Například longitudinální populační irská studie TILDA dokumentovala, že až jedna třetina osob potřebné rychlosti chůze nedosahuje a přecházení silnice je pro ně stresující a nebezpečné.(16) Ve věkové skupině nad 80 let nebylo schopno dosáhnout rychlosti 1,2 m/s 73 % osob. V italské studii InCHIANTI se potvrdilo, že výkonnost v rychlé chůzi začíná klesat již po 50. roce věku, zatímco chůze normální rychlostí zůstala zachována do 65–70 let.(15) To má za následek klesající rezervní kapacitu v rychlosti chůze (počítá se jako rozdíl mezi maximální a obvyklou rychlostí chůze) a neschopnost lidí vysokého věku zvýšit rychlost chůze, včetně situací, kdy by jim hrozilo nebezpečí. U osob s narůstající křehkostí a závislostí dochází k dalšímu omezení mobility a zpomalení chůze s dalšími riziky funkčního poklesu, disability a v konečném důsledku i institucionalizace. Tabulka 1 uvádí jednotlivá rizika s ohledem na zpomalující se rychlost chůze.(17)
Tab. 1. Rychlost chůze ve vyšším věku a rizika spojená se zpomalením chůze (upraveno dle Abellan van Khan, 2009) (17) 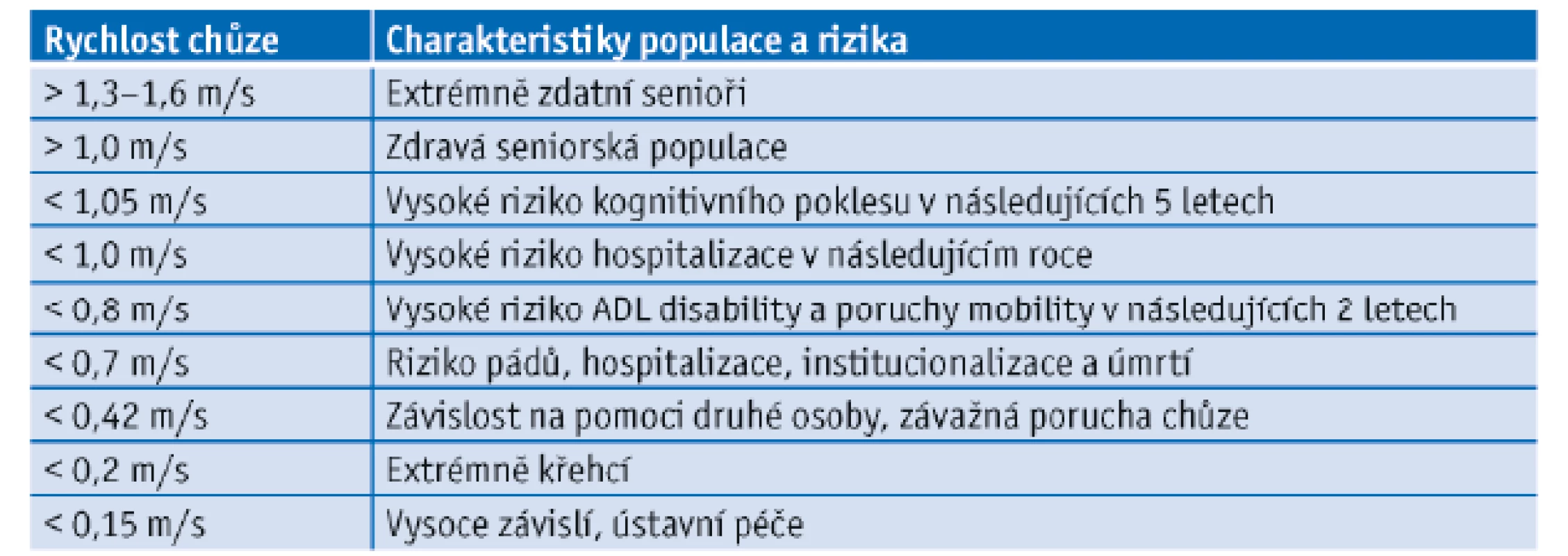
ADL - aktivity denního života Mobilita a stárnutí neuromuskulárního systému
V průběhu stárnutí dochází ke změnám svalových vláken, zmenšuje se jejich velikost, a to dominantně rychlých vláken typu II. Právě tato vlákna generují svalový výkon nutný například k postavení ze sedu.(18) Kromě změn velikosti svalových vláken dochází ke změnám motorických jednotek tvořených alfa motoneuronem a jím inervovaných svalových vláken. Redukce počtu motoneuronů může být jedním z patofyziologických mechanismů věkem podmíněné sarkopenie.(19) Zbývající motorické jednotky kompenzatorně hypertrofují, což zvyšuje počet svalových vláken inervovaných jedním motoneuronem. V průběhu remodelace může docházet k reinervaci a tvorbě nových axonálních spojení z vedlejších motoneuronů. Zvyšuje se také variabilita nervového signálu během maximální izometrické svalové kontrakce ve svalech s redukovaným počtem motorických jednotek, redukce může dosahovat 30–40 %.(18) Zdá se, že tento mechanismus je zodpovědný za svalovou slabost i při zachovalé svalové hmotě.
Věkem podmíněné změny svalové hmoty, svalové síly a svalového výkonu
Z klinické praxe i populačních studií je známo, že s věkem klesá svalový výkon.(20) Svalový výkon je podmíněn množstvím svalové hmoty, svalovou sílou a rychlostí svalové kontrakce. Maxima svalové hmoty i síly dosahujeme ve třetí dekádě života a následně dochází k pozvolnému poklesu.(15) Pokles svalové hmoty je způsoben tukovou infiltrací svalu a úbytkem svalových vláken. Ztráta svalové hmoty mezi 30. a 80. rokem věku může dosahovat až 40 % u fyzicky neaktivních osob. Je zajímavé, že pokles svalové hmoty a síly neprobíhá synchronně. Svalová síla klesá rychleji než svalová hmota. Ztráta 1 % svalové hmoty znamená úbytek svalové síly o 3 %. Proto byla původní Rosenbergova definice sarkopenie jako ztráty svalové hmoty revidována a rozšířena. Podle konsenzu Evropské pracovní skupiny pro sarkopenii u starších osob (EWGSOP, 2019) je v definici sarkopenie obsažena nejen ztráta svalové hmoty, ale zejména její kvality, která negativně ovlivňuje svalovou sílu, ale i parametry chůze.(21) Rychlost chůze je v této definici zahrnuta jako marker funkčního postižení mobility a nepřímo celkové fyzické výkonnosti/zdatnosti.(21,22) Sarkopenie u starších osob zhoršuje jejich celkovou fyzickou zdatnost, především vede k omezené mobilitě (obtížná nebo pomalá chůze do schodů, nejistá chůze v nerovném terénu a za ztížených podmínek), vyššímu riziku pádů, pomalé rekonvalescenci při akutním onemocnění nebo hospitalizaci a dalším negativním zdravotním dopadům.(18,21,23) Metody a testy využívané pro diagnózu sarkopenie v klinické praxi a hraniční hodnoty jednotlivých testů jsou přehledně zachyceny v tabulce 2.
Tab. 2. Metody a testy využívané pro diagnostiku sarkopenie 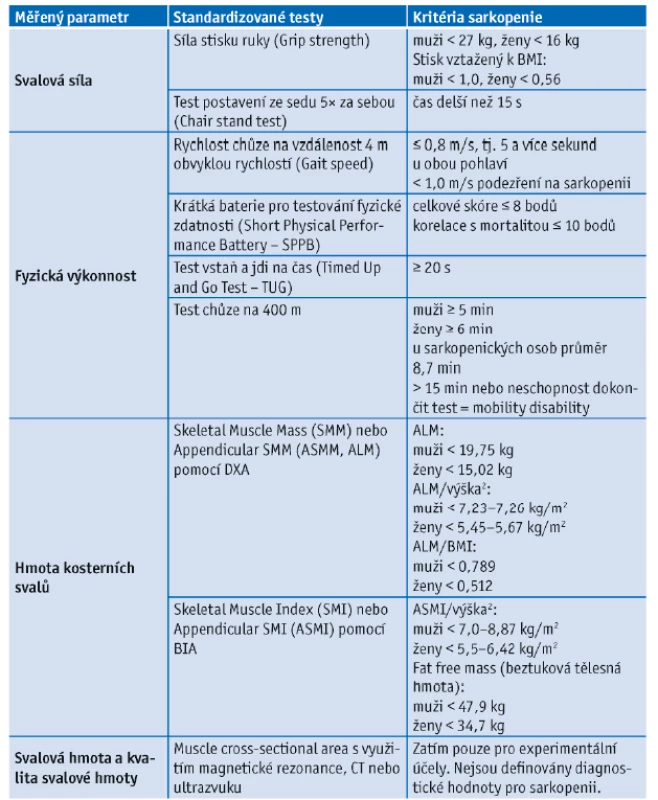
BIA - bioimpedanční analýza, DXA - dual emission X-ray absorptiometry Z experimentálních i klinických studií vyplynulo, že energie svalové kontrakce (muscle power) klesá se zvyšujícím se věkem a inaktivitou rychleji než svalová síla. Energie svalové kontrakce dolních končetin je určující pro mobilitu a pro schopnost postavit se ze sedu na židli bez opory rukou nebo stoupat po schodech bez přidržování se madla nebo bez opory hole. Reid et al. v longitudinální studii potvrdili pokles energie svalové kontrakce s věkem asi o 3 % ročně, která významně koreluje se snižující se rychlostí chůze a narůstajícím časem v testu postavení ze židle (Chair stand test, viz tab. 2.).(24) Můžeme tedy shrnout, že mobilitu nejvíce ovlivňuje klesající dynamika pohybu dolních končetin vyjádřená rychlostí a silou svalové kontrakce. Klesá-li síla svalové kontrakce pod limitní hodnotu, manifestuje se omezením mobility. Další pokles síly pak vede k tzv. mobility disability, to znamená k zdravotnímu postižení s praktickou/funkční imobilitou. Tito pacienti jsou významně omezeni v chůzi, vyžadují oporu kompenzačních pomůcek, nejčastěji chodítka, a vyžadují dohled, popřípadě dopomoc při chůzi.(15) Vhodným testem pro klinickou praxi, který má i prediktivní hodnotu pro rozvoj poruch mobility v následujících letech, je Krátká baterie pro testování fyzické zdatnosti seniorů (Short Physical Performance Battery, SPPB). Podrobněji o tomto testu píše Berková et al.(25) Další progrese poruchy lokomoce ústí v plné upoutání na lůžko nebo židli/křeslo, kdy pacient vyžaduje pomoc jedné nebo dvou osob k postavení. V tomto případě jde již o plnou imobilitu se všemi riziky rozvoje imobilizačního syndromu a jeho klinických komplikací. Testy na vyšetření mobility již nelze použít (podobně jako například u těžké demence, kdy již nemocný není schopen vyšetření MMSE testem, který by vyšel s nulovým skóre).
Věkem podmíněné změny kognitivních funkcí ve vztahu k mobilitě
U osob bez patologického postižení kognice dochází zejména ve vyšších věkových skupinách nad 75 let ke zhoršování schopnosti CNS zpracovat informace a signály, řešit problémové situace. Rychlost zpracování signálů začíná klesat již od třetí dekády života a lineárně dále klesá se stoupajícím věkem.(26) Současně klesají i pozornost a paměťové funkce. To může mít negativní vliv na mobilitu, chůzi a rovnováhu, neboť rychlé zpracování signálů ze senzorů je nezbytné pro dokonalou kontrolu motoriky. Významnou roli pro chůzi i rovnováhu hrají i exekutivní funkce, definované jako schopnost nezávislého, účelného a cíleného chování. Zahrnují schopnost řešit problémy, plánovat a organizovat činnost, což jsou základní schopnosti nutné pro mobilitu.
Výzkumy v posledních letech potvrdily, že chůze není automatická činnost, ale kognicí ovlivňovaný proces. To dobře dokumentuje skutečnost, že zvýšení kognitivní náročnosti chůze při duální činnosti (např. chůze + recitování básně) zhorší fyzické provedení chůze, dojde k jejímu zpomalení a riziku pádů.(27,28) Chůze je komplexní činnost a vyžaduje koordinovanou funkci oblastí zajišťujících pozornost, exekutivní a zrakově-prostorové funkce, dále mozečku, bazálních ganglií a motorického kortexu. Studie Gait and Brain (chůze a mozek) prokázala, že pokles rychlosti chůze může předcházet kognitivní poruchu/demenci o více než 10 let před jejími klinickými projevy.(29) V roce 2019 upozornila pracovní skupina vedená De Cockovou et al. na skutečnost, že podrobná analýza chůze a jejích spaciotemporálních charakteristik umožňuje diagnostikovat závažnost kognitivní poruchy. Na základě přidané další kognitivní činnosti (počítání nebo vyjmenovávání zvířat při chůzi) bylo možné odlišit Alzheimerovu a frontotemporální demenci od skupiny vaskulárních demencí a demencí s Lewyho tělísky až 3 roky před jejich klinickou diagnózou.(30)
Rizikové faktory omezené mobility
Chronická onemocnění. Nejvýznamnějším rizikovým faktorem pro omezenou mobilitu jsou chronická onemocnění. Finská studie na dvojčatech publikovaná Kujalou et al. ukázala, že téměř u čtvrtiny osob (23,2 %), které udávaly omezení mobility, bylo příčinou chronické onemocnění.(31) Nejčastější byla muskuloskeletální (60,2 %), kardiovaskulární (18,8 %) a neurologická onemocnění (7,7 %). V probíhajícím evropském projektu Mobilise-D (Connecting Digital Mobility Assessment to Clinical Outcomes; www.mobilise-d.eu) se ověřuje vliv chronických nemocí – například chronické obstrukční bronchopulmonální choroby, Parkinsonovy nemoci, srdečního selhání a stavů po fraktuře horní části stehenní kosti – na trajektorii dysmobility, a to nejen ve smyslu zpomalení chůze, ale také pomocí digitálně snímaného počtu kroků za den a času stráveného vsedě bez pohybu. Z výzkumu vyplynulo, že ztráta mobility je medicínským problémem sama o sobě, bez ohledu na vyvolávající diagnózu/diagnózy. Kromě snahy o stabilizaci příčinné chronické choroby se v léčbě musíme samostatně věnovat vlastnímu poklesu mobility a neméně intenzivně ji léčit.
Tělesné a duševní rizikové faktory dysmobility. Tělesná výkonnost podmíněná dostatečným svalovým výkonem je komplexní a multifaktoriální. Řada výzkumných studií identifikovala rizikové faktory pro rozvoj sarkopenie: sníženou anabolickou stimulaci v důsledku sedavého způsobu života, vynuceného klidu na lůžku, malnutrice, anorexie a hormonálních změn. Známý je katabolický vliv chorob, poranění, zánětu, oxidativního stresu, mitochondriální dysfunkce a zvýšení myostatinu na rozvoj sarkopenie.(32) Jak již bylo zmíněno, mají starší osoby s kognitivní poruchou významnější omezení mobility, které je prokazatelné již u mírné kognitivní poruchy a počínající demence. Porucha mobility se manifestuje nejdříve za ztížených vyšetřovacích podmínek (nutnost projít konkrétní dráhu, chůze plus další činnost). S progresí kognitivního deficitu pozorujeme omezení spontánního pohybu, narůstá apatie a neochota pacienta účastnit se pohybových aktivit, je zvýšené riziko pádů. V pokročilých fázích demence se ztrácí schopnost pohybových automatismů včetně chůze, pacient se stává zcela neschopen chůze, je apraktický a plně imobilní.
Psychologické rizikové faktory dysmobility. Jedním z problémů starších lidí je zvýšený výskyt pádů. U osob, které mají v anamnéze pád nebo vícečetné pády, nebo i u těch s nejistotou při chůzi se v praxi setkáváme se strachem z pádu. Tito lidé omezují nebo se zcela vyhýbají postavení a chůzi, popřípadě omezují chůzi a další fyzické aktivity mimo domov a často omezují i své sociální kontakty (obava ze společenské blamáže, pokud by museli žádat o pomoc).(33) V některých případech jde o úzkostnou nebo anxiózně-depresivní poruchu.
Sedavý způsob života je rizikovým faktorem pro omezenou mobilitu. Bohužel s rostoucím věkem se snižuje spontánní motorická aktivita, a proto jsou starší a staří lidé náchylní k sedavému způsobu života. Sedavý způsob života (v angličtině se užívá termín sedentary behavior neboli sedavé chování) je definován jako „jakákoli činnost v bdělém stavu, při které výdej energie nepřesahuje ≤ 1,5 MET (metabolického ekvivalentu) v poloze vsedě, polosedě nebo vleže“.(34) Výzkumy potvrzují úzký vztah mezi sedavým chováním a omezenou mobilitou, což může být zmírněno opakovanými kratšími přerušeními a negativní dopad na zdraví může být snížen.(35)
Významnou roli hrají i faktory prostředí, které mohou působit jako facilitátory nebo environmentální bariéry mobility (například překážky v bytě, vhodnost okolí domova pro chůzi – v angličtině se užívá termín walkability).
Vyšetření a posouzení mobility
Posouzení mobility umožňuje odhalit RF a predikovat možný rozvoj poruch mobility. Screening je vhodné provádět u seniorů nad 65 let a měl by být součástí posouzení funkčních schopností, fyzické zdatnosti a soběstačnosti, například v rámci pravidelných preventivních prohlídek v primární péči.
Vyšetření mobility umožní stratifikovat starší populaci na 3 skupiny:
a) senior s uspokojivou, věku odpovídající mobilitou a fyzickou zdatností,
b) senior v riziku rozvoje „mobility disability“,
c) senior s omezenou/limitovanou schopností pohybu.
Pro nezávisle žijící seniory se využívají sebehodnotící dotazníky, fyzické testy nebo data získaná ze senzorů (aktimetry, krokoměry, v současnosti i další „smart“ technologie).(36) Z funkčních testů užívaných v geriatrii se doporučují testy Vstaň a jdi (Get Up and Go, TUG), Krátký test pro hodnocení fyzické zdatnosti seniorů (Short Physical Performance Battery, SPPB) a testy hodnotící chůzi (6minutový test, test chůze na 400 metrů atd.). V sebehodnotících testech se posuzuje chůze do schodů, schopnost ujít 1 míli (1,7 km), používání pomůcek a jiné opory při chůzi atd. Objektivně se hodnotí rovnováha, chůze a svalová síla dolních končetin, vhodné je posoudit riziko pádů.(10)
Cesty pro zlepšení mobility, prevence dysmobility
Prokázanou efektivní intervencí pro prevenci i ovlivnění již přítomné dysmobility je cvičení. Vzhledem k fyziologickým změnám je třeba kombinovat cvičení zaměřené na zvyšování svalové síly, zlepšení chůze a rovnováhy.(32) Tato doporučení vycházejí z výsledků dosud největší studie LIFE (Lifestyle Interventions and Independence for Elders), která zahrnula 1635 osob s fyzickým omezením v riziku křehkosti ve věku 70 a více let v USA.(37) Tato randomizovaná kontrolovaná studie potvrdila příznivý efekt pohybové individualizované aktivity zahrnující chůzi, silová a rovnovážná cvičení na prevenci rozvoje „mobility disability“, definované jako neschopnost ujít vzdálenost 400 metrů v časovém limitu 15 minut (31,1 % v intervenované vs. 35,9 % v kontrolní necvičící skupině). Také trvalá porucha mobility byla častější u kontrolní skupiny (14,7 % intervenovaná vs. 19,8 % kontrolní skupina).(37) Podobný design má i v roce 2020 ukončená evropská studie SPRINTT (Sarcopenia & Physical fRailty IN older people: multi-componenT Treatment strategies), jejíž výsledky jsou očekávány v letošním roce.(38) V obou studiích se jednalo o dlouhodobý cvičební program (24–36 měsíců), individualizovanou cvičební zátěž prováděnou ve skupině za supervize vyškoleným instruktorem 2× týdně doplněnou o individuální domácí cvičení 2× týdně.
Tyto výzkumy navázaly na úspěšný program OTAGO, který zahrnoval chůzi a domácí balanční a posilovací cvičení individuální i skupinová.(39) U 80letých a starších žen vedlo cvičení ke snížení pádů o 32 %, zlepšení fyzické zdatnosti a poklesu 12měsíční mortality (relativní riziko 0,48; 95% CI 0,25–0,80).(40)
Přes pozitivní výsledky těchto studií i u seniorů nad 70–80 let jsou pochybnosti o tom, zda je možné udržet podobnou formu, frekvenci, intenzitu, a především adherenci ke cvičení mimo klinické studie bez supervize a monitorování terapeutem. Proto nový koncept pro zvýšení fyzické aktivity doporučuje zařadit cvičební aktivity cíleně do denních rutinně prováděných činností. Jde například o každodenní chůzi do obchodu nebo pravidelnou denní vycházkovou trasu.(41) Možné je také zařadit posilovací nebo rovnovážná cvičení do běžných činností: například před každým usednutím na židli provést nejprve několikrát posazení a postavení nebo při vaření u kuchyňské linky provádět činnost v obtížnější rovnovážné poloze (s chodidly u sebe nebo v semitandemovém postoji).(42) Pacient si tak nemusí vyhrazovat čas jen pro cvičení, což může usnadnit jeho motivaci a compliance. V současnosti se ověřují i další nové modely například formou videoher či telerehabilitace spojené s koučinkem, zaměřené na zlepšení fyzické zdatnosti.
Závěr
Mobilita je nejvýznamnějším faktorem ovlivňujícím funkční stav seniora, soběstačnost a kvalitu života. Omezení mobility a v nejzávažnější fázi praktická imobilita (omezení pohybu na několik kroků a metrů) a plná imobilita s upoutáním na křeslo nebo lůžko mají závažné klinické, sociální i ekonomické důsledky. Cílem zdravého stárnutí je udržení nezávislosti a funkční zdatnosti, jejíž součástí je schopnost pohybovat se bezpečně, bez omezení, bez obtíží a přiměřenou rychlostí. K naplnění tohoto cíle je důležitý screening mobility a možných rizik a širší zapojení praktických lékařů. Potřebný je i rozvoj preventivních programů, zejména prevence pádů a úrazů, udržení tělesné zdatnosti, obratnosti, síly a vytrvalosti, které by byly široce dostupné, popřípadě i hrazené nebo s částečným příspěvkem ze zdravotního pojištění.
prof. MUDr. Eva Topinková, CSc.
Od roku 2001 je přednostkou Geriatrické kliniky 1. LF UK a VFN v Praze, od r. 1997 vedoucí Subkatedry geriatrie Institutu postgraduálního vzdělávání ve zdravotnictví. Na 1. LF UK zavedla výuku geriatrie do magisterského studia lékařství a řady bakalářských studijních programů, je předsedkyní oborové rady postgraduálního doktorandského studia Gerontologie, které iniciovala, předsedkyní specializační oborové rady geriatrie 1. LF UK. Je vědeckou sekretářkou České gerontologické a geriatrické společnosti, past-prezidentkou klinické sekce IAGG-ER (International Association of Gerontology and Geriatrics European Region) a Akademické rady EuGMS (European Geriatric Medicine Society) a dalších mezinárodních organizací (interRAI, UEMS, SIOG). Je řešitelkou a koordinátorkou řady mezinárodních výzkumných projektů v oblasti epidemiologie, disability, klinických a sociálních aspektů geriatrické péče. Dále je autorkou a spoluautorkou více než 20 monografií a vysokoškolských učebnic a více než 450 odborných a vědeckých publikací.
Korespondenční adresa:
prof. MUDr. Eva Topinková, CSc.
Geriatrická klinika 1. LF UK a VFN
Londýnská 15
120 00 Praha 2
e-mail: eva.topinkova@vfn.cz
Zdroje
1. World Health Organization. World Report on Ageing and Health. WHO 2015. Dostupné z: www.who.int/life-course/publications/2015-ageing-report/en/.
2. World Health Organization. Decade of Healthy Ageing (2021-2030). WHO 2021. Dostupné z: https://www.who.int/ageing/decade-of-healthy-ageing.
3. Cummings SR, Studenski S, Ferrucci LA. Diagnosis of dismobility – giving mobility clinical visibility: a Mobility Working Group recommendation. JAMA 2014; 311 : 2061–2062.
4. Musich S, Wang SS, Ruiz J, et al. The impact of mobility limitations on health outcomes among older adults. Geriatr Nurs 2018; 39 : 162–169.
5. Gill TM, Gahbauer EA, Murphy TE, et al. Risk factors and precipitants of long-term disability in community mobility: a cohort study of older persons. Ann Intern Med 2012; 156 : 131–140.
6. Hallal PC, Andersen LB, Bull FC, et al. Global physical activity levels: surveillance progress, pitfalls, and prospects. Lancet 2012; 380 : 247–257.
7. Brabrand M, Kellett J, Opio M, et al. Should impaired mobility on presentation be a vital sign? Acta Anaesthesiol Scandinavica Acta 2018; 62 : 945–952.
8. Mitchell JA, Johnson-Lawrence V, Williams EG, Thorpe jr R. Characterizing mobility limitations among older African American men. J Nat Med Assoc 2018; 110 : 190–196.
9. Webber SC, Porter MM, Menec VH. Mobility in older adults: A comprehensive framework. Gerontologist 2010; 50 : 443–450.
10. Freiberger E, Sieber CCh, Kob R. Mobility in older community-dwelling persons: a narrative review. Front Physiol 2020; 11 : 881.
11. Studenski S, Perera S, Patel K, et al. Gait speed and survival in older adults. JAMA 2011; 305 : 50–58.
12. Clark BC, Woods AJ, Clark LA, et al. The aging brain & the dorsal basal ganglia: implications for age-related limitations of mobility. Adv Geriatr Med Res 2019; 1: e190008.
13. Herssens N, Verbecque E, Hallemans A, et al. Do spatiotemporal parameters and gait variability differ across the lifespan of healthy adults? A Sys Rev Gait Posture 2018; 64 : 181–190.
14. Liu B, Hu X, Zhang Q, et al. Usual walking speed and all-cause mortality risk in older people: a systematic review and meta-analysis. Gait Posture 2016; 44 : 172–177.
15. Ferrucci L, Cooper R, Shardell M, et al. Age-related change in mobility: Perspectives from life course epidemiology and geroscience. J Gerontol Ser A Biol Sci Med Sci 2016; 71 : 1184–1194.
16. Donoghue OA, Savva GM, Borsch-Supan A, Kenny RA. Reliability, measurement error and minimum detectable change in mobility measures: a cohort study of community-dwelling adults aged 50 years and over in Ireland. BMJ 2019; 9: e030475.
17. Abellan van Kan G, Rolland Y, Andrieu S, et al. Gait speed at usual pace as a predictor of adverse outcomes in community-dwelling older people an International Academy on Nutrition and Aging (IANA) Task Force. J Nutr Health Aging 2009; 13 : 881–889.
18. Tieland M, Trouwborst I, Clark BC. Skeletal muscle performance and ageing. J Cachex Sarcop Musc 2018; 9 : 3–19.
19. Drey M, Krieger B, Sieber CC, et al. Motoneuron loss is associated with sarcopenia. J Am Med Dir Assoc 2014; 15 : 435–439.
20. Ferrucci L, Baroni M, Ranchelli A, et al. Interaction between bone and muscle in older persons with mobility limitations. Curr Pharm 2014; 20 : 3178–3197.
21. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. M et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019; 48 : 16–31.
22. Topinková E. Sarkopenie, revidovaná evropská kritéria 2018. Geri Gero 2019; 8(1): 14–19.
23. Topinková E. Sarkopenie jako závažné orgánové selhání, její diagnostika a současné možnosti léčby. Vnitř Lék 2018; 64(11): 1038–1052.
24. Reid KF, Pasha E, Doros G, et al. Longitudinal decline of lower extremity muscle power in healthy and mobility-limited older adults: influence of muscle mass, strength, composition, neuromuscular activation and single fiber contractile properties. Eur J Appl Physiol 2014; 114 : 29–39.
25. Berková M, Topinková E, Mádlová P, et al. Krátká baterie pro testování fyzické zdatnosti seniorů – pilotní studie a validizace testu u starších osob v České republice. Vnitř Lék 2013; 59 : 256–263.
26. Salthouse TA. Trajectories of normal cognitive aging. Psychol Aging 2019; 34 : 17–24.
27. Verghese J, Holtzer R, Lipton RB, Wang C. Mobility stress test approach to predicting frailty, disability, and mortality in high-functioning older adults. J Am Geriatr Soc 2012; 60 : 1901–1905.
28. Verghese J, Wang C, Lipton RB, Holtzer R. Motoric cognitive risk syndrome and the risk of dementia. J Gerontol A Biol Sci Med Sci 2013; 68 : 412–418.
29. Montero-Odasso M, Speechley M, Muir-Hunter S W, et al. Motor and cognitive trajectories before dementia: results from Gait and Brain Study. J Am Geriatr Soc 2018; 66 : 1676–1683.
30. De Cock AM, Fransen E, Perkisas S, et al. Comprehensive quantitative spatiotemporal gait analysis identifies gait characteristics for early dementia subtyping in community dwelling older adults. Front Neurol 2019; 10 : 313.
31. Kujala UM, Hautasaari P, Vähä-Ypyä H, et al. Chronic diseases and objectively monitored physical activity profile among aged individuals – a cross-sectional twin cohort study. Ann Med 2019; 51 : 78–87.
32. Marzetti E, Calvani R, Tosato M, et al. Physical activity and exercise as countermeasures to physical frailty and sarcopenia. Aging Clin Exp Res 2017; 29 : 35–42.
33. Bielaková K, Matějovská Kubešová H, Weber P. Prevence a management instability a pádů u geriatrických nemocných. Geri Gero 2014; 3(1): 25–28.
34. Tremblay MS, Aubert S, Barnes JD, et al. Sedentary Behavior Research Network (SBRN) – Terminology Consensus Project process and outcome. Int J Behav Nutr Phys Act 2017; 14 : 75.
35. Scher LML, Barros MVG, Chen Z, Anton SD. Sedentary time and disability in older adults: a systematic review and meta-analysis. J Aging Sci 2019; 7 : 206.
36. Soubra R, Chkeir A, Novella JL. A systematic review of thirty-one assessment tests to evaluate mobility in older adults. BioMed Res Int 2019 : 1354362.
37. Pahor M, Guralnik JM, Ambrosius WT. Effect of structured physical activity on prevention of major mobility disability in older adults: the LIFE study randomized clinical trial. JAMA 2014; 311 : 2387–2396.
38. Landi F, Cesari M, Calvani R, et al. The Sarcopenia and Physical fRailty IN older people: multi-componenT Treatment strategies (SPRINTT) randomized controlled trial: design and methods. Aging Clin Exp Res 2017; 29 : 89–100.
39. Campbell J, Robertson C, Gardner M, et al. Falls prevention over 2 years: a randomized controlled trial in women 80 years and older. Age Ageing 1999; 28 : 513–518.
40. Thomas S, Mackintosh S, Halbert J. Does the ‘Otago exercise programme’ reduce mortality and falls in older adults?: a systematic review and meta-analysis. Age Ageing 2010; 39 : 681–687.
41. Weber M, Belala N, Clemson L, et al. Feasibility and effectiveness of intervention programmes integrating functional exercise into daily life of older adults: a systematic review. Gerontology 2018; 64 : 172–187.
42. Boulton E, Weber M, Hawley-Hague H, et al. Attitudes towards adapted lifestyle-integrated functional exercise developed for 60-70-year-olds: perceptions of participants and trainers. Gerontology 2019; 65 : 599–609.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2021 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Metamizol v terapii akutních bolestí hlavy
-
Všetky články tohto čísla
- Editorial
-
Hodnocení disability s využitím nástroje WHODAS 2.0 u geriatrických pacientů.
Pilotní studie WHODAS-GERI - Knihy
- WHODAS 2.0
- Mobilita jako klíčový faktor zdravého stárnutí
- Kniha
- Sarkopenická obezita: od vzniku k intervenci
- Jak určit kardiovaskulární riziko u geriatrických pacientů?
- Obrovskobuněčná arteriitida – závažné onemocnění vyššího věku
-
Standard nutriční péče v geriatrii
Nutriční screening a proces péče
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Sarkopenická obezita: od vzniku k intervenci
-
Standard nutriční péče v geriatrii
Nutriční screening a proces péče - Mobilita jako klíčový faktor zdravého stárnutí
-
Hodnocení disability s využitím nástroje WHODAS 2.0 u geriatrických pacientů.
Pilotní studie WHODAS-GERI
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




