-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Infekční endokarditida – diagnostika a doporučené postupy
Infectious endocarditis – diagnostics and guidelines
Despite the progress in diagnostics and treatment, infectious endocarditis continues to be a severe disease where the incidence is not decreasing. The nature of the disease in developed countries has been changing due to aging of the population, an increasing number of comorbidities and changing risk factors. The European Society of Cardiology has published new guidelines for the diagnostics and treatment of infectious endocarditis. These recommendations introduce changes regarding treatment organisation and diagnostic criteria for patients with infectious endocarditis. This article characterises infectious endocarditis in current conditions and discusses its diagnostics, therapy and prophylaxis. Infectious endocarditis in patients with intracardiac electronic devices is mentioned as a specific type of the disease.
Keywords:
infectious endocarditis – diagnostics – guidelines – cardiac device related infectious endocarditis
Autoři: J. Přeček; M. Hutyra; J. Látal; F. Kováčik; M. Táborský
Působiště autorů: I. interní klinika – kardiologická LF UP a FN Olomouc
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(4): 307-314
Kategorie: Kardiologická revue
Souhrn
Infekční endokarditida zůstává stále přes pokroky v diagnostice i léčbě závažným onemocněním s neklesající incidencí. Charakter onemocnění se v podmínkách rozvinutých zemí mění v důsledku stárnutí populace, přibývajících komorbidit a měnících se rizikových faktorů. V letošním roce byla publikována nová doporučení Evropské kardiologické společnosti pro diagnostiku a léčbu infekční endokarditidy. Tato doporučení přinášejí změny na poli organizace péče o pacienty s infekční endokarditidou a dále především změny v diagnostických kritériích. Článek se zabývá charakteristikou infekční endokarditidy v současných podmínkách, diagnostikou, terapií a profylaxí infekční endokarditidy. Ze specifických typů je zmíněna infekční endokarditida u nitrosrdečních elektronických přístrojů.
Klíčová slova:
infekční endokarditida – diagnostika – doporučené postupy – infekční endokarditida u nitrosrdečních elektronických přístrojůÚvod
Infekční endokarditida (IE) je definována jako infekce nativních nebo umělých srdečních chlopní, endokardiálního povrchu nebo implantovaných nitrosrdečních elektronických přístrojů (tedy kardiostimulátorů a defibrilátorů). IE je závažné onemocnění, navzdory pokroku v diagnostice i terapii je mortalita spojená s IE stále vysoká. V posledních dekádách došlo k posunu v epidemiologii i příčinách IE. Pacienti prezentující se s diagnózou IE jsou stále vyššího věku a zatíženi větším množstvím komorbidit.
Na letošním (2015) kongresu Evropské kardiologické společnosti (ESC) v Londýně na přelomu srpna a září byla zveřejněna nová doporučení pro léčbu IE [1]. Tato doporučení přinášejí nový koncept v organizaci péče o pacienty s IE – vznik specializovaných referenčních center a týmu pro endokarditidu, dále novou modifikaci Dukových kritérií pro diagnostiku IE zohledňující roli nových zobrazovacích metod především na poli nukleární medicíny a dále detailní aktualizaci režimů antibiotické léčby.
Epidemiologie
IE je poměrně vzácné onemocnění, roční incidence se pohybuje v rozmezí 3–10 případů na 100 000 jedinců [2,3].
Charakter onemocnění je celosvětově rozdílný. Současná struktura onemocnění v rozvojových, nízkopříjmových zemích odpovídá situaci v rozvinutých zemích v počátcích antibiotické éry. Revmatické srdeční onemocnění je v rozvojových zemích hlavním rizikovým faktorem pro vznik IE a je zodpovědné za dvě třetiny případů. Pacienti jsou obvykle mladí dospělí a infekce je způsobena převážně streptokoky citlivými na penicilin se vstupní branou v dutině ústní. Naproti tomu v rozvinutých zemích vzniká IE spíše u polymorbidních pacientů s mediánem věku kolem 70 let. Rizikovými faktory jsou degenerativní chlopenní vady, přítomnost chlopenních náhrad či elektronických nitrosrdečních implantátů, dále imunosuprese a také intravenózní narkomanie. Etiologickým agens jsou častěji stafylokoky a bránou vstupu infekce jsou mnohdy invazivní lékařské procedury [3,4].
Patofyziologie
Prvotní podmínkou pro vznik IE je poškození endokardu či endotelu. Endokardiální poškození může vzniknout turbulencí krve v důsledku stenotických či regurgitačních chlopenních vad nebo nitrosrdečních zkratů, dále traumaty, cizími tělesy, v některých případech i přímou bakteriální aktivitou (zvláště u Staphylococcus aureus) [5]. V místech poškozeného endotelu vznikají depozita trombocytů a fibrinů – tzv. nebakteriální trombotická endokarditis, která je náchylnější ke kolonizaci mikrobů, ke které dochází během přechodné bakteremie. Zdrojem bakteremie bývá nejčastěji dutina ústní a kůže a poté invazivní výkony. Pouze některé mikroorganizmy mají schopnost kolonizovat trombotickou endokarditis, klíčovým faktorem je především schopnost vazby na fibronektin, povrchový glykoprotein řady buněk, včetně endoteliálních. Typickými etiologickými agens jsou viridující streptokoky, bakterie ze skupiny HACEK (rody Haemophillus, Actinobacillus, Cardiobacterium, Eikenella, Kingella) a také Staphylococcus aureus. Po kolonizaci trombu dochází za přispění zánětlivých buněk a další aktivace koagulačních faktorů ke vzniku charakteristické léze pro IE – vegetace (obr. 1). Vegetace je obvykle uchycena v místech základní struktury, na kterou působí nižší tlak, tj. např. síňová strana atrioventrikulárních chlopní. Vegetace mohou vést k insuficienci chlopní, vzácněji k obstrukci. Přímá bakteriální invaze vede k destrukci srdečních struktur a ke vzniku abscesů. Vegetace mohou rovněž embolizovat, především jsou-li objemné a mobilní. Klinicky patrné embolizace lze nalézt v jedné třetině až polovině případů, ovšem reálná incidence embolizací je ještě vyšší z důvodu silentního průběhu. Vegetace levostranné endokarditidy embolizují predilekčně do mozku, sleziny, ledvin a končetin, u pravostranné endokarditidy pak do plic se vznikem pneumonie či plicního abscesu. Další možné komplikace mohou způsobovat depozita imunokomplexů [6].
Klinické projevy
Klinický obraz IE může být velmi rozdílný v závislosti na etiologickém agens, základním srdečním onemocnění a komorbiditách – diagnostika je tedy mnohdy obtížná. IE může probíhat jako akutní rychle progredující infekce, ale také jako subakutní nebo chronické onemocnění s velmi nespecifickými projevy, jako je horečka, únava, nevolnost, váhový úbytek či s projevy dominantně mimosrdečními v důsledku embolizací či depozit imunokoplexů – např. iktus, pneumonie, nefrologické či revmatologické projevy apod. [1].
V klinické úvaze je nutno zhodnotit při podezření na možnost IE především rizikové faktory pro vznik IE. Základními kardiálními rizikovými faktory jsou anamnéza dřívější proběhlé IE, přítomnost umělé srdeční chlopně nebo jiného nitrosrdečního přístroje a dále chlopenní vada nebo vrozená srdeční vada. Nekardiálními rizikovými faktory jsou imunosuprese, intravenózní narkomanie, déledobé cévní vstupy a dále recentní stomatologické nebo chirurgické výkony.
Klinické doporučené postupy pro IE vydané Českou kardiologickou společností v roce 2007 doporučují zvažovat možnost IE především v následujících situacích:
- sepse s projevy embolizace do kůže nebo do různých orgánů,
- febrilní stav nejasného původu trvající déle než 5–7 dnů při vyloučení obvyklých příčin horečky,
- postupné chřadnutí provázené známkami chronické infekce,
- obraz cévní mozkové příhody provázený horečkou a zvýšením zánětlivých ukazatelů,
- migrující pneumonie postihující především dolní laloky obou plic a špatně reagující na běžnou léčbu,
- febrilní stav u osoby s disponující chorobou srdce nebo s nálezem nápadného kardiálního šelestu,
- febrilní stav u intravenózního narkomana nebo u pacienta v dialyzačním programu [7].
Diagnostika
V diagnostice je nutno zohlednit klinickou situaci, mikrobiologické výsledky a nálezy zobrazovacích metod. Základními kameny diagnózy je průkaz infekčního agens v hemokultuře a průkaz přítomnosti vegetace, obvykle echokardiograficky.
Zlatým standardem diagnostiky bylo doposud použití tzv. modifikovaných Dukových kritérií pro diagnostiku IE. Tato kritéria vycházejí z původních pravidel publikovaných týmem Duke University v Durhamu (Severní Karolína, USA) pod vedením prof. Duracka v roce 1994. Oproti předchozím diagnostickým pravidlům tato kritéria nově zohledňovala echokardiografické nálezy [8]. V současné době jsou používána mírně modifikovaná kritéria z roku 2000 [9]. Je vhodné poznamenat, že tato kritéria byla původně navržena pro použití v klinických a epidemiologických studiích a nikoli v rutinní klinické praxi. V tomto systému pravidel jsou uvedena tzv. velká a malá kritéria, jejichž splnění predikuje pravděpodobnost diagnózy IE (tab. 1 a 2).
Tab. 1. Diagnostická kritéria pro infekční endokarditidu podle doporučení ESC 2015.Upraveno dle [1,7]. ![Diagnostická kritéria pro infekční endokarditidu podle doporučení ESC 2015.Upraveno dle [1,7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5a2130526ea6de1497d2d41541f69414.jpg)
* V textu změny oproti původním modifikovaným Dukovým kritériím. Upraveno dle [1,7]. Tab. 2. Definice jednotlivých případů infekční endokarditidy podle doporučení ESC 2015. 
Upraveno dle [1,7]. Modifikovaná Dukova kritéria mají zhruba 80% senzitivitu, jsou-li hodnocena v závěru pacientova sledování [10]. Tato kritéria mají nižší senzitivitu, především jsou-li použita při časné diagnostice, a dále zvláště v případech endokarditidy chlopenních náhrad (prosthetic valve endocarditis – PVE) nebo endokarditidy postihující kardiostimulátory a defibrilátory, u kterých může být echokardiografie normální nebo neprůkazná až v 30 % případů [11]. Použití dalších zobrazovacích metod zlepšuje možnosti detekce endokardiálního poškození a extrakardiálních komplikací IE, a nové zobrazovací metody jsou tedy zahrnuty do diagnostických kritérií IE. V recentně publikovaných doporučených postupech ESC pro léčbu IE se v oblasti diagnostiky můžeme setkat s těmito změnami:
- identifikace paravalvulární léze pomocí CT srdce je považována za hlavní diagnostické kritérium,
- za hlavní diagnostické kritérium je v případě podezření na endokarditidu chlopenní náhrady považována abnormální aktivita kolem místa implantované umělé chlopně detekovaná pomocí 18F-FDG PET/ CT (v případech, že byla protéza implantovaná před více než třemi měsíci) nebo SPECT/ CT se značenými leukocyty,
- průkaz recentních embolizací nebo infekčních aneuryzmat pouze zobrazovací metodou (klinicky silentní příhoda) je považováno za malé kritérium [1].
Přehled aktualizovaných diagnostických kritérií je uveden v tab. 1, definice jednotlivých případů IE pak v tab. 2.
Schéma diagnostického algoritmu podle „nových“ kritérií je uvedeno ve schématu 1. Základem jsou stále modifikovaná Dukova kritéria založená především na echokardiografii a výsledcích hemokultur. V případech, kde diagnóza IE zůstává podle těchto kritérií pouze možná či je přímo zamítnuta, ale trvá vysoké klinické podezření, je doporučeno zopakovat echokardiografii a odběr hemokultur a doplnit další diagnostickou techniku pro zobrazení srdečního postižení nebo embolizačních komplikací.
Schéma 1. Algoritmus pro diagnostiku infekční endokarditidy. 
Upraveno dle [1]. Nově zavedené metody nukleární medicíny (18F-FDG PET/ CT, SPECT/ CT se značenými leukocyty) mají svou úlohu rovněž v diagnostice IE spojené s nitrosrdečními elektronickými přístroji, nicméně v současné době nemáme dostatek dat pro to, aby v tomto specifickém případě byly tyto metody použity jako samostatné diagnostické kritérium [1].
Echokardiografie
Echokardiografie je základní zobrazovací modalitou v diagnostice IE, detekci komplikací a sledování pacientů. Echokardiograficky můžeme zobrazit léze přímo související s IE (vegetace, abscesy) i následné komplikace (regurgitace, perforace chlopní, fistuly).
Transtorakální echokardiografické vyšetření musí být provedeno co nejdříve, když je na diagnózu IE pomýšleno. V případě negativní transtorakální echokardiografie (TTE) či v případě suboptimálního zobrazení při TTE a trvajícího vysokého klinického podezření na IE je nutné provedení transezofageální echokardiografie (TEE). TEE musí být provedena rovněž v případě pozitivního nálezu při TTE k vyloučení lokálních komplikací. TEE je jako první zobrazovací modalita doporučena u pacientů s klinickým podezřením na IE a s chlopenní náhradou nebo intrakardiálním elektronickým přístrojem. V případě negativní echokardiografie (TTE i TEE) a trvajícího vysokého klinického podezření na IE je doporučeno vyšetření zopakovat za 5–7 dnů. Echokardiografické vyšetření by mělo být provedeno rovněž po ukončení antibiotické terapie ke zhodnocení event. reziduálního chlopenního postižení a dalších následků IE.
Jako hlavní kritérium pro diagnózu IE je považován echokardiografický nález vegetace (obr. 1, 2), abscesu (obr. 3) nebo pseudoaneuryzmatu a nové dehiscence chlopenní náhrady.
Obr. 1. Vegetace na aortální chlopni pohledem: a) 2D echokardiografi e, b) 3D echokardiografi e a c) peroperačně. 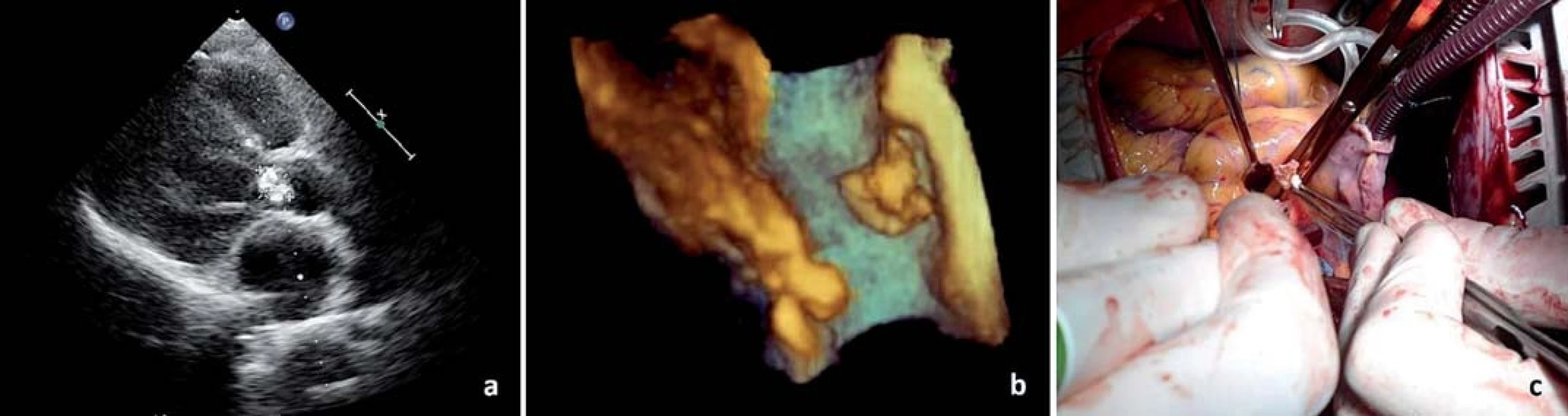
(Fotografie poskytnuty MUDr. Pavlem Marciánem, Ph.D. – Kardiochirurgická klinika FN Olomouc) Obr. 2. Vlající vegetace na pravém koronárním cípu aortální chlopně (transtorakální echokardiografie – parasternální projekce na dlouhou osu). 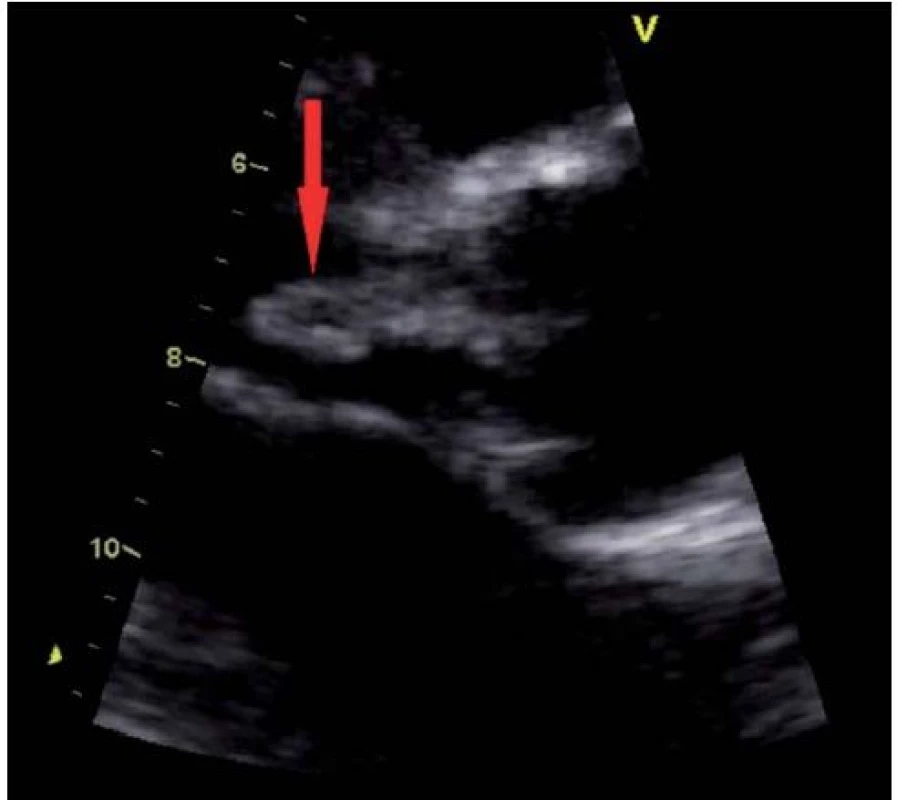
Obr. 3. Paravalvulární absces při aortální chlopni (transezofageální echokardiografie – projekce na dlouhou osu levé komory). 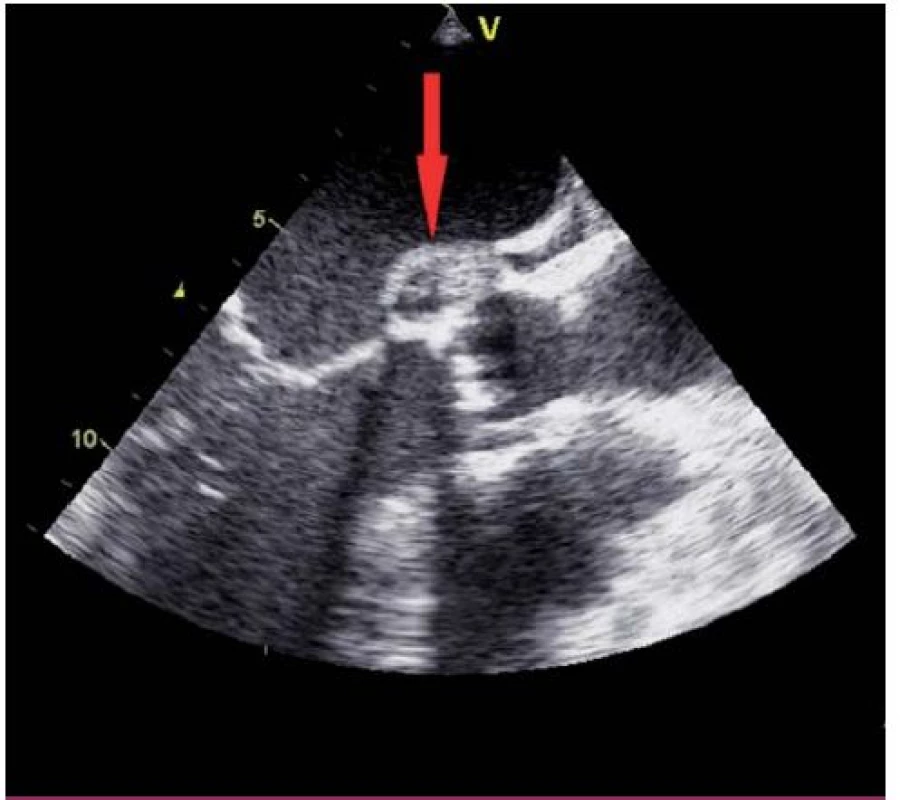
Vegetace je echokardiograficky zobrazena jako oscilující nebo neoscilující intrakardiální masa nacházející se na chlopni nebo jiné endokardiální struktuře či na implantovaném nitrosrdečním materiálu. Senzitivita pro nález vegetace na nativní chlopni a chlopenní náhradě je 70, resp. 50 % při TTE a 96, resp. 92 % v případě TEE. Specificita echokardiografie v detekci IE není absolutní, v diferenciální diagnostice je možné zmínit tromby, Lamblovu exkrescenci (obr. 4), marantické vegetace, nitrosrdeční tumory (obr. 5) a další [1].
Obr. 4. Lamblova ekrescence na nekoronárním cípu aortální chlopně (transesofageální echokardiografie – projekce na dlouhou osu levé komory). 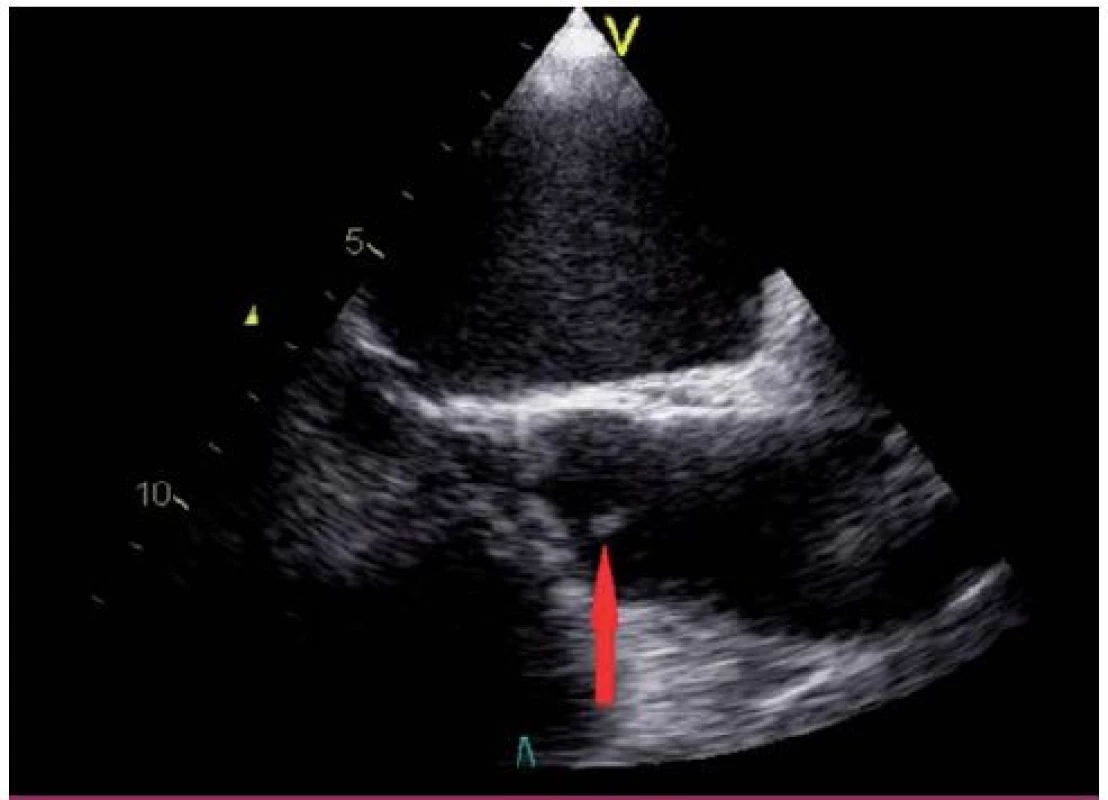
Obr. 5. Papilární fibroelastom na levém koronárním cípu aortální chlopně (transtorakální echokardiografie – parasternální projekce na krátkou osu). 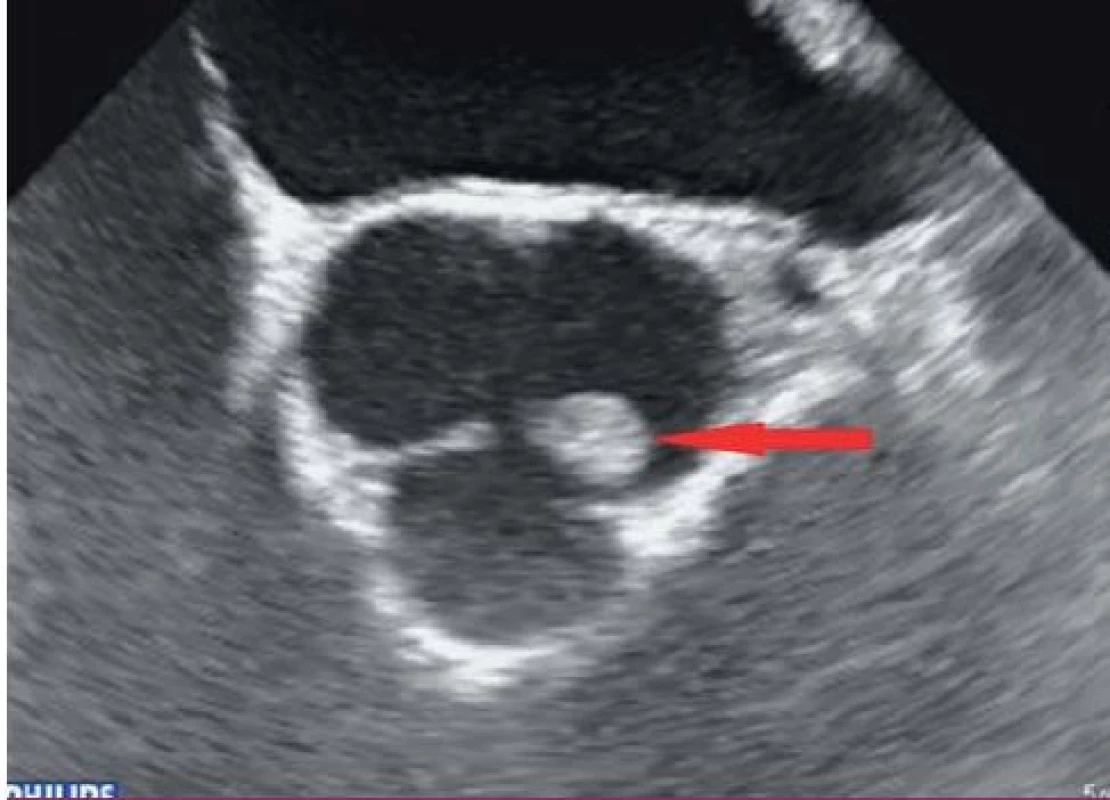
Technika třídimenzionální (3D) echokardiografie umožňuje analýzu objemů srdečních struktur v jakékoli rovině. Podle studie Berdejo et al podhodnocuje klasická TEE velikost vegetací, a 3D TEE je tedy vhodnější metodou k přesnějšímu hodnocení rozměrů vegetací a lepší predikci případného embolizačního rizika [12].
Hemokultury
Identifikaci etiologického agens způsobující IE je nutno věnovat maximální pozornost, protože se od něj odvíjí korektně zvolená antibiotická léčba. Základem mikrobiologické diagnostiky je sériový odběr hemokultur. V případě klinického podezření na IE je nutno provést odběr min. 3 hemokultur v odstupu alespoň 30 min. Každá hemokultura by měla obsahovat alespoň 10 ml krve a měla by být vyšetřena v aerobních i anaerobních podmínkách. Vzhledem k tomu, že v případě IE je bakteremie trvalá, není nutno s odběrem hemokultur vyčkávat na febrilní špičku (i když v jejím případě je výtěžnost ještě vyšší). Není doporučeno odebírat hemokultury z venózních katetrů pro riziko kolonizace. Hemokultury je rovněž nutno odebírat před zahájením antibiotické léčby. V případě odběru při současné antibiotické léčbě, byť neúčinné, je šance na záchyt etiologického agens malá. Je-li potřeba zjistit etiologické agens u neúspěšně léčeného pacienta, je vhodné podávání antibiotik na 1–3 dny přerušit a pak teprve znovu odběry hemokultur realizovat [1,7].
Problémem je kultivačně negativní IE, tedy takové případy IE, kdy se klasickým odběrem hemokultur nepodařilo zachytit etiologické agens. Podle literárních údajů se jedná až o 31 % případů IE. Zčásti je tato situace způsobena nesprávným odběrem hemokultur (většinou odběr při již probíhající antibiotické léčbě), zčásti se tak děje v důsledku agens se speciálními kultivačními nároky nebo nelze agens kultivačně vůbec zachytit.
Kromě odběru hemokultur lze v mikrobiologické diagnostice využít analýzu materiálu z vegetací odebraného peroperačně či z míst periferních embolizací. U některých původců jsou potřebné speciální kultivační techniky (např. u Bartonella sp., Legionella sp., Mykobakterium sp., Fungi), sérologická diagnostika (Brucella sp., Coxiella burnetii, Mycoplasma sp., Legionella sp.), polymerázová řetězová reakce (PCR) či jiné speciální techniky.
Terapie
V nových doporučeních ESC je vyzdvihnuta role specializovaného referenčního centra pro IE a „týmu pro IE“. Je zohledněn multioborový aspekt onemocnění a potřeba spolupráce odborníků několika oborů (kardiolog, kardiochirurg, infektolog, mikrobiolog, specialista na zobrazovací metody aj.), dostupnosti celé řady vyšetřovacích metod (pokročilá a rutinní mikrobiologická diagnostika, MR, CT, metody nukleární medicíny) a v neposlední řadě i kardiochirurgického pracoviště. Na příkladu zavedení toho postupu ve Francii je dokumentována signifikantní redukce jednoroční mortality na IE (z 18,5 na 8,2 %) při použití tohoto centralizovaného přístupu [13].
Všichni pacienti s komplikovanou IE (např. IE s projevy srdečního selhání, embolizační či neurologické komplikace, endokarditida u vrozených srdečních vad) by měli být do těchto specializovaných center časně referováni a v nich léčeni. Pacienti s nekomplikovanou IE mohou být léčeni mimo tato centra, ale s předpokladem pravidelných konzultací s „týmem pro IE“ [1].
Klíčovým principem úspěšné léčby IE je úplné odstranění zdroje infekce. Základním kamenem léčby IE je antibiotická terapie. Chirurgická terapie přispívá odstraněním infikovaných struktur a má dále uplatnění v řešení komplikací a obnově srdečních struktur poškozených procesem IE.
V antibiotické terapii používáme baktericidní preparáty podávané intravenózně v kombinovaných režimech. Obvyklou minimální dobou trvání léčby jsou čtyři týdny intravenózní terapie. V případech endokarditidy chlopenních náhrad je doba antibiotické léčby delší (alespoň šest týdnů). Volba konkrétních antimikrobiálních preparátů závisí na etiologickém agens a musí probíhat v těsné spolupráci s lokálním antibiotickým centrem. Detaily jednotlivých léčebných režimů přesahují rozsah tohoto textu, a odkazujeme tedy na aktuální doporučené postupy [1].
Chirurgická léčba je potřebná až u 40–50 % pacientů s IE [14]. Pro chirurgickou léčbu tradičně existují tři indikace (v pořadí četnosti) –srdeční selhání v důsledku chlopenní dysfunkce, nekontrolovaná infekce a prevence embolizačních příhod [15].
Dřívější hypotézy předpokládaly, že antikoagulační či antiagregační terapie může redukovat růst vegetací [16]. Tyto předpoklady však v klinické praxi nebyly potvrzeny a naopak je antikoagulační léčba spojena s riziky krvácivých komplikací v případě mozkových embolizací. Antikoagulační či antiagregační léčba tedy není rutinně v terapii IE doporučena, pokud k ní neexistuje jiná jednoznačná indikace (např. fibrilace síní, mechanická chlopenní náhrada apod.) [17].
Prevence a profylaxe
Podstata profylaxe IE spočívá v podání vhodně načasované dávky antibiotik k zabránění bakteremie u rizikových procedur u pacientů se zvýšeným rizikem vzniku IE. Původní koncept byl odvozen z observačních a animálních studií a vedl k podávání antibiotik velmi široké skupině pacientů s různými predisponujícími srdečními onemocněními před celou řadou intervenčních výkonů. Postupem času došlo k určitým restrikcím v posuzování toho, za jakých okolností je profylaxe IE nezbytná. K přechodné, ale opakované bakteremii totiž dochází během každodenních aktivit, jako je čištění zubů, používání zubního párátka apod. Riziko vzniku IE po stomatologických výkonech je poměrně nízké a antibiotická profylaxe dokáže zabránit pouze poměrně malé části případů IE. Široké používání antibiotik může vést ke zvýšené rezistenci mikroorganizmů. Účinnost antibiotické profylaxe navíc nebyla potvrzena žádnou randomizovanou kontrolovanou studií [18].
Současné doporučení ESC v otázce profylaxe IE pokračují v limitaci antibiotické profylaxe IE pouze na pacienty s nejvyšším stupněm rizika vzniku IE – tedy pacienti s chlopenní náhradou nebo protetickým materiálem použitým k opravě chlopní, pacienti s anamnézou předchozí prodělané IE a pacienti s vrozenými srdečními vadami (všemi cyanotickými vadami) a šest měsíců po chirurgické nebo katetrové korekci vrozených vad s použitím protetického materiálu či celoživotně v případě reziduálního zkratu nebo chlopenní regurgitace (tab. 3). V případě ostatních chlopenních nebo vrozených srdečních vad není profylaxe IE indikována (tzn. včetně stavů se středním rizikem vzniku IE, jako je bikuspidální aortální chlopeň, prolaps mitrální chlopně a kalcifikovaná aortální stenóza).
Tab. 3. Stavy s nejvyšším rizikem vzniku infekční endokarditidy indikované k ATB prevenci. 
Upraveno dle [1]. Antibiotická profylaxe je doporučena jen před stomatologickými výkony, při kterých dochází k manipulaci s gingivou nebo v periapikální oblasti zubu nebo k perforaci ústní mukózy. Paušální profylaxe před výkony v neinfikovaném terénu v respiračním traktu, gastrointestnálním traktu, urogenitálním traktu, kůži a měkkých tkáních rovněž není doporučena. Opačně tomu však je, pokud v dané lokalitě infekci předpokládáme [1].
Doporučené režimy antibiotické profylaxe IE jsou uvedeny v tab. 4.
Tab. 4. Antibiotické režimy profylaxe infekční endokarditidy u vysoce rizikových stomatologických výkonů (u pacientů s vysokým rizikem vzniku IE). 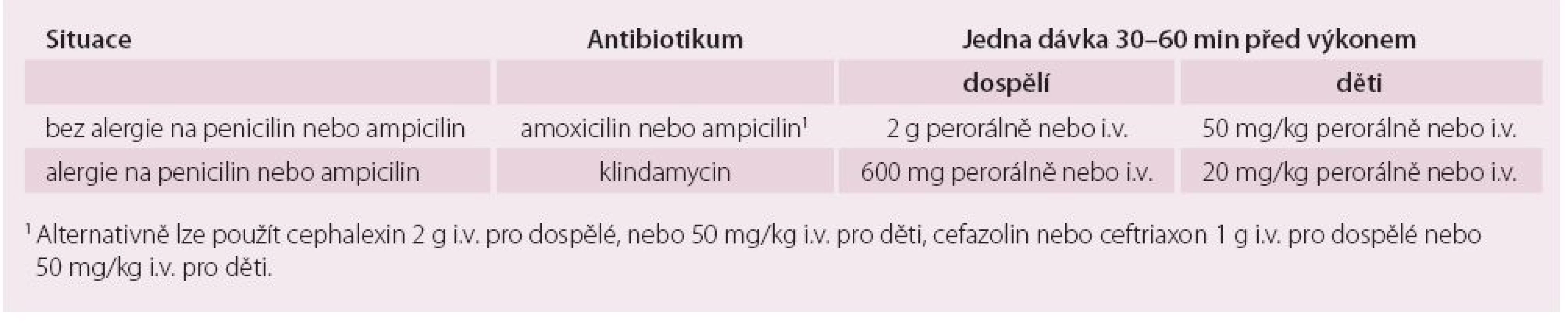
(Upraveno dle [1]). IE u nitrosrdečních elektronických přístrojů
IE nitrosrdečních elektronických přístrojů (cardiac device related IE – CDRIE) zahrnuje infekce kardiostimulátorů a implantabilních kardioverterů-defibrilátorů (ICD). S narůstajícím počtem implantovaných zařízení roste i počet infekčních komplikací. V rámci infekce nitrosrdečních elektronických přístrojů lze rozlišovat lokální infekci kapsy přístroje (obr. 6) a postižení systému elektrod a případně dalších srdečních struktur přímo IE (obr. 7, 8). V rozsáhlé populační studii z roku 2011 je uváděna incidence infekčních komplikací související s nitrosrdečními elektronickými přístroji na úrovni 1,82/ 1 000 přístrojoroků. Riziko infekce během prvních 6–12 měsíců po implantaci je 0,5–1 % [19]. Riziko infekce je vyšší u ICD než u kardiostimulátorů [20].
Obr. 6. Lokální infekce kapsy kardiostimulátoru – dekubitus kapsy s výhřezem přístroje. 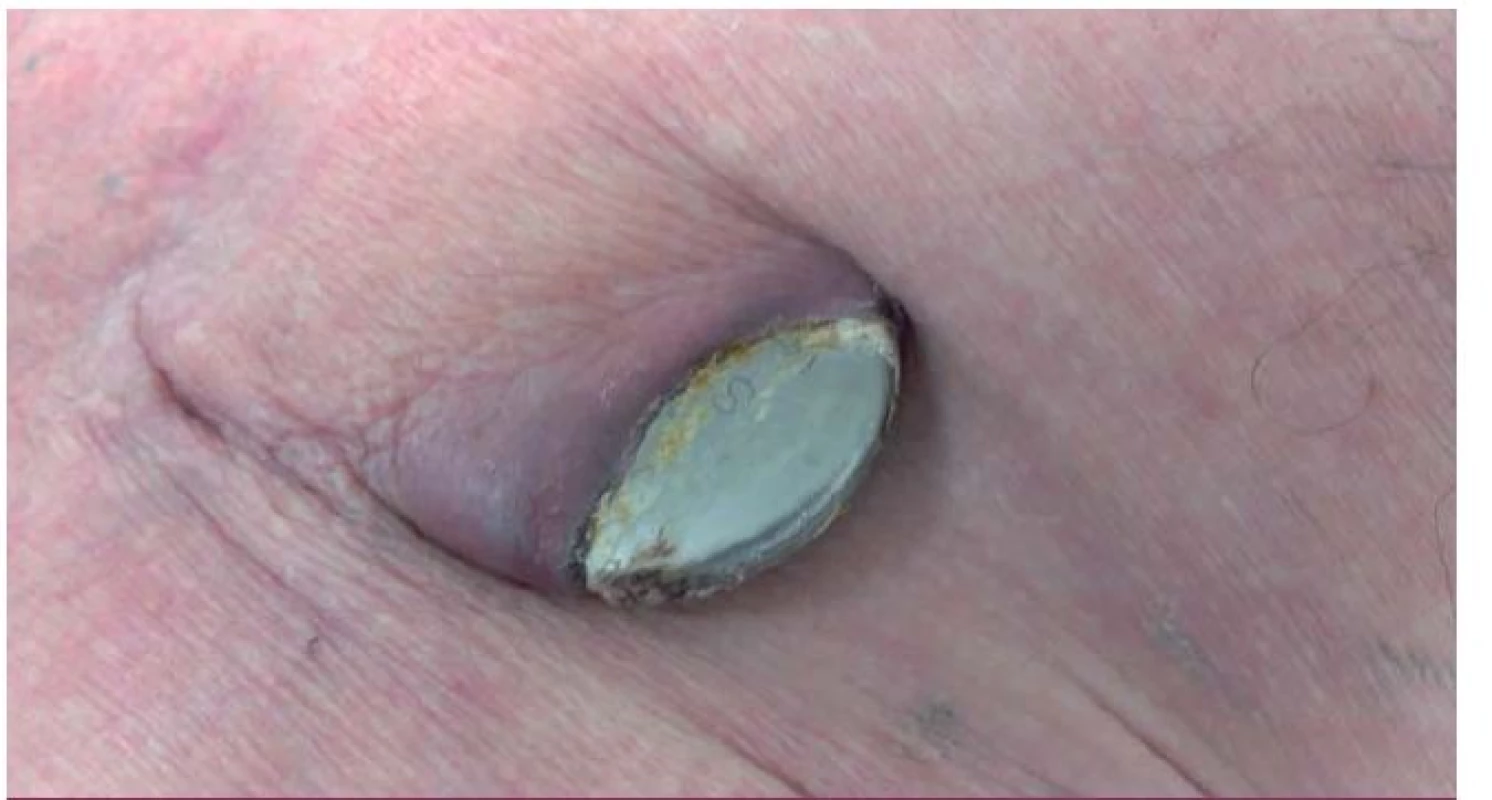
Obr. 7. Vegetace na síňové elektrodě kardiostimulátoru po kardiochirurgické extrakci. 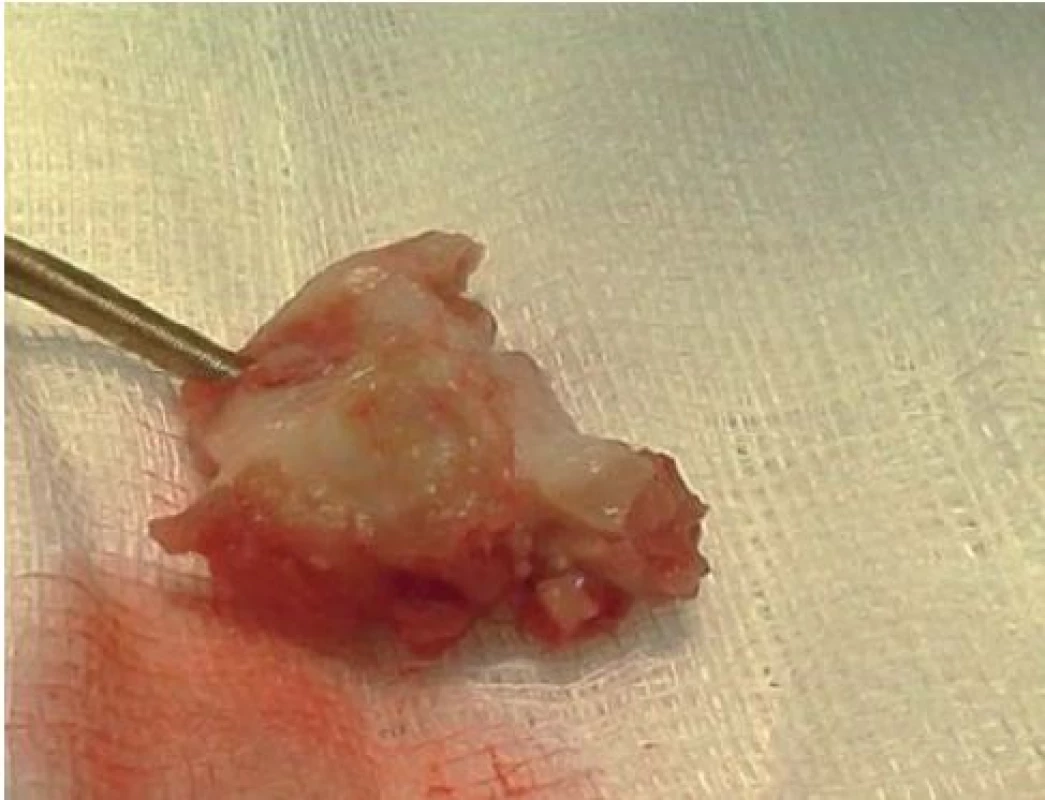
Obr. 8. Vegetace na pravokomorové elektrodě kardiostimulátoru v místě průchodu trikuspidální chlopní (transezofageální echokardiografie – čtyřdutinová projekce). 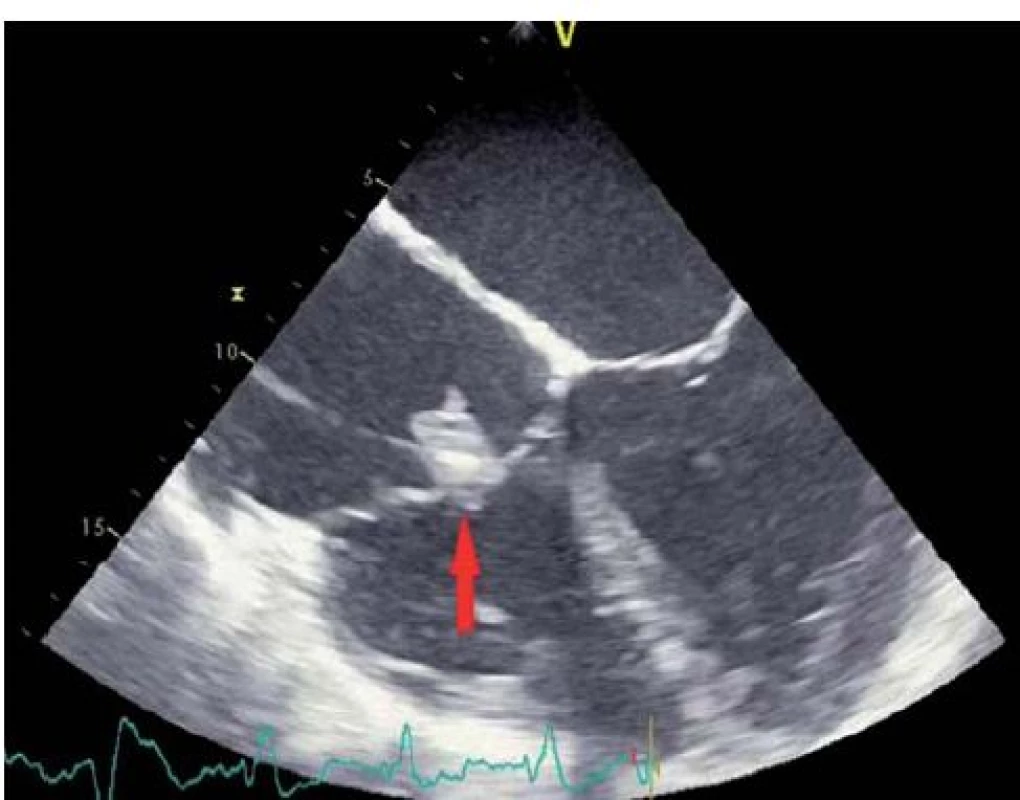
Rizikovými faktory pro infekci jsou renální insuficience, kortikoterapie, srdeční selhání, užívání antikoagulační terapie, diabetes mellitus a vznik hematomu v místě implantace. Svou roli hrají samozřejmě i faktory spojené s implantací a použití antibiotické profylaxe k implantaci [21].
Etiologickými agens CDRIE jsou nejčastěji koaguláza-negativní stafylokoky a Staphylococcus aureus. Tyto bakteriální kmeny jsou spojeny s tvorbou biofilmu na povrchu přístroje a elektrod, který zabraňuje pronikání antimikrobiálních léků, a činí tak samostatnou konzervativní terapii neúčinnou [22].
Léčba CDRIE spočívá v prolongované terapii antibiotiky a v kompletní extrakci celého systému přístroje. Obvyklá délka terapie antibiotiky je 4–6 týdnů a u pacientů s prokázanou infekcí krevního řečiště by měla pokračovat alespoň dva týdny po extrakci přístroje. Preferovanou metodou odstranění systému kardiostimulátoru či ICD u většiny pacientů je transvenózní extrakce, která musí být prováděna v centrech s dostatečnou zkušeností s tímto typem výkonu. Otevřená chirurgická extrakce je doporučena u pacientů s neúplnou nebo nemožnou transvenózní extrakcí a dále v případě objemných vegetací (> 20 mm) k redukci rizika embolizací. Před reimplantací přístroje je vždy nutno znovu zhodnotit správnost jeho indikace a pokud je reimplantace indikována, je doporučeno realizovat ji kontralaterálně a s dostatečným odstupem po adekvátní antibiotikové terapii k zabránění recidivy infekce [1,23].
Závěr
IE zůstává závažným onemocněním s neklesající incidencí navzdory mnoha pokrokům v diagnostice i terapii. Měnící se spektrum rizikových faktorů a stárnutí populace zatížené větším počtem komorbidit činí toto onemocnění klinickou jednotkou s neklesajícím významem. Mnohotvárnost projevů IE je pak stálou diagnostickou výzvou. V některých souvislostech se již hovoří i o tom, že IE má potenciál zařadit se mezi civilizační nemoci nebo dokonce mezi nemoci vznikající jako pozdní následek léčebných výkonů (health care-associated diseases) [24,25].
Doručeno do redakce: 19. 10. 2015
Přijato po recenzi: 30. 10. 2015
MU Dr. Jan Přeček
www.fnol.cz
jan.precek@fnol.cz
Zdroje
1. Habib G, Lancellotti P, Antunes MJ et al. 2015 ESC Guidelines for the management of infective endokarditis. The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC) Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J2015; pii: ehv319. doi: 10.1093/ eurheartj/ ehv319.
2. Murdoch DR, Corey GR, Hoen B et al. The International Collaboration on Endocarditis-Prospective Cohort Study (ICE-PCS) Investigators. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009; 169 : 463–473. doi: 10.1001/ archinternmed.2008.603.
3. Cahill JT, Prendergast BD. Infective Endocarditis. Lancet 2015; pii: S0140-6736(15)00067-7. doi: 10.1016/ S0140-6736(15)00067-7.
4. Yew HS, Murdoch DR. Global trends in infective endokarditis epidemiology. Curr Infect Dis Rep 2012; 14 : 367–372. doi: 10.1007/ s11908-012-0265-5.
5. Werdan K, Dietz S, Lofflër B et al. Mechanisms of infective endocarditis: pathogen-host interaction and risk states. Nat Rev Cardiol 2014; 11 : 35–50. doi: 10.1038/ nrcardio.2013.174.
6. Daniel WG, Flachskampf FA. Infective Endocarditis. In: Camm AJ, Lüscher TF, Serruys PW. The ESC Testbook of Cardiovascular Medicine. Oxford: Oxford University Press 2009 : 819–833.
7. Beneš J, Gregor P, Mokráček P. Infekční endokarditida: Doporučené postupy diagnostiky, léčby, dispenzarizace a profylaxe. Cor Vasa 2007; 49: Kardio.
8. Durack DT, Lukes AS, Bright DK. New criteria for diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Am J Med 1994; 96 : 200–209.
9. Li JS, Sexton DJ, Mick N et al. Proposed modifications to the Duke criteria for the diagnosis if infective endocarditis. Clin Infect Dis 2000; 30 : 633–638.
10. Habib G, Derumeaux G, Avierinos JF et al. Value and limitations of the Duke criteria for the diagnosis of infective endocarditis. J Am Coll Cardiol 1999; 33 : 2023–2029.
11. Vieira ML, Grinberg M, Pomerantzeff PM et al. Repeated echocardiographic examinations of patients with suspected infective endocarditis. Heart 2004; 90 : 1020–1024.
12. Berdejo J, Shibayama K, Harada K et al. Evaluation of vegetation size and its relationship with embolism in infective endocarditis: a real-time 3-dimensional transesophageal echocardiography study. Circ Cardiovasc Imaging 2014; 7 : 149–154. doi: 10.1161/ CIRCIMAGING.113.000938.
13. Botelho-Nevers E, Thuny F, Casalta JP et al. Dramatic reduction in infective endocarditis-related mortality with a management-based approach. Arch Intern Med 2009; 169 : 1290–1298. doi: 10.1001/ archinternmed.2009.192.
14. Prendergast BD, Tornos P. Surgery for infective endocarditis: who and when? Circulation 2010; 121 : 1141–1152. doi: 10.1161/ CIRCULATIONAHA.108.773598.
15. Mallhotra A, Rayner J, Williams TM et al. Infective endocarditis: therapeutic options and indications for surgery. Curr Cardiol Rep 2014; 16 : 464–469. doi: 10.1007/s11886-014-0464-9.
16. Kupferwasser LI, Yeaman MR, Shapiro SM et al. Acetylsalicylic acid reduces vegetation bacterial density, hematogenous bacterial dissemination, and frequency of embolic events in experimental Staphylococcus aureus endocarditis through antiplatelet and antibacterial effects. Circulation 1999; 99 : 2791–2797.
17. Chan KL, Dumesnil JG, Cujec B et al. A randomized trial of aspirin on the risk of embolic events in patients with infective endocarditis. J Am Coll Cardiol 2003; 42 : 775–780.
18. Duval X, Leport C. Prophylaxis of infective endocarditis: current tendencies, continuing controversies. Lancet Infect Dis 2008; 8 : 225–232. doi: 10.1016/ S1473-3099(08)70064-1.
19. Johansen JB, Jorgensen OD, Moller M et al. Infection after pacemaker implantation: infection rates and risk factors associated with infection in a population-based cohort study of 46299 consecutive patients. Eur Heart J 2011; 32 : 991–998. doi: 10.1093/ eurheartj/ ehq497.
20. Uslan DZ, Sohail MR, St Sauver JL et al. Permanent pacemaker and implantable cardioverter defibrillator infection: a population-based study. Arch Intern Med 2007; 167 : 669–675.
21. Lekkerkerker JC, van Nieuwkoop C, Trines SA et al. Risk factors and time delay associated with cardiac device infections: Leiden device registry. Heart 2009; 95 : 715–720. doi: 10.1136/ hrt.2008.151985.
22. Baddour LM, Bettmann MA, Bolger AF et al. Nonvalvular, cardiovascular device-related infections. Circulation 2003; 108 : 2015–2031.
23. Sandoe JA, Barlow G, Chambers JB et al. Guidelines for the diagnosis, prevention and management of implantable cardiac electronic device infection. Report of a joint Working Party project on behalf of the British Society for Antimicrobial Chemotherapy (BSAC, host organization), British Heart Rhythm Society (BHRS), British Cardiovascular Society (BCS), British Heart Valve Society (BHVS) and British Society for Echocardiography (BSE). J Antimicrob Chemother 2015; 70 : 325–359. doi: 10.1093/ jac/ dku383.
24. Beneš J. Mění se incidence infekční endokarditidy? Interv Akut Kardiol 2010; 9 : 231–232.
25. Trubil M, Němec P. Infekční endokarditida. Interv Akut Kardiol 2007; 6(4): 139–143.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2015 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Myokarditidy a zánětlivé kardiomyopatie
- Obrovskobuněčná myokarditida a sarkoidóza srdce – update 2015
- Perikarditidy
- Infekční endokarditida – diagnostika a doporučené postupy
- Srdeční vrozené vady v dospělosti
- Klinický přístup k pacientovi s aortální stenózou
- Indikace k intervenci a volba nejvhodnějšího postupu u mitrálních regurgitací
-
Vztah a klinický význam chronického onemocnění ledvin u pacientů s poruchami srdečního rytmu a/ nebo s implantabilními elektrickými přístroji
Zkrácená komentovaná verze oficiálního stanoviska Evropské společnosti pro srdeční rytmus -
Jak léčit dyslipidemii u pacientů s renální insuficiencí
Výběr z doporučení KDIGO s klinickým komentářem - Dávkování antibiotik u pacientů léčených hemoeliminačními metodami
- Vénové vaskulárne choroby – aktuálny naliehavý problém klinickej medicíny
- Diagnóza, klasifikácia a princípy manažmentu cerebrovaskulárnej aterosklerotickej choroby z hľadiska angiológie
- Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem
- Co zaznělo na kongresu AHA 2015 v Orlandu
-
European Society of Cardiology Congress
Co může být lepší než NOAC?
Snad jedině NOAC s antidotem... -
European Society of Cardiology Congress
Mají pacienti se srdečním selháním opět naději?
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Perikarditidy
- Myokarditidy a zánětlivé kardiomyopatie
- Srdeční vrozené vady v dospělosti
- Infekční endokarditida – diagnostika a doporučené postupy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



