-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vztah a klinický význam chronického onemocnění ledvin u pacientů s poruchami srdečního rytmu a/ nebo s implantabilními elektrickými přístroji
Zkrácená komentovaná verze oficiálního stanoviska Evropské společnosti pro srdeční rytmus
Relationship and clinical significance of chronic kidney disease in patients with cardiac arrhythmias and/ or implantable electrical devices Shortened annotated version of the official position paper of the European Heart Rhythm Association
Chronic kidney disease increases the risk of cardiovascular morbidity and overall mortality, therefore, if heart disease is present, kidney function must be regularly monitored. The pharmacokinetics of drugs is altered in these patients and in dialysed patients the drug may be entirely eliminated from the circulation system, therefore it is necessary to individualise the dose of antiarrhythmic drugs according to the glomerular filtration rate. Catheter ablation for rhythm control is the preferable method in patients with atrial fibrillation. Patients with severe renal insufficiency should not be administered any new anticoagulants; warfarin continues to be indicated instead, with a stricter control of the effective therapeutic range. Patients with implantable electronic devices have a higher risk of complications, especially infectious, and higher total and cardiac mortality. To minimise infectious complications, it is necessary to establish the access route for electrode system implantation on an individual basis, avoid the introduction of dialysis catheter in persons with implants, and where arteriovenous clutches are required, they should be installed on the contralateral side to the implanted device.
Keywords:
kidney disease – heart disease – pharmacokinetics – arrhythmias – thromboembolism – infective complication – implantable electrical devices
Autori: P. Heinc; L. Gajdošová; M. Kamasová; J. Látal; J. Přeček; A. Smékal; L. Rec
Pôsobisko autorov: I. interní klinika – kardiologická LF UP a FN Olomouc
Vyšlo v časopise: Kardiol Rev Int Med 2015, 17(4): 331-338
Kategória: Kardiologická revue
Súhrn
Chronické onemocnění ledvin zvyšuje riziko kardiovaskulární morbidity i celkové mortality, proto je třeba v přítomnosti srdečního onemocnění pravidelně sledovat funkce ledvin. Farmakokinetika všech léků je u těchto pacientů změněna, u dialyzovaných pacientů může dojít i k úplnému odstranění léku z oběhu, proto je třeba individualizovat dávky antiarytmik dle glomerulární filtrace a u pacientů s fibrilací síní se stále více ke kontrole rytmu preferuje katetrizační ablace. Žádná nová antikoagulancia by se neměla podávat při těžké renální insuficienci, zde je nadále indikován warfarin s přísnější kontrolou účinného terapeutického rozmezí. Pacienti s implantabilními elektronickými přístroji mají vyšší riziko komplikací, především infekčních, a vyšší celkovou i kardiální mortalitu. K minimalizaci infekčních komplikací je třeba individuálně zvážit místo přístupu implantace elektrodového systému, u nositelů implantátů se vyhnout zavedení dialyzačního katetru a v případě potřeby arteriovenózní spojky by tato měla být založena na kontralaterální straně od implantovaného přístroje.
Klíčová slova:
onemocnění ledvin – onemocnění srdce – farmakokinetika – arytmie – tromboembolie – infekční komplikace – implantabilní elektrické přístrojeÚvod
Prevalence chronického onemocnění ledvin (chronic kidney disease – CKD) přesahuje v dospělé populaci 10 % a dosahuje 47 % u populace starší 70 let [1]. I mírné formy CKD jsou spojeny se zvýšeným rizikem kardiovaskulární (KV) morbidity a celkové mortality, přitom s věkem dochází k přirozenému horšení funkce ledvin [1]. U pacientů s různými formami srdečního onemocnění není často funkce ledvin vyšetřena a podobně není sledován ani vývoj CKD. U pacientů s kardiálním onemocněním CKD predisponuje k akutnímu poškození ledvin a stejně tak je tomu naopak, přitom oba faktory mohou výrazně ovlivnit léčbu srdečních onemocnění. CKD může po řadu let zůstávat asymptomatické, než dosáhne pokročilého stadia, které je již nezvratné a léčebně velmi obtížné. Proto screening pacientů s vyšším rizikem CKD, tzn. screening pacientů se srdečním selháním (SS), s diabetes mellitus, hypertenzí nebo přímo s CKD, je třeba brát za vysoce potřebný, jelikož to sekundárně vede také k potenciálně nemalé úspoře nákladů při časně nasazené optimální léčbě (schéma 1). Léčba kardiaka s CKD, zejména pacienta se SS a poruchou rytmu, může výrazně těžit pouze ze společného mezioborového přístupu kardiologa a nefrologa. Vzhledem k těmto souvislostem je třeba zvýšit znalosti kardiologů v problematice CKD, a to především těch, kteří se specificky zaměřují na oblast antiarytmické léčby.
Schéma 1. Komplex interakcí mezi onemocněním srdce, arytmiemi a chronickým onemocněním ledvin ve vztahu k rizikovým faktorům, progresi onemocnění, komplikacím a k mortalitě. 
Vztah kardiovaskulárních onemocnění a CKD
Kardiovaskulární onemocnění (KVO) a CKD mají mnoho společných rizikových faktorů, jako je např. hypertenze, diabetes mellitus a věk. Z metaanalytických studií vyplývá, že 30% snížení glomerulární filtrace (GF) je spojeno s 20 – 30% zvýšením rizika velké KV příhody i celkové mortality [2]. Pokud tyto analýzy mají příčinnou souvislost, pak to znamená, že je 10 – 20 % vaskulárních příhod způsobeno sníženou funkcí ledvin. Významný nezávislý vztah je také mezi stupněm albuminurie a KV rizikem. V současné době existuje již řada důkazů, že dysfunkce jednoho orgánu negativně ovlivňuje druhý orgán, což se označuje jako tzv. kardiorenální syndrom [3]. Přítomnost CKD je spojena se zvýšeným rizikem vzniku a rozvoje fibrilace síní (FS) a opačně přítomnost FS urychluje progresi CKD [4]. Ze sledovacích studií vyplývá pozitivní zjištění, že u této populace pacientů s CKD a FS má výskyt mozkových příhod a mortalita klesající tendenci [5]. Úmrtí na KVO je častou příčinou úmrtí pacientů s progresí CKD a zvýšení KV rizika je všeobecně úměrné závažnosti CKD.
Stadia chronického onemocnění ledvin a sledování poruchy funkce ledvin
CKD je definováno jako přítomnost ledvinných abnormalit, které mohou spočívat ve strukturálním postižení a/ nebo funkčním postižení, které je přítomno po dobu delší než tři měsíce. Funkční postižení je u CKD definováno jako snížení GF pod 1 ml/ s/ 1,73 m² po dobu delší než tři měsíce [6].
Ledviny mají řadu funkcí, z nichž nejdůležitější jsou funkce vylučovací, metabolické a endokrinní. GF odráží pouze vylučovací funkce ledvin, ale je pokládána za nejlepší obecný index funkce ledvin, protože je obvykle snížena při jakémkoli strukturálním postižení a většina ostatních funkcí ledvin klesá paralelně s GF [6]. V běžné praxi se GF odhaduje výpočtem ze sérového kreatininu. Současná doporučení pro hodnocení stadia CKD jsou založena na klasifikaci zahrnující příčinu a závažnost CKD, která je vyjádřena hodnotou GF a výší albuminurie. Kategorizaci GF a kategorizaci albuminurie ukazuje tab. 1 a 2. Albuminurie tvoří s GF základní dva markery závažnosti funkčního postižení, protože albuminurie samotná je rovněž významně spojena nejen s progresí CKD, ale také se špatnou KV prognózou [6]. Při sledování CKD by měly být kontrolovány renální funkce a albuminurie alespoň jedenkrát ročně. Kontroly by měly být častější při vysokém riziku progrese CKD a/ nebo pokud by sledování funkce ledvin mohlo mít vliv na léčebnou strategii. Rychlá progrese onemocnění je v současné době definována jako pokles GF o více než 0,07 ml/ s/ 1,73 m² za rok [6].
Tab. 1. Kategorie chronického onemocnění ledvin podle glomerulární filtrace. 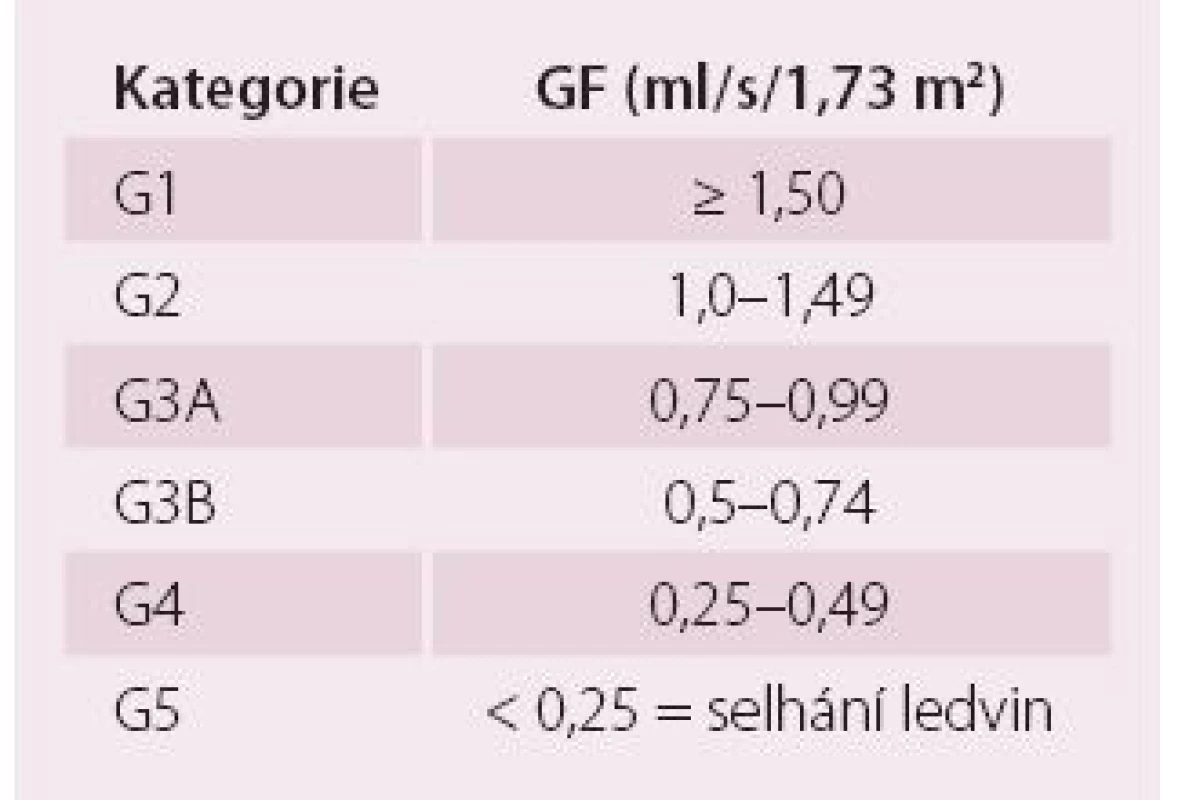
GF – glomerulární filtrace; není-li přítomno poškození ledvin, kategorie G1A G2 nesplňují kritéria chronického onemocnění ledvin Tab. 2. Kategorie chronického onemocnění ledvin podle albuminurie a porovnání s proteinurií. 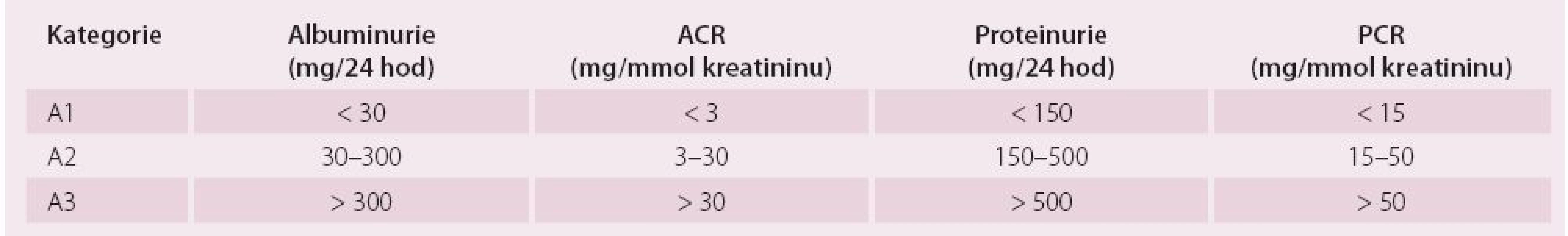
ACR – poměr albumin/kreatinin, PCR – poměr protein/kreatinin Vliv CKD na léčbu pacienta s arytmiemi – vliv poruchy elektrolytů a fibrózy na vývoj arytmických mechanizmů
U pacientů v různých stadiích CKD se vyskytuje celé spektrum arytmií, od supraventrikulárních tachykardií přes nejčastěji přítomnou FS až po komorové tachyarytmie včetně náhlé srdeční smrti (NSS) v důsledku fibrilace komor [7]. V pokročilejších stadiích se mohou objevovat bradyarytmie až asystolie, které jsou obvykle spojené s hyperkalemií nebo jinou elektrolytovou dysbalancí [7]. Faktory, které spouštějí patologické procesy odpovědné za onemocnění koronárních tepen, jsou velmi pravděpodobně stejné nebo podobné jako faktory, které spouštějí patologické procesy odpovědné za CKD: hyperlipidemie, hypertenze, diabetes mellitus, poruchy acidobazické rovnováhy, poruchy metabolizmu vápníku a zánětlivé faktory. Nicméně u pacientů s CKD přispívají k arytmogenezi ještě další faktory, které jsou uvedeny v tab. 3.
Tab. 3. Faktory přispívající k arytmogenezi u pacientů s chronickým onemocněním ledvin. 
Vliv farmakokinetiky na antiarytmickou a antitrombotickou léčbu u pacientů s CKD
Potenciální problémy spojené se změněnou farmakokinetikou u pacientů s CKD jsou: (tab. 4) [6].
Tab. 4. Hlavní změny farmakokinetiky léků u pacientů s chronickým onemocněním ledvin. 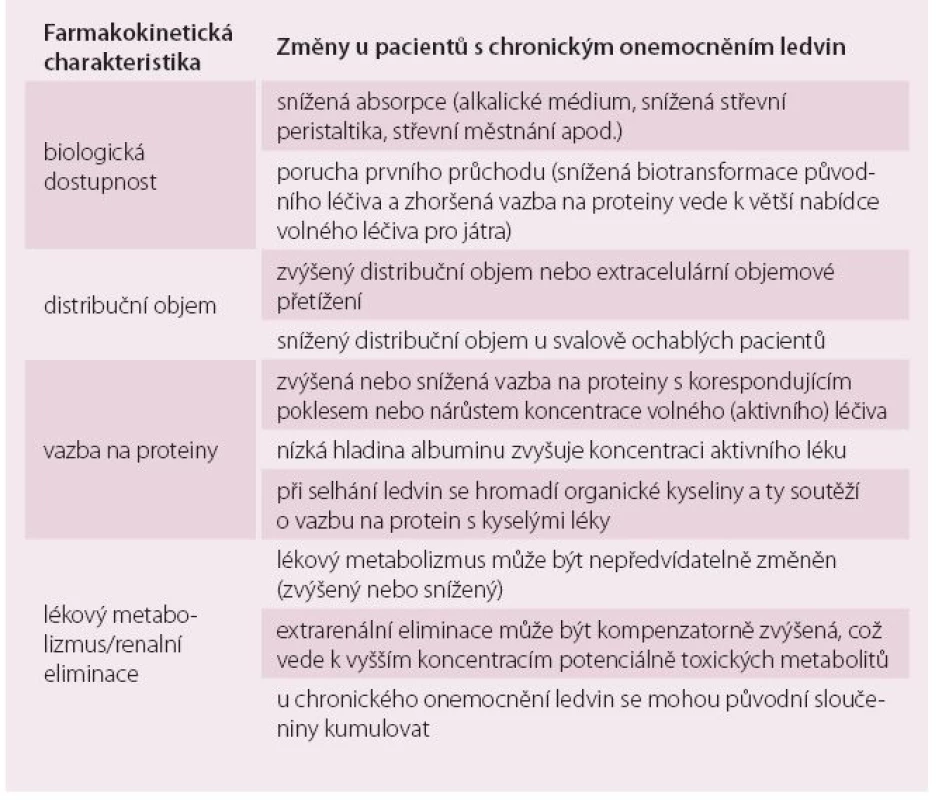
- snížená schopnost vylučovat léky a/ nebo jejich metabolity,
- zvýšená citlivost na léky (např. ty, které se váží na albumin při hypoalbuminemických stavech, jako je tomu u nefrotického syndromu),
- nižší tolerance vedlejších účinků, především u starších pacientů,
- ztráta účinnosti.
I přes různá doporučení stále existují spory o optimální běžné antiarytmické a antitrombotické farmakoterapii u pacientů s CKD. Pokud je to možné, pak by pacienti s CKD měli dostávat stejnou léčbu jako nemocní s normální funkcí ledvin, nicméně dávky léků je třeba upravit podle GF vzhledem k prodlouženému poločasu a sníženému clearance léku [6,8]. Pro antiarytmika, betablokátory ani pro většinu antitrombotik neexistují žádné doporučené úvodní dávky. Úprava dávky je možná jejím snížením a/ nebo prodloužením intervalu dávkování (preferovány by měly být léky s delším poločasem a s širším terapeutickým rozmezím [8]). Hlavní charakteristiky farmakokinetiky a návrh na vhodnou úpravu u pacientů s CKD pro většinu používaných betablokátorů a antiarytmik jsou popsány v tab. 5 [9].
Tab. 5. Hlavní charakteristiky farmakokinetiky a návrh na vhodnou úpravu dávky většiny používaných betablokátorů a antiarytmik u pacientů s chronickým onemocněním ledvin. 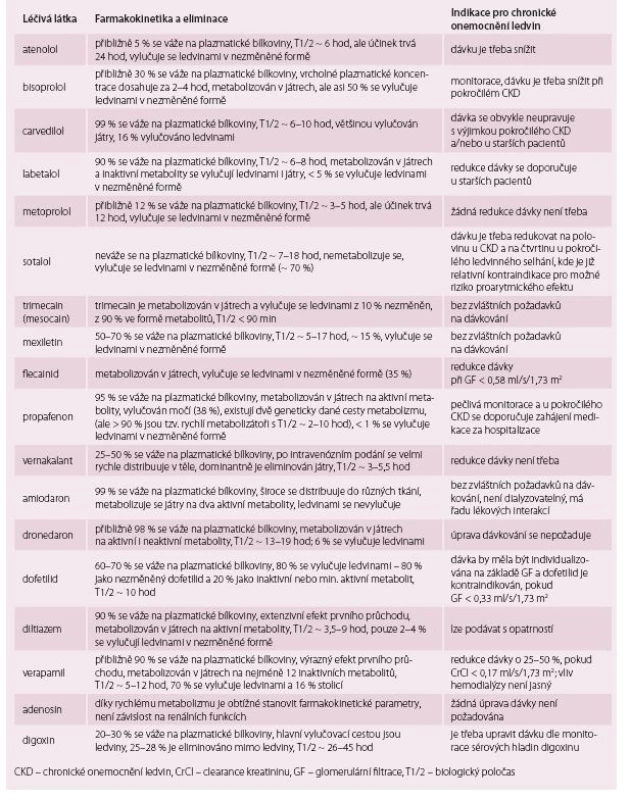
Riziko tromboembolických komplikací a krvácivých příhod při FS – vztah CKD k přidruženým chorobám
Přítomnost FS je u pacientů s CKD spojena s vyšším rizikem přechodu do terminálního stadia [5]. Pacienti s CKD mají v přítomnosti FS vysoké riziko cévní mozkové příhody (CMP), tromboembolie (TE) i závažného krvácení, přitom u pacientů léčených dialýzou nebo po transplantaci ledviny je riziko TE i závažného krvácení obzvláště vysoké a u dialyzovaných pacientů na warfarinu může riziko závažného krvácení převážit snížené riziko CMP [10]. Vysoké riziko TE i závažného krvácení snižuje pouze přísná kontrola warfarinizace. Všechna nová perorální antikoagulancia (NOAC) se do jisté míry vylučují ledvinami, proto byli pacienti se závažným renálním selháním ze studií s NOAC vyřazeni. To je důvodem, proč se NOAC u pacientů s CKD a FS nedoporučují užívat, pokud GF klesne pod 0,5 ml/ s/ 1,73 m², nebo by dávka NOAC měla být snížena, pokud je GF v rozmezí 0,5 – 0,8 ml/ s/ 1,73 m² [11]. Pokud jsou přítomny další přidružené choroby nebo jde o zesláblé pacienty, pak je vhodné častější sledování funkce ledvin. U 20 % pacientů s FS dochází během dvou let k výraznému snížení GF. Progrese SS v důsledku FS či jiných tachyarytmií a současné užívání diuretik, ACE inhibitorů a dalších medikamentů může výrazně ohrozit funkci ledvin, především u pacientů se sníženou renální rezervou. Hypertenze je oboustranně úzce spojena s CKD. Nedostatečně léčená hypertenze zvyšuje u pacientů s FS riziko nežádoucích KV příhod a naopak léčba hypertenze ACE inhibitory nebo blokátory receptorů pro angiotenzin může snížit riziko vzniku FS a KV příhod, a to především u starších pacientů. Hypertrofie levé komory zvyšuje riziko paroxysmu FS i riziko dalších KV onemocnění.
Komorové tachyarytmie a náhlá smrt u pacientů s pokročilým CKD léčených hemodialýzou
NSS je nejčastější příčinou úmrtí u dialyzovaných pacientů, včetně dětské populace, a představuje více než 50 % všech srdečních úmrtí a 25 % všech úmrtí [12,13]. Riziko NSS je zvýšené u všech pacientů s CKD, přitom riziko NSS se lineárně zvyšuje s klesající renální funkcí [14]. Ischemická choroba srdeční je v obecné populaci přítomna u 80 % pacientů s NSS a vysoce převažuje také u pacientů s CKD. Hypertrofie levé komory je častou příčinou komorových arytmií a NSS. Nadměrná aktivita sympatiku je velmi častá u dialyzovaných pacientů, začíná brzy v průběhu CKD a pravděpodobně je způsobena samotnými ledvinami, protože po nefrektomii klesá. U dialyzovaných pacientů je hladina plazmatického noradrenalinu nezávisle spojena s přežitím a KV příhodami. Srdeční arytmie a NSS jsou častější během 12 hod po zahájení hemodialýzy. Tato zjištění předpokládají, že ke vzniku arytmií vedou velké změny krevního tlaku, koncentrace elektrolytů i objemu tekutin. Riziko NSS pacientů s CKD snižují betablokátory a toto riziko také klesá po úspěšné transplantaci ledvin [12]. Bohužel dávka betablokátorů je u dialyzovaných pacientů často limitována z důvodu hypotenzních epizod v důsledku redukce tekutin při dialýze. S významným snížením KV mortality dialyzovaných pacientů je spojena statinová léčba. Zda ACE inhibitory a/ nebo blokátory angiotenzinového receptoru (ARB) snižují riziko NSS u pacientů s CKD, není jasné. Nicméně, použití těchto léků může být u pacientů s CKD omezené, zejména pro potenciální možnost vzniku hyperkalemie a hypotenze u dialyzovaných pacientů.
Supraventrikulární tachyarytmie u pacientů s pokročilým CKD a u pacientů léčených hemodialýzou – hemodynamický efekt akutní i dlouhodobé léčby
Doporučované léčebné strategie nemusí být dostatečně efektivní a/ nebo mohou mít dokonce závažné škodlivé účinky na pacienty s FS a funkčně významným CKD. Intradialytická hypotenze je způsobena nedostatečnou KV reakcí na relativně rychlé snížení objemu krve a vyskytuje se ve 20 – 30 % dialyzačních sezení [15]. Tato situace se řeší zastavením ultrafiltrace, Trendelenburgovou polohou a podáním fyziologického roztoku. Takové epizody často vedou k objemovému přetížení, které způsobuje remodelaci levé komory, diastolickou i systolickou dysfunkci a arytmogenní myokardiální fibrózu [15]. Intradialytické hypotenze jsou spojeny s významně zvýšenou KV morbiditou a mortalitou [15]. Pro léčebné strategie kontroly rytmu i kontroly frekvence u pacientů s CKD jsou omezena bezpečnostní data, a to se týká všech antiarytmik, podobně jako je tomu u rizika antikoagulační léčby. Tento fakt vede k preferenčnímu řešení tachyarytmií pomocí katetrizační ablace. Udržování sinusového rytmu po ablaci u pacientů s GF ≥ 0,5 ml/ s/ 1,73 m² bylo spojeno s výrazným zlepšením renálních funkcí [16]. Katetrizační ablace jsou obecně spojeny s nižším počtem recidiv symptomatické FS ve srovnání s farmakoterapií [17]. U hemodialyzovaných pacientů se radiofrekvenční katetrové ablace provádějí stále častěji vzhledem k tomu, že antiarytmická farmakoterapie je u těchto pacientů do značné míry limitována. K dlouhodobému udržení sinusového rytmu je však většinou třeba více než jeden ablační výkon, nicméně po opakovaném zákroku se daří udržet sinusový rytmus až u 80 % hemodialyzovaných pacientů. Předoperační optimalizace léčby představuje vhodný dialyzační režim, úpravu anémie, elektrolytové dysbalance (především hyperkalemie), krevního tlaku, SS a antikoagulační léčby ke snížení rizika perioperačního krvácení. Prevencí proti pooperačnímu zhoršení funkce ledvin v důsledku kontrastem indukované nefrotoxicity je zajištění dostatečné hydratace a vyhýbání se nefrotoxickým lékům. Diabetici jsou často léčeni metforminem, který je vylučován ledvinami. Metformin je třeba vysadit 48 hod před angiografickým vyšetřením, kde se používají intravenózní jodované kontrastní látky, aby se zabránilo vysokým koncentracím metforminu v séru a nedošlo ke kontrastní nefropatii, která může vést k laktátové acidóze. Pokud pacienti užívají betablokátory, měli by v této medikaci v perioperačním období pokračovat. U vysoce rizikových pacientů lze před nekardiální operací zahájit léčbu betablokátory, v tom případě je však vhodná přísnější EKG monitorace se sledováním srdeční frekvence a QT intervalu. U antiarytmické léčby je třeba zdůraznit, že i u léků, které nejsou vylučovány ledvinami, je třeba u pacientů s CKD opatrné titrace z důvodu odlišného účinku při často přítomné elektrolytové dysbalanci, hypertrofii levé komory či SS.
Vliv CKD na léčbu pacientů s implantabilními elektrickými kardiálními přístroji (CIED)
Trvalá kardiostimulace pro bradykardii
Retrospektivní studie hemodialyzovaných pacientů s implantovaným kardiostimulátorem ukázala, že mají vyšší dlouhodobou mortalitu, ale přítomnost kardiostimulátoru nebyla u těchto nemocných nezávislým prediktorem mortality. U pacientů s kardiostimulátorem je stimulační práh ovlivňován mnoha faktory, včetně hladiny draslíku, a ke ztrátě uplatnění stimulace dochází v případě závažné hyperkalemie, přitom síňový myokard je na akutní nárůst kalemie obvykle citlivější než komorový myokard. Vzhledem k častému kolísání hladiny draslíku u pacientů s CKD mají tito pacienti větší prospěch z přístrojů, u kterých se automaticky nastavuje stimulační práh stah od stahu. U takto řízené amplitudy stimulačního výdeje se zvyšuje jak bezpečnost stimulace, tak i délka životnosti přístroje. Při volbě cévního přístupu by se měla dodržovat praktická doporučení, aby byla implantace přístroje na opačné straně, než je arteriovenózní spojka. V případě výměny přístroje je třeba přísně monitorovat antikoagulační léčbu, aby se minimalizovaly krvácivé komplikace.
Resynchronizační léčba pro chronické SS
CKD u pacientů se SS má prevalenci až 55 % a kombinace těchto onemocnění má špatnou prognózu. U pacientů s CKD v terminální fázi se zdá, že srdeční resynchronizační terapie (CRT) přináší potenciálně větší riziko, než činí přínos ze CRT. Nicméně analýza studií a registru IMPROVE HF registry ukázala, že implantace biventrikulárního stimulátoru u pacientů v pokročilém i méně pokročilém stadiu CKD (dle GF) je spojena s výhodami CRT, které jsou pozorovány u pacientů se SS bez CKD, ale je třeba počítat s vyšším rizikem nežádoucích komplikací [18].
Implantabilní kardioverter defibrilátor v prevenci NSS
U pacientů s CKD představuje NSS více než 50 % všech kardiálních úmrtí. Obecně se předpokládá, že přítomnost řady komorbidit u pacientů s CKD i bez CKD snižuje přínos léčby pomocí implantabilního kardio-verterdefibrilátoru (ICD). Pacienti s CKD mají zvýšenou úmrtnost způsobenou jinými kardiálními i nekardiálními příčinami. Zvýšený defibrilační práh může způsobit refrakteritu myokardu na ICD léčbu a vyšší procento implantačních komplikací snižuje přínos ICD léčby u pacientů s CKD. Pacienti s GF < 0,5 ml/ s/ 1,73 m² měli větší výskyt hematomů, pneumotoraxu a infekcí. V retrospektivní analýze CKD bylo spojeno s horší prognózou po implantaci prostého ICD v indikaci primární prevence NSS, ale ne po implantaci ICD v sekundární prevenci NSS, a horší prognózu nemá ani implantace ICD s režimem CRT [19]. U pacientů po implantaci prostého ICD dochází ke snížení GF a naopak nedochází k tomu u pacientů po implantaci ICD s režimem CRT [20]. Tyto výsledky nabádají k pečlivé úvaze při indikaci implantace ICD u starších pacientů s pokročilejším stadiem CKD.
Riziko infekčních komplikací u pacientů s indikací implantace elektrického přístroje
Infekční komplikace CIED se bohužel zvyšují rychleji než implantace samotných elektrických přístrojů. Selhání ledvin je jedna z nejvýznamnějších komorbidit spojených s infekcí spolu s respiračním selháním, SS a diabetem mellitus [21]. Bylo prokázáno, že GF < 1,0 ml/ s/ 1,73 m² je jedním ze šesti faktorů ve skórovacím systému pro předpověď rizika infekčních komplikací u pacientů s CIED. Šestiměsíční riziko infekce se zvýšilo z 1 % u pacientů s kompozitním rizikovým skórem mezi 0 a 7 na 3,4 % u pacientů s rizikovým skórem 8 – 14 a na 11,1 % u pacientů se skórem ≥ 15 (tab. 6) [22]. CKD je jedním z hlavních rizikových faktorů mortality pacientů s infekčními komplikacemi v souvislosti s CIED. Klinické projevy infekce u hemodialyzovaných pacientů s CIED se liší od pacientů bez závislosti na hemodialýze, přičemž častější jsou zde endokarditické komplikace související s elektrodovým systémem, zatímco infekce kapsy CIED jsou méně časté. Uremie je spojena s dysfunkcí imunitního systému, kde deprese imunitního systému přispívá k vysoké prevalenci infekcí u těchto pacientů a aktivace imunitního systému přispívá k progresi zánětu. Většina pacientů má hemodialýzu prováděnou přes centrální žilní katetr, což je spojeno s vysokým rizikem katetrové bakteriemie s následným rizikem transvenózní infekce CIED. Aby se minimalizovalo riziko infekce u kandidátů na CIED, měl by být individuálně zvážen optimální typ přístroje a cévní přístup s ohledem na zvýšené riziko infekce a vaskulární komplikace spojené se složitějším implantátem (např. CRT). V době implantace by pacienti s CKD měli mít vždy antibiotickou profylaxi. U pacientů, kteří jsou již nositeli CIED, bychom se měli vyhnout zavedení dialyzačního katetru a měla by být preferována kontralaterální arteriovenózní spojka. Obecnou zásadou řešení infekce spojené s CIED je účinná léčba antibiotiky, úplné odstranění CIED a pro opětovnou implantaci nového systému je třeba pečlivé zvážení jeho nezbytnosti [23]. Tyto zásady dominantně platí pro pacienty v terminálním stadiu CKD, kde je riziko infekčních komplikací výrazně vyšší, a reálně je třeba zvážit pouhou explantaci CIED, při které riziko komplikací zvýšeno není. Vzhledem k vysokému riziku infekčních komplikací u hemodialyzovaných pacientů a u pacientů v terminálním stadiu CKD by měly být zváženy i CIED, kde se nemusí použít endovaskulární přístup (epikardiální nebo podkožní) [23]. Epikardiální nebo podkožní přístup zkrátí dobu implantace a sníží komplikace spojené s endovaskulární implantací. V případě, že je endovaskulární reimplantace nutná, pak načasování či algoritmus reimplantace implantabilního elektrického přístroje ukazuje schéma 2.
Tab. 6. Klinické faktory a jejich relativní podíl na stanovení rizikového skóre (0–25) pro vznik infekční komplikace u pacienta s ICD, včetně možnosti CRT. 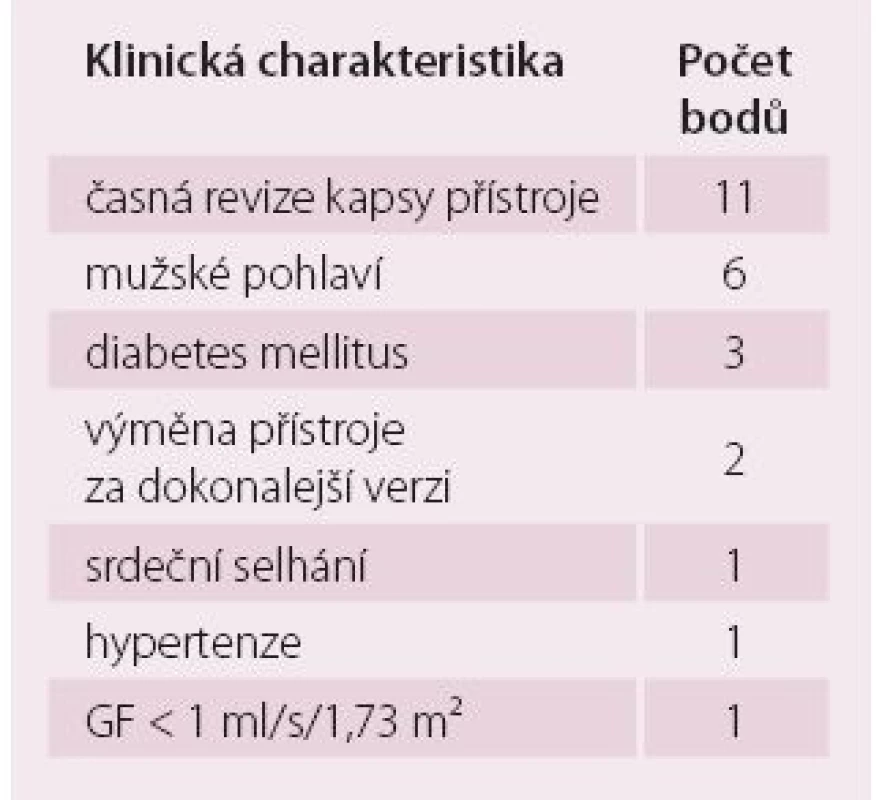
ICD – implantabilní kardioverter-defibrilátor, CRT – srdeční resynchronizační terapie, GF – glomerulární filtrace Schéma 2. Časování reimplantace po extrakci implantabilního elektronického přístroje (Heart Rhythm Society: Consensus on lead extraction). 
CRT – resynchronizační léčba Vliv implantabilních elektrických kardiálních přístrojů na léčbu pacientů s CKD
Perioperační opatření pro elektromagnetické interference, limitace magnetické rezonance
Perioperační opatření u nemocných s CKD jsou podobná jako u ostatních, nicméně pacienti s CKD a s CIED jsou více náchylní k perioperačním komplikacím, proto je třeba pečlivější perioperační monitorace, předoperační úprava vnitřního prostředí i oběhová kompenzace. Pacienti závislí na trvalé kardiostimulaci potřebují před operací přeprogramovat kardiostimulátor do režimu, který intrakardiálně nesnímá elektromagnetické potenciály (VOO/ / DOO) a pokud lze, pak je lépe preferovat bipolární kautery před monopolárními. U pacientů s implantovaným ICD je třeba rovněž přístroj před operací přeprogramovat v tom smyslu, že je třeba vypnout terapie, tedy především se jedná o zabránění falešným defibrilačním výbojům. Po operaci je třeba CIED přeprogramovat do původního režimu.
U pacientů s CKD by nemělo být prováděno vyšetření magnetickou rezonancí s použitím gadolinia pro riziko gadoliniem indukované systémové sklerózy.
Závěr – souhrnná stanoviska Evropské společnosti pro srdeční rytmus
- CKD, definované jako GF < 1 ml/ s/ 1,73 m² po dobu > 3 měsíce, je v dospělé populaci relativně běžné onemocnění (47 % populace starší než 70 let), které zvyšuje riziko KV morbidity i celkové mortality, proto je žádoucí, aby v přítomnosti srdečního onemocnění či v přítomnosti závažnějších arytmií (FS, komorové tachykardie) byly pravidelně sledovány funkce ledvin.
- V běžné praxi se GF odhaduje výpočtem ze sérového kreatininu. V případě pochybností o přesnosti vyšetření či za zvláštních okolností by měl lékař použít další vyšetření k upřesnění funkční závažnosti ledvinného onemocnění.
- U pacientů s CKD je arytmogeneze a riziko náhlé NSS spojeno s mnoha protichůdnými faktory, kterým je třeba předcházet, opakovaně je hodnotit a korigovat (hyperkalemie nebo hypokalemie, elektrolytové dysbalance, rychlé změny objemu tekutin, autonomní dysbalance, změny komorové disperze a/ nebo repolarizace, anémie, acidóza atd.). Pro úpravu řady těchto dysbalancí se uznává podávání betablokátorů, i když pro jejich podávání neexistuje žádná objektivní podpora.
- Farmakokinetika léků může být u pacientů s CKD výrazně změněna, proto je třeba dávku u řady léků upravit podle GF. Toto platí především pro léky s úzkým terapeutickým rozmezím, kterými jsou mnohá antiarytmika a antikoagulancia. U dialyzovaných pacientů je třeba počítat s odstraněním léku samotnou dialýzou, proto se u těchto pacientů s FS stále více ke kontrole rytmu indikuje katetrizační ablace. U perzistentní formy FS, jejímž podkladem je pokročilejší fibróza, je k efektní prevenci recidiv FS třeba počítat s opakovaným výkonem.
- Pacienti s FS a CKD mají vysoké riziko vzniku CMP a tromboembolizmu stejně jako riziko velkého krvácení. Tato rizika jsou obzvláště vysoká u dialyzovaných pacientů a u pacientů po transplantaci ledvin. U pacientů s CKD je třeba zvláštní pozornost věnovat výběru antitrombotické léčby a jejímu sledování.
- Všechna NOAC mají určitý stupeň exkrece ledvinami a neměla by se podávat při těžké renální insuficienci (clearance kreatininu < 0,41 – 0,5 ml/ s/ 1,73 m²). V těchto případech je k antikoagulační léčbě indikován warfarin.
- U pacientů na warfarinu by měla být co nejpřísnější kontrola, aby bylo dosaženo co nejdelšího času antikoagulace v účinném terapeutickém rozmezí.
- U pacientů, kteří potřebují léčbu implantabilními elektrickými přístroji (kardiostimulátor a/ nebo defibrilátor, včetně možnosti resynchronizační léčby), se musí počítat s vyšším rizikem komplikací, vyšší celkovou i kardiální mortalitou, vyšším počtem všech i KV hospitalizací a s vyšším rizikem infekčních komplikací v souvislosti s implantovanými přístroji. K minimalizaci infekčních komplikací je třeba individuálně zvážit místo přístupu implantace elektrodového systému (endovaskulární, epikardiální nebo podkožní). U pacientů s již implantovaným přístrojem transvenózním přístupem bychom se měli vyhnout zavedení dialyzačního katetru a arteriovenózní spojka by měla být založena na kontralaterální straně od implantovaného přístroje.
- Vedení antiarytmické léčby i péče o implantované přístroje u pacientů s onemocněním srdce a CKD je komplexní a může vyžadovat urgentní řešení komplikací (SS, renální selhání, elektrická bouře atd.), k čemuž je třeba spolupráce kardiologa, nefrologa i dalších odborníků.
Doručeno do redakce: 2. 11. 2015
Přijato po recenzi: 16. 11. 2015
doc. MU Dr. Petr Heinc, Ph.D.
www.fnol.cz
petr.heinc@fnol.cz
Zdroje
1. Eckardt KU, Coresh J, Devuyst O et al. Evolving importance of kidney disease: from subspecialty to global health burden. Lancet 2013; 382 : 158 – 169. doi: 10.1016/ S0140-6736(13)60439-0.
2. Mafham M, Emberson J, Landray MJ et al. Estimated glomerular filtration rate and the risk of major vascular events and all-cause mortality: a meta-analysis. PLoS One 2011; 6: e25920. doi: 10.1371/ journal.pone.0025920.
3. Tumlin JA, Costanzo MR, Chawla LS et al. Cardiorenal syndrome type 4: insights on clinical presentation and pathophysiology from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI). Contrib Nephrol 2013; 182 : 158 – 173. doi: 10.1159/ 000349972.
4. Watanabe H, Watanabe T, Sasaki S et al. Close bidirectional relationship between chronic kidney disease and atrial fibrillation: the Niigata preventive medicine study. Am Heart J 2009; 158 : 629 – 636. doi: 10.1016/ j.ahj.2009.06.031.
5. Goldstein BA, Arce CM, Hlatky MA et al. Trends in the incidence of atrial fibrillation in older patients initiating dialysis in the United States. Circulation 2012; 126 : 2293 – 2301.
6. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Supplements 2013; 3 : 1 – 150.
7. Roberts PR, Green D. Arrhythmias in chronic kidney disease. Heart 2011; 97 : 766 – 773. doi: 10.1136/ hrt.2010.208587.
8. Matzke GR, Aronoff GR, Atkinson AJ et al. Drug dosing consideration in patients with acute and chronic kidney disease – a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2011; 80 : 1122 – 1137. doi: 10.1038/ ki.2011.322.
9. Kaski JC, Baker S, Hayward C et al. Drugs in Cardiology: a Comprehensive Guide to Cardiovascular Pharmacotherapy. London, UK: Oxford University Press 2010.
10. Olesen JB, Lip GY, Kamper AL et al. Stroke and bleeding in atrial fibrillation with chronic kidney disease. N Engl J Med 2012; 367 : 625 – 635. doi: 10.1056/ NEJMoa1105594.
11. Camm AJ, Lip GY, De Caterina R et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation – developed with the special contribution of the European Heart Rhythm Association. Europace 2012; 14 : 1385 – 1413.
12. U.S. Renal Data System, USRDS 2006 Annual Data Report: Atlas of End-Stage Renal Disease in the United States, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, Bethesda, MD, 2006.
13. Wang AY, LamCW, Chan IH et al. Sudden cardiac death in end-stage renal disease patients: a 5-year prospective analysis. Hypertension 2010; 56 : 210 – 216. doi: 10.1161/ HYPERTENSIONAHA.110.151167.
14. Goldenberg I, Moss AJ, McNitt S et al. Relations among renal function, risk of sudden cardiac death, and benefit of the implanted cardiac defibrillator in patients with ischemic left ventricular dysfunction. Am J Cardiol 2006; 98 : 485 – 490.
15. Henderson LW. Symptomatic intradialytic hypotension and mortality: an opinionated review. Semin Dial 2012; 25 : 320 – 325. doi: 10.1111/ j.1525-139X.2012.01068.x.
16. Navaravong L, Barakat M, Burgon N et al. Improvement in estimated glomerular filtration rate in patients with chronic kidney disease undergoing catheter ablation for atrial fibrillation. J Cardiovasc Electrophysiol 2015; 26 : 21 – 27. doi: 10.1111/ jce.12530.
17. Haegeli LM, Calkins H. Catheter ablation of atrial fibrillation: an update. Eur Heart J 2014; 35 : 2454 – 2459. doi: 10.1093/ eurheartj/ ehu291.
18. Garg N, Thomas G, Jackson G et al. Cardiac resynchronization therapy in CKD: a systematic review. Clin J Am Soc Nephrol 2013; 8 : 1293 – 1303. doi: 10.2215/ CJN.00750113.
19. Cannizzaro LA, Piccini JP, Patel UD et al. Device therapy in heart failure patients with chronic kidney disease. J Am Coll Cardiol 2011; 58 : 889 – 896. doi: 10.1016/ j.jacc.2011.05.024.
20. Eisen A, Suleiman M, Strasberg B et al. Renal dysfunction and clinical outcomes of patients undergoing ICD and CRTD implantation: data from the Israeli ICD registry. J Cardiovasc Electrophysiol 2014; 25 : 990 – 997. doi: 10.1111/ jce.12442.
21. Polyzos KA, Konstantelias AA, Falagas ME. Risk factors for cardiac implantable electronic device infection: a systematic review and meta-analysis. Europace 2015; 17 : 767 – 777. doi: 10.1093/ europace/ euv053.
22. Mittal S, Shaw RE, Michel K et al. Cardiac implantable electronic device infections: incidence, risk factors, and the effect of the AigisRx antibacterial envelope. Heart Rhythm 2014; 11 : 595 – 601. doi: 10.1016/ j.hrthm.2013.12.013.
23. Diemberger I, Mazzotti A, Giulia MB et al. From lead management to implanted patient management: systematic review and meta-analysis of the last 15 years of experience in lead extraction. Expert Rev Med Devices 2013; 10 : 551 – 573. doi: 10.1586/ 17434440.2013.811837.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2015 Číslo 4- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Statinová intolerance
- Genetický podklad a screening familiární hypercholesterolémie
- Metabolit živočišné stravy produkovaný střevní mikroflórou zvyšuje riziko závažných kardiovaskulárních příhod
-
Všetky články tohto čísla
- Myokarditidy a zánětlivé kardiomyopatie
- Obrovskobuněčná myokarditida a sarkoidóza srdce – update 2015
- Perikarditidy
- Infekční endokarditida – diagnostika a doporučené postupy
- Srdeční vrozené vady v dospělosti
- Klinický přístup k pacientovi s aortální stenózou
- Indikace k intervenci a volba nejvhodnějšího postupu u mitrálních regurgitací
-
Vztah a klinický význam chronického onemocnění ledvin u pacientů s poruchami srdečního rytmu a/ nebo s implantabilními elektrickými přístroji
Zkrácená komentovaná verze oficiálního stanoviska Evropské společnosti pro srdeční rytmus -
Jak léčit dyslipidemii u pacientů s renální insuficiencí
Výběr z doporučení KDIGO s klinickým komentářem - Dávkování antibiotik u pacientů léčených hemoeliminačními metodami
- Vénové vaskulárne choroby – aktuálny naliehavý problém klinickej medicíny
- Diagnóza, klasifikácia a princípy manažmentu cerebrovaskulárnej aterosklerotickej choroby z hľadiska angiológie
- Evolocumab – protilátka proti PCSK9 s mohutným hypolipidemických účinkem
- Co zaznělo na kongresu AHA 2015 v Orlandu
-
European Society of Cardiology Congress
Co může být lepší než NOAC?
Snad jedině NOAC s antidotem... -
European Society of Cardiology Congress
Mají pacienti se srdečním selháním opět naději?
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Perikarditidy
- Myokarditidy a zánětlivé kardiomyopatie
- Srdeční vrozené vady v dospělosti
- Infekční endokarditida – diagnostika a doporučené postupy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



