-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Adaptivní IG-IMRT karcinomu prostaty
Adaptive IG-IMRT for Prostate Cancer
Backgrounds:
Adaptive image-guided intensity-modulated radiation therapy (IG-IMRT) is a perspective method for the treatment of localized prostate cancer. Validate optimal protocols for IG-IMRT using kilovoltage cone-beam CT (CBCT) are required.Patients and Methods:
Seventy-six patients with prostate cancer were treated using adaptive IG-IMRT. Based on the CBCT performed during the first 10 fractions of radiotherapy, an average prostate position in relation to the pelvic bones was determined in antero-posterior AP, supero-inferior SI, and right-left axes. An adapted treatment plan for the second phase of the treatment included an isocenter shift into its average position (correction of the systematic error Σ). A margin between a clinical and planned target volume (CTV-PTV) was adjusted according to the magnitude of random error σ. During the second phase of radiotherapy, set-up of patients was performed daily on pelvic bones using kilovoltage skiagraphic imaging in two projections (kV-kV). Follow-up CBCTs were repeated once a week.Results:
An average isocenter position differed from the position of a reference planning CT isocenter in at least one axis in 63 patients (83%). Major changes were recorded in AP axis – shift ≥ 2 mm in 33 patients (43%), shift ≥ 5 mm in 7 patients (9%). PTV for the second phase of radiotherapy was in the range of 6–10 mm in AP axis, 6–8 mm in SI axis, and 6 mm in RL axis. Mean σ value in the AP axis was smaller in patients with a specific diet compared to patients without the diet (2.2 mm vs. 2.7 mm, p = 0.05). We evaluated 446 follow-up CBCT images from the second phase of radiotherapy (66 patients had 6 CBCT, 10 patients had 5 CBCT). Set-up error exceeding CTV-PTV margin occurred in 4 cases with no more than once per patient. Safety margin was sufficient in 72/76 patients (95%).Conclusion:
IG-IMRT protocol integrating CBCT and kV-kV imaging provided adequate coverage of the target volume and proved to be compatible with departmental workflow. Margin reduction around the CTV is a prerequisite for dose escalation aimed at a intraprostatic lesion.Key words:
prostate cancer – radiation therapy – adaptive – image guidance – IMRT
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
16. 2. 2011Accepted:
15. 3. 2011
Autoři: J. Vaňásek 1; K. Odrážka 1,2,3; M. Doležel 1,3; I. Kolářová 1
Působiště autorů: Oddělení klinické a radiační onkologie, Multiscan s. r. o., Pardubická krajská nemocnice a. s., Pardubice 1; 1. a 3. lékařská fakulta, Univerzita Karlova v Praze 2; Katedra radiační onkologie IPVZ, Praha 3
Vyšlo v časopise: Klin Onkol 2011; 24(5): 361-366
Kategorie: Původní práce
Souhrn
Východiska:
Adaptivní obrazem navigovaná radioterapie s modulovanou intenzitou (IG-IMRT) je perspektivní metoda léčby lokalizovaného karcinomu prostaty. Je třeba vytvořit a validovat optimální protokoly pro IG-IMRT s využitím kilovoltážního CT kónickým svazkem (CBCT).Soubor pacientů a metody:
Adaptivní IG-IMRT bylo léčeno 76 pacientů s karcinomem prostaty. Na základě CBCT prováděného během prvních 10 frakcí radioterapie byla stanovena průměrná pozice prostaty vůči skeletu pánve ve třech osách: anteroposteriorní AP, kraniokaudální SI, laterolaterální RL. Adaptovaný ozařovací plán pro druhu fázi radioterapie zahrnoval posun izocentra do jeho průměrné pozice (korekce systematické chyby Σ). Podle velikosti náhodné chyby σ byl upraven lem mezi klinickým a plánovacím cílovým objemem (CTV-PTV). Ve druhé fázi radioterapie byli pacienti denně nastavováni na skelet pánve kilovoltážním skiagrafickým zobrazením ve dvou projekcích (kV-kV). Kontrolní CBCT bylo provedeno 1× týdně.Výsledky:
Průměrná pozice izocentra byla u 63 pacientů (83 %) alespoň v jedné ose odlišná od pozice izocentra na referenčním plánovacím CT. Největší změny byly zaznamenány v AP ose – posun ≥ 2 mm u 33 pacientů (43 %), posun ≥ 5 mm u 7 pacientů (9 %). PTV pro druhou fázi radioterapie byl v rozmezí 6–10 mm v AP ose, 6–8 mm v SI ose, respektive 6 mm v RL ose. Průměrná hodnota σ byla v AP ose menší u pacientů s dietním režimem oproti pacientům bez diety (2,2 vs 2,7 mm, p = 0,05). Vyhodnotili jsme 446 kontrolních CBCT obrazů z druhé fáze radioterapie (66 pacientů mělo 6 CBCT, 10 pacientů mělo 5 CBCT). Chyba nastavení přesahující lem CTV-PTV se objevila ve 4 případech, vždy maximálně jedenkrát u jednoho pacienta. Bezpečnostní lem byl dostatečný u 72/76 pacientů (95 %).Závěr:
Protokol IG-IMRT kombinující CBCT a kV-kV zobrazení zajišťuje adekvátní pokrytí cílového objemu a vyhovuje po stránce organizace provozu. Redukce lemu kolem CTV je předpokladem pro eskalaci dávky na intraprostatickou lézi.Klíčová slova:
karcinom prostaty – radioterapie – adaptivní – řízení obrazem – IMRTÚvod
Protinádorový účinek zevní radioterapie u lokalizovaného karcinomu prostaty závisí na výši aplikované dávky záření. Randomizované a retrospektivní studie prokázaly, že eskalace dávky pomocí 3D-CRT (trojrozměrná konformní radioterapie) a IMRT (radioterapie s modulovanou intenzitou) přináší vyšší kontrolu nádoru a přijatelnou toxicitu [1–3]. Přesné provedení frakcionované radioterapie je nezbytnou podmínkou efektu léčby. Opakovaná verifikace pozice pacienta před ozářením, kvantifikace chyby nastavení a korekce dle přijatého protokolu jsou základními prvky IGRT (radioterapie řízená obrazem) [4]. IGRT se v klinické praxi rozšířila především v posledních 5 letech, kdy jsou komerčně dostupné různé systémy verifikace nastavení. Při radioterapii karcinomu prostaty jsou nejčastěji využívány dvě metody – kilovoltážní skiagrafické zobrazení ve dvou projekcích (kV-kV) a kilovoltážní CT kónickým svazkem (CBCT). Nespornou výhodou CBCT je zobrazení měkkých tkání – prostaty, rekta a močového měchýře [5].
Adaptivní radioterapie je proces, při němž je ozařovací plán modifikován na základě zpětných informací – systematické monitorování variací v časné fázi léčby umožňuje optimalizovat ozařovací plán pro další fázi radioterapie [6]. Yan et al prokázali, že na základě portálového zobrazení v prvních dnech radioterapie lze predikovat chybu nastavení a vytvořit pro pacienta individuální PTV (plánovací cílový objem) a následně nový ozařovací plán [7,8]. Touto metodou bylo možné redukovat objem PTV v průměru o 24 %. Výzkum v Netherlands Cancer Institute ukázal, že s využitím adaptivní radioterapie lze omezit lem mezi CTV (klinický cílový objem) a PTV z 10 mm na 7 mm [9]. Při prvních 6 ozářeních bylo vždy zhotoveno CBCT a na základě těchto zobrazení byl vytvořen průměrný CTV a průměrný objem rekta. Následný plán tak částečně zohlednil systematickou chybu nastavení a umožnil redukci bezpečnostního lemu.
Naším cílem bylo vytvořit a validovat protokol pro adaptivní obrazem navigovanou radioterapii s modulovanou intenzitou (IG-IMRT). S ohledem na nádorovou lokalitu, vybavení pracoviště a organizaci provozu jsme zvolili kombinaci CBCT a kV-kV.
Soubor pacientů a metody
Charakteristika souboru
V období od listopadu 2008 do ledna 2010 bylo na Oddělení klinické a radiační onkologie, Multiscan a Pardubická krajská nemocnice, léčeno adaptivní IG-IMRT celkem 76 pacientů s karcinomem prostaty. Jednalo se o pacienty s lokalizovaným onemocněním, bez klinických či chirurgických známek postižení uzlin, bez klinických známek distančních metastáz – stadium T1-3 N0 (pN0) M0. Hormonální léčba byla podávána v souladu s doporučením National Cancer Institute a National Comprehensive Cancer Network. Všichni pacienti podepsali před léčbou informovaný souhlas.
Plánování radioterapie – IMRT
Pacienti byli plánováni a léčeni v poloze na zádech s vakuovou podložkou nebo podložkou pod kolena a nohy (Vac-Lok/Dual Leg Positioner Cushion, Civco) k imobilizaci dolních končetin a pánve. Všechny ozařovací plány byly vyhotoveny v 3D plánovacím systému s inverzním plánováním (Eclipse 8.0, Varian). Klinický cílový objem zahrnoval prostatu a bázi semenných váčků / celé semenné váčky při jejich postižení. Plánovací cílový objem (PTV) je specifikován v textu o adaptivní radioterapii. Rektum bylo konturováno v úrovni PTV plus 10 mm kraniálně i kaudálně; močový měchýř byl konturován celý. Používali jsme techniku pěti koplanárních polí (45°, 105°, 180°, 255°, 315°). Předepsaná dávka v izocentru byla 78 Gy během 8 týdnů, dávka na frakci 2 Gy, jedna frakce denně. Při kalkulaci a optimalizaci ozařovacího plánu jsme respektovali řadu dávkově-objemových parametrů pro PTV a rizikové orgány. Mezi parametry s nejvyšší prioritou patřily následující limity: PTV – minimálně 95 % objemu obdrží 95 % předepsané dávky; rektum – maximálně 25 % objemu obdrží dávku 70 Gy; močový měchýř – maximálně 30 % objemu obdrží dávku 70 Gy. Modulace fotonového svazku byla prováděna pomocí mnoholistového dynamického kolimátoru metodou sliding window. Ozařování probíhalo na lineárním urychlovači (Clinac 2100 C/D, Varian) při energii fotonů 18 MV.
Od června 2009 byli pacienti před léčbou instruováni, aby respektovali specifický dietní režim. Jeho cílem bylo omezení plynatosti střev, evakuace rekta před ozařováním a zajištění konstantní náplně močového měchýře. Dietní opatření začali pacienti dodržovat jeden týden před plánovacím CT a pokračovali kontinuálně v celém průběhu radioterapie.
Verifikace nastavení – IGRT
Ověření pozice pacienta a její korekce byly prováděny před každým ozářením (OBI 1.3, Varian). Kombinovali jsme dvě metody IGRT – kilovoltážní CT kónickým svazkem (CBCT) a kilovoltážní skiagrafické zobrazení ve dvou projekcích (kV-kV). CBCT bylo získáno při rotaci gantry o 360° nebo 180° a porovnáváno s referenčním plánovacím CT. Nejprve jsme provedli registraci skeletu pánve a zaznamenali chybu nastavení ve třech osách (anteroposteriorní AP, kraniokaudální SI, laterolaterální RL) – viz obr. 1a. Potom jsme dosáhli shody pozice prostaty a opět jsme zaznamenali chybu nastavení, která současně reprezentovala korekci polohy stolu před ozářením (obr. 1b). Ortogonální kV-kV obrazy byly snímány při pozici rentgenky 0° a 90°. V obou projekcích jsme provedli manuální registraci skeletu pánve s referenčními digitálně rekonstruovanými snímky z plánovacího CT. Chyba nastavení odpovídala následné korekci pozice stolu před ozářením.
Obr. 1. CBCT – registrace pozice skeletu pánve (a), registrace pozice prostaty (b). (a) vlevo aktuální CBCT, vpravo refrenční plánovací CT (b) vlevo aktuální CBCT, vpravo refrenční plánovací CT CBCT – kilovoltážní CT kónickým svazkem 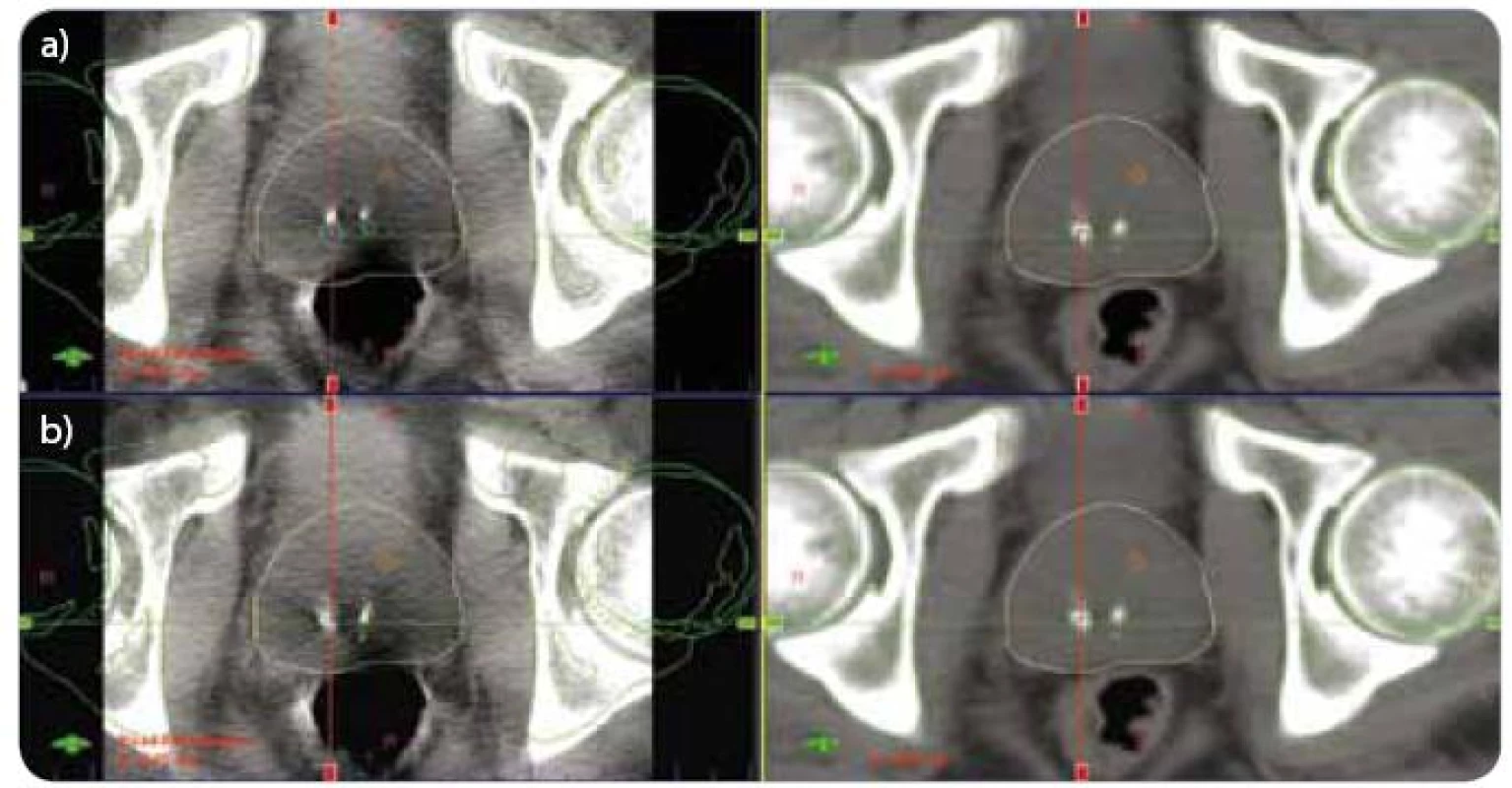
Adaptivní radioterapie
Každý pacient měl v rámci IG-IMRT dva ozařovací plány – zatímco plán pro první fázi léčby byl standardní, plán pro druhou fázi radioterapie byl individuálně upraven na základě dat získaných během prvních dvou týdnů léčby (obr. 2). Lem mezi CTV a PTV byl v první fázi terapie 8 mm, 6 mm a 6 mm v AP, SI, respektive RL ose. Jeho velikost byla stanovena na základě předchozí pilotní analýzy nepřesnosti nastavení na pracovišti (vyhodnotili jsme změny pozice prostaty vůči skeletu pánve na základě 225 CBCT u 20 pacientů; stanovili jsme průměrný posun izocentra/prostaty, systematickou a náhodnou komponentu chyby nastavení (tab. 1), vypočítali jsme teoretický lem potřebný k pokrytí CTV izodózou 95 % u minimálně 90 % nastavení [10]; vypočítaný lem jsme modifikovali s ohledem na další možné zdroje chyb nastavení a použitý způsob verifikace nastavení. Po dvou týdnech léčby jsme vyhodnotili 10 CBCT procedur, stanovili jsme průměrnou pozici izocentra vůči skeletu pánve (systematická chyba Σ) a distribuci měření kolem průměrné pozice (náhodná chyba σ).
Obr. 2. Algoritmus adaptivní IG-IMRT karcinomu prostaty. CBCT – kilovoltážní CT kónickým svazkem; kV-kV – kilovoltážní skiagrafické zobrazení ve dvou projekcích; W – týden; CTV – klinický cílový objem; PTV – plánovací cílový objem 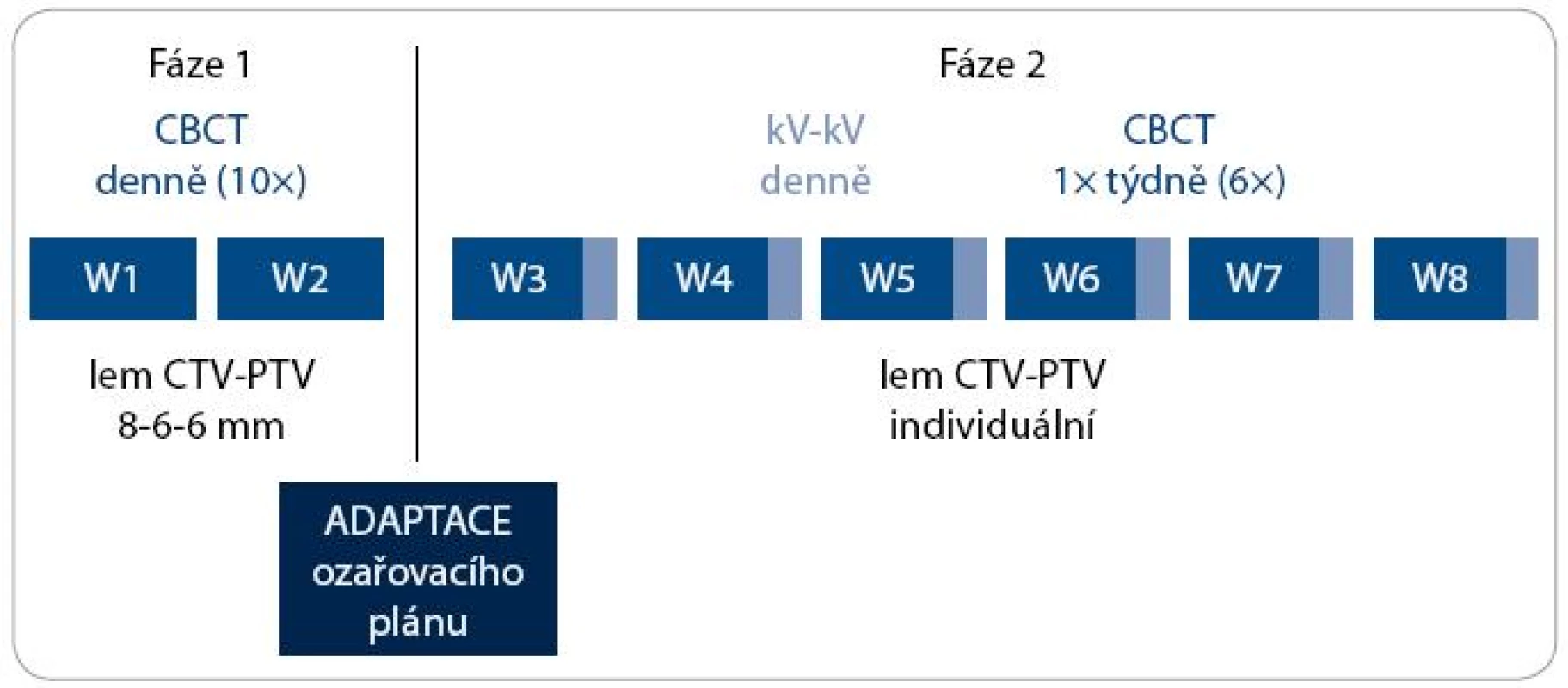
Tab. 1. Chyba nastavení prostata – skelet pánve. 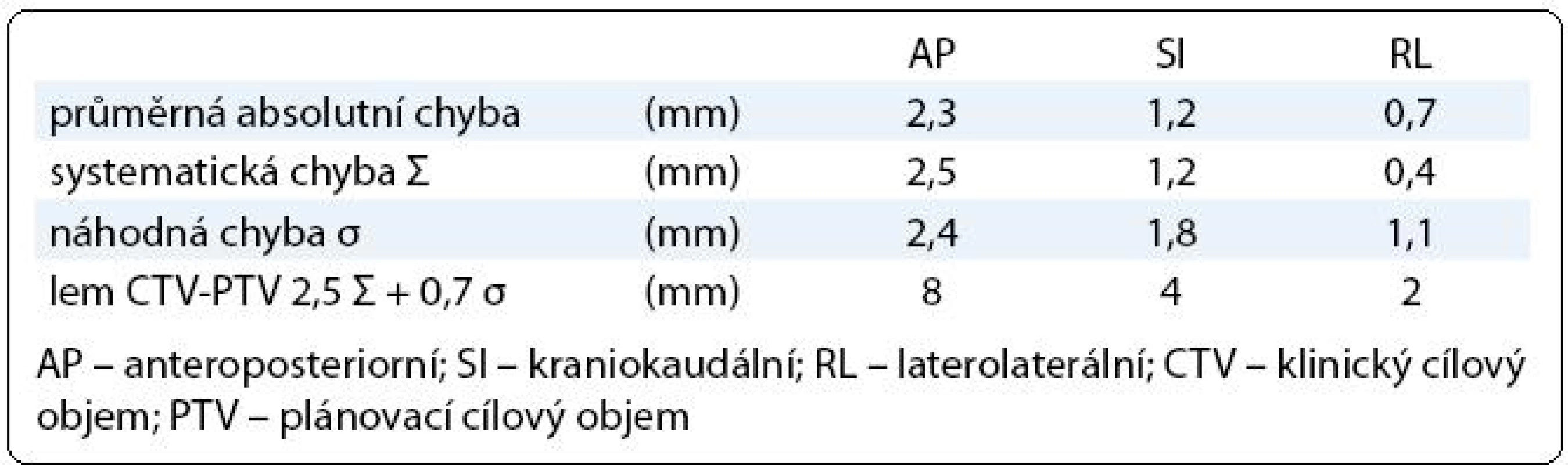
Úpravu ozařovacího plánu pro druhou fázi radioterapie jsme provedli ve dvou krocích:
- posun izocentra do jeho průměrné pozice – tak jsme z větší části eliminovali systematickou chybu,
- volba lemu CTV-PTV podle velikosti náhodné chyby (izotropní lem 6 mm při σ ≤ 2,5 mm; lem 8 mm v té ose, kde bylo σ > 2,5 mm, ale maximálně 5 mm; lem 10 mm v té ose, kde bylo σ > 5 mm).
Verifikace nastavení byla ve druhé fázi léčby prováděna denně kV-kV metodou – registrace skeletu pánve. Jednou týdně bylo zhotoveno kontrolní CBCT, tj. celkem 6 procedur mezi 3. a 8. týdnem ozařovací série.
Hodnocení nepřesnosti nastavení
Ve druhé fázi radioterapie jsme u všech 6 CBCT sledovali chyby nastavení. Zaznamenali jsme posun izocentra vůči skeletu pánve v AP, SI, respektive RL ose. Ověřovali jsme, zda naměřené hodnoty nepřekračují velikost individuálního lemu CTV-PTV v libovolné ose. Pokud by chyba nastavení byla větší než příslušný lem CTV-PTV minimálně při dvou kontrolních CBCT, následovala by intervence (revize velikosti lemu, změna metody verifikace nastavení).
Statistika
Interfrakční náhodná chyba nastavení (σ) ve dvou skupinách pacientů (pacienti s dietou versus pacienti bez diety) byla porovnávána v AP, SI, respektive RL ose dvouvýběrovým t-testem. Jestliže výběry nepocházely z normálního rozdělení hodnot, byl použit Mann-Whitneyův test.
Výsledky
V první fázi radioterapie jsme v celém souboru 76 pacientů vyhodnotili celkem 760 CBCT obrazů (10 zobrazení u každého pacienta). Průměrná pozice izocentra vypočítaná na základě 10 CBCT měření byla u 63 pacientů (83 %) alespoň v jedné ose odlišná od pozice izocentra na referenčním plánovacím CT (tab. 2). Nejčastěji byla jiná pozice prostaty zjištěna v AP ose – 51 pacientů (67 %), přičemž posun ≥ 2 mm, respektive ≥ 5 mm, byl prokázán u 33 (43 %), respektive 7 (9 %) pacientů. Změna pozice prostaty v SI ose ≥ 2 mm byla detekována u 9 pacientů (12 %) a změna ≥ 5 mm u jednoho pacienta (1 %). Lem CTV-PTV pro druhou fázi radioterapie vycházející z hodnot σ byl v rozmezí 6–10 mm v AP ose, 6–8 mm v SI ose, respektive 6 mm v RL ose (obr. 3). Průměrná hodnota σ z 10 CBCT měření byla ve všech třech osách menší u pacientů s dietním režimem oproti pacientům bez diety (tab. 3). Rozdíl dosáhl v AP ose hranice statistické významnosti.
Tab. 2. Posun izocentra vůči skeletu pánve. 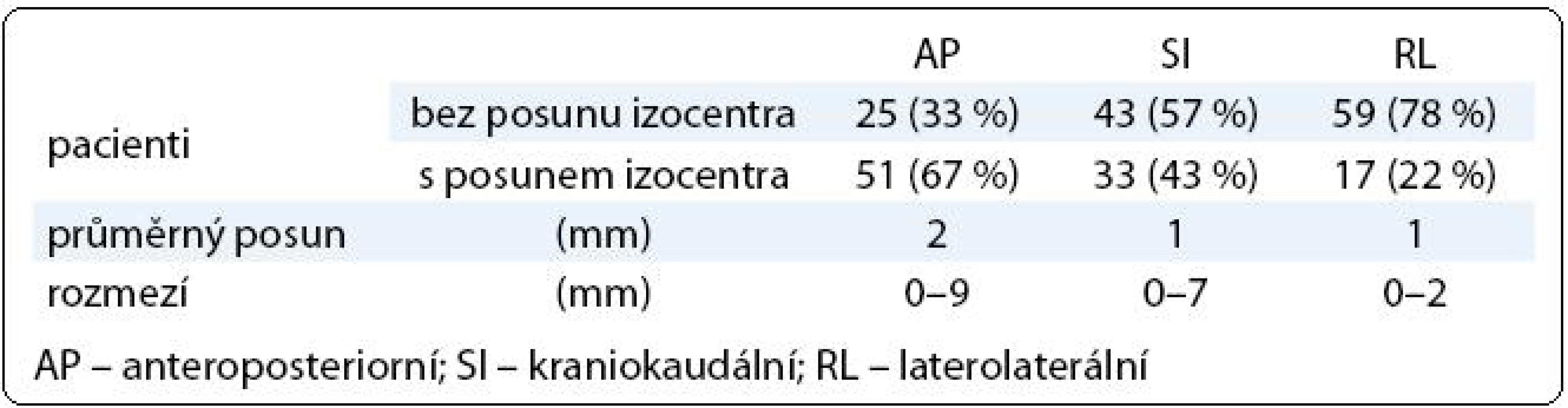
Obr. 3. Distribuce pacientů podle velikosti lemu CTV -PTV. CTV – klinický cílový objem; PTV – plánovací cílový objem; AP – anteroposteriorní; SI – kraniokaudální; RL – laterolaterální 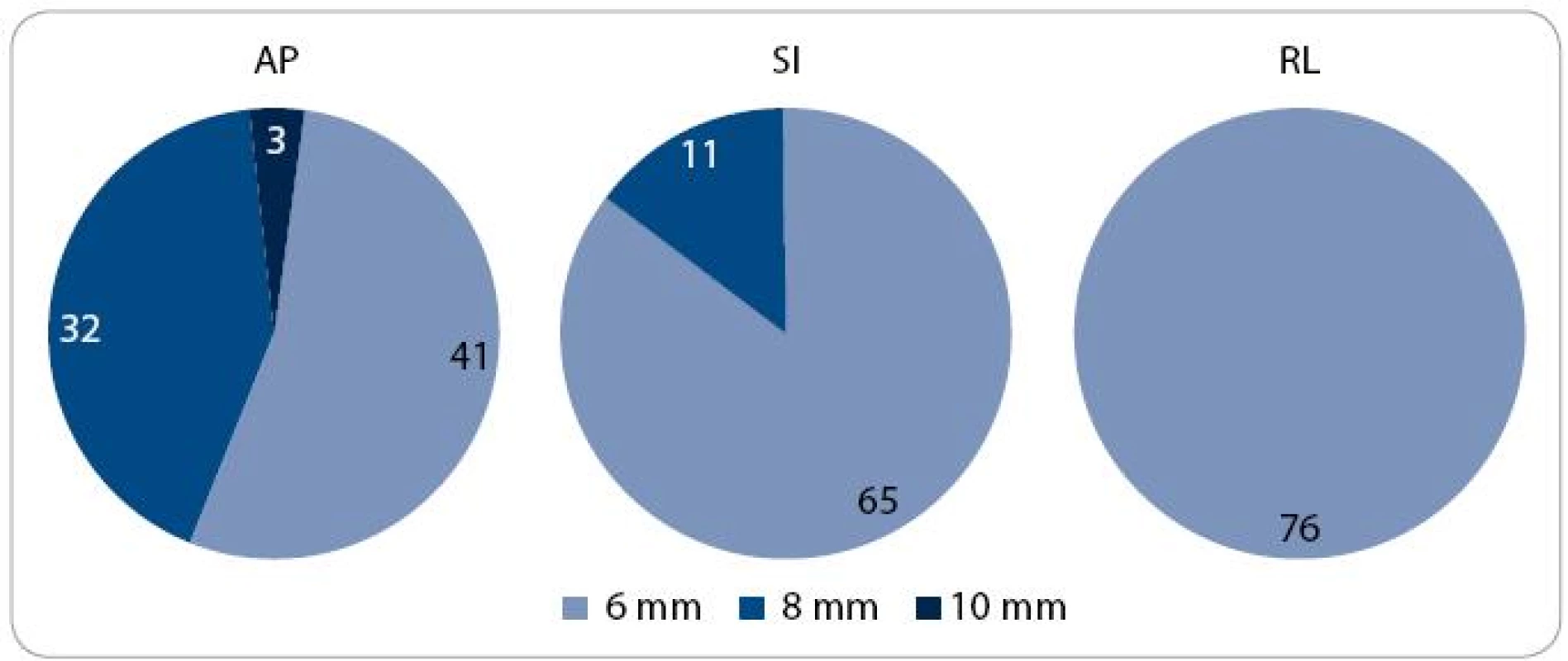
Tab. 3. Vliv diety na náhodnou chybu nastavení. 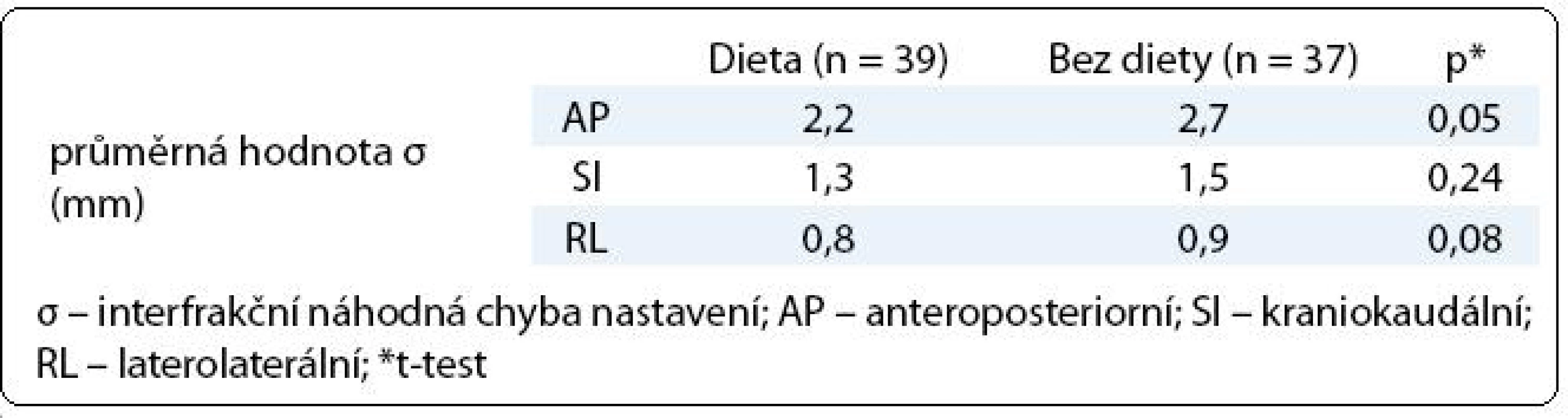
Ve druhé fázi radioterapie jsme v souboru 76 pacientů vyhodnotili celkem 446 kontrolních CBCT obrazů (66 pacientů mělo 6 CBCT, 10 pacientů mělo 5 CBCT). Chyba nastavení přesahující lem CTV-PTV se objevila celkem čtyřikrát, vždy maximálně jedenkrát u jednoho pacienta (tab. 4). Lem CTV-PTV byl dostatečný u 72/76 pacientů (95 %).
Tab. 4. Chyba nastavení ve vztahu k lemu CTV -PTV. 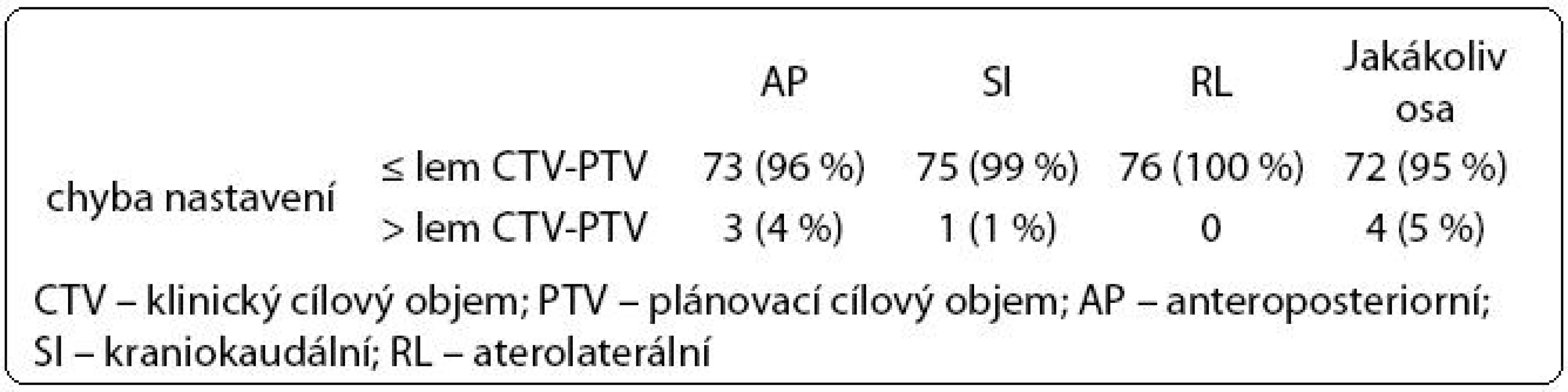
Diskuze
Verifikace pozice pacienta před ozářením pomocí zobrazení tělesných struktur má svoje počátky v 50. letech 20. století (mobilní či integrovaný rentgenový přístroj pro skiagrafii). Moderní IGRT přichází v 90. letech minulého století a je spojena s periodickým zobrazováním pomocí elektronického portálového zařízení EPID (electronic portal imaging device), vyhodnocením chyby nastavení a činností směřující ke korekci chyb [4,11]. V posledním desetiletí je v klinické praxi dostupná řada IGRT systémů – pro verifikaci pozice prostaty se nejčastěji používají EPID, ortogonální kV zobrazení, CBCT a lokalizace ultrazvukem. EPID a kV-kV zobrazí skelet a intraprostatické markery, nikoliv měkké tkáně. Naproti tomu CBCT a UZ poskytují obraz prostaty a rizikových orgánů.
Chyba nastavení mezi prostatou a kožními značkami může vyžadovat bezpečnostní lem přesahující 10 mm. Tanyi et al sledovali denně a během ozáření kontinuálně pozici prostaty pomocí mikročipů [12]. Lem potřebný k pokrytí chyby nastavení při použití kožních značek byl v AP, SI a RL ose 16,3 mm, 11,4 mm, respektive 7,5 mm; při registraci na skelet pánve klesly hodnoty na 10,5 mm (AP), 9,4 mm (SI), respektive 2,1 mm (RL). Lem potřebný k pokrytí chyby nastavení prostaty při registraci na skelet byl zkoumán rovněž na Mayo Clinic u 20 pacientů pomocí EPID a intraprostatických markerů [13]. Autoři uvádějí následující hodnoty: 7,3 mm v AP ose, 5,1 mm v SI ose a 5,0 mm v RL ose. Sami jsme analýzou 225 CBCT u 20 pacientů zjistili, že lem mezi CTV a PTV při registraci na kožní značky musí být 12 mm (AP), 9 mm (SI) a 12 mm (RL), aby izodóza 95 % pokryla minimálně 90 % nastavení. Při nastavení na skelet pánve jsme dospěli k hodnotám lemu CTV-PTV v AP, SI a RL ose 8 mm, 4 mm, respektive 2 mm (nepublikované údaje). Nastavení na skelet pánve je přesnější než nastavení na kůži, přesto je pohyb prostaty vůči skeletu významný. Podílí se na něm měnící se náplň rekta a močového měchýře, tonus svalstva pánve a dýchání. Pohyb prostaty nejvíce ovlivňuje objem rekta – naplněné rektum vytlačuje prostatu ventrálně a kraniálně. Posun prostaty je nejmenší v oblasti apexu a zvětšuje se směrem k bázi a semenným váčkům.
Měření systematické a náhodné chyby nastavení a výpočet lemu CTV-PTV v populaci pacientů má spolehlivé výstupy [10]. Určení optimálního individuálního lemu pro konkrétního pacienta je problematické. V souboru našich pacientů jsme posunem izocentra do jeho průměrné pozice z 10 CBCT měření částečně eliminovali systematickou chybu. Podobný postup použili Nijkamp et al v Amsterodamu, kteří místo posunu izocentra vytvořili na základě 6 CBCT průměrné kontury CTV a rekta [9]. Reziduální systematická chyba závisí na počtu CBCT měření, celkovém počtu frakcí a náhodné chybě; v podmínkách našeho protokolu je její velikost přibližně ≤ 1 mm [14]. Při stanovení lemu pro druhou fázi léčby jsme vycházeli z hodnoty 1,5–2× náhodná chyba σ a zohlednili jsme reziduální systematickou chybu a nepřesnost registrace prostaty při CBCT [15,16]. Jako minimální lem CTV-PTV jsme zvolili hodnotu 6 mm. Taková velikost lemu odpovídá výsledkům výzkumu, který provedli Polat et al ve Würzburgu [17]. Ve skupině 21 pacientů bylo CBCT provedeno před ozářením a bezprostředně po jeho skončení. Intrafrakční posun prostaty přesahující 5 mm byl zjištěn u 12 % frakcí, přičemž pohyb prostaty byl nezávislý na pohybu skeletu. Autoři vypočítali, že ke kompenzaci intrafrakční chyby je potřebný lem 6 mm.
Vzhledem k nejistotě při určení správného lemu CTV-PTV má zásadní význam ověření vlastních dat. Validace našeho protokolu (446 kontrolních CBCT u 76 pacientů) prokázala, že aktuální posun prostaty nepřesahoval lem v adaptovaném plánu u 442/446 měření (99 %). Adekvátního pokrytí CTV jsme dosáhli u 72/76 pacientů (95 %). Nijkamp et al v protokolu adaptivní radioterapie zaznamenali, že při 137/143 (96 %) kontrolních CBCT byl CTV vzat do PTV. Tomu odpovídalo adekvátní pokrytí cílového objemu u 15/20 pacientů (75 %) [9].
Analýza ozařovacích plánů u 127 pacientů léčených 3D-CRT v M. D. Anderson Cancer Center ukázala, že distenze rekta na plánovacím CT zvyšuje riziko biochemického relapsu [18]. Ke shodnému závěru dospěli rovněž onkologové v Bruselu [19]. Je evidentní, že distenze rekta je tak spojena s vyšším rizikem poddávkování cílového objemu. Zavedení dietního protokolu u našich pacientů mělo pozitivní vliv na náhodnou chybu nastavení především v AP ose (dieta σ 2,2 mm vs bez diety σ 2,7 mm, p = 0,05). Podobné rozdíly zaznamenali Smitsmans et al při analýze CBCT u 49 pacientů s karcinomem prostaty [20]. Náhodná chyba v AP ose 4,0 mm (pacienti bez diety) se snížila na 2,6 mm (pacienti s dietou).
Závěr
IG-IMRT protokol využívající CBCT a kV-kV zobrazení zajišťuje adekvátní pokrytí cílového objemu a vyhovuje po stránce organizace provozu. Redukce bezpečnostního lemu nám umožňuje respektovat striktní kritéria pro dávku v rizikových orgánech a eskalovat dávku záření na prostatu, případně na intraprostatickou lézi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
doc. MUDr. Jaroslav Vaňásek, CSc.
Oddělení radiační a klinické onkologie
Multiscan & Pardubická krajská nemocnice
Kyjevská 44
532 03 Pardubice
e-mail: vanasek@multiscan.cz
Obdrženo: 16. 2. 2011
Přijato: 15. 3. 2011
Zdroje
1. Dearnaley DP, Sydes MR, Graham JD et al. Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial. Lancet Oncol 2007; 8(6): 475–487.
2. Kuban DA, Tucker SL, Dong L et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008; 70(1): 67–74.
3. Dolezel M, Odrazka K, Vaculikova M et al. Dose escalation in prostate radiotherapy up to 82 Gy using simultaneous integrated boost: direct comparison of acute and late toxicity with 3D-CRT 74 Gy and IMRT 78 Gy. Strahlenther Onkol 2010; 186(4): 197–202.
4. Verellen D, De Ridder M, Storme G. A (short) history of image-guided radiotherapy. Radiother Oncol 2008; 86(1): 4–13.
5. Xing L, Thorndyke B, Schreibmann E et al. Overview of image-guided radiation therapy. Med Dosim 2006; 31(2): 91–112.
6. Ghilezan M, Yan D, Martinez A. Adaptive radiation therapy for prostate cancer. Semin Radiat Oncol 2010; 20(2): 130–137.
7. Yan D, Vicini F, Wong J et al. Adaptive radiation therapy. Phys Med Biol 1997; 42(1): 123–132.
8. Martinez A, Yan D, Lockman D et al. Improvement in dose escalation using the process of adaptive radiotherapy combined with three-dimensional conformal or intensity-modulated beams for prostate cancer. Int J Radiat Oncol Biol Phys 2001; 50(5): 1226–1234.
9. Nijkamp J, Pos FJ, Nuver TT et al. Adaptive radiotherapy for prostate cancer using kilovoltage cone-beam computed tomography: first clinical results. Int J Radiat Oncol Biol Phys 2008; 70(1): 75–82.
10. Van Herk M, Remeijer P, Rasch C et al. The probability of correct target dosage: dose-population histograms for deriving treatment margins in radiotherapy. Int J Radiat Oncol Biol Phys 2000; 47(4): 1121–1135.
11. Odrážka K, Vaculíková M, Petera J et al. Nepřesnost nastavení během konformní radioterapie karcinomu prostaty. Radiační onkologie 2011; 1 : 11–19.
12. Tanyi JA, He T, Summers PA et al. Assessment of planning target volume margins for intensity-modulated radiotherapy of the prostate gland: role of daily inter - and intrafraction motion. Int J Radiat Oncol Biol Phys 2010; 78(5): 1579–1585.
13. Schallenkamp JM, Herman MG, Kruse JJ et al. Prostate position relative to pelvic bony anatomy based on intraprostatic gold markers and electronic portal imaging. Int J Radiat Oncol Biol Phys 2005; 63(3): 800–811.
14. Bortfeld T, van Herk M, Jiang SB. When should systematic patient positioning errors in radiotherapy be corrected. Phys Med Biol 2002; 47(23): N297–N302.
15. Litzenberg DW, Balter JM, Lam KL et al. Retrospective analysis of prostate cancer patients with implanted gold markers using off-line and adaptive therapy protocols. Int J Radiat Oncol Biol Phys 2005; 63(1): 123–133.
16. White EA, Brock KK, Jaffray DA et al. Inter-observer variability of prostate delineation on cone beam computerized tomography images. Clin Oncol 2009; 21(1): 32–38.
17. Polat B, Guenther I, Wilbert J et al. Intra-fractional uncertainties in image-guided intensity-modulated radiotherapy (IMRT) of prostate cancer. Strahlenther Onkol 2008; 184 : 668–673.
18. de Crevoisier R, Tucker SL, Dong L et al. Increased risk of biochemical and local failure in patients with distended rectum on the planning CT for prostate cancer radiotherapy. Int J Radiat Oncol Biol Phys 2005; 62(4): 965–973.
19. Engels B, Soete G, Verellen D et al. Conformal arc radiotherapy for prostate cancer: increased biochemical failure in patients with distended rectum on the planning computed tomogram despite image guidance by implanted markers. Int J Radiat Oncol Biol Phys 2008; 74(2): 388–391.
20. Smitsmans MH, Pos FJ, de Bois J et al. The influence of a dietary protocol on cone beam CT-guided radiotherapy for prostate cancer patients. Int J Radiat Oncol Biol Phys 2008; 71(4): 1279–1286.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2011 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Hsp90 – cíl protinádorové terapie
- Předoperační chemoradioterapie v kombinaci s bevacizumabem u karcinomu konečníku
- Co pacientky potřebují vědět před operací mamárního karcinomu
- Neuroendoskopická biopsie tumoru mozku
- Cetuximab zvyšuje antiproliferativní účinek trastuzumabu u buněk karcinomu prsu s nadměrnou expresí ERBB2 – předběžná studie
- Adaptivní IG-IMRT karcinomu prostaty
- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Výsledky terapie metastatického renálního karcinomu lékem everolimus – analýza údajů z klinického registru RENIS
- Zápis ze schůze výboru České onkologické společnosti ČLS JEP konané dne 20. 9. 2011 v Olomouci
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
- Recenze
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Parciální regrese ložisek Erdheimovy-Chesterovy nemoci v CNS po léčbě 2-chlorodeoxyadenosinem a jejich kompletní vymizení při léčbě lenalidomidem
- Neuroendoskopická biopsie tumoru mozku
- Sekundární angiosarkomy po konzervativní léčbě nádorů prsu
- Onkochirurg doc. MUDr. Zdeněk Pačovský, CSc., zemřel
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



