-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
Patient with B-CLL with a History of Unrelated Hematopoietic Cells Donation – Retrospective Analysis of CLL Development and Implication for the Recipient
Background:
Donor cell leukemia (DCL) is a relatively rare but well documented complication of hematopoietic stem cell transplantation. So far, publications described only DCL arising de novo in the recipient.Observation:
In this study, we describe a case of chronic lymphocytic leukemia (B-CLL) developing in a volunteer unrelated donor from the Czech National Marrow Donors Registry (CNMDR) several years after donation. From archival DNA sample, we have retrospectively found that subclinical CLL clone was already present at the time of donation but early death of recipient prevented eventual development of DCL. This case documents well the long period between detection of B-CLL clone and full development of clinical-laboratory symptomatology. The medical and ethical questions posed by an isolated case of detection of hematological malignancy present either only in the donor or only in the recipient are discussed.Conclusion:
The case demonstrates the increasing risk of development of various forms of DCL and thus highlights the need for long-term monitoring of stem cell donor, not only in terms of health of donor but also in terms of potential risks for the recipient.Key words:
donor cell leukemia – chronic lymphocytic leukemia – grafts – donors
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
13. 9. 2011Accepted:
7. 11. 2011
Autoři: P. Jindra 1; L. Žejšková 2; S. Peková 2; J. Navrátilová 1; M. Schutzova 1; S. Vokurka 1; V. Koza 1
Působiště autorů: Hematologicko-onkologické oddělení, FN Plzeň 1; Laboratoř molekulární diagnostiky, Praha 2
Vyšlo v časopise: Klin Onkol 2012; 25(3): 212-215
Kategorie: Kazuistiky
Souhrn
Východiska:
Leukemie z dárcovských buněk (DCL) jsou relativně vzácnou, ale již dobře dokumentovanou komplikací transplantace krvetvorných buněk. Publikovány byly většinou situace, kdy DCL vzniká de novo u příjemce krvetvorných buněk.Pozorování:
Popisujeme případ, kdy u dobrovolného nepříbuzného dárce Českého národního registru dárců dřeně (ČNRDD) došlo s několikaletou latencí po darování k rozvoji chronické lymfocytární leukemie (B-CLL). Z archivní DNA izolované krátce před darováním krvetvorných buněk bylo následně retrospektivně zjištěno, že subklinický klon CLL byl přítomný již v době darování, nicméně s ohledem na úmrtí nemocné krátce po transplantaci nemohlo dojít k případnému rozvoji DCL. Případ dobře dokumentuje dlouhou dobu od vzniku klonu B-CLL do plného rozvoje klinicko-laboratorní symptomatologie. Jsou diskutovány medicínské i etické otázky, které přináší izolovaná detekce hematologické malignity, ať již pouze u dárce, či pouze u příjemce.Závěr:
Případ dokumentuje rostoucí riziko rozvoje nejrůznějších forem DCL, a tím dokládá nezbytnost dlouhodobého sledování dárců krvetvorných buněk nejen z hlediska zdraví dárce, ale i z hlediska potenciálního rizika pro příjemce.Klíčová slova:
leukemie z dárcovských buněk – chronická lymfatická leukemie – transplantáty – dárciÚvod
Leukemie z dárcovských buněk (donor cell leukemia – DCL) je sice relativně vzácnou, ale dobře popsanou komplikací transplantace krvetvorných buněk (TKB). Poprvé byla dokumentována již v roce 1971 [1] a do současnosti bylo popsáno více než 50 případů [2–4]. Většina publikovaných případů popisuje vznik DCL de novo u příjemce krvetvorných buněk. Náš případ ale popisuje situaci, kdy u dobrovolného nepříbuzného dárce Českého národního registru dárců dřeně (ČNRDD) došlo s několikaletou latencí po darování k rozvoji chronické lymfocytární leukemie (B-CLL). Z archivní DNA bylo následně retrospektivně zjištěno, že subklinický klon CLL byl přítomný již v době darování, nicméně vzhledem k úmrtí příjemce časně po transplantaci nemohlo dojít k případnému rozvoji DCL. Případ dokumentuje jak dlouhou dobu od vzniku klonu B-CLL do plného klinicko-laboratorního obrazu, tak nezbytnost dlouhodobého sledování dárců krvetvorných buněk nejen z hlediska zdraví dárce, ale i z hlediska potenciálního rizika pro příjemce.
Popis případu
46letý muž, dlouholetý dárce krve, byl v roce 2006 odeslán transfuzním oddělením na Hematologicko-onkologické oddělení FN Plzeň pro opakovaně zachycenou leukocytózu s lymfocytózou (KO: leukocyty 15,1 × 109/L, Hb 135 g/l, trombo 182 × 109/l. Diferenciální obraz: neutrofily 0,21; lymfocyty 0,76; monocyty 0,03; ojediněle Gumprechtovy stíny). Byla stanovena diagnóza B-CLL, st. I dle Raie s pakety uzlin v retroperitoneu a s nemutovanou sekvencí IgVH genů, čili šlo o prognosticky nepříznivou CLL. Od prosince 2006 bylo podáno celkem 5 cyklů chemoimunoterapie v kombinaci R-FC (rituximab, fludarabin, cyklofosfamid), kterou bylo dosaženo kompletní remise trvající až do roku 2010. Již vstupně však bylo anamnesticky zjištěno, že nemocný byl od roku 1992 registrován jako dobrovolný nepříbuzný dárce kostní dřeně v Českém národním registru dárců dřeně (ČNRDD) v Plzni. O onemocnění dárce byl proto obratem informován ČNRDD, protože v září 2000, tedy 6 let před stanovením diagnózy CLL, byla dárci po lékařském vyšetření a stanovení jeho způsobilosti k odběru podle platných právních norem ČR [5] a mezinárodních doporučení [6,7] odebrána kostní dřeň, jež byla transplantována nepříbuznému příjemci, 50leté pacientce s diagnózou B akutní lymfoblastické leukemie. Pacientka však 18 měsíců po transplantaci zemřela v kompletní remisi na potransplantační komplikace, přičemž kontrolní vyšetření kostní dřeně 15 měsíců po transplantaci neprokázalo žádnou signifikantní patologii; archivní DNA z tohoto vzorku nebyla již bohužel k dispozici. Bylo zjištěno, že odběr kostní dřeně proběhl bez komplikací, dárce byl po darování dle tehdejších standardů Registru sledován 1 rok ve svém spádovém dárcovském centru a nebyla zjištěna žádná patologie. Následně jako dárce krve opět pravidelně daroval krev, přičemž ani zde nebyly do roku 2006 detekovány žádné klinické ani laboratorní patologie. Vzhledem k tomu, že u dárce byla k dispozici archivní DNA izolovaná z periferní krve v době odběru kostní dřeně, pokusili jsme se retrospektivně stanovit, nebyl-li klon B-CLL přítomen již v době darování. Analýza byla provedena dle již dříve publikované metodiky [8]. Stručně řečeno, byly navrženy klon-specifické primery amplifikující oblast FWR1 až CDR3 a tato oblast byla molekulárně vyklonována pro přípravu kvantifikačního standardu. Pro RQ-PCR detekci byla použita LNA-modifikovaná sonda pro rodinu VH3. Pomocí RQ-PCR byla na cDNA z období diagnózy a z období dárcovství štěpu amplifikována hledaná klonální sekvence. Jako kontrolní gen byl použit ABL. Pro výpočet relativní exprese IgVH byl použit vztah 2-DDCt. Z doby záchytu onemocnění však byla k dispozici pouze RNA, kterou není možné přímo kvantitativně srovnávat s archivní DNA pacienta (dárce) v době odběru. Proto bylo provedeno jen přímé srovnání archivní DNA dárce s DNA kostní dřeně již po chemoterapii, tedy z doby, kdy byl dle flowcytometrické analýzy přítomen již pouze 10% klon B-CLL. Výsledek (obr. 1) však přesto jasně prokázal, že u pacienta byl v periferní krvi již v době darování, tedy 6 let před klinickým rozvojem, jasně přítomen klon B-CLL.
Obr. 1. Relativní kvantifikace klonu B-CLL u dárce. 1. DNA izolovaná v době darování kostní dřeně – rok 2000, tj. 6 let před klinickou dg. B-CLL 2. DNA z roku 2007, tj. 2 roky po klinické dg. B-CLL se zbytkovou nemocí ve dřeni. Jasně prokázána přítomnost klonu 6 let před klinickým rozvojem B-CLL. 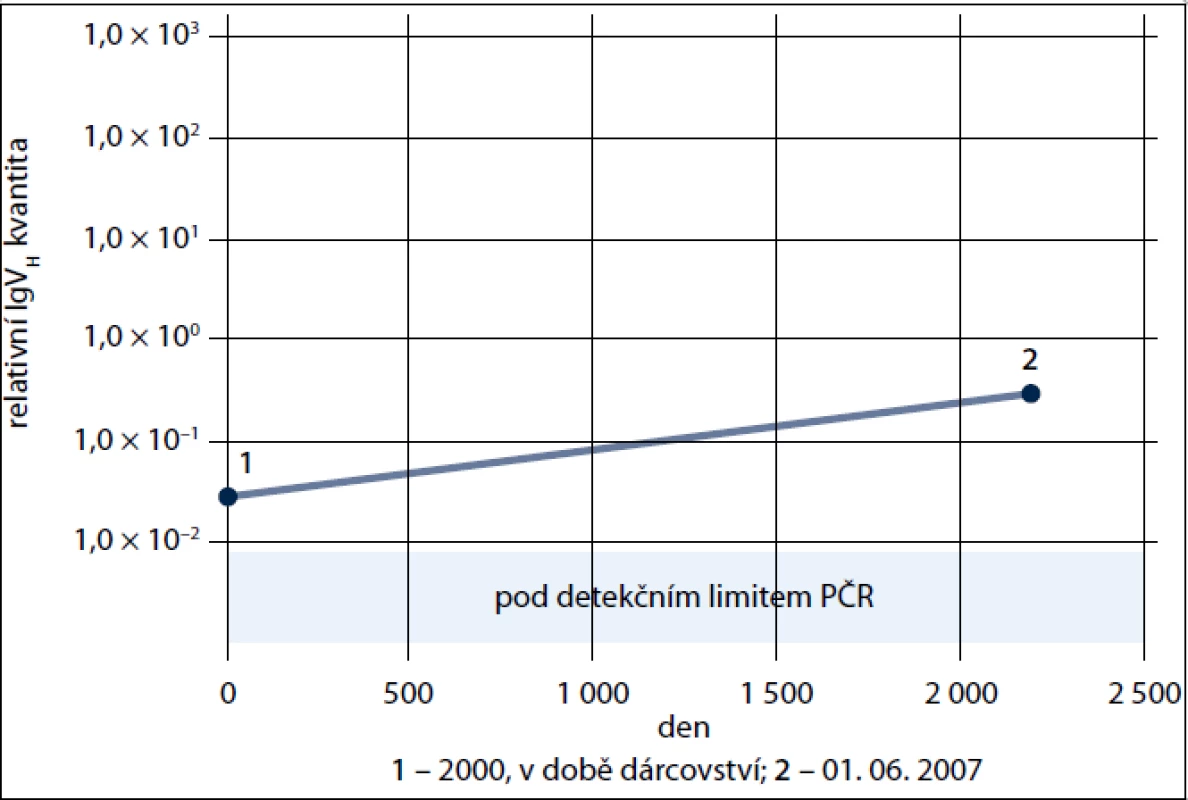
Diskuze
Rozvoj leukemie po TKB obvykle představuje relaps původního onemocnění. Nicméně vzácně se může leukemie rozvinout i de novo z transplantovaných krvetvorných buněk dárce a pak hovoříme o tzv. leukemii z dárcovských buněk (DCL). S rozvojem molekulárních technik umožňujících jednoznačně stanovit původ leukemie bylo v posledních letech publikováno poměrně velké množství případů DCL a některé práce uvádějí až 5% incidenci [9]. V poslední době tato problematika vzbuzuje ještě větší pozornost, a to ze dvou důvodů. Jednak se alogenní TKB staly standardní procedurou i u pacientů starších 50 let, přičemž v případě příbuzenských transplantací jsou pak logicky starší i dárci (sourozenci). Jelikož incidence většiny hematologických malignit roste s věkem, tak by přirozeně mělo stoupat i riziko rozvoje DCL, ať již kvůli věku příbuzného dárce, či vlivem věku příjemce. Je-li podpůrným faktorem přirozeně snížená protinádorová imunita u starších příjemců a/nebo dárců, je však v tuto chvíli pouhou hypotézou a neexistují žádná publikovaná data podporující tuto teorii. Druhým faktorem je častější používání růstových faktorů granulopoézy (filgrastim, G-CSF) jako mobilizačního prostředku před odběry periferních krvetvorných buněk. V souvislosti s jeho podáváním se spekuluje o zvýšeném riziku rozvoje hematologických malignit [10,11]. Nicméně v rozsáhlých analýzách evropských či amerických registrů nebyla u dárců vystavených G-CSF potvrzena vyšší incidence hematologických malignit ve srovnání s běžnou populací [12,13]. V současnosti tedy nejsou žádné jednoznačné důkazy o možném zvýšeném výskytu malignit u dárců vystavených G-CSF, a tudíž ani neexistují data o případné vyšší incidenci DCL jako důsledku transplantace krvetvorných buněk dárce vystavených G-CSF. V našem případě však dárce daroval kostní dřeň, a nebyl tedy vystaven účinku G-CSF.
DCL je v zásadě možno rozdělit na 2 hlavní skupiny:
- případy, kdy je malignita aktivně přímo transplantována od dárce;
- případy, kdy se malignita rozvine až po transplantaci, a to pouze u příjemce [14].
V první skupině je maligní klon u dárce přítomen již v době darování, DCL u příjemce vzniká relativně krátce po transplantaci a tatáž malignita se dříve či později rozvíjí i u dárce. Typicky se jedná o indolentní lymfoidní malignity [14], což je pochopitelné, neboť ty mají obvykle delší dobu od detekce klonu k plnému klinicko-laboratornímu obrazu, a tudíž nejsou během předtransplantačního vyšetření dárce zjištěny. Ve druhé skupině k rozvoji malignity u dárce z nejrůznějších důvodů obvykle nikdy nedojde a ani maligní klon není zpravidla detekován, neboť v etiopatogenezi malignity hraje klíčovou roli alterované mikroprostředí kostní dřeně imunosuprimovaného příjemce. U těchto případů je typická delší doba od transplantace k detekci DCL, přičemž je zajímavé, že tento typ DCL představují takřka výhradně myeloidní hematologické malignity (AML, CML, MDS) a je spíše asociovaný s mladšími dárci [3,14].
U našeho případu nedošlo pro relativně časné úmrtí příjemce na potransplantační komplikace k rozvoji B-CLL u příjemce, nicméně, jak dokládá přítomnost klonu v době darování (obr. 1), v případě jejího vzniku by se jednalo jednoznačně o přímý přenos malignity. Případné srovnání jednotlivých dynamik rozvoje B-CLL u příjemce a dárce by bylo nesporně zajímavé a mohlo by přispět k poznání mechanizmu transformace (pre)maligních buněk dárce v rozdílném imunitním a genetickém prostředí příjemce [3].
Sala-Torra et al v souboru 12 případů DCL [14] popisují celkem 3 případy dokumentovaného přenosu CLL nepříbuzným dárcem. V jednom případě byla u dárce klinicky diagnostikována CLL již 2 roky po TKB, a přestože molekulární přítomnost CLL byla u příjemce zjištěna krátce po TKB, ke klinickému rozvoji došlo až po 12 letech. Naopak u druhého pacienta byla situace opačná – CLL se dříve rozvinula u příjemce. U posledního pacienta byl pouze detekován klon a další sledování nebylo pro časné úmrtí možné. Dva publikované případy přenosu CLL u sourozeneckých TKB nepodporují hypotézu vlivu rozdílného genetického prostředí a imunitního systému, neboť klinický průběh byl vždy podobný u příjemce i dárce, v jednom případě indolentní [15] a podruhé agresivní [16].
Detekce malignity u dárce či malignity z dárcovských buněk u příjemce přináší některé další závažné etické problémy týkající se nejen dárce, ale i příjemce. Primárně je na místě otázka, jak hluboce vyšetřovat dárce před vlastním darováním krvetvorných buněk. U příbuzných dárců pro pacienty s CLL či s rodinnou anamnézou CLL je doporučován systematický screening neinvazivními citlivými metodami, jako je např. flowcytometrie lymfocytů periferní krve [16]. V případě zdravých nepříbuzných dárců však tento postup nelze univerzálně aplikovat a měl by být aplikován individuálně pouze u starších dárců s průkaznou rodinnou zátěží CLL. Ještě složitější je otázka informování a dalšího sledování dárce v případě, že se u příjemce jeho buněk rozvinula DCL. Z dosavadních dat je zřejmé, že ne u všech dárců vznikne stejná DCL jako u jejich příjemce [2,14], zvláště je-li dárcovskou leukemií u příjemce myeloidní malignita. I s ohledem na relativní vzácnost případů je logické, že univerzálně platná doporučení neexistují, obecně je na místě vždy přísně individuální přístup k informování dárce a pečlivé sledování s příslušnými fyzikálními i laboratorními vyšetřeními. Analogický postup by měl být zvolen i v případě příjemce, u jehož dárce je následně diagnostikována hematologická malignita.
Lze shrnout, že náš případ v souladu s literárními daty dokládá rostoucí frekvenci detekce nejrůznějších forem DCL. To jen podtrhuje nezbytnost dlouhodobého (několikaletého) prospektivního a jasně definovaného aktivního sledování dárců krvetvorných buněk, tak jak je vyžadováno českou legislativou [5] i doporučeními mezinárodních autorit [6,7]. V souvislosti s tím je potěšující, že od roku 2005 je politika sledování nepříbuzných dárců ČNRDD a příbuzných dárců prostřednictvím HOO FN Plzeň v plném souladu s těmito požadavky [17,18].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Pavel Jindra
Hematologicko-onkologické oddělení FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: jindra@fnplzen.cz
Obdrženo: 13. 9. 2011
Přijato: 7. 11. 2011
Zdroje
1. Fialkow PJ, Thomas ED, Bryant JI et al. Leukaemic transformation of engrafted human marrow cells in vivo. Lancet 1971; 1(7693): 251–255.
2. Hertenstein B, Hambach L, Bacigalupo A et al. Development of leukemia in donor cells after allogeneic stem cell transplantation – a survey of the European Group for Blood and Marrow Transplantation (EBMT). Haematologica 2005; 90(7): 969–975.
3. Flynn CM, Kaufman DS. Donor cell leukemia: insight into cancer stem cells and the stem cell niche. Blood 2007; 109(7): 2688–2692.
4. Igarashi N, Chou T, Hirose T et al. Donor cell-derived acute lymphocytic leukemia after allogeneic stem cell transplantation for multiple myeloma. Int J Hematol 2009; 90(3): 378–382.
5. Nařízení vlády, kterým se provádí zákon č. 285/2002 Sb., o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (transplantační zákon), č. 436/2002 Sb. a Vyhláška Ministerstva zdravotnictví, kterou se stanoví bližší podmínky posuzování zdravotní způsobilosti a rozsah vyšetření žijícího nebo zemřelého dárce tkání nebo orgánů pro účely transplantací (vyhláška o zdravotní způsobilosti dárce tkání a orgánů pro účely transplantací), č. 437/2002 Sb.
6. Worldmarrow.org [online], The World Marrow Donor Association (WMDA). Last update: 2011 June 06, cited 2011 June 23. Available from: http://www.worldmarrow.org/.
7. Jacie.org [online], The Joint Accreditation Committee--ISCT (Europe) & EBMT (JACIE-EBMT). Last update: 2011 June 22, cited 2011 June 25. Available from: http://www.jacie.org/.
8. Peková S, Bezdíčková L, Smolej L et al. Quantitation of minimal residual disease in patients with chronic lymphocytic leukemia using locked nucleic acid-modified, fluorescently labeled hybridization probes and real-time PCR technology. Mol Diagn Ther 2007; 11(5): 325–335.
9. Boyd CN, Ramberg RC, Thomas ED. The incidence of recurrence of leukemia in donor cells after allogeneic bone marrow transplantation. Leuk Res 1982; 6(6): 833–837.
10. Nagler A, Korenstein-Ilan A, Amiel A et al. Granulocyte colony-stimulating factor generates epigenetic and genetic alterations in lymphocytes of normal volunteer donors of stem cells. Exp Hematol 2004; 32(1): 122–130.
11. Bennett CL, Evens AM, Andritsos LA et al. Haematological malignancies developing in previously healthy individuals who received haematopoietic growth factors: report from the Research on Adverse Drug Events and Reports (RADAR) project. Br J Haematol 2006; 135(5): 642–650.
12. Halter J, Kodera Y, Ispizua AU et al. Severe events in donors after allogeneic hematopoietic stem cell donation. Haematologica 2009; 94(1): 94–101.
13. Confer DL, Miller JP. Long-term safety of filgrastim (rhG-CSF) administration. Br J Haematol 2007; 137(1): 77–78.
14. Sala-Torra O, Hanna C, Loken MR et al. Evidence of donor-derived hematologic malignancies after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2006; 12(5): 511–517.
15. Perz JB, Ritgen M, Moos M et al. Occurence of donor--derived CLL 8 years after sibling donor SCT for CML. Bone Marrow Transplant 2008; 42(10): 687–688.
16. Flandrin-Gresta P, Callanan M, Nadal N et al. Transmission of leukemic donor cells by allogeneic stem cell transplantation in a context of familial CLL: should we screen donors for MBL? Blood 2010; 116(23): 5077–5078.
17. Kostnidren.cz [online], Český Národní Registr Dárců Dřeně (ČNRDD). Last update: 2011 August 31, cited 2011 September 3. Dostupné z: http://www.kostnidren.cz/registr.
18. Vokurka S, Koza V, Jungová A et al. Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně. Klin Onkol 2012; 25(1): 42–46.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Výhody jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Reprodukční funkce u onkologických pacientek
- Pozitronová emisní tomografie a klinické prediktory přežití u primárních extragonadálních germinálních nádorů
- Genetické pozadí ototoxicity cisplatiny
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
- Informace z České onkologické společnosti
- Klinický registr BREAST
- Prof. MUDr. Luboš Petruželka, CSc., se dožívá jubilea
-
Onkologie v obrazech
Miliární plicní rozsev
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Prof. MUDr. Luboš Petruželka, CSc., se dožívá jubilea
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



