-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
Triple-Negative Breast Cancer: Analysis of Patients Diagnosed and/or Treated at the Masaryk Memorial Cancer Institute between 2004 and 2009
Background:
Triple-negative breast cancer (TNBC) represents a heterogeneous group of breast cancers that do not express ER-α, PgR and Her-2 receptors. Generally, these tumors are aggressive and more common in younger women, in which an association of TNBC with mutations in the BRCA1 gene was documented. The aim of our study was to create a representative group of patients with TNBC, which could be analyzed and the data gathered to build basic epidemiological, molecular and clinical characteristics of Czech patients with TNBC.Patients and Methods:
We performed basic clinical-pathologic correlations in a group of 335 patients diagnosed and/or treated for TNBC at the Masaryk Memorial Cancer Institute between 2004 and 2009. We also performed immunohistochemical examination of expression of cytokeratin 5/6, cytokeratin 14 and EGFR to identify the ‘basal-like’ subset of TNBC.Results:
The median age of patients with TNBC was 56 years, range 25–88 years. A total of 9.25% of TNBC cases were diagnosed in patients under the age of 34, and another 15.22% of cases were in the age group of 35 to 44 years. ‘Basal-like’ carcinomas accounted for 75% of TNBC. We confirmed the aggressive nature of this disease: in the follow-up period we observed a relapse in 25% of patients: 55% of deaths due to disease progression occured within 2 years after diagnosis of the disease. Treatment strategies include chemotherapy, in most cases (88.4%). Chemotherapy was mostly based on regimens with anthracyclines or in combination with taxanes. The most important negative prognostic factors in relation to OS (disease specific OS) were: higher clinical stage (p < 0.0001), pN – positive status (p < 0.0001), high proliferative activity (as measured by Ki-67, cut-off 50%, HR = 0.4740, p = 0.0411) and positive expression of CK5/6 (HR = 0.4274, p = 0.0338). In relation to DFS, the negative prognostic significance was found for these factors: higher clinical stage (p < 0.0001), pN positive status (p < 0.0001), high proliferative activity (Ki-67, cut-off 50%, HR = 0.04993, p = 0.0240). DFS was longer in patients with a higher number of applied cycles of anthracycline-based chemotherapy (> 4 cycles, HR = 1.7273, p = 0.0467).Conclusion:
TNBC is an aggressive form of breast cancer, which may occur in patients of all ages, but more frequently in younger patients. Only early detection of disease and intensive treatment gives a high chance of cure. Unfortunately, no reliable predictive factors have been identified so far. Better therapeutic results can be expected from targeted therapy.Key words:
triple-negative breast cancer – cytokeratin 5/6 – Ki-67 protein – chemotherapy – breast cancerThis study was supported by the following research programmes:
NO. NS/10357-3 of the Internal Grant Agency, Ministry of Health of the Czech Republic; No. CZ.1.07/2.4.00/17.0100. – A-MATH-NET, Ministry of Education, Youth and Sports of the Czech Republic.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
26. 2. 2012Accepted:
21. 5. 2012
Autoři: M. Svoboda 1,2
; J. Navrátil 1; P. Fabian 3; M. Palacova 1; J. Gombošová 4; L. Slámová 1; D. Princ 4; B. Syptáková 4; A. Kudláček 4; O. Bílek 1; P. Pospíšil 4
; T. Kazda 4; P. Grell 1; A. Poprach 1; I. Selingerová 5; R. Nenutil 3; J. Juráček 1; R. Héžová 1; O. Slabý 1; R. Vyzula 1
Působiště autorů: Klinika komplexní onkologické péče, MOÚ Brno 1; Oddělení epidemiologie a genetiky nádorů, MOÚ Brno 2; Oddělení onkologické a experimentální patologie, MOÚ Brno 3; Klinika radiační onkologie, MOÚ Brno 4; Ústav matematiky a statistiky, PřF MU Brno 5
Vyšlo v časopise: Klin Onkol 2012; 25(3): 188-198
Kategorie: Původní práce
Souhrn
Východiska:
Triple-negativní karcinom prsu představuje heterogenní skupinu karcinomů prsu, které neexprimují estrogenový receptor-α, progesteronový receptor a receptor Her-2. Obecně se jedná o nádory s agresivním chováním, které se častěji vyskytují u mladších žen a u kterých je zdokumentována spojitost s mutací v genu BRCA1. Cílem naší práce bylo vytvořit dostatečně reprezentativní soubor pacientek s TNBC, který by bylo možné analyzovat, a na základě získaných údajů sestavit základní epidemiologickou, molekulární a klinickou charakteristiku populace českých pacientek s TNBC.Soubor pacientů a metody:
Na souboru 335 pacientek diagnostikovaných a/nebo léčených v MOÚ v letech 2004–2009 s triple-negativním karcinomem prsu jsme provedli základní klinicko- patologické korelace. Imunohistochemickým vyšetřením exprese cytokeratinu 5/6, cytokeratinu 14 a EGFR jsme identifikovali basal-like podskupinu triple-negativního karcinomu.Výsledky:
Medián věku pacientek s triple-negativním karcinomem prsu v našem souboru byl 56 let, rozpětí 25–88 let. Ve věkové skupině do 34 let bylo diagnostikováno 9,25 % případů a ve skupině 35–44 let 15,22 % případů. Basal-like karcinomy představovaly 75 % všech triple-negativních karcinomů. Potvrdili jsme agresivní charakter tohoto onemocnění, ve sledovaném období jsme zaznamenali relaps u 25 % pacientek, do dvou let od diagnózy onemocnění nastalo 55 % z úmrtí v důsledku progrese choroby. Strategie léčby v naprosté většině případů (88,4 %) zahrnovala chemoterapii. Nejčastěji se jednalo o režimy založené na antracyklinech, případně v kombinaci s taxany. Mezi nejvýznamnější negativní prognostické faktory ve vztahu k OS patřily: vyšší klinické stadium (p < 0,0001), pozitivní pN status (p < 0,0001), vysoká proliferační aktivita dle Ki-67 (cut-off 50 %, HR = 0,4740; p = 0,0411), pozitivní exprese CK5/6 (HR = 0,4274; p = 0,0338). Ve vztahu k DFS měly negativní prognostický význam faktory: vyšší klinické stadium (p < 0,0001), pozitivní pN status (p < 0,0001), vysoká proliferační aktivita dle Ki-67 (cut-off 50 %, HR = 0,04993; p = 0,0240). Delší DFS dosahovaly pacientky s počet aplikovaných cyklů chemoterapie na bázi antracyklinů > 4 (HR = 1,7273; p = 0,0467).Závěr:
Triple-negativní karcinom představuje agresivní formu karcinomu prsu, která se může vyskytovat u pacientek v každém věku, častěji však tomu bývá u mladších pacientek. Pouze časný záchyt onemocnění a intenzivní léčba dává vysokou šanci na vyléčení. Bohužel, dosud nebyly identifikovány spolehlivé prediktivní faktory. Lepších léčebných výsledků lze očekávat od cílené terapie.Klíčová slova:
triple-negativní karcinom prsu – cytokeratin 5/6 – Ki-67 protein – chemoterapie – karcinom prsuÚvod
Zhoubné novotvary (ZN) prsu představují po ZN kůže druhou nejčastější malignitu u žen ve vyspělých zemích světa. Za předchozích 25 let vzrostl počet nově hlášených ZN prsu v ČR dvojnásobně. V roce 2008 dosáhl absolutní počet nových případů čísla 6 416 nemocných a v důsledku uvedené nemoci zemřelo 1 942 pacientek. Incidence tak v uvedeném roce činila 120/100 000 žen a mortalita 36/100 000 žen. I přes narůstající incidenci ZN prsu lze od poloviny 90. let 20. století sledovat pokles jeho mortality [1]. Na tomto jevu se obecně podílí včasný záchyt onemocnění při existenci screeningového programu pro karcinom prsu a vyšší všeobecná informovanost veřejnosti o uvedené problematice, na straně druhé i změna léčebných algoritmů nebo možnost využití efektivnější cílené léčby, která je u přesně definovaných podtypů ZN prsu indikována.
ZN prsu, přestože se v naprosté většině případů jedná o karcinomy, tvoří heterogenní skupinu jednotlivých podtypů charakterizovaných molekulárně, histologicky a svým biologickým chováním [2,3]. Z tohoto pohledu jsou ZN prsu zároveň i modelovým příkladem, neboť molekulární klasifikace se zde významným způsobem odráží v klinické praxi a následně i ve vývoji epidemiologické situace [3]. Ukazují to například data z amerického epidemiologického programu SEER (Surveillance, Epidemiology and End Results), pokles mortality na ZN prsu je markantnější u skupiny karcinomů exprimujících estrogenové a/nebo progesteronové receptory, což souvisí s existencí a dlouhodobým užíváním cílené léčby u tohoto molekulárního podtypu karcinomu prsu [4]. Podobnou situaci sledujeme v současnosti také u Her-2 pozitivních tumorů, u kterých došlo od zavedení cílené léčby k významnému zlepšení prognózy [5,6].
Přestože povědomí o existenci některých molekulárních podtypů karcinomu prsu lze datovat do dřívějších let, teprve analýzy nádorového genomu karcinomů prsu pomocí DNA čipů umožnily globální pohled na jeho molekulární strukturu. V roce 2000 tak vznikla molekulární klasifikace karcinomu prsu, která se postupně dále vyvíjela a v současnosti definuje sedm molekulárních podtypů [3,7–9]. Z pohledu klinicky používané histologické klasifikace karcinomů prsu, která „technicky“ nemůže plně korespondovat s molekulární klasifikací postavenou na základě exprese stovek genů, existuje v současnosti rozdělení karcinomů na pět základních podtypů:
- „luminální A“,
- „luminální B/Her-2 negativní“,
- „luminální B/Her-2 pozitivní“,
- Her-2 pozitivní klasický (neexprimující ER-α a PgR) a
- triple-negativní karcinom prsu (TNBC) (karcinomy neexprimující receptory: ER-α, PgR a Her-2) [10].
Právě omezené možnosti histologické klasifikace jsou v případě TNBC příčinou, že takto definovaná skupina stále obsahuje biologicky značně heterogenní nádory, což se projevuje i ve výsledcích léčby.
Přibližně 70–90 % triple-negativních karcinomů představují basal-like karcinomy (BL-TNBC) [11,12]. Zbývající část nemá prokázanou expresi cytokeratinů bazálního typu a/nebo EGFR a po molekulární stránce mezi ně patří: „claudin-low“ karcinomy, „normal breast-like“ karcinomy, „molekulárně apokrinní“ karcinomy a karcinomy prsu, které neexprimují žádný klasifikující marker (např. ER-α, PR, Her-2, cytokeratiny bazálního typu, EGFR, c-Kit a další) [9,11,12]. Na úrovni profilu genové exprese a v histologickém obraze sdílí TNBC a BL-TNBC významnou podobnost s karcinomy nesoucími mutaci supresorového BRCA1 genu [13–15].
V prevalenci TNBC jsou patrné rasové a věkové rozdíly. V populaci evropských žen kolísá prevalence mezi 10 a 25 % [11,12,16]. Prevalence TNBC v populaci pacientek diagnostikovaných v roce 2007 v MOÚ byla 15,2 % (dosud nepublikovaná data autorů). Triple-negativní karcinomy jsou biologicky velmi agresivní, ve srovnání s ostatními podtypy karcinomů prsu postihují ve větší míře mladší ženy (< 50 let), častěji jsou diagnostikovány v pokročilém stadiu onemocnění (mají vysoký proliferační potenciál, více než 2/3 tumorů mají histologický grade III, více než 2/3 tumorů přesahují 2 cm, více než 1/2 tumorů metastazuje do uzlin), častěji relabují a mají kratší celkové přežití (OS). Práce Denta et al udává medián OS u tohoto podtypu 4,2 let, přičemž 70 % úmrtí pacientek nastalo do pěti let od stanovení diagnózy [11,17]. Naše práce prokázala, že TNBC a BL-TNBC často metastazují do CNS. Ve srovnání s ostatními fenotypy karcinomu prsu mají TNBC a BL-TNBC nejkratší čas od relapsu choroby do průkazu metastatického postižení CNS [18]. Na straně druhé jsou TNBC častěji považovány za primárně chemosenzitivní, což bylo opakovaně doloženo nejvyšším výskytem odpovědí na léčbu („response rate“ dosahuje až 86 %) a patologických kompletních remisí (pCR) (až 62 % v závislosti na cytostaticích) po neoadjuvantní chemoterapii mezi jednotlivými podtypy karcinomů prsu [19–22].
Vysoká agresivita TNBC, absence silných prognostických faktorů, prediktorů k cytostatické léčbě a neexistence podobně efektivní cílené terapie, jako je u luminálních a Her-2 pozitivních karcinomů, vede k tomu, že se v současnosti jedná o podtyp karcinomu prsu s nejhorší prognózou.
Cílem naší práce bylo vytvořit dostatečně reprezentativní soubor pacientek s TNBC, který by bylo možné analyzovat a na základě získaných údajů sestavit základní epidemiologickou, molekulární a klinickou charakteristiku populace českých pacientek s TNBC.
Soubor pacientů a metody
Soubor pacientek
Vycházeli jsme ze souboru 335 pacientek diagnostikovaných a/nebo léčených v MOÚ v letech 2004–2009 s triple-negativním karcinomem prsu. Z údajů ze zdravotnické dokumentace pacientek, které byly standardně pořizovány v průběhu diagnostiky, léčby a následného sledování pacientek, jsme shromažďovali a v anonymizované podobě evidovali údaje: datum narození, pohlaví, datum stanoveni histologie, věk pacienta v době zjištění nemoci a v době zjištění prvního nádorového onemocnění, počet a typ nádorových onemocnění, kterými pacient onemocněl, klinické stadium, vstupní hodnoty nádorových markerů, hodnocení stavu fyzické výkonnosti pacienta (performance status) na základě kritérií ECOG, typ chirurgického výkonu, datum zahájení a ukončení léčby, chemoterapeutický režim, počet podaných cyklů režimu, údaj o aplikaci radioterapie, datum hodnocení efektu a efekt primární terapie, datum relapsu choroby, místo relapsu, údaje o další léčebné strategii, datum poslední kontroly, stav pacienta a jeho choroby při poslední kontrole a v případě úmrtí i příčina smrti. Z původního výsledku histologického vyšetření primárního tumoru byla čerpána data o pTNM, histologickém typu nádoru a jeho gradingu, hodnotě exprese estrogenových (ER-α), progesteronových (PgR) a Her-2 receptorů a výsledek vyšetření FISH Her-2/neu genu.
Imunohistochemická vyšetření
Nádorová tkáň archivovaná po formalinové fixaci v parafinovém bloku pocházela výhradně z diagnostické biopsie nebo z resekátu tumoru odebraném při mastektomii. Parafinové bloky byly následně zpracovány do podoby složených tkáňových bloků (tissue arrays) pomocí manuálního přístroje TA-1 (A. Fintajsl, Brno, ČR). V každém případě byly z každého původního tkáňového bloku vykrojeny dva vzorky o průměru 1,6 mm a maximální délce 3 mm. Tyto válečky byly přeneseny do předem připraveného místa shodných rozměrů v novém parafinovém bloku. Do každého nového parafinového bloku bylo možné postupně takto přenést 23 případů. Za účelem standardního imunohistochemického vyšetření (IHC) byly z tkáňových bloků nebo ze složených tkáňových bloků mikrotomem krájeny řezy o tloušťce 3–4 µm, které byly nejprve deparafinizovány v xylenu a následně hydratovány v řadě roztoků o stupňovitě klesající koncentraci etanolu. K demaskování epitopů bylo nejčastěji použito mikrovlnného zahříváni a inkubace tkáně v citrátovém pufru pH 6,0. Protilátky byly ředěny dle doporučení výrobce v roztoku Antibody Diluent (DAKO, Dánsko). Vizualizace IHC reakce byla provedena pomocí kitu EnVision+ HRP/DAB (DAKO, Dánsko). K detekci proteinů byly použity následující protilátky (v pořadí: antigen, klon, výrobce, ředění): ER-α (obr. 1), SP1, Lab Vision, 1 : 4 000; PgR, SP2, Lab Vision, 1 : 2 000; ER-β1 (estrogenový receptor-β1, obr. 1), PPG5/10, DAKO, 1 : 50; Her-2 (obr. 2), HercepTest, DAKO, 1 : 200; EGFR (receptor pro epidermální růstový faktor), 31G7, Invitrogen, 1 : 100; CK5/6 (cytokeratin 5 a 6), D5/16B4, DAKO, 1 : 400; CK14 (cytokeratin 14, obr. 3), LL02, Novocastra, 1 : 40. Výsledky IHC vyšetření byly v případě hodnocení exprese detekovaných proteinů zapsány v podobě procenta vyjadřujícího počty pozitivních buněk a pokud není dále uvedeno jinak, pak za pozitivní expresi proteinu karcinomem byla považována hranice nad 1 % pozitivních buněk. Hodnocení exprese Her-2 receptoru probíhalo v souladu s manuálem DAKO a doporučením společností ASCO a CAP (American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer). Za Her-2 negativní karcinomy byly považovány ty, které neexprimovaly Her-2 protein (IHC skóre 0/1+) nebo měly prokázaný neamplifikovaný stav genu Her-2 (viz níže). Karcinomy s pozitivní expresí Her-2 receptoru hodnocenou stupněm 2+ a 3+ byly podrobeny vyšetření amplifikace Her-2/neu genu metodou FISH. Při hodnocení exprese EGFR bylo postupováno podobně jako u proteinu Her-2 (IHC skóre 0, 1+, 2+, 3+). Za pozitivní byly označeny karcinomy s expresí EGFR odpovídající stupni 3+ při IHC vyšetření. Triple-negativní karcinomy byly definovány na základě nepřítomnosti exprese všech tří základních sledovaných molekulárních znaků (ER-α, PgR, Her-2). Do souboru bylo možné zařadit i ty karcinomy, u kterých byla zjištěna klonální přítomnost ER-α a/nebo PgR pozitivních buněk, a to maximálně do počtu 10 %. Tato diskriminační hladina pozitivity pro ER-α a/nebo PgR byla dříve všeobecně akceptována. V našem souboru bylo pouze šest karcinomů (1,8 %) s expresí ER-α a/nebo PgR v rozmezí 2–10 %.
Obr. 1. Imunohistochemické vyšetření sledovaných znaků v nádorové tkáni karcinomů prsu. 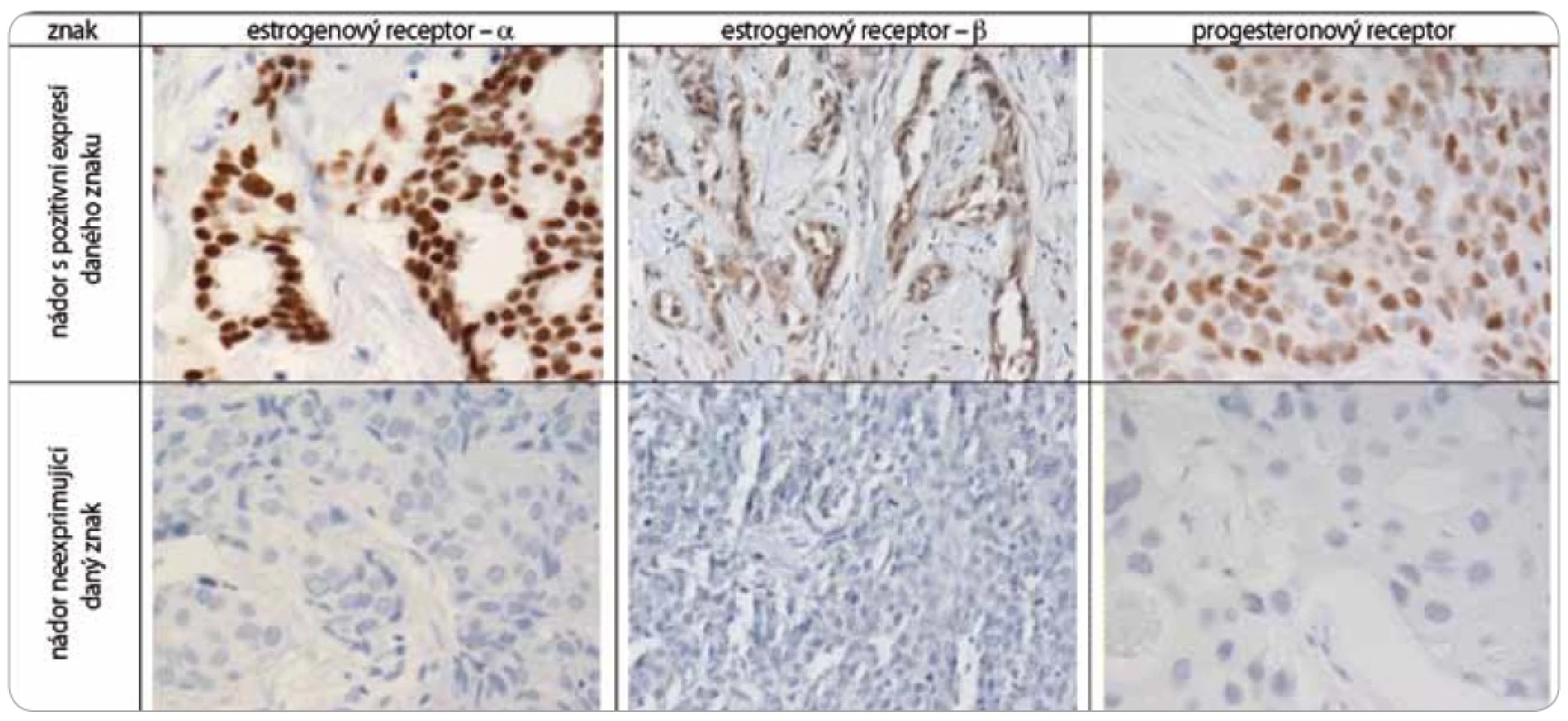
Obr. 2. Imunohistochemické vyšetření sledovaných znaků v nádorové tkáni karcinomů prsu. 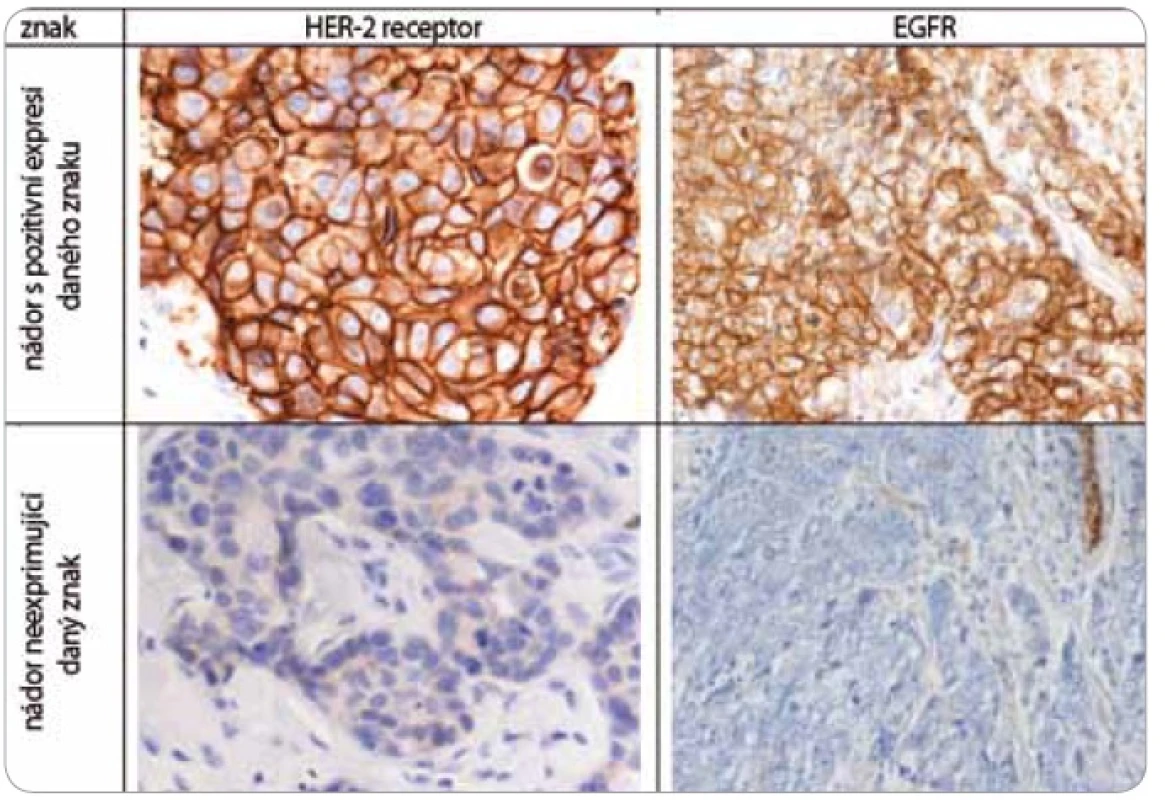
Obr. 3. Imunohistochemické vyšetření sledovaných znaků v nádorové tkáni karcinomů prsu. 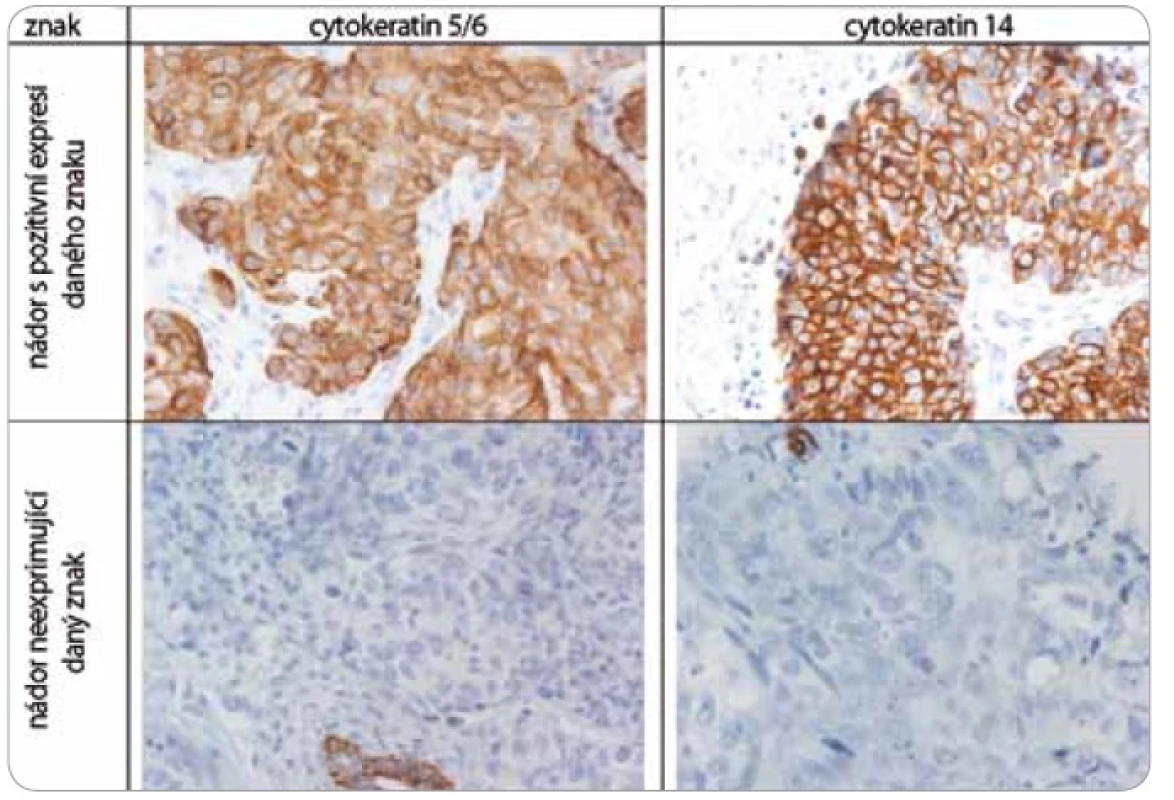
Vyšetření metodou FISH
Amplifikace genu Her-2/neu byla vyšetřována pomocí metody FISH (fluorescenční in situ hybridizace). Použita byla lokusově specifická sonda Her-2/neu (Kreatech, Holandsko) a SE (satelite enumeration) kontrolní sonda pro chromozom 17 (Kreatech, Holandsko). Jednoznačně pozitivní výsledek amplifikace HER-2/genu byl konstatován v případě, že poměr počtu signálů sondy Her-2/neu a počtu signálů sondy pro chromozom 17 byl 2,2 a vyšší nebo bylo detekováno alespoň šest kopií Her-2/neu genu. Za hraničně pozitivní byly označeny výsledky s poměrem signálů sondy pro Her-2/neu a sondy chromozomu 17 v rozmezí 1,8–2,19 nebo detekce 4–5,9 kopií Her-2/neu genu. Nádory s poměrem signálů < 1,8 nebo počtem kopií < 4 byly označeny za Her-2 negativní.
Statistické hodnocení
Na základě diskriminačních hodnot byly výsledky laboratorních vyšetření, případně i některá klinická pozorování, převedeny do podoby kategoriálních dat a ve vztahu ke sledovaným parametrům byly zpracovány pomocí kontingenčních tabulek. Potom jsme testovali nezávislosti sledovaných kategorizovaných proměnných. K testům jsme použili Pearsonův chí-kvadrát test nezávislosti a Fischerův exaktní test. V analýzách přežití se při porovnání přežívání jednotlivých skupin pacientů využil log-rank test. Křivky přežití byly vytvořeny pomocí Kaplanovy-Meierovy metody. Za statisticky signifikantní byly považovány hodnoty p ≤ 0,05. Ke všem statistickým analýzám byl použit počítačový program MedCalc Version 11.4.2.0 (MedCalc Software, Belgie).
Sledované klinické parametry ve vztahu k analýzám přežití
Celkové přežití ve vztahu k základní chorobě – OS(ds) (overall survival – disease specific): časový interval mezi datem stanovení diagnózy pacienta a datem jeho úmrtí z důvodů progrese choroby. Žijící pacienti a pacienti, kteří zemřeli z jiné příčiny, jsou cenzorováni k datu poslední kontroly. Přežití bez známky choroby – DFS (disease free survival): časový interval od stanovení diagnózy do doby zdokumentovaného relapsu onemocněni nebo úmrtí z důvodů progrese choroby (pokud nebyl zdokumentován relaps). Žijící pacienti jsou cenzorováni k datu poslední kontroly. Hodnocení léčebné odpovědi bylo prováděno na základě RECIST kritérií, verze 1.1.
Výsledky
Základní epidemiologická charakteristika
Sestavili jsme soubor o celkovém počtu 335 pacientek s triple-negativním karcinomem prsu, které byly diagnostikovány a/nebo léčeny v MOÚ v letech 2004–2009 (tab. 1). Medián věku žen v době, kdy ve sledovaném období měly diagnostikovaný karcinom prsu, byl 56 let, přičemž nejmladší pacientce bylo 25 a nejstarší 88 let. Vícečetný výskyt malignit byl evidován u 72 žen (21,5 %), z toho naprostou většinu tvořil duplicitní karcinom prsu (47 pacientek). Medián věku žen, kdy měly karcinom prsu diagnostikovaný poprvé, byl 55 let, při stejném věkovém rozpětí. Na základě klinického hodnocení byla téměř polovina (48,1 %) pacientek diagnostikována s onemocněním postihujícím regionální lymfatické uzliny (cN+), u téměř 2/3 pacientek bylo onemocnění zjištěno ve II. nebo III. klinickém stadiu (69,9 %). Na druhou stranu pouze necelá tři procenta (2,9 %) pacientek měla v době diagnózy zjištěny vzdálené metastázy. Vyšší výskyt hodnocení primárních tumorů stupněm pT1 a regionálních uzlin stupněm pN0 ve srovnání s cTNM klasifikací je způsoben především aplikací neoadjuvantní protinádorové léčby. V souboru významně převažoval invazivní duktální karcinom (77 %), v menší míře se vyskytovaly karcinomy: medulární (10,2 %), nediferencovaný (3,6 %), metaplastický (3,6 %), invazivní lobulární (1,8 %), apokrinní (0,5 %) a další jednotlivé typy (3,3 %). Žádný z karcinomů nevykazoval vysoký stupeň diferenciace (G1), naopak naprostá většina z nich (90,4 %) byla špatně diferencovaných (G3).
Tab. 1. Epidemiologická, klinická, histologická a molekulární charakteristika souboru. 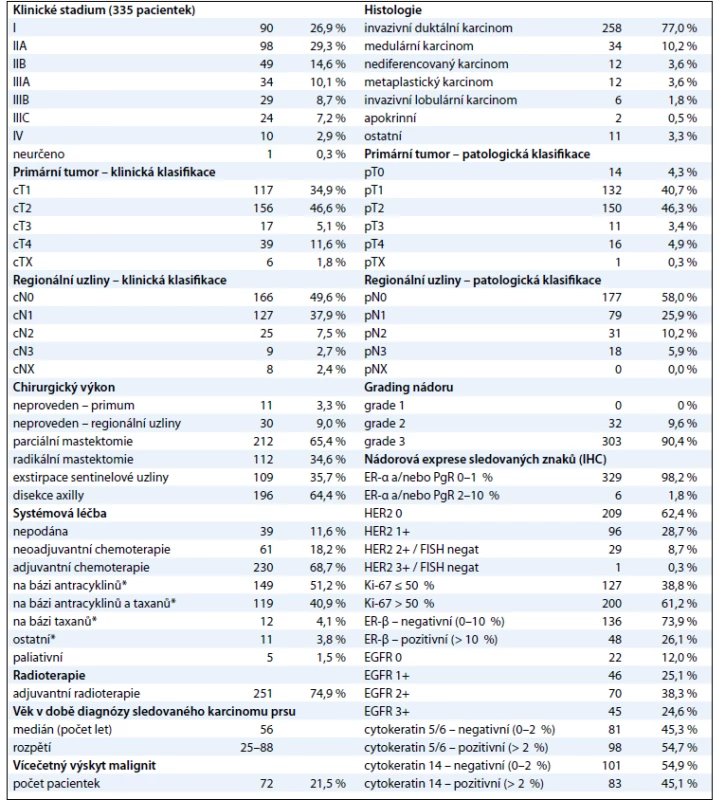
*režimy aplikované v rámci adjuvantní nebo neoadjuvantní chemoterapie. Strategie léčby
Kromě 11 pacientek (3,3 %) podstoupily všechny operační výkon, kterým byla nejčastěji parciální mastektomie (63,3 %). Radikální mastektomii mělo provedeno 33,4 % pacientek. Nejčastější příčinou, která vedla k ponechání primárního tumoru, bylo onemocnění diagnostikované ve IV. klinickém stadiu (osm případů), přičemž se nejednalo o všechny pacientky s metastatickým onemocněním, neboť dvě z deseti podstoupily radikální mastektomii. U zbývajících třech pacientek došlo ve dvou případech k progresi onemocnění v CNS v průběhu neoadjuvantní chemoterapie a od plánované operace se pak ustoupilo, jedna pacientka operační zákrok odmítla. Z hlediska přístupu k regionálním lymfatickým uzlinám převažovala ve finální fázi disekce axilly (64,4 %), u 35,7 % pacientek byla realizována exstirpace sentinelové uzliny, 9 % pacientek nemělo provedeno žádný chirurgický zákrok v oblasti regionálních uzlin. Hlavní důvody, které k tomu vedly, byly: onemocnění ve IV. klinickém stadiu (10 případů), vysoký věk pacientek (9 případů), chirurgická léčba předchozího karcinomu prsu s navazující disekcí axilly a radioterapií (8 případů), v obou posledních případech při současné klinické absenci postižení regionálních uzlin. Zbývající tři pacientky měly stejnou příčinu (progrese v průběhu neoadjuvance, odmítnutí). Systémová léčba byla nejčastěji podána formou adjuvantní chemoterapie (230 pacientek; 68,7 %), neoadjuvantní přístup byl zvolen u 61 pacientek (18,2 %), paliativní chemoterapie u 5 (1,5 %). Devětatřiceti ženám (11,6 %) nebyla chemoterapie vůbec aplikována. Hlavním důvodem byly interkurence a/nebo vysoký věk pacientek (26 případů), odmítnutí léčby (7 případů), neindikovaná adjuvantní léčba na základě postupů platných v dané době (6 případů). U pacientek léčených neoadjuvantní nebo adjuvantní chemoterapií byly použité režimy založeny nejčastěji na antracyklinech bez taxanů (51,2 %) nebo na antracyklinech v sekvenční nebo kombinované léčbě s taxany (40,9 %). Samotnými taxany bylo léčeno 4,1 % pacientek, u 3,8 % byl zvolen jiný režim, bez uvedených dvou cytostatik. Jednalo se zejména o pacientky s duplicitním karcinomem prsu, které již v minulosti byly pro tuto diagnózu léčeny. K prvním pěti nejužívanějším chemoterapeutickým režimům v adjuvanci patřily: 1. FEC (5-fluorouracil, epirubicin, cyklofosfamid, 37 % aplikací), 2. FEC/TXT (FEC následovaný monoterapií docetaxelem, případně paklitaxelem, 17 % aplikací), 3. AC (doxorubicin, cyklofosfamid, 16 % aplikací), 4. TAC (doxorubicin, cyklofosfamid, docetaxel, 12 % aplikací), 5. FAC (5-fluorouracil, doxorubicin, cyklofosfamid, 9 % aplikací). V neoadjuvanci se nejčastěji aplikovaly režimy: 1. AC (54 % aplikací), 2. AC/TXT (AC následovaný monoterapií docetaxelem, případně paklitaxelem, 16,4 % aplikací), 3. FAC (7 % aplikací). Adjuvantní radioterapie byla indikována u 251 pacientek (77,2 % z 325, tj. mimo klinické stadium IV). Podrobná charakteristika souboru viz tab. 1.
Bližší charakteristika fenotypu karcinomů
Za účelem podrobnější molekulární charakteristiky TNBC jsme provedli vyšetření proteinů ER-β, Ki-67, EGFR, CK5/6 a CK14 (obr. 1–3). Zajímavým zjištěním bylo relativně vysoké zastoupení karcinomů s pozitivní expresí ER-β mezi TNBC. Tato skupina tvořila 26,1 % TNBC při diskriminační hladině pozitivity 10 %. Pokud bychom aplikovali diskriminační hladinu 1 %, byla by pozitivní exprese ER-β detekována u 58 % TNBC. K dalším sledovaným znakům patřil marker proliferační aktivity Ki-67 a proteiny asociované s basal-like fenotypem TNBC: EGFR, cytokeratiny (CK) o vysoké molekulární hmotnosti, tzv. cytokeratiny buněk bazálního typu, CK 5/6 a CK 14. Z hlediska proliferační aktivity se jednalo v naprosté většině případů o rychle rostoucí tumory, přičemž u více než 60 % karcinomů byla exprese Ki-67 detekována u více než 50 % buněk. U 24,6 % TNBC byla prokázána exprese EGFR, v případě CK5/6 a CK14 se jednalo o 54,7 %, resp. 45,1 %, karcinomů (tab. 1).
Při identifikaci podskupiny BL-TNBC jsme vycházeli s modifikovaného Nielsenova kritéria [12]. Za BL-TNBC jsme považovali triple-negativní karcinomy s pozitivní expresí CK5/6 a/nebo CK14 a/nebo EGFR. Takto definovaná podskupina BL-TNBC zahrnovala v našem souboru 75,9 % karcinomů. Pro případ srovnání se zahraniční literaturou obsahuje tab. 2 údaje o výskytu BL-TNBC v našem souboru při použití dvou dalších definic BL-TNBC [11].
Tab. 2. Molekulární klasifikace TNBC na základě histologického a imunohistochemického vyšetření. 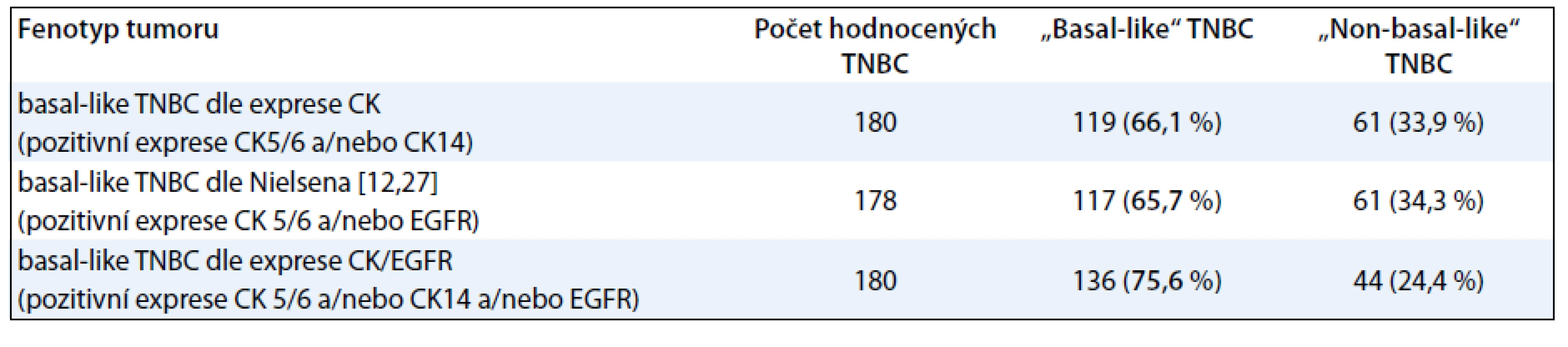
Analýzy přežití
V tab. 3 prezentujeme procentuálně vyjádřené počty žijících pacientů s TNBC a pacientů bez známky choroby v 1.–6. roce od diagnózy TNBC, a to v závislosti na klinickém stadiu onemocnění. V naší práci jsme se dále zabývali vlivem studovaných faktorů na parametry přežití pacientek s TNBC I.–III. klinického stadia (tab. 4). V univariantní analýze jsme prokázali statisticky signifikantní závislost mezi OS(ds) (celkové přežití ve vztahu k chorobě) a následujícími faktory: klinickým stadiem nemoci (ve prospěch nižších stadií; p < 0,0001; graf 1A), rozsahem primárního tumoru – pT (ve prospěch menších tumorů; p < 0,0001), rozsahem postižení regionálních lymfatických uzlin – pN (ve prospěch žádného nebo menšího postižení; p < 0,0001; graf 2A), proliferační aktivitou měřenou expresí Ki-67 (ve prospěch nádorů s expresí Ki-67 u méně než 50 % buněk; p = 0,0411; graf 3A) a expresí CK5/6 (ve prospěch nádorů neexprimujících CK5/6; p = 0,0338; graf 4). Multivariační analýza prokázala nezávislou prediktivní hodnotu pro parametry: klinické stadium nemoci, rozsah postižení regionálních uzlin a exprese CK5/6. V případě DFS (čas bez známky choroby) jsme v univariantní analýze prokázali statisticky signifikantní závislost mezi DFS a následujícími faktory: klinickým stadiem nemoci (ve prospěch nižších stadií; p < 0,0001; graf 1B), rozsahem primárního tumoru – pT (ve prospěch menších tumorů; p < 0,0001), rozsahem postižení regionálních lymfatických uzlin – pN (ve prospěch žádného nebo menšího postižení; p < 0,0001; graf 2B), podáním více než čtyř cyklů chemoterapie s antracykliny (ve prospěch podání více než čtyř cyklů; p = 0,0467), proliferační aktivitou měřenou expresí Ki-67 (ve prospěch nádorů s expresí Ki-67 u méně než 50 % buněk; p = 0,024; graf 3B). Multivariační analýza prokázala nezávislou prediktivní hodnotu pro parametry: klinické stadium nemoci, rozsah postižení regionálních uzlin a případně i pro proliferační aktivitu, pokud se jednalo o hodnocení celého souboru, tj. pacientek s neoadjuvantní i adjuvantní chemoterapií). Jak v případě OS(ds), tak DFS jsme pozorovali statisticky signifikantní závislost obou parametrů na způsobu podání systémové léčby, tj. neoadjuvance vs adjuvance, a to v neprospěch neoadjuvantního podání. Toto pozorování však nelze takto interpretovat, neboť se prokazatelně jednalo o přenesený vztah rozsahu nemoci (pokročilý primární tumor a/nebo metastatické postižení regionálních uzlin) do strategie léčby! K parametrům, které vykazovaly vzájemnou závislost, nicméně ta nedosáhla akceptované hranice statistické významnosti, patřily: tendence k delšímu DFS a OS(ds) (p = 0,1341) u pacientů s medulárním karcinomem ve srovnání s ostatními karcinomy (DFS; p = 0,0749; OS(ds); p = 0,1341) a podobně u pacientů s karcinomy neexprimujícími ER-β (DFS; p = 0,0506; OS(ds); p = 0,0876). Mezi ostatními sledovanými faktory a parametry přežití nebyl prokázán žádný významný vztah (tab. 4).
Tab. 3. Tabulka přežívání pacientů s TNBC v závislosti na klinickém stadiu nemoci. 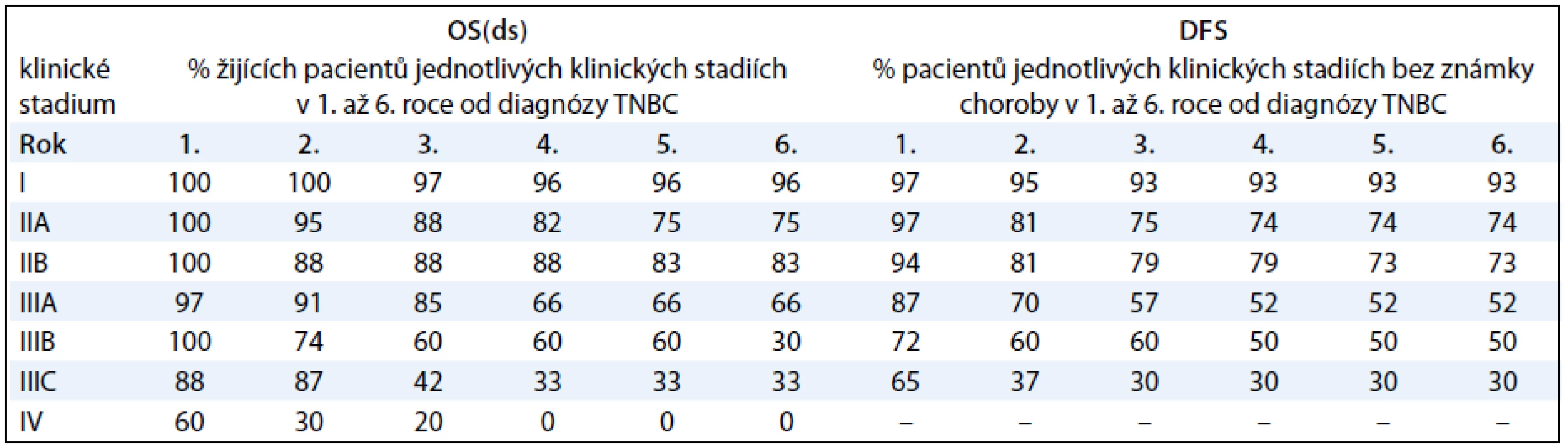
OS(ds) – celkové přežití ve vztahu k základní chorobě, DFS – přežití bez známky choroby
Tab. 4. Vliv studovaných faktorů na parametry přežití u pacientek s triple-negativním karcinomem prsu I.–III. klinického stadia. 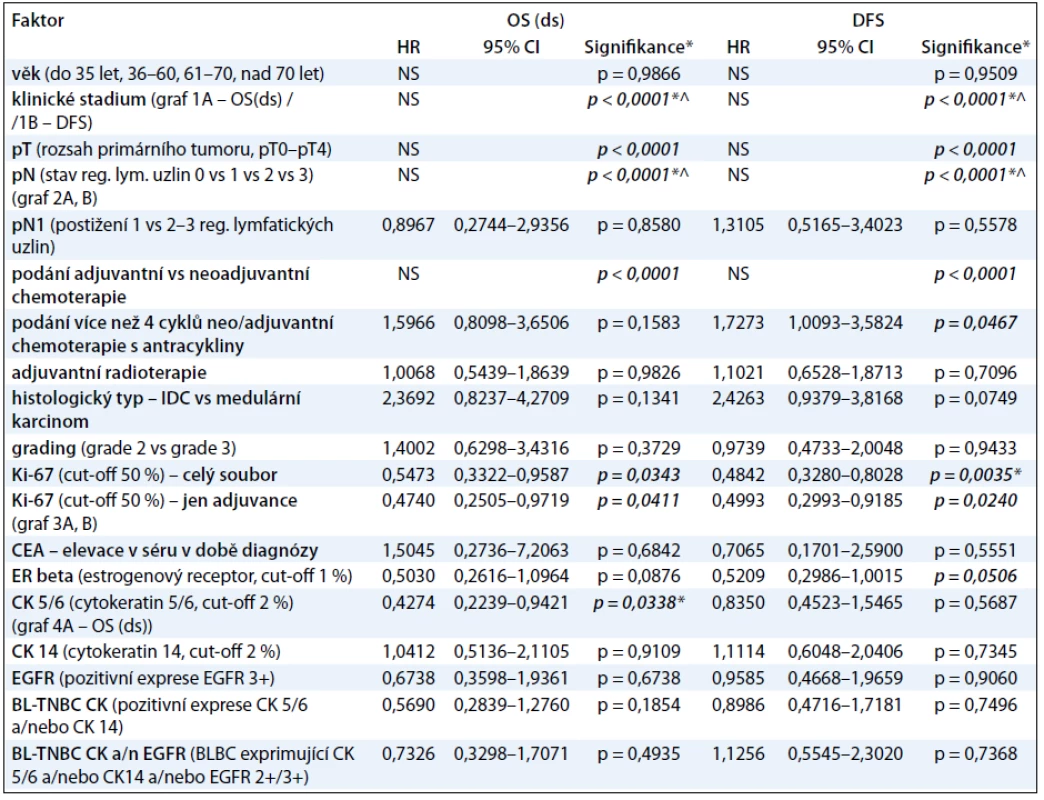
BL-TNBC (basal-like triple negative breast cancer) – triple negativní karcinom prsu vycházející z buněk, jež exprimují některý z markerů „bazálních buněk“ ; CI – Confidence Interval, 95% rozmezí; HR – Hazard Ratio; NS – nestanoveno; *tyto parametry byly jako nezávislé prediktivní faktory potvrzeny i v multivariační analýze (p < 0,05); ^ multivariační analýza provedena zvlášť pro klinické stadium a pN. Graf 1. A, B. Křivky přežití (A – celkové přežití ve vztahu k chorobě OS(ds); B – přežití bez známky choroby (DFS) u pacientek s TNBC v závislosti na klinickém stadiu). 
Graf 2. A, B. Křivky přežití (A – celkové přežití ve vztahu k chorobě OS(ds); B – přežití bez známky choroby (DFS) u pacientek s TNBC v závislosti na stavu postižení regionálních lymfatickcýh uzlin (pN)). 
Graf 3. A, B. Křivky přežití (A – celkové přežití ve vztahu k chorobě OS(ds); B – přežití bez známky choroby (DFS) u pacientek s TNBC léčených adjuvantní chemoterapií v závislosti na proliferační aktivitě nádoru). 
Graf 4. Křivka celkového přežití ve vztahu k chorobě OS(ds) u pacientek s TNBC v závislosti na nádorové expresi CK5/6. 
Diskuze
Na základě výsledků naší práce se podařilo sestavit základní epidemiologickou, molekulární a klinickou charakteristiku pacientek diagnostikovaných s triple-negativním karcinomem v ČR. Co do rozsahu souboru se jedná o dosud největší publikovanou sestavu českých pacientek s TNBC. Naše výsledky jsou u většiny sledovaných parametrů v souladu s publikacemi zahraničních autorů, případně je rozšiřují o nové poznatky.
Tak jako v jiných vyspělých zemích je i v ČR karcinom prsu diagnostikován nejčastěji v populaci žen ve věku mezi 55 až 74 lety [1]. Potvrdili jsme, že z pohledu věkové struktury populace pacientek s karcinomem prsu, je TNBC diagnostikován častěji u mladších žen. Medián v našem souboru byl 56 let, přičemž ve věkové skupině do 34 let bylo diagnostikováno 9,25 % případů a ve skupině 35–44 let 15,22 % případů. Ve srovnání s populací všech pacientek s karcinomem prsu diagnostikovaných v ČR ve stejném období (2004–2009) bylo ve věkové skupině do 34 let bylo diagnostikováno 1,7 % případů a ve skupině 35–44 let 6,5 % případů [1]. K nejdiskutovanějším příčinám patří již prokázaná souvislost mezi výskytem TNBC a mutačním stavem genu BRCA, kdy většina karcinomů od pacientek s hereditární mutací BRCA1 genu má fenotyp basal-like triple-negativního karcinomu (60–80 %) [13–15]. Tuto asociaci v případě našeho souboru potvrzuje i relativně vysoký výskyt vícečetných malignit, který je typický pro hereditární nádorové syndromy. V našem souboru mělo 21,5 % pacientek diagnostikováno více než jeden zhoubný novotvar, a to je dvojnásobně vyšší výskyt než v populaci všech českých pacientek s karcinomem prsu z let 1998–2007 [23]. Z pohledu těchto indicií by mělo být pacientkám s TNBC ve věku do 50 let nabízeno genetické vyšetření za účelem vyloučení hereditární mutace v genech BRCA1 a BRCA2.
Dalším jedinečným zjištěním naší práce bylo určení zastoupení BL-TNBC v populaci českých pacientek s TNBC. Na základě námi aplikované modifikované Nielsenovy definice BL-TNBC představovala tato skupina přibližně 75 % všech TNBC. To odpovídá publikovaným údajům u zahraničních populací [11,12]. Potvrdili jsme rovněž, že významná část TNBC exprimuje ER-β. Pokud bychom za hranici pozitivity exprese ER-β stanovili hodnotu 10 % buněk nádorové populace, jednalo by se o 26,1 % případů TNBC. Pokud bychom hranici snížili na 1 %, podobně jako je nyní u ER-α, jednalo by se o 58,2 % případů TNBC. Počet prací na toto téma je velmi omezený, nicméně existují i publikace uvádějící 66% zastoupení ER-β pozitivních tumorů mezi TNBC a/nebo BRCA1 mutovanými ER-α negativními karcinomy prsu. Dosud nelze jednoznačně rozhodnout, zda exprese ER-β má pozitivní, či negativní prognostický či prediktivní význam [24,25].
Potvrdili jsme, že TNBC je agresivní forma karcinomu prsu. V námi studované populaci pacientek s TNBC bylo onemocnění diagnostikováno častěji ve II. a III. klinickém stadiu ve srovnání s populací všech pacientek s karcinomem prsu diagnostikovaných v ČR ve stejném období (69,9 vs 48 %) [1]. Naprostou většinu karcinomů (90 %) představovaly špatně diferencované karcinomy (grade 3), 61,2 % karcinomů mělo vysokou proliferační aktivitu s více než 50 % nádorových buněk exprimujících Ki-67 antigen, u 48,1 % případů bylo klinicky diagnostikováno metastatické postižení regionálních lymfatických uzlin. I přes relativně krátký medián sledování jsme zaznamenali relaps onemocnění u 25 % pacientek. Do dvou let od diagnózy onemocnění nastalo 55 % z evidovaných úmrtí v důsledku progrese onemocnění, do pěti let to bylo 98,5 %. Nepříznivá prognóza TNBC je odrazem jeho biologických vlastností, které jsou determinované na molekulární úrovni řadou genových mutací a deregulací genové exprese či aktivity proteinů, které řídí procesy proliferace, metastazování a apoptózy (např. p53, p63, p73, BRCA1, CKN1, RAD17, MSH3, XRCC4, EGFR, Akt/mTOR, IGF-1R, Hsp90, c-Myc a další) [9,11,12].
Z našich výsledků rovněž vyplývá, že v klinické praxi je důsledně přihlíženo k nepříznivým biologickým vlastnostem TNBC, což demonstruje skutečnost, že pouze u 39 pacientek (11,6 %) nebyla součástí iniciální léčby chemoterapie. Největší část z této skupiny (25 případů) přitom tvořily pacientky, u kterých bylo podání chemoterapie kontraindikováno s ohledem na jejich interkurence a/nebo vysoký věk. Volba chemoterapeutických režimů vycházela z aktuálně platných doporučení, přičemž indikace u jednotlivých pacientek byla v naprosté většině případů realizována prostřednictvím kolegia odborníků mammární komise MOÚ. U více než 90 % pacientek byla indikována chemoterapie na bázi antracyklinů s komlikacemi s taxany, nebo bez nich. Tento směr systémové léčby byl v současnosti potvrzen jako nejefektivnější [10]. Zatímco v případě rozsahu chirurgického výkonu a aplikace adjuvantní radioterapie nebyl prokázán vliv na OS(ds) nebo DFS, počet aplikovaných cyklů chemoterapie s antracykliny měl vztah k DFS (HR 1,7273; p = 0,0467). Na základě tohoto zjištění jsme se rozhodli pokusit se o identifikaci možných molekulárních prediktorů odpovědi TNBC k chemoterapii založené na antracyklinech a ve spolupráci s kolegy z olomouckého Institutu molekulární a translační medicíny jsme identifikovali Bcl-2 protein jako jeden z kandidátních proteinů, jehož vysoká exprese predikuje kratší čas do vzniku relapsu i kratší celkové přežití [26]. Tohoto zjištění by bylo možné případně využít při rozhodování o režimu neo/adjuvantní chemoterapie, a to zda aplikovat pouze režim založený na antracyklinech, anebo raději zvolit kombinovaný režim, ve kterém jsou buď souběžně, nebo sekvenčně aplikovány i taxany. Kromě Bcl-2 proteinu jsme sledovali vztah k parametrům přežití u několika dalších molekulárních markerů: CK5/6, Ki-67 a ER-β. Nádorová exprese CK5/6 a ER-β byla asociována s kratším OS(ds) a v případě ER-β i s kratším DFS. Naše pozorování tak opět potvrdilo výsledky dalších autorů [24,27]. Přestože je určení fenotypu BL-TNBC založeno i na expresi CK5/6, mezi tímto fenotypem a OS(ds) či DFS nebyla zjištěna žádná vazba. To je zřejmě dáno skutečností, že kromě exprese CK5/6 se na určení fenotypu basal-like TNBC podílely i další znaky, např. exprese CK14. Přitom právě u CK14 již byly publikovány práce o jeho možném pozitivním vlivu na parametry přežití [28]. V případě Ki-67, jako markeru proliferační aktivity, byla vysoká exprese Ki-67 asociována s kratším OS(ds) i DFS. Při interpretaci hodnot Ki-67 u TNBC je nutné si vždy uvědomovat, že byť je vyšší exprese Ki-67 asociována i s větší šancí na účinnost chemoterapie, je vysoká hodnota Ki-67 obecně markerem špatné prognózy [29].
Závěr
Podařilo se nám sestavit základní epidemiologickou, molekulární a klinickou charakteristiku pacientek diagnostikovaných s triple-negativním karcinomem v ČR. Triple-negativní karcinom představuje agresivní formu karcinomu prsu, která se může vyskytovat u pacientek v každém věku, častěji však tomu bývá u mladších pacientek. 75 % případů triple-negativního karcinomu nese znaky basal-like karcinomu. Mezi hlavní prognostické faktory patřily: klinické stadium, postižení regionálních lymfatických uzlin, proliferační aktivita nádoru a exprese cytokeratinu 5/6 nádorovými buňkami. Dále se ukazuje, že v rámci populace pacientek s triple-negativním karcinomem existuje podskupina, která má vyšší benefit z aplikace většího počtu cyklů s antracykliny. Na její identifikaci se v současné době pracuje. Obecně však bude možné dosáhnout u triple--negativního karcinomu zlepšení léčebných výsledků až v souvislosti se zavedením cílené terapie tohoto onemocnění.
Poděkování
Naše poděkování patří všem členům multioborového týmu pro nádory prsu MOÚ, kteří se podíleli na péči o pacientky zařazené v tomto souboru. Dále děkujeme: Ing. Evě Konečné a Ing. Renatě Slezákové za pomoc s vyhledáváním pacientek v nemocničním informačním systému, Ing. Daně Knoflíčkové za pomoc s logistikou vzorků a Leoši Mertovi za pomoc s datovými systémy.
Práce byla realizována za podpory Interní grantové agentury MZ ČR (IGA MZ ČR) pod grantovým číslem NS/10357-3. Statistické zpracování dat bylo realizováno v rámci projektu A-MATH-NET, MŠMT, číslo: CZ.1.07/2.4.00/17.0100.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Marek Svoboda, Ph.D.
Klinika komplexní onkologické péče a
Oddělení epidemiologie a genetiky nádorů
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: msvoboda@mou.cz
Obdrženo: 26. 2. 2012
Přijato: 21. 5. 2012
Zdroje
1. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice republice [online]. Masarykova univerzita 2005 [cit. 2012-5-31]. Dostupný z: http://www.svod.cz.
2. Ellis IO, Schnitt SJ, Sastre-Garau X et al. Invasive breast carcinoma. In: Tavassoli FA, Devilee P (eds). Pathology and Genetics of Tumours of the Breast and Female Genital Organs. 3rd ed. Lyon: WHO and IARC Press 2003 : 13–60.
3. Svoboda M, Grell P, Fabian P et al. Molekulární taxonomie a prediktivní systémy karcinomu prsu definované na základě profilů genové exprese. Klin Onkol 2006; 19 (Supp 2): 373–381.
4. Jatoi I, Chen BE, Anderson WF et al. Breast cancer mortality trends in the United States according to estrogen receptor status and age at diagnosis. J Clin Oncol; 25(13): 1683–1690.
5. Piccart-Gebhart MJ, Procter M, Leyland-Jones B et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005; 353(16): 1659–1672.
6. Gianni L, Eirmann W, Semiglazov V et al. Neoadjuvant chemotherapy with trastuzumab followed by adjuvant trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet 2010; 375(9712): 377–384.
7. Perou CM, Sørlie T, Eisen MN et al. Molecular portraits of human breast tumours. Nature 2000; 406(6796): 747–752.
8. Sørlie T, Perou CM, Tibshirani R et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci USA 2001; 98(19): 10869–10874.
9. Valentin MD, da Silva SD, Privat M et al. Molecular insights on basal-like breast cancer. Breast Cancer Res Treat 2012. In press.
10. Goldhirsch A, Wood WC, Coates AS et al. Strategies for subtypes-dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22(8): 1736–1747.
11. Minami CA, Chung DU, Chang HR. Management options in triple-negative breast cancer. Breast Cancer (Auckl) 2011; 5 : 175–199.
12. Choo JR, Nielsen TO. Biomarkers for Basal-like Breast Cancer. Cancers 2010; 2(2): 1040–1065.
13. Rakha EA, Reis-Filho JS, Ellis IO. Basal-like breast cancer: a critical review. J Clin Oncol 2008; 26(15): 2568–2581.
14. Lakhani SR, Reis-Filho JS, Fulford L et al. Prediction of BRCA1 status in patients with breast cancer using estrogen receptor and basal phenotype. Clin Cancer Res 2005; 11(14): 5175–5180.
15. Kandel MJ, Stadler Z, Masciari S et al. Prevalence of BRCA1 mutatitons in triple-negative breast cancer (BC). J Clin Oncol 2006; 24 (Suppl 18): Abstract 508.
16. Bauer KR, Brown M, Cress RD et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California cancer Registry. Cancer 2007; 109(9): 1721–1728.
17. Dent R, Trudeau M, Pritchard K et al. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res 2007; 13(15 Pt 1): 4429–4434.
18. Svoboda M, Fabian P, Ondrová B et al. Brain metastases in breast cancer: a retrospective cohort study of 187 patients and prognostic markers determination. Breast Cancer Res Treat 2007; 106 (Supp 1): S253.
19. Silver DP, Richardson A, Eklund AC et al. Efficacy of neoadjuvant Cisplatin in triple-negative breast cancer. J Clin Oncol 2010; 28(7): 1145–1153.
20. Chang HR, Glaspy J, Allison MA et al. Differential response of triple-negative breast cancer to a docetaxel and carboplatin-based neoadjuvant treatment. Cancer 2010; 116(18): 4227–4237.
21. Torrisi R, Balduzzi A, Ghisini R et al. Tailored preoperative treatment of locally advanced triple negative (hormone receptor negative and HER2 negative) breast cancer with epirubicin, cisplatin, and infusional fluorouracil followed by weekly paclitaxel. Cancer Chemother Pharmacol 2007; 62(4): 667–672.
22. Frasci G, Comella P, Rinaldo M et al. Preoperative weekly cisplatin-epirubicin-paclitaxel with G-CSF support in triple-negative large operable breast cancer. Ann Oncol 2009; 20(7): 1185–1192.
23. Dusek L, Muzik J, Gelnarova E et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2010; 23(5): 311–324.
24. Yan M, Rayoo M, Takano EA et al. Nuclear and cytoplasmic expressions of ERβ1 and ERβ2 are predictive of response to therapy and alters prognosis in familial breast cancers. Breast Cancer Res Treat 2011; 126(2): 395–405.
25. Novelli F, Milella M, Melucci E et al. A divergent role for estrogen receptor-beta in node-positive and node-negative breast cancer classified according to molecular subtypes: an observational prospective study. Breast Cancer Res 2008; 10(5): R74.
26. Bouchalova K, Svoboda M, Kharaishvili G et al. BCL2 protein in prediction of relapse in triple-negative breast cancer (TNBC) treated with adjuvant anthracycline-based chemotherapy. J Clin Oncol 2012; 30 (Suppl): Abstract 1087.
27. Nielsen TO, Hsu FD, Jensen K et al. Immunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma. Clin Cancer Res 2004; 10(16): 5367–5374.
28. Fulford G, Reis-Filho JS, Ryder K et al. Basal-like grade III invasive ductal carcinoma of the breast: patterns of metastasis and long-term survival. Breast Cancer Res 2007; 9(1): R4.
29. Urruticoechea A, Smith IE, Dowsett M. Proliferation marker Ki-67 in early breast cancer. J Clin Oncol 2005; 23(28): 7212–7220.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Výhody jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Reprodukční funkce u onkologických pacientek
- Pozitronová emisní tomografie a klinické prediktory přežití u primárních extragonadálních germinálních nádorů
- Genetické pozadí ototoxicity cisplatiny
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
- Informace z České onkologické společnosti
- Klinický registr BREAST
- Prof. MUDr. Luboš Petruželka, CSc., se dožívá jubilea
-
Onkologie v obrazech
Miliární plicní rozsev
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Prof. MUDr. Luboš Petruželka, CSc., se dožívá jubilea
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



