-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chirurgie plicních metastáz
Surgery of the Pulmonary Metastases
Introduction:
Surgical resection of lung metastases of epithelial and mesenchymal tumors has an irreplaceable position in the complex treatment of advanced stages of these malignancies. Among the most significant prognostic factors affecting longterm survival of these patients are: parameter of complete resection, number and size of metastases, histological type of primary tumor, lymph node involvement, DFI (Disease Free Interval) and biological aggressiveness of the tumor or TDT (Tumor Doubling Time).Aim:
retrospective analysis of patients with lung metastases of epithelial and mesenchymal tumors operated on at the I. Department of Surgery from 2005 to 2011.Material and Methods:
The authors present a set of 50 patients and evaluation of their age, gender, type of primary tumor, number of metastases, occurrence of bilateral metastases, repeat metastasectomies, duration of DFI, type of operation and selected approach and performance of mediastinal lymphadenectomy. The probability of five-year survival, relationship between survival on DFI, difference in survival between metastases of colorectal cancer versus renal cancer and the influence of repeated metastasectomies and number of metastases on survival were statistically analyzed.Results:
Sixty operations were performed on a set of 50 patients (average age 61.2 years). Forty-two procedures were performed by thoracotomic approach. A solitary metastasis was discovered in 43 patients; in 8 patients, more than 3 metastases were resected. Repeated metastasectomies were performed 10 times. Mediastinal lymphadenectomy was performed in 21 cases. The most frequent procedure was extraanatomic resection (28×). Fourteen patients had DFI < 12 months, 19 patients had DFI 12–36 months and 17 patients had DFI > 36 months. Average survival was 66.9 months; the probability of five-year survival was 0.549 (54.9%). A relationship between DFI and survival was not discovered. There was no statistically significant difference in survival after metastasectomy for colorectal cancer and renal cancer. A relationship between survival interval and number of metastases and repeated metastasectomies was not discovered.Conclusion:
Surgical resection of lung metastases plays an important role in multidisciplinary care, assuming a precise selection of patients indicated for this treatment. When properly adhering to the indication criteria, very positive results of long-term survival may be expected.Key words:
lung – neoplasm metastases – metastasectomy – prognosis – survival
Autoři: M. Szkorupa 1; T. Bohanes 1; Č. Neoral 1; J. Chudáček 1; K. Langová 2
Působiště autorů: I. chirurgická klinika LF UP a FN Olomouc 1; Ústav lékařské biofyziky LF UP v Olomouci 2
Vyšlo v časopise: Klin Onkol 2013; 26(1): 35-41
Kategorie: Původní práce
Souhrn
Východiska:
Chirurgická resekce plicních metastáz řady epiteliálních i mezenchymálních tumorů má své nezastupitelné místo v komplexní léčbě pokročilých stadií těchto malignit. K nejvýznamnějším prognostickým faktorům, které mají vliv na dlouhodobé přežívání nemocných, patří parametr kompletní resekce, počet a velikost metastáz, histologický typ primárního nádoru, lymfatické postižení, DFI (Disease Free Interval), biologická agresivita nádoru nebo TDT (Tumor Doubling Time).Cíl:
Retrospektivní analýza nemocných operovaných na I. chirurgické klinice LF UP a FN Olomouc v letech 2005–2011 pro plicní metastázy epiteliálních i mezenchymálních nádorů.Materiál a metody:
Autoři předkládají soubor 50 nemocných, hodnocen byl věk, pohlaví, typ primárního nádoru, počet metastáz, výskyt oboustranných metastáz, opakované metastazektomie, délka DFI, typ operace a volba operačního přístupu, provedení mediastinální lymfadenektomie. Statisticky zpracována byla pravděpodobnost pětiletého přežívání, závislost přežívání na délce DFI, rozdíl v přežívání mezi metastázami kolorektálního karcinomu a renálního karcinomu a závislost délky přežívání na opakovaných metastazektomiích a na počtu metastáz.Výsledky:
U 50 nemocných (průměrný věk 61,2 let) bylo provedeno 60 operací, z toho 42 výkonů torakotomickým přístupem. U 43 nemocných byla nalezena solitární metastáza, u 8 nemocných pak byly resekovány více než 3 metastázy. Opakovanou metastazektomii prodělalo 10 pacientů. Mediastinální lymfadenektomie byla provedena ve 21 případech. Nejčastějším výkonem byla extraanatomická resekce (28×). DFI < 12 měsíců mělo 14 pacientů, 12–36 měsíců 19 pacientů a > 36 měsíců 17 pacientů. Průměrný čas přežívání byl 66,9 měsíců, pravděpodobnost pětiletého přežívání byla 0,549 (54,9 %). Nebyl prokázán vztah délky DFI k délce přežívání. Nebyl zjištěn statisticky významný rozdíl v přežívání po metastazektomiích mezi kolorektálním a renálním karcinomem. Nebyla zjištěna závislost délky přežívání na počtu metastáz a při opakovaných metastazektomiích.Závěr:
Chirurgická resekce plicních metastáz hraje důležitou roli v multioborové péči o nemocné s tímto postižením, ovšem za předpokladu exaktní selekce pacientů vhodných k této léčbě. Při splnění indikačních kritérií lze očekávat příznivé výsledky dlouhodobého přežívání.Klíčová slova:
plíce – nádory – metastazektomie – prognóza – přežitíÚvod
Plíce jsou častým cílovým orgánem metastazování různých druhů nádorů epiteliálních, mezenchymálních nebo tumorů ze zárodečných buněk. Chirurgická metastazektomie je jednou z léčebných modalit, která může za určitých podmínek vést k prodloužení přežívání. Předpokladem je radikálně resekabilní primární nádor, možnost kompletní resekce plicních metastáz podle předoperačních vyšetření, technická proveditelnost operace, adekvátní kardiopulmonální rezerva pacienta a vyloučení jiných extrapulmonálních metastáz nebo předpoklad jejich radikální léčby. K vedlejším kritériím opravňujícím provedení chirurgické resekce pak patří koexistence účinné chemoterapie, nemožnost diferenciálně diagnosticky odlišit primární plicní karcinom, neexistuje jiná účinnější kurativní metoda léčby anebo jsou tyto ložiska symptomatické (hemoptýzy, obstrukce bronchů, inflamace). Nicméně indikaci k chirurgické metastazektomii nelze v obecné rovině zcela standardizovat, protože kromě uvedených kritérií závisí také na histologickém typu primárního nádoru, počtu a uložení metastáz, lymfatickém postižení nebo délce disease free intervalu [1–3].
Výsledky dlouhodobého přežívání (pěti - a desetiletého) po chirurgických metastazektomiích dosahují v retrospektivních studiích přijatelných 36, resp. 26 % bez rozlišení původu primárního nádoru, ale existuje řada opět retrospektivních studií, které se týkají i hodnocení jednotlivých specifikovaných malignit [1,2].
Cílem následující retrospektivní analýzy je vyhodnotit výsledky plicních metastazektomií pracoviště I. chirurgické kliniky LF UP a FN Olomouc v letech 2005–2011.
Materiál a metody
V letech 2005–2011 bylo na I. chirurgické klinice LF UP a FN Olomouc operováno 50 nemocných pro plicní metastázy epiteliálních, mezenchymálních maligních nádorů i nádorů ze zárodečných buněk. Ze souboru 50 pacientů bylo 26 mužů (52 %) a 24 žen (48 %). Věkový průměr byl 61,2 let, ve věkovém rozmezí 22–78 let, medián 63 let.
Indikační kritéria pro metastazektomii byla následující. Pacient byl bez známek recidivy primárního onemocnění. Předoperační vyšetření neprokázala diseminaci základního onemocnění, nicméně např. přítomnost radikálně odstranitelných jaterních metastáz u kolorektálního karcinomu nebyla kontraindikací plicní resekce. Metastáza, resp. metastázy byly dle předoperačních radiologických vyšetření (především CT a PET CT) radikálně resekovatelné. Pacienti byli podle interního, pneumologického a anesteziologického vyšetření schopni plánovaného výkonu. Vícečetné bilaterální metastázy ani opakované výkony nebyly kontraindikací resekce.
Všechny operace byly provedeny se selektivní plicní ventilací. Operační přístup byl zvolen v závislosti na lokalizaci metastázy, velikosti metastázy, nutnosti event. peroperační biopsie v případě neověřeného ložiska nebo na indikaci mediastinální lymfadenektomie. U periferních solitárních lézí byl preferován přístup torakoskopický nebo VATS (Video-Assisted Thoracoscopic Surgery). V případě vícečetných lézí, nutnosti peroperačního ověření ložiska, anatomické resekce nebo mediastinální lymfadenektomie byl zvolen přístup VATS nebo z klasické posterolaterální torakotomie.
Jako typ výkonu byla preferována extraanatomická resekce, pokud to lokalizace, resp. počet a velikost metastáz dovoloval. V případě centrálního uložení metastázy v laloku nebo nadměrné velikosti metastázy byla indikována lobektomie. Pneumonektomie se v našem souboru nevyskytla.
Mediastinální lymfadenektomie nebyla rutinní součástí výkonu. Standardně byla provedena u metastazektomií v letech 2009–2011 v rámci grantového projektu IGA NS 100095-4 – „Význam mediastinální lymfadenektomie u plicních metastáz“. Jako typ lymfadenektomie byla indikována systematická mediastinální lymfadenektomie.
Statistické zpracování dat bylo hodnoceno pomocí Kaplan-Meierovy analýzy přežívání. Pro porovnání obou křivek přežití byl použit Log-rank test. Hodnoceny byly parametry celkového přežívání, pravděpodobnost pětiletého přežívání, vztah DFI (Disease Free Intervalu, tedy doby od primární operace nádoru do nálezu plicní metastázy) k délce přežívání, závislost přežívání na typu nádoru (hodnoceno u kolorektálního karcinomu a karcinomu ledviny) a dále závislost přežívání na počtu metastáz a opakovaných metastazektomiích. Sledování a data byly vztaženy k 1. 5. 2012.
Výsledky
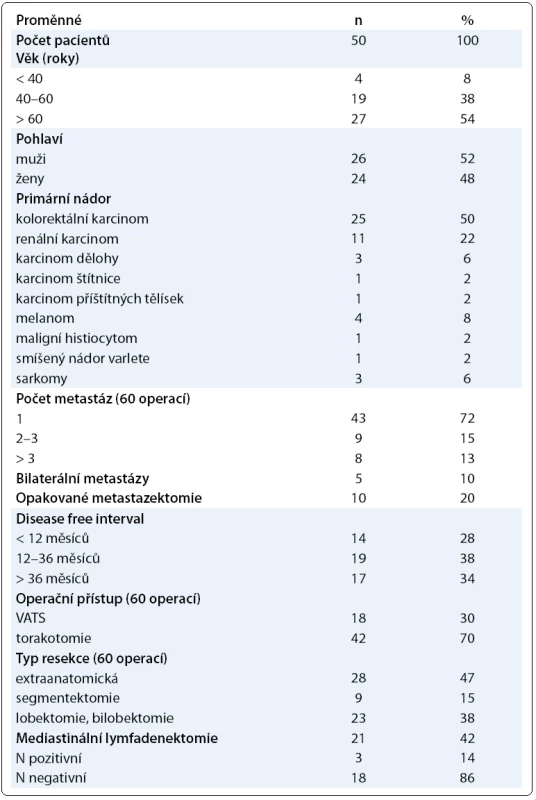
U 50 nemocných bylo provedeno celkem 60 operací. Přehled podle věku, pohlaví, typu primárního nádoru, počtu operovaných metastáz, počtu oboustranných metastáz, počtu opakovaných metastazektomií, DFI, operačního přístupu, typu operací a provedené mediastinální lymfadenektomie udává tab. 1.
Průměrný čas přežívání byl 66,9 měsíců, pravděpodobnost pětiletého přežívání byla 0,549 (54,9 %) 95% CI (0,343–0,755), tedy (34,3–75,5 %). Tyto parametry znázorňuje graf 1.
Graf 1. Celkové přežívání po metastazektomiích. 
Dále byl hodnocen vztah DFI k délce přežívání – nebyl prokázán vztah délky DFI k délce přežívání, p = 0,642 (graf 2).
Graf 2. Závislost přežívání na délce DFI. 
Hodnocen byl také rozdíl v přežívání u nejčastějších typů primárního nádoru, tedy kolorektálním karcinomu a karcinomu ledviny (graf 3). Rozdíl nebyl signifikantní, p = 0,051 > 0,05.
Graf 3. Rozdíl v přežívání po metastazektomiích kolorektálního karcinomu a karcinomu ledviny. 
Ani závislost délky přežívání na opakovaných metastazektomiích nebyla v tomto souboru prokázána. Rozdíl nebyl signifikantní, p = 0,789 > 0,05 (graf 4).
Graf 4. Závislost délky přežívání na opakovaných metastazektomiích. 
Jako poslední byla hodnocena závislost přežívání na počtu metastáz. V tomto souboru také nebyl signifikantní rozdíl, p = 0,496 > 0,05 (graf 5).
Graf 5. Závislost délky přežívání na počtu metastáz. 
Diskuze
V současné době stále nejsou k dispozici prospektivní randomizované studie, které by hodnotily benefit plicních metastazektomií u homogenních souborů pacientů, většina dosavadních analýz jsou retrospektivní review, které hodnotí přínos kompletní resekce plicních metastáz na dlouhodobé přežívání. IRLM je Mezinárodní registr plicních metastáz, který zpracoval výsledky z 18 pracovišť hrudní chirurgie z Evropy, USA a Kanady, kde 4 572 pacientů podstoupilo kompletní plicní metastazektomii různých primárních nádorů (karcinomy, sarkomy, melanomy a tumory ze zárodečných buněk). Hodnocení pěti-, deseti - a patnáctiletého přežívání bylo 36,26, resp. 22 %. Mezi signifikantní faktory, které měly vliv na dlouhodobé přežívání, patří primární nádor ze zárodečných buněk, DFI > 36 měsíců, výskyt solitární metastázy a především kompletní resekce [1,4,5]. První prospektivní randomizovaná studie – PulMiCC Trial, která začala v roce 2010, by měla zhodnotit benefit plicní metastazektomie u plicních metastáz kolorektálního karcinomu se zaměřením na dlouhodobé přežívání, výhody a rizika chirurgického výkonu a kvalitu života nemocných po chirurgické resekci [6].
Důležitým požadavkem před operací ložiskového procesu plic, který může být metastatickým rozsevem původního primárního nádoru, je pečlivá diagnostika procesu zahrnující vyšetření metodami sérologickými (tumor markery), zobrazovacími (RTG, CT, resp. spirální CT, PET CT, scintigrafie), endoskopickými (bronchoskopie) a bioptickými (např. FNA). Primárním úkolem je co nejpřesnější diagnostika s vyloučením jiné etiologie ložiska (primární plicní karcinom, ložiska benigní, zánětlivé nebo specifické etiologie), vyloučení recidivy primárního tumoru nebo diseminace procesu. Mezi zobrazovacími metodami je první metodou volby CT, resp. spirální CT, které je schopno diagnostikovat i drobné léze kolem 2–3 mm a používá je většina pracovišť (74 %). Přesto je až ve 20 % případů peroperačně při palpaci detekováno více ložisek, než bylo patrno na předoperačním CT vyšetření [7–9]. PET CT nemá vyšší rozlišovací schopnost detekce než spirální CT a nelze je považovat za zásadní vyšetření ani v diferenciální diagnostice benigních a maligních lézí. Význam PET CT spočívá především v detekci extrapulmonálních metastáz, a tím diseminace onemocnění. Zde dosahuje PET CT vysoké senzitivity a umožňuje vyloučit skupinu pacientů, kteří by z resekce plicních metastáz neprofitovali, což bývá v 10–15 % případů [8,10].
Nejčastějším výkonem pro plicní metastázu je klínovitá, resp. extraanatomická resekce s bezpečnostní linií 5–10 mm, která je stále považována za dostatečně radikální výkon pro odstranění metastázy. Zásadním požadavkem však musí být parametr kompletní resekce, který je jedním z nejdůležitějších prognostických faktorů přežívání [11]. Anatomické výkony (segmentektomie, lobektomie) jsou vyhrazeny metastázám, lokalizovaným centrálněji v rámci postiženého segmentu nebo laloku. Pneumonektomie a rozšířené resekce jsou méně častou indikací pro plicní metastázu u selektované skupiny pacientů s centrální hilovou metastázou, u kterých lze předpokládat přijatelné riziko morbidity, mortality a efekt dlouhodobého přežívání [4,11].
Často diskutovanou otázkou je chirurgický přístup k metastazektomiím. Zlatým standardem byl po dlouhou dobu klasický přístup (torakotomie, stereotomie, clamshell), s nástupem miniinvazivní chirurgie jsou tyto výkony technicky možné samozřejmě i torakoskopicky, resp. VATS přístupem. Obě metody mají své zastánce i odpůrce. VATS přístup lze preferovat především u periferně umístěných lézí a solitárních metastáz do velikosti 3 cm. Nevýhodou VATS přístupu je omezená možnost ohledání celé plíce, a tím identifikace možných okultních lézí [12]. Na druhou stranu lze primárně neresekované okultní metastázy v dalším průběhu radiologicky sledovat do jejich klinické manifestace a díky miniinvazivnímu přístupu jsou reoperace technicky snazší (výskyt adhezí). Navíc ani tento odklad resekce nemá podle některých autorů vliv na délku přežívání [13,14]. VATS přístup s sebou také přináší všeobecně známé výhody menší traumatizace tkání, snížení bolestivosti, kratší doby hospitalizace, a tím v druhém sledu i ekonomický efekt [15,16].
Klasický torakotomický (sternotomický, clamshell) přístup umožňuje dostatečnou exploraci plíce, a tím vysokou pravděpodobnost kompletní resekce, a je preferován v případě většího počtu lézí, centrální lokalizace metastázy, větší velikosti metastázy nebo v případě nutnosti rozšířené resekce. Přináší s sebou určité vyšší riziko infekčních komplikací a menší komfort pro pacienta oproti VATS (větší bolesti, omezení hybnosti, prodloužení doby hospitalizace).
Nicméně dlouhodobé výsledky přežívání VATS a klasického operačního přístupu jsou srovnatelné [16,17], i když v retrospektivních studiích nebyly vždy srovnávány homogenní soubory pacientů (s ohledem na již výše uvedené rozdíly v indikacích k VATS a klasickému přístupu).
Remetastazektomie mohou dosáhnout za určitých podmínek poměrně dobrých výsledků dlouhodobého přežívání. Kandioler et al ve své retrospektivní studii na souboru 35 pacientů, kteří prodělali 82 metastazektomií, zjistili, že na délku přežívání nemá vliv velikost, počet, lateralita ani lokalizace metastáz při opakovaných výkonech. Vliv na délku přežívání měla délka DFI (Disease Free Interval). K podobným závěrům došly i další studie, které se týkaly remetastazektomií [18–20]. Z uvedených studií vyplývá, že i u recidivujících metastáz lze vyselektovat skupinu pacientů, kteří mohou z opakovaných resekcí profitovat. Zvláště to platí u pacientů s kolorektálním karcinomem, karcinomem ledviny, nádorem ze zárodečných buněk a sarkomem [21–23].
S ohledem na možnost opakovaných resekcí je důležitým požadavkem také prezervace plicního parenchymu u každé resekce. Minimalizace resekčního výkonu za předpokladu onkochirurgické radikality umožňuje zachování funkčního plicního parenchymu, a tím i možnost další resekce v případě recidivy metastatického procesu. V případech, kdy radikální resekce z důvodu nedostatečné plicní kapacity není možná, lze použít alternativní metody ablační léčby. Mezi ně patří metoda precizní laserové excize pomocí Nd:YAG laseru (Neodymium-doped Yttrium Aluminium Garnet), který umožňuje provést excizi ložiska s potřebným bezpečnostním lemem i v případě centrálněji uložené metastázy nebo odstranění více ložisek bez nutnosti anatomické plicní resekce [24].
Otázka mediastinální lymfadenektomie u plicních metastazektomií není stále plně dořešena. Je zřejmé, že pozitivita lymfatických uzlin představuje negativní prognostický faktor dlouhodobého přežívání. Metastatické šíření z plicních metastáz do lymfatických uzlin hilu a mediastina není tak časté jako u primárního plicního karcinomu, četnost se pohybuje od 8 do 28 % u metastazektomií pro karcinom, u sarkomového origa je výskyt vzácnější [25,26]. Někteří autoři dokonce považují přítomnost N2 pozitivních uzlin jako kontraindikaci chirurgické resekce [27,28]. Tyto pracoviště doporučují předoperační ověření mediastinálních uzlin nejen zobrazovacími metodami, ale také biopticky i z důvodu nízké citlivosti předoperačních zobrazovacích metod na metastatické postižení mediastinálních uzlin. U nemocných s pozitivními mediastinálními uzlinami bylo prokázáno nižší pětileté přežívání (24,4 %) [29]. Kurativní efekt systematické mediastinální lymfadenektomie u plicních metastazektomií v obecné rovině dosud nebyl prokázán, nicméně některá retrospektivní data prokázala zlepšení přežívání u metastáz renálního karcinomu v případě, že byla provedena anatomická resekce s lymfadenektomií a postižení lymfatických uzlin bylo omezeno na intrapulmonální nebo hilové uzliny [28,30,31].
Počet metastáz – vyšší počet metastáz je negativním prognostickým ukazatelem dlouhodobého přežívání. Lepší výsledky mají nemocní se solitárním postižením [5]. Nicméně není striktně určena hranice počtu metastáz, nad kterou by výkon byl již kontraindikován. Nejdůležitějším a rozhodujícím aspektem je předpoklad kompletní resekce s přihlédnutím k dalším výše uvedeným resekčním kritériím. Pravděpodobnost kompletní resekce klesá s počtem metastáz, zvyšuje se i možnost existence dalších okultních lézí, možnost jiné, dosud nepoznané diseminace i pravděpodobnost výskytu recidivy metastáz [32,33]. Navíc je nutno počítat s větším rozsahem resekčního výkonu, a tedy možným zvýšením morbidity a mortality. S tím souvisí i požadavek na prezervaci plicního parenchymu a možnost využití jiných léčebných modalit při nemožnosti radikální resekce (viz výše).
DFI je definován jako doba ode dne stanovení diagnózy primárního nádoru k datu stanovení diagnózy plicní metastázy. Delší DFI je indikátorem méně biologicky agresivního nádoru [26]. Krátký DFI (< 12 měsíců) bývá spojován s kratším přežíváním [5].
Existuje řada dalších faktorů, které ovlivňují přežívání po plicních metastazektomiích. Patří sem histologie, origo primárního nádoru a biologická agresivita nádoru, které se podílí na významných rozdílech v přežívání. Je to dáno různým biologickým chováním různých nádorů, odlišným charakterem metastazování, jinou odpovědí na systémovou léčbu. Biologická agresivita pak ovlivňuje délku DFI, tumor doubling time a například i počet metastáz.
Závěr
Plicní metastazektomie je u řady diseminujících nádorů nedílnou součástí komplexní onkochirurgické léčby. Poměrně úspěšných výsledků lze však dosáhnout jen za předpokladu respektování indikačních kritérií, které vyselektují ty nemocné, kterým resekce přinese benefit prodloužení života a šanci možného vyléčení. Přežívání ovlivňuje řada prognostických faktorů, které by v budoucnu měly být předmětem dalších, především prospektivních randomizovaných studií, které mohou následně přispět ke zlepšení výsledků léčby těchto pokročilých stadií malignit.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Marek Szkorupa
I. chirurgická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: szkorupm@fnol.cz
Obdrženo: 30. 12. 2012
Přijato: 28. 1. 2013
Zdroje
1. Jacklitsch MT, Ravi S, Carlos MM et al. Surgical resection of pulmonary metastases: Benefits; indications; preoperative evaluation and techniques. In: UpToDate [online]. 2011 [cit. 2012-04-24]. Dostupné z: http://www.uptodate.com/contents/surgical-resection-of-pulmonary-metastases-benefits-indications-preoperative-evaluation-and--techniques.
2. Kondo H, Okumura T, Ohde Y et al. Surgical treatment for metastatic malignancies. Pulmonary metastasis: indications and outcomes. Int J Clin Oncol 2005; 10(2): 81–85.
3. Riad NY, Abdo LF, Jefferson LG. Pulmonary metastasectomy: a multivariate analysis of 440 patients undergoing complete resection. Interact Cardiovasc Thorac Surg 2012; 14(2): 156–161.
4. Koong HN, Pastorino U, Ginsberg RJ. Is there a role for pneumonectomy in pulmonary metastases? International Registry of Lung Metastases. Ann Thorac Surg 1999; 68(6): 2039–2043.
5. Pastorino U, Buyse M, Friedel G et al. Long-term results of lung metastasectomy: prognostic analyses based on 5206 cases. The International Registry of Lung Metastases. J Thorac Cardiovasc Surg 1997; 113(1): 37–49.
6. Treasure T, Fallowfield L, Lees B. Pulmonary Metastasectomy in Colorectal Cancer The PulMiCC Trial. J Thorac Oncol 2010; 5(6): 203–206.
7. Villeneuve PJ, Sundaresan RS. Surgical Management of Colorectal Lung Metastasis. Clin Colon Rectal Surg 2009; 22(4): 233–241.
8. Detterbeck FC, Grodzki T, Gleeson F et al. Imaging requirements in the practice of pulmonary metastasectomy. J Thorac Oncol 2010; 5(6): 134–139.
9. Internullo E, Cassivi S, van Raemdonck D et al. Pulmonary metastasectomy: a survey of current practice amongst members of the European Society of Thoracic Surgeons. J Thorac Oncol 2008; 3(11): 1257–1266.
10. Pastorino U, Veronesi G, Landoni C et al. Fluorodeoxyglucose positron emission tomography improves preoperative staging of resectable lung metastasis. J Thorac Cardiovasc Surg 2003; 126(6): 1906–1910.
11. Kaifi JT, Gusani NJ, Deshaies I et al. Indications and approach to surgical resection of lung metastases. J Surg Oncol 2010; 102(2): 187–195.
12. McCormack PM, Bains MS, Begg CB et al. Role of videoassisted thoracic surgery in the treatment of pulmonary metastases: Results of a prospective trial. Ann Thorac Surg 1996; 62(1): 213–216.
13. Tanaka Y, Maniwa Y, Nishio W et al. The optimal timing to resect pulmonary metastasis. Eur J Cardiothorac Surg 2008; 33(6): 1135–1138.
14. Younes RN, Gross JL, Deheinzelin D. Surgical resection of unilateral lung metastases: Is bilateral thoracotomy necessary? World J Surg 2002; 26(9): 1112–1116.
15. Landreneau RJ, De Giacomo T, Mack MJ et al. Therapeutic video-assisted thoracoscopic surgical resection of colorectal pulmonary metastases. Eur J Cardiothorac Surg 2000; 18(6): 671–676.
16. Carballo M, Maish MS, Jaroszewski DE et al. Video-assisted thoracic surgery (VATS) as a safe alternative for the resection of pulmonary metastases: a retrospective cohort study. J Cardiothorac Surg 2009; 4 : 13.
17. Nakajima J, Takamoto S, Tanaka M et al. Thoracoscopic surgery and conventional open thoracotomy in metastatic lung cancer. Surg Endosc 2001; 15(8): 849–853.
18. Kandioler D, Kromer E, Tuchler H et al. Long-term results after repeated surgical removal of pulmonary metastases. Ann Thorac Surg 1998; 65(4): 909–912.
19. Pogrebniak HW, Roth JA, Steinberg SM et al. Reoperative pulmonary resection in patients with metastatic soft tissue sarcoma. Ann Thorac Surg 1991; 52(2): 197–203.
20. Ogata Y, Matono K, Hayashi A et al. Repeat pulmonary resection for isolated recurrent lung metastases yields results comparable to those after first pulmonary resection in colorectal cancer. World J Surg 2005; 29(3): 363–368.
21. Liebl LS, Elson F, Quaas A et al. Value of repeat resection for survival in pulmonary metastases from soft tissue sarcoma. Anticancer Res 2007; 27(4C): 2897–2902.
22. Pfannschmidt J, Muley T, Hoffmann H et al. Prognostic factors and survival after complete resection of pulmonary metastases from colorectal carcinoma: Experiences in 167 patients. J Thorac Cardiovasc Surg 2003; 126(3): 732–739.
23. Piltz S, Meimarakis G, Wichmann MW et al. Long-term results after pulmonary resection of renal cell carcinoma metastases. Ann Thorac Surg 2002; 73(4): 1082–1087.
24. Vodička J, Špidlen V, Šimánek V et al. Možnosti a výsledky chirurgické léčby plicních metastáz světlobuněčného (konvenčního) renálního karcinomu. Klin Onkol 2011; 24(4): 293–297.
25. Doležel J, Veverková L, Jedlička V et al. Mediastinální lymfadenektomie v chirurgii plicních metastáz. Rozhl Chir 2008; 88(5): 259–261.
26. Čapov I, Wechsler J, Jedlička V et al. Současný stav chirurgie plicních metastáz – review. Klin Onkol 2004; 17(3): 85–90.
27. Welter S, Jacobs J, Krbek T et al. Prognostic impact of lymph node involvement in pulmonary metastases from colorectal cancer. Eur J Cardiothorac Surg 2007; 31(2): 167–172.
28. Veronesi G, Petrella F, Leo F et al. Prognostic role of lymph node involvement in lung metastasectomy. J Thorac Cardiovasc Surg 2007; 133(4): 967–972.
29. Pfannschmidt J, Hoffmann H, Muley T et al. Prognostic factors for survival after pulmonary resection of metastatic renal cell carcinoma. Ann Thorac Surg 2002; 74(5): 1653–1657.
30. Pfannschmidt J, Klode J, Muley T et al. Nodal involvement at the time of pulmonary metastasectomy: experiences in 245 patients. Ann Thorac Surg 2006; 81(2): 448–454.
31. Murthy SC, Kim K, Rice TW et al. Can we predict long--term survival after pulmonary metastasectomy for renal cell carcinoma? Ann Thorac Surg 2005; 79(3): 996–1003.
32. Todd TR. The surgical treatment of pulmonary metastases. Chest 1997; 112 (4 Suppl): 287S–290S.
33. Monteiro A, Arce N, Bernardo J et al. Surgical resection of lung metastases from epithelial tumors. Ann Thorac Surg 2004; 77(2): 431–437.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Editorial
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Inhibitory proteazomu v léčbě mnohočetného myelomu
- Germinatívne nádory pineálnej oblasti: prehľad
- Molekulárně biologická diagnostika mutací genu KRAS a BRAF u pacientů s kolorektálním karcinomem – zkušenosti laboratorního pracoviště
- Primární rakovina žlučníku diagnoastikovaná pooperačně po elektivní a hospitalizační cholecystektomii
- Chirurgie plicních metastáz
- Maligní melanom léčený intenzivní chemoterapií, podobnost histologického obrazu maligního melanomu a nádorů měkkých tkání, kazuistika pacientky
- Hepatotoxicita po cyproteron acetátu v léčbě karcinomu prostaty – kazuistika
- Recidivující krvácení z jater a hemoperitoneum jako následek masivního postižení AL amyloidózou: popis případu a přehled literatury
- Editorial
- Zpráva z „malých“ registrů – Pemetrexed, Tarceva a Yondelis
- Další linie cílené léčby u nemocných s metastatickým renálním karcinomem s progresí na léčbě pazopanibem: expertní stanovisko České kooperativní skupiny pro metastatický renální karcinom
- Informace z České onkologické společnosti
- Tematický seznam publikací vydaných v Klinické onkologii v roce 2012
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Germinatívne nádory pineálnej oblasti: prehľad
- Inhibitory proteazomu v léčbě mnohočetného myelomu
- Maligní melanom léčený intenzivní chemoterapií, podobnost histologického obrazu maligního melanomu a nádorů měkkých tkání, kazuistika pacientky
- Chirurgie plicních metastáz
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy