-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza nákladové efektivity porovnávající panitumumab plus mFOLFOX6 a bevacizumab plus mFOLFOX6 v první linii metastatického kolorektálního karcinomu s expresí nemutovaného typu onkogenu RAS – adaptace modelu na podmínky České republiky
Cost‑effectiveness Analysis of Panitumumab Plus mFOLFOX6 Compared to Bevacizumab Plus mFOLFOX6 for First‑line Treatment of Patients with Wild‑type RAS Metastatic Colorectal Cancer – Czech Republic Model Adaptation
Background:
Pharmacoeconomic assessments are a part of the decision process not only during reimbursement setting, but in clinical practice as well. The presented cost‑effectiveness analysis assesses panitumumab + mFOLFOX6 vs. bevacizumab + mFOLFOX6 in 1st line treatment of patients with wild‑type RAS metastatic colorectal cancer (mCRC) in the Czech environment.Material and Methods:
The adaptation of a Markov model considers the health ‑ care perspective; clinical data (efficacy, health ‑ care utilization and adverse events) are derived from a head ‑ to ‑ head comparison (PEAK study). Health states included in the model: progression free on treatment, progression (with/ without active treatment), resection of metastases, disease‑free after successful resection and death. Actual reimbursement levels were used to estimate costs, published literature to estimate duration of 2nd line treatment. The analysis assumes a life ‑ time horizon; uncertainty was limited by performing one ‑ way and probabilistic sensitivity analyses. Analysis outcomes are life‑years gained (LYG) and quality‑adjusted life‑years (QALYs).Results:
Panitumumab + mFOLFOX6 is more effective and more costly in 1st line patients with wild‑type RAS mCRC. Incremental costs per QALY are 837,270 CZK, per LYG 615,022 CZK; however, below the willingness‑to‑pay threshold applied in the Czech Republic.Conclusions:
Panitumumab + mFOLFOX6 is cost‑effective in 1st line treatment of patients with wild‑type RAS mCRC compared to bevacizumab + mFOLFOX6 in the Czech setting.Key words:
cost‑effectiveness – panitumumab – bavacizumab – colorectal cancer
Co-author of the article Jandova P. is employed with Amgen s. r. o., Prague. She did not participate in the creation and validation of models, modeling and interpretation of results.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
22. 6. 2015Accepted:
28. 7. 2015
Autori: J. Fínek 1; J. Skoupá 2; P. Jandová 3
Pôsobisko autorov: Onkologická a radioterapeutická klinika LF UK a FN Plzeň 1; Medicínské datové centrum, 1. LF UK v Praze 2; Amgen s. r. o., Praha 3
Vyšlo v časopise: Klin Onkol 2015; 28(4): 265-272
Kategória: Původní práce
doi: https://doi.org/10.14735/amko2015265Súhrn
Východiska:
Farmakoekonomická hodnocení jsou součástí rozhodovacího procesu nejen v systému stanovení úhrady, ale i v klinické praxi. Předložená farmakoekonomická analýza hodnotí panitumumab + mFOLFOX6 oproti režimu bevacizumab + mFOLFOX6 v 1. linii léčby u pacientů s metastatickým kolorektálním karcinomem (metastatic colorectal cancer – mCRC) s expresí nemutovaného typu (wild‑type) onkogenu RAS v podmínkách České republiky.Materiál a metody:
Adaptovaný Markovův model vychází z perspektivy plátce zdravotního pojištění, klinická data (účinnost, utilizace zdravotní péče a výskyt nežádoucích účinků) z přímého srovnání ve studii PEAK. Pacienti se v modelu nacházejí v jednom z následujících stavů: bez progrese s léčbou, progrese (s/ bez léčby), resekce metastáz, stav po úspěšné resekci a smrt. Aktuální výše úhrady byla použita pro odhad nákladů, literární data pro odhad délky následné léčby. Utility vychází z klinických studií s panitumumabem v 1. – 3. linii léčby. Analýza uvažuje celoživotní horizont, nejistota byla limitována jednocestnou a pravděpodobnostní analýzou senzitivity. Parametr přínosu je rok zachráněného života (life-year gained – LYG) a rok života v plné kvalitě (quality-adjusted life-year – QALY).Výsledky:
Panitumumab + mFOLFOX6 je účinnější a nákladnější než bevacizumab + mFOLFOX6 u pacientů s mCRC a wild‑type RAS v 1. linii léčby. Inkrementální náklady na QALY jsou 837 270 Kč, na LYG 615 022 Kč. Propočtené náklady leží pod hranicí ochoty platit v České republice.Závěr:
Režim panitumumab + mFOLFOX6 je nákladově efektivní intervencí oproti režimu bevacizumab + mFOLFOX6 v 1. linii wild‑type RAS mCRC.Klíčová slova:
nákladová efektivita – panitumumab – bevacizumab – kolorektální karcinomVýchodiska
Kolorektální karcinom (colorectal cancer – CRC) je druhou nejčastější malignitou u mužů v ČR a představuje tak závažný medicínský a ekonomický problém. Z celkového počtu je 20 – 25 % diagnostikováno v metastatickém stadiu [1]. Panitumumab a bevacizumab jsou součástí doporučených režimů v 1. linii léčby [2]. V roce 2014 byla publikována studie PEAK, což byla randomizovaná otevřená multicentrická studie fáze II [3]. Zahrnuti byli pacienti s metastatickým kolorektálním karcinomem (metastatic colorectal cancer – mCRC) a ECOG (Eastern Cooperative Oncology Group) skóre 0 nebo 1, s histologicky nebo cytologicky potvrzeným adenokarcinomem kolon nebo rekta a neoperabilními metastázami, s nemutovaným exonem 2. genu KRAS (kodóny 12 a 13) a min. 1 lézí o velikosti nejméně 20 mm. Z celkového počtu 285 randomizovaných pacientů bylo léčeno 278, a to buď panitumumabem + mFOLFOX6, nebo bevacizumabem + mFOLFOX6. Léčba byla podávána do progrese onemocnění nebo projevů nezvládnutelné toxicity. Primárním cílem sledování byla doba do progrese (progression free survival – PFS), sekundárními cíli celkové přežití (overall survival – OS) a bezpečnost. Podskupina s wild‑type RAS zahrnovala celkem 170 pacientů. Medián PFS byl 13,0 měsíce (panitumumab + mFOLFOX) a 9,5 měsíce (bevacizumab + mFOLFOX). Medián OS byl 41,3 vs. 28,9 měsíce ve prospěch režimu s panitumumabem.
Cílem této farmakoekonomické analýzy je zhodnotit náklady a přínosy léčby panitumumabem v kombinaci s mFOLFOX6 oproti terapii bevacizumabem v kombinaci s mFOLFOX6 v 1. linii léčby pacientů s mCRC a wild‑type RAS exonu 2 na základě studie PEAK.
Materiál a metody
Farmakoekonomické hodnocení bylo provedeno z hlediska plátce zdravotního pojištění, tedy úhrady zdravotní péče. Náklady a přínosy jsou v modelu diskontovány 3 % ročně, což odpovídá metodice schválené v ČR [4]. Vzhledem k charakteru onemocnění byl zvolen doživotní časový horizont. Představuje tak období od zahájení 1. linie léčby až do úmrtí. Model předpokládá, že toto období nepřekročí délku 20 let.
Cílovou populaci v analýze představují dospělí pacienti s mCRC a wild‑type RAS, kteří dosud nebyli léčeni pro mCRC. Charakteristika hodnocené i komparativní kohorty odpovídá populaci ze studie PEAK.
Pro analýzu nákladové efektivity byl adaptován Markovův model s dvoutýdenními cykly. Struktura modelu je uvedena na obr. 1. Pacienti vstupují do Markovova modelu ve stavu „bez progrese“ (progression free) a jsou léčeni jednou z hodnocených terapií až do progrese choroby. Pokud dojde ke zmenšení metastáz do operabilního stavu, přechází pacient do stavu „pokus o resekci metastáz“ (attempted resection of metastases). Po úspěšné resekci metastáz přechází pacienti do stavu „bez onemocnění po resekci metastáz“ (disease free after metastases resection), kde setrvává až do relapsu, kde pak přechází do stavu „progrese onemocnění: po resekci a relapsu“ (progressive disease: after resection and relapse). U pacientů, u kterých nebyla provedena resekce, nebo v případě neúspěšného operačního výkonu, přechází kohorta postupně do stavu progrese. Při progresi choroby je uvažována buď další linie chemoterapie (treat with subsequent active therapy), nebo BSC (best supportive care) – nejlepší podpůrná léčba (treat with BSC). Pokud nastane progrese při aktivní 2. linii léčby, pacient přechází do stavu „léčba BSC“. Do stavu „smrt“ (death) může pacient přejít z kteréhokoli výše popsaného stavu. Následná léčba zahrnovala anti‑EGFR + FOLFIRI nebo bevacizumab + FOLFIRI nebo BSC. Distribuce režimů 2. linie léčby v modelu vychází ze studie PEAK a dále pak z dalších publikovaných dat [5,6]. Délka léčby ve 2. linii léčby odpovídá PFS uvedené v literatuře [5,6], přičemž medián PFS byl převeden na průměrné hodnoty při předpokládané exponenciální distribuci. Léčba 2. linie neovlivňovala OS v modelu (OS pro hodnocenou a komparativní kohortu vycházel ze studie PEAK), ale měla vliv na náklady a kvalitu života (utility).
Obr. 1. Struktura Markovova modelu. 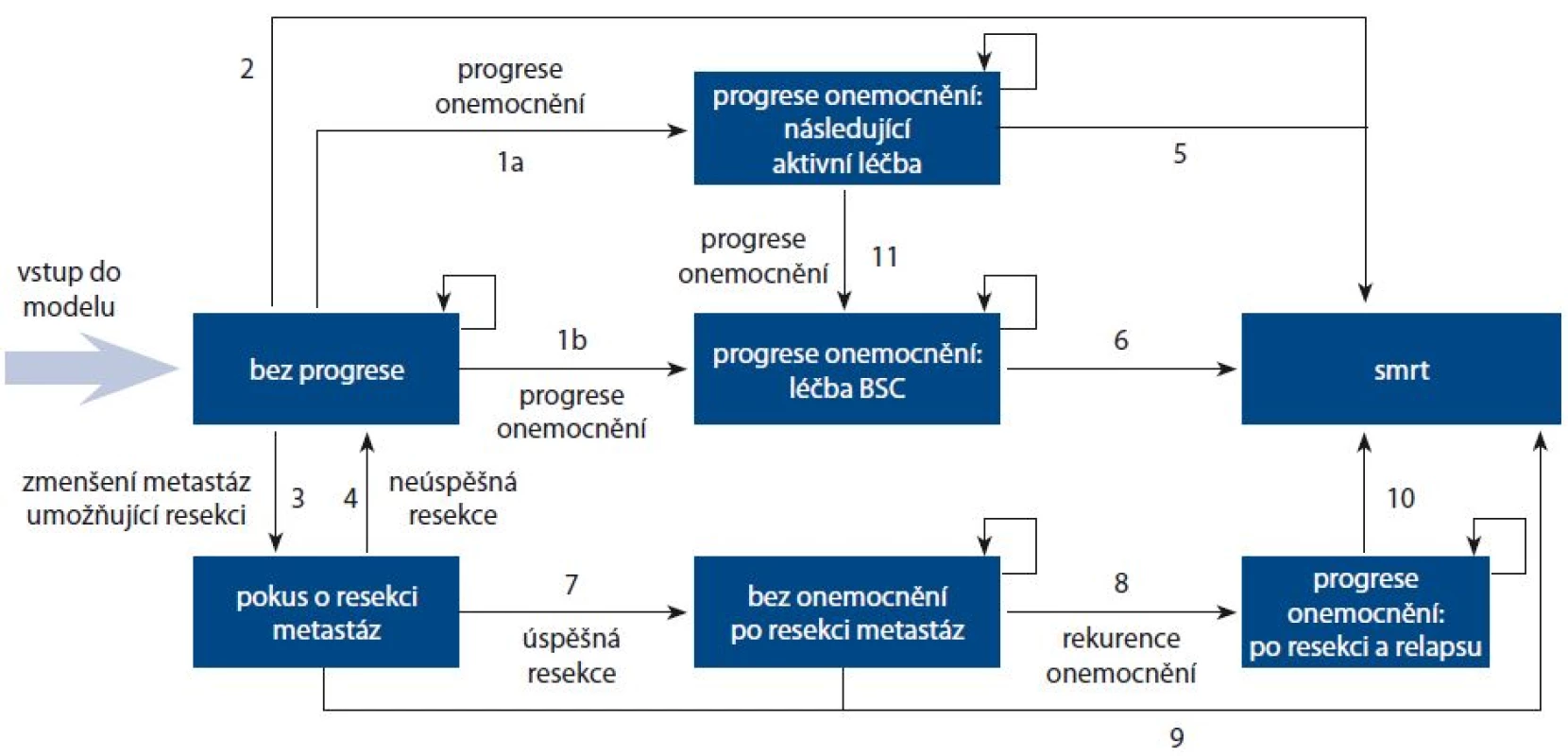
BSC – nejlepší podpůrná péče Přechodové pravděpodobnosti mezi jednotlivými stavy v modelu byly založeny na výsledcích studie PEAK. Ta sledovala především PFS a OS, tedy pravděpodobnost přechodu do stavu „progrese onemocnění“ a „smrt“. Vzhledem k absenci dat za horizont studie PEAK bylo nutné provést extrapolaci dat v horizontu modelu (tedy celoživotním). Parametrické křivky přežívání byly vytvořeny s použitím tří typů rozdělení: exponenciálního, Weibullova a log ‑ logistického. Všechny pracují s četností rizika; pokrývají možné změny v četnosti rizika OS a PFS v čase. Křivka založená na Weibullově rozdělení vykazuje nejvyšší shodu na základě grafických metod překrývání křivek a Kaplan ‑ Maierova (KM) diagramu a výpočtu AIC (Akaike‘s information criterion). Také v případě dlouhodobé projekce dat (za časovou hranici studie PEAK) vykazovala tato křivka nejpravděpodobnější frekvence pacientů po 300 a 600 týdnech od zahájení léčby (5,75 a 11,50 let). Projekce založené na ostatních dvou distribucích předpokládaly nerealisticky vysoké frekvence přežívání. Weibullovo rozložení je proto použito v základním scénáři analýzy jak pro PFS, tak i OS.
Přechodové pravděpodobnosti vztahující se k resekci byly rovněž odvozeny ze studie PEAK, kde ve skupině panitumumabu bylo operováno 13,6 % pacientů s úspěšností 66,7 % a ve skupině bevacizumabu 11 % pacientů s úspěšností 77,8 %. Průměrná doba do resekce pro vybranou populaci wild‑type RAS činila 27,1 týdne. Data o PFS a OS pro pacienty s úspěšnou resekcí vycházejí z dostupné literatury [7].
Přechodové pravděpodobnosti ve 2. linii léčby a BSC byly vypočteny jako vážený průměr PFS každé modelované terapie. Po progresi onemocnění při jakémkoli typu následné léčby 2. linie přecházejí pacienti v modelu doživotně na léčbu BSC. Vstupní parametry do modelu, specifické pro jednotlivé skupiny, jsou uvedeny v tab. 1.
Tab. 1. Vstupní parametry podle linií léčby. 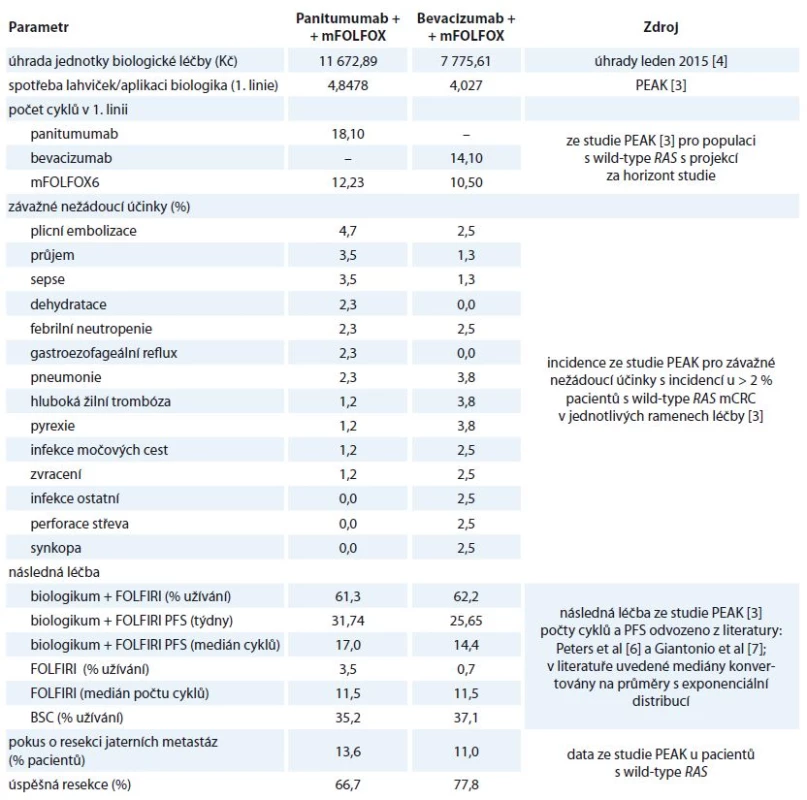
PFS – přežití bez progrese, BSC – nejlepší podpůrná péče Přímé zdravotní náklady jsou založeny na úhradách léků platných v lednu 2015 [4]. Náklady na výkony vycházejí z Vyhlášky 421/ 2013 (MZ ČR) [8], náklady na hospitalizaci z DRG (metodický materiál pro rok 2014) [8]. Část nákladových položek byla převzata z pravomocných správních řízení Státního ústavu pro kontrolu léčiv v podobných indikacích. Náklady jsou uvedeny v Kč.
Předpokládaný počet lahviček panitumumabu a bevacizumabu na jednu aplikaci vychází z dávkování ve studii PEAK. Počet upotřebených lahviček je kalkulován se „zbytkem a tolerancí“, tj. zbytek v lahvičce není sdílen dalším pacientem a tolerance představuje 30 mg; pokud do potřebné dávky pro pacienta chybí více, je otevřena další lahvička, jejíž zbytek je neupotřeben. Náklady na ostatní léky (FOLFOX v 1. linii a FOLFIRI v linii další) jsou počítány beze zbytků, je tedy předpokládáno „sdílení“ obsahu balení dalšími pacienty.
Chemoterapie je podávána každé dva týdny, návštěvy onkologa jednou měsíčně a vyšetření počítačovou tomografií jednou za osm týdnů, což odpovídá frekvenci ve studii PEAK. Přehled nákladů je uveden v tab. 2.
Tab. 2. Nákladové parametry v modelu (v Kč), hodnoty utilit. 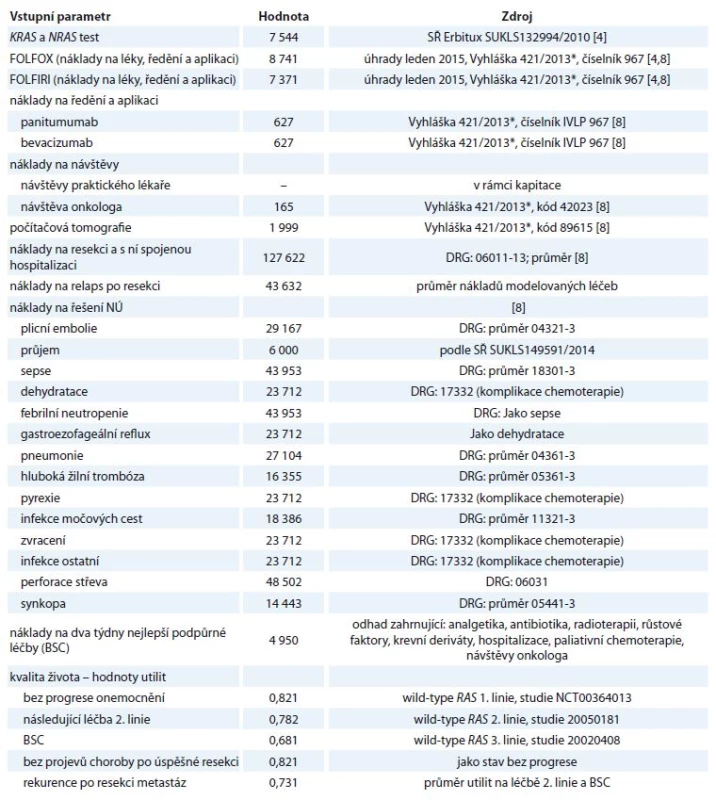
NÚ – nežádoucí účinky, BSC – nejlepší podpůrná péče, *MZ ČR Součástí nákladů na léčbu jsou i náklady na léčbu nežádoucích účinků (NÚ), jejichž frekvence jsou odvozeny ze studie PEAK. Zohledněny jsou pouze NÚ stupně ≥ 3, které jsou řešeny při hospitalizaci. Zvládnutí NÚ stupně 1 a 2 model předpokládá bez signifikantních nákladů pouze odložením další dávky či přechodným přerušením léčby.
Utility odpovídají kvalitě života v jednotlivých cyklech a nabývají hodnot v rozmezí „0“ (smrt) až „1“ (plné zdraví). Ve studii PEAK nebyla kvalita života sledována, proto jsou utility odvozené z jiných studií se srovnatelnou populací a linií léčby za použití Dolanova algoritmu [9]. Model předpokládá, že utility u pacientů s wild‑type KRAS a wild‑type RAS jsou podobné. U stavu „bez projevů onemocnění po úspěšné resekci“ model předpokládá shodnou utilitu se stavem „bez progrese“ a při rekurenci onemocnění pak předpokládá průměrnou hodnotu utility mezi stavem „následující aktivní léčba“ a „léčba BSC“. V modelu použité hodnoty utilit jsou uvedeny v tab. 2.
Výsledky jsou uvedeny jako inkrementální poměr nákladů a přínosů (incremental cost‑effectiveness ratio – ICER). Přínosem je rok života v plné kvalitě (quality adjusted life‑year – QALY) a rok zachráněného života (life‑years gained – LYG). Princip propočtu ICER vychází z předpokladu, že současná standardní léčba (tedy bevacizumab + mFOLFOX6 v tomto případě) generuje určité přínosy (LYG a QALY), ale i náklady. Hodnocená alternativní intervence (v tomto případě panitumumab + mFOLFOX6) vede k vyšším přínosům i nákladům. ICER potom propočítává inkrement nákladů na každý další dosažený inkrement přínosů (LYG a QALY) podle vzorce:
Výsledky
Farmakoekonomické modelování nákladů a přínosů panitumumabu ++ mFOLFOX6 v porovnání s bevacizumabem + mFOLFOX6 u pacientů s mCRC a wild‑type onkogenem RAS v 1. linii léčby prokázalo, že hodnocený režim (panitumumab + mFOLFOX6) generuje v celoživotním horizontu vyšší náklady i vyšší přínosy. Odhad OS (diskontovaného 3 % ročně) v modelu je 3,69 roku pro pacienty léčené panitumumabem a 2,80 roku pro pacienty léčené bevacizumabem. Diskontovaná hodnota QALY (zohledňující délku i kvalitu přežití) je pro panitumumab 2,75 QALY a bevacizumab 2,10 QALY. Výsledky deterministického scénáře jsou uvedeny v tab. 3. Největší část nákladů představuje biologická léčba (69 – 73 % v obou skupinách), další významnou položkou jsou náklady na BSC (13 % v obou skupinách). Vyšší náklady u hodnocené intervence jsou dané delším PFS a vyššími náklady BSC v této skupině v souvislosti s delším přežitím. Kalkulované inkrementální náklady/ QALY jsou 837 270 Kč, inkrementální náklady na rok zachráněného života (LYG) jsou 615 022 Kč.
Tab. 3. Výsledky deterministického modelování (celoživotní horizont). 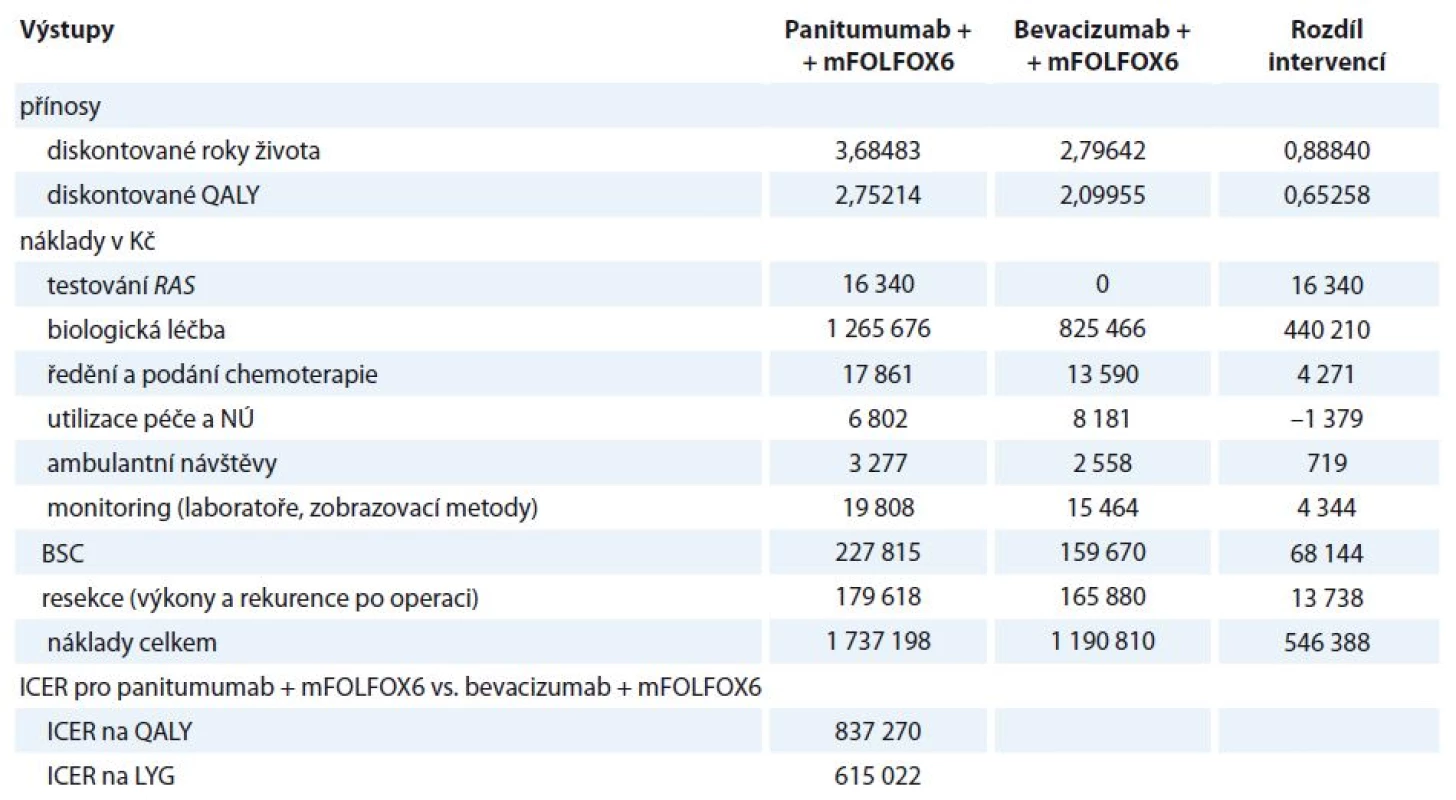
QALY – rok života v plné kvalitě, LYG – rok zachráněného života, ICER – inkrementální poměr nákladů a přínosů, NÚ – nežádoucí účinky, BSC – nejlepší podpůrná péče Diskuze
Model hodnotil nákladovou efektivitu panitumumabu + mFOLFOX6 proti bevacizumabu + mFOLFOX6 u pacientů s mCRC a wild‑type RAS v 1. linii léčby.
Výsledky prokazují, že hodnocený režim (panitumumab + mFOLFOX6) je v českém prostředí nákladově efektivní oproti komparátorovi; celoživotní inkrementální náklady na LYG jsou 615 022 Kč, náklady na získané QALY 837 270 Kč.
Každý zdravotní systém hodnotí, zda jsou inkrementální náklady na daný výstup akceptabilní, a tím možno hodnocenou intervenci hradit z veřejných prostředků. Světová zdravotnická organizace doporučuje pro země s nižší úrovní ekonomiky trojnásobek HDP/ obyvatele za akceptabilní hranici nákladové efektivity. Pro českou ekonomiku to představuje hranici přibližně 1 mil. Kč/ QALY jako hranici nákladově efektivní intervence. Panitumumab je tedy v porovnání s bevacizumabem u této skupiny pacientů na základě modelování nákladově efektivní.
Ekonomické analýzy jsou zatíženy značnou mírou nejistoty. Nejistota je dána jednak strukturou modelu, který extrapoluje matematickými metodami data z klinických studií za rámec horizontu jejich trvání, jednak kombinací řady klinických dat používaných v modelu.
Analýza senzitivity, testující robustnost výsledků základního scénáře, je proto nedílnou součástí ekonomických analýz.
Jednou z možností testování robustnosti je pravděpodobnostní (probabilistická) analýza, která modeluje ≥ 1 000 pacientů s různými vstupními hodnotami v určitém rozmezí, resp. statistickém rozložení. V rámci probabilistické analýzy senzitivity (probabilistic sensitivity analysis – PSA) model provedl 10 000 iterací (graf 1). Výsledek byl robustní (výsledky byly koncentrovány kolem určité průměrné hodnoty) s malou variací oproti použití průměrných hodnot v základním scénáři popsaném výše.
Graf 1. Výsledky pravděpodobnostní analýzy senzitivity (parametr efektivity QALY). 
Na základě modelace individuálních pacientů potom lze sestrojit křivku (cost‑effectiveness acceptability curve – CEAC), která označuje, jaký podíl pacientů (vertikální osa) je nákladově efektivní při jednotlivých hodnotách hranice ochoty platit (horizontální osa). V případě této adaptace modelu je 63 % iterací (tedy léčených pacientů) v pásmu do 1 mil. Kč, tedy nákladově efektivních (graf 2).
Graf 2. CEAC panitumumab vs. bevacizumab (parametr efektivity QALY). 
Navíc jsme provedli testování citlivosti výsledků na změnu jednotlivých parametrů v modelu, a to zkrácení časového horizontu na 10 let, sdílení lahviček obou posuzovaných přípravků, změny parametrického rozložení a diskontace. Ve všech případech se prokázala robustnost výsledku, ve všech modelacích zůstal panitumumab nákladově efektivní (tab. 4).
Tab. 4. Změna nastavení modelu; výsledky ICER. 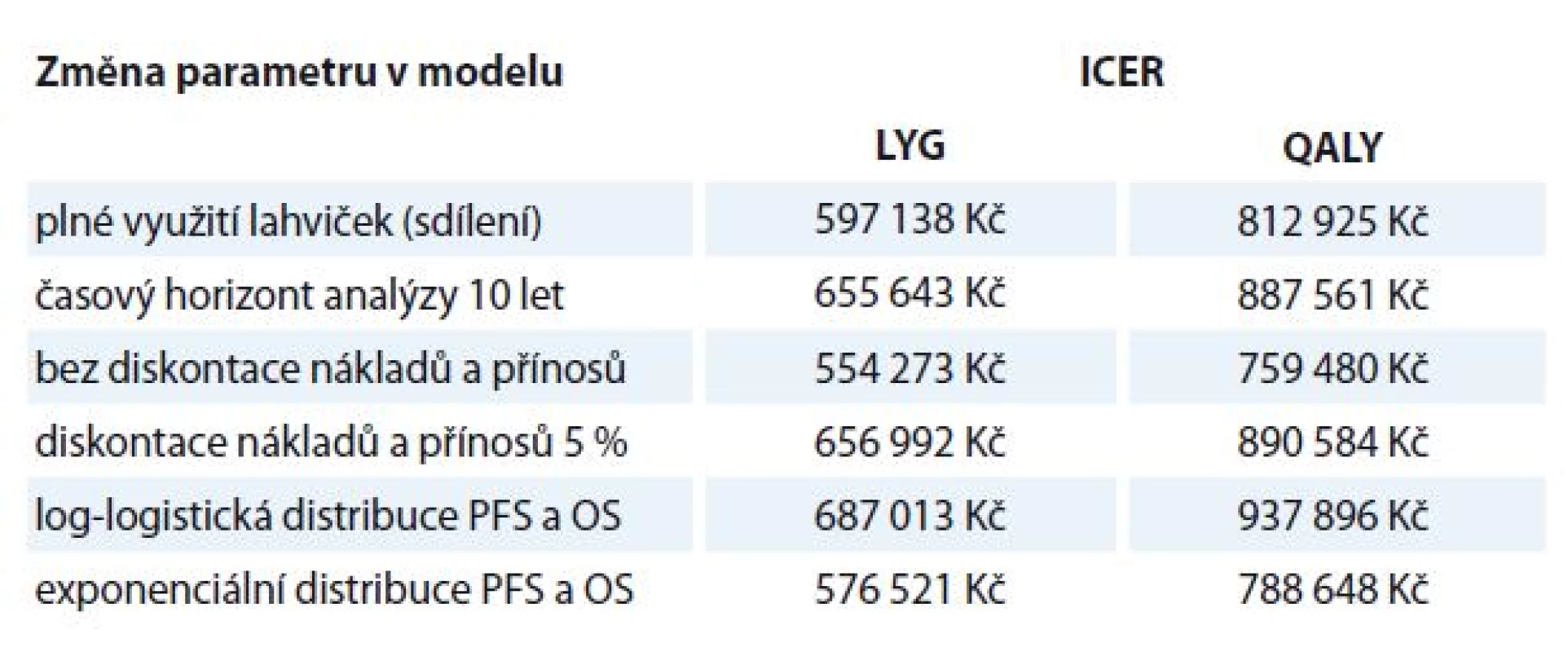
LYG – rok zachráněného života, QALY – rok života v plné kvalitě, ICER – inkrementální poměr nákladů a přínosů, PFS – přežití bez progrese, OS – celkové přežití Stejně jako všechny ekonomické modely vykazuje i předložená analýza řadu limitací. Výchozí studie PEAK je studií fáze II s menším počtem zařazených pacientů (n = 170 v podskupině) v porovnání se studiemi fáze III. Nicméně v rámci primárního cíle sledování (PFS) bylo zjištěno signifikantní prodloužení doby do progrese (13 vs. 9,5 měsíce; p = 0,029). Pro OS byl rovněž zjištěn pozitivní trend ve prospěch panitumumabu (41,3 vs. 28,9 měsíce; p = 0,058). V rámci pravděpodobnostní analýzy senzitivity byly tyto nižší počty zařazených pacientů zohledněny modelací v relativně širokém rozmezí průměrných hodnot při zachování nákladové efektivity hodnoceného režimu.
Další limitace vychází z designu klinické studie, jejímž primárním cílem je doba do progrese. Přežívání v modelu je tedy do značné míry modelováno a nemusí tak plně odpovídat reálné klinické praxi. V základním scénáři bylo zvoleno Weibullovo rozložení, které graficky i kalkulací AIC vykazuje nejlepší shodu s KM diagramem. Pro limitaci této parametrické nejistoty modelu jsme proto použili i jiná rozložení (log‑logistické a exponenciální), bez signifikantního ovlivnění výsledku.
Současná léčebná doporučení ESMO (European Society for Medical Oncology) dělí nemocné s mCRC do čtyř klinicky definovaných skupin dle záměru léčby. Skupinou 0 jsou mínění nemocní s primárně R0 resekabilními plicními či jaterními metastázami. Skupinou 1 pak nemocní s potencionálně resekabilními metastázami, léčení s kurativním záměrem. Ve skupině 2 jsou vedeni nemocní s diseminovaným onemocněním a technicky (či pravděpodobně) neresekovatelným onemocněním, kdy je doporučován chemoterapeutický dublet s cíleným agens, ve skupině 3 pak nemocní s nikdy neresekovatelným onemocněním, kdy léčebným záměrem není rychlé zmenšení nádoru a tito nemocní jsou určení k sekvenční minimálně intenzivní léčbě. Studie PEAK a tato analýza zahrnuje nemocné skupin 1 a 2.
Na základě výše uvedených skutečností a předložených výsledků se vyšší náklady spojené s léčbou panitumumab + mFOLFOX6 režimem jeví v českém prostředí jako účelně vynaložené oproti léčbě bevacizumab + mFOLFOX6 u pacientů s mCRC a wild‑type RAS.
Prohlášení o střetu zájmů:
Spoluautorka článku Jandová P. je zaměstnanec společnosti Amgen s. r. o., Praha a nepodílela se na tvorbě a validaci modelu, modelování a interpretaci výsledků.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 22. 6. 2015
Přijato: 28. 7. 2015
MUDr. Jana Skoupá, MBA
Medicínské datové centrum
1. LF UK v Praze
Studničkova 7
128 20 Praha 2
e-mail: jana.skoupa@iol.cz
Zdroje
1. Svod.cz [internetová stránka]. Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika; [aktualizováno 13. července 2014; citováno 21. března 2015]. Dostupné z: http:/ / www.svod.cz.
2. Linkos. cz [internetová stránka]. Modrá kniha České onkologické společnosti ČLS JEP, Česká republika [aktualizováno 1. března 2015; citováno 21. března 2015]. Dostupné z: http:/ / www.linkos.cz/ files/ modra ‑ kniha/ 13.pdf.
3. Schwartzberg LS, Rivera F, Karthaus M et al. PEAK: a randomized, multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin, and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated, unresectable, wild ‑ type KRAS exon 2 metastatic colorectal cancer. J Clin Oncol 2014; 32(21): 2248 – 2247. doi: 10.1200/ JCO.2013.53.2473.
4. SUKL.cz [internetová stránka]. Státní ústav pro kontrolu léčiv; [aktualizováno 1. února 2013; citováno 21. března 2015]. Dostupné z: http:/ / www.sukl.cz/ file/ 73935_1_1a http:/ / www.sukl.cz/ file/ 79359_1_1.
5. Peeters M, Price T, Hotko Y et al. Randomized phase 3 study of panitumumab with FOLFIRI vs. FOLFIRI alone as second‑line treatment in patients with metastatic colorectal cancer. J Clin Oncol 2010; 28(31): 4706 – 4713. doi: 10.1200/ JCO.2009.27.6055.
6. Giantonio BJ, Catalano PJ, Meropol NJ et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol 2007; 25(12): 1539 – 1544.
7. Adam R, Delvart V, Pascal G et al. Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long‑term survival. Ann Surg 2004; 240(4): 644 – 657.
8. MZCR.cz [internetová stránka]. Ministerstvo zdravotnictví České republiky; [aktualizováno 20. prosince 2013 a 16. dubna 2014; citováno 21. března 2015]. Dostupné z: http:/ / www.mzcr.cz/ dokumenty/ vyhlaska ‑ c421/ 2013 – sb ‑ _8573_1154_3.html a http:/ / www.mzcr.cz/ dokumenty/ metodicke ‑ materialy ‑ 2014_8590_1058_3.html.
9. Dolan P. Modeling valuations for EuroQol Health States. Med Care 1997; 35(11): 1085 – 108.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Moderní nanomedicína v léčbě karcinomů plic
- Potenciál volné cirkulující DNA v diagnostice nádorových onemocnění
- Možnosti inhibice receptoru pro epidermální růstový faktor u karcinomu anu
- Analýza nákladové efektivity porovnávající panitumumab plus mFOLFOX6 a bevacizumab plus mFOLFOX6 v první linii metastatického kolorektálního karcinomu s expresí nemutovaného typu onkogenu RAS – adaptace modelu na podmínky České republiky
- Odhadovaná glomerulární filtrace u onkologických pacientů před chemoterapií cisplatinou
- Incidencia a prognostický význam známych genetických aberácií u pacientov s diagnózou akútnej myeloblastovej leukémie – dvojročná štúdia
- Extraoseální Ewingův sarkom, primární postižení děložního čípku – kazuistika
- Embryonálne tumory s mnohovrstvovými rozetami – vzácne tumory centrálneho nervového systému v detskom veku
- Antikoagulační léčba a trombembolizmus při léčbě bevacizumabem – opatrnost, či obavy?
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Domácí parenterální výživa v onkologii
- Aktuality z odborného tisku
- Plicní fibróza po oxaliplatině
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Extraoseální Ewingův sarkom, primární postižení děložního čípku – kazuistika
- Domácí parenterální výživa v onkologii
- Embryonálne tumory s mnohovrstvovými rozetami – vzácne tumory centrálneho nervového systému v detskom veku
- Potenciál volné cirkulující DNA v diagnostice nádorových onemocnění
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




