-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv předoperační radiochemoterapie na hustotu CD8+ tumor infiltrujících lymfocytů adenokarcinomu rekta
Changes in the CD8+ Density of Tumor Infiltrating Lymphocytes after Neoadjuvant Radiochemotherapy in Patients with Rectal Adenocarcinom
Background:
The goal of this study is to examine the effect of neoadjuvant radiochemotherapy on the density of CD8+ tumor infiltrating lymphocytes (TILs) in endoscopical biopsies and resection specimens from patients with rectal adenocarcinoma before and after therapy.Patients and Methods:
In total, 53 patients with locally advanced rectal cancer were studied.Results:
The median density of CD8+ TILs in pretreatment biopsies was 12 (1 – 232) and that in surgical specimens after radiochemotherapy was 18 (1 – 319). During radiochemotherapy, the density of CD8+ TILs increased in 30 patients (57%), decreased in 18 (34%), and did not change in one. It was not possible to assess the dynamics of CD8+ TILs density in four patients. The increased density of CD8+ TILs after radiochemotherapy was associated with a median survival rate 2.5 times longer than that associated with no increase in density.Conclusion:
In the present study, the density of CD8+ TILs in endoscopical biopsies before radiochemotherapy, the density in resection specimens after radiochemotherapy, or in changes in the density after radiochemotherapy showed no predictive or prognostic significance. However, studying a larger number of patients may show that CD8+ TILs density is of predictive or prognostic significance.Key words:
rectal adenocarcinoma – preoperative treatment – radiochemotherapy – immunoscore – CD8+ tumor infiltrating lymphocytes
This study was supported by project PRVOUK P37/01 and PRVOUK P37/11.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
5. 11. 2015Accepted:
9. 1. 2016
Autori: D. Buka 1; J. Dvořák 2
; V. Sitorová 3; J. Hátlová 3; I. Richter 4; I. Sirák 1
Pôsobisko autorov: Klinika onkologie a radioterapie LF UK a FN Hradec Králové 1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha 2; Fingerlandův ústav patologie, LF UK a FN Hradec Králové 3; Oddělení klinické onkologie, Krajská nemocnice Liberec, a. s. 4
Vyšlo v časopise: Klin Onkol 2016; 29(3): 204-209
Kategória: Původní práce
doi: https://doi.org/10.14735/amko2016204Súhrn
Východiska:
Cílem této studie je retrospektivně zhodnotit imunomodulační účinek předoperační radiochemoterapie lokálně pokročilého karcinomu rekta imunohistochemickým vyšetřením hustoty CD8+ tumor infiltrujících lymfocytů (TIL) v endobiopsii před předoperační radiochemoterapií a u stejných pacientů v chirurgickém resekátu po předoperační radiochemoterapii.Pacienti a metody:
Do studie bylo zařazeno 53 pacientů s lokálně pokročilým adenokarcinomem rekta léčených předoperační radiochemoterapií.Výsledky:
Medián hustoty CD8+ TIL v endobiopsii před radiochemoterapií činil 12 (1 – 232) CD8+ TIL a v chirurgickém resekátu po radiochemoterapii 18 (1 – 319) CD8+ TIL. V průběhu předoperační radiochemoterapie došlo u 30 (57 %) pacientů k nárůstu hustoty CD8+ TIL, u 18 (34 %) pacientů došlo k poklesu, u jednoho pacienta zůstala hustota CD8+ TIL zachována, u čtyř pacientů nebylo možné změnu hustoty CD8+ TIL hodnotit. Pacienti s nárůstem CD8+ TIL po radiochemoterapii měli statisticky nesignifikantní 2,5krát delší medián celkového přežití.Závěr:
V hodnoceném souboru nebyl prokázán prediktivní ani prognostický význam hustoty CD8+ TIL u pacientů léčených předoperační radiochemoterapií pro lokálně pokročilý adenokarcinom rekta, což může být způsobeno limitovaným počtem pacientů.Klíčová slova:
adenokarcinom rekta – předoperační léčba – radiochemoterapie – imunoskóre – CD8+ tumor infiltrující lymfocytyÚvod
V současné době je standardem léčby lokálně pokročilého karcinomu rekta předoperační radiochemoterapie s konkomitantním 5-fluorouracilem (5-FU) nebo kapecitabinem, radikální operace a adjuvantní chemoterapie. Alternativou u vybraných pacientů může být akcelerovaný režim předoperační radioterapie následovaný radikální operací a adjuvantní chemoterapií. Zvýšení účinnosti radiochemoterapie lokálně pokročilého karcinomu rekta se očekává od potenciace dalšími léky a individualizací léčby dle biomarkerů [1,2].
S klinickými úspěchy imunoterapie zaměřené na kontrolní body imunitní reakce je v poslední době zvýšená pozornost věnována účinkům radioterapie na buňky imunitního systému v nádorovém mikroprostředí [3,4]. V radiobiologii dochází k významnému posunu v chápání účinků radioterapie z tradičních „4R“ (reparace, repopulace, redistribuce, reoxygenace) na současné „4R + 3E“ (elimination, equilibrium, escape). Zjednodušeně řečeno to znamená, že současná radiobiologie se již nezaměřuje pouze na zlomy DNA v nádorové buňce způsobené ionizujícím zářením, ale i na účinky ionizujícího záření na okolní imunokompetentní buňky. Při poškození buňky ionizujícím zářením se do mezibuněčného prostoru uvolňuje DNA a ATP (adenosintrifosfát, energetická molekula), které by se extracelulárně vůbec neměly nacházet [5,6]. To silně přitahuje dendritické buňky, které se aktivují, migrují do lymfatických uzlin, kde aktivují naivní T lymfocyty na cytotoxické CD8+ T lymfocyty, které migrují do nádoru. Hlavním mechanizmem protinádorové imunity je likvidace nádorových buněk CD8+ T lymfocyty [7]. Dle preklinických studií se CD8+ T lymfocyty významně podílejí na účincích radioterapie v ozařovaném poli [8]. Intenzivně je také studován význam CD8+ T lymfocytů při abskopálních účincích radioterapie (účinky radioterapie na nádorová ložiska a zdravé tkáně anatomicky vzdálené od ozařovaného pole) při současné imunoterapii blokující CTLA-4 nebo PD-1 [9]. Zatímco v rozmezí let 1960 – 2014 lze v literatuře dohledat pouze 23 kazuistik abskopálních účinků samotné radioterapie, které se zpětně jeví spíše jako spontánní remise, při kombinaci radioterapie s imunoterapií zaměřenou na kontrolní body imunitního systému v posledních letech exponenciálně přibylo podrobně zdokumentovaných případů abskopálních účinků radioterapie [10,11].
V nádorovém mikroprostředí je přítomno široké spektrum buněk imunitního systému. Zatímco hojná přítomnost cytotoxických T lymfocytů, paměťových lymfocytů a TH1 lymfocytů v nádorovém mikroprostředí bývá pravidelně spojena s prodlouženým přežitím bez příznaků onemocnění (disease-free survival – DFS), nádorově specifickým přežitím (disease-specific survival – DSS) a celkovým přežitím (overall survival – OS) u primárních nádorů různých anatomických lokalit (kolorektální karcinom, melanom, karcinom prsu, plic, žaludku, jícnu, močového měchýře, pankreatu, hlavy a krku a další) i odlišných histologických typů (adenokarcinom, dlaždicobuněčný karcinom, velkobuněčný karcinom, melanom), prognostický význam B lymfocytů, NK buněk, myeloid-derived-suppressor cells (MDSC), mikrofágů, TH2, TH17 a TREG se u různých primárních nádorů a rozdílných histologických typů liší [12,13].
Francouzský imunolog prof. Jerome Galon vypracoval metodiku vyšetření CD3+ a CD8+ tumor infiltrujících lymfocytů (TIL) v invazivním okraji a v centru nádoru, nazvanou Imunoskóre. V invazivních okrajích nádoru, na rozdíl od centra nádoru, dochází k tvorbě epitelo-mezenchymového přechodu, což je spojeno s expresí specifických antigenů, rozeznatelných imunitním systémem. Lepší prognostický význam by mělo ještě současné vyšetření paměťových, antigenem aktivovaných CD45RO+ T lymfocytů a granzymu B, který spolu s perforinem tvoří hlavní obsah cytoplazmatických granul cytotoxických T lymfocytů a NK buněk. U těchto dvou vyšetření jsou však technické problémy, např. se silným šumem pozadí, které by snižovaly reprodukovatelnost těchto vyšetření při zavedení do rutinní praxe. Proto bylo do Imunoskóre zařazeno pouze vyšetření CD3+ a CD8+ TIL. Imunoskóre prokázalo prognostický význam nejprve u kolorektálního karcinomu, následně u většiny typů solidních nádorů, jak primárních nádorů, tak i viscerálních (jaterních) a mozkových metastáz. V posledních letech je diskutována možnost rozšíření stávající TNM klasifikace o Imunoskóre na TNM-I [14].
Radioterapie a chemoterapie má velmi komplexní imunomodulační účinky, které ve výsledku nemusí být vždy jen imunosupresivní [15]. Při neoadjuvantní radiochemoterapii lokálně pokročilého karcinomu rekta nelze použít metodiku Imunoskóre v předléčebné endobiopsii, protože zpravidla není dost materiálu pro posouzení všech kritérií Imunoskóre (vyšetření hustoty TIL zvlášť v invazivním okraji a zvlášť v centru nádoru), lze však alespoň hodnotit hustotu cytotoxických CD8+ T lymfocytů [12].
Cílem této práce je retrospektivně zhodnotit imunomodulační účinek předoperační radiochemoterapie lokálně pokročilého karcinomu rekta imunohistochemickým vyšetřením hustoty CD8+ TIL v endobiopsii před předoperační radiochemoterapií a u stejných pacientů v chirurgickém resekátu po předoperační radiochemoterapii.
Pacienti a metody
Soubor pacientů
Do studie bylo zařazeno 53 pacientů (38 mužů a 15 žen) s lokálně pokročilým adenokarcinomem rekta, kteří byli léčeni na Klinice onkologie a radioterapie FN Hradec Králové od února 2001 do listopadu 2006. Medián věku činil 63 (41 – 75) let. Medián předléčebné hladiny CEA byl 4,54 (0,2 – 62,39) μg/ l. Anatomická sublokalizace nádoru: dolní rektum (0 – 5 cm) 19 pacientů, střední rektum (výše než 5 – 10 cm) 28 pacientů a horní rektum (výše než 10 cm) šest pacientů. Klinická TNM klasifikace před předoperační radiochemoterapií – II. stadium 16 pacientů a III. stadium 37 pacientů.
Léčba
Předoperační radiochemoterapie sestávala z radioterapie na oblast malé pánve ze čtyř polí box technikou, lineárním urychlovačem, ložiskovou dávkou 45 Gy/ 25 frakcí/ 5krát týdně, následně boost 5,4 Gy/ 3 frakce zmenšenými poli (obr. 1), s potenciací 5-FU v dávce 200 mg/ m2/ den kontinuálně, po dobu radioterapie, s víkendovými přerušeními. Ve snaze o dosažení vysoké homogenity hodnoceného souboru nebyli do studie zařazeni pacienti léčení IMRT technikou, boostem brachyterapie nebo potenciací kapecitabinem. Všichni pacienti dokončili plánovanou dávku radioterapie. Dva pacienti nedokončili plánovanou potenciaci 5-FU z důvodu hematologické toxicity.
Obr. 1. Izodózní plán předoperační radioterapie dolního rekta T3 N0 M0. 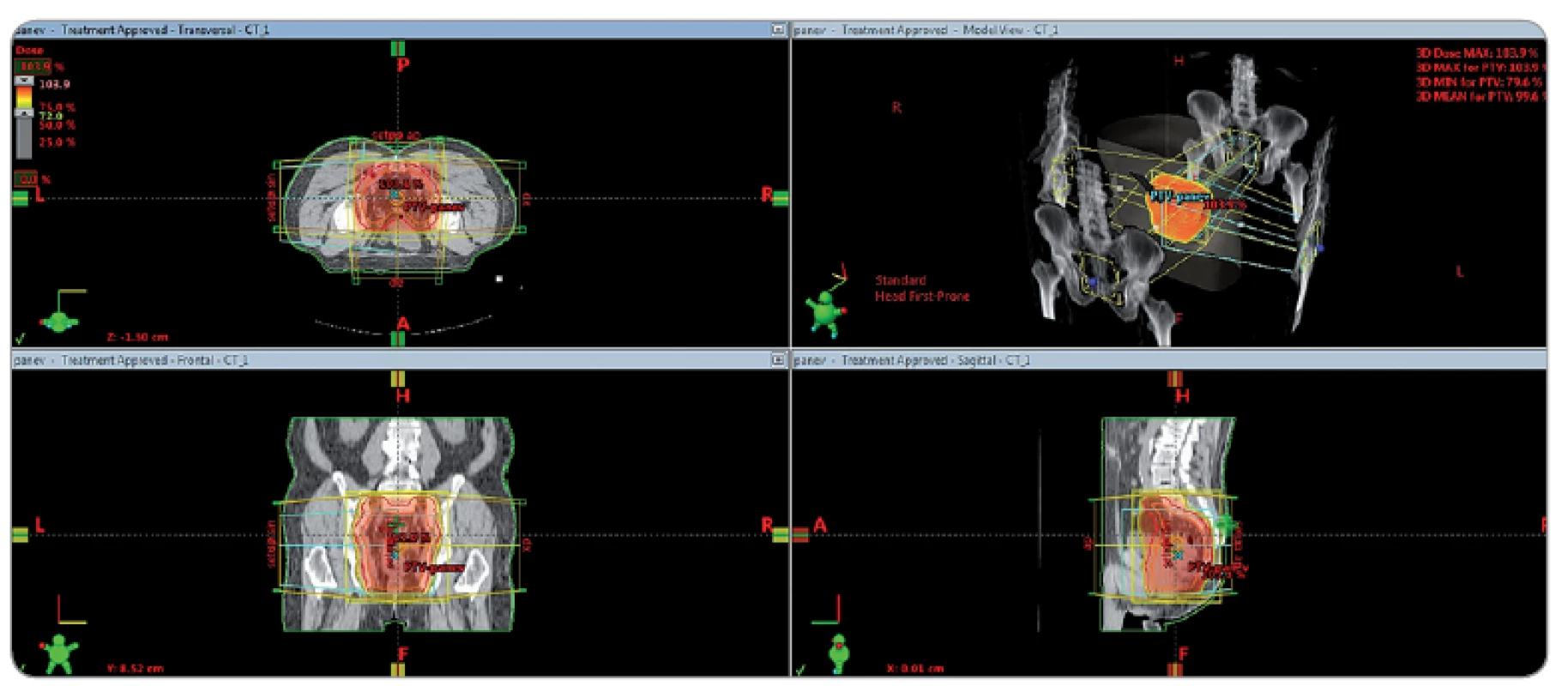
Chirurgický zákrok následoval 4 – 6 týdnů po ukončení předoperační radiochemoterapie. Po předoperační radiochemoterapii byla provedena radikální R0 resekce nádoru u 51 pacientů – radikální resekce nádoru se zachováním anu u 22 pacientů a abdominoperianální amputace rekta u 29 pacientů. Radikální resekce s mikroskopicky pozitivními okraji byla u dvou pacientů – u jednoho pacienta se zachováním anu a jednoho pacienta po abdominoperianální amputaci rekta.
Patologická TNM klasifikace po předoperační radiochemoterapii – patologická kompletní remise byla verifikována u dvou pacientů, u dalších dvou pacientů bylo nalezeno pouze mikroskopické reziduum onemocnění, I. stadium 16 pacientů, II. stadium 18 pacientů, III. stadium 12 pacientů, IV. stadium tři pacienti, u IV. stadia se ve všech případech jednalo o metastázy jater zjištěné při operaci. Downstaging činil 64 %.
Toxicita léčby radiochemoterapií byla hodnocena dle Common toxicity criteria for adverse events v4.0 (CTCAE) [16].
Metodika laboratorních vyšetření
Histologická vyšetření endobiopsie a chirurgického resekátu byla prováděna ve Fingerlandově ústavu patologie FN v Hradci Králové. Materiál byl rutinně fixován v 10% formalinu, zpracován běžnou parafinovou technikou a barven hematoxylinem-eosinem. Stanoven byl histologický typ nádoru a stupeň jeho diferenciace. U všech pacientů byl v předléčebné endobiopsii prokázán adenokarcinom rekta. Grading v endobiopsii byl u tří pacientů dobře diferencovaný, u 32 pacientů středně a u 18 pacientů málo diferencovaný. Grading v resekátu byl u tří pacientů dobře diferencovaný, u 28 pacientů středně a u 20 pacientů málo diferencovaný. K imunohistochemickému průkazu CD8+ TIL v archivních parafinových bločcích byla použita protilátka proti antigenu CD8 (obr. 2 a 3). Počet CD8+ TIL v nádorové tkáni byl hodnocen kvantitativně (počet CD8+ TIL na 1 mm2 nádoru).
Obr. 2. Nízká hustota CD8<sup>+</sup> TIL v předléčebné endobiopsii, imunohistochemická pozitivita CD8, zvětšeno 200x. 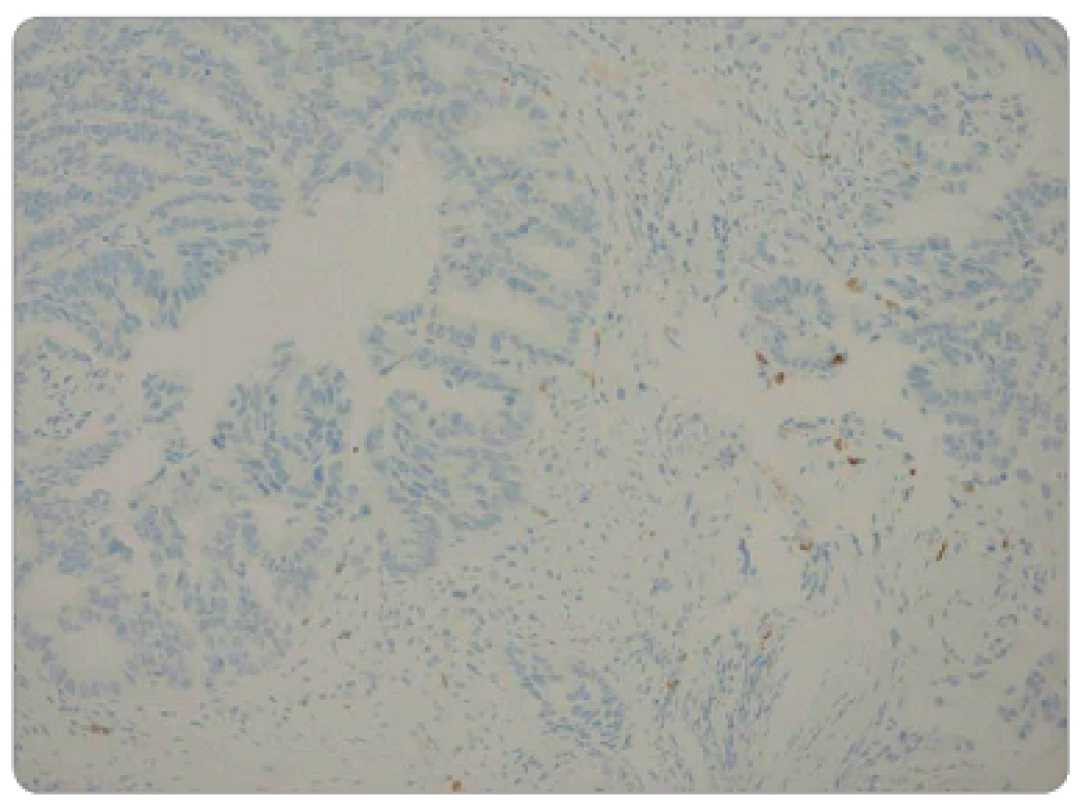
Obr. 3. Vysoká hustota CD8<sup>+</sup> TIL chirurgickém resekátu, imunohistochemická pozitivita CD8, zvětšeno 200x. 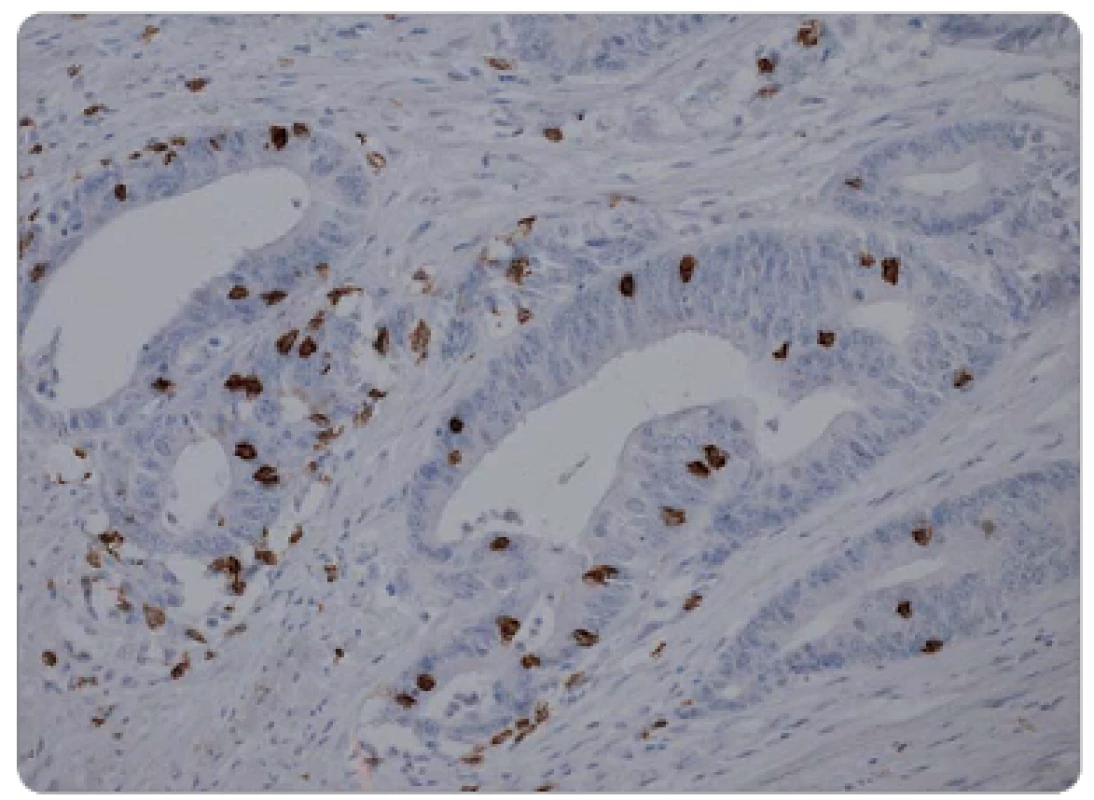
Výsledky
Medián hustoty CD8+ TIL v endobiopsii před radiochemoterapií činil 12 (1 – 232) CD8+ TIL a v chirurgickém resekátu po radiochemoterapii 18 (1 – 319) CD8+ TIL.V průběhu předoperační radiochemoterapie došlo u 30 (57 %) pacientů k nárůstu hustoty CD8+ TIL, u 18 (34 %) pacientů došlo k poklesu, u jednoho pacienta zůstala hustota CD8+ TIL zachována, u dvou pacientů nebylo možné změnu hustoty CD8+ TIL hodnotit z důvodu patologické kompletní odpovědi po radiochemoterapii. U dvou pacientů nebylo možné hustotu CD8+ TIL hodnotit z důvodu nedostatku materiálu pro imunohistochemické vyšetření (u jednoho pacienta v endobiopsii a jiného pacienta v chirurgickém resekátu). Medián doby sledování souboru byl 75 měsíců (tj. 6,3 roku) od ukončení léčby. U 24 pacientů došlo v průběhu poléčebného sledování k recidivě onemocnění, 30 pacientů v době sledování zemřelo. V době hodnocení souboru žilo 22 pacientů bez známek onemocnění a jeden pacient s recidivou onemocnění. Pětileté OS souboru činilo 56 % (95% CI 43 – 70 %) (graf 1). Nárůst hustoty CD8+ TIL po radiochemoterapii neměl signifikantní vliv na OS v Coxově regresní analýze (p = 0,16) a v log-rank testu (p = 0,16). Nesignifikantní byl také vliv nárůstu CD8+ TIL na downstaging hodnocený chí-kvadrátem (p = 0,37). Pacienti s nárůstem CD8+ TIL po radiochemoterapii měli statisticky nesignifikantní 2,5krát delší medián OS v porovnání s ostatními pacienty bez nárůstu CD8+ TIL (graf 2).
Graf 1. Doba OS pacientů s lokálně pokročilým adenokarcinomem rekta léčených předoperační radiochemoterapií ve dnech. 
Graf 2. Doba OS pacientů dle vzestupu CD8<sup>+</sup> TIL po předoperační radiochemoterapii. 
Diskuze
V hodnoceném souboru pacientů s lokálně pokročilým karcinomem rekta jsme pozorovali vzestup mediánu hustoty CD8+ TIL v chirurgickém resekátu po předoperační radiochemoterapii v porovnání s předléčebnou endobiopsií. Pacienti s nárůstem CD8+ TIL po radiochemoterapii měli 2,5krát delší medián OS, který však v našem souboru nebyl statisticky signifikantní, což je pravděpodobně způsobeno omezeným počtem 53 pacientů. Výsledky naší studie jsou ve shodě s výsledky studií na větším počtu pacientů.
V retrospektivní studii celkem 136 pacientů s lokálně pokročilým karcinomem rekta léčených předoperační samostatnou radioterapií (30 pacientů), samostatnou chemoterapií (24 pacientů) nebo konkomitantní radiochemoterapií (63 pacientů) byla imunohistochemicky vyšetřena hustota CD3+ a CD8+ TIL v endobiopsii před zahájením předoperační chemoradioterapie a v chirurgickém resekátu po předoperační radiochemoterapii. V chirurgickém resekátu po předoperační radioterapii, chemoterapii a radiochemoterapii byla statisticky významně zvýšena hustota CD3+ a CD8+ TIL v porovnání s předléčebnou endobiopsií. Přitom nebyl signifikantní rozdíl mezi jednotlivými modalitami předoperační léčby. Vysoká hustota CD3+ a CD8+ TIL v předléčebné endobiopsii predikovala dobrou léčebnou odpověď na předoperační radiochemoterapii (p = 0,033 a p = 0,021), signifikantně DFS (p = 0,010 a p = 0,022) a OS (p = 0,019 a p = 0,003). Tato studie prokázala, že předoperační radiochemoterapie karcinomu rekta může zvýšit lokální imunitní odpověď zvýšením hustoty TIL [17].
V retrospektivní studii na 276 pacientech s karcinomem kolorekta při době poléčebného sledování 14 let byl prokázán prognostický význam TIL. Exprese TIL v univariantní i multivariantní analýze byla statisticky významně spojena s delší dobou přežití bez recidivy i delší dobou OS. V této studii byla pozorována i inverzní korelace mezi přítomností TIL a TNM stadiem karcinomu kolorekta – zvýšená přítomnost TIL u časných stadií karcinomu a snížená přítomnost TIL u pokročilých stadií karcinomu [18].
V retrospektivní studii na 371 pacientech s karcinomem kolorekta byly imunohistochemicky vyšetřeny CD8+ TIL. Hustota CD8+ TIL inverzně korelovala s TNM stadiem onemocnění. V univariantní analýze byl statisticky významný rozdíl v době přežití dle hustoty CD8+ TIL teprve po 1 – 2 letech poléčebného sledování ve prospěch vyšší hustoty CD8+ TIL. V multivariantní analýze byla prokázána statisticky významně delší doba přežití při vyšší hustotě CD8+ TIL při době poléčebného sledování delší než dva roky, ale nikoliv kratší než dva roky. Hustota CD8+ TIL byla signifikantně vyšší u pacientů, kteří po léčbě žili déle než pět let [19].
Ve studii na třech nezávislých kohortách 415, 119 a 69 pacientů s I. – III. stadiem kolorektálního karcinomu byla vyšetřena hustota CD3+ TIL v centru nádoru a v jeho invazivním okraji. Byl prokázán jejich prognostický význam, pokud byly vyšetřeny pouze v centru nádoru i pokud byly vyšetřeny pouze v invazivním okraji nádoru. Nejlepší prognostickou hodnotu mělo jejich vyšetření v obou oblastech. Stejná studie prokázala signifikantně nižší počet recidiv a delší OS pacientů s vysokou hustotou CD3+, CD8+, CD45RO+ TIL a granzymu B [20].
Studie na 411 pacientech s I. a II. stadiem karcinomu kolorekta prokázala příznivý prognostický význam vysoké hustoty CD8+ a CD45RO+ TIL [21]. Studie na 599 pacientech s I. – IV. stadiem kolorektálního karcinomu ukázala, že se hustota CD8+ TIL signifikantně snižuje spolu s progresí kolorektálního karcinomu v rámci T stadia i v rámci TNM stadia [22].
Imunoskóre pozitivně koreluje s prevalencí somatických mutací v lidských nádorech [12,23]. V rámci karcinomů kolorekta ty karcinomy, které vznikly na podkladě nestability mikrosatelitů způsobené mutací některého z mismatch repair genů odpovědných za opravy replikačních chyb v DNA, jsou snáze rozeznatelné imunitním systémem, mají vyšší hustotu CD8+ TIL a méně metastazují [24]. V naší studii jsme nestabilitu mikrosatelitů nehodnotili.
Závěr
V hodnoceném souboru nebyl prokázán prediktivní ani prognostický význam hustoty CD8+ TIL u pacientů léčených předoperační radiochemoterapií pro lokálně pokročilý adenokarcinom rekta, což může být způsobeno limitovaným počtem pacientů.
Práce byla podpořena projektem PRVOUK P37/01 a PRVOUK P37/11.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. David Buka
Klinika onkologie a radioterapie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: davidbuka@seznam.cz
Obdrženo: 5. 11. 2015
Přijato: 9. 1. 2016
Zdroje
1. Dvořák J, Richter I, Buka D et al. Chemoradioterapeutická léčba lokálně pokročilých karcinomů rekta. Farmakoterapie Kolorektální karcinom 2013 : 42 – 46.
2. Richter I, Dvořák J, Bartoš J. Neoadjuvantní léčba karcinomu rekta. Onkologie 2013; 7(6): 287 – 290.
3. Pilones KA, Vanpouille-Box C, Demaria S. Combination of radiotherapy and immune checkpoint inhibitors. Semin Radiat Oncol 2015; 25(1): 28 – 33. doi: 10.1016/ j.semradonc.2014.07.004.
4. Wattenberg MM, Fahim A, Ahmed MM et al. Unlocking the combination: potentiation of radiation-induced antitumor responses with immunotherapy. Radiat Res 2014; 182(2): 126 – 138. doi: 10.1667/ RR13374.1.
5. Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift. J Natl Cancer Inst 2013; 105(4): 256 – 265. doi: 10.1093/ jnci/ djs629.
6. Demaria S, Pilones KA, Vanpouille-Box C et al. The optimal partnership of radiation and immunotherapy: from preclinical studies to clinical translation. Radiat Res 2014; 182(2): 170 – 181. doi: 10.1667/ RR13500.1.
7. Kopecký J, Slováček L, Priester P et al. Změny imunologické reaktivity u onkologických pacientů. Klin Onkol 2012; 25(2): 97 – 102. doi: 10.14735/ amko201297.
8. Lee Y, Auh SL, Wang Y et al. Therapeutic effects of ablative radiation on local tumor require CD8+ T cells: changing strategies for cancer treatment. Blood 2009; 114(3): 589 – 595. doi: 10.1182/ blood-2009-02-206870.
9. Crittenden M, Kohrt H, Levy R et al. Current clinical trials testing combinations of immunotherapy and radiation. Semin Radiat Oncol 2015; 25(1): 54 – 64. doi: 10.1016/ j.semradonc.2014.07.003.
10. Reynders K, Illidge T, Siva S et al. The abscopal effect of local radiotherapy: using immunotherapy to make a rare event clinically relevant. Cancer Treat Rev 2015; 41(6): 503 – 510. doi: 10.1016/ j.ctrv.2015.03.011.
11. Postow MA, Callahan MK, Barker CA et al. Immunologic correlates of the abscopal effect in a patient with melanoma. N Engl J Med 2012; 366(10): 925 – 931. doi: 10.1056/ NEJMoa1112824.
12. Galon J, Mlecnik B, Bindea G et al. Towards the introduction of the ‚Immunoscore‘ in the classification of malignant tumours. J Pathol 2014; 232(2): 199 – 209. doi: 10.1002/ path.4287.
13. Fridman WH, Dieu-Nosjean MC, Pagès F et al. The immune microenvironment of human tumors: general significance and clinical impact. Cancer Microenviron 2013; 6(2): 117 – 122. doi: 10.1007/ s12307-012-0124-9.
14. Galon J, Pagès F, Marincola FM et al. Cancer classification using the Immunoscore: a worldwide task force. J Transl Med 2012; 10 : 205. doi: 10.1186/ 1479-5876-10-205.
15. Soukup K, Wang X. Radiation meets immunotherapy – a perfect match in the era of combination therapy? Int J Radiat Biol 2015; 91(4): 299 – 305. doi: 10.3109/ 09553002.2014.995383.
16. National Cancer Institute [homepage on the Internet]. Common Toxicity Criteria for Adverse Events v 4.0 (CTCAE). Available from: http:/ / ctep.cancer.gov.
17. Teng F, Mu D, Meng X et al. Tumor infiltrating lymphocytes (TILs) before and after neoadjuvant chemoradiotherapy and its clinical utility for rectal cancer. Am J Cancer Res 2015; 5(6): 2064 – 2074.
18. Ropponen KM, Eskelinen MJ, Lipponen PK et al. Prognostic value of tumour-infiltrating lymphocytes (TILs) in colorectal cancer. J Pathol 1997; 182(3): 318 – 324.
19. Chiba T, Ohtani H, Mizoi T et al. Intraepithelial CD8+ T-cell-count becomes a prognostic factor after a longer follow-up period in human colorectal carcinoma: possible association with suppression of micrometastasis. Br J Cancer 2004; 91(9): 1711 – 1717.
20. Galon J, Costes A, Sanchez-Cabo F et al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 2006; 313(5795): 1960 – 1964.
21. Pagès F, Kirilovsky A, Mlecnik B et al. In situ cytotoxic and memory T cells predict outcome in patients with early-stage colorectal cancer. J Clin Oncol 2009; 27(35): 5944 – 5951. doi: 10.1200/ JCO.2008.19.6147.
22. Mlecnik B, Tosolini M, Kirilovsky A et al. Histopathologic-based prognostic factors of colorectal cancers are associated with the state of the local immune reaction. J Clin Oncol 2011; 29(6): 610 – 618. doi: 10.1200/ JCO.2010.30.5425.
23. Alexandrov LB, Nik-Zainal S, Wedge DC et al. Signatures of mutational processes in human cancer. Nature 2013; 500(7463): 415 – 421. doi: 10.1038/ nature12477.
24. Maby P, Tougeron D, Hamieh M et al. Correlation between density of CD8+ T-cell infiltrate in microsatellite unstable colorectal cancers and frameshift mutations: a rationale for personalized immunotherapy. Cancer Res 2015; 75(17): 3446 – 3455. doi: 10.1158/ 0008-5472.CAN-14-3051.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Současné možnosti predikce odpovědi na cílenou anti-EGFR léčbu metastatického kolorektálního karcinomu
- Vyhodnocení výživových zvyklostí ve studii karcinomu pankreatu
- Vliv předoperační radiochemoterapie na hustotu CD8+ tumor infiltrujících lymfocytů adenokarcinomu rekta
- Mapování psychologického distresu po 4,5 letech u pacientek s diagnózou karcinomu prsu v porovnání se zdravou populací
- Ložisková amyloidóza v dutině nosní
- Karcinoid z pohárkových buněk apendixu metastazovaný do orbity – klinická kazuistika a přehled literatury
-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Aktuality z odborného tisku
- MUDr. Eva Siracká, DrSc. – prvá dáma rádioterapie na Slovensku jubiluje
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
-
Onkologie v obrazech
Karcinom prsu s aktivní imunoeditací a aktivací imunitní kontrolní dráhy PD-L1/ PD-1 - Informace z České onkologické společnosti
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle-
Průvodce mladého onkologa infuzní terapií a výživou
Díl 3 – Hypomagnezemie a hypofosfatemie. Realimentace. Kazuistika 3 - História onkológie na Slovensku
- Diagnóza Lynchova syndromu od patologa
- Doc. MUDr. Juraj Kaušitz, CSc. – 70-ročný
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



