-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv kortikoterapie na diagnostickou výtěžnost stereotaktické biopsie u nemocných s lymfomem mozku
The Impact of Corticotherapy on the Diagnostic Yield of Stereotactic Biopsy in Patients with Brain Lymphoma
Backround:
Because of the dismal prognosis of untreated brain lymphoma early histological verification using stereobiopsy is decisive for patient with this disease. The study analysed the diagnostic yield of stereobiopsy in brain lymphoma patients with respect to prebiopsy corticosteroid administration.Patients and Methods:
Patients with brain lymphomas were identified in a group of 162 stereotactic biopsies (108 frame-based and 54 frameless) of patients harboring suspected brain tumor. Non conclusive biopsies were reevaluated to exclude the possibility of missed lymphoma.Results:
Total 9 patients (8.3%) and 4 patients (7.4%) had lymphomas in the frame-based and frameless stereobiopsy groups, resp. In 10 patients, corticosteroid treatment of perifocal brain oedema was conducted continually up until biopsy (including one patient with corticotherapy for pulmonary disease). Lesion regression was observed in 6 of these patients. Transient lesion remission was observed during corticotherapy in one patient with lesion recurrence after steroid discontinuation. In 2 patients, corticosteroids were not administered before biopsy. The results of stereobiopsy were inconclusive in 8 patients (4.9%). Before biopsy, the possibility of brain lymphoma was considered in 3 patients, but the final diagnoses were autoimmune vasculitis, histological changes after embolic events from the thrombosed pulmonary veins in pulmonary malformation and local inflammation.Conclusion:
Although the extent of brain lymphoma decreased after corticosteroid administration, corticotherapy does not exclude valid diagnostic biopsy.Key words:
brain lymphoma – stereotaxic techniques – frameless stereotaxy – stereotactic biopsy – corticosreroids
Part of the message was presented on XLI. Brno Oncological Days within the Glio Meeting and published in the form of a short abstract.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
27. 5. 2017Accepted:
2. 7. 2017
Autoři: J. Chrastina 1; M. Hermanová 2; R. Jančálek 1; V. Feitová 3; D. Hrabovský 1; Z. Novák 1
Působiště autorů: Neurochirurgická klinika LF MU a FN U sv. Anny v Brně 1; I. patologicko-anatomický ústav, LF MU a FN u sv. Anny v Brně 2; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně 3
Vyšlo v časopise: Klin Onkol 2017; 30(6): 437-442
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2017437Souhrn
Východiska:
Vzhledem k závažné prognóze neléčeného mozkového lymfomu je pro nemocného rozhodující včasná histologická verifikace. Cílem sdělení je rozbor výtěžnosti stereobiopsie u nemocných s mozkovým lymfomem především s ohledem na předoperační podávání kortikoidů.Soubor pacientů a metody:
V souboru 162 stereotaktických biopsií (108 rámových, 54 bezrámových) pro suspektní tumor mozku byli vyhledáni nemocní s verifikovaným mozkovým lymfomem. Dále byly přehodnoceny nekonkluzivní biopsie k vyloučení nezachyceného mozkového lymfomu.Výsledky:
V souboru rámových biopsií byl mozkový lymfom prokázán u 9 nemocných (8,3 %) a ve skupině biopsií bezrámových byla diagnóza mozkového lymfomu stanovena u 4 nemocných (7,4 %). Podávání kortikoidů nebylo před biopsií přerušeno u 10 nemocných (vč. nemocného s kortikoterapií pro plicní chorobu) a u 6 z nich došlo v průběhu kortikoterapie k regresi velikosti léze. U dalšího nemocného bylo při kortikoterapii pozorováno přechodné vymizení léze s recidivou po jejím přerušení. U 2 nemocných nebyla kortikoterapie před biopsií nasazena. Výsledek stereobiopsie byl nekonkluzivní u 8 nemocných (4,9 %). U 3 z nich byl před biopsií zvažován i lymfom mozku, ovšem konečné diagnózy byly autoimunitní vaskulitida, stav po opakovaných embolizacích z trombozovaných plicních žil při plicní malformaci a zánětlivé postižení.Závěr:
I když při kortikoterapii dochází k regresi mozkového lymfomu, tato léčba nevylučuje provedení diagnosticky validní stereotaktické biopsie.Klíčová slova:
mozkový lymfom – rámová stereotaxe – bezrámová navigace – stereotaktická biopsie – kortikosteroidyÚvod
Incidence primárního lymfomu centrálního nervového systému (primary central nervous system lymphoma – PCNSL) dosahuje 2–6 % veškerých nitrolebních tumorů a v současnosti se zvyšuje [1]. Jednou z příčin je zlepšený záchyt nemocných s mozkovým lymfomem díky využití moderních radiologických technik. Další příčinou je ale také vysoká četnost mozkového lymfomu u nemocných s poruchami imunity vč. iatrogenních, kdy např. u imunosuprimovaných nemocných po orgánových transplantacích dosahuje incidence mozkových lymfomů až 22 % [2], s vaskulárně kolagenními chorobami, virózou Epstein-Barrové (EB) a HIV pozitivitou (neurologické komplikace u 6 % HIV pozitivních nemocných, z toho mozkový lymfom 10–30 %) [3–5].
Radiologický obraz mozkového lymfomu při CT i MRI vyšetření je nejednoznačný a velmi variabilní – solitární masa, vícečetné léze (20–40 % nemocných), difuzní postižení mozkové tkáně (připomínající nyní již opuštěnou diagnózu gliomatosis cerebri), bilaterální subependymální infiltráty nebo leptomeningeální postižení [6–8]. Diferenciální diagnóza tedy zahrnuje celou řadu patologických procesů – gliální tumory, mozkové metastázy nebo abscesy, meningeom při leptomeningeálním postižení, zánětlivé onemocnění mozku a změny při roztroušené skleróze, sarkoidóze a vaskulitidě [3]. Možnost lymfomu výrazně podporuje redukce rozsahu tumoru až jeho vymizení po podávání kortikoidů [9].
Vzhledem k závažné prognóze neléčeného onemocnění [10] a pestré diferenciální diagnostice vyvstává do popředí nutnost včasné adekvátní histologické verifikace radiologicky prokázané léze. Výtěžnost biopsie ovlivňuje řada faktorů spojených s perioperační péčí a operačním výkonem. Zde je nutné zmínit především kortikoterapii, kterou je často nutné nasadit v rámci terapie závažného otoku mozku u mozkové expanze. Podle klasické neurochirurgické literatury ale právě kortikoterapie snižuje u nemocných s lymfomem mozku výtěžnost biopsie [11], a proto není doporučováno její zahájení před provedením biopsie [8]. Na druhé straně jiná sdělení tento negativní dopad kortikoterapie na výtěžnost biopsie nepotvrzují [12].
První částí sdělení je rozbor souboru nemocných s biopticky prokázáným mozkovým lymfomem především z hlediska vlivu kortikoidů na rozsah a radiologické charakteristiky léze. Další částí práce je rozbor skupiny nemocných s nekonkluzivní biopsií a zde bude diskutována možnost neprokázaného lymfomu mozku v této skupině. Na základě uvedených dat bude provedeno vyhodnocení efektu kortikoterapie na diagnostickou výtěžnost stereotaktické biopsie u nemocných s mozkovým lymfomem.
Soubor pacientů a metody
V letech 2006–2016 bylo na pracovišti autorů provedeno celkem 162 stereotaktických biopsií pro suspektní tumor mozku. Rámová stereotaxe (keramický rám Leibinger, systém Zamorano Dujovny, software Praezis Tatramed) byla použita u 108 nemocných a bezrámové (frameless navigační systémy BrainLab a později Scopis) u 54 nemocných. Obecně byly rámové systémy (považované za přesnější) využívány spíše pro biopsii menších a hluboko uložených lézí, zatímco systémy bezrámové u větších povrchověji uložených lézí, ovšem volba byla ovlivněna i preferencemi operujících neurochirurgů.
Co se týče provedení biopsie, u postkontrastně se sytících lézí s perifokálním hypointenzním otokem v T1W MRI byly vzorky odebírány v blízkém hypodenzním okolí sytící se léze, na jejím okraji a poté v oblasti postkontrastního sycení. V případě, že bylo vytvořeno hypointenzní centrum léze, byl bioptický vzorek odebrán i v této oblasti (vyloučení abscesu, evakuace a drenáž možné pseudocysty). V případě nehomogenně se sytících lézí nebo difuzních infiltrátů s chudým sycením byla snaha provést biopsii především v postkontrastně se sytících oblastech. Velká pozornost byla věnována vztahu plánované trajektorie pro zavedení bioptické kanyly k cévním strukturám, zvláště u lézí postihujících oblast bazálních ganglií. S odstupem několika hodin po provedené biopsii bylo vždy provedeno kontrolní CT vyšetření k vyloučení hemoragické komplikace a k lokalizaci stop po biopsii (bublinky vzduchu nebo drobná hypertenzní stopa krve v místě odběru).
Výsledky
Prvním krokem byla identifikace nemocných s biopticky prokázaným mozkovým lymfomem v celém souboru stereotaktických biopsií pro suspektní tumor mozku. Diagnóza mozkový lymfom byla stanovena u 13 nemocných (5 mužů, 8 žen; průměrný věk 73,0 roku; rozmezí 49–85 let). Ve skupině nemocných s rámovou biopsií byl mozkový lymfom prokázán v 9 případech (8,3 %). Ve skupině bezrámových biopsií byla diagnóza mozkového lymfomu stanovena u 4 nemocných (7,4 %). Nejčastěji byly postiženy subkortikální struktury bílé hmoty (4 nemocní). U 3 nemocných byla postižena oblast bazálních ganglií a u stejného počtu corpus callosum. U 2 nemocných bylo prokázáno postižení obou hemisfér mozku (bazální ganglia vpravo a subkortikální oblast vlevo u prvního a obou frontálních laloků a bazálních ganglií vlevo u druhého nemocného) a u poslední nemocné byla přítomna infiltrace prakticky celé hemisféry. U 1 nemocné s postižením corpus callosum se jednalo o sekundární lymfom při prokázaném postižení krčních uzlin (7,7 %).
Pooperační průběh byl u všech nemocných s výjimkou časného pooperačního epileptického záchvatu u 1 nemocné bez komplikací. Histologickým nálezem u všech nemocných byl maligní non-hodgkinský difuzní velkobuněčný B lymfom. Po obdržení histologického nálezu byli nemocní ihned konzultováni na Interní hematoonkologické klinice LF MU FN Brno s následným převzetím do péče tohoto pracoviště.
Podávání kortikoidů v indikaci antiedematózní terapie nebylo před výkonem přerušeno u 10 nemocných. U těchto nemocných bylo prováděno hodnocení dynamiky léze při podávané kortikoterapii, kdy jsme porovnávali rozsah léze na vstupním MRI vyšetření a plánovací MRI studii pro potřeby stereotaktické biopsie. Průměrný odstup mezi oběma vyšetřeními byl 14,6 dne (rozmezí 1–21 dnů). V tomto období nedošlo k pozorovatelné změně rozsahu léze a intenzity postkontrastního sycení u 2 nemocných, regrese velikosti léze o < 20 % původních rozměrů byla pozorována u 3 nemocných a regrese léze o > 50 % původních rozměrů byla zjištěna u 3 nemocných (obr. 1–4). U 5 nemocných byla také pozorována výrazná regrese postkontrastního sycení. U 1 nemocné byl interval mezi vstupním CT vyšetřením a plánovací MRI studií 24 hod a v tomto krátkém intervalu ke změně velikosti nebo charakteru léze nedošlo. Diagnosticky výtěžný vzorek byl získán i u nemocného, u kterého byl dlouhodobě pro chronickou obstrukční plicní nemoc podáván prednison. Kortikoterapie zásadně ovlivnila terapeutický plán u nemocného, který byl indikovaný k biopsii parietální expanze vpravo. Při ponechané kortikoterapii indikované pro symptomatický otok mozku byla na navigační MRI studii provedené těsně před plánovanou biopsií zjištěna úplná regrese postkontrastně se sytící léze, což vedlo k odložení operace. Za 2 měsíce po vysazení kortikoidů byla na MRI a CT znovu patrná postkontrastně se sytící léze ve stejné lokalizaci a provedená biopsie prokázala difuzní velkobuněčný B lymfom mozku. U zbývajících 2 nemocných nebyly kortikoidy před biopsií podávány.
Obr. 1. Rozsáhlý víceložiskový expanzivní proces postihující oba frontální laloky a bazální ganglia vlevo. 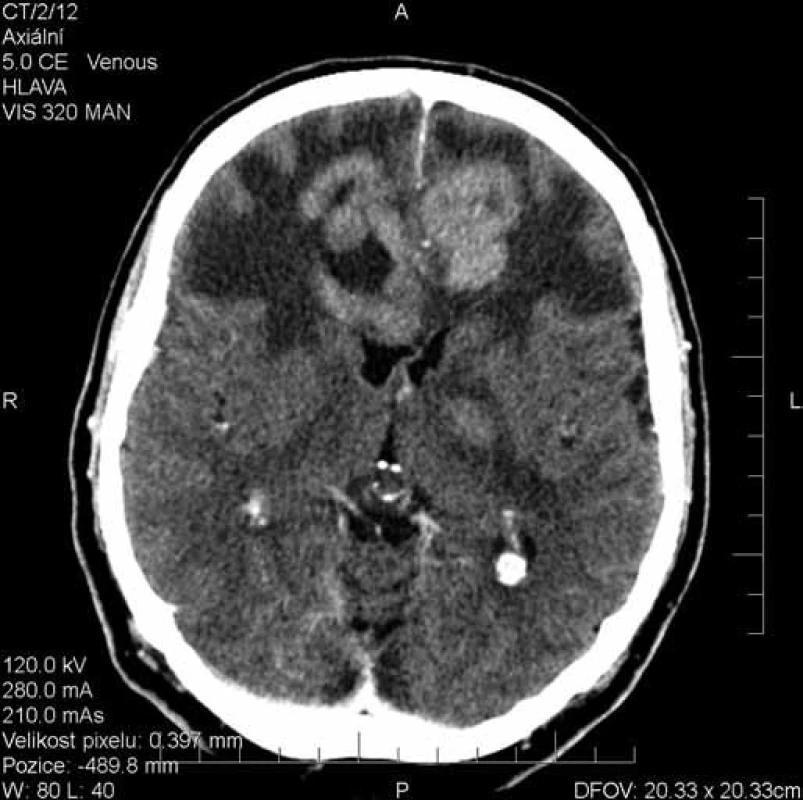
Obr. 2. Vyšetření MRI s odstupem 19 dnů při kortikoterapii – výrazná regrese nálezu, pouze reziduální postkontrastní sycení v oblasti mediální části frontálního laloku vpravo. 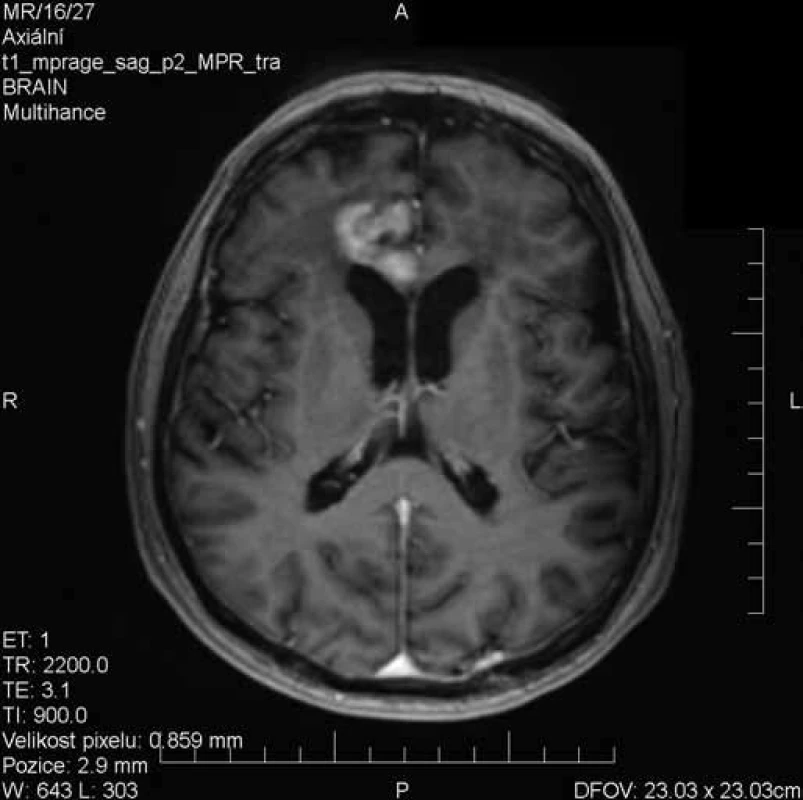
Obr. 3. Prakticky kompletní regrese postkontrastního sycení léze bazálních ganglií vlevo. 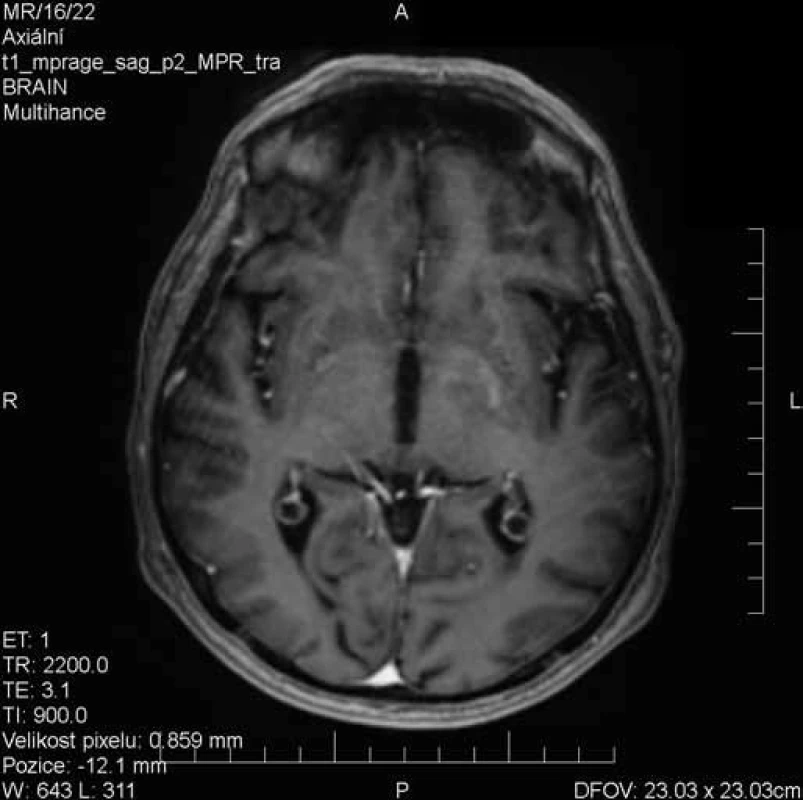
Obr. 4. Plánovací CT scan pro stereotaktickou rámovou biopsii. Histologicky potvrzen difúzní velkobuněčný B lymfom mozku. 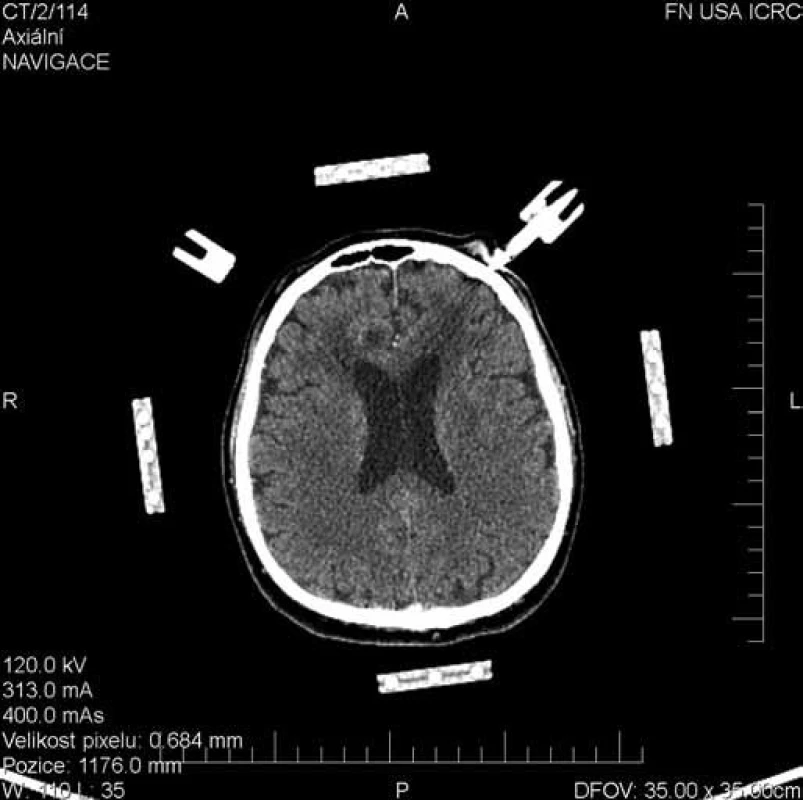
Dalším krokem byla analýza podskupiny nemocných s nekonkluzivním výsledkem stereotaktické biopsie s cílem zjistit, zda se u některých z těchto nemocných nemohlo jednat o mozkový lymfom.
V souboru nemocných s rámovou biopsií nebylo možné na jejím základě učinit diagnózu u 7 nemocných a ve skupině bezrámových biopsií u 1 nemocného. U 5 nemocných klinický průběh po biopsii, nález při operační revizi z kraniotomie a v neposlední řadě i pitevní nález diagnózu mozkového lymfomu jednoznačně vyloučily. Navíc se u žádného z těchto nemocných před biopsií o možnosti mozkového lymfomu neuvažovalo.
U polymorbidní nemocné byl pokus o biopsii tuhé léze v oblasti tentoriální incisury (primárně zvažován meningiom, možnost i metastázy Grawitzova tumoru) komplikován značným krvácením, které si vynutilo předčasné ukončení výkonu, naštěstí bez následků pro nemocnou. U nemocného s předpokládanou mozkovou metastázou stereobiopsie zachytila pouze nekrotickou tkáň a až pitevní nález prokázal plicní karcinom. U jiného nemocného nebyly při stereotaktické evakuaci atypického hematomu vzbuzujícího naléhavé podezření na prokrvácený tumor zachyceny nádorové buňky a předpokládaný glioblastom byl prokázán až při resekčním výkonu. U dalšího nemocného s velmi cévnatou lézí v oblasti mezencefala byla při pokusu o biopsii jejího okraje zachycena pouze gliotická tkáň a až pitevní nález po velmi rychlé progresi klinického stavu prokázal glioblastom mezencefala. U poslední nemocné biopsie drobné cystické léze frontálně sice neprokázala nádorovou tkáň, ale dlouhodobě stacionární klinický a radiologický obraz potvrzuje podezření na postmalatickou pseudocystu.
U tří nemocných s ne zcela konkluzivními výsledky biopsie byla před provedením biopsie na základě radiologického nálezu zvažována i možnost mozkového lymfomu.
U první nemocné, ženy ve věku 70 let s rozsáhlou hypodenzní lézí parietookcipitálně vpravo s nehomogenním diskrétním sycením, byla po komplexním došetření stanovena diagnóza autoimunitní vaskulitidy s přítomností ANCA protilátek (anti-neutrophil cytoplasmic antibody). Před výkonem nebyly podávány kortikoidy. Nemocná nebyla onkologicky léčena a po celou dobu pooperačního sledování (4 roky) byla klinicky ve stabilizovaném stavu.
U další nemocné ve věku 47 let byla indikována stereobiopsie výrazně se sytící léze v parietálním laloku s rozsáhlým perifokálním otokem, kdy radiolog a neurochirurg zvažovali možnost lymfomu mozku. I když pooperační CT kontrola potvrdila korektní lokalizaci míst odběru, výsledkem biopsie byla gliotická a zánětlivě změněná tkáň. Na kontrolním CT mozku s odstupem měsíce po biopsii při vysazené kortikoterapii byla evidentní regrese rozsahu léze. Navíc CT plic prokázalo rozsáhlou neřešitelnou cévní malformaci s trombózou v oblasti plicních žil. Na kontrolním MRI s odstupem 1 měsíce po zmíněném CT mozku stále při vysazené kortikoterapii byla evidentní další regrese nálezu. Tento vývoj spolu s nálezem plicní cévní malformace a trombotických změn plicních žil podporuje úvahu o zánětlivé nebo postembolizační etiologii léze.
U poslední nemocné, ženy ve věku 72 let s postupně se rozvíjející lehkou pravostrannou hemiparézou, CT a následně MRI prokázalo nehomogenně se sytící lézi v oblasti bazálních ganglií vlevo, kdy byl zvažován především mozkový lymfom. K výkonu byla nemocná z referujícího pracoviště přeložena s kortikoterapií. Histologické vyšetření odebraného materiálu prokázalo struktury šedé hmoty mozkové s infiltrací směsnou populací malých B a T lymfocytů a s nápadnou tvorbou perivaskulárních plášťových lymfocytárních infiltrátů. Na základě tohoto nálezu byla v diferenciální diagnostice zvažována především možnost encefalitidy, demyelinizační onemocnění bylo považováno za málo pravděpodobné a známky vaskulitidy nebyly zastiženy. I když nález směsné populace B a T lymfocytů přímo nepodporoval diagnózu mozkového lymfomu, popisovaný záchyt objemných perivaskulárních infiltrátů nevylučoval možnost odběru tkáně z okraje lymfomové proliferace s přítomností nenádorového pozadí. K dalšímu konzultačnímu a molekulárnímu vyšetření byl materiál zaslán do Ústavu patologie a molekulární medicíny 2. LF UK a FN Motol, ovšem nejednoznačný výsledek imunohistochemického i molekulárního vyšetření neumožnil stanovit jasnou diagnózu. Konzultant zvažoval především infekční postižení (vč. neuroboreliózy) nebo autoimunní onemocnění a nevyloučil možnost infiltrace při diseminaci spíše low-grade B lymfomu. O difuzní velkobuněčný B lymfom mozku se podle konzultanta nejednalo.
Možnost mozkového lymfomu nepotvrdil ani další klinický průběh. Při dalších MRI vyšetřeních s odstupem 3 a 5 měsíců po provedené biopsii byla zřejmá postupná regrese rozsahu léze i při postupně vysazované kortikoterapii, která byla ukončena po prvním kontrolním MRI vyšetření. Na MRI provedeném s odstupem 1 roku po biopsii již nebyly patrné známky postkontrastně se sytící léze. Při zpětném zhodnocení se jeví jako pravděpodobná spíše možnost autoimunního onemocnění nebo zánětlivého procesu.
Diskuze
Termín lymfom CNS se v literatuře objevuje roku 1975, kdy nahradil dřívější názvy jako mikrogliom, reticular cell sarcoma nebo perivaskulární sarkom (Baileyho klasifikace). Tyto názvy odrážely dobovou nejistotu týkající se histologického původu těchto nádorů. Většina PCNSL jsou difuzní velkobuněčné B lymfomy (> 95 %). T lymfomy jsou výjimečné [3], i když Choi et al uvádějí jejich četnost v souboru PCNSL 16,7 % [13]. Ve vlastním souboru nebyl nemocný s T lymfomem zachycen.
K postižení mozku lymfomem může dojít i sekundárně při primárním ložisku mimo CNS, což je popsáno u 1–9 % primárně extracerebrálních lymfomů [6,9]. V našem souboru byl sekundární lymfom prokázán u jediné nemocné.
Primárním výkonem při podezření na mozkový lymfom je biopsie, většinou s využitím rámové nebo bezrámové stereotaxe. Určitou výjimkou je článek autorů Dubuisson et al, kteří u 33 % nemocných indikovali otevřenou biopsii ložiska z kraniotomie [14]. I když z obecného hlediska nebyl prokázán přínos resekčních výkonů s cílem debulkingu tumoru, nemocní s rozsáhlými ohraničenými a chirurgicky dostupnými lézemi mohou z resekčního výkonu profitovat [15].
Podíl lymfomů v souboru stereotaktických biopsií popsaném Sawinem et al dosahuje 11,6 % [16]. Podobnou četnost prokazuje i novější sdělení Binnahila et al – 12,4 % [12]. Oba údaje a naše výsledky (8,3 % mozkových lymfomů u rámových a 7,4 % u bezrámových biopsií) převyšují literárně uváděný podíl mozkových lymfomů na celkovém počtu primárních mozkových nádorů (2–6 %), což potvrzuje dominantní úlohu stereobiopsie v neurochirurgické terapii lymfomu mozku.
Charakteristickým a z hlediska diferenciální diagnostiky a volby místa odběru biopsie velmi důležitým rysem mozkových lymfomů je regrese nádorové masy po podání kortikosteroidů, kdy může dojít až k úplnému vymizení tumoru. Zde stojí za zmínku starší sdělení Vaquera et al, kteří popsali nemocného s CT verifikovanou mozkovou expanzí, která nebyla prokázána při operační revizi provedené po dlouhodobé kortikoterapii [17]. Někdy se v této souvislosti používá i termín ghost tumors [18]. Rozsah regrese postkontrastně se sytící léze při kortikoterapii ovšem není konstantní, jak ukazují i naše výsledky, i když po relativně krátkém trvání kortikoterapie (nejčastěji okolo 14 dnů).
Histologický korelát těchto radiologických změn popsal Choi et al. U nemocných s biopsií mozkového lymfomu provedenou po podávání kortikoidů v trvání 2–18 dnů byla prokázána axonální destrukce a reaktivní glióza s různě rozsáhlou infiltrací lymfocyty (B i T) a mikrofágy. Selektivní destrukci nádorových buněk odpovídal nález rozptýlených malých oblých buněk s pyknotickými nebo fragmentovanými jádry [13].
Regrese rozsahu postkontrastně se sytícího ložiska při kortikoterapii není ovšem výlučnou charakteristikou mozkových lymfomů. Zaki et al u dvou nemocných s prokázaným multiformním glioblastomem popsali atypický postkontrastní enhancement, který po podání kortikoidů zmizel, ovšem postkontrastní sycení se objevilo v jiné oblasti. Za příčinu považují stabilizaci částečně narušené hematoencefalické bariéry, což může odpovídat i regresi intenzity postkontrastního sycení popsané u většiny našich pacientů po kortikoterapii [19].
Výše popsané regresivní změny při kortikoterapii s úbytkem nádorových buněk mohou zásadním způsobem ovlivnit výtěžnost biopsie. Ovšem některá recentní data přinášejí poněkud odlišný pohled. Binnahil et al analyzovali soubor 155 nemocných po biopsii mozkové expanze, z nichž bylo 135 před výkonem léčeno kortikoidy. PCNSL byl korektně diagnostikován u 15 ze 16 nemocných léčených kortikoidy a u 5 z 5 nemocných, u kterých kortikoidy podávány nebyly. U nemocného s nediagnostickým vzorkem prokázalo vyšetření PCR (polymerase chain reaction) lymfoproliferativní onemocnění odpovídající PCNSL. Autoři uzavírají, že jejich zjištění zpochybňuje nutnost vysazení kortikoterapie před stereobiopsií u nemocných s podezřením na lymfom mozku [12]. Na druhé straně ve sdělení Portera et al bylo nutné biopsii opakovat u 8 z 68 nemocných (12 %) s mozkovými lymfomy, u kterých byly podávány kortikoidy. Zde je ale nutné uvést, že ve skupině nemocných bez kortikoidů podíl nediagnostických biopsií dosahoval rovněž relativně vysoké hodnoty – 13 % [20]. V našem souboru nemocných s biopticky prokázaným mozkovým lymfomem je podíl pacientů s kortikoterapií ponechanou před biopsií 76,9 % a i po odečtení nemocného s dlouhodobou kortikoterapií pro plicní onemocnění dosahuje 69,3 %. U jediného nemocného došlo v souvislosti s kortikoterapií k úplné regresi postkontrastně sytící se léze, což vedlo k odložení již naplánované biopsie. U žádného nemocného nebylo nutné biopsii opakovat.
Při biopsii s využitím rámové stereotaxe je plánování biopsie provedeno na základě vyšetření provedeného v den operace u nemocného s připevněným rámovým systémem. Situace je odlišná u stereotaxe bezrámové, kdy je možné pro plánování využít i starší radiologickou studii, pokud splňuje podmínky navigačního systému. I když u žádného z našich nemocných s výraznou regresí rozměrů léze přesahujících 50 % nebyla doba kortikoterapie kratší než 14 dnů, je nutné interval mezi plánovací studií a provedením biopsie neprodlužovat. Jako příklad uvádíme práci Binnahila et al, v níž byl průměrný interval MRI – biopsie 4 dny [12]. V našem souboru nebyl u žádného nemocného s bezrámovou biopsií interval plánovací vyšetření – biopsie delší než týden.
Pokud se týče tří nemocných s biopticky nepotvrzeným naléhavým podezřením na mozkový lymfom, u první nemocné byl nález uzavřen jako autoimunní vaskulitida s přítomností ANCA protilátek, což potvrdil i následný klinický průběh – stabilizovaný klinický stav bez onkologické terapie a podávání kortikoidů. Při hodnocení druhé nemocné je sice nutné uvést, že literární data popisují možnost regrese až remise mozkového lymfomu i bez kortikoterapie [21], ale dynamika vývoje radiologického nálezu spolu s prokázanou plicní malformací s četnými trombozovanými žilami s postižením i plicních žil umožňuje se přiklonit k cévnímu postižení mozku při opakovaných embolizacích z plicních žil do mozkového řečiště vč. možnosti infikovaného embolu. U třetí nemocné je nejzásadnějším klinickým argumentem svědčícím proti možnosti mozkového lymfomu především dynamika nálezu v MRI s postupnou regresí až vymizením léze i při vysazení kortikoterapie s remisí trvající 2 roky, i když jsou popisovány relapsy mozkových lymfomů po iniciální spontánní remisi trvající 4 a 2 roky [22].
Pokud se týče nových technik MRI, především 1H MRI spektroskopie, jejich potenciální přínos spočívá hlavně v neinvazivním odlišení mozkových lymfomů od jiných expanzivních procesů CNS, především high-grade gliomů. Toto může být výhodné u velmi rizikových nemocných, u kterých může být takto stanovena rámcová diagnóza bez nutnosti invazivního výkonu [23]. Setzer et al zjistili pro techniku H MRI spektroskopie 100% pozitivní prediktivní hodnotu pro low-grade gliomy, a naopak nejvyšší negativní prediktivní hodnota byla zjištěna u nemocných s mozkovými metastázami a právě lymfomy mozku [24]. Z novějších literárních dat je možné citovat nedávno publikované sdělení Aburana et al, podle kterého mohou být poměry Glu/Cr, Glu/Glu + Gln a Cho/Cr užitečné pro odlišení glioblastomu a mozkového lymfomu [25].
Závěr
Možnost mozkového lymfomu je nutné v rámci předoperační diferenciálně diagnostické rozvahy zvážit především při postižení paraventrikulární oblasti, hlubokých struktur mozku a mening. Úlohou neurochirurga v terapii lymfomu mozku je bezpečný odběr průkazných reprezentativních vzorků patologické tkáně. Výhodou stereotaktické biopsie (rámové nebo bezrámové) je plánování bezpečné trajektorie na základě aktuálního obrazu patologického procesu. Navíc provedení plánovací studie těsně před biopsií umožňuje vyhodnocení dynamiky obrazu onemocnění v čase.
Naše výsledky sice vycházejí z limitního souboru, ale přesto adekvátně doplňují literární data, která na podobně rozsáhlých souborech ukazují, že kortikoterapie výrazně nezvyšuje pravděpodobnost nediagnostické biopsie u nemocných s mozkovým lymfomem, i když podávání kortikoidů nepochybně ovlivňuje velikost a postkontrastní sycení nádorového ložiska. Za předpokladu adekvátního načasování plánovacího vyšetření a především provedení stereotaktické biopsie získané výsledky nepotvrzují nutnost vysazení kortikoterapie nasazené pro mozkový edém a expanzivní chování mozkového tumoru před biopsií při podezření na mozkový lymfom.
Část sdělení byla přednesena na XLI. brněnských onkologických dnech v rámci Glio Meetingu a publikována ve formě krátkého abstraktu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Jan Chrastina, Ph.D.
Neurochirurgická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: jan.chrastina@fnusa.cz
Obdrženo: 27. 5. 2017
Přijato: 2. 7. 2017
Zdroje
1. van der Sanden GA, Schouten LJ, van Dick JA et al. Primary central nervous system lymphomas: incidence and survival in the Southern and Eastern Netherlands. Cancer 2002; 94 (5): 1548–1556.
2. Penn I, Porat G. Central nervous system lymphomas in organ allografts recipients. Transplantation 1995; 59 (2): 240–244.
3. Kozler P (ed). Intrakraniální nádory. 1. vyd. Praha: Galén 2007.
4. Gerstner E, Batchelor T. Primary CNS lymphoma. Expert Rev Anticancer Ther 2007; 7 (5): 689–700. doi: 10.1586/1473 7140.7.5.689.
5. Černý R, Kapla J, Machala L. Ložiskové léze CNS u pa-cientů s HIV infekcí. Cesk Slov Neurol N 2010; 73/106 (4): 374–378.
6. Cellina M, Fetoni V, Baron P et al. Unusual primary central nervous system lymphoma location involving the fourth ventricle and hypothalamus. Neuroradiol J 2015; 28 (2): 120–125. doi: 10.1177/1971400915576671.
7. Furusawa T, Okamoto K, Ito J et al. Primary central nervous system lymphoma presenting as difuse cerebral infiltration. Radiat Med 1998; 16 (2): 137–140.
8. Vokurka S, Tupý R, Boudová L et al. Klinické, histopatologické a zobrazovací charakteristiky non-hodgkinských lymfomů u pacientů s postižením mozku. Klin Onkol 2013; 26 (5): 348–353.
9. Mansour A, Qandeel M, Abdel-Razeq H et al. MR imaging features of intracranial primary CNS lymphoma in immuno competent patients. Cancer Imaging 2014; 14 (1): 22. doi: 10.1186/1470-7330-14-22.
10. Pánková J, Benešová E, Klener P et al. Primární lymfom centrální nervové soustavy. Klin Onkol 1998; 11 (4): 112–115.
11. Geppert M, Ostertag CB, Seitz G et al. Glucocorticoid therapy obscures the diagnosis of cerebral lymphoma. Acta Neuropathol 1990; 80 (6): 629–634.
12. Binnahil M, Au K, Lu JQ et al. The influence of corticosteroid on diagnostic accuracy of biopsy for primary central nervous system lymphoma. Can J Neurol Sci 2016; 43 (5): 721–725. doi: 10.1017/cjn.2016.255.
13. Choi YL, Suh YL, Kim D et al. Malignant lymphoma of the central nervous system: difficult histological diagnosis after glucocorticoid therapy prior to biopsy. Clin Neuropathol 2006; 25 (1): 29–36.
14. Dubuisson A, Kaschten B, Lénelle J et al. Primary central nervous system lymphoma report of 32 cases and review of the literature. Clin Neurol Neurosurg 2004; 107 (1): 55–63. doi: 10.1016/j.clineuro.2004.03.005.
15. Liu BL, Cheng JX, Zhang X et al. Limited role of surgery in the management of primary central nervous system lymphoma. Oncol Rep 2009; 22 (3): 439–449.
16. Sawin PD, Hitchon PW, Follet KA et al. Computer imaging – assisted stereotactic brain biopsy: a risk analysis of 225 consecutive cases. Surg Neurol 1998; 49 (6): 640–649.
17. Vaquero J, Martínez R, Rossi E et al. Primary cerebral lymphoma: the,,ghost tumor“. Case report. J Neurosurg 1984; 60 (1): 174–176. doi: 10.3171/jns.1984.60.1.0174.
18. Korner S, Raab P, Brandis A et al. Spontaneous regression of an intracerebral lymphoma (ghost tumor) in a liver-engrafted patient. Neurologist 2011; 17 (4): 218–221. doi: 10.1097/NRL.0b013e318220c666.
19. Zaki HS, Jenkinson MD, Du Plessis DG et al. Vanishing contrast enhancement in malignant glioma after corticosteroid treatment. Acta Neurochir (Wien) 2004; 146 (8): 841–845. doi: 10.1007/s00701-004-0282-8.
20. Porter AB, Giannini C, Kaufmann T et al. Primary CNS lymphoma can be histologically diagnosed after previous corticosteroid use: a pilot study to determine whether corticosteroids prezent the diagnosis of primary CNS lymphoma. Ann Neurol 2008; 63 (5): 662–667. doi: 10.1002/ana.21366.
21. Hernández Rubio L,Giner Bernabeau JC, Perez Sempere A. Primary cerebral lymphoma with spontaneous remission. Neurologia 2013; 28 (2): 123–126. doi: 10.1016/j.nrl.2011.08.002.
22. Al-Yamany M, Lozano A, Naq S et al. Spontaneous remission of primary central nervous system lymphoma: report of 3 cases and discussion of pathophysiology. J Neurooncol 1999; 42 (2): 151–159.
23. Taillibert S, Guillevin R, Menuel C et al. Brain lymphoma: usefulness of the magnetic resonance spectroscopy. J Neurooncol 2008; 86 (2): 225–229. doi: 10.1007/s11060-007-9468-2.
24. Setzer M, Herminghaus S, Marquardt G et al. Diagnostic impact of proton MRI – spectroscopy versus image guided stereotactic biopsy. Acta Neurochir (Wien) 2007; 149 (4): 379–386. doi: 10.1007/s00701-007-1126-0.
25. Aburano H, Ueda F, Yoshie Y et al. Differences between glioblastomas and primary central nervous system lymphomas in 1 H-magnetic resonance spectroscopy. Jpn J Radiol 2015; 33 (7): 392–403. doi: 10.1007/s11604-015-0430-5.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2017 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Minulá a současná praxe chirurgického řešení karcinomu prsu
- Katétrové infekcie krvného prúdu – vieme o nich všetko?
- Molekulární patogeneze testikulárních germinálních nádorů
- Možnosti snížení radikality operací v axile a značení axilárních lymfatických uzlin v rámci terapie karcinomu prsu
- Ostropestřec mariánský (Silybum marianum) jako podpůrný fytoterapeutický prostředek v onkologii
- Role paliativní radioterapie při krvácení lokálně pokročilých nádorů gastrointestinálního traktu
- Vliv kortikoterapie na diagnostickou výtěžnost stereotaktické biopsie u nemocných s lymfomem mozku
- Kognitívne deficity onkologických pacientov s hematologickými malignitami
- Informace z České onkologické společnosti
- The Inclusion of a Gemcitabine + Nab-paclitaxel Regimen as a 2nd Line Treatment for Advanced Pancreatic Cancer – First Experience
- Role adjuvantní radioterapie při léčbě papilárních nádorů pineální oblasti: kazuistika a krátký přehled literatury
- Aktuality z odborného tisku
- Profesor MUDr. Jindřich Fínek, Ph.D., MHA životní jubileum
-
Onkologie v obrazech
Agresivní fibromatóza stěny břišní
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Katétrové infekcie krvného prúdu – vieme o nich všetko?
- Ostropestřec mariánský (Silybum marianum) jako podpůrný fytoterapeutický prostředek v onkologii
- The Inclusion of a Gemcitabine + Nab-paclitaxel Regimen as a 2nd Line Treatment for Advanced Pancreatic Cancer – First Experience
- Možnosti snížení radikality operací v axile a značení axilárních lymfatických uzlin v rámci terapie karcinomu prsu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



