-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Význam mutace BRAFV600E v tyreoidální onkologii a možnosti léčebného ovlivnění – aktuální poznatky a výsledky studií
The Significance of BRAFV600E Mutation in Thyroid Cancer in Terms of Novel Targeted Therapies – Overview of Current Knowledge and Studies
Background: About 50% of papillary thyroid cancers, the most common type of all thyroid malignancies, harbor the BRAFV600E mutation. The prognostic value of this mutation is still under debate, but according to many studies, the BRAF mutation significantly downregulates genes involved in the iodine metabolism of tumor follicular cells. This mutation can be also found in some dedifferentiated and anaplastic thyroid cancers, which raises the issue of the selective advantage of novel targeted therapies. Aim: The aim of this review is to discuss the significance of the BRAF mutation mostly in radioiodine-refractory thyroid cancers (RR-TC) with respect to recent preclinical and clinical studies reporting the results of different RAF and MEK inhibitors. Conclusions: BRAF mutation detection in progressive RR-TC could play a role in decision-making of targeted therapies in the near future. So far, only multi-kinase inhibitors (sorafenib and lenvatinib) are legally accepted. On the other hand, for patients with disseminated BRAF mutant malignant melanoma or lung cancer, selective treatments with RAF and MEK inhibitors (vemurafenib, dabrafenib, and trametinib) are available. A crucial advantage of these inhibitors in the treatment of thyroid cancer is their ability to restore expression of the genes involved in iodine metabolism in cancer cells that have lost this ability, thus opening the door for radioiodine treatment again.
Key words
thyroid cancer – BRAF mutation – biological therapy – tyrosine kinase inhibitor – MEK inhibitor
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 4. 6. 2018
Accepted: 1. 8. 2018
Autoři: Jakubíková Iva 1; Gabalec Filip 1; Beránek Martin 2; Žák Pavel 1; Čáp Jan 1
Působiště autorů: IV. interní hematologická klinika LF UK a FN Hradec Králové 1; Ústav klinické biochemie a diagnostiky, FN Hradec Králové 2
Vyšlo v časopise: Klin Onkol 2018; 31(5): 339-344
Kategorie: Přehled
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2018339Souhrn
Východiska: Papilární karcinom tvoří 80 % všech nádorů štítné žlázy a je zhruba v 50 % spojen s přítomností mutace BRAFV600E. Prognostický význam této mutace je předmětem řady diskuzí, nicméně vztah této mutace ke snížené expresi genů zapojených do jodového metabolizmu folikulárních buněk je zřejmý. Nález mutovaných variant genu i u některých dediferencovaných či anaplastických nádorů štítné žlázy přináší potenciální selekční výhodu jejich cíleného ovlivnění. Cíl: Cílem tohoto přehledového článku je poukázat na význam mutace BRAF u radiojod-refrakterních karcinomů štítné žlázy (radioiodine-refractory thyroid cancer – RR-TC) ve světle nových poznatků z preklinických a klinických studií, které se zabývají testováním různých RAF, MEK inhibitorů a jejich kombinovanou léčbou. Závěr: Význam stanovení a detekce BRAF mutace u progredujících RR-TC může do budoucna hrát roli v optimalizaci léčby. V současné době jsou pro tyto pacienty oficiálně schválené pouze multikinázové inhibitory (sorafenib a lenvatinib). Na trhu jsou již ale k dispozici i RAF a MEK inhibitory (vemurafenib, dabrafenib, trametinib), t. č. dostupné pro pacienty s diseminovaným BRAF mutovaným maligním melanomem nebo karcinomem plic. Zásadní výhodou pro karcinomy štítné žlázy se zdá být schopnost RAF a MEK inhibitorů navodit rediferenciaci nádorových buněk a reexpresi genů pro jodový metabolizmus. Znovuobnovení citlivosti k léčbě 131I je klíčovým mechanizmem pro léčbu radiojod-refrakterních diseminovaných nádorů štítné žlázy.
Klíčová slova:
nádory štítné žlázy – BRAF mutace – biologická léčba – inhibitory tyrozinkináz – MEK inhibitory
Úvod
Nádory štítné žlázy (thyroid cancer – TC) patří mezi nejčastější endokrinní malignity a jejich incidence každoročně narůstá, zejména v důsledku časného záchytu raných stadií. Dominantní zastoupení dle histologie tvoří diferencované karcinomy papilární (papillary thyroid cancer – PTC) a folikulární (follicular thyroid cancer – FTC), které jsou ve většině případů dobře léčitelné pomocí operace na štítné žláze aplikací radiojodu v kombinaci se supresní terapií levothyroxinem, čímž je dosaženo 10leté doby přežití v 90 % případů. Některé diferencované karcinomy mají tendenci perzistovat nebo se vracet, zakládat lokoregionální či vzdálené metastázy a přestat být ovlivnitelné podáním radiojodu. Pro pacienty s radiojod-refrakterním diferencovaným karcinomem štítné žlázy (radioiodine-refractory differentiated thyroid cancer – RR-DTC) je 10letá doba přežití 10 % od diagnózy metastatické diseminace. Pro případy těchto agresivních progredujících RR-DTC, které nelze adekvátně chirurgicky ošetřit, jsme byli řadu let odkázáni na externí radioterapii, metody radiofrekvenčních ablací či podávání cytostatik, jejichž účinnost byla sporná a často zatížená řadou nežádoucích účinků [1]. S pokrokem molekulární genetiky byly rozklíčovány stěžejní signální dráhy MAPK (mitogen-activated proteinkinase) a PI3K/AKT a klíčové genetické změny, např. BRAF a RAS mutace, genetické přestavby RET/PTC, jejichž aktivace vede ke vzniku diferencovaných nádorů štítné žlázy (differentiated thyroid cancer – DTC). Objasňují se také mechanizmy vedoucí k dediferenciaci až progresi do anaplastického karcinomu štítné žlázy (anaplastic thyroid cancer – ATC), kde medián přežití je 6 měsíců. V posledních letech byly pro léčbu RR-DTC americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) schváleny dva preparáty na bázi tyrozinkinázových inhibitorů (TKI) – sorafenib a lenvatinib. Jejich účinek oproti placebo skupině znamenal pro zhruba dvě třetiny pacientů dosažení parciální remise (PR) či stabilní choroby (stable disease – SD) po dobu několika měsíců. Nicméně řada pacientů pro nežádoucí účinky léčbu přerušila nebo ukončila. Obecně cytostatický efekt TKI je zatížen rizikem relapsu a progrese nádorů po jejich vysazení či nastartování jiné signální dráhy určující mechanizmus vzniku rezistence na léčbu. Sorafenib a lenvatinib jsou multikinázové inhibitory, které mají dominantně vliv na angiogenezi a invazivitu nádorů bez ohledu na genetický podklad. V současné onkologii se začíná razit interindividuální přístup, který je založen na cílené terapii dle genetického profilu konkrétního nádoru. Recentní studie poukazují na dominantní zastoupení mutace BRAFV600E u papilárních karcinomů i s přesahem k ATC a začínají poskytovat výsledky o efektu RAF/MEK – cílených inhibitorů. Cílem tohoto článku je poukázat na význam a léčebné perspektivy BRAF mutovaných TC.
BRAF mutace
V patogenezi nádorů je zásadní aktivace mutací v tzv. driver onkogenech. Až 75 % mutací postihuje kontrolní geny v MAPK signální dráze a dále dráhu PI3K/AKT/mTOR (phosphatidylinositol 3-kinase/v-akt murine thymoma viral oncogene homolog 1/mammalian target of rapamycin). Mutace vedou většinou ke konstitutivní aktivaci příslušné signální dráhy a jejímu trvalému spuštění, což vede k deregulaci buněčné smrti, proliferace či diferenciace. BRAF (v-raf murine sarcoma viral oncogene homolog B1) protoonkogen vede k expresi cytoplazmatické serin/threoninové BRAF kinázy, která je nejpotentnějším stimulantem navazující MEK kinázy a fosforylaci ERK v rámci MAPK dráhy. BRAF mutace je hojně zastoupenou mutací u řady malignit, je přítomna v 8 % všech solidních nádorů. Dominantně je zastoupena až v 60 % maligních melanomů (MM), ve 40 % TC a dále v 10 % ovariálních či kolorektálních karcinomů apod. Nejčastější z BRAF mutací je V600E, která vzniká záměnou aminokyseliny glutamátu za valin na pozici 600 (odvozeno na základě záměny thyminu za adenin v nukleotidu 1799) [2]. BRAF mutace je uznanou nejčastější „starter“ mutací u PTC-like TC a se svojí 100% pozitivní prediktivní hodnotou pro tento karcinom má své opodstatnění jako screeningový marker malignity u tenkojehlových aspirací z uzlů štítné žlázy, kde jejich biologická podstata na základě cytologie není jednoznačná [3]. Prognostický význam BRAF mutace je kontroverzní. Některé studie poukazují na vztah BRAF mutace k rizikovým faktorům (např. vyšší věk, velikost tumoru, pokročilý staging, extratyreoidální invaze, postižení lymfatických uzlin), dále pak na vztah k perzistenci a rekurenci u DTC a celkově horší prognóze [4–6]. Jiné studie tato fakta vyvracejí [7–9]. Nicméně mutace BRAFV600E bývá hojněji zastoupena u histologicky agresivnějších podtypů papilárního karcinomu, kterými je např. tall cell varianta nebo hobnail varianta. Dále bylo prokázáno, že BRAFV600E mutace výrazně snižuje expresi genů zapojených do utilizace jodu, např. gen pro jodový symportér (natrium iodine symporter – NIS), tyreoidální peroxidázu (TPO), tyreoglobulin (Tg), což může komplikovat léčbu radiojodem. Kromě poruchy utility jodu se zdá, že BRAF mutace dokáže pomocí konstitutivního zapnutí MAPK dráhy aktivovat též transformující růstový faktor β (transforming growth factor – TGFβ), který podporuje zisk invazivních vlastností na základě aktivace epiteliálně-mezenchymálního posunu [10–12].
Na základě analýz, při nichž diferencované BRAF mutované TC přecházejí do dediferencovaných forem, či na základě analýzy ATC dochází k aktivaci dalších signalizačních drah, např. β kateninové dráhy (mutace CTNNB1), PI3 kinázové dráhy (RAS, PIK3CA mutace), alteraci na úrovni tumor supresorového genu TP53 či PTEN nebo afekci telomeráz cestou mutací v promoteru TERT genu. Radiojod-avidní metastatické DTC obsahují spíše RAS mutace oproti RR-DTC, kde je častěji zastoupena BRAF mutace, zejména pak u nádorů FDG (fluor-2-deoxy-L-glukosa) PET (pozitronová emisní tomografie) pozitivních. Dále bylo zjištěno, že primární nádory nesoucí driver mutaci BRAF mají tendenci si ji udržet i ve svých metastázách [13–18].
Studie na nádorových buněčných liniích či myších modelech poukazují na perspektivy vyvíjených léků, které zasahují do alterovaných signálních drah. Jedná se jednak o TKI inhibitory, dále cílené RAF inhibitory, PIK3 inhibitory, MEK inhibitory a další imunomodulační sloučeniny. Kapitolou samou pro sebe je možnost ovlivnění epigenetických změn na úrovni DNA acetylace histonů či miRNA.
Konkrétně pro BRAFV600E mutované TC se jeví slibně cílená biologická léčba RAF a MEK inhibitory. Efekt těchto molekul na poli cytotoxického efektu až po rediferenciaci si ukážeme v následujícím přehledu preklinických a klinických studií. V textu probírané signální dráhy a cíle biologické léčby shrnuje schéma 1.
Schéma 1. Přehled základních signálních drah MAPK a PI3K/AKT/mTOR a jejich kontrolních bodů se schematickým náznakem cílů jednotlivých inhibitorů využívaných v biologické léčbě [35]. ![Schéma 1. Přehled základních signálních drah MAPK a PI3K/AKT/mTOR a jejich kontrolních
bodů se schematickým náznakem cílů jednotlivých inhibitorů využívaných v biologické
léčbě [35].](https://pl-master.mdcdn.cz/media/image_pdf/21dfba470c06c8fb8f5c54594f3fe518.jpeg?version=1539604772)
VEGFR – receptor pro vaskulární endotelový růstový faktor, FGFR – receptor pro fi broblastový růstový faktor Preklinické studie
Zajímavá studie od ElMokh et al [19] na buněčných liniích (8505c, OCUT-2, SW1736) a myším mutovaném modelu BRAFV600E a PIK3CAH1047R podala svědectví o progresi PTC směrem k ATC. Ve studii byl použit MEK1/2 inhibitor PD-325901 a PI3-kinázový inhibitor GDC-0491. Na buněčných liniích, které všechny byly BRAF mutované (linie 8505c navíc s TP53 mutací a OCUT-2 linie navíc s PIK3CA mutací), byl zaznamenán signifikantní antiproliferační efekt, indukováno zastavení G1 buněčného cyklu i apoptóza. Dominantní byl efekt MEK inhibitoru, který byl synergisticky potencován PI3 inhibitorem. Na úrovni myšího modelu po aktivaci tamoxifenem do 3 měsíců myši vyvinuly agresivní PTC-ATC tumory. Ve 2. měsíci započatá léčba pomocí GDC-0491 vedla k 20% zmenšení nádorů během 6 týdnů, u PD-325901 k 40% zmenšení a v kombinované léčbě oběma inhibitory k 60% redukci. Navíc myší nádory na léčbě MEK inhibitorem vykazovaly známky rediferenciace, vč. reexprese NIS transportéru, receptoru tyreostimulačního hormonu, tyreoglobulinu, tyreoidální peroxidázy apod. Na druhou stranu po ukončení inhibitorové léčby došlo k opětovnému nádorovému bujení. Duální inhibice dvou majoritních drah u agresivních forem TC (RAF-MEK-ERK a PI3-AKT-mTOR) tak má své opodstatnění.
Studie Nagarajaha et al [20] testovala efekt MEK inhibitorů na poli rediferenciace pomocí 124I PET/CT. Na myším modelu TPO-Cre LSL-BRAFV600E byly testovány inhibitory CKI (CH 5126766) a selumetinib. Zde je vhodné poznamenat, že selumetinib je MEK 1 inhibitor a CKI duální inhibitor RAF/MEK 1,2. Po 8 dnech léčby oba inhibitory zvýšily vychytávání 124I, nicméně CKI 2× více než selumetinib. Dále byla myším aplikována kurativní dávka 131I. CKI inhibitor dosáhl překvapivého výsledku, po 24 týdnech od podání 131I dle histologie došlo k totální regresi malignity oproti předléčení selumetinibem, kde PTC perzistoval. Dále tato studie poukázala, že protrahovaná léčba MEK inhibitorem nevede k potenciaci vychytávání radiojodu. Velmi perspektivní duální RAF/MEK 1,2 inhibitor CH 5126766 je zatím ve fázi I klinického hodnocení [21].
Ve studii od Kurata et al [22] byly na lidských ATC nádorových liniích testovány BRAF inhibitor dabrafenib a MEK1/2 inhibitor trametinib, které jsou v současné době již FDA schválenými preparáty pro léčbu diseminovaného MM. Lidské ATC linie obsahovaly BRAF, NRAS a PIK3CA mutace. Oba inhibitory vedly k downregulaci MEK/ERK fosforylace a k navození G0/1 buněčné fáze (cell cycle arrest), čímž bylo dosaženo cytostatického efektu. Nicméně NRAS mutované nádory při léčbě dabrafenibem mají tendenci obejít RAF kinázu, což vede k aktivaci MEK/ERK dráhy. Tento únikový mechanizmus je v některých případech příčinou selhání úvodní léčby MM dabrafenibem. Proto se zdá být efektivnější zahajovat léčbu rovnou MEK inhibitorem. Nicméně i v této studii byla prokázána potenciace efektu a synergní účinek dabrafenibu s trametinibem.
Na preklinické úrovni byl ve studii od Weie et al [23] na BRAF mutovaných nádorových liniích DTC popsán účinek nového pan-RAF inhibitoru LY3009120, který byl účinný i na vemurafenib rezistentní linie a vedl nejen k zastavení buněčného cyklu, ale i k buněčné apoptóze. Dále byl otestován účinek obatoclaxu (pan-BCL-2 inhibitor, vede k inhibici mitochondriální respirace a glykolýzy), který stimuloval buněčnou apoptózu a dokázal potencovat cytotoxický účinek vemurafenibu.
Překled aktuálních BRAF a MEK inhibitorů používaných v klinické fázi/praxi
V současné době se již v klinické praxi používají RAF a MEK inhibitory oficiálně schválené FDA pro léčbu metastatického BRAFV600-mutovaného MM a některé v terapii BRAF-mutovaného nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC). Jejich přehled shrnuje tab. 1, vč. selumetinibu, který je zatím ve fázi III klinického testování pro léčbu MM a NSCLC. Ve výše uvedených indikacích je již povolena i kombinovaná terapie RAF a MEK inhibitoru.
Tab. 1. Přehled aktuálních RAF a MEK inhibitorů používaných v klinické praxi. 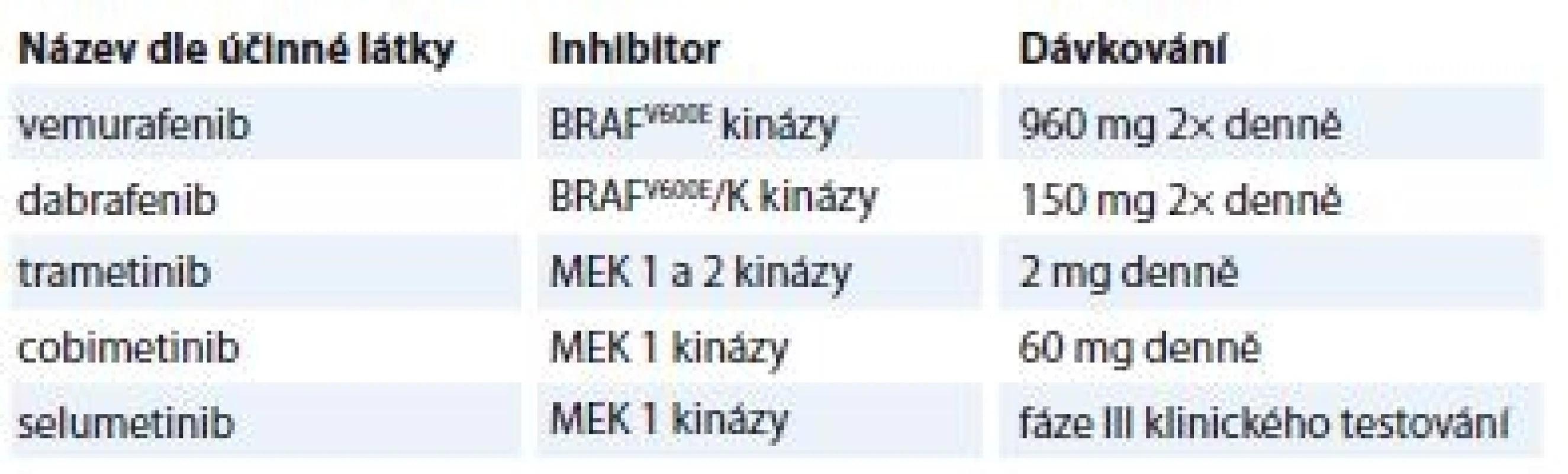
Biologická léčba pomocí inhibitorů (TKI, RAF, MEK apod.) je značně zatížena jejich toxicitou, pro kterou někteří pacienti musí léčbu redukovat, dočasně či zcela vysadit [24–26]. Nicméně obavy z nárůstu toxicity při kombinované terapii dabrafenibem s trametinibem se nepotvrdily. Ucelený přehled o dalších vyvíjených RAF/MEK inhibitorech podává ve svém článku Cheng et al [21]. Nástup farmakorezistence na RAF inhibitory díky zpětné signalizaci přes Craf-MEK signalizaci se dá efektivně obejít kombinací s MEK inhibitorem, což je značný pokrok. Navíc při monoterapii RAF inhibitory byly zřídka zaznamenány případy kompletní remise (complete remission – CR), což nástup kombinované terapie RAF/MEK inhibitory změnil [27,28]. Na druhou stranu je třeba říci, že stejně jako v případě léčby TKI není přesně definováno, kdy je již vhodné biologickou léčbu zahájit, jak postupovat v dávkování při dosažení CR a jaká je optimální doba podávání inhibitorů (kontinuálně/ v cyklech).
Klinické studie
Léčba agresivních BRAF mutovaných melanomů dospěla v posledních letech k průlomu. Pomocí preparátů oficiálně schválených FDA, zejména díky kombinované terapii (dabrafenibu s trametinibem) došlo k celkové odpovědi v 69 % (z toho v 16 % k CR) oproti standardní chemoterapii (celková odpověď 9 %). Z mediánu celkového přežití (overall survival – OS) jsme se posunuli z 11 na 25 měsíců [28]. Tyto úspěchy z léčby MM vedly k testování těchto preparátů na progredujících RR-DTC a na pacientech s ATC.
Ho et al [29] zkoumali efekt selumetinibu v terapii pokročilých radiojod-refrakterních karcinomů štítné žlázy (radioiodine-refractory thyroid cancer – RR-TC) (13 DTC, 7 PDTC – poorly differentiated thyroid cancer), které obsahovaly mutace BRAF, NRAS i wild type. Dominantně PDTC nádory obsahovaly NRAS mutaci. Bylo podáváno150 mg selumetinibu po 4 týdny a u 8 z 20 pacientů bylo pomocí 124I PET/CT dozimetrie dosaženo dostatečné radiorefrakterity, že jim byla podána kurativní dávka 131I. Během 6měsíčního sledování bylo dosaženo PR u 5 z nich a SD u 3 pacientů, doprovodně s poklesem sérové hladiny tyreoglobulinu. Všichni tolerovali selumetinib bez nutnosti redukce či předčasného ukončení léčby, toxicita byla nízká (stupeň 1 a 2). V této studii překvapivě lépe zareagovaly všechny NRAS mutované PDTC tumory oproti těm BRAF mutovaným, což přináší naději i pro pokročilé NRAS mutované nádory.
Brose et al [30] ve své studii zatím otestovali vemurafenib na t. č. největším souboru BRAFV600E mutovaných radiojod-refrakterních papilárních karcinomech. Bylo podáváno 1 920 mg vemurafenibu denně a minimální medián sledování byl 15 měsíců. Celkem 51 pacientů bylo rozděleno do dvou skupin, skupina 1 (terapeuticky naivní), skupina 2 (předchozí léčba chemoterapií, sorafenibem či jiným TKI). Skupina 1 odpověděla na léčbu 38,5 % PR, 57,5 % SD, medián PFS (progression-free survival) 18,2 měsíce, doba podávání léku medián 63 týdnů. Skupina 2 ve srovnání dosáhla ve 27 % PR, 64 % SD a medián PFS 8,0 měsíce, doba podávání léku medián 27 týdnů. Monoterapie vemurafenibem byla zatížena vysokým stupněm toxicity (stupeň 3 a 4) u více než 60 % pacientů, obdobně jako to vídáme u pacientů s MM.
Rothenberg et al [31] ve své studii podrobili soubor 10 pacientů s radiojod-refrakterním PTC s BRAFV600E mutací léčbě dabrafenibem (300 mg denně po 25–42 dní). U 6 pacientů tumory vykázaly rediferenciaci na 131I celotělové scintigrafii (4 mCi), poté dostali kurativní dávku 150 mCi. Po 6měsíčním sledování 2 pacienti dosáhli PR a 4 pacienti SD. Zajímavé je, že majoritně zareagovaly PTC s tall cell variantním histotypem oproti klasickému. V této studii byly též proměřovány hladiny sérového tyreoglobulinu, které spíše po aplikaci 131I vykazovaly nárůst. Zdá se, že v některých situacích nárůst hladiny tyreoglobulinu nemusí ukazovat pouze na progresi onemocnění, ale i na znovunabytí rediferenciace.
Formou kazuistického sdělení [32] byl publikován případ sekvenčního podání vemurafenibu a dabrafenibu u agresivního BRAFV600E mutovaného PTC – tall cell varianta. Počáteční staging nádoru byl T3N1bM1 (plicní mikro-makrometastázy) FDG pozitivní, RAI negativní. Úvodní 3měsíční léčba vemurafenibem vedla k výrazné PR a znovunabytí radiojod-avidity. Po 7 měsících byla léčba ukončena pro toxicitu. Zanedlouho pro progresi choroby byla zahájena léčba dabrafenibem (3 měsíce), který opět navodil radiojod-aviditu na podanou kurativní dávku 131I. Další follow-up nebyl zaznamenán.
Zatím jediná studie [33] testovala kombinační léčbu dabrafenibu s trametinibem na souboru BRAFV600E-mutovaných ATC. Celkem 16 pacientů různě předléčených užívalo 300 mg dabrafenibu s 2 mg trametinibu denně. Po 12 měsících léčby bylo dosaženo trvání odpovědi v 90 %, PFS u 79 % a OS 80 %. Celkově zareagovalo na léčbu 69 % (z toho 1 případ CR, 10 PR), po oficiálním ukončení studie pokračuje v léčbě 7 pacientů. Toxicita byla srovnatelná s jinými studiemi. Limitací této studie je, že nebyl podán radiojod a nebyl tím pádem ověřen rediferenciační efekt přímo v klinické studii. Nicméně v této studii bylo dosaženo závratného prodloužení přežití pro pacienty s ATC.
Finálně je vhodné shrnout, jakého efektu bylo dosaženo v léčbě RR-DTC pomocí sorafenibu a lenvatinibu, které nadále t. č. zůstávají jedinými oficiálně schválenými preparáty.
Jako první multicentrická, dvojitě zaslepená studie DECISION [25] poukázala na efekt TKI-sorafenibu v léčbě RR-DTC. Medián PFS byl 10,8 měsíce pro sorafenib vs. 5,8 měsíce pro placebo, medián doby sledování byl 16 měsíců. Ve 12 % bylo dosaženo PR, SD si po 6 měsících udrželo 42 %. Medián doby podávání sorafenibu byl 10,6 měsíce. Nežádoucí účinky stupně 3 a vyššího se objevily ve 37 %. V průběhu studie bylo progredujícím pacientům ve větvi placebo dovoleno přejít do větve sorafenib, proto OS nebyla stanovena. Dvojitě zaslepená studie SELECT [26] otestovala efekt lenvatinibu na souboru 261 pacientů vs. 131 pacientů v placebo skupině. Lenvatinib byl podáván v dávce 24 mg ve 28denních cyklech. Medián doby sledování byl 17 měsíců. Medián PFS byl 18,3 měsíce vs. 3,6 měsíce. Odpověď na léčbu byla 63,8 % (4 CR, 165 PR, 60 SD) vs. 1,5 %. OS nebyla zhodnocena s ohledem na přechod některých pacientů z placebo skupiny do otevřené větve s lenvatinibem. Efekt lenvatinibu byl též zaznamenán u nádorů, které podstoupily předchozí kúru sorafenibem. Efekt lenvatinibu byl zaznamenán u různých histotypů (PTC, FTC, PDTC) bez ohledu na status BRAF, NRAS mutace. S toxicitou stupně 3 a vyššího se setkalo 76 % pacientů. Oproti sorafenibu je lenvatinib vzácně zatížen smrtelnými nežádoucími účinky zejména na vrub tromboembolických či krvácivých komplikací. Podíváme-li se na recentně uveřejněnou malou švýcarskou studii s lenvatinibem u RR-DTC [34], tak OS byla 22,7 měsíce, přičemž medián doby zařazení těchto pacientů do této studie trval 11 let s dosažením dobré kvality života, která byla narušena nezanedbatelnou toxicitou TKI.
Závěr
RR-TC vycházející z folikulární buňky jsou špatně ovlivnitelné konvenčními léčebnými metodami a jsou spojeny se značnou mortalitou. Pokroky v molekulární genetice vedou ke vzniku různých preparátů na bázi cílené léčby. Předpokladem nejlepšího efektu je zásah konkrétní alterované signální dráhy a konkrétní mutace vč. zpětnovazebných mechanizmů. Obecně hojné zastoupení BRAFV600E mutace napříč těmito karcinomy vede k potenciální selekční léčebné výhodě pomocí RAF inhibitorů či kombinované léčbě RAF/MEK inhibitory, jejichž efekt se zdá, že vede k reexpresi NIS, TPO a jiných genů nutných pro efekt léčby radiojodem. Ačkoli bude trvat řadu let, než se u těchto vzácných případů dostaneme na statisticky významné soubory, je vhodné zejména na základě mezinárodní spolupráce pokračovat v těchto klinických studiích. Pro BRAF wild type agresivní TC by perspektivy mohla skýtat kombinovaná terapie TKI s MEK inhibitory či v kombinaci s imunomodulační léčbou.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Iva Jakubíková
IV. interní hematologická klinika LF UK a FN Hradec Králové
Sokolská 581 500 05 Hradec Králové
e-mail: ivajakub@gmail.com
Obdrženo: 4. 6. 2018
Přijato: 1. 8. 2018
Zdroje
1. Tumino D, Frasca F, Newbold K. Updates on the management of advanced, metastatic, and radioiodine refractory differentiated thyroid cancer. Front Endocrinol 2017; 8 : 312. doi: 10.3389/fendo.2017.00312.
2. Arenbergerová M, Puzanov I. Mutace BRAF: nový přístup k cílené léčbě melanomu. Klin Onkol 2012; 25 (5): 323–328.
3. Nikiforov YE, Steward DL, Robinson-Smith TM et al. Molecular testing for mutations in improving the fine-needle aspiration diagnosis of thyroid nodules. J Clin Endocrinol Metab 2009; 94 (6): 2092–2098. doi: 10.1210/jc.2009-0247.
4. Zhang Q, Liu SZ, Guan YX et al. Meta-analyses of association between BRAFV600E mutation and clinicopathological features of papillary thyroid carcinoma. Cell Physiol Biochem 2016; 38 (2): 763–776. doi: 10.1159/000443032.
5. Xing M. BRAF mutation in thyroid cancer. Endocr Relat Cancer 2005; 12 (2): 245–262.
6. Xing M, Alzahrani AS, Carson KA et al. Association between BRAF V600E mutation and recurrence of papillary thyroid cancer. J Clin Oncol 2015; 33 (1): 42–50. doi: 10.1200/JCO.2014.56.8253.
7. Dettmer MS, Schmitt A, Steinert H et al. Tall cell papillary thyroid carcinoma: new diagnostic criteria and mutations in BRAF and TERT. Endocr Relat Cancer 2015; 22 (3): 419–429. doi: 10.1530/ERC-15-0057.
8. Ito Y, Yoshida H, Maruo R et al. BRAF Mutation in papillary thyroid carcinoma in a japanese population: its lack of correlation with high-risk clinicopathological features and disease-free survival of patients. Endocr J 2009; 56 (1): 89–97.
9. Sancisi V, Nicoli D, Ragazzi M et al. BRAFV600E mutation does not mean distant metastasis in thyroid papillary carcinomas. J Clin Endocrinol Metab 2012; 97 (9): E1745–E1749. doi: 10.1210/jc.2012-1526.
10. Tavares C, Coelho MJ, Eloy C et al. NIS expression in thyroid tumors, relation with prognosis clinicopathological and molecular features. Endocr Connect 2018; 7 (1): 78–90. doi: 10.1530/EC-17-0302.
11. Donh H, Shen WZ, Yan YJ et al. Effects of BRAFV600E mutation on Na+/I-symporter expression in papillary thyroid carcinoma. J Huazhong Univ Sci Technolog Med Sci 2016; 36 (1): 77–81. doi: 10.1007/s11596-016-1545-3.
12. Knauf JA, Sartor MA, Medvedovic M et al. Progression of BRAF-induced thyroid cancer is associated with epithelial–mesenchymal transition requiring concomitant MAP kinase and TGFβ signaling. Oncogene 2011; 30 (28): 3153–3162. doi: 10.1038/onc.2011.44.
13. Ludvíková M, Kholová I, Kalfeřt D. Molecular aspects of thyroid tumors with emphasis on microRNA and their clinical implications. Klin Onkol 2017; 30 (3): 167–174. doi: 10.14735/amko2017167.
14. Penna GC, Vaisman F, Vaisman M et al. Molecular markers involved in tumorigenesis of thyroid carcinoma: focus on aggressive histotypes. Cytogenet Genome Res 2016; 150 (3–4): 194–207. doi: 10.1159/000456576.
15. Ricarte-Filho JC, Ryder M, Chitale DA et al. Mutational profile of advanced primary and metastatic radioactive iodine-refractory thyroid cancers reveals distinct pathogenetic roles for BRAF, PIK3CA, and AKT1. Cancer Res 2009; 69 (11): 4885–4893. doi: 10.1158/0008-5472.CAN-09-0727.
16. Sabra MM, Dominguez JM, Grewal RK et al. Clinical outcomes and molecular profile of differentiated thyroid cancers with radioiodine-avid distant metastases. J Clin Endocrinol Metab 2013; 98 (5): E829–E836. doi: 10.1210/jc.2012-3933.
17. Durante C, Haddy N, Baudin E et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. J Clin Endocrinol Metab 2006; 91 (8): 2892–2899. doi: 10.1210/jc.2005-2838.
18. Saji M, Ringel MD. The PI3K-Akt-mTOR pathway in initiation and progression of thyroid tumors. Mol Cell Endocrinol 2010; 321 (1): 20–28. doi: 10.1016/j.mce.2009.10.016.
19. ElMokh O, Ruffieux-Daidié D, Roelli MA et al. Combined MEK and Pi3’-kinase inhibition reveals synergy in targeting thyroid cancer in vitro and in vivo. Oncotarget 2017; 8 (15): 24604–24620. doi: 10.18632/oncotarget.15599.
20. Nagarajah J, Le M, Knauf JA et al. Sustained ERK inhibition maximizes responses of BrafV600E thyroid cancers to radioiodine. J Clin Invest 2016; 126 (11): 4119–4124. doi: 10.1172/JCI89067.
21. Cheng Y, Tian H. Current development status of MEK inhibitors. Molecules 2017; 22 (10): E1551. doi: 10.3390/molecules22101551.
22. Kurata K, Onoda N, Noda S et al. Growth arrest by activated BRAF and MEK inhibition in human anaplastic thyroid cancer cells. Int J Oncol 2016; 49 (6): 2303–2308. doi: 10.3892/ijo.2016.3723.
23. Wei WJ, Sun ZK, Shen CT et al. Obatoclax and LY3009120 efficiently overcome vemurafenib resistance in differentiated thyroid cancer. Theranostics 2017; 7 (4): 987–1001. doi: 10.7150/thno.17322.
24. Cabanillas ME, Patel A, Danysh BP et al. BRAF Inhibitors: experience in thyroid cancer and general review of toxicity. Horm Cancer 2015; 6 (1): 21–36. doi: 10.1007/s12672-014-0207-9.
25. Brose MS, Nutting CM, Jarzab B et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 2014; 384 (9940): 319–328. doi: 10.1016/S0140-6736 (14) 60421-9.
26. Schlumberger M, Tahara M, Wirth LJ et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 2015; 372 (7): 621–630. doi: 10.1056/NEJMoa1406470.
27. Heneberg P. Dabrafenib: nový inhibitor hyperaktivní kinázy B-RAF. Klin Onkol 2012; 25 (5): 333–339.
28. Kopecký J. Kubeček O. Role BRAF/MEK inhibice u metastazujícího maligního melanomu – kazuistika. Klin Onkol 2016; 29 (2): 133–138. doi: 10.14735/amko2016133.
29. Ho AL, Grewal RK, Leboeuf R et al. Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer. N Engl J Med 2013; 368 (7): 623–632. doi: 10.1056/NEJMoa1209288.
30. Brose MS, Cabanillas ME, Cohen EE et al. Vemurafenib in patients with BRAFV600E – positive metastatic or unresectable papillary thyroid cancer refractory to radioactive iodine: a non-randomised, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17 (9): 1272–1282. doi: 10.1016/S1470-2045 (16) 30166-8.
31. Rothenberg SM, McFadden DG, Palmer EL et al. Redifferentiation of iodine-refractory BRAF V600E – mutant metastatic papillary thyroid cancer with dabrafenib. Clin Cancer Res 2015; 21 (5): 1028–1035. doi: 10.1158/1078-0432.CCR-14-2915.
32. Huillard O, Tenenbaum F, Clerc J et al. Restoring radioiodine uptake in BRAF V600E – mutated papillary thyroid cancer. J Endocr Soc 2017; 1 (4): 285–287. doi: 10.1210/js.2016-1114.
33. Subbiah V, Kreitman RJ, Wainberg ZA et al. Dabrafenib and trametinib treatment in patients with locally advanced or metastatic BRAF V600 – mutant anaplastic thyroid cancer. J Clin Oncol 2018; 36 (1): 7–13. doi: 10.1200/JCO.2017.73.6785.
34. Balmelli C, Railic N, Siano M et al. Lenvatinib in advanced radioiodine-refractory thyroid cancer – a retro-spective analysis of the swiss lenvatinib named patient program. J Cancer 2018; 9 (2): 250–255. doi: 10.7150/jca.22318.
35. Cabanillas ME, Habra MA. Lenvatinib: Role in thyroid cancer and other solid tumors. Cancer Treat Rev 2016; 42 : 47–55. doi: 10.1016/j.ctrv.2015.11.003.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2018 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gravidita po terapii pro karcinom prsu
- Gravidita a ovariální stimulace u pacientek s karcinomem prsu
- Metaanalýza polymorfizmů v BRCA1 a náchylnost k nádorům prsu
- Význam mutace BRAFV600E v tyreoidální onkologii a možnosti léčebného ovlivnění – aktuální poznatky a výsledky studií
- Psychoneuroimunológia nádorových chorôb – súčasné východiská a perspektívy
- Detekce EGFR mutací v cirkulující nádorové DNA (ctDNA) v plazmě – mezilaboratorní porovnání referenčních laboratoří v České republice
- Zhodnocení výskytu a charakteru neurologických/neuropsychiatrických komplikací v souboru pacientů s maligním melanomem léčených adjuvantně vysokodávkovaným interferonem
- Metastáza nádoru do nádoru – raritný prípad svetlobunkového renálneho karcinómu obsahujúceho metastázu adenokarcinómu neznámeho pôvodu
- Pituitárna metastáza u pacienta s pľúcnym adenokarcinómom prezentujúca sa poruchou vedomia
- Solidní pseudopapilární tumor pankreatu – vzácné onemocnění 20leté ženy
- Afatinib v léčbě pokročilého nemalobuněčného karcinomu plic se vzácnou mutací EGFR (v exonu 18-T719X) – kazuistika
- Aktuality z odborného tisku
- Pocta MUDr. Zdeňkovi Mechlovi, CSc.
- Jubilant doc. MUDr. Bohuslav Konopásek, CSc.
- TAS-102 (trifluridin/tipiracil) zlepšuje celkové přežití u pacientů s metastazujícím karcinomem žaludku refrakterním na standardní léčbu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Solidní pseudopapilární tumor pankreatu – vzácné onemocnění 20leté ženy
- Psychoneuroimunológia nádorových chorôb – súčasné východiská a perspektívy
- Význam mutace BRAFV600E v tyreoidální onkologii a možnosti léčebného ovlivnění – aktuální poznatky a výsledky studií
- Jubilant doc. MUDr. Bohuslav Konopásek, CSc.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



