-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Zhodnocení výskytu a charakteru neurologických/neuropsychiatrických komplikací v souboru pacientů s maligním melanomem léčených adjuvantně vysokodávkovaným interferonem
Assessment of Incidence and Character of Neurologic/ Neuropsychiatric Complications in a Group of Patients with Malignant Melanoma Treated with Adjuvant High Dose Interferon
Background:
Authors describe the incidence and character of neurologic and neuropsychiatric complications – particularly depression and parkinsonism – during adjuvant treatment of malignant melanoma (MM) with high dose interferon (HDI). Among the most frequently observed side effects are fatigue, hematotoxicity, and hepatotoxicity. Most research has been directed at depression and parkinsonism because of the lack of literature concerning these complications. Interferon induced parkinsonism has only been described rarely and only in case reports.
Patients and methods:
Twenty-nine patients with MM, treated from January 2010 to January 2014 with adjuvant high dose interferon alfa-2b intravenous (HDI 20MIU/sqm for 5 days per week during the first 4 weeks, and then maintenance subcutaneous 10MIU/sqm up to a total time of 1 year) were retrospectively evaluated and the incidence and character of neurologic and neuropsychiatric complications were determined.
Results:
Significant neurologic and neuropsychiatric complications were observed in 3 of the 29 patients. Dose modifications were required in 2 cases. One case developed parkinsonism and treatment had to be stopped after 10 applications of intravenous interferon.
Conclusion:
High dose interferon can cause depression and parkinsonism. Prophylaxis with antidepressant medication can keep the incidence of depression as low as 10% or lower. Development of parkinsonism during HDI is rare. According to available reports, this is the first description of parkinsonism development related to HDI in MM.
Key words
malignant melanoma – high dose interferon – neurologic and neuropsychiatric complication – drug-induced depression – drug-induced parkinsonism
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 7. 4. 2018
Accepted: 16. 8. 2018
Autoři: Prošvicová Jarmila 1; Grim Jiří 2; Kopecký Jindřich 2; Priester Peter 2; Priester Iva 2; Trojanová Petronela 2; Jílková Věra 2; Paulík Adam 2; Lukešová Šárka 1; Stanislav. Filip 2
Působiště autorů: Oddělení klinické onkologie, Oblastní nemocnice Náchod a. s. 1; Klinika onkologie a radioterapie FN Hradec Králové 2
Vyšlo v časopise: Klin Onkol 2018; 31(5): 361-365
Kategorie: Původní práce
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2018361Souhrn
Východiska:
Autoři popisují výskyt a charakter neurologických a neuropsychiatrických komplikací – konkrétně deprese a parkinsonizmu – jakožto interferonem indukovaných komplikací při adjuvantní léčbě maligního melanomu (MM) vysokodávkovaným interferonem (high dose interferon – HDI). Mezi nejčastější nežádoucí účinky této léčby patří únava, hematotoxicita a hepatotoxicita. Autoři se věnují především depresi a parkinsonizmu, jelikož o tom v literatuře moc informací není. Interferony indukovaný parkinsonizmus je popisován pouze raritně a kazuisticky.
Soubor pacientů a metody:
V souboru je retrospektivně hodnocen výskyt a charakter neurologických a neuropsychiatrických komplikací u 29 pacientů s MM, léčených mezi lednem 2010 a lednem 2014 adjuvantně vysokodávkovaným interferonem alfa-2b intravenózně (HDI 20 MIU/m2 5 dní v týdnu první 4 týdny, pak udržovací schéma subkutánní 10 MIU/m2 do celkové doby 1 roku).
Výsledky:
Ve 3 případech z 29 byl zaznamenán rozvoj významných neurologických a neuropsychiatrických komplikací, přičemž redukci dávky či schématu si projevená symptomatika vyžádala ve 2 případech. V 1 případě se jednalo o rozvoj parkinsonizmu, pro který bylo nutné léčbu předčasně ukončit po 10 podáních.
Závěr:
Interferony ve vysokodávkovaném podání mohou způsobit rozvoj deprese a parkinsonizmu. Profylaktickým podáním antidepresiva lze výskyt deprese udržovat pod 10 %. Rozvoj parkinsonizmu při HDI je vzácný, v našem souboru představoval 1 z 29 případů. Dle nám známých literárních dat se jedná o první popisovaný rozvoj parkinsonizmu v souvislosti s HDI u MM.
Klíčová slova:
maligní melanom – vysokodávkovaný interferon – neurologické a neuropsychiatrické komplikace – léky indukovaná deprese – léky indukovaný parkinsonizmus
Úvod
Maligní melanom (MM) je nejfatálnější z kožních nádorů a jeho incidence celosvětově vzrůstá až o 5 % meziročně [1]. V ČR má incidence MM vzrůstající tendenci a dle dat Ústavu zdravotnických informací a statistiky z roku 2016 se pohybuje okolo 25 na 100 000 mužů a 19 na 100 000 žen.
Vysoce rizikoví pacienti po resekci MM stadia IIB, IIC, III a IV mají dle American Joint Committee on Cancer (AJCC) riziko 30–60 % rekurence a úmrtí (30 % u stadia IIB, u stadia IIIC je to až 60 %). Lokoregionální rekurence po úvodní chirurgické léčbě má prognózu horší. Ve stadiu IIIA je 5leté přežívání (overall survival – OS) 70 %, zatímco ve stadiu IIIC 39 % [2]. V těchto stadiích adjuvantní léčba prokázala maximální benefit ve smyslu zlepšeného OS, a je proto v těchto stadiích indikována.
Adjuvantní léčba
Za radikální léčbu MM lze považovat léčbu chirurgickou, pokud nádor nedosáhl angiogenního switch a vertikálního růstu. U melanomů, jejichž tloušťka dle Breslow je větší než 1 mm, nelze s jistotou vyloučit potenciál k metastazování. Rovněž tak u MM s povrchovou ulcerací či mikrometastázami v uzlinách.
V adjuvantní léčbě MM se užívá interferonů (IFN) již skoro 30 let. IFN-α-2b je první schválenou látkou, avšak doposud zůstává tato léčba kontroverzní. Ze souhrnných dat studií E1684, E1690, E1694, EORTC 18952 a EORTC 18991 vychází, že vysokodávkovaný interferon (high-dose interferon – HDI) zlepšuje dobu bez relapsu choroby o zhruba 33 % a má vliv i na OS [3]. Mezi nejčastější nežádoucí účinky (NÚ) patří únava, hematotoxicita a hepatotoxicita. IFN jsou řazeny mezi preparáty, které mohou indukovat depresi. Léky indukovaný parkinsonizmus je popisován pouze raritně a kazuisticky.
IFN jsou přirozeně se v těle vyskytující cytokiny s antivirovou, imunomodulační, antiproliferační a antiangiogenní aktivitou [1,4]. Kromě typických a téměř vždy přítomných komplikací HDI, jako jsou chřipkový syndrom (tzv. flue-like syndrom – zvýšené teploty, pocení, artralgie, myalgie, bolesti hlavy, nechutenství), pokles v některé krevní řadě (leuko/trombocytopenie), se vyskytují komplikace o něco vzácnější, které mají autoimunitní podklad (hypothyreóza). Sem můžeme zařadit i některé neurologické a neuropsychiatrické komplikace (depresivní stavy).
Rozvoj NÚ má charakteristickou dynamiku. V prvních dnech intravenózní aplikace to je flue-like syndrom s bolestmi hlavy. V horizontu týdnů, zpravidla ještě v průběhu intravenózní aplikace, je to hepatopatie a neutropenie. Únava, anémie, anxieta a depresivní stavy přicházejí zpravidla až v udržovací subkutánní fázi, několik měsíců od zahájení aplikace [5].
Proti některým z NÚ můžeme úspěšně působit i profylakticky, důslednou hydratací (osvědčuje se pomalá infuze 2 000 ml fyziologického roztoku přes noc) či aplikací intravenózního paracetamolu po vykapání infuze s IFN (s opatrností při projevu hepatopatie).
Neurologické a neuropsychiatrické komplikace
Neurologické komplikace aplikace IFN můžeme rozdělit na centrální a periferní. Mezi nejčastější neuropsychiatrické komplikace se řadí depresivní stavy, poruchy spánku, únava, podrážděnost či nervozita. Popisovány jsou i stavy zmatenosti, anhedonie, váhový úbytek, třes, sexuální dysfunkce, zhoršení paměti, manické symptomy, kognitivní dysfunkce a suicidální tendence [6–9]. V literatuře se udává, že psychické obtíže potkají až 30 % pacientů, depresi popisuje 30–45 %, únavu 70–100 % pacientů [10,11].
Léky indukovaná deprese je zvláštní kategorií v neurobiologii deprese [12]. Dochází k narušení neurochemie podávaným IFN. Jeho působení může koincidovat i s autoimunitním či endokrinním navozením deprese. Terapie cytokiny je natolik známá tím, že navozuje depresi, že dokonce existuje i nozologická jednotka „cytokiny indukovaná deprese“. Model cytokiny indukované deprese nám poskytuje důležité informace právě o rizikových faktorech a biologických cestách zahrnutých v etiologii symptomů deprese. Exogenní podání cytokinů aktivuje proinflamatorní cytokiny, což navodí alterace v neurotransmisi a endokrinních drahách, a je patogenezí zmiňované neurotoxicity [13].
V průkopnických ECOG (Eastern Cooperative Oncology Group) studiích s HDI je popisován rozvoj depresí či jiné neuropsychiatrické symptomatiky až u 40 % léčených pacientů, z čehož 10 % potřebovalo konzultaci či léčbu psychiatra a modifikaci dávky HDI [10].
Mánie, bipolární poruchy a změny nálad bývají spojovány spíše se změnou dávkování IFN či ukončením terapie. Rozvoj mánie či prohloubení deprese navzdory podávání antidepresiv je již stav, který patří do rukou psychiatra. Tři pacienti léčení v Greenbergově studii dobře odpověděli na gabapentin ve smyslu stabilizace nálady, nespavosti a rovněž ve smyslu prevence rozvoje mánie během léčby deprese [8].
Deprese postihuje 30–45 % pacientů léčených IFN a její hloubka může vést k ukončení terapie [14,15]. Navzdory této klinické závažnosti mechanizmy, na jejichž podkladě se IFN-α-indukovaná deprese rozvíjí, nebyly stále zcela popsány. Koincidovat může i příčina endokrinní či autoimunitní. Rozvoj je závislý na dávce a přichází spíše až s dlouhodobou terapií, není to rychle vznikající projev. Hovoří se i o vlivu na nervové kmenové buňky [16]. Tým Musselmana et al popisuje, že profylaktickým podáváním antidepresiv lze výskyt deprese snížit na 11 % [17].
Dopad únavy navozené léčbou je významný a může vést až k redukci dávkového schématu či ukončení léčby. I při převedení z nitrožilního podávání na subkutánní mohou příznaky únavy přetrvávat a ovlivnit tak adherenci pacienta k léčbě. Ačkoliv kognitivní deficit nebyl ve studii Kirkwooda et al [10] popsán, Valentine et al popisují poruchy nálad a zpomalení kognitivního výkonu [18]. Ke zlepšení tohoto nálezu u pacientů bylo třeba snížení dávky IFN (> 3 mill. MIU/m2).
Z NÚ periferních bývají vzácně popisovány parestezie, poruchy citlivosti, neuropatie či třes. Léky indukovaný parkinsonizmus je druhou nejčastější příčinou rozvoje parkinsonizmu po Parkinsonově chorobě [13,19]. Bývá závislý na dávce. Rozvoj parkinsonizmu v důsledku podávání IFN jsme v literárním rozboru našli popisovaný pouze 3 kazuistikami.
Profylaktické podání antidepresiva na principu selektivních inhibitorů zpětného vychytávání serotoninu modifikuje dysfunkční neurotransmiterový systém. Pokud s podáváním antidepresiv příznaky neustupují, ba se naopak prohlubují, je potřeba na depresi pohlédnout jakožto na systémové neuroprogresivní onemocnění, které působí v těle na mnoha biologických drahách vč. imunologických faktorů, a konzultovat s psychiatrem a neurologem.
Charakteristika souboru pacientů a metody
Soubor je tvořen 16 muži a 13 ženami ve věkovém rozmezí 26–72 let (průměr 56,6 roku). Jedná se o pacienty indikované ke standardní adjuvantní léčbě HDI s MM stadia IIB, IIIA a IIIB MM dle AJCC (s tloušťkou dle Breslowa > 2 mm, úrovní invaze dle Clarka > III, s přítomností intranzitních metastáz – regionální metastázy v kůži lokalizované od 2 cm od primárního ložiska do první drénující uzliny), tj. pT3N0M0 (1,5–4 mm), pT4N0M0, s pozitivní sentinelovou uzlinou nebo pTxN1-2M0 s klinicky zjevnými metastázami do uzlin, s rekurencí do uzlin nebo s postiženými uzlinami a neznámým primárním ložiskem. Jedná se o soubor pacientů léčených v době, kdy nebyly adjuvantně dostupné checkpoint inhibitory ani v klinické studii, proto jsou data vztažená k neurologickým a neuropsychiatrickým komplikacím dobře výmluvná pro IFN (tab. 1–3) a nedochází k překrývání s NÚ imunoterapie, které mají často autoimunitní podklad.
Tab. 1. Podání HDI, redukce dávky či schématu. 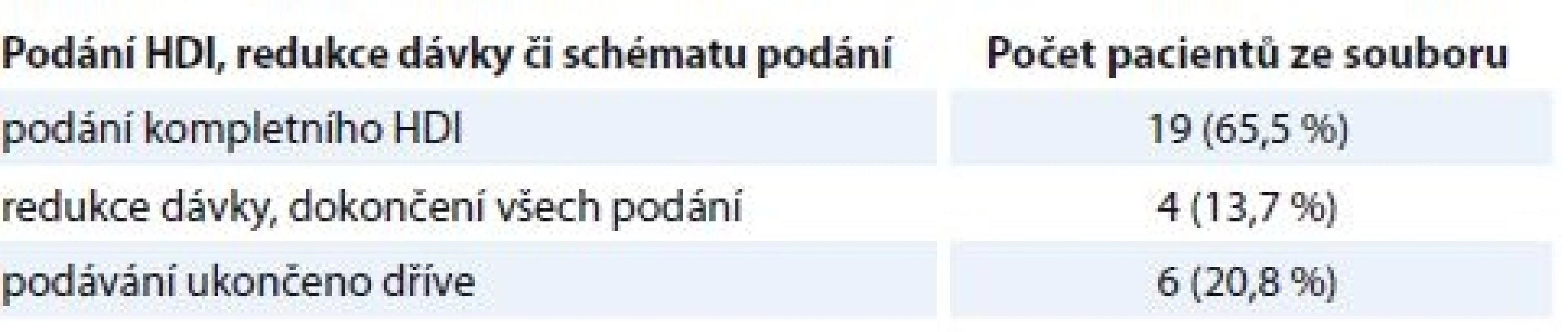
HDI – vysokodávkovaný interferon Tab. 2. Charakteristika pacientů, u kterých došlo k redukci či schématu podávání. 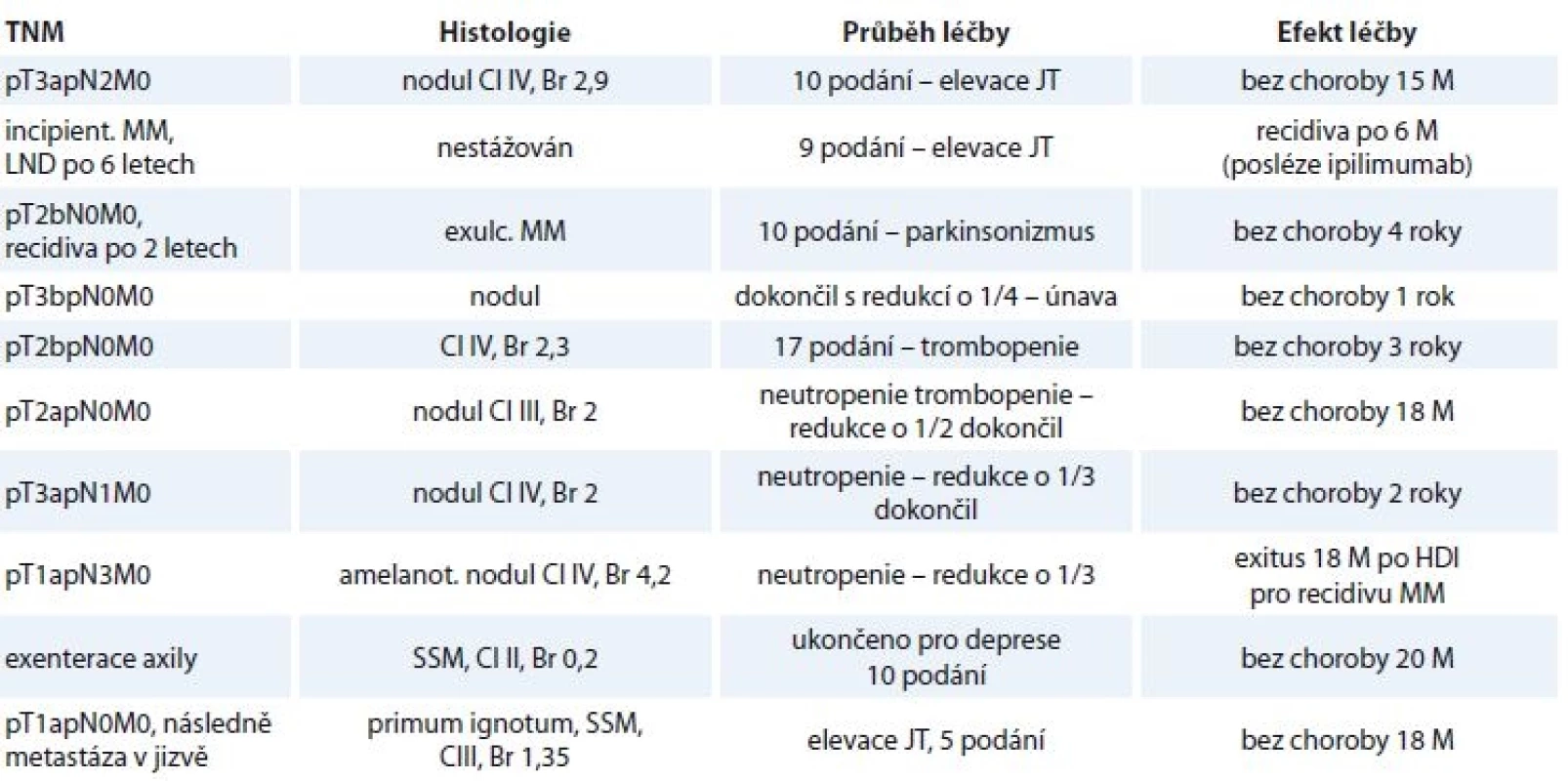
nodul – nodulární melanom, JT – jaterní testy, M – měsíce, HDI – vysokodávkovaný interferon, MM – maligní melanom, SSM – superfi ciálně se šířící melanom, Cl – hodnota dle Clarka, Br – hodnota dle Breslowa Tab. 3. Charakteristika pacienta s dokumentovaným rozvojem deprese ke konci HDI, u něhož nebyla redukována dávka ani schéma HDI. 
nodul – nodulární melanom, Br – hodnota dle Breslowa, HDI – vysokodávkovaný interferon Podaná léčba
Pacientům byl v adjuvantní léčbě podáván intravenózně HDI alfa-2b v dávce 20 MIU/m2 5 dní v týdnu první 4 týdny, pak udržovací schéma subkutánní 10 MIU/m2 do celkové doby 1 roku. Adjuvantní léčbu zahájili do 6 týdnů od radikální operace MM či disekce uzlinové recidivy. Po dobu léčby byl kladen důraz na dostatečnou hydrataci (min. 2 l/den, optimálně pomalá parenterální hydratace přes noc), kontrolu hematologických a biochemických parametrů, zejména jaterních funkcí a profylaxi antidepresivem. Ve shodě s doporučením psychiatrů jsme v našem souboru podávali profylakticky sertralin. Podávání bylo zahájeno ještě před zahájením adjuvantní léčby a dávka sertralinu byla postupně navýšena až na 200 mg/den.
U jednoho pacienta (tab. 3) máme popisovaný rozvoj deprese, který nás však nevedl k redukci dávky či schématu podávání, přesněji řečeno markantnější a v psychiatrické anamnéze zaznamenaný rozvoj deprese byl až ke konci podání HDI.
Výsledky
Výsledky jsou prezentovány s mediánem follow-upu 2 roky. V souboru 29 pacientů léčených HDI s profylaktickým podáváním sertralinu 200 mg/den jsme závažné neurologické komplikace shledali ve třech případech (10,3 %). V prvním případě byla hloubka deprese – navzdory profylaxi sertralinem – taková, že nás po 10. podání, po domluvě s psychiatrem, přiměla léčbu ukončit.
Ve druhém případě měl rozvoj deprese oddálený nástup a klinické relevance dosáhl ke konci intravenózního podávání. Z 11 pacientů (uvedených v tab. 2 a 3) 2 zemřeli, 9 jich dlouhodobě přežívá (81 %).
V jednom případě (3,4 %) jsme dokumentovali na základě klinického vyšetření rozvoj parkinsonizmu (třes a rigiditu), což před léčbou přítomné nebylo. Jeho charakter byl takový, že si vyžádal ukončení léčby HDI po 10 aplikacích. Pacient byl předán do neuropsychiatrické péče a symptomy parkinsonizmu v čase a po léčbě odezněly. Dle nám známých literárních dat se jedná o první popisovaný rozvoj parkinsonizmu v souvislosti s HDI u MM.
Co jistě stojí za vyzdvižení při pohledu do tab. 2 a 3, pacienti, u kterých se rozvinuly NÚ, které často i vedly k ukončení terapie či redukci dávky a schématu, si vedou velmi dobře stran OS a doby do progrese.
Diskuze
Výskyt deprese u pacientů adjuvantně léčených HDI se popisuje okolo 30–45 %. Tým Musselmana et al popisuje rozvoj deprese u téměř poloviny (45 %) pacientů léčených HDI, bez profylatického podání antidepresiva (v rameni s placebem), kdežto pouze u 11 % pacientů při profylaktickém podání paroxetinu [17]. V našem souboru s profylakticky podávaným sertralinem jsme se dostali na stejné procento neuropsychiatrických komplikací (10,3 %); vztaženo přímo jen na depresi, pohybujeme se v našem souboru okolo 7 %.
Jaké máme současné možnosti diagnostiky a prevence? Je velmi důležité psychiatrické anamnéze (depresivní stavy, anxiozita, abúzus) věnovat pozornost před zahájením léčby, jelikož antidepresivům trvá přibližně 4–6 týdnů nástup plného terapeutického efektu. Takováto anamnéza není kontraindikací zahájení léčby, ale progrese symptomů v průběhu léčby může vést k jejímu předčasnému ukončení [20–23]. K tomu, abychom mohli zavčas detekovat nástup neuropsychiatrických symptomů, je třeba inkorporovat specifické otázky k detekci neuropsychiatrické patologie do svého rutinního klinického zhodnocení pacienta. Za příznaky, které přikládáme únavě navozené léčbou, se může také skrývat deprese. Změna oproti předléčebnému nastavení by pro nás měla být více směrodatná než numerické hodnocení deprese fungující obecně v psychiatrii. Nesmíme opomenout i přidružené příčiny, které kromě IFN mohou rozvoj deprese ještě potencovat – komedikace kortikosteroidy, hormonálními kontraceptivy či jinými hormony, jež mohou ovlivnit hladinu progestinu, β-blokátory apod. A pak stavy organické – reaktivní deprese, mozkové metastázy či dysfunkce štítné žlázy [5,20,23–24].
Naše zkušenosti v konkordanci s poznatky Hauschilda [5] či Raisona [25] potvrzují, že je smysluplné profylaktickou medikaci antidepresivy zahajovat rutinně. Ačkoliv v této oblasti neexistuje jasný konsenzus, antidepresiva prokázala efektivitu v léčbě IFN indukovaných poruch nálad, úzkosti a kognitivních zhoršení [25]. V našem souboru jsme podávali sertralin, avšak skutečně profylakticky čili min. 14 dní až 1 měsíc před začátkem HDI, od dávky 50 mg s postupným nastoupáním na 200 mg sertralinu denně. A to po dobu HDI, pak ještě po několik měsíců, setrvává-li pacient na udržovací léčbě následující rok, tak skutečně dlouhodobě. Při této komedikaci (sertralinu, citalopramu, fluoxetinu či paroxetinu) s IFN je třeba mít na paměti možný rozvoj okulární toxicity (retinopatie či neuropatie optiku) popisované Lohmanem et al a Hejnym et al u < 1 % pacientů léčených IFN [26,27]. Zároveň je nutno poznamenat, že podání antidepresiva může u pacientů, kteří jsou příliš depresivní na to, aby vyvíjeli jakoukoli aktivitu, relativně zvýšit možné riziko suicidálního jednání. Jedná se však o zcela výjimečné situace [28].
Z rozboru literárních zdrojů vyplývá, že rozvoj parkinsonizmu v průběhu HDI je raritní. Našli jsme pouze jednu kazuistiku popisující rozvoj parkinsonizmu indukovaný IFN, a to při léčbě chronické hepatitidy [29]. Wangensteen popisuje dva případy rozvoje parkinsonizmu při aplikaci IFN rovněž u pacientů s chronickou hepatitidou [30]. V našem souboru se jedná o první popsaný rozvoj parkinsonizmu při léčbě MM pomocí HDI.
Pokud se objeví příznaky jako rigidita, tremor či posturální nestabilita v průběhu aplikace IFN, musíme na možný rozvoj parkinsonizmu pomyslet. Příznaky postupně odeznívají s ukončením podávání IFN a v reakci na psychiatrickou léčbu [31].
Závěr
Interferony ve vysokodávkovaném podání mohou způsobit rozvoj deprese a parkinsonizmu. Profylaktickým podáním antidepresiva lze výskyt deprese udržovat pod 10 %. Rozvoj parkinsonizmu při HDI je vzácný. Zaznamenali jsme 1 případ parkinsonizmu v souboru 29 pacientů s MM. K rozvoji parkinsonizmu došlo v průběhu 2. týdne aplikace intravenózního HDI. Po 10 podáních musela být pro rozvoj parkinsonizmu léčba ukončena. V čase a po léčbě příznaky zcela odezněly. Pacient je 4 roky bez známek recidivy či generalizace choroby. Dle nám známých literárních dat se jedná o první popisovaný rozvoj parkinsonizmu v souvislosti s HDI u MM.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Jarmila Prošvicová
Oddělení klinické onkologie
Oblastní nemocnice Náchod a. s.
Purkyňova 446 547 69 Náchod
e-mail: jaja.vanaskova@seznam.cz
Obdrženo: 7. 4. 2018
Přijato: 16. 8. 2018
Zdroje
1. Basu B, Biswas S, Wrigley J et al. Angiogenesis in cutaneous malignant melanoma and potential therapeutic strategie. Expert Rev Anticancer Ther 2009; 9 (11): 1583–1598. doi: 10.1586/era.09.135.
2. Balch CM, Gershenwald JE. Clinical value of the sentinel-node biopsy in primary cutaneous melanoma. N Engl J Med 2014; 370 (7): 663–664. doi: 10.1056/NEJMe1313690.
3. Kirkwood JM, Ibrahim J, Lawson DH et al. High-dose interferon alfa-2b does not diminish antibody response to GM2 vaccination in patients with resected melanoma: results of the Multicenter Eastern Cooperative Oncology Group Phase II Trial E2696. J Clin Oncol 2001; 19 (5): 1430–1436. doi: 10.1200/JCO.2001.19.5.1430.
4. Prošvicová (Vaňásková) J, Grim J, Kopecký J et al. High-dose interferon alfa v léčbě pacientů s maligním melanomem, sledování prediktivních a prognostických biomarkerů. Klin Onkol 2011; 24 (3): 180–186. doi: 10.14735/amko2011180.
5. Hauschild A, Gogas H, Tarhini A et al. Practical guidelines for the management of interferon-alpha-2b side effects in patients receiving adjuvant treatment for melanoma: expert opinion. Cancer 2008; 112 (5): 982–994. doi: 10.1002/cncr.23251.
6. Trask PC, Paterson AG, Esper P et al. Longitudinal course of depression, fatigue, and quality of life in patients with high risk melanoma receiving adjuvant interferon. Psychooncology 2004; 13 (8): 526–536. doi: 10.1002/pon.770.
7. Nishihori T, Abdo-Matkiwsky M, Fleishman SB et al. Severe action tremor related to interferon-alpha-2b therapy for malignant melanoma. Am J Clin Oncol 2005; 28 : 526.
8. Greenberg DB, Jonasch E, Gadd MA et al. Adjuvant therapy of melanoma with interferon-alpha-2b is associated with mania and bipolar syndromes. Cancer 2000; 89 (2): 356–362.
9. Morgan JC, Sethi KD. Drug-induced tremors. Lancet Neurol 2005; 4 (12): 866–876. doi: 10.1016/S1474-4422 (05) 70250-7.
10. Kirkwood JM, Bender C, Agarwala S et al. Mecha-nisms and management of toxicities associated with high-doseinterferon alfa-2b therapy. J Clin Oncol 2002; 20 (17): 3703–3718. doi: 10.1200/JCO.2002.03.052.
11. Afzal MZ, Pinnamaneni V, Birendra KC et al. A retrospective analysis of tolerance and outcomes of cutaneous malignant melanoma in patients receiving adjuvant interferon-alpha-2b: a community oncology perspective. J Exp Ther Oncol 2017; 11 (2): 91–96.
12. Höschl C. Neurobiologie deprese. [online]. Dostupné z: http: //www.hoschl.cz/files/4841_cz_Hoschl_Neurobiologie%20deprese-CTS%202013.pdf.
13. Udina M, Moreno-España J, Capuron L et al. Cytokineinduced depression: current status and novel targets for depression therapy. CNS Neurol Disord Drug Targets 2014; 13 (6): 1066–1074.
14. Bonaccorso S, Puzella A, Marino V et al. Immunotherapy with interferon-alpha in patients affected by chronic hepatitis C induces an intercorrelated stimulation of the cytokine network and an increase in depressive and anxiety symptoms. Psychiatry Res 2001; 105 (1–2): 45–55.
15. Lieb K, Engelbrecht MA, Gut O et al. Cognitive impairment in patients with chronic hepatitis treated with interferon alpha (IFNalpha): results from a prospective study. Eur Psychiatry 2006; 21 (3): 204–210. doi: 10.1016/j.eurpsy.2004.09.030.
16. Zheng LS, Hitoshi S, Kaneko N et al. Mechanisms for interferon-α-induced depression and neural stem cell dysfunction. Stem Cell Reports 2014; 3 (1): 73–84. doi: 10.1016/j.stemcr.2014.05.015.
17. Musselman DL, Lawson DH, Gumnick JF et al. Paroxetine for the prevention of depression induced by high-dose interferon alfa. N Engl J Med 2001; 344 (13): 961–966. doi: 10.1056/NEJM200103293441303.
18. Valentine AD, Meyers CA, Kling MA et al. Mood and cognitive side effects of interferon-alpha therapy. Semin Oncol 1998; 25 (Suppl 1): 39–47.
19. Brigo F, Erro R, Marangi A et al. Differentiating drug-induced parkinsonism from Parkinson‘s disease: an update on non-motor symptoms and investigations. Parkinsonism Relat Disord 2014; 20 (8): 808–814. doi: 10.1016/ j.parkreldis.2014.05.011.
20. Patten SB, Barbui C. Drug-induced depression: a systematic review to inform clinical practice. Psychother Psychosom 2004; 73 (4): 207–215. doi: 10.1159/000077739.
21. Schwartz AL, Thompson JA, Masood N. Interferon-induced fatigue in patients with melanoma: a pilot study of exercise and methylphenidate. Oncol Nurs Forum 2002; 29 (7): E85–E90. doi: 10.1188/02.ONF.E85-E90.
22. Hanna TP, Baetz T, Xu J et al. Mental health services use by melanoma patients receiving adjuvant interferon: association of pre-treatment mental health care with early discontinuation. Curr Oncol 2017; 24 (6): e503–e512. doi: 10.3747/co.24.3685.
23. Okereke OI. Neuropsychiatric complications associated with interferon-alpha-2b treatment of malignant melanoma. Psychosomatics 2002; 43 (3): 237–240. doi: 10.1176/appi.psy.43.3.237.
24. Eggermont AM, Suciu S, MacKie R et al. Post-surgery adjuvant therapy with intermediat doses of interferon-alfa-2b versus observation in patients with stage IIb/III melanoma (EORTC 18952): randomised controlled trial. Lancet 2005; 366 (9492): 1189–1196. doi: 10.1016/S0140-6736 (05) 67482-X.
25. Raison CL, Demetrashvili M, Capuron L et al. Neuropsychiatric adverse effects of interferon-alpha: recognition and management. CNS Drugs 2005; 19 (2): 105–123.
26. Lohmann CP, Kroher G, Bogenrieder T et al. Severe loss of vision during adjuvant interferon-alfa-2b treatment for malignant melanoma. Lancet 1999; 353 (9161): 1326. doi: 10.1016/S0140-6736 (99) 00403-1.
27. Hejny C, Sternberg P, Lawson DH et al. Retinopathy associated with high-dose interferon-alfa-2b therapy. Am J Ophthalmol 2001; 131 (6): 782–787.
28. Loftis JM, Hauser P. Safety of the treatment of interferon-alpha-induced depression. Psychosomatics 2003; 44 (6): 524–526. doi: 10.1176/appi.psy.44.6.524.
29. Almeida CM, Galvão Mde L, Ferreira PL et al. Interferon-induced Parkinsonism in a patient with chronic hepatitis C. Arq Neuropsiquiatr 2009; 67 (3A): 715–716.
30. Wangensteen KJ, Boyd JT, Hamill RW et al. Interferon alpha treatment, hepatitis C and Parkinson‘s disease [abstract]. Movement Disorders 2013; 28 (Suppl 1): 828.
31. Bohlega SA, Al-Foghom NB. Drug-induced Parkinson‘s disease. A clinical review. Neurosciences (Riyadh) 2013; 18 (3): 215–221.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Aktuality z odborného tisku
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2018 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Gravidita po terapii pro karcinom prsu
- Gravidita a ovariální stimulace u pacientek s karcinomem prsu
- Metaanalýza polymorfizmů v BRCA1 a náchylnost k nádorům prsu
- Význam mutace BRAFV600E v tyreoidální onkologii a možnosti léčebného ovlivnění – aktuální poznatky a výsledky studií
- Psychoneuroimunológia nádorových chorôb – súčasné východiská a perspektívy
- Detekce EGFR mutací v cirkulující nádorové DNA (ctDNA) v plazmě – mezilaboratorní porovnání referenčních laboratoří v České republice
- Zhodnocení výskytu a charakteru neurologických/neuropsychiatrických komplikací v souboru pacientů s maligním melanomem léčených adjuvantně vysokodávkovaným interferonem
- Metastáza nádoru do nádoru – raritný prípad svetlobunkového renálneho karcinómu obsahujúceho metastázu adenokarcinómu neznámeho pôvodu
- Pituitárna metastáza u pacienta s pľúcnym adenokarcinómom prezentujúca sa poruchou vedomia
- Solidní pseudopapilární tumor pankreatu – vzácné onemocnění 20leté ženy
- Afatinib v léčbě pokročilého nemalobuněčného karcinomu plic se vzácnou mutací EGFR (v exonu 18-T719X) – kazuistika
- Aktuality z odborného tisku
- Pocta MUDr. Zdeňkovi Mechlovi, CSc.
- Jubilant doc. MUDr. Bohuslav Konopásek, CSc.
- TAS-102 (trifluridin/tipiracil) zlepšuje celkové přežití u pacientů s metastazujícím karcinomem žaludku refrakterním na standardní léčbu
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Solidní pseudopapilární tumor pankreatu – vzácné onemocnění 20leté ženy
- Psychoneuroimunológia nádorových chorôb – súčasné východiská a perspektívy
- Význam mutace BRAFV600E v tyreoidální onkologii a možnosti léčebného ovlivnění – aktuální poznatky a výsledky studií
- Jubilant doc. MUDr. Bohuslav Konopásek, CSc.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



