Pituitárna metastáza u pacienta s pľúcnym adenokarcinómom prezentujúca sa poruchou vedomia
Pituitary Metastasis in a Patient with Pulmonary Adenocarcinoma Presenting with a Disturbance of Consciousness
Background:
Brain metastases are one of the main causes of morbidity and mortality of patients with oncological disease. In non-small cell lung carcinoma (NSCLC), the risk of CNS secondary development is 30–50%. An unusual diagnostic and therapeutic problem is the finding of suspicious pituitary lesions. Obtaining a differential diagnosis relies on evaluating the clinical course of the disease (visual disturbances, diabetes insipidus (DI), weakness etc.), and performing endocrinological examinations and imaging analyses (CT, but mainly MRI). Sometimes, however, definitive resolution of the problem requires histological assessment of the tumor. Case report: A 65-year-old patient with a newly diagnosed metastatic lung adenocarcinoma was admitted to our department for a first cycle of chemotherapy consisting of cisplatin and navelbine. However, at the beginning of hospitalization, the patient developed qualitative disturbances in consciousness and disorientation. Emergency CT of the CNS revealed a tumor of the pituitary gland, and a subsequent MRI showed intraseller and suprasellar masses making contact with the optic chiasma. An endocrinological examination revealed panhypopituitarism. Pituitary metastasis of NSCLC was confirmed by tumor histology using the trans-sphenoid approach.
Conclusion:
Lung and breast carcinomas are among the most common cancers to metastasize to the pituitary gland. The incidence of pituitary metastases is reported to be 0.4–28.1%. Clinically, they are mostly silent, but may manifest as endocrine disorders, such as DI, hypothyroidism, and hypocorticism, or as visual disturbances due to compression of the optic nerve. Management depends on the establishment of a correct diagnosis.
Key words:
hypopituitarism – magnetic resonance imaging – pituitary neoplasm – radiosurgery – targeted therapy
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 26. 4. 2018
Accepted: 27. 6. 2018
Autoři:
Cahajlová Radka 1; Kollerová Jana 2
Působiště autorů:
Oddelenie klinickej onkológie Kliniky pneumológie, ftizeológie a funkčnej diagnostiky SZU a UN Bratislava, Nemocnica Ružinov
1; V. interná klinika LF UK a UN Bratislava, Nemocnica Ružinov
2
Vyšlo v časopise:
Klin Onkol 2018; 31(5): 371-375
Kategorie:
Kazuistika
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amko2018371
Souhrn
Východiska:
Mozgové metastázy sú jednou z hlavných príčin morbidity a mortality pacientov s onkologickým ochorením. U nemalobunkového karcinómu pľúc (non-small cell lung cancer – NSCLC) je riziko rozvoja sekundarizmov v centrálnej nervovej sústave (CNS) 30–50 %. Špeciálny diagnostický a terapeutický problém je nález podozrivých ložísk v hypofýze. V diferenciálnej diagnostike sa opierame o klinický priebeh ochorenia (poruchy zraku, diabetes insipidus – –DI, slabosť atd.), endokrinologické vyšetrenie a zobrazovacie metódy (CT, ale hlavne MR). Niekedy však definitívne rozlúštenie problému prinesie až histologizácia tumorózneho procesu. Prípad: Pacient vo veku 65 rokov s novodiagnostikovaným metastatickým adenokarcinómom pľúc bol prijatý na naše oddelenie za účelom zahájenia prvého cyklu chemoterapie v zložení cisplatina a navelbin. V úvode hospitalizácie však u pacienta dochádza k rozvoju kvalitatívnej poruchy vedomia a dezorientácii. Urgentné CT CNS nachádza tumor hypofýzy, MR popisuje masu supra-a intraselárne, s kontaktom na optickú chiazmu. Endokrinologickým vyšetrením zisťujeme panhypopituitarizmus. Pituitárnu metastázu NSCLC potvrdzuje až histologizácia tumoru transfenoidálnym prístupom.
Záver:
K malignitám najčastejšie metastazujúcim do hypofýzy patria pľúcny karcinóm a karcinóm prsníka. Incidencia pituitárnych metastáz sa udáva od 0,4 do 28,1 %. Klinicky sú väčšinou nemé, môžu sa však manifestovať endokrinologickými poruchami ako sú DI, hypotyreóza a hypokorticizmus alebo poruchami zraku pri útlaku optickej dráhy. Od stanovenia správnej diagnózy závisí ďalší management pacienta.
Kľúčové slová:
hypopituitarizmus – magnetická rezonancia – tumor hypofýzy – rádiochirurgia – cielená liečba
Úvod
Napriek mnohým pokrokom v diagnostike a liečbe, pľúcny karcinóm (lung cancer – LC) naďalej patrí k nádorom s najvyššou incidenciou, v mortalite mu patrí nepopulárne prvé miesto [1]. Kameňom úrazu je vysoké percento neskoro diagnostikovaných prípadov Podľa Americkej spoločnosti pre výskum rakoviny (American Association for Cancer Research) ve IV. štádiu ochorenie k lekárovi prichádza až 40 % pacientov [2]. Na Slovensku a v Európe bude toto číslo pravdepodobne vyššie, keďže na rozdiel od USA tu zatiaľ nefunguje účinný screeningový program. Nemalobunkový karcinóm tvorí 85–90 % prípadov. LC [3,4], z histologických typov sa v USA, ale aj vo väčšine európskych krajín dostáva do popredia adenokarcinóm [1]. Klinicky môže ochorenie dlho ostať nemé. Slabosť, nechutenstvo, bolesti kostí, novovzniknuté parézy sú už známkami diseminovaného ochorenia. Mozgové metastázy (MTS) sú hlavnou príčinou morbidity a mortality pacientov s onkologickým ochorením [3]. Medián celkového prežívania (overall survival – OS) s mozgovými MTS je od 3,4–12,1 mesiaca [3,5–7]. Vo všeobecnosti sa udáva, že postihnutie centrálnej nervovej sústavy (CNS) má už iniciálne 7,4 % chorých, počas ochorenia počet vzrastie na 23–30 % [6]. Riziko pacientov s nemalobunkovým karcinómom pľúc (non-small cell lung cancer – NSCLC) patrí k najvyšším [3,7]. Sekundárne postihnutie hypofýzy je zriedkavé, udáva sa incidencia 0,4–28,1 % [6–11]. Medzi malignity najčastejšie metastazujúce do hypofýzy patrí karcinóm prsníka (breast cancer – BC) a LC [10,12,13]. Prvýkrát však pituitárnu MTS popísal v roku 1857 L. Benjamin a išlo o nález pacienta s diseminovaným malígnym melanómom [10,14]. Ložiská sú často klinicky nemé, alebo sa príznaky z MTS postihnutia prekrývajú s celkovými príznakmi onkologického ochorenia (slabosť, kachexia,…) [14,15]. Zobrazovacie metódy vrátane MR majú v diagnostike len pomocný význam, keďže nález môže často pripomínať benígne novotvary [12]. V nami uvedenej kazuistike uvádzame prípad pacienta, u ktorého sa pituitárna MTS manifestovala ťažkou kvalitatívnou poruchou vedomia navodenou hypokorticizmom, neskôr poruchou vízu pri postihnutí zrakovej dráhy. Podozrenie na mozgovú MTS potvrdila až histologizácia nádoru cestou transfenoidálnej resekcie.
Kazuistika
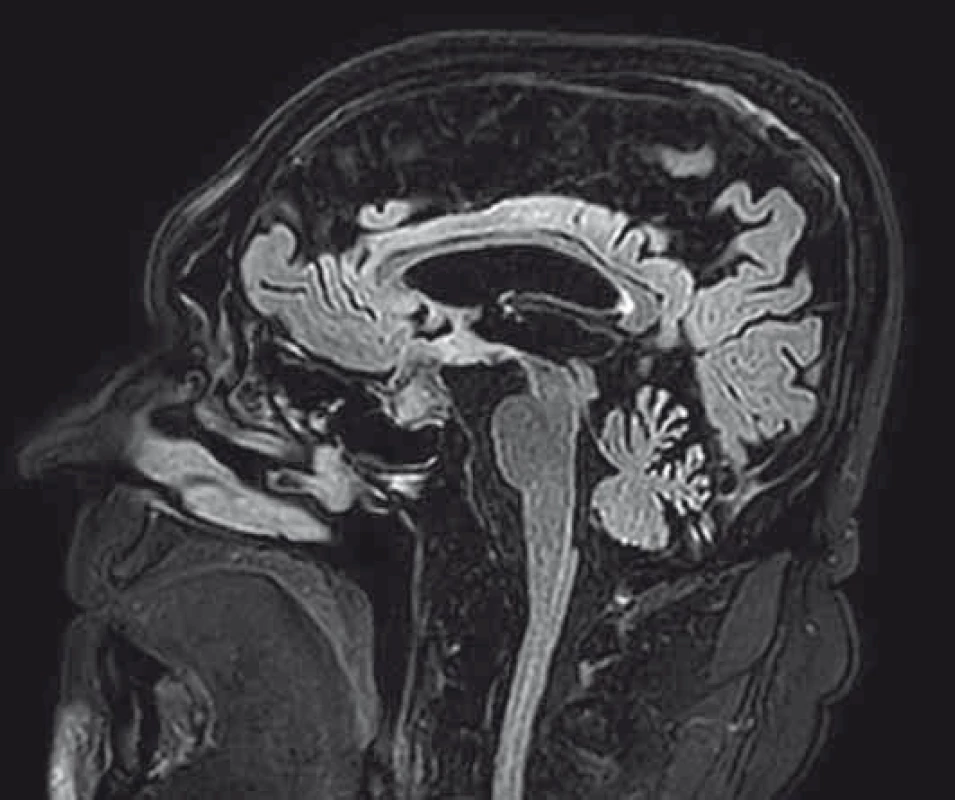
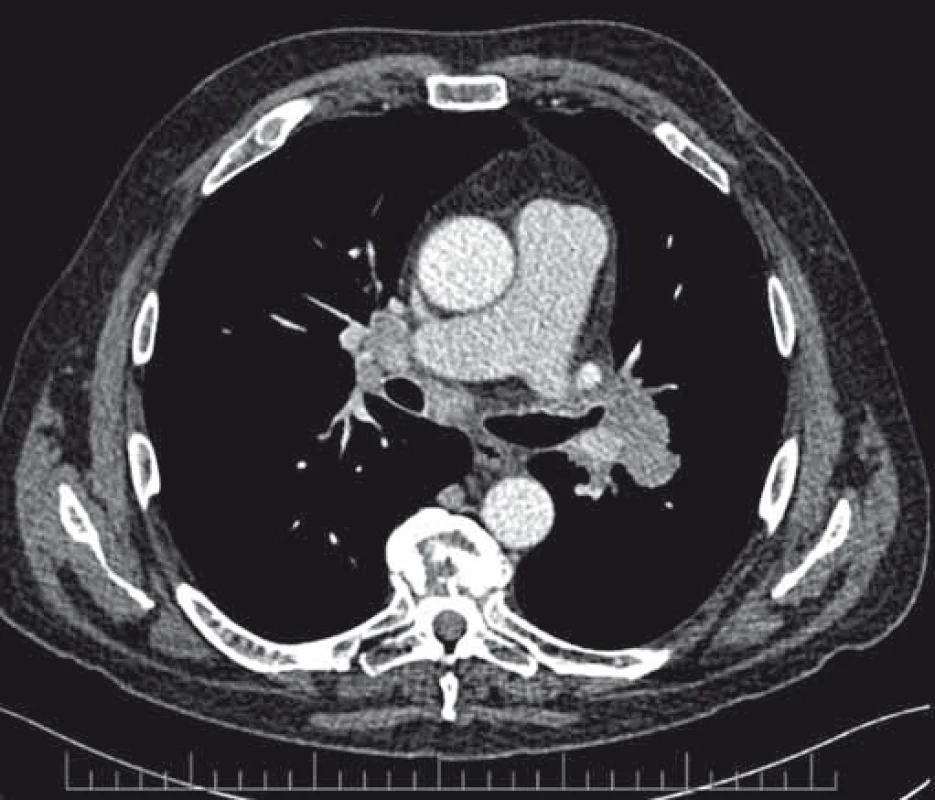
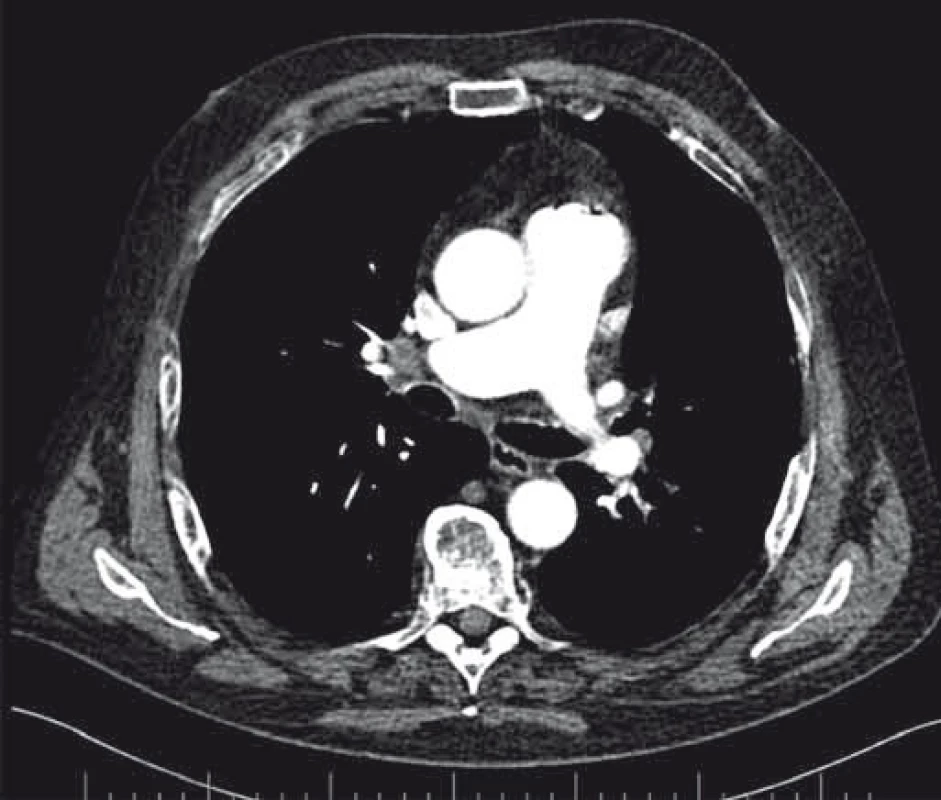
Pacient vo veku 65 rokov, nefajčiar, bez vážnejšieho predchorobia bol 3 mesiace prešetrovaný pre kašeľ a febrility. Počítačovou tomografiou (CT) bolo zistené tumorózne ložisko v oblasti ľavého pľúcneho hilu, mediastinálna a bilaterálna hilová lymfadenopatia, MTS na pľúcach obojstranne a v oblasti pravej nadobličky. Histologicky z bronchoskopie ide o pľúcny adenokarcinóm. Vzhľadom na oneskorenie molekulárno-genetickej analýzy a pokročilosť ochorenia sme sa rozhodli pre zahájenie systémovej liečby v zložení s platinovým doubletom. Pri príjme sa však u pacienta začali objavovať poruchy správania v zmysle intermitentnej dezorientácie až amentiformných stavov, ktoré v priebehu 2 dní prešli do dezorientácie s nutnosťou medikamentózneho tlmenia. Laboratórne odbery až na hyponatriémiu ľahkého stupňa sú bez nálezu vysvetľujúceho klinický stav, pacient je naďalej kardiopulmonálne kompenzovaný, skôr so sklonom ku nižším hodnotám tlaku (86/68 mmHg), normoxemický. Realizované CT CNS po opätovnom prehodnotení nachádza tumor hypofýzy, v MR obraze nález imponuje ako intra-/supraselárna expanzia, najskôr primárneho charakteru. V diferenciálnej diagnostike by sa mohlo jednať o makroadenóm, menej pravdepodobne kranyofaryngeóm. Konzultujeme neurochirurga, ktorý aktuálne neurochirurgický zákrok neodporúča, dopĺňame vyšetrenie hormonálneho profilu s novozisteným panhypopituitarizmom (deficit v kortiko-, tyreo-, gonado-i somatotropnej osi). Na odporúčanie endokrinológa sme pri adrenálnej kríze najskôr zahájili substitúciu hypokorticizmu parenterálne, za prísneho monitoringu mineralogramu, bilancií, tlaku a pulzu. Po 48 hod podávania kortikoidov pozorujeme úplnú úpravu psychického stavu, bez nutnosti sedácie. Zároveň však dochádza k rozvoju diabetes insipidus (DI), ktorý je nutné pre vysoký príjem a výdaj tekutín a hypokaliémiu (príjem 7 950 ml / výdaj 9 400 ml) korigovať podávaním dezmopresínu s titráciou dávky na dosiahnutie vyrovnanej bilancie tekutín a vyhovujúceho mineralogramu. Do liečby pre prehĺbenie voľného tyroxínu (fT4) pridávame tyroxín. Po stabilizácii stavu pacient zahájil chemoterapiu v zložení karboplatina + navelbin. Pre hematologickú toxicitu v zmysle afebrilnej neutropénie a leukopénie stupňa 2 deň 8 ani deň 15 liečby nebol podaný. Pred plánovaným zahájením druhého cyklu terapie pacient prichádza pre úplnú stratu zraku na pravom oku. Kontrolné MR vyšetrenie potvrdzuje progresiu veľkosti expanzie v oblasti tureckého sedla s útlakom optickej chiazmy (obr. 1). Perimeter pravého oka vykazuje absolútny skotóm, vľavo početné skotómy vo všetkých 4 kvadrantoch. Opätovne konzultovaný na neurochirugickej klinike. Neurochirurg už na základe charakteru MR nálezu suponuje MTS proces, pre progresiu stavu a zhoršovanie zraku i na druhom oku indikuje operačné riešenie. Pacient podstúpil dekompresiu a parciálnu resekciu tumoru. Histologicky ide o MTS ložisko, s prihliadnutím na imunohistochemickú analýzu (IHC) ide o MTS primárneho LC. Napriek neurochirurgickej intervencii k obnove zraku na pravom oku nedochádza, nález na ľavom oku je stacionárny. Indikovaná je rádioterapia (RAT) na CNS s boostom na selárnu oblasť. Po ukončení RAT, s prihliadnutím na prolongovanú toxicitu počas prvého cyklu chemoterapie a po obdržaní pozitívneho výsledku ROS1 mutácie chorý zahájil terapiu krizotinibom. Po troch cykloch liečby kontrolné CT popisuje takmer úplné vymiznutie tumoru v oblasti hilu, pľúcnych MTS aj ložísk na oboch nadobličkách (obr. 2, 3). Liečba panhypopituitarizmu je naďalej v rukách endokrinológa, pacient t. č. užíva hydrokortizon, tyroxín a antidiuretický hormón. Liečba testosterónom a rastovým hormónom vzhľadom ku základnému onkologickému ochoreniu nie je indikovaná. Je v dobrom výkonnostnom stave.
Diskusia
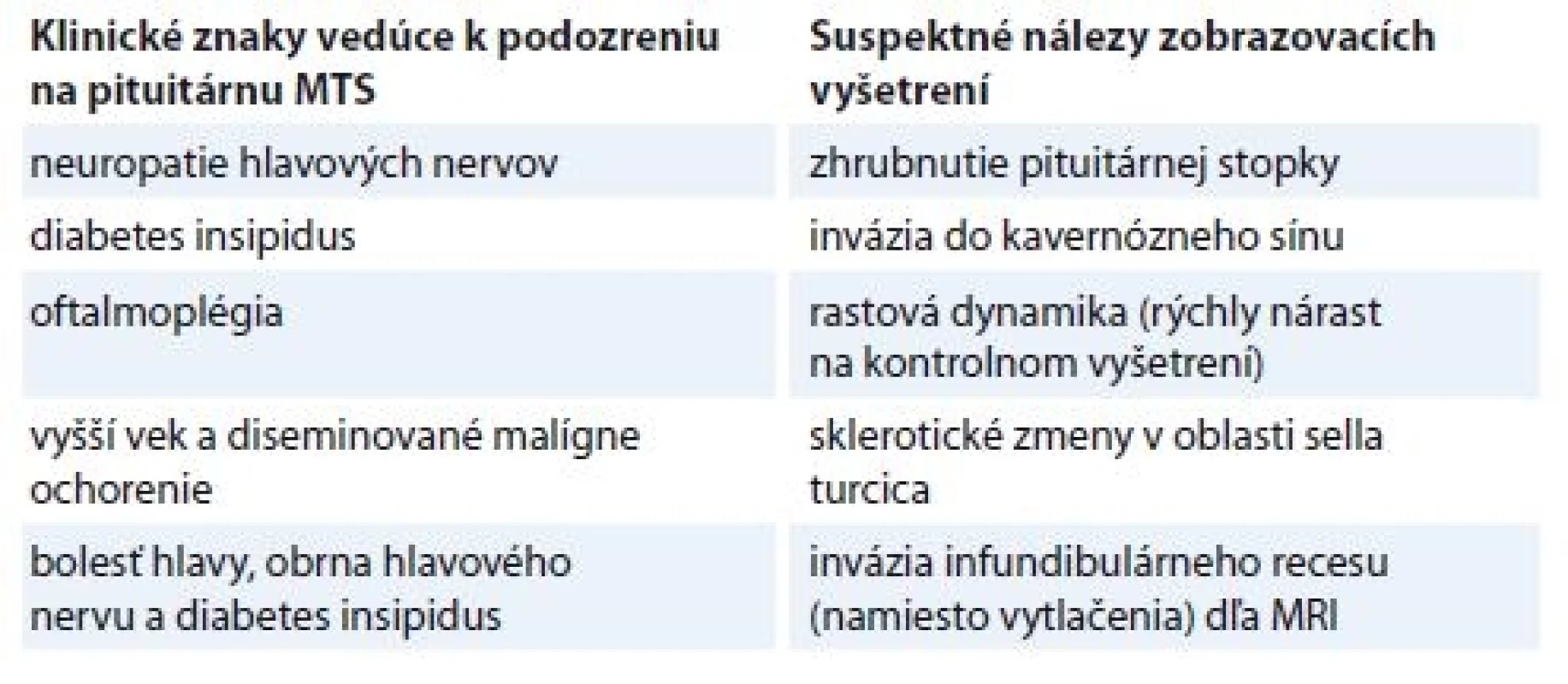
Mozgové MTS sú jednou z hlavných príčin morbidity a mortality pacientov s onkologickým ochorením. Udáva sa, že 20–40 % onkologických pacientov vyvinie mozgové MTS v priebehu ochorenia, pričom riziko pre pacientov s NSCLC je ešte o niečo vyššie, 30–50% [3]. Hypofýza je zriedkavým miestom metastázovania. Podľa Japonského registra tumorov CNS (Brain Tumor Registry of Japan) iba 0,4 % intracerebrálnych MTS je lokalizovaných hypofýze [9]. Literárne sa uvádza aj vyššia incidencia, a to 0,14–28,7 % [8,15,16]. Najčastejšie do hypofýzy metastazujú BC a LC [17,18]. Postihnutí sú väčšinou starší pacienti v 6. až 7. dekáde života, s diseminovaným malígnym ochorením [17]. Z anatomického hľadiska býva dominatne postihnutý zadný lalok hypofýzy, čo súvisí s priamym zásobením zadného laloka zo systémovej cirkulácie (hypofyzeálne artérie). Predný lalok býva postihnutý minoritne [8,10,11,17,19]. Iba 6,8–10 % pituitárnych MTS sa prejaví klinicky [8,12,14,17,18], pričom príznaky súvisia s postihnutím toho ktorého laloka. Zadný lalok hypofýzy produkuje oxytocín a antidiuretický hormón, najčastejším prejavom MTS postihnutia teda býva DI. Predný lalok je producentom ACTH, GH, TSH, LH a FSH, jeho postihnutie sa môže prejaviť výpadkom syntézy jedného alebo niekoľkých hormónov. Najčastejšie ide o hypotyreoidizmus a hypokorticizmus [17]. Všeobecne je z príznakov najčastejšie prítomný DI, vzhľadom na blízkosť zrakových dráh sú spomínané poruchy zorného poľa, diplopia, z ďalších ťažkostí ide o bolesti hlavy a slabosť. V prípade nášho pacienta išlo hlavne o hypokorticizmus, ktorý sa prejavil ťažkou kvalitatívnou poruchou vedomia s nutnosťou urgentného medikamentózneho zásahu (poruchu vedomia ako následok pituitárnej MTS spomína len Habu et al v 8 % zo skupiny 201 pacientov s rôznym primárnym nádorom) [9]. Zahájená bola intravenózna substitúcia kortikoidmi, pri ktorej cca po 48 hod dochádza k celkovej úprave stavu vedomia. Rozvíja sa však DI. Pravdepodobne tu išlo o poruchu syntézy antidiuretického hormónu (ADH), ktorá však bola iniciálne maskovaná insuficienciou kortikotropných buniek. Ako iná príčina neskoršieho rozvoja DI sa uvádza invázia infundibula alebo hypotalamu [16]. Zo zobrazovacích vyšetrení sa v diagnostike pituitárnych tumorov spomínajú MR so zameraním na hypofýzu. Ak je kontraindikovaná alebo nedostupná, tak CT, resp. pri podozrení na onkologický proces PET (pozitronová emisná tomografia) CT. Bez súčasného zhodnotenia kliniky a endokrinologického vyšetrenia majú len pomocný význam, resp. stanovenie diagnózy len na základe samotných zobrazovacích vyšetrení môže byť komplikované [3]. Nádor sa totiž môže prezentovať ako adenóm, kraniofaryngeóm, cysta alebo apoplexia. Navyše, ak ide o pacienta bez doteraz známeho zhubného procesu, s klinicky rozvinutým DI, môže byť nesprávne interpretovaný ako tuberkulóza, histiocytóza z Langerhansových buniek či sarkoidóza [12,13,16,19]. Ide aj o najčastejšie príčiny DI u pacientov bez malignity [18]. PET CT, na ktoré sa v dnešnej dobe s obľubou spoliehame tiež nemusí priniesť rozlúštenie problému, keďže aj benígne lézie ako adenómy sa môžu prejaviť zvýšeným vychytávaním glukózy [12]). Definitívny záver prináša histologizácia cestou transfenoidálnej resekcie. Má diagnostický význam, u pacientov s poruchami vízu spôsobenom útlakom zrakovej dráhy je aj terapeutickým zásahom. Radikalitu a liečebný efekt výkonu negatívne oplyvňujú vaskularita tumoru a s ňou spojené zvýšené riziko krvácania, prerastanie do okolitých kostných štruktúr, kavernózneho sínusu, infiltrácia optických nervov a hypotalamu alebo fibrózna komponenta tumoru [8,9]. Tento scenár nastal aj u nášho pacienta, ktorý cca po 2–3 týždňoch od stanovenia tumorózneho procesu v oblasti hypofýzy prichádza na ambulanciu s novovzniknutou poruchou zraku. Vzhľadom na rozsah tumoróznej formácie (propagácia intra-aj supraselárne, so šírením k optickej chiazme) bola realizovaná len dekompresia a parciálna resekcia tumoru, avšak k obnoveniu zraku u nášho pacienta nedošlo. Pre riziko metastatického šírenia ochorenia intrakraniálne bol odoslaný na RAT, kde mu bola aplikovaná adjuvantná RAT s boostom na selárnu oblasť. U pacientov, ktorí z rôznych dôvodov nemôžu podstúpiť neurochirurgickú intervenciu sa rozhodujeme na základe klinických príznakov, endokrinologického vyšetrenia a MRI cielenej na hypofýzu (tab. 1). Z terapeutických modalít sa ako možnosť voľby núka rádiochirurgia (gamma knife, gammanôž). Ide o neinvazívnu, jednodňovú procedúru, ktorá zároveň so sebou prináša znížené riziko nežiadúcich účinkov z ožiarenia celého mozgu. Na druhej strane rádiochirurgia využíva nižšiu dávku žiarenia na periférii kvôli šetreniu optického aparátu [15]. Z tohto dôvodu je nevhodná, ak je infiltrovaný optický nerv. Zástancovia ožiarenia celého mozgu tiež argumentujú rizikom šírenia MTS buniek meningami a priamym prerastaním mimo radiačné pole [8]. RAT tiež nie je pre pozvoľný nástup účinku vhodnou voľbou v situácii, keď musíme urgentne riešiť poruchu zraku a prejavy intrakraniálnej hypertenzie. Radikálny neurochirurgický výkon s kompletnou resekciou v kombinácii s RAT sa spájajú s lepšou kontrolou, resp. odstránením symptómov, ale nepredlžujú OS [8,9,16]. OS pacientov s pituitárnou MTS závisí hlavne od kontroly primárneho tumoru. Keďže náš pacient bol po ukončení RAT na CNS stále vo vyhovujúvom klinickom stave, po obdržaní molekulárno genetického statusu s pozitívnym testovaním na ROS1 prestavbu sme sa rozhodli pre zahájenie liečby krizotinibom. Medzi chorými s LC iba približne 1 % pacientov vykazuje ROS1 pozitivitu [20]. Ako vieme, krizotinib je ALK a ROS1 inhibítor. Liečbu krizotinibom u 50 ROS1 pozitívnych pacientov s pokročilým LC podporila už fáza I štúdie, v ktorej bola dosiahnutá miera odpovedí 72 %, medián trvania odpovede bol 17,6 mesiaca, prežitie bez progresie 19,2 mesiace [20]. Aj napriek poznatku, že krizotinib má len obmedzený priestup cez hematoencefalickú bariéru, na základe porovnaní zo štúdie PROFILE 1014 [21] dosiahol lepšiu kontrolu ochorenia intrakraniálne v porovnaní s kombinovanou chemoterapiou. Povzbudením môžu byť aj kazuistiky prezentovaných pacientov, ktorí dosiahli na krizotinibe dlhodobú kontrolu intrakraniálneho ochorenia [22,23].
Záver
Sekundárne postihnutie CNS u pacientov s NSCLC pomerne často komplikuje liečbu a má negatívny vplyv na kvalitu života chorého. Príznaky z MTS postihnutia CNS bývajú rôzne, podľa lokalizácie MTS. Manifestácia pituitárnych MTS je špecifická podľa toho, či ide o postihnutie predného alebo zadného laloka hypofýzy. Okrem známok hypokorticizmu, DI a hypotyreoidizmu sa môžu objaviť aj poruchy vízu a perimetra pri postihnutí optickej dráhy. MRI selárnej oblasti je súčasťou diagnostického algoritmu, definitívne rozlúštenie však často prináša až histologizácia transfenoidálnym prístupom, ktorého súčasťou býva aj resekcia tumorózneho ložiska. Alternatívnym riešením u pacientov neschopných podstúpiť neurochirurgický výkon je RAT. Celkové prežívanie chorých však v prvom rade závisí od kontroly primárneho tumoru, takže systémová liečba je základom.
V neposlednom rade treba spomenúť dôležitosť medziodborovej spolupráce s endokrinológom, bez ktorej by diagnostika a management tumorov hypofýzy neboli možné.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Radka Cahajlová
Oddelenie klinickej onkológie
UN Bratislava Nemocnica Ružinov
Ružinovská 6 82606 Bratislava, Slovensko
e-mail: radka.cahajlova@gmail.com
Obdržané: 26. 4. 2018
Prijaté: 27. 6. 2018
Zdroje
1. Novello S, Barlesi F, Califano R et al. Metastatic nonsmall cell lung cacer: ESMO clinical practise guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016; 27 (Suppl 5): v1–v27. doi: 10.1093/annonc/mdw 326.
2. Cancer Treatment Centers of America. Stage IV nonsmall cell lung cancer. [online]. Available from: https: // www.cancercenter.com/lung-cancer/stages/tab/non-small-cell-lung-cancer-stage-IV.
3. Fenske DC, Price GL, Hess ML et al. Systematic review of brain metastases in patients with non-small cell lung cancer in the United States, European Union, and Japan. Clin Lung Cancer 2017; 18 (6): 607– 614. doi: 10.1016/j.cllc.2017.04.011.
4. McGranahan T, Nagpal S. A neuro-oncologist’s perspective on management of brain metastases in patients with EGFR mutant non-small cell lung cancer. Curr Treat Options Oncol 2017; 18 (4): 22. doi: 10.1007/s11864-017-0466-0.
5. Greenspoon JN, Ellis PM, Pond G et al. Comparative survival in patients with brain metastases from non-small cell lung cancer treated before and after implementation of radiosurgery. Curr Oncol 2017; 24 (2): e146–e151. doi: 10.3747/co.24.3420.
6. Owen S, Souhami L. The management of brain metastases in non-small cell lung cancer. Front Oncol 2014; 4: 248. doi: 10.3389/fonc.2014.00248.
7. Wong A. The emerging role of targeted therapy and immunotherapy in the management of brain metastases in non-small cell lung cancer. Front Oncol 2017; 7 (5): 33. doi: 10.3389/fonc.2017.00033.
8. Fassett DR, Couldwell WT. Metastases to the pituitary gland. Neurosurg Focus 2004; 16 (4): E8.
9. Habu M, Tokimura H, Hirano H et al. Pituitary metastases: current practice in Japan. J Neurosurg 2015; 123 (4): 998–1007. doi: 10.3171/2014.12.JNS14870.
10. Rajput R, Bhansali A, Dutta P et al. Pituitary metastases masquerading as non-funcioning pituitary adenoma in a woman with adenocarcinoma lung. Pituitary 2006; 9 (2): 155–157. doi: 10.1007/s11102-006-8326-0.
11. Yaylalı GF, Topsakal S, Değirmencioğlu S et. al. Pituitary metasasese of lung cancer presenting with hypopitua-trism. Abstract 49. In: Endocrine Abstracts. 19th European Congress of Endocrinology. European Society of Endocrinology, Lisbon, 2017.
12. Goulart CR, Upadhyay S, Beer-Furlan A et al. Newly diagnosed sellar tumors in patients with cancer: a diagnostic challenge and management dilemma. World neurosurg 2017; 106: 254-265. doi: 10.1016/j.wneu.2017.06.139.
13. Marsh JC, Garg S, Wendt JA et al. Intracranial metastases disease rarely involves the pituitary: retrospective analysis of 935 metastases in 155 patients and review of the literature. Pituitary 2010; 13 (3): 260–265. doi: 10.1007/s11102-010-0229-4.
14. Guijarro de Armas MG, Torán Ranero CE, Pavón de Paz I et al. Panhypopituitarism and lung neoplasm: A case study. Endocrinol Nutr 2013; 60 (10): e35–e36. doi: 10.1016/j.endonu.2013.02.006.
15. Iwai Y, Yamanaka K, Honda Y et al. Radiosurgery for pituitary metastases. Neurol Med Chir (Tokyo) 2004; 44 (3): 112–116.
16. Komninos J, Vlassopoulou V, Protopapa D et al. Tumors metastatic to the pituitay gland: case report and literature review. J Clin Endocrinol Metab 2004; 89 (2): 574–580. doi: 10.1210/jc.2003-030395.
17. Hsiao CH, Wang CH, CHung MT et al. Diabetes insipidus due to pituitary metastases in a woman with lung adenocarcinoma: a case report. Cent Eur J Med 2011; 6 (4): 475–479.
18. Schubiger O, Haller D. Metastases to the pituitary-hypothalamic axis. An MR study of 7 symptomatic patients. Neuroradiology 1992; 34 (2): 131–134.
19. Harzallah L, Migaw H, Harzallah F et al. Diabetes insipidus and panhypopituitarism revealing pituitary metastasese of small cell lung canrcinoma: a case report. Ann Endocrinol (Paris) 2005; 66 (2 Pt 1): 117–120.
20. Shaw AT, Ou SH, Bang YJ et al. Crizotinib in ROS1– re-arranged non-small cell lung cancer. N Engl J Med 2014; 371 (21): 1963–1971. doi: 10.1056/NEJMoa1406766.
21. Solomon BJ, Cappuzo F, Felip E et al. Intracranial efficacy od crizotinib verusus chemotherapy in patients with advanced ALK-positive non-small cell lung cancer: results from PROFILE 1014. J Clin Oncol 2016; 34 (24): 2858–2865. doi: 10.1200/JCO.2015.63.5888.
22. Lukas RV, Hasan Y, Nicholas MK et al. ROS1 rearranged non-small cell lung cancer brain metastases respond to low dose radiotherapy. J Clin Neurosci 2015; 22 (12): 1978–1979. doi: 10.1016/j.jocn.2015.04.009.
23. Kinoshita Y, Koga Y, Sakamoto A et al. Long-lasting response to crizotinib in brain metastases due to EML4-ALK-rearranged non-small cell lung cancer. BMJ Case Rep 2013; 2013 (10): bcr-2013-200867. doi: 10.1136/bcr-2013-200867.
Štítky
Detská onkológia Chirurgia všeobecná OnkológiaČlánok vyšiel v časopise
Klinická onkologie

2018 Číslo 5
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Tramadol a paracetamol v tlumení poextrakční bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
Najčítanejšie v tomto čísle
- Solidní pseudopapilární tumor pankreatu – vzácné onemocnění 20leté ženy
- Psychoneuroimunológia nádorových chorôb – súčasné východiská a perspektívy
- Význam mutace BRAFV600E v tyreoidální onkologii a možnosti léčebného ovlivnění – aktuální poznatky a výsledky studií
- Jubilant doc. MUDr. Bohuslav Konopásek, CSc.