-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kazuistika pacientky s prognosticky nepříznivým metastatickým kolorektálním karcinomem léčené trifluridin/tipiracilem – příklad úspěšné multioborové spolupráce
Autori: B. Bencsiková 1; L. Sirotek 2; R. Feranec 3; L. Fiala 2; M. Ondrák 2; M. Staník 4; D. Macík 4; E. Suškevičová 5
Pôsobisko autorov: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Klinika operační onkologie, Oddělení chirurgické onkologie, Masarykův onkologický ústav, Brno 2; Klinika operační onkologie, Oddělení gynekologické onkologie, Masarykův onkologický ústav, Brno 3; Klinika operační onkologie, Oddělení urologické onkologie, Masarykův onkologický ústav, Brno 4; Anesteziologicko-resuscitační oddělení, Masarykův onkologický ústav, Brno 5
Vyšlo v časopise: Klin Onkol 2019; 32(3): 232-234
Kategória: Aktuality v onkologii
Úvod
Trifluridin/tipiracil (FTD/TPI) je perorální kombinace tymidinového analoga trifluridinu a inhibitoru tymidinfosforylázy (TP) tipiracil hydrochloridu. Trifluridin je aktivní protinádorová komponenta, která je inkorporována do nádorové DNA. Tipiracil inhibuje tymidinfosforylázu, enzym degradující trifluridin, udržuje přiměřenou koncentraci trifluridinu v plazmě, a tím potencuje jeho protinádorový účinek [1]. FTD/TPI je léčivo, které bylo vyvinuto s cílem překonat rezistenci vůči fluoropyrimidinům (5-FU). FTD/TPI je schválen pro použití u předléčených pacientů s metastatickým kolorektálním karcinomem (metastatic colorectal carcinoma – mCRC), kteří jsou rezistentní ke standardní chemoterapii.
Účinek FTD/TPI byl posuzován v četných klinických studiích. Mezinárodní multicentrická randomizovaná klinická studie fáze III RECOURSE posuzovala účinek FTD/TPI ve srovnání s placebem v léčbě mCRC refrakterního na předchozí chemoterapii. Studie RECOURSE prokázala významné zlepšení celkového přežití (overall survival – OS) a doby do progrese (progression-free furvival – PFS) u pacientů léčených FTD/TPI. Medián OS byl 7,2 měsíce u pacientů léčených FTD/TPI ve srovnání s 5,2 měsíce u pacientů léčených placebem (HR = 0,69; p < 0,0001) [2].
Popis případu
Pacientka ve věku 53 let byla vyšetřena kolonoskopicky pro pozitivní test na okultní krvácení.
S ničím vážnějším se neléčila, celoživotně byla nekuřačka, pracovala jako laborantka. Otec pacientky zemřel na karcinom prostaty.
Kolonoskopicky byl zjištěn nález nádorové infiltrace v oblasti příčného tračníku, který na vyšetření počítačovou tomografií (computed tomography – CT) nebyl diferencovatelný, bez metastáz na CT.
V březnu 2009 byla provedena resekce příčného tračníku, s histologickým nálezem invazivního adenokarcinomu grade 2, s fokální angioinvazí prorůstající do tukové perikolické tkáně, ale nedosahující až na serózu. Minoritně (10 %) byla popsána mucinózní komponenta, pět mízních uzlin bylo bez metastáz, tedy pT3 pN0 (uzliny [pozitivní/vyšetřené] 0/5) L1. Pooperačně byl stav pacientky komplikován respirační insuficiencí s nutností intubace a založením dočasné tracheostomie pro parézu hlasivek nejasné etiologie.
Vzhledem k high risk II. klinickému stadiu (stenotizující nádor, mucinózní komponenta, lymfangioinvaze) byla indikována adjuvantní chemoterapie kapecitabinem. Tato léčba byla ukončena předčasně vzhledem k možnému kardiotoxickému účinku (klinicky evidentní stenokardie). Následně byly podány dva cykly 5-FU bolusovým FU/FA (fluorouracil/leukovorin) Mayo režimem, který ale pacientka rovněž špatně tolerovala, zejm. z důvodu problémů s aftózní stomatitidou. Adjuvantní léčba dále nepokračovala.
Recidiva nádoru v oblasti děložního čípku se objevila po 3 letech, v roce 2011. V březnu 2011 byla provedena radikální abdominální hysterektomie, bilaterální adnexektomie a resekce rekta. Histologie potvrdila infiltraci děložního čípku a stěny rekta tubulárním adenokarcinomem G2, morfologicky shodným s předchozím tumorem tračníku. Kritický okraj byl vaginálně 1,5 mm. Na četných místech byla patrna propagace tumoru v cévách (střevo, cervix). Radioterapie nebyla indikována. Pooperačně byla podána chemoterapie režimem bolusový 5-FU v kombinaci s oxaliplatinou, léčba probíhala do října 2011. Dále byla pacientka sledována.
Druhá recidiva v malé pánvi se objevila po 2 letech po operaci, v únoru 2013. Vyšetření pozitronovou emisní tomografií / počítačovou tomografií (PET/CT) prokázalo ložisko za symfýzou vlevo v oblasti poševní stěny. Následovala operační revize v květnu 2013 v rozsahu přední exenterace pánve, kolpektomie, s vytvořením ureteroileoanastomózy sec Bricker. Pooperačně byla nutná dvakrát resutura pro dehiscenci laparotomie. Histologický nález prokázal v resekátu pochvy ložiskovou sekundární infiltraci tubulárním karcinomem kolorektálního typu, v kritickém místě byla nádorová infiltrace vzdálena 1 mm od okraje. Radioterapie pooperačně nebyla indikována, chemoterapie rovněž ne (z důvodu předchozí špatné tolerance léčby, neurotoxicitě po oxaliplatině, radikalitě operačního výkonu).
Po dalších 3 letech klidu byla v rámci pravidelné kontroly zjištěna mírná elevace CEA. PET/CT v 1/2016 zobrazilo ložisko ve zbytku pochvy a vícečetná ložiska v obou plicích (obr. 1).
Obr. 1. PET/CT v 1/2016. Metastázy v obou plicních křídlech. Vlevo 3 metastázy < 8 mm, vpravo 5 metastáz < 1 cm + recidiva v malé pánvi. 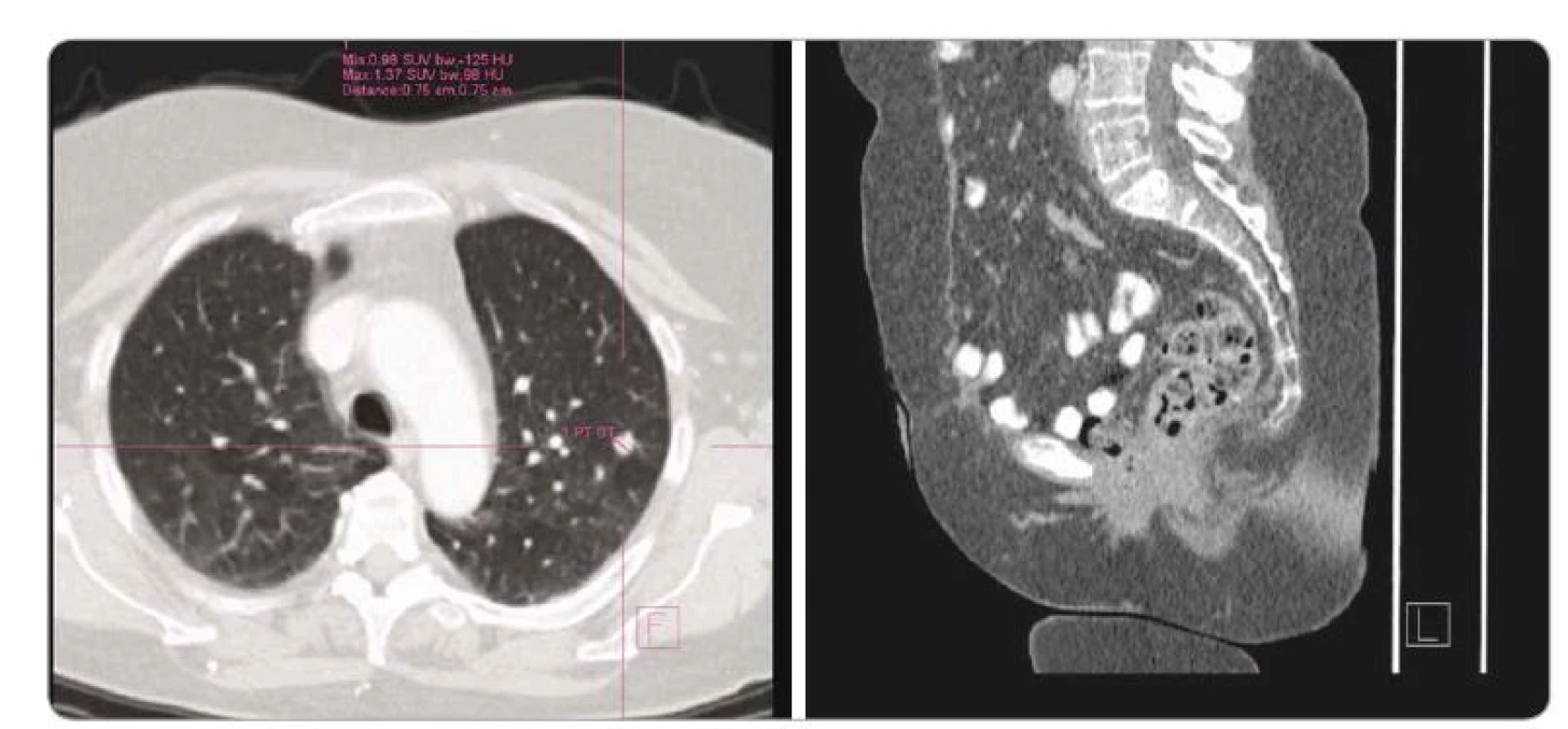
Doplnilo se prediktivní vyšetření RAS a BRAF. Nebyla zachycena mutace v genech KRAS, NRAS, avšak byla zachycena aktivující mutace V600E v genu BRAF. Je známo, že mutace BRAF s sebou nese horší prognózu. Výsledky studií podporují užití chemoterapie a antiangiogenních léčiv u této podskupiny pacientů. Studie fáze III BEACON testovala novou kombinaci encorafenibu, binimetinibu a cetuximabu v léčbě BRAF mutovaných CRC. Jejich výskyt je přibližně u 8–12 % pacientů s mCRC. Mutace BRAF (V600E) je silným prediktorem špatné prognózy s odlišnými klinickými a patologickými charakteristikami nádoru [3].
Pacientka zahájila systémovou léčbu v kombinaci irinotekan a cetuximab v lednu 2016. Tato léčba probíhala 7 měsíců s efektem stabilizace nemoci. Od září 2016 do října 2017 probíhala 2. linie systémové léčby režimem b-FOL (oxaliplatina/5-fluorouracil/leukovorin) v kom-binaci s bevacizumabem pro progresi plicních metastáz.
Tolerance léčby byla snesitelná, nežádoucí účinky zejména hematologické, z nichž pouze neutropenie dosáhla stupně 3. Důležitý byl efekt léčby, a to dlouhodobá stabilizace, PFS celkem 11 měsíců.
V listopadu 2017 byla zjištěna progrese plicních metastáz a progrese recidivy v oblasti poševního pahýlu (obr. 2).
Obr. 2. PET/CT v 11/2017. Plicní metastázy, ložiska v obou plicích, největší vpravo u mediastina 2 cm, ostatní velikosti 1 cm, před zahájením léčby Lonsurfem®. 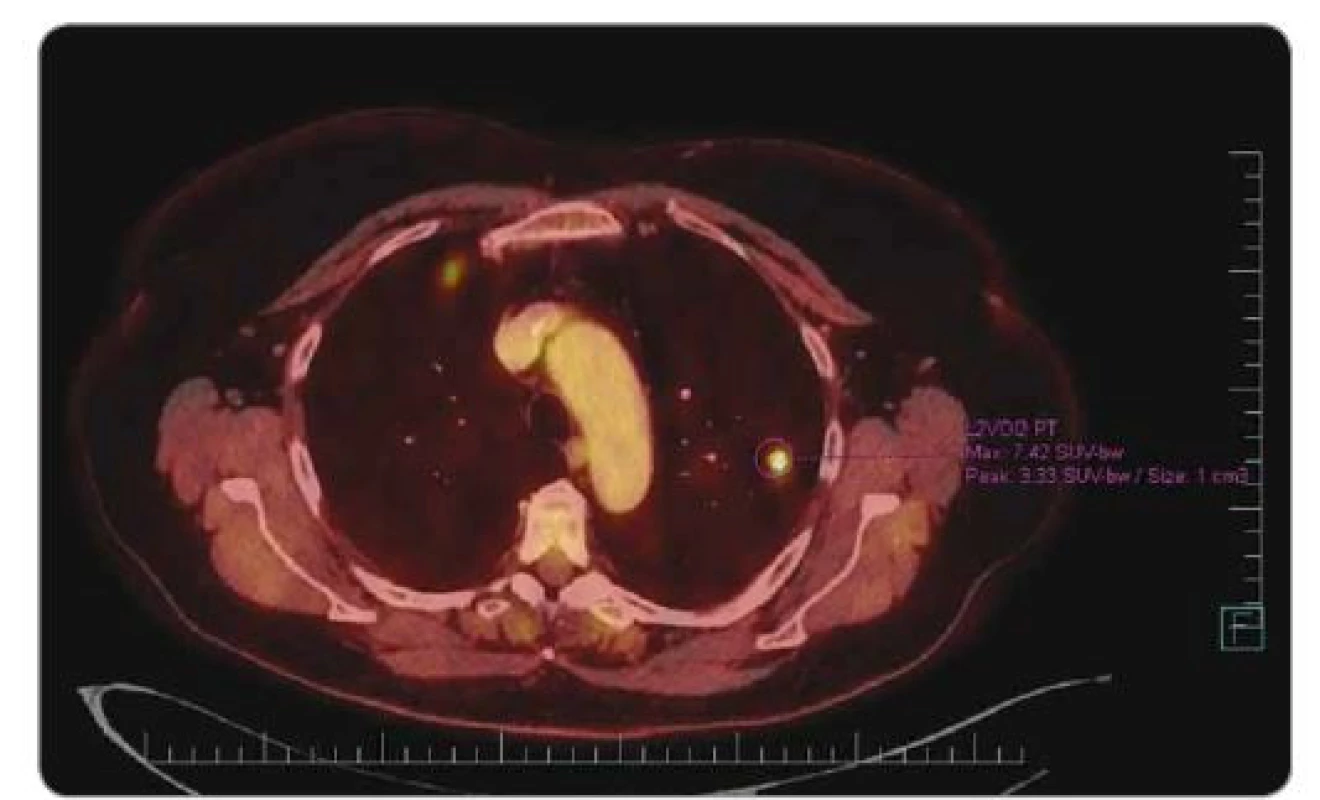
Pacientka zahájila léčbu 3. linie v listopadu 2017. Vzhledem k příznivému profilu toxicity a efektivitě jsme zvolili léčbu FTD/TPI. Celkově absolvovala sedm cyklů ve standardním dávkování 35 mg/m2 perorálně 2× denně 1.–5. den a 8.–12. den z 28denního léčebného cyklu. Nebyla nutná redukce dávkování. Vyskytla se pouze neutropenie stupně 3. Nebyla pozorována kardiotoxicita. Léčbou FTD/TPI bylo dosaženo dlouhodobé stabilizace u pacientky s uvedeným nepříznivým fenotypem nádoru (mucinózní adenokarcinom, BRAF mutovaný nádor). Z důvodu další progrese byla léčba Lonsurfem® ukončena (obr. 3). Nicméně vzhledem k výbornému výkonnostnímu stavu pacientky PS1 jsme nabídli pokračování v další paliativní chemoterapii (restart irinotekanu).
Obr. 3. PET/CT v 8/2018 po ukončení léčby Lonsurfem® pro progresi početně stacionárních plicních metastáz. 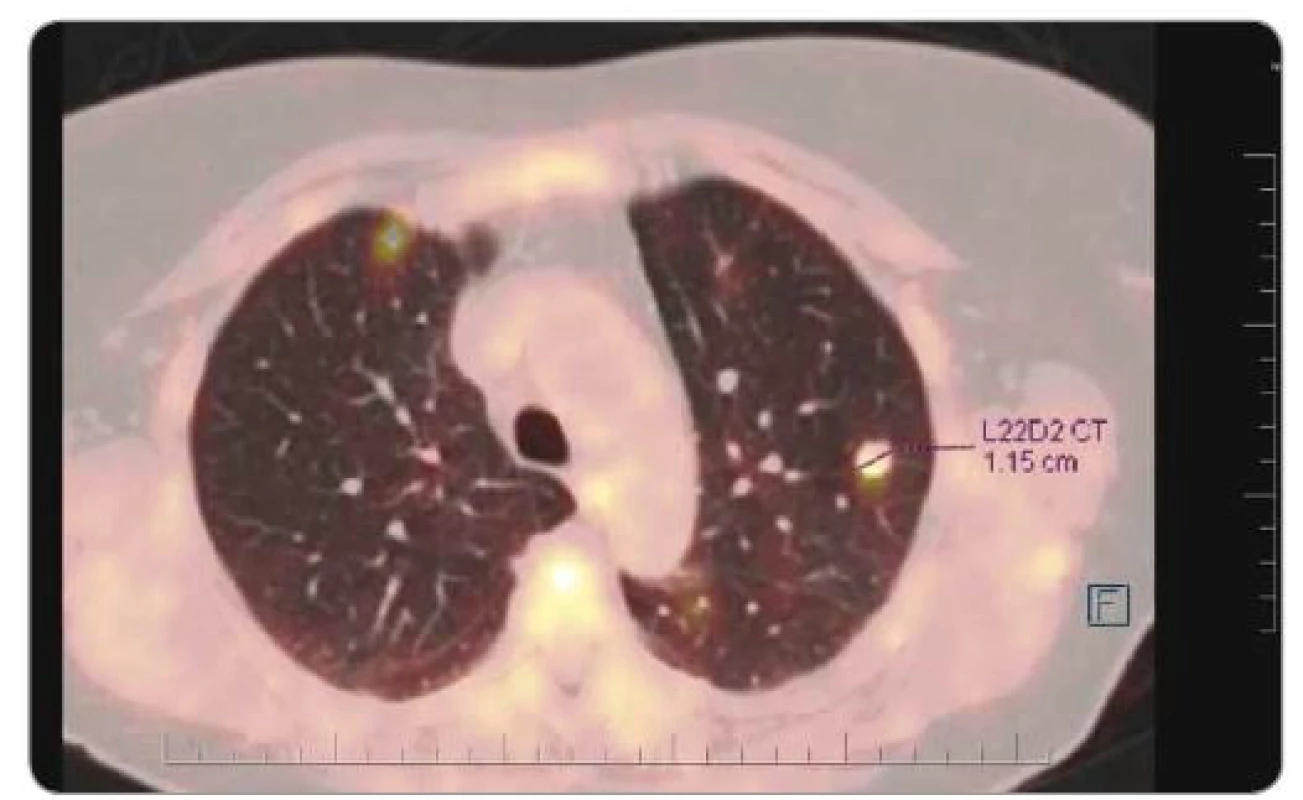
Po celou dobu léčby byla pacientka ve výborném výkonnostním stavu ECOG PS 0–1. Léčbu zvládala ambulantně, pracovala jako dobrovolník v pacientské organizaci.
Závěr
Případ pacientky demonstruje výrazný vliv multioborové spolupráce na OS pacientky. Prokazuje dále příznivý léčebný účinek FTD/TPI u pacientky s refrakterním mCRC v reálné praxi. Koreluje s výsledkem studie BBE_CZ1 PRECONNECT – Lonsurf® zachovává v reálné klinické praxi výkonnostní stav PS 0–1 v mediánu po dobu 8,7 měsíce [4]. Lonsurf® prokazuje nejlepší medián PFS u pacientů s dobrými prognostickými charakteristikami, tedy s nízkým nádorovým zatížením, bez jaterních metastáz a s méně agresivním onemocněním [5]. Profil toxicity FTD/TPI a 5-FU se liší. Na rozdíl od 5-FU je možné podat FTD/TPI i pacientům s deficitem dihydropyrimidin dehydrogenázy, protože TP je primární enzym, který metabolizuje trifluridin, a ne dehydrogenázu [6,7].
Neutropenie po zahájení léčby FTD/TPI koreluje s lepší prognózou u pacientů s refrakterním mCRC léčených FTD/TPI [8]. Japonští autoři popisují hodnotu clearance kreatinu CrCl < 57,1 ml/min u pacientů s mCRC léčených FTD/TPI jako rizikový faktor vzniku neutropenie stupně 3 [9].
FTD/TPI má příznivý bezpečnostní profil a je zajímavým a perspektivním přípravkem v léčbě pacientů s mCRC.
Tato aktualita byla podpořena společností Servier.
MUDr. Beatrix Bencsiková, Ph.D.
Klinika komplexní onkologické péče
RECAMO
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: bencsikova@mou.cz
Zdroje
1. Emura T, Nakagawa F, Fujioka A et al. An optimal dosing schedule for a novel combination antimetabolite, TAS-102, based on its intracellular metabolism and its incorporation into DNA. Int J Mol Med 2004; 13 (2): 249–255.
2. Mayer RJ, Van Cutsem E, Falcone A et al. Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 2015; 372 (20): 1909–1919. doi: 10.1056/NEJMoa1414325.
3. Lago NM, Fernandez Montes AF, Covela Rúa M et al. BRAF (V600E) mutant metastatic colorectal cancer: What is the role of the antiangiogenic therapy in a real-world setting. Abstr. e15561. Annual Meeting of the American Society of Clinical Oncology 2018.
4. Falcone A, Andre T, Edeline T et al. Safety and efficacy of trifluridine/tipiracil in previously treated metastatic colorectal cancer (mCRC). Preliminary results from the phase 3b, international, open-label, early-access study. Abstr. O-013. ESMO 20th WCGC 2018, Barcelona.
5. Tabernero J, Sobrero A, Borg C et al. Exploratory analysis of the effect of FTD/TPI in patients treated in Recourse by prognostic factors. Abstr. 677. ASCO GI 2019.
6. Zaniboni A, Bertocchi P, Barni S et al. TAS-102 (Lonsurf®) for the treatment of metastatic colorectal cancer. A concise review. Clin Colorectal Cancer 2016; 15 (4): 292–297. doi: 10.1016/j.clcc.2016.06.003.
7. Peeters M, Cervantes A, Moreno Vera S et al. Trifluridine/tipiracil: an emerging strategy for the management of gastrointestinal cancers. Future Oncol 2018; 14 (16): 1629–1645. doi: 10.2217/fon-2018-0147.
8. Kasi PM, Kotani D, Cecchini M et al. Chemotherapy induced neutropenia at 1-month mark is a predictor of overall survival in patients receiving TAS-102 for refractory metastatic colorectal cancer: a cohort study. BMC Cancer 2016; 16 : 467. doi: 10.1186/s12885-016-2491-y.
9. Yasue F, Kimura M, Usami E et al. Risk factors contributing to the development of neutropenia in patients receiving oral trifluridine-tipiracil (TAS-102) chemotherapy for advanced/recurrent colorectal cancer. Pharmazie 2018; 73 (3): 178–181. doi: 10.1691/ph.2018.7908.
Štítky
Detská onkológia Gastroenterológia a hepatológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2019 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Izolovaná hypertermická perfuze končetiny
- Asociace TNF-α -308G>A polymorfizmu s citlivostí na karcinom děložního čípku a prsu – systematický přehled a metaanalýza
- MikroRNA v mozkomíšním moku jako biomarkery u pacientů s nádory mozku
- Sledování prognózy HPV pozitivních a negativních orofaryngeálních karcinomů v závislosti na léčebné modalitě
- Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Neoadjuvantní užití hypertermické izolované perfuze končetiny v léčbě nediferencovaného vřetenobuněčného sarkomu dolní končetiny s dosažením kompletní patologické odpovědi
- Primární intrakraniální sarkomy, myxoidní meningeální sarkom – kazuistika a přehled literatury
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Kazuistika pacientky s prognosticky nepříznivým metastatickým kolorektálním karcinomem léčené trifluridin/tipiracilem – příklad úspěšné multioborové spolupráce
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



