-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sledování prognózy HPV pozitivních a negativních orofaryngeálních karcinomů v závislosti na léčebné modalitě
Prognosis of HPV-Positive and -Negative Oropharyngeal Cancers Depends on the Treatment Modality
Background: The association between human papilloma virus (HPV) and oropharyngeal carcinoma is a topical issue due mainly to the rapid increase in incidence over recent years. These tumors are etiopathogenetically, epidemiologically, and clinically different from other carcinomas at this location. They have a better prognosis in that they are more chemo-and radiosensitive. Indeed, this has been shown by many extensive retrospective and prospective studies. HPV status is considered an integral part of a standard histopathological examination and is included as a new biological parameter in TNM classification.
Materials and methods: The results of 77 patients who were treated non-surgically for locally advanced oropharyngeal carcinoma at a single university ear, nose, and throat clinic were analyzed retrospectively.
Results: Overall and specific survival of those with HPV-positive (HPV+) tumors was better that those for HPV negative (HPV-) tumors. With the exception of TNM classification, HPV positivity appeared to be the strongest predictor of local control, and of overall and specific survival, regardless of the type of treatment. However, smoking and p53 positivity were significant negative predictors of overall survival. Patients with HPV-associated tumors had a significantly better prognosis, regardless of treatment type. The difference between treatment modalities was confirmed for the whole group of patients, but not for the HPV+ and HPV-patients specifically, most probably due to the small number of patients enrolled.
Conclusion: The results obtained herein may constitute the first step toward the concept of treatment de-escalation in those with HPV-associated oropharyngeal carcinoma; however, this decision can be based only on the results of current extensive randomized trials. Specification of the optimal de-escalation scheme, or the choice of treatment modality, for which the difference in treatment results is most pronounced, has yet to be identified.
This work was supported by grants of the Ministry of Health of the Czech Republic IGA NT12483-4/2011 and AZV 15-31627A.
he authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 21. 9. 2018
Accepted: 14. 5. 2019
Keywords:
Oropharynx – cancer – HPV
Autori: Z. Horáková 1
; M. Slavik 2; K. Veselý 3; M. Budíková 4
; R. Kostřica 1; H. Binková 1
Pôsobisko autorov: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u svaté Anny v Brně 1; Klinika radiační onkologie LF MU a Masarykův onkologický ústav, Brno 2; I. patologicko-anatomický ústav, LF MU a FN u svaté Anny v Brně 3; Ústav matematiky a statistiky, PřF MU, Brno 4
Vyšlo v časopise: Klin Onkol 2019; 32(3): 187-196
Kategória: Původní práce
Súhrn
Východiska: Asociace lidského papilomaviru (human papillomavirus – HPV) s karcinomy orofaryngu jsou velmi aktuální otázkou. Důvodem je především jejich prudce stoupající incidence v posledních letech. Jedná se o skupinu nádorů etiopatogeneticky, epidemiologicky i klinicky odlišnou od ostatních karcinomů této lokality. Jejich pozitivním aspektem je lepší prognóza, vyšší chemo-a radiosenzitivita. Tato skutečnost byla ověřena mnoha rozsáhlými retrospektivními i prospektivními studiemi a akceptována natolik, že HPV status je považován za nedílnou součást standardního histopatologického vyšetření a byl zařazen jako další, biologický parametr do TNM klasifikace nádorů.
Materiál a metody: V prezentovaném souboru bylo retrospektivně hodnoceno 77 pacientů léčených na jednom klinickém pracovišti nechirurgickým postupem pro lokálně pokročilý karcinom orofaryngu.
Výsledky: Celkové i specifické přežití bylo statisticky signifikantně lepší u pacientů s HPV pozitivními (HPV+) nádory ve srovnání s pacienty s nádory HPV negativními (HPV−). HPV se ukazuje jako nejsilnější prediktor lokální kontroly, celkového i specifického přežívání, a to bez ohledu na typ léčby. Pro celkové přežívání je v našem souboru dalším významným negativním prediktivním faktorem pokročilost nádoru a kouření. Pacienti s HPV asociovanými karcinomy orofaryngu mají významně lepší prognózu bez ohledu na typ léčby. Rozdíl mezi jednotlivými léčebnými modalitami se potvrdil v celém souboru. Při dalším dělení dle HPV statusu již nikoliv, pravděpodobně na vrub malých počtů pacientů.
Závěr: Získané výsledky jsou součástí výzkumu, jehož koncepčním záměrem je deeskalace léčby HPV asociovaných nádorů. K té bude možné přistoupit až na základě výsledků rozsáhlých, v současnosti probíhajících randomizovaných studií. Volba léčebné modality, pro kterou je rozdílnost léčebných výsledků nejvýraznější, resp. specifikace konkrétního optimálního schématu deintenzifikace terapie, nebyla prozatím jednoznačně objektivizována.
Klíčová slova:
orofarynx – karcinom – HPV
Úvod
Spinocelulární karcinomy hlavy a krku představují ve světě šestou nejrozšířenější skupinu zhoubných nádorů; orální a orofaryngeální karcinomy (OFK) se podílejí na 3–5 % malignit v Evropě [1]. Výskyt nádorů hlavy a krku má všeobecně mírně klesající charakter, pravděpodobně díky klesající prevalenci kouření. Tento trend ale neplatí pro OFK, jejichž incidence naopak významně vzrůstá. V ČR počet nově diagnostikovaných nádorů orofaryngu během posledních 30 let narostl trojnásobně, v posledních letech dosáhla incidence tohoto onemocnění u nás 5–7 případů/100 000 obyvatel za rok [2].
Vedle skupiny OFK nádorů souvisejících etiopatogeneticky se známými tradičními faktory, jako je expozice tabáku a alkoholu, se vyčleňuje skupina nádorů asociovaných s lidskými papilomaviry (human papillomavirus – HPV) [3]. Tato se v současnosti považuje za zcela samostatnou jednotku s odlišnou etiopatogenezí, epidemiologií i biologickým chováním [4]. Odlišnost obou skupin je natolik klinicky významná, že HPV se v současné době akceptuje jako první prognostický nádorový marker u nádorů hlavy a krku, resp. OFK. Přestože současné léčebné standardy v ČR zatím HPV status nezohledňují ve smyslu deeskalace léčby, je tento parametr zařazen do oficiální klasifikace nádorů v poslední revizi TNM [5].
Soubor pacientů
Do retrospektivní analýzy bylo zařazeno celkem 77 nemocných s pokročilou formou OFK (stadium III + IV), kteří byli léčeni nechirurgicky v letech 2007–2013 (v Masarykově onkologickém ústavu) a následně sledováni na jednom pracovišti (Klinika otorinolaryngologie a chirurgie hlavy a krku FN u sv. Anny v Brně) dle protokolu pracoviště (tab. 1). Aplikovány byly tři léčebné modality ve vícero schématech – konkomitantní chemoradioterapie (CHRT), radioterapie s biologickou léčbou a samostatná radioterapie (RT). Aplikovaná dávka RT na oblast primárního tumoru a spádových lymfatických uzlin byla v kurativní dávce 70 Gy nebo biologicky ekvivalentní (dávka nižší než 68 Gy byla aplikována z důvodu toxicity u 15 pacientů). Při konkomitantní CHRT byla současně s RT aplikovaná chemoterapie (cisplatina 40 mg/m² týdně, s mediánem 3 série) nebo ve skupině s biologickou léčbou byla RT potencována monoklonální protilátkou cetuximabem (v nasycovací dávce 400 mg/m2 a poté v týdenním podání 250 mg/m2). V prv-ních sledovaných letech byla u tří pacientů dle aktuálních protokolů aplikovaná i neoadjuvantní chemoterapie před vlastní RT nebo CHRT u tří pacientů. Indikace monomodální RT léčby se pro pokročilé tumory OFK jeví podle všeobecně akceptovaných léčebných protokolů (National Comprehensive Cancer Network, European Society for Medical Oncology) jako nedostačující, byla ale aplikována pouze v případech, kdy nebyla z důvodu špatného performance statusu pacientů přijatelná možnost vícemodalitní léčby. Pro účely naší retrospektivní analýzy srovnávající efekt jednotlivých léčebných modalit bylo ale zařazení tohoto typu léčby přínosné.
Tab. 1. Charakteristiky pacientů zařazených do studie s dělením dle HPV statusu. 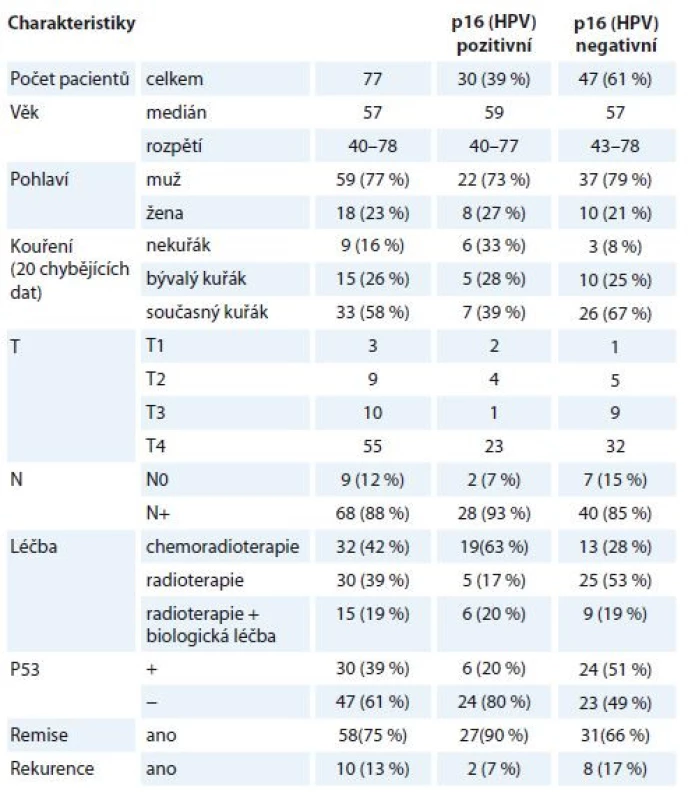
HPV – lidský papilomavirus Analýza vzorků OFK od všech pacientů proběhla retrospektivně, ze vzorků získaných při verifikaci z biopsie nádoru před zahájením léčby. Pacienti byli sledováni dle protokolu našeho pracoviště – pravidelná otorinolaryngologická (ORL) vyšetření v 1. roce po ukončení léčby v měsíčních intervalech, ve 2. roce ve dvouměsíčních, ve 3. roce v tříměsíčních intervalech, následně v půlročních odstupech. Počítačová tomografie (computed tomography – CT) nebo pozitronová emisní tomografie/počítačová tomografie (PET/CT) byla provedena v intervalu 2–3 měsíců od ukončení léčby a dále dle klinické indikace. Kompletní remise byla hodnocena jako negativní nález při ORL vyšetření s negativním nálezem na CT nebo PET/CT. Všechny ostatní případy byly hodnoceny jako perzistence nemoci po léčbě. V případě kompletní remise byla rekurence nemoci charakterizována přítomností známek onemocnění při ORL vyšetření s histologickou verifikací, příp. při zobrazovací metodě, byla-li indikována.
Metody
Imunohistochemické vyšetření p16 a p53
Tkáně byly fixovány v 10% pufrovaném formalinu, konvenčním způsobem zpracovány a zality do parafínu. Tkáňové řezy tloušťky 3 µm byly umístěny na podložní sklo a nechány schnout v termostatu při teplotě 56 °C přes noc. Poté byly deparafinizovány xylenem a rehydratovány alkoholem.
Revitalizace antigenů byla provedena pomocí tlakové komory Pascal (Dako, Dánsko) v pufru pH9 po dobu 40 min při teplotě 117 °C. Aktivita endogenní peroxidázy byla blokována pomocí 3% vodného roztoku peroxidu vodíku 15 min.
Pro hodnocení p16 byla jako primární použita myší monoklonální protilátka CINtec® p16 Histology, klon E6H4 (Ventana Medical Systems, Inc., USA), detekce byla prováděna detekčním kitem Envision™ Detection Systems Peroxidase/DAB Mouse (Dako, Dánsko). Imunoreakce byla vizualizována pomocí diaminobenzidinu (DAB) (Dako, Dánsko). Jako pozitivní kontrola byl užit metaplastický dlaždicový epitel děložního hrdla s těžkou dysplazií. Jako pozitivní bylo hodnoceno hnědé zbarvení jader, popř. jader a cytoplazmy nádorových buněk, byla posuzována intenzita zbarvení ve škále +, ++ a +++ pro nejintenzivnější zbarvení a semikvantitativně bylo odhadnuto procento pozitivních buněk. Jako p16 pozitivní dlaždicový karcinom byl klasifikován nádor s více než 70% zastoupením pozitivních jader, popř. jader a cytoplazmy.
Pro hodnocení p53 byla jako primární použita myší monoklonální protilátka p53 Protein, klon DO-7 (Leica Biosystems Newcastle Ltd, Newcastle Upon Tyne, UK), v ředění 1 : 2 000, a detekce byla provedena detekčním kitem Vectastain Elite ABC Kit (Mouse IgG), (Vector Laboratories Ltd., UK). Imunoreakce byla vizualizována pomocí DAB (Dako, Dánsko). Jako pozitivní kontrola byl užit dlaždicový karcinom se známou expresí p53. Jako pozitivní bylo hodnoceno hnědé zbarvení jader nádorových buněk, byla posuzována intenzita zbarvení ve škále +, ++ a +++ pro nejintenzivnější zbarvení a semikvantitativně odhadnuto procento pozitivních buněk. Jako p53 pozitivní dlaždicový karcinom byl klasifikován nádor s více než 10% zastoupením pozitivních jader.
Statistická analýza
Data byla analyzována pomocí Kaplanovy-Meierovy metody, která poskytla odhad funkce přežití. Pro ověření shody přežití v různých skupinách pacientů byly použity tyto testy: log-rank test, Gehanův-Wilcoxonův test a chí-kvadrát test. Dále byl pomocí zpětné krokové metody vybudován Coxův regresní model proporcionálních rizik, který mj. poskytl odhad poměru rizik společně s 95% intervaly spolehlivosti.
Hladina významnosti pro všechny testy byla zvolena α = 0,05. S touto hladinou byla vždy porovnávána vypočtená p-hodnota příslušného testu. Pokud bylo p ≤ α, nulová hypotéza byla zamítnuta na hladině významnosti α = 0,05.
Tabulkové a grafické zpracování dat bylo provedeno pomocí statistického softwaru StatSoft, Inc. (2013), STATISTICA (data analysis software system, version 12, www.statsoft.com).
Výsledky
Hlavním cílem bylo sledování prognózy OFK v závislosti na HPV statusu s přihlédnutím k závislosti na léčebné modalitě. V nechirurgicky léčené skupině jsme hodnotili léčebnou odezvu. Kompletní remise dosáhlo nejvíce pacientů léčených CHRT (91 %), dále RT v kombinaci s biologickou léčbou (RT + BIO) (60 %) a RT (66 %). Celkové 5leté přežití (overall survival – OS) souboru činilo 38 %. Srovnání pacientů dle pohlaví ukázalo lepší prognózu pro ženy (p = 0,0169). OS i interval bez recidivy byly statisticky signifikantně lepší u pacientů s HPV pozitivními (HPV+) nádory ve srovnání s pacienty s nádory HPV negativními (HPV−) (z = 2,92; p = 0,0035) (graf 1, 2). HPV se ukazuje jako nejsilnější prediktor OS při hodnocení Coxovou regresní analýzou (poměr rizik 2,99; p = 0,0115).
Graf 1, 2. Kaplan-Meierův odhad funkce přežití pro dvě skupiny pacientů rozlišených podle statusu p16. OS – celkové přežití, DFS – přežití bez nemoci 
V našem souboru se potvrdil i význam prognostického parametru p53, jehož zvýšenou expresi jsme zaznamenali významně vyšší u HPV − OFK. Ve srovnání p53+ proti p53 − je patrný trend rozdílné prognózy onemocnění, asociace p53 s horší lokální kontrolou onemocnění i OS, ovšem nikoliv statisticky významné (p = 0,147; p = 0,146) (graf 3, 4).
Graf 3, 4. Kaplan-Meierův odhad funkce přežití pro dvě skupiny pacientů rozlišených podle statusu p53. OS – celkové přežití, DFS – přežití bez nemoci 
Při srovnání léčebných modalit je zjevný, ovšem statisticky nesignifikantní rozdíl OS a délky remise onemocnění, ve srovnání CHRT, RT a biologická léčba (p = 0,147; p = 0,123) hovořící ve prospěch CHRT v obou parametrech (graf 5, 6).
Graf 5, 6. Kaplan-Meierův odhad funkce přežití pro tři skupiny pacientů rozlišených podle způsobu léčby. OS – celkové přežití, DFS – přežití bez nemoci 
Při srovnání jednotlivých terapeutických skupin v rámci HPV+ a HPV − byla potvrzena větší průkaznost tohoto trendu, i když skupina léčená biologickou léčbou je málo početná (p = 0,062 pro skupinu CHRT a p = 0,064 pro léčbu RT, p = 0,606 pro biologickou léčbu) (graf 7, 8).
Graf 7, 8. Kaplan-Meierův odhad funkce přežití pro dvě skupiny pacientů rozlišených podle p16 a způsobu léčby. OS – celkové přežití 
Při hodnocení negativního dopadu abúzu kouření a alkoholu, při vzájemném srovnání skupin kuřáků proti nekuřákům a abstinentů, resp. příležitostných konzumentů alkoholu proti pravidelným konzumentům (denně) byl patrný významný rozdíl OS pro celý soubor pacientů bez ohledu na p16 status. Hodnoceno bylo 57 pacientů, u 20 údaj o kouření nebyl zjistitelný (p = 0,0530 pro kouření a p = 0,0151 pro alkohol) (graf 9, 10).
Graf 9. Kaplan-Meierův odhad funkce přežití pro dvě skupiny pacientů rozlišených podle kuřáctví. OS – celkové přežití 
Graf 10. Kaplan-Meierův odhad funkce přežití pro dvě skupiny pacientů rozlišených podle konzumace alkoholu. OS – celkové přežití 
Vliv kouření byl patrný u souboru p16 − nádorů (p = 0,0485) (graf 11). Signifikantní rozdíl jsme zaznamenali při rozdělení skupin s ohledem na p16 status i kouření, kdy se bere v potaz samostatná prognosticky odlišná skupina p16+ kuřáků, tj. srovnání p16−, p16+ kuřáci, p16+ nekuřáci, kdy byla staticky významně potvrzena prognostická odlišnost skupin (p = 0,0185) (graf 12). Pomocí logistické Coxovy analýzy byl vyhodnocen status p16, pokročilost nádoru T a kouření jako faktory významně ovlivňující přežívání pacientů (poměr rizik 2,99; 2,18; 1,74; p = 0,0115; 0,0604; 0,135) (tab. 2).
Graf 11. Kaplan-Meierův odhad funkce přežití pro dvě skupiny pacientů se statusem p16− rozlišených podle kouření. OS – celkové přežití 
Graf 12. Kaplan-Meierův odhad funkce přežití pro tři skupiny pacientů: p16+ nekouří, p16+ kouří, p16−. OS – celkové přežití 
Tab 2. Coxův regresní model proporcionálních rizik.
Tab. 2A. Přehled proměnných vstupujících do modelu. 
HPV – lidský papilomavirus, T status – status tumoru, N status – status uzlin Tab. 2B. Výsledky Coxova modelu získané zpětnou krokovou metodou. 
T status – status tumoru Tab. 2C. Meze 95% intervalů spolehlivosti pro poměr rizik. 
T status – status tumoru Diskuze
Lidský papilomavirus byl poprvé identifikován v roce 1949 [6], v etiopatogenezi OFK se uplatňují především typy 16 a 33, nejrozšířenější je jednoznačně HPV 16. Perzistence HPV infekce představuje významně vyšší riziko vzniku karcinomu. Změny regulačních proteinů buněčného cyklu p53 a Rb proteinu vedou ke zvýšené expresi p16 proteinu, jehož imunohistochemickou detekci tak lze využít jako nepřímý marker infekce vysoce rizikovými kmeny HPV.
Retrospektivní analýzy potvrzují tento trend vzestupné incidence HPV asociace s OFK i prevalence HPV perzistující infekce orofaryngu jako rizikového faktoru [7].
V posledních desetiletích současně s incidencí OFK narůstá podobným způsobem i prevalence HPV v OFK; jejich asociace s HPV je udávána u OFK v širokém rozmezí asi 45–95 % OFK [8,9]. V našem souboru 77 pacientů byla necelá polovina nádorů (39 %) asociovaná s infekcí HPV.
Jednou z nejrozšířenějších metod ke stanovení HPV u pacientů s OFK je imunohistochemická detekce proteinu p16, jenž je za normálních podmínek detekovatelný jen v nevýznamné míře [10]. Protein p16 je vysoce senzitivním, ale nikoliv zcela specifickým ukazatelem aktivní replikace HR HPV. I když je p16 exprese zařazena do poslední verze TNM klasifikace pro OFK nádory jako dostatečný marker, pro účely studií je stále vhodné používat detekci HPV RNA či pozitivitu na expresi p16 a zároveň přítomnost HPV DNA [5].
Pro zvýšení specificity se toto vyšetření v praxi často kombinuje s průkazem dalších markerů, např. p53 [11].
Dostatečnosti imunohistochemického stanovení p16 jako orientačního markeru diagnostiky se věnovalo vícero autorů a bylo potvrzeno i na prospektivní analýze souboru více než 400 pacientů [12]. Přestože nelze stavět imunohistochemické vyšetření p16 na úroveň samotné detekce HPV DNA a nesmí se opomíjet existence malé skupiny pacientů p16 pozitivních a HPV negativních, je přesto toto vyšetření považováno v klinické praxi za vhodné, rutinně aplikovatelné, kompromisní a cenově dostupné [13]. Vyšetření p16 jsme využili i při hodnocení našeho souboru pacientů.
Podskupina HPV+ nemocných je odlišná nejen etiopatogeneticky, epidemiologicky, ale i klinicky od HPV−. Nemocní jsou většinou v lepším celkovém zdravotním stavu [14], histopatologicky bývají HPV+ OFK nízce diferencované, nekeretinizující, typický je bazaloidní typ [15]. Nádory se typicky diagnostikují až ve stadiu pokročilého onemocnění, zejm. kvůli charakteristické přítomnosti krčních uzlinových metastáz, často cystických, v době diagnostiky i při poměrně malém primárním nádoru (T1–T2) [16]. I v našem souboru je patrná odlišnost pacientů, vyšší podíl nekuřáků, poměrně vyšší zastoupení žen i vyšší výskyt uzlinových metastáz. Prognosticky, jak bylo výše zmíněno, HPV+ OFK převyšují HPV − nádory nezávisle na věku, pohlaví, stadiu, diferenciaci [3]. U těchto nádorů je menší prognostický význam uzlinových metastáz, který je jinak považován za jeden z nejvýznamnějších negativních prognostických faktorů zhoršující OS [17]. Někteří tuto skutečnost přičítají statisticky významně nižší expozici tabáku, alkoholu a kouření a lepšímu celkovému stavu s relativně vyšším performance statusem ve skupině HPV asociovaných tumorů. Na našem souboru byl rozdíl 5letého OS pro HPV+ 60 vs. 32 % u HPV – OFK. Většinou se ale spojuje s vyšší radio-a chemosenzitivitou těchto tumorů, která je vysvětlována alespoň částečně funkčním p53 zajišťujícím apoptózu a minimalizující chromozomální aberace [18], resp. imunologickými faktory souvisejícími s HPV infekcí [19].
I v našem souboru se jednoznačně potvrdil prognostický rozdíl ve sledovaných parametrech celkového přežití i lokální kontroly, jak jsme předpokládali, s jednoznačně lepšími výsledky pro HPV+ nádory.
I když je stále nejasné, zda je kouření rizikovým faktorem pro indukci HPV+ OFK [20,21], má pro ně negativní prognostický význam [22], což bylo potvrzeno i v našem souboru, kde se i v rámci skupiny HPV asociovaných nádorů jednoznačně projevil vliv abúzu tabáku na negativní prognózu. Význam HPV převyšuje vliv kouření, ale signifikantně horší je prognóza kuřáků v rámci skupiny HPV+ pacientů proti nekuřákům. Stratifikovat pacienty s OFK lze do 3 skupin podle rizika – nízké (HPV+ nekuřáci), střední (HPV+ kuřáci) a vysoké (HPV−) [22,23].
Při popsané prognostické výhodě HPV+ OFK se nabízí možnost deeskalace terapie u HPV asociovaných prognosticky příznivějších nádorů s cílem snížit toxicitu při zachování výsledků léčby a lokální kontroly. Prospektivně se testují ve studiích různé cesty deeskalace léčby (redukce dávky RT či ozařovaného objemu, redukce chemoterapeutika nebo adjuvantní RT) [24,25]. Jednoznačnou prognostickou výhodu HPV+ OFK napříč terapeutickými modalitami potvrdila rozsáhlá metaanalýza zahrnující přes 5 600 pacientů [26].
V recentní retrospektivní studii z jednoho pracoviště hodnotícího efektivitu léčby se pro HPV asociované OFK potvrdil, v souladu s podobnými studiemi, i rozdíl v odpovědi na podávanou systémovou léčbu, se signifikantně horšími výsledky cetuximabu proti tradiční chemoterapii na bázi platiny. Ani v našem souboru se benefit z navýšení RT o biologickou léčbu nepotvrdil.
V rámci našeho souboru se sice potvrdil signifikantní vliv HPV asociace na prognózu, stejně jako vyšší účinnosti multimodalitní terapie, optimálně CHRT, proti pouhé RT, ovšem zásadní rozdíl se v rámci souborů HPV+ a HPV − samostatně nepotvrdil; vysvětlením může být nízká četnost pacientů v jednotlivých skupinách při relativní heterogenitě aplikované léčby (RT, CHRT, RT + BIO).
Popsána je p53 overexprese, která koreluje s jeho mutací, hojná u spinocelulárních karcinomů hlavy a krku; i když výsledky jednotlivých studií nejsou zcela jednoznačné vzhledem k heterogenitě souborů. Proto je z tohoto parametru jen obtížné vyvozovat klinické dopady jakožto využitelný biologický parametr nádoru [27].
Většinou se potvrdila záporná korelace mutace p53 s HPV asociací, tj. mutace u HPV+ nádorů je považována za vzácnou, na rozdíl od HPV − nádorů [28].
I v našem souboru se potvrdila záporná korelace exprese p53 s HPV statusem a prognostický rozdíl mezi skupinami p53+ a p53−.
Snaha o implementaci získaných poznatků a projekci do běžné praxe v budoucnu by měla navazovat na změnu klasifikace systému. Aspekt HPV etiologie se zařadil vedle morfologických charakteristik nádoru jako další faktor rozhodující o jeho klasifikaci. Tento fakt reflektuje 8. edice American Joint Committee on Cancer TNM, jejíž česká verze vyšla v roce 2017 [5,29,30].
Masivní nárůst výskytu OFK indukovaných HPV infekcí v posledních dvou dekádách je alarmující. Vzhledem k tomu, že HPV 16 je odpovědná až za 94 % HPV+ OFK, dá se předpokládat, že je vakcinace vysoce účinná i v prevenci OFK, při vakcinaci jak dívek, tak chlapců.
Závěr
V současnosti se již jednoznačně považují HPV asociované nádory za svébytnou, etiopatogeneticky, epidemiologicky i klinicky odlišnou jednotku v souboru všech OFK s prudce stoupající incidencí v posledních desetiletích. HPV asociace je jednoznačně považována za prognosticky pozitivní parametr.
Rutinní testování všech vzorků OFK na HPV při verifikaci nádorového onemocnění by mělo být v dnešní době již standardem. V aktuální verzi TNM 8 je HPV status již součástí kompletní rutinní histopatologické diagnostiky. Kromě morfologicko-anatomických parametrů je zásadním faktorem určujícím prognózu onemocnění a v budoucnu nejspíše i faktorem důležitým při léčebné stratifikaci. Ke zvažované deeskalaci léčby HPV+ pacientů bude možné přistoupit až na základě výsledků rozsáhlých randomizovaných studií, které v současnosti probíhají. Specifikaci konkrétního schématu deeskalace, resp. výběr modality léčby, pro kterou je rozdílnost léčebných výsledků nejvýraznější a která by naznačila optimální cestu deeskalace, se dosud nepodařilo jednoznačně objektivizovat.
Tato práce byla podpořena granty IGA MZ ČR NT12483-4/2011 a AZV MZ ČR 15-31627A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 21. 9. 2018
Přijato: 14. 5. 2019
MUDr. Binková Hana, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku
LF MU a FN u svaté Anny v Brně
Pekařská 664/53
656 91 Brno
e-mail: binkova.ha@seznam.cz
Zdroje
1. Chaturvedi AK, Anderson WF, Lortet-Tieulent J et al. Worldwide trends in incidence rates for oral cavity and oropharyngeal cancers. J Clin Oncol; 31 (36): 4550–4559. doi: 10.1200/JCO.2013.50.3870.
2. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: http: //www.svod.cz/analyse.
3. Chaturvedi AK, Engels EA, Pfeiffer RM et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011; 29 (32): 4294–4301. doi: 10.1200/JCO.2011.36.4596.
4. Fakhry C, Gillison ML. Clinical implications of human papillomavirus in head and neck cancers. J Clin Oncol 2006; 24 (17): 2606–2611. doi: 10.1200/JCO.2006.06.1291.
5. TNM Klasifikace zhoubných novotvarů. 8. vyd. Česká republika 2018.
6. Parkin DM, Bray F, Ferlay J et al. Global cancer statistics 2002. CA Cancer J Clin 2005; 55 (2): 74–108.
7. Smith E, Justine M. Ritchie et al. Human papillomavirus in oral exfoliated cells and risk of head and neck cancer head and neck cancer. J Natl Cancer Inst 2004; 96 (6): 449–455. doi: 10.1093/jnci/djh074.
8. Chaturvedi AK, Engels EA, Pfeiffer RM et al. Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J Clin Oncol 2011; 29 (32): 4294–301. doi: 10.1200/JCO.2011.36.4596.
9. Hammarstedt L, Lindquist D, Dahlstrand H et al. Human papillomavirus as a risk factor for the increase in incidence of tonsillar cancer. Int Jour Cancer 2006; 119 (11): 2620–2623. doi: 10.1002/ijc.22177.
10. Ernster JA, Sciotto CG, O’Brien MM et al. Rising incidence of oropharyngeal cancer and the role of oncogenic human papilloma virus. Laryngoscope 2007; 117 (12): 2115–2128. doi: 10.1097/MLG.0b013e31813e5fbb.
11. Rotnáglová E, Tachezy R, Saláková M et al. HPV involvement in tonsillar cancer: prognostic significance and clinically relevant markers. Int J Cancer 2011; 129 (1): 101–110. doi: 10.1002/ijc.25889.
12. Golusiński P, Pazdrowski J, Szewczyk M et al. Is immunohistochemical evaluation of p16 in oropharyngeal cancer enough to predict the HPV positivity? Rep Pract Oncol Radiother 2017; 22 (3): 237–242. doi: 10.1016/j.rpor.2017.01.003.
13. Rischin D, Young RJ, Fischer R et al. Prognostic significance of p16INK4A and human papillomavirus in patients with oropharyngeal cancer treated on TROG 02.02 phase III trial. J Clin Oncol 2010; 28 (27): 4142–4148. doi: 10.1200/JCO.2010.29.2904.
14. Chaturvedi AK, Engels EA, Anderson WF et al. Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. J Clin Oncol 2008; 26 (4): 612–619. doi: 10.1200/JCO.2007.14.1713.
15. Wilczynski SP, Lin BT, Xie Y et al. Detection of human papillomavirus DNA and oncoprotein overexpression are associated with distinct morphological patterns of tonsillar squamous cell carcinoma. Am J Pathol 1998; 152 (1): 145–156.
16. Pytynia K, Dahlstrom KR, Sturgis EM. Epidemiology of HPV-associated oropharyngeal cancer. Oral Oncol 2014; 50 (5): 380–386. doi: 10.1016/j.oraloncology.2013.12.019.
17. Ang KK, Harris J, Wheeler R et al. Human papillomavirus and survival of patients with oropharyngeal cancer. N Engl J Med 2010; 363 (1): 24–35. doi: 10.1056/NEJM-oa0912217.
18. Dai M, Clifford GM, le Calvez F et al. Human papillomavirus type 16 and TP53 mutation in oral cancer: matched analysis of the IARC multicenter study. Cancer Res 2004; 64 (2): 468–471.
19. Spanos WC, Nowicki P, Lee DW et al. Immune response during therapy with cisplatin or radiation for human papillomavirus-related head and neck cancer. Arch Otolaryngol Head Neck Surg 2009; 135 (11): 1137–1146. doi: 10.1001/archoto.2009.159.
20. Gillison ML, D’Souza G, Westra W et al. Distinct risk factor profiles for human papillomavirus type 16-positive and human papillomavirus type 16-negative head and neck cancers. J Natl Cancer Inst 2008; 100 (6): 407–420. doi: 10.1093/jnci/djn025.
21. Smith EM, Rubenstein LM, Haugen TH et al. Tobacco and alcohol use increases the risk of both HPV-associated and HPV-independent head and neck cancers. Cancer Causes Control 2010; 21 (9): 1369–1378. doi: 10.1007/s10552-010-9564-z.
22. Hafkamp HC, Manni JJ, Haesevoets A et al. Marked differences in survival rate between smokers and nonsmokers with HPV 16-associated tonsillar carcinomas. Int J Cancer 2008; 122 (12): 2656–2664. doi: 10.1002/ijc.23 458.
23. Maxwell JH, Kumar B, Feng FY. Tobacco use in HPV-positive advanced oropharynx cancer patients related to increased risk of distant metastases and tumor recurrence. Clin Cancer Res 2010; 16 (4): 1226–1235.
24. Mirghani H, Blanchard P. Treatment de-escalation for HPV-driven oropharyngeal cancer: Where do we stand? Clin Transl Radiat Oncol 2017; 8 : 4–11. doi: 10.1016/ j.ctro.2017.10.005.
25. Orlandi E, Licitra L. Personalized medicine and the contradictions and limits of first-generation deescalation trials in patients with human papillomavirus–positive oropharyngeal cancer. JAMA Otolaryngol Head Neck Surg 2018; 144 (2): 99–100. doi: 10.1001/jamaoto.2017.2308.
26. Masterson L, Moualed D, Masood A et al. De-escalation treatment protocols for human papillomavirus-associated oropharyngeal squamous cell carcinoma. Cochrane Database Syst Rev 2014; (2): CD010271. doi: 10.1002/14651858.CD010271.pub2.
27. Tandon S, Tudur-Smith C, Riley RD et al. A systematic review of p53 as a prognostic factor of survival in squamous cell carcinoma of the four main anatomical subsites of the head and neck. Cancer Epidemiol Biomarkers Prev 2010; 19 (2): 574–587. doi: 10.1158/1055-9965.EPI-09-0981.
28. Maruyama H, Yasui T, Ishikawa-Fujiwara T et al. Human papillomavirus and p53 mutations in head and neck squamous cell carcinoma among Japanese population. Cancer Sci 2014; 105 (4): 409–417. doi: 10.1111/cas. 12369.
29. Wittekindt C, Klussmann JP. Tumor staging and HPV-related oropharyngeal cancer. Recent Results Cancer Res 2017; 206 : 123–133. doi: 10.1007/978-3-319-435 80-0_9.
30. Horne ZD, Glaser SM, Vargo JA et al. Confirmation of proposed human papillomavirus risk-adapted staging according to AJCC/UICC TNM criteria for positive oropharyngeal carcinomas. Cancer 2016; 122 (13): 2021–2030. doi: 10.1002/cncr.30021.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2019 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Izolovaná hypertermická perfuze končetiny
- Asociace TNF-α -308G>A polymorfizmu s citlivostí na karcinom děložního čípku a prsu – systematický přehled a metaanalýza
- MikroRNA v mozkomíšním moku jako biomarkery u pacientů s nádory mozku
- Sledování prognózy HPV pozitivních a negativních orofaryngeálních karcinomů v závislosti na léčebné modalitě
- Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Neoadjuvantní užití hypertermické izolované perfuze končetiny v léčbě nediferencovaného vřetenobuněčného sarkomu dolní končetiny s dosažením kompletní patologické odpovědi
- Primární intrakraniální sarkomy, myxoidní meningeální sarkom – kazuistika a přehled literatury
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Kazuistika pacientky s prognosticky nepříznivým metastatickým kolorektálním karcinomem léčené trifluridin/tipiracilem – příklad úspěšné multioborové spolupráce
- Aktuality z odborného tisku
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



