-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
Photodynamic therapy (PDT) belongs in perspective modalities of cancer treatment. It is based on the tumour-selective accumulation of a photosensitizer followed by irradiation with light of a specific wavelength. PDT is widely developed nowadays due to its high specificity and selectivity along with absence of the unadvisable side-effects. Sonodynamic therapy (SDT) exploits ultrasound to induce cytotoxic effect of sensitizer. In our study we tested the possibility of combination of this therapies and icrease of efficiency. Our results suggest that irradiation in combination with application of therapeutic ultrasound increases production of reactive oxygen species and reduces viability of tumour MCF7 cells, compared to irradiation of ZnTPPS4 only, especially in the case of higher therapeutic doses. In the future, the combination of PDT and SDT can bring a new treatment modality for malignant and also nonmalignant diseases.
Keywords:
photosensitizer, photodynamic therapy, sonodynamic therapy, porphyrine derivative
Autoři: Klára Pížová 1,2; Kateřina Tománková 1; Kateřina Langová 1; Adéla Hanáková 1,2; Hana Lenobelová 1; Hana Zapletalová 1; Jakub Malohlava 1,2; Svatopluk Binder 1; Robert Bajgar 1,2; Jaromír Vachutka 1; Ladislav Doležal 1; Hana Kolářová 1
Působiště autorů: Ústav lékařské biofyziky, Lékařská fakulta, Univerzita Palackého, Olomouc, ČR 1; Ústav molekulární a translační medicíny, Lékařská fakulta, Univerzita Palackého, Olomouc, ČR 2
Vyšlo v časopise: Lékař a technika - Clinician and Technology No. 4, 2012, 42, 18-22
Souhrn
Fotodynamická terapie (PDT) patří k perspektivním metodám léčby nádorů. Je založená na selektivní akumulaci fotosensitizeru v nádorové tkáni a následném ozáření světlem určité vlnové délky. PDT je díky vysoké specifitě a selektivitě a faktu, že nevyvolává nežádoucí vedlejší účinky, v současnosti široce rozvíjena. Sonodynamická terapie (SDT) využívá k vyvolání cytotoxického efektu sensitizeru ultrazvuk. V naší práci jsme ověřovali, zda je možné tyto metody kombinovat a zvýšit tak jejich účinek. Z výsledků vyplývá, že ozáření v kombinaci s aplikací terapeutického ultrazvuku zvyšuje oproti samotnému ozáření ZnTPPS4 produkci reaktivních forem kyslíku a snižuje životnost nádorových buněk MCF7, zvláště v případě vyšších terapeutických dávek. Kombinace PDT a SDT může do budoucna přinést nové možnosti léčby nádorových, ale také nenádorových onemocnění.
Klíčová slova:
fotosensitizer, fotodynamická terapie, sonodynamická terapie, derivát porfyrinuÚvod
Fotodynamická terapie (PDT) je jednou z metod minimálně invazivního způsobu léčby celé řady nádorů i některých nenádorových onemocnění a v současné době se stále více rozvíjí. PDT kombinuje tři faktory - kyslík, viditelné záření a fotosensitizer, který se akumuluje přednostně v nádorové tkáni. Tyto komponenty jsou samy o sobě neškodné, ale společně mohou mít letální efekt a tak vyhubit nádorové buňky [1]. Po ozáření světlem určité vlnové délky je molekula fotosensitizeru excitována a dochází k přenosu energie na substráty v buňce (fotochemická reakce typu I), což vede k tvorbě volných radikálů a radikálových produktů (peroxidy, superoxidové ionty a hydroxylové radikály), které spouští řetězové radikálové reakce. Nebo energie excitovaného fotosensitizeru přechází přímo na molekulu kyslíku (fotochemická reakce typu II), čímž vznikne singletní kyslík (1O2), který poté oxiduje další molekuly v buňce. Výsledné poškození organel nádorových buněk vede k zániku nádoru. Buňky nádoru mohou umírat apoptózou nebo nekrózou [2–5]. Hlavními výhodami PDT oproti radioterapii a chemoterapii je vyšší selektivita při destrukci nádorové tkáně, možnost opakované aplikace a fakt, že PDT nezpůsobuje těžké lokální ani systémové komplikace. Další výhodou fotodynamických reakcí je možnost využít jejich principu jak k léčbě, tak k fluorescenční diagnostice nádoru [4].
Sonodynamická terapie (SDT) využívá k aktivaci senzitivní látky v patologických tkáních ultrazvuk. Doposud není objasněn mechanismus účinku SDT, výzkumy však naznačují, že SDT vyvolává tzv. vnitřní kavitaci, což je proces, kdy se vzduchová bublina vyvolaná ultrazvukem v kapalině náhle rozpadne a vyvolá šokovou vlnu doprovázenou silným uvolněním tepelné energie. Okolní molekuly vody se přitom rozloží na *H a *OH radikály, které spolu s následně vzniklými radikálovými produkty opět spouští řetězové radikálové reakce a poškozují molekuly buňky. Kromě kavitace může SDT způsobovat také změnu rozmístění sensitizeru v buňce a přeměnu agregovaných molekul sensitizeru na stabilnější monomerní formu, která má silnější cytotoxický účinek. Ultrazvuk může rovněž destabilizovat buněčnou membránu, díky čemuž se buňka stane citlivější a zvýší se transport léčiva přes buněčnou membránu. Tato metoda má oproti jiným fyzikálním způsobům léčby výhodu opět především v selektivitě, protože ultrazvuk je možné zaměřit na malou cílovou oblast. Výhodou oproti PDT je fakt, že ultrazvuk může pronikat hlouběji do tkáně [6–10].
Protože se v literatuře objevily náznaky, že některé fotosensitizery lze aktivovat jak fotochemicky, tak sonochemicky [11–18], zajímalo nás, jak a zda je možné zmíněné terapie kombinovat a tak zvýšit jejich účinnost. Hodnotili jsme tedy podpůrný vliv ultrazvuku na PDT s fotosensitizerem na bázi porfyrinu ZnTPPS4 na nádorovou buněčnou linii MCF7 v podmínkách in vitro. Účinek in vitro terapie jsme zkoumali pomocí detekce tvorby reaktivních forem kyslíku (ROS) a testem buněčné viability (MTT test).
Materiál a metody
Příprava buněčné kultury
Použili jsme buněčnou linii MCF7 (odvozená od lidského karcinomu prsu). Buňky byly kultivovány v médiu DMEM (10% fetálního bovinního séra, 2% 200 mM L-glutaminu, 0,4% penicilinu/streptomycinu, Sigma) ve sterilních Petriho miskách (TPP, 35 mm), (300 000 buněk/misku) v atmosféře 5% CO2 při 37°C.
Fotodynamická a sonodynamická terapie
Do kultivačního média DMEM byl přidán fotosentitizer ZnTPPS4 [zinečnatý komplex meso-tetrakis(4-sulfonatofenyl)porfyrinu] v koncentracích 0 (kontrola); 1; 2,5; 5 a 10 μmol/l. Po 24 h inkubace ve tmě (5% CO2, 37°C) byly buňky opláchnuty PBS a trypsinizovány 0,5% trypsinem (Sigma-Aldrich). Průběh trypsinnizace byl sledován na inverzním optickém mikroskopu Olympus IX81 s DSU jednotkou (Olympus). Po uvolnění buněk ze dna byla trypsinizace zastavena čerstvým médiem DMEM s 10% FBS a suspenze byla přenesena do 2ml zkumavek eppedorf (P-LAB). Suspenze byla centrifugována při 1250 rpm 5 minut centrifuga HERMLE Z 300 K) a pelet buněk byl resuspendován v 5μM roztoku 5-(and 6-)-chloromethyl-2´,7´-dichlorodihydrofluorescein diacetátu (CM-H2DCFDA), (Invitrogen). Po 30 min inkubace ve tmě byla polovina vzorků vystavena na 5 min působení terapeutického ultrazvuku (BTL-4000, BTL Industries) o frekvenci 1 MHz a intenzitě 2 W/cm2. Buněčná suspenze všech vzorků byla následně rozpipetována na 96ti jamkovou kultivační destičku (TPP) a ozářena LED diodami s vlnovou délkou 414 nm, FWHM 20 nm o celkové dávce 0 (kontrola); 10 a 25 J/cm2.
Detekce reaktivních forem kyslíku (ROS)
Ihned po ozáření byla měřena fluorescence 5-(-6)-chloromethyl - 2’,7’-dichlorofluoresceinu (CM-DCF), (excitace/emise: 485/540 nm) na readeru Synergy HT (BioTek). Poté byl přebytek sondy vymyt PBS, nahrazen čerstvým médiem DMEM a buňky byly inkubovány dalších 24 h (5% CO2, 37°C).
Test viability (MTT test)
Médium DMEM bylo nahrazeno 2mM roztokem 3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromidu (MTT), (Sigma-Aldrich) v PBS. Buňky byly v roztoku MTT inkubovány 3,5 h (5% CO2, 37°C). Poté byl roztok MTT odstraněn a krystalky formazánu rozpuštěny v DMSO. Absorbance formazánu byla měřena na readeru Synergy HT při 570 nm (absorbance formazánu) a 690 nm (absorbance destičky - pozadí). Odečtené hodnoty absorbance byly zpracovány v programu PHOTOTOX a byly zjištěny hodnoty IC50 pro neozvučované a ozvučované vzorky.
Statistické zpracování dat
Ke statistickému zpracování dat byl použit software SPSS verze 15 (SPSS Inc. Chicago, USA). Nejprve se testy normality Shapiro-Wilk zjišťovalo, zda mají data normální rozdělení. Pokud bylo prokázáno, že mají normální rozložení, skupiny byly dále porovnány dvouvýběrovým t-testem. U skupin, kde se neprokázalo normální rozdělení dat, byly na následné porovnání použity neparametrické Mann-Whitney U-testy.
Výsledky
Detekce reaktivních forem kyslíku (ROS)
Jak je patrné z výsledných grafů, množství vzniklých ROS závisí zejména na celkové dávce ozáření, méně pak na koncentraci fotosensitizeru. Při terapii bez ozáření (viz Graf 1) byly hodnoty ROS podle očekávání minimální a rozdíly mezi ozvučenými a neozvučenými vzorky nebyly patrné. Při statistickém hodnocení (viz Tab. 1) sice vyšlo v případě 10 μM ZnTPPS4, že aplikace ultrazvuku hodnoty ROS statisticky významně zvýšila (p = 0,004), vzhledem k vysokým hodnotám ROS u ozařovaných vzorků je to ovšem zanedbatelné. Při terapii s dávkou ozáření 10 J/cm2 (viz Graf 2) aplikace ultrazvuku zvýšila produkci ROS při vyšších koncentracích ZnTPPS4 (5 a 10 μmol/l), jako statisticky významné (viz Tab. 1) bylo ovšem zvýšení pouze u nejvyšší koncentrace 10 μmol/l (p = 0,0001). V případě koncentrací 0 a 5 μmol/l je ale patrný statistický trend směrem ke zvýšení hodnot při aplikaci ultrazvuku, protože hodnoty signifikance byly těsně nad hladinou významnosti (p = 0,088). Při terapii s dávkou ozáření 25 J/cm2 (viz Graf 3) byly hodnoty ROS podle očekávání nejvyšší a je patrné, že použití ultrazvuku produkci ROS ještě zvyšovalo a to při všech aplikovaných koncentracích ZnTPPS4. Jako statisticky významné (viz Tab. 1) bylo ovšem zvýšení v případě 0μM ZnTPPS4 (p = 0,0001), 2,5μM ZnTPPS4 (p = 0,029) a 5μM ZnTPPS4 (p = 0,015).
Graf 1. Hodnoty fluorescence reaktivních forem kyslíku (ROS) při různých koncentracích fotosensitizeru ZnTPPS<sub>4</sub> v kombinaci s (světle šedé sloupce) nebo bez (tmavě šedé sloupce) aplikace terapeutického ultrazvuku na buňkách MCF7 naměřené ihned po terapii. Znázorněná data reprezentují průměrné hodnoty a směrodatné odchylky ze tří nezávislých měření. 
Tab. 1. Statistické vyhodnocení počátečních hodnot ROS. 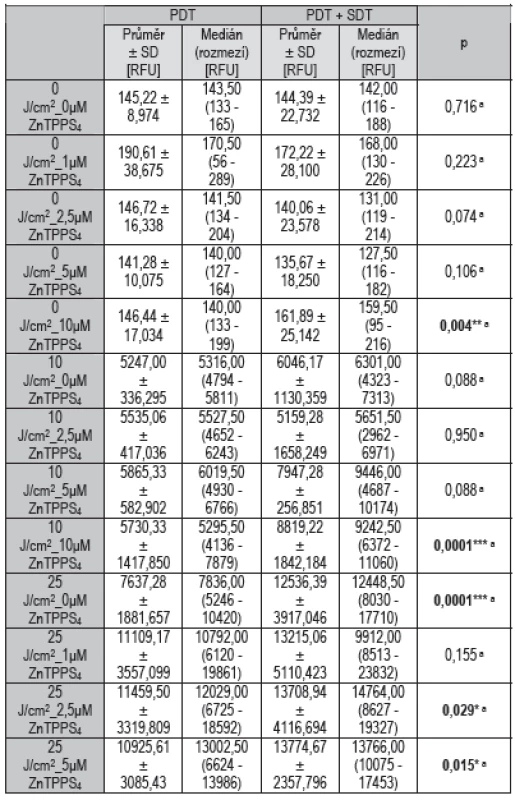
a Mann-Whitney U-testy * hodnoty jsou statisticky významné na hladině 0,05 ** hodnoty jsou statisticky významné na hladině 0,01 *** hodnoty jsou statisticky významné na hladině 0,001 Graf 2. Hodnoty fluorescence ROS při různých koncentracích fotosensitizeru ZnTPPS<sub>4</sub> v kombinaci s viditelným světlem vlnové délky 414 nm o celkové dávce ozáření 10 J/cm<sup>2</sup> a v kombinaci s (světle šedé sloupce) nebo bez (tmavě šedé sloupce) aplikace terapeutického ultrazvuku na buňkách MCF7 naměřené ihned po terapii. Znázorněná data reprezentují průměrné hodnoty a směrodatné odchylky ze tří nezávislých měření. 
Graf 3. Hodnoty fluorescence ROS při různých koncentracích fotosensitizeru ZnTPPS<sub>4</sub> v kombinaci s viditelným světlem vlnové délky 414 nm o celkové dávce ozáření 25 J/cm<sup>2</sup> a v kombinaci s (světle šedé sloupce) nebo bez (tmavě šedé sloupce) aplikace terapeutického ultrazvuku na buňkách MCF7 naměřené ihned po terapii. Znázorněná data reprezentují průměrné hodnoty a směrodatné odchylky ze tří nezávislých měření. 
Test viability (MTT test)
Na základě předběžných experimentů pomocí testu viability MTT v širší škále koncentrací ZnTPPS4 (data nezobrazena) byly vybrány pro každou dávku ozáření vždy tři koncentrace (a kontrola) tak, aby ta prostřední vyvolávala přibližně 50% úmrtnost buněk (pro 10 J/cm2 je to 5 μmol/l ZnTPPS4, pro 25 J/cm2 je to 2,5 μmol/l ZnTPPS4).
Při terapii bez ozáření životnost buněk podle očekávání neklesla pod 50 % při žádné aplikované koncentraci fotosensitizeru, ať už bez nebo s použitím ultrazvuku (viz Tab. 2), hodnotu IC50 tedy nebylo možno určit. Při terapii s dávkou ozáření 10 J/cm2 aplikace ultrazvuku snížila hodnotu IC50 v průměru ze 4,972 μmol/l na 3,693 μmol/l, snížení ale nebylo statisticky významné. Při terapii s dávkou ozáření 25 J/cm2 aplikace ultrazvuku snížila hodnotu IC50 v průměru z 2,632 μmol/l na 0,995 μmol/l a snížení se prokázalo jako statisticky významné (p = 0,048).
Tab. 2. Statistické vyhodnocení hodnot IC50. 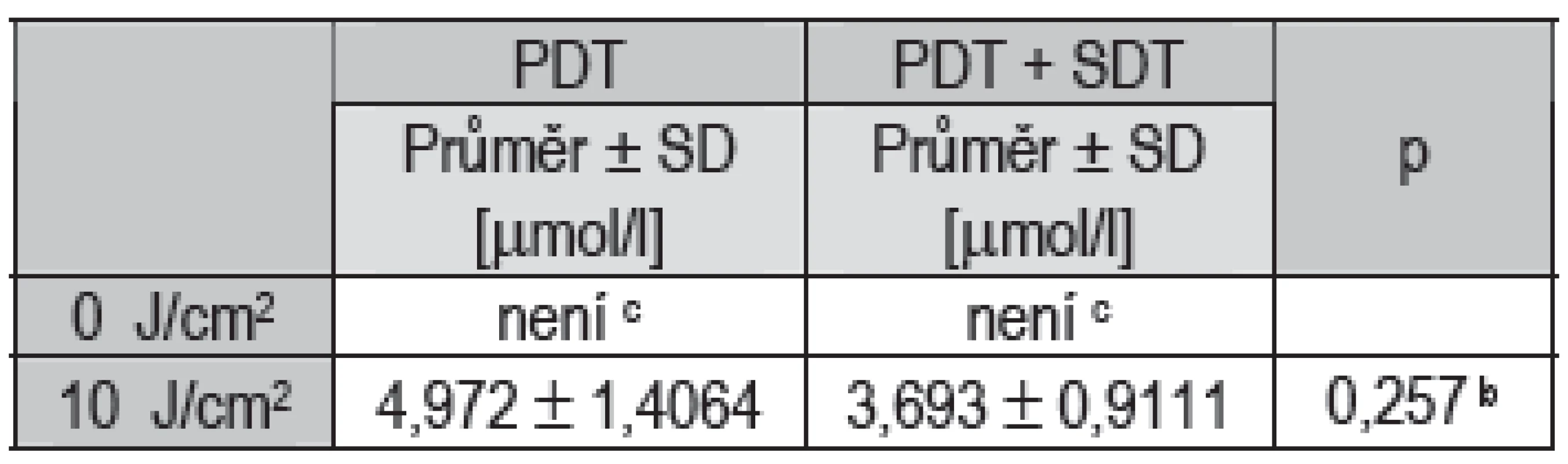
b Dvouvýběrový t-test c hodnoty životnosti neklesly pod 50 % * hodnoty jsou statisticky významné na hladině 0,05 ** hodnoty jsou statisticky významné na hladině 0,01 *** hodnoty jsou statisticky významné na hladině 0,001 Diskuze
Některé fotosensitizery lze aktivovat jak fotochemicky, tak sonochemicky [11–14, 17, 18]. V této práci jsme testovali na nádorové buněčné linii MCF7 v podmínkách in vitro, zda je možné PDT a SDT kombinovat a tak zvýšit jejich účinnost. Na základě výsledků lze soudit, že kombinace SDT a PDT je účinnější. Aplikace terapeutického ultrazvuku v kombinaci s PDT se ZnTPPS4 zvyšuje oproti samotné PDT produkci reaktivních forem kyslíku i úmrtnost buněk, což se statisticky prokázalo u vyšších terapeutických dávek (vyšší koncentrace fotosensitizeru, vyšší dávky ozáření).
Tímto tématem se naše skupina již dříve zabývala, když jsme zkoumali tvorbu ROS po PDT v kombinaci s SDT, rovněž na buněčné linii MCF7 [15], ale také na linii G361 (odvozené od lidského melanomu) [16], jako fotosensitizer jsme ovšem používali ftalocyanin ClAlPcS2. Kvůli poněkud odlišnému postupu (vzorky nebyly trypsinizovány, byly ozvučovány v Petriho miskách a ultrazvuk byl aplikován po delší dobu – 10 min) a především jinému typu sensitizeru nelze výsledky příliš srovnávat. Ovšem i při těchto experimentech se prokázalo, že PDT v kombinaci s SDT zvyšuje produkci ROS oproti samotné PDT, na buněčné linii MCF7 však opět pouze při nejvyšších terapeutických dávkách.
Předpokládá se, že SDT vyvolává kavitaci, může také měnit rozmístění fotosensitizeru v buňce, vyvolávat destabilizaci buněčné membrány a přeměnu agregovaných molekul fotosensitizeru na stabilnější monomerní formu se silnějším cytotoxickým účinkem [6–10]. Z výsledků vyplývá, že ultrazvuk působí mimo jiné na samotnou molekulu fotosensitizeru a v případě buněčné linie MCF7 se vliv ultrazvuku u kombinované terapie PDT s SDT nejvíce projevuje při vyšších terapeutických dávkách.
Závěr
Je velmi důležité hledat a rozvíjet nové účinnější způsoby léčby. Fotodynamická a sonodynamická terapie by mohla výhledově doplnit běžně používané terapeutické postupy pro zhoubné nádory jako chirurgické odstranění, radioterapie a chemoterapie. S pomocí PDT bylo dosaženo už celé řady úspěchů a několik fotosensitizerů bylo schváleno pro klinické použití (k léčbě nádorových i některých nenádorových onemocnění). PDT je ale neustále předmětem výzkumu. Hlavní snahou je zvýšit účinnost této metody a rozšířit její použití. V naší práci jsme prokázali, že aplikace terapeutického ultrazvuku může významně zvýšit účinnost PDT v podmínkách in vitro. I když všechny mechanismy kombinovaného efektu SDT a PDT ještě nejsou zcela vysvětleny, věříme, že tato kombinovaná terapie se může do budoucna stát další účinnou léčebnou metodou a je vhodné zabývat se jí dále.
Poděkování
Práce vznikla za podpory výzkumných projektů CZ.1.05/2.1.00/01.0030 a LF_2011_009.
Prof. RNDr. Hana Kolářová, CSc.
Ústav lékařské biofyziky
Lékařská fakulta
Univerzita Palackého v Olomouci
Hněvotínská 3, 775 15 Olomouc
E-mail: hana.kolarova@upol.cz
tel.: +420 585 632 101
Zdroje
[1] Pushpan, S.K., Venkatraman, S., Anand, V.G., Sankar, J., Parmeswaran, D., Ganesan, S., Chandrashekar, T.K.: Porphyrins in photodynamic therapy - a search for ideal photosensitizers. Curr Med Chem Anticancer Agents, 2, 2002, pp. 187-207.
[2] Calzavara-Pinton, P.G., Venturini, M., Sala, R.: Photodynamic therapy: update 2006. Part 1: Photochemistry and photobiology. J Eur Acad Dermatol Venereol, 21, 2007, pp. 293-302.
[3] O'Connor, A.E., Gallagher, W.M., Byrne, A.T.: Porphyrin and nonporphyrin photosensitizers in oncology: preclinical and clinical advances in photodynamic therapy. Photochem Photobiol, 85, 2009, pp. 1053-1074.
[4] Kudinova, N.V., Berezov, T.T.: Photodynamic Therapy of Cancer: Search For Ideal Photosensitizer. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry, 4, 2010, pp. 95–103.
[5] Agostinis, P., Berg, K., Cengel, K.A., Foster, T.H., Girotti, A.W., Gollnick, S.O., Hahn, S.M., Hamblin, M.R., Juzeniene, A., Kessel, D., Korbelik, M., Moan, J., Mroz, P., Nowis, D., Piette, J., Wilson, B.C., Golab, J.: Photodynamic therapy of cancer: an update. CA Cancer J Clin, 61, 2011, pp. 250-281.
[6] Suslick, K.S.: Sonochemistry. Science, 247, 1990, pp. 1439-1445.
[7] Worthington, A.E., Thompson, J., Rauth, A.M., Hunt, J.W.: Mechanism of ultrasound enhanced porphyrin cytotoxicity. Part I: A search for free radical effects. Ultrasound Med Biol, 23, 1997, pp. 1095-1105.
[8] Miyoshi, N., Takeshita, T., Misik, V., Riesz, P.: Monomerization of photosensitizers by ultrasound irradiation in surfactant micellar solutions. Ultrason Sonochem, 8, 2001, pp. 367-371.
[9] Rosenthal, I., Sostaric, J.Z., Riesz, P.: Sonodynamic therapy - a review of the synergistic effects of drugs and ultrasound. Ultrason Sonochem, 11, 2004, pp. 349-363.
[10] Hiraoka, W., Honda, H., Feril, L.B. Jr., Kudo, N., Kondo, T.: Comparison between sonodynamic effect and photodynamic effect with photosensitizers on free radical formation and cell killing. Ultrason Sonochem, 13, 2006, pp. 535-542.
[11] Jin, Z.H., Miyoshi, N., Ishiguro, K., Umemura, S., Kawabata, K., Yumita, N., Sakata, I., Takaoka, K., Udagawa, T., Nakajima, S., Tajiri, H., Ueda, K., Fukuda, M., Kumakiri, M.: Combination effect of photodynamic and sonodynamic therapy on experimental skin squamous cell carcinoma in C3H/HeN mice. J Dermatol, 27, 2000, pp. 294-306.
[12] Yumita, N., Nishigaki, R., Umemura, S.: Sonodynamically induced antitumor effect of Photofrin II on colon 26 carcinoma. J Cancer Res Clin Oncol, 126, 2000, pp. 601-606.
[13] Yumita, N., Umemura, S.: Sonodynamic therapy with photofrin II on AH130 solid tumor. Pharmacokinetics, tissue distribution and sonodynamic antitumoral efficacy of photofrin II. Cancer Chemother Pharmacol, 51, 2003, pp. 174-178.
[14] Milowska, K., Gabryelak, T.: Synergistic effect of ultrasound and phthalocyanines on nucleated erythrocytes in vitro. Ultrasound Med Biol, 31, 2005, pp. 1707-1712.
[15] Kolarova, H., Bajgar, R., Tomankova, K., Krestyn, E., Dolezal, L., Halek, J.: In vitro study of reactive oxygen species production during photodynamic therapy in ultrasound-pretreated cancer cells. Physiol Res, 56Suppl 1), 2007, pp. S27-32.
[16] Kolarova, H., Tomankova, K., Bajgar, R., Kolar, P., Kubinek, R.: Photodynamic and sonodynamic treatment by phthalocyanine on cancer cell lines. Ultrasound Med Biol, 35, 2009, pp. 1397-1404.
[17] Wang, J., Guo, Y., Gao, J., Jin, X., Wang, Z., Wang, B., Li, K., Li, Y.: Detection and comparison of reactive oxygen species (ROS) generated by chlorophyllin metal (Fe, Mg and Cu) complexes under ultrasonic and visible-light irradiation. Ultrason Sonochem, 18, 2011, pp. 1028-1034.
[18] El-Sikhry, H.E., Miller, G.G., Madiyalakan, M.R., Seubert, J.M.: Sonodynamic and photodynamic mechanisms of action of the novel hypocrellin sonosensitizer, SL017: mitochondrial cell death is attenuated by 11, 12-epoxyeicosatrienoic acid. Invest New Drugs, 29, 2011, pp. 1328-1336.
Štítky
Biomedicína
Článek Editorial
Článok vyšiel v časopiseLékař a technika

2012 Číslo 4-
Všetky články tohto čísla
- Vliv poruch sondy sonografu na kvalitativní parametry ultrazvukového B-obrazu
- Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
- Editorial
- Fantom pro diagnostický ultrazvuk a dopplerovské vyšetření
- A performance tester of defibrillator accumulators for clinical purposes
- Methodology of thermographic atlas of the human body
- Home measurement of blood pressure: present problems and perspective improvements
- Úskalí termografického měření v medicíně
- Lékař a technika
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Úskalí termografického měření v medicíně
- Fantom pro diagnostický ultrazvuk a dopplerovské vyšetření
- Vliv poruch sondy sonografu na kvalitativní parametry ultrazvukového B-obrazu
- Vliv ultrazvuku na účinnost fotodynamické terapie – in vitro studie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



