-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Identifikácia estrogénového alfa receptora v proliferačnom endometriu a vo svetlobunkovom karcinóme
Identification of the estrogen alpha receptor in normal endometrium and in clear cell carcinoma
Histomorphological appearance of endometrium and content of some proteins in it is changing in relation to a biological age of a woman. Important changes are arising mainly in tumour processes. In this work we focused on the expression of estrogen α receptor in clear cell endometrial carcinoma. We examined immunohistochemically 10 samples with normal proliferative endometrium and 10 samples with clear cell endometrial carcinoma. The expression of estrogen α receptor was high in proliferative endometrium. The expression of estrogen α receptor was not found in clear cell endometrial carcinoma that corresponded with worse clinical behaviour of the tumour. In conformity with other publications we are stating that the expression of this protein is an important prognostic marker of endometrial carcinoma. Therefore evaluation of this protein by immunohistochemistry is an important factor with implications for clinical practice.
Key words:
endometrial carcinoma – estrogen receptor – immunohistochemistry – prognostic marker
Autori: V. Šišovský 1; Ľudovít Danihel 1; M. Palkovič 1; B. Bučeková 1; M. Redecha 2; M. Korbeľ 2; Z. Nižňanská 2; Vanda Repiská 3
; A. Molnárová 4; I. Bartošová 5
Pôsobisko autorov: Ústav patologickej anatómie, Lekárska fakulta, Univerzita Komenského v Bratislave 1; 1. gynekologicko pôrodnícka klinika, Lekárska fakulta, Univerzita Komenského v Bratislave 2; Ústav lekárskej biológie, genetiky a klinickej genetiky, Lekárska fakulta, Univerzita Komenského v Bratislave 3; Oddelenie brachyterapie, Klinika radiačnej onkológie, Onkologický ústav sv. Alžbety, s. r. o., a SZU Bratislava 4; Interné oddelenie, Národný onkologický ústav, Bratislava 5
Vyšlo v časopise: Prakt Gyn 2009; 13(2): 106-109
Súhrn
Histomorfologický vzhľad endometria a obsah niektorých proteínov v ňom sa menia v závislosti na biologickom veku ženy. Významné zmeny vznikajú najmä pri nádorových procesoch. V práci sme sa zamerali na expresiu estrogénového α receptora pri svetlobunkovom karcinóme endometria. Imunohistochemicky sme vyšetrili po 10 vzorkách svetlobunkového karcinómu a fyziologického proliferačného endometria. Expresia estrogénového α receptora bola vysoká v proliferačnom endometriu. V svetlobunkovom karcinóme endometria sme expresiu estrogénového α receptora nezistili, čo korešpondovalo s horším klinickým správaním sa tumoru. V súlade s inými publikovanými prácami konštatujeme, že expresia tohto proteínu je dôležitým prognostickým faktorom karcinómu endometria. Jeho hodnotenie pomocou imunohistochémie je preto dôležitým faktorom s implikáciou pre klinickú prax.
Kľúčové slová:
karcinóm endometria – estrogénový receptor – imunohistochémia – prognostický faktorPráce je převzata z časopisu Gynekol prax 2007; 5(4): 223 – 226.
Úvod
Karcinóm endometria (CaE) je najčastejšia neoplázia ženského pohlavného systému. V Spojených štátoch amerických ide o 4. a celosvetovo o 5. najčastejší karcinóm. Jeho výskyt má stúpajúci trend [1,2,3]. Na Slovensku vzrástol za posledných 20 rokov minulého storočia počet ročne diagnostikovaných prípadov takmer o tretinu [4,5,6]. Na CaE ochorie na Slovensku každoročne približne 700 žien, pričom asi 200 z nich ochoreniu podľahne.
Histomorfologický vzhľad endometria a prítomnosť niektorých proteínov v ňom sa v priebehu biologického veku ženy menia [7]. Ešte výraznejšie zmeny vznikajú pri nádorových procesoch [2]. Imunohistochemická analýza je niekedy jedným z rozhodujúcich faktorov stanovenia diagnózy. Identifikáciou niektorých prognostických faktorov nádorového ochorenia uľahčuje klinikovi voľbu optimálnejšej liečby [8,9,10,11,12,13]. Patológ svojou prácou významne prispieva k hodnoteniu nádorovej choroby, najmä ku klasifikácii nádoru, ako aj k určeniu prognózy choroby [14,15,16,17].
Receptor 1 (α) pre estrogén (ES1R) je proteín s molekulovou hmotnosťou 67 kDa [18]. ES1R patrí k vnútrobunkovým steroidovým receptorom, ktoré sa nachádzajú najmä v jadre bunky [19]. Sprostredkúva fyziologické efekty estrogénu. Má významnú úlohu v regulácii rastu a diferenciácie buniek [20]. Je asociovaný s veľkou rozmanitosťou buniek. Defekt riadnej tvorby ES1R má za následok viacero chorôb, napr. karcinóm mliečnej žľazy [18]. Endometrioidné CaE často majú receptory pre estrogény (ESR), serózne a svetlobunkové CaE majú tieto receptory len zriedkavo [21].
CaE pochádza zo žľazových epitelových štruktúr endometria. Má rozličné histologické formy so špecifickým morfologickým vzhľadom. Podľa Robboya et al [22] niektoré formy hyperplázie endometria (HE) a CaE tvoria široké spektrum proliferačných stavov, ktoré predstavujú morfologické a biologické kontinuum, začínajúce hyperpláziou žliaz endometria a končiace adenokarcinómom. Podľa Gusberga [23] je možno predísť adenokarcinómu endometria včasnou liečbou HE. Pozorovania iných autorov dokazujú, že niektoré histologické podtypy (serózny) CaE nepochádzajú z HE [2,11,24,25,26,27].
Početné epidemiologické, klinické, histopatologické, molekulovo-biologické a genetické štúdie z posledných rokov poukazujú na odlišnú patogenézu rôznych foriem tejto neoplázie. Predpokladajú sa dva základné typy CaE, typ I a typ II [28,29,30]. S typom malignity endometria potom súvisí aj stupeň histologickej diferenciácie buniek, stupeň malignity a celková prognóza ochorenia [25,30,31] (tabuľka 1).
Tab. 1. Patogenetické formy karcinómu endometria [2]. ![Patogenetické formy karcinómu endometria [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/be259715c8a1ea04c102315b7cc37b3e.jpeg)
Typ I CaE sa vyskytuje u mladších žien, väčšinou v období perimenopauzy. Má nižší malígny potenciál, býva histologicky dobre diferencovaný, invázia do myometria je často minimálna a prienik do lymfatických priestorov je zriedkavejší. Vo všeobecnosti má dobrú prognózu, relatívne včas sa diagnostikuje a lieči. Súvisí s hyperestrogenizmom a v bunkách nachádzame estrogénové (ESR) a progesterónové (PGR) receptory [29]. Vzniká v HE [25], z atypickej HE [2]. Najčastejšou skorou genetickou poruchou je inaktivácia nádorového supresorového génu PTEN spôsobená mutáciou [32]. Typ I CaE reprezentuje endometrioidný (EC) histologický podtyp CaE [28].
Typ II CaE sa vyskytuje väčšinou u starších žien. Má vyšší malígny potenciál, býva histologicky menej diferencovaný, infiltrácia myometria je rýchlejšia a hlbšia a nádor má vyšší sklon k lymfogénnej propagácii [22]. Vo všeobecnosti má horšiu prognózu. V anamnéze nie sú dokázateľné žiadne endogénne rizikové faktory [33], nesúvisí s hyperestrogenizmom a nezisťujeme prítomnosť ESR a PGR [29]. Vzniká nezávisle od HE [25], obyčajne v prostredí atrofického endometria [2]. Najčastejšia skorá genetická porucha je v nádorovom supresorovom géne TP53 [29,34]. Typ II CaE reprezentuje serózny (SC) histologický podtyp CaE [28].
O III. možnej forme CaE s biologickými vlastnosťami a biologickým správaním niekde na rozmedzí medzi nádormi I. a II. typu uvažujú Sivridis et al [35]. Nesúvisí s hyperestrogenizmom. Vzniká v prostredí atrofie endometria.
IV. skupinu CaE s výskytom u žien s vrodenou dispozíciou k niektorým malignitám navrhli Bandera a Boyd [36]. Vzniká o 15 rokov skôr než je všeobecne udávaná pre ostatnú populáciu. Má pomerne dobrú prognózu.
Cieľ práce
Cieľom práce je imunohistochemická (IHC) identifikácia zmien expresie ES1R v epitelových bunkách endometria pri svetlobunkovom CaE.
Materiál a metódy
Do štúdie sme zaradili IHC vyšetrenie 20 archívnych bioptických vzoriek endometria (z Ústavu patologickej anatómie Lekárskej fakulty Univerzity Komenského v Bratislave, r. 1997–2007), získaných kyretom maternicovej dutiny alebo hysterektómiou. Išlo o formalínom fixované a do parafínu zaliate tkanivové vzorky. V 10 prípadoch išlo o nálezy fyziologického endometria v proliferačnej fáze cyklu (PE). Išlo o ženy vo veku 26–45 rokov. V ďalších 10 prípadoch išlo o nálezy svetlobunkového podtypu CaE (SvC) u žien 60–86-ročných. Vyšetrovali sme expresiu ES1R v jadrách epitelových buniek žliazok endometria monoklonovou králičou protilátkou (DakoCytomation, Glostrup, Denmark). Na vizualizovanie reakčného produktu sme použili nepriamu metódu s komplexom streptavidínu a biotínu s chrenovou peroxidázou (ABC-Px) a s 3,3’-diaminobenzidínom (DakoCytomation, Glostrup, Denmark) ako chromogénom [10,37]. Nálezy (reakcie protilátky/expresiu proteínu) sme hodnotili svetelným mikroskopom (Nikon Eclipse E400, Tokyo, Japonsko) semikvantitatívne ako: „–“ negatívne, „+/–“ nepravidelne slabo pozitívne (intenzita), „+“ pravidelne slabo pozitívne (intenzita), „++“ pravidelne stredne silne pozitívne (intenzita), „+++“ pravidelne silne pozitívne (intenzita). Za špecifickú reakciu sme považovali iba reakciu jadier buniek. Tkanivové rezy inkubované s obyčajným pufrom namiesto primárnej protilátky sme stanovili ako negatívnu kontrolu. Použité postupy zodpovedali príslušným národným a medzinárodným etickým štandardom (Helsinská deklarácia z r. 2002) [38].
Výsledky
Výsledky hodnotenia expresie ES1R sú zhrnuté v tabuľke 2. Expresia ES1R bola vysoká v PE (obrázok 1). V SvC (II. typ CaE – s agresívnym fenotypom) expresia ES1R nebola prítomná (obrázok 1) a korelovala s horším klinickým priebehom nádorovej choroby.
Tab. 2. Prehľad reakcií protilátky proti ES<sub>1</sub>R s jadrami epitelových buniek žliazok endometria. 
Obr. 1. Detekcia ES<sub>1</sub>R v PE (ľavá časť obrázku). Neprítomnosť expresie ES<sub>1</sub>R v SvC (pravá časť obrázku). Imunohistochemické vyšetrenie s protilátkou proti ES<sub>1</sub>R. ABC- Px, 100×. 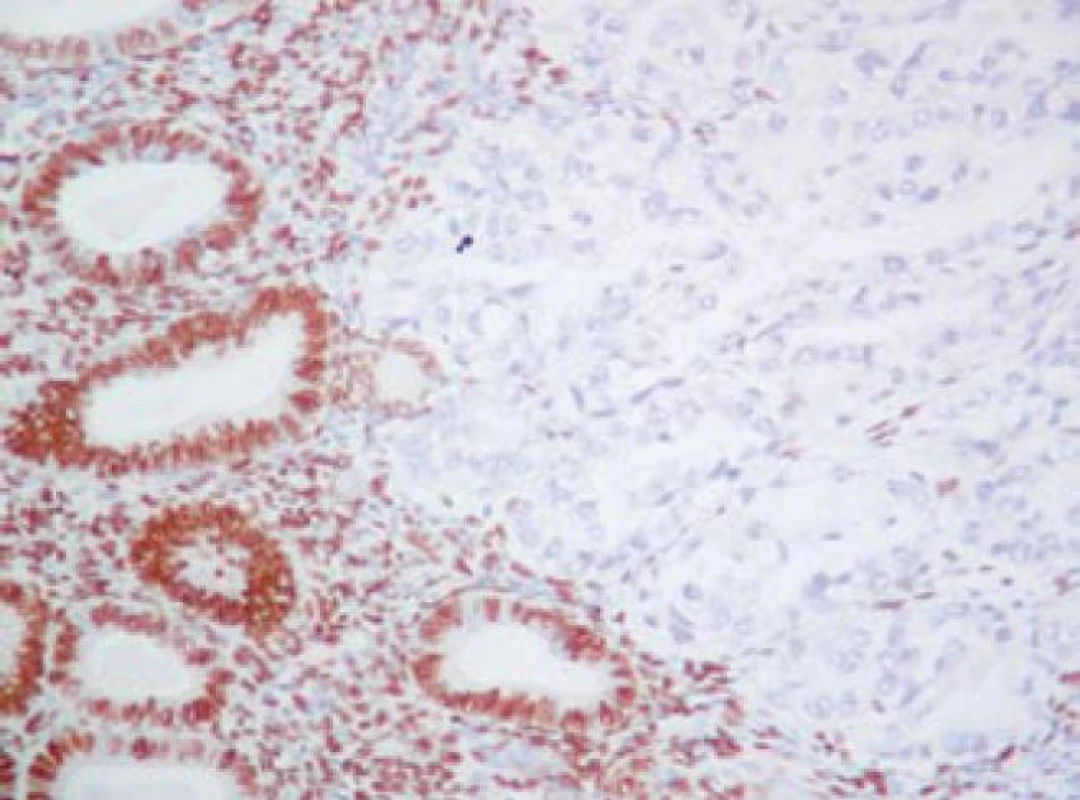
Diskusia
Naše výsledky ukazujú dobrú koreláciu expresie proteínu ES1R s histologickým podtypom aj typom CaE a sú v zhode s inými publikovanými prácami, ktoré hodnotili validitu tohto znaku.
ES1R, receptor 2 (β) pre estrogén (ES2R) a PGR hrajú dôležitú rolu vo fyziológii normálneho endometria a pri jeho malígnej premene [39]. Expresia ES1R, ES2R a PGR signifikantne klesá v normálnom endometriu od proliferačnej k neskorej sekrečnej fáze, hoci intenzita expresie ES2R je nižšia než ES1R [39]. Expresia ES1R postupne klesá od normálneho endometria k jeho tumorom a pri tumoroch klesá so stúpajúcim gradingom, od stupňa G1 k tumorom stupňa G3. Expresia ES2R sa však nemení [40]. Naše výsledky podporujú nálezy iných autorov [21,29], ktorí naznačujú, že EC často tvoria ESR a PGR, zatiaľ čo SC a SvC tieto receptory skoro nikdy nemajú. V SvC sme expresiu ES1R nezistili, zatiaľ čo v PE bola expresia ES1R vysoká.
Lax et al [21] sa domnievajú, že SC a SvC nezávisia od estrogénov a majú vysoký index Ki-67 (% jadier buniek obsahujúcich Ki-67). Na rozdiel od SC, vo SvC zriedkavejšie dochádza k výraznej expresii proteínu p53. Preto usudzujú, že patogenéza SvC je odlišná od patogenézy EC a SC.
Vo väčšine štúdií je prítomnosť a množstvo steroidových receptorov úmerné histologickej diferenciácii nádoru, FIGO (International Federation of Gynecology and Obstetrics, FIGO) štádiu a prežitiu žien s CaE [41,42], čo korešponduje s našim nálezom.
Záver
Expresia proteínu ES1R je dôležitým znakom prognózy CaE. Jeho hodnotenie pomocou IHC je preto dôležitým faktorom s implikáciou pre klinickú prax, s dopadom na liečbu žien s CaE. Tá, v prípade už rozvinutej malígnej nádorovej choroby, je mimoriadne náročná z hľadiska finančného, sociálneho aj spoločenského. PE tvorí ES1R, zatiaľ čo v SvC (II. typ CaE – s agresívnym fenotypom) nedochádza k expresii tohto receptora.
Poďakovanie
Táto práca bola realizovaná s podporou (finančným darom) Lions Club International LC Bamberg-Mischelsberg a LC Kremnica a čiastočne grantom UK/36/2007. Autori ďakujú za technickú spoluprácu laborantkám p. I. Uhnavej, p. V. Chmelíkovej a p. L. Donarovej. Prvý autor ďakuje za láskavú podporu Distriktnému Guvernérovi 2006–2007 Lions Club International District D-122 Česká republika a Slovenská republika p. dipl. Ing. Tiborovi Bučekovi.
MUDr. Vladimír Šišovský, Ph.D.1
prof. MUDr. Ľudovít Danihel, Ph.D.1
MUDr. Michal Palkovič, Ph.D.1
MUDr. Beata Bučeková1
doc. MUDr. Martin Redecha, Ph.D.2
doc. MUDr. Miroslav Korbeľ, CSc.2
MUDr. Zuzana Nižňanská, Ph.D.2
doc. RNDr. Vanda Repiská, Ph.D.3
MUDr. Alžbeta Molnárová4
MUDr. Ivica Bartošová5
1 Ústav patologickej anatómie, Lekárska fakulta, Univerzita Komenského v Bratislave
2 1. gynekologicko pôrodnícka klinika, Lekárska fakulta, Univerzita Komenského v Bratislave
3 Ústav lekárskej biológie, genetiky a klinickej genetiky, Lekárska fakulta, Univerzita Komenského v Bratislave
4 Oddelenie brachyterapie, Klinika radiačnej onkológie, Onkologický ústav sv. Alžbety, s. r. o., a SZU Bratislava 1
5 Interné oddelenie, Národný onkologický ústav, Bratislava
Zdroje
1. American Cancer Society. 2000 cancer statistics. CA Cancer J Clin 2000; 50(1): 1–64.
2. Ronnett BM, Zaino RJ, Ellenson LH et al. Endometrial Carcinoma. In: Kurman RJ. Blaustein`s Pathology of the Female Genital Tract. 5. ed. New York: Springer-Verlag 2002 : 501–559.
3. Jemal A, Murray T, Ward E et al. Cancer statistics, 2005. CA Cancer J Clin 2005; 55(1): 10–30. Erratum in: CA Cancer J Clin 2005; 55(4): 259.
4. Pleško I, Vlasák V, Obšitníková A et al. Incidencia zhubných nádorov v Slovenskej republike v roku 1990. Bratislava: Národný onkologický ústav, Aktual klin Onkol 1994.
5. Pleško I, Vlasák V, Štefaňáková D et al. Incidencia zhubných nádorov v Slovenskej republike 2000. Bratislava: Národný onkologický ústav, Ústav experimentálnej onkológie SAV, Národný onkologický register Slovenskej republiky 2003.
6. Redecha M, Nižňanská Z, Korbeľ M. Výskyt zhubných nádorov tela maternice na Slovensku v rokoch 1990–2000. Gynekol prax 2004; 2(4): 194–199.
7. Mutter GL, Ferenczy A. Anatomy and histology of the uterine corpus. In: Kurman RJ. Blaustein`s Pathology of the Female Genital Tract. 5. ed. New York: Springer-Verlag 2002 : 383–419.
8. Danihel Ľ, Porubský J. Prínos monoklonálnych protilátok v bioptickej diagnostike nádorov. Bratisl lek listy 1991; 92(9): 460–466.
9. Danihel Ľ, Babál P, Porubský J et al. Imunohistochemické markery v diagnostike nádorov maternice. Bratisl lek listy 1995; 96(7): 353–360.
10. Azumi N, Czernobilsky B. Immunohistochemistry. In: Kurman RJ. Blaustein`s Pathology of the Female Genital Tract. 5. ed. New York: Springer-Verlag 2002 : 1251–1276.
11. Šišovský V. Imunohistochemická analýza endometria za fyziologických a patologických stavov. Dizertačná práca. Bratislava: Univerzita Komenského 2005.
12. Budaj M, Bučeková B, (Šišovský V, Danihel Ľ – školitelia). Identifikácia markerov proliferačnej aktivity v karcinóme endometria. 46. fakultná konferencia ŠVOČ. Zborník prác, Bratislava: LF UK a Slovak Academic Press 10. máj 2007 : 22–25. (Práca ocenená diplomom dekana LF UK v Bratislave za prácu I. poradia, 1. miesto).
13. Budaj M, Bučeková B, (Šišovský V, Danihel Ľ, Repiská V – Mentors). Identification of proliferation markers in correlation with p53 gene mutation in endometrial carcinoma. Vědecká konference studentů českých a slovenských lékařských fakult. Program a abstrakta prednášek, Praha: 3. lékařská fakulta Univerzity Karlovy v Praze, 21.–22. listopad 2007.
14. Ondriaš F, Hrušovský A, Slugeň I et al. Mikroskopická diagnostika zmiešaných a mezenchýmových nádorov sliznice tela maternice. Bratisl lek listy 1990; 91 : 551–558.
15. Ondriaš F. Zu routinemässigen gynekopathologischen bioptischen Utersuchungen und diagnostischen Problemen im Gebiet von Bratislava. Ber Path 1991; 113 : 123–124.
16. Babál P, Slugen I, Daniš D et al. Sialic acid expression in normal and diseased human kidney. Acta Histochem 1996; 98(1): 71–77.
17. Sloboda J, Zaviačič M, Jakubovský J et al. Metastasizing adenocarcinoma of the female prostate (Skene‘s paraurethral glands). Histological and immunohistochemical prostate markers studies and first ultrastructural observation. Pathol Res Pract 1998; 194(2): 129–136.
18. Liang X, Lu B, Scott GK et al. Oxidant stress impaired DNA‑binding of estrogen receptor from human Brest cancer. Mol Cell Endocrinol 1998; 146(1–2): 151–161.
19. Henzl M. Patofyziologie ženských reprodukčních hormonů. In: Hulín I. Patofyziológia. 6. ed. Bratislava: Slovak Academic Press 2002 : 1087–1097.
20. Marquez DC, Pietras RJ. Membrane‑associated binding sites for estrogen contribute to growth regulation of human breast cancer cells. Oncogene 2001; 20(39): 5420.
21. Lax SF, Pizer ES, Ronnett BM et al. Clear cell carcinoma of the endometrium is characterized by a distinctive profile of p53, Ki-67, estrogen, and progesterone receptor expression. Hum Pathol 1998; 29 : 551–558.
22. Robboy SJ, Duggan MA, Kurman RJ. Gynecologic Pathology. In: Rubin E, Farber JL. Pathology. Philadelphia: J. B. Lippincott Company 1988 : 942–989.
23. Gusberg SB. Detection and prevention of uterine cancer. Cancer 1988; 62 : 1784–1786.
24. Redecha M, Korbeľ M, Sasko A. Histologické nálezy endometria pri krvácaní v klimaktériu a séniu. Prakt Gynek 1996; 3 : 61–64.
25. Silverberg SG, Kurman RJ, Nogales F et al. Epithelial Tumors and Related Lesions In: Tavassoli FA, Devilee P. WHO classification of Tumours, Pathology and Genetics, Tumours of the Breast and Female Genital Organs. Tumours of the Uterine Corpus. Lyon: IARC Press 2003 : 221–232.
26. Danihel Ľ, Horváth R, Breitenecker G et al. Súčasná klasifikácia a charakteristika nádorov endometria. Slov gynek por 2003; 10(Suppl 1): 14–17.
27. Danihel Ľ, Šišovský V, Palkovič M et al. Karcinóm endometria – histopatologická klasifikácia a charakteristika. Gynekol prax 2005; 3(1): 9–12.
28. Bokhman N. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15 : 10–17.
29. Lax SF. Molecular genetic pathways in various types of endometrial carcinoma: from a phenotypical to a molecular‑based classification. Virchows Arch 2004; 444(3): 213–223.
30. Liu FS. Molecular carcinogenesis of endometrial cancer. Taiwan J Obstet Gynecol 2007; 46(1): 6–32.
31. Redecha M, Nižňanská Z, Korbeľ M. Klinická charakteristika karcinómu endometria. Gynekol prax 2005; 3(1): 13–16.
32. Mutter GL, Lin MC, Fitzgerald JT et al. Altered PTEN expression as a diagnostic marker for the earliest endometrial precancers. J Natl Cancer Inst 2000; 92 : 924–930.
33. Anderson MC, Robboy SJ, Russell P et al. Endometrial carcinoma. In: Robboy SJ, Anderson MC, Russell P. Pathology of the Female Reproductive Tract. London: Churchill Livingstone 2002 : 331–359.
34. Deligdisch L, Cohen CJ. Histologic correlates and virulence implications of endometrial carcinoma associated with adenomatous hyperplasia. Cancer 1985; 56(6): 1452–1455.
35. Sivridis E, Fox H, Buckley CH. Endometrial carcinoma – two or three entities? Int J Gynecol Cancer 1988; 183–188.
36. Bandera CA, Boyd J. The molecular genetics of endometrial carcinoma. In: Aldaz CM et al. Etiology of breast and Gynecological Cancers. Progres in Clinical and Biological Research. New York: Willey-Liss 1977 : 185–203.
37. DakoCytomation 2004/05 Catalog. Denmark: Glostrup 2004.
38. Jakubovský J. Nekorektnosť vo vedeckom bádaní. In: Hulín I et al. Úvod do vedeckého bádania 1. Bratislava: Slovak Academic Press 2003 : 424–442.
39. Mylonas I, Jeschke U, Shabani N et al. Normal and malignant human endometrium express immunohistochemically estrogen receptor alpha (ER‑alpha), estrogen receptor beta (ER‑beta) and progesterone receptor (PR). Anticancer Res 2005; 25(3A): 1679–1686.
40. Saegusa M, Okayasu I. Changes in expression of estrogen receptors alpha and beta in relation to progesterone receptor and pS2 status in normal and malignant endometrium. Jpn J Cancer Res 2000; 91(5): 510–518.
41. McCarty KSJ, Banon TK, Fetter BF et al. Correlation of estrogen and progesterone receptors with histologic differentiation in endometrial adenocarcinoma. Am J Pathol 1979; 96 : 171–183.
42. Kadar N, Malfetano JH, Homesley HD. Steroid receptor concentrations in endometrial carcinoma: effect on survival in surgically staged patients. Gynecol Oncol 1993; 50 : 281–286.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopisePraktická gynekologie
Najčítanejšie tento týždeň
2009 Číslo 2- Ne každé mimoděložní těhotenství musí končit salpingektomií
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Mýty a fakta ohledně doporučení v těhotenství
- Gynekologické potíže pomáhá účinně zvládat benzydamin
-
Všetky články tohto čísla
- Identifikácia estrogénového alfa receptora v proliferačnom endometriu a vo svetlobunkovom karcinóme
- Forenzné aspekty asistovanej reprodukcie v legislatívnych podmienkach Českej a Slovenskej republiky
- Úvodní slovo
- Edukační kazuistika
- Peroperační prevence adhezí v gynekologii
- Adenocarcinoma in situ děložního hrdla – rozbor 10 případů
- Terapie karcinomu štítné žlázy pomocí radiojódu 131I, vliv na gonadální funkce a fertilitu
- Některé bioetické otázky asistované reprodukce – literární přehled (Štrasburská konvence, status lidského embrya)
- Těhotenské ztráty po metodách asistované reprodukce
- Intrahepatálna cholestáza gravidných a liečba kyselinou ursodeoxycholovou
- Praktická gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Intrahepatálna cholestáza gravidných a liečba kyselinou ursodeoxycholovou
- Těhotenské ztráty po metodách asistované reprodukce
- Terapie karcinomu štítné žlázy pomocí radiojódu 131I, vliv na gonadální funkce a fertilitu
- Peroperační prevence adhezí v gynekologii
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



