-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kalprotektin ve stolici
Faecal calprotectin
Calprotectin is a calcium-binding protein contained in neutrophils. Inflammatory damage of the intestinal mucosa causes an influx of neutrophils into the intestinal lumen, after which increased calprotectin levels can be measured in stools. Calprotectin in faeces is a good marker of inflammation and disease activity in inflammatory bowel disease, and is suitable for assessment of disease course, monitoring of treatment effect and probably predicting relapses. Normalization of faecal calprotectin seems to be a strong indicator of healing of the intestinal mucosa. Calprotectin is of some differential diagnostic value in patients with irritable bowel syndrome and it can make indications to colonoscopy more accurate in these patients.
Key words:
calprotectin, Crohn disease, inflammatory bowel disease, irritable bowel disease, ulcerative colitis.
Autoři: D. Kamenář; J. Špičák
Působiště autorů: Institut klinické a experimentální medicíny, Praha, Klinika hepatogastroenterologie, Přednosta: prof. MUDr. Julius Špičák, CSc.
Vyšlo v časopise: Prakt. Lék. 2011; 91(11): 665-669
Kategorie: Diagnostika
Souhrn
Kalprotektin je kalcium vázající protein obsažený v neutrofilech. Zánětlivé poškození střevní sliznice způsobí příliv neutrofilů do střevního lumen a ve stolici pak lze detekovat zvýšené hladiny kalprotektinu. Kalprotektin ve stolici je dobrým markerem zánětu a aktivity střevních zánětlivých onemocnění a je vhodný k hodnocení průběhu choroby, monitorování efektu léčby a pravděpodobně i k predikci relapsů těchto onemocnění. Normalizace fekálního kalprotektinu se zdá být přesvědčivým indikátorem hojení střevní sliznice. Kalprotektin má rovněž určitý diferenciálně diagnostický význam u pacientů se syndromem dráždivého tračníku, kde může zpřesnit indikaci ke koloskopickému vyšetření.
Klíčová slova:
Crohnova choroba, kalprotektin, ulcerózní kolitida, střevní zánětlivá onemocnění, syndrom dráždivého tračníku.Úvod
Kalprotektin je malý (36,5 kDa) protein detekovatelný v různých tělesných tekutinách a tkáních. Jedná se o kalcium vázající protein, který patří do rodiny proteinů S100. Je obsažen zejména v neutrofilních granulocytech (polymorfonukleárech) a v menší míře v monocytech a makrofázích. Má bakteriostatické a fungicidní vlastnosti a při infekci a/nebo zánětu dochází k mnohonásobnému vzestupu jeho plazmatických hladin (1). Je přítomen také ve stolici a hladina fekálního kalprotektinu je přibližně 6 krát vyšší než v plazmě (2). Zvýšené hladiny kalprotektinu se nachází ve stolici pacientů s různými akutním i chronickými střevními zánětlivými chorobami, lokalizovanými jak v tenkém, tak v tlustém střevě.
Granulocyty po uvolnění z kostní dřeně cirkulují volně v krvi. Několik dní pak setrvávají v různých periferních tkáních, než ukončí svůj živost z velké části právě v gastrointestinálním traktu (3), kde uvolňují množství antimikrobiálních substancí, mezi nimi kalprotektin. To vysvětluje několikanásobně vyšší koncentrace kalprotektinu ve stolici než v krvi. Předpokládá se, že kalprotektin plní důležitou biologickou funkci v regulaci střevní mikroflóry.
Každý granulocyt obsahuje kolem 20 pg kalprotektinu, který tak tvoří 5 % celkového množství proteinu a 60 % proteinu cytosolové frakce těchto buněk. To znamená množství kalprotektinu v granulocytech srovnatelná s množstvím hemoglobinu v erytrocytech.
Kalprotektin váže kalcium a zinek a má řadu biologických charakteristik. Jak již bylo uvedeno, vykazuje
- antimikrobiální aktivitu (4),
- inhibuje řadu metaloproteináz (5), a
- indukuje apoptózu u nádorových i nenádorových buněčných kultur (6).
Protein je uvolněn z granulocytů po jejich aktivaci a jeho koncentrace může vzrůst na mnohonásobek normálních hodnot jak v krvi – např. při aktivní revmatoidní artritidě (7) – tak ve stolici, např. při aktivním zánětlivém střevním onemocnění (8–10).
Poprvé popsali kalprotektin Fagerhol a kol. v roce 1980 (11). V roce 1992 vyvinuli Røseth a kol. první měření kalprotektinu ve stolici metodou ELISA. Od této doby byla metoda zdokonalena a široce validována. Používají se velice malá množství stolice (0,1 g), která se mixují s pufrovacím roztokem v 5 ml zkumavce (12). Výsledky velmi dobře korelují s 3 denní fekální exkrecí granulocytů značených radionuklidem india In111 (13).
V přítomnosti kalcia je kalprotektin velmi stabilní protein rezistentní k enzymatické degradaci. Jeho hladina ve vzorcích stolice se nemění ani po týdnu skladování při pokojové teplotě (9), takže vzorky k vyšetření mohou být do laboratoře odeslány i v rozmezí několika dní třeba běžnou poštou.
Novější metody vyjadřují koncentraci fekálního kalprotektinu v mikrogramech na gram. Hladina fekálního kalprotektinu u zdravých jedinců je obvykle nižší než 50 μg/g, zatímco u pacientů s aktivním zánětlivým střevním onemocněním (bez ohledu na lokalizaci v gastrointestinálním traktu) často přesahuje 500–1000 μg/g (9, 10, 14, 15). Naproti tomu pacienti s celiakií mají hladinu fekálního kalprotektinu srovnatelnou se zdravými jedinci (16).
Fekální kalprotektin a syndrom dráždivého tračníku
Přetrvávající bolesti břicha a změny defekačního stereotypu jsou častým důvodem návštěvy praktického lékaře. Nejčastější příčinou je syndrom dráždivého tračníku, který se vyskytuje u 10–20 % dospělé populace (17). Odhaduje se, že asi 40 % všech doporučení ke koloskopii je v rámci diagnostiky dráždivého tračníku (18). Toto onemocnění se může objevit v každém věku, nejčastěji se však plně rozvíjí mezi 20. až 40. rokem věku, s mírně vyšším výskytem u žen.
Diagnóza dráždivého tračníku je podobně jako diagnózy dalších funkčních poruch založena na charakteristických symptomech (19) (tab. 1), ve většině případů se ovšem nevyhneme vyloučení organického onemocnění podrobným vyšetřením.
Tab. 1. Řím III kritéria pro diagnózu syndromu dráždivého tračníku 
Symptomy dráždivého tračníku mohou být snadno zaměněny s
- neléčenou celiakií,
- intolerancí laktózy,
- ulcerózní kolitidou, a
- Crohnovou nemocí.
Vzhledem k vysokému výskytu syndromu dráždivého tračníku jsou celkové náklady na vyšetření, tj. laboratorní testy a zobrazovací metody včetně endoskopického vyšetření značně vysoké. Kalkulace z USA a Velké Británie ukazují, že tyto náklady tvoří až 0,5 % z celkového rozpočtu zdravotnictví, nehledě na nepříménáklady, jako je absence v práci a nemocenské dávky (20).
Jednoduchý a spolehlivý test k odlišení organického od funkčního postižení neexistuje, ale vyšetření fekálního kalprotektinu může být zejména v diferenciální diagnostice proti zánětlivému střevnímu onemocnění velmi přínosné.
Výsledky dosavadních studií jsou nekonzistentní, pokud jde o schopnost fekálního kalprotektinu rozlišit mezi organickými a funkčními poruchami gastrointestinálního traktu (tab. 2) (14, 15, 21, 22, 23). Způsobují to rozdíly v populacích pacientů, které se liší
- věkem,
- symptomatologií,
- prevalencí onemocnění, a
- známou diagnózou.
Tab. 2. Kalprotektin ve stolici – organické vs. funkční postižení 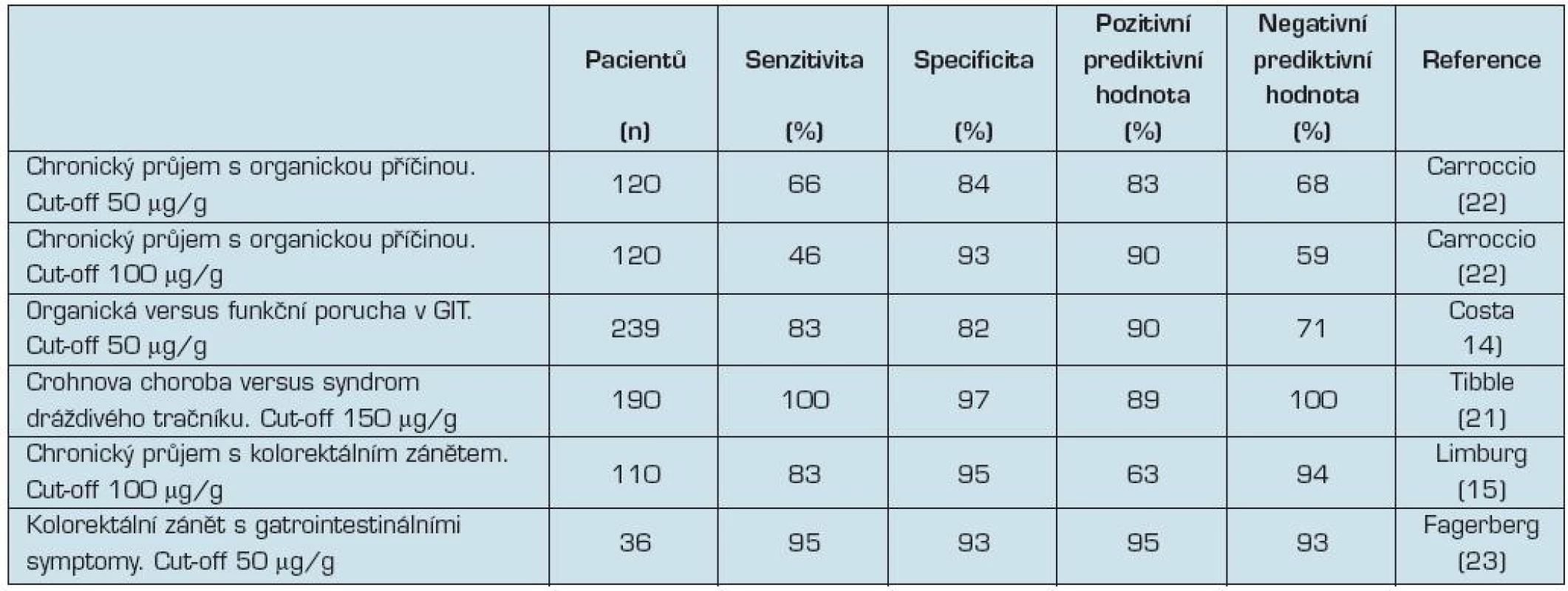
Například v jedné ze studií s nízkou senzitivitou fekálního kalprotektinu, byla u jedné třetiny pacientů s organickou příčinou průjmů a normální hodnotou kalprotektinu ve stolici základní diagnózou celiakie (22).
Z meta-analýzy 13 studií (zahrnující 1 595 pacientů) vyplývá, že fekální kalprotektin vykazuje v odlišení zánětlivého střevního onemocnění od funkční poruchy senzitivitu 89–98 % a specificitu 81–91 % (24). Důležitá je samozřejmě volba mezní (cut-off) hodnoty. Někteří autoři navrhují jako optimální hodnotu pro rozlišení mezi syndromem dráždivého tračníku a zánětlivým střevním onemocněním 150 μg/g (21). Při absenci alarmujících příznaků (jako je krvácení nebo úbytek hmotnosti) doporučují autoři finské studie ještě před indikací koloskopie ověřit mírně zvýšené hodnoty kalprotektinu (50–200 μg/g) novým testem (25).
Vzhledem k téměř stoprocentní negativní prediktivní hodnotě testu v případě zánětlivého střevního onemocnění, může správné použití výsledku testu snížit počet zbytečných koloskopií. Pacienti s příznaky kompatibilními se syndromem dráždivého tračníku a normálními hodnotami kalprotektinu ve stolici mají s velkou pravděpodobností normální koloskopický nález (26).
Fekální kalprotektin a zánětlivá střevní onemocnění
Laboratorní markery jsou u zánětlivých střevních onemocnění řadu let v popředí zájmu. Studuje se jejich význam pro
- diagnostiku,
- hodnocení aktivity onemocnění,
- rizika komplikací,
- predikci relapsu, a
- sledování účinnosti léčby.
Zavedení biologické terapie akcentovalo zájem o markery zánětu, vzhledem k jejich potenciálu usnadnit selekci pacientů s dobrou odpovědí na tuto léčbu.
Ze všech krevních laboratorních markerů byl nejvíce studován C-reaktivní protein (CRP). CRP je objektivní ukazatel zánětu, jeho stanovení je rychlé, poměrně jednoduché a univerzálně dostupné. V klinických studiích s biologickou léčbou jsou zvýšené hladiny CRP spojeny s lepší odpovědí na účinnou látku a normální hladiny CRP naopak s vyšší mírou odpovědi na placebo. Nevýhodou CRP je v případě zánětu nulová orgánová specificita. Kromě toho CRP méně koreluje s aktivitou onemocnění u pacientů s ulcerózní kolitidou ve srovnání s Crohnovou nemocí.
Další laboratorní markery, včetně
- sedimentace erytrocytů (ESR),
- počtu leukocytů a krevních destiček,
- hladiny albuminu, a
-
α1-kyselého
glykoproteinu (orosomukoidu),
byly u nespecifických střevních zánětů studovány buď méně systematicky, nebo se ukázaly být méně užitečné než CRP.
Fekální markery jsou u zánětlivých střevních onemocnění citlivější než krevní testy a specificky detekují zánět střevní sliznice. Sedimentace i C-reaktivní protein (CRP) se mohou často pohybovat v normálních hodnotách i přes výraznou zánětlivou aktivitu (8, 10, 21, 25, 27). Jak u ulcerózní kolitidy, tak u Crohnovy choroby jsou s použitím fekálního kalprotektinu dobré výsledky.
Není vzácností, když pacienti se zánětlivým střevním onemocněním trpí funkčními obtížemi typu syndromu dráždivého tračníku, které může být velmi obtížné nebo nemožné odlišit od příznaků způsobených aktivním střevním zánětem. Nejen v těchto situacích může být stanovení fekálního kalprotektinu je užitečné pro monitorování zánětlivé aktivity a odpovědi na léčbu.
Sledování aktivity onemocnění
Posouzení zánětlivé aktivity je v klinické praxi založeno na kombinaci klinických příznaků a laboratorních vyšetření, jako krevní obraz, C-reaktivní protein (CRP) a sedimentace erytrocytů (tab. 3). V klinických studiích i v praxi se používají kombinované indexy aktivity (tab. 4).
Tab. 3. Aktivita ulcerozní kolitidy (Truelove & Witts) 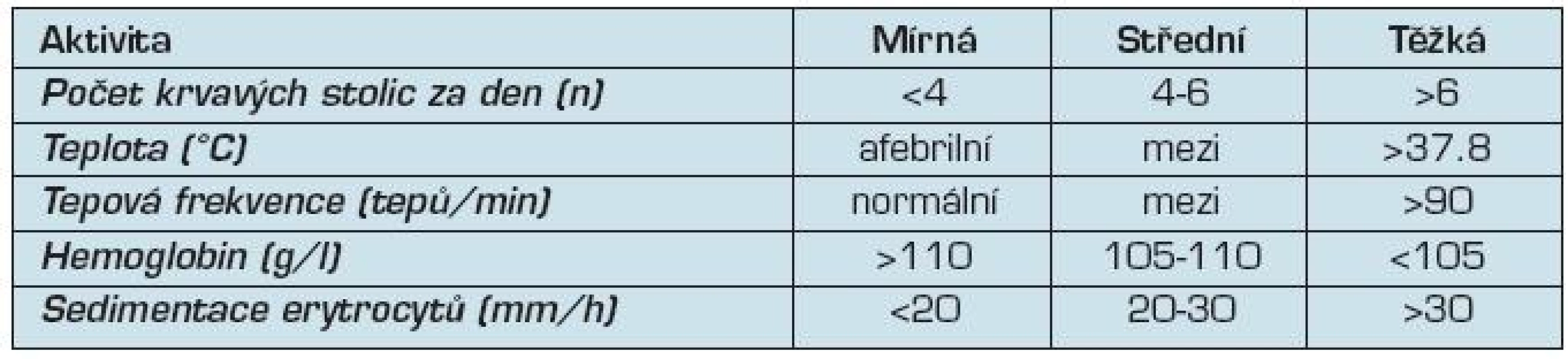
Tab. 4. Index aktivity Crohnovy nemoci (Crohn Disease Activity Index, CDAI) 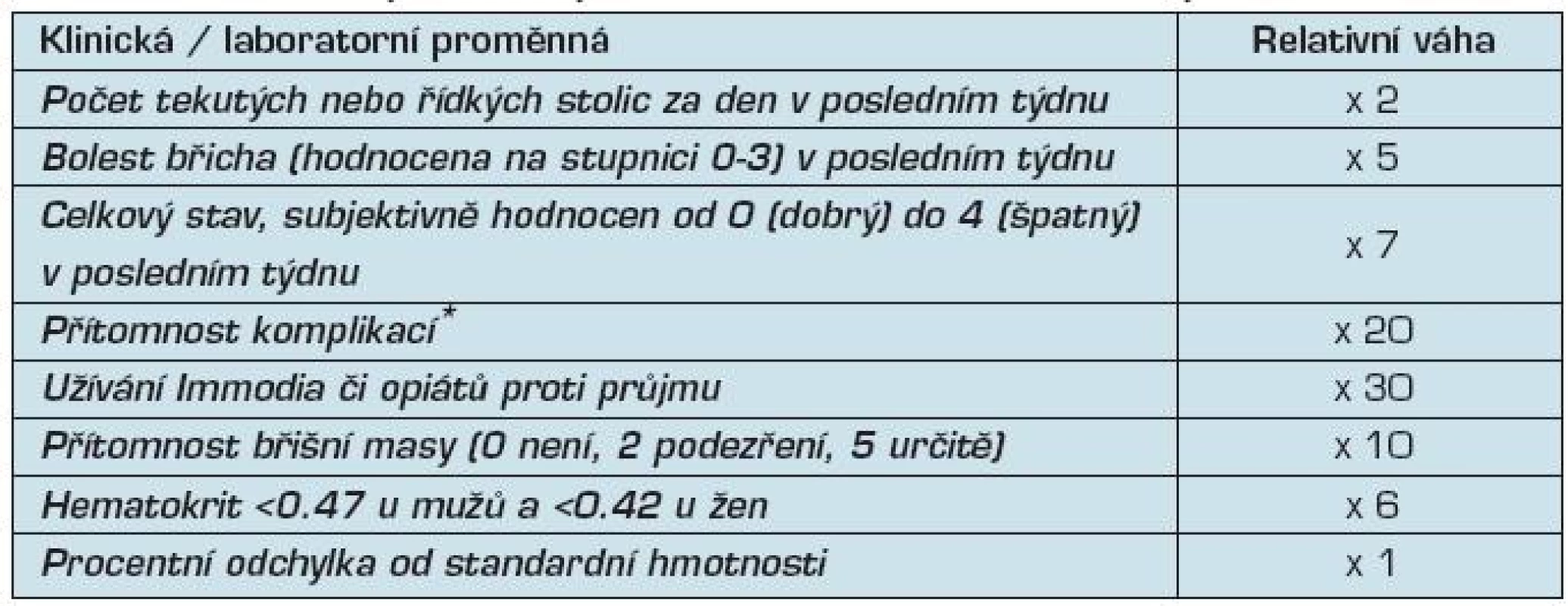
Legenda * Po bodu je přidáno za každou skupinu komplikací: • bolest kloubů (artralgie) nebo diagnóza. artritidy; • iridocyklitida, uveitida; • erythema nodosum, pyoderma gangrenosum, aftózní vředy; • anální fissury, píštěle, abscesy; • jiné píštěle; • horečka během minulého týdne ; Remise Crohnovy nemoci je definována jako pokles CDAI pod 150. Těžká Crohnova nemoc je definována jako hodnota CDAI >450. Odpověď na léčbu Crohnovy nemoci je obvykle definována jako pokles CDAI o 70 a více bodů.
Přesné vyhodnocení zánětlivé aktivity umožňuje koloskopie. Ačkoliv je současným standardem k posouzení střevního zánětu a slizničního hojení, je to vyšetření invazivní, pro pacienta nepříjemné, nákladné a časově náročné, a proto jej nelze libovolně opakovat. Nadějnou odpovědí na potřebu jednoduchého a spolehlivého neinvazivního markeru střevního zánětu se zdá být fekální kalprotektin.
Sipponen a kol. hodnotili klinický význam fekálního kalprotektinu v posuzování aktivity Crohnovy choroby srovnáním s endoskopickou aktivitou, klinickým indexem aktivity Crohnovy nemoci (CDAI) a hodnotou CRP u 77 pacientů (25). Fekální kalprotektin byl v jejich studii významně citlivějším markerem než CDAI nebo CRP, a to zejména u kolonického a ileokolonického postižení. U 14-ti pacientů z jejich souboru s izolovaným ileálním postižením byla senzitivita fekálního kalprotektinu nižší.
Røseth a kol. ukázali signifikantní korelaci mezi hladinou fekálního kalprotektinu a endoskopickým a histologickým nálezem u 62 pacientů s ulcerózní kolitidou (28). Autoři zároveň naznačují, že hladinu fekálního kalprotektinu určuje spíše stupeň zánětu než rozsah kolitidy.
Predikce relapsu
Nespecifická zánětlivá střevní onemocnění mají variabilní klinický průběh a ulcerózní kolitida i Crohnova nemoc jsou charakteristické střídáním období remise a relapsu. Vzplanutí nemoci jsou nepředvídatelná. Určitá aktivita zánětu ovšem předchází samotné klinické symptomatologii a její detekce by dovolila predikovat klinické relapsy a zabránit jim časnější a/nebo agresivnější léčbou.
Možnostmi predikce relapsu Crohnovy nemoci pomocí panelu laboratorních markerů se zabývala řada studií již v dřívějších letech (29, 30). V jedné recentnější studii bylo prospektivně sledováno 71 pacientů s medikamentózně navozenou remisí Crohnovy choroby, u kterých byla každých 6 týdnů monitorována řada laboratorních markerů (31). Celkem 38 pacientů relabovalo v mediánu 31 týdnů. Pouze 2 laboratorní testy byly prediktivní pro relaps v následujících 6 týdnech: CRP (>20 mg/l) a sedimentace (>15 mm).
Údajů o významu laboratorních markerů pro odhad průběhu ulcerózní kolitidy je méně, například ve studii z Oxfordu frekvence stolic >8/den nebo 3–8 stolic/den spolu s elevací CRP (>45 mg/l) predikovala s 85 % pravděpodobností nutnost kolektomie (32).
V posledních letech se hromadí důkazy o významu fekálního kalprotektinu. Tibble a kol. hodnotili hladiny fekálního kalprotektinu u 43 pacientů s Crohnovou nemocí a 37 pacientů s ulcerózní kolitidou v klinické remisi (33). U 85 % pacientů s hodnotou fekálního kalprotektinu nad 250 μg/g došlo během 12-ti měsíců k relapsu, zatímco pacienti s hodnotou nižší než 250 μg/g relabovali v tomto období pouze ve 12 %. Při této cut-off hodnotě autoři vyvozují senzitivitu a specificitu fekálního kalprotektinu pro predikci relapsu u všech pacientů se střevním zánětlivým onemocněním 90 %, respektive 83 %.
Costa a kol. zahrnuli do své studie 38 pacientů s Crohnovou chorobou a 41 pacientů s ulcerózní kolitidou v remisi (34). Hladina kalprotektinu ve stolici větší než 150 μg/g se ukázala být prediktivní pro relaps onemocnění v následujícím roce. Ačkoliv senzitivita byla vysoká jak u Crohnovy nemoci (87 %), tak ulcerózní kolitidy (89%), specificita byla mnohem nižší u Crohnovy choroby (43 % vs. 82 %). Naproti tomu CRP ani sedimentace erytrocytů neměly v této studii žádnou prediktivní hodnotu.
D’ Incà a kol. pozorovali 97 pacientů s ulcerózní kolitidou a 65 pacientů s Crohnovou nemocí v klinické remisi (35). Cut-off hodnotu stanovili na 130 μg/g. Prokázali signifikantní korelaci mezi pozitivním kalprotektinem ve stolici a pravděpodobností relapsu u ulcerózní kolitidy. Takovou korelaci vykazovali u Crohnovy nemoci pouze pacienti s postižením colon. V souladu s uvedenými studiemi je vyšší riziko relapsu u pacientů, kteří jsou sice v klinické a endoskopické remisi, ale mají „low grade“ zánětlivou celulizaci ve střevní sliznici histologicky (36).
Hodnocení léčby
Management zánětlivých střevních onemocnění, zejména Crohnovy choroby, se posunul od krátkodobé kontroly symptomů k dlouhodobému ovlivnění průběhu choroby a jejích komplikací. Rostoucí množství důkazů svědčí o tom, že vhodným parametrem pro zhodnocení efektu terapie je tzv. slizniční hojení. Pokud se sliznice hojí, jsou komplikace onemocnění nepravděpodobné a počet hospitalizací a nutnost chirurgických zákroků se snižují (37, 38). Slizniční hojení se stává nejdůležitějším parametrem užívaným k posouzení účinnosti léčby, protože zatím nejlépe reflektuje skutečnou modifikaci přirozeného průběhu nemoci.
Slizniční hojení lze přímo hodnotit pouze endoskopicky. Ideální neinvazivní marker slizničního hojení neexistuje, některé práce s kalprotektinem jsou však povzbudivé.
Røseth a kol. vyšetřili 45 pacientů se zánětlivým střevním onemocněním a normální hladinou kalprotektinu ve stolici (<50 μg/g). Z nich 44 pacientů mělo endoskopicky normální sliznici a 38 pacientů kompletně normální histologický nález. Pouze 7 pacientů mělo mikroskopicky mírnou infiltraci leukocyty. Autoři tak shledávají normalizaci hodnot fekálního kalprotektinu u pacientů se zánětlivým střevním onemocněním jako silný indikátor slizničního hojení (39).
Sipponen a kol. hodnotili vztah endoskopického nálezu a hladiny fekálního kalprotektinu u pacientů s těžkou aktivitou Crohnovy choroby z jejich dřívějšího souboru (25) v průběhu biologické léčby (40). Zatímco u všech responderů (ve smyslu normalizace nebo zlepšení endoskopického nálezu) došlo k významnému poklesu fekálního kalprotektinu, u non-responderů byly změny hladiny fekálního kalprotektinu nesignifikantní. Studie je sice limitována malým počtem pacientů, autoři však rovněž hodnotí fekální kalprotektin jako slibný marker slizničního hojení. Jistě bude zapotřebí dalších rozsáhlejších studií před aplikací těchto závěrů do klinické praxe.
Závěr
Kalprotektin ve stolici je objektivním měřítkem aktivity střevních zánětlivých onemocnění. Jeho stěžejní význam bude patrně v predikci relapsů a monitorování účinnosti léčby u těchto pacientů. Syndrom dráždivého tračníku je chronické onemocnění, se kterým se ve svých ordinacích setkávají praktičtí lékaři i specialisté velmi často. Tato skupina pacientů má normální hodnoty kalprotektinu ve stolici. Fekální kalprotektin zde má diferenciálně diagnostický význam a může zpřesnit indikaci k endoskopickému vyšetření.
MUDr. David Kamenář
Klinika hepatogastroenterologie IKEM
Vídeňská 1958/9
140 21 Praha 4
E-mail: david.kamenar@ikem.cz
Zdroje
1. Bunn, S.K., Bisset, W.M., Main, M.J., Golden, B.E. Fecal calprotectin as a measure of disease activity in childhood inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2001, 32, p. 171-177.
2. Fagerberg, U.L., Lööf, L., Merzoug, R.D. et al. Fecal calprotectin levels in healthy children studied with an improved assay. J. Pediatr. Gastroenterol. Nutr. 2003, 37, p. 468-472.
3. Fliedner, S.H., Cronkite, E.P., Robertson, J.S. Granulopoesis, senescence and random loss of neutrophilic granulocytes in human beings. Blood 1964, 24, p. 404-414.
4. Steinbakk, M., Naess-Andresen, C.F., Lingaas, E. et al. Antimicrobial action of a calcium binding leukocyte L-1 protein, calprotectin. Lancet 1990, 336, p. 763-765.
5. Isaksen, B., Fagerhol, M.K. Calprotectin inhibits matrix metalloproteinases by sequestration of zinc. Mol. Pathol. 2001, 54, p. 289-292.
6. Yui, S., Mikami, M., Yamazaki, M. Induction of apoptotic cell death in mouse lymphoma and human leukemia cell lines by a calcium-binding complex, calprotectin, derived from inflammatory peritoneal exudate cells. J. Leukoc. Biol. 1995, 58, p. 650-658.
7. Berntzen, H.B., Olmez, U., Fagerhol, M.K. et al. The leukocyte protein L1 in plasma and synovial fluid from patients with rheumatoid arthritis and osteoarthritis. Scand. J. Rheumatol. 1991, 20, p. 74-82.
8. Røseth, A.G., Fagerhol, M.K., Aadland, E. et al. Assessment of the neutrophil dominating protein calprotectin in feces. Scand. J. Gastroenterol. 1992, 27, p. 793-798.
9. Bunn, S.K., Bisset, W.M., Main, M.J.C. et al. Faecal calprotectin: Validation as a noninvasive measure of bowel inflammation in childhood inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2001, 33, p. 14-22.
10. Fagerberg, U.L., Lööf, L., Lindholm, J. et al. Fecal calprotectin: A quantitative marker of colonic inflammation in children with inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2007, 45, p. 414-420.
11. Fagerhol, M.K., Dale, I., Andersson, T. Release and quantification of a leucocyte derived protein (L1). Scand. J. Haematol. 1980, 24, p. 393-398.
12. Tøn, H., Brandsnes, O., Dale, S. et al. Improved assay for fecal calprotectin. Clin. Chem. Acta 2000, 292, p. 41-54.
13. Røseth, A.G., Schmidt, P.N., Fagerhol, M.K. Correlation between faecal excretion of indium-111-labeled granulocytes and calprotectin, a granulocyte marker protein in patients with inflammatory bowel disease. Scand. J. Gastroenterol. 1999, 34, p. 50-54.
14. Costa, F., Mumolo, M.G., Bellini, M. et al. Role of faecal calprotectin as non-invasive marker of intestinal inflammation. Dig. Liver. Dis. 2003, 35, p. 642-647.
15. Limburg, P.J., Ahlquist, D.A., Sandborn, W.J. et al. Fecal calprotectin levels predict colorectal inflammation among patients with chronic diarrhea referred for colonoscopy. Am. J. Gastroenterol. 2000, 95, p. 2831-2837.
16. Montalto, M., Santoro, L., Curgliano, V. et al. Faecal calprotectin concentrations in untreated celiac patients. Scand. J. Gastroenterol. 2007, 42, p. 957-961.
17. Drossman, D.A., Camilleri, M., Mayer, E.A. AGA technical review on irritable bowel syndrome. Gastroenterology 2002, 123, p. 2108-2131.
18. Suleiman, S., Sonnenberg, A. Cost-effectiveness of endoscopy in irritable bowel syndrome. Arch. Intern. Med. 2001, 161, p. 369-375.
19. Longstreth, G.F., Thompson, W.G., Chey, W.D. et al. Functional bowel disorders. Gastroenterology 2006, 130, p. 1480-1491.
20. Camilleri, M., Williams, D.E. Economic burden of irritable bowel syndrome. Proposed strategies to control expenditures. Pharmacoeconomics 2000, 17, p. 331-338.
21. Tibble, J., Teahon, K., Thjodleifsson, B. et al. A simple method for assessing intestinal inflammation in Crohn’s disease. Gut 2000, 47, p. 506-513.
22. Carroccio, A., Iacono, G., Cottone, M. et al. Diagnostic accuracy of fecal calprotectin assay in distinguishing organic causes of chronic diarrhea from irritable bowel syndrome: a prospective study in adults and children. Clin. Chem. 2003, 49, p. 861-867.
23. Fagerberg, U.L., Lööf, L., Myrdal, U. et al. Colorectal inflammation is well predicted by fecal calprotectin in children with gastrointestinal symptoms. J. Pediatr. Gastroenterol. Nutr. 2005, 40, p. 450-455.
24. von Roon, A.C., Karamountzos, L., Purkayastha, S. et al. Diagnostic precision of fecal calprotectin for inflammatory bowel disease and colorectal malignancy. Am. J. Gastroenterol. 2007, 102, p. 803-813.
25. Sipponen, T., Savilathi, E., Kolho, K.L. et al. Crohn’s disease activity assessed by fecal calprotectin and lactoferrin: Correlation with Crohn’s disease activity index and endoscopic findings. Inflamm. Bowel Dis. 2007, 13, p. 1-7.
26. Jahnsen, J., Røseth, A.G., Aadland, E. Measurement of calprotectin in faeces. Tidsskr. Nor. Laegeforen. 2009, 129(8), p. 743-745.
27. Vermeeire, S., van Assche, G., Rutgeerts, P. Laboratory markers in IBD; useful, magic, or unnecessary toys? Gut 2006, 55, p. 426-431.
28. Røseth, A.G., Aadland, E., Jahnsen, J. et al. Assessment of disease activity in ulcerative colitis by faecal calprotectin, a novel granulocyte marker protein. Digestion 1997, 58, p. 176-180.
29. Brignola, C., Campieri, M., Bazzocchi, G. et al. A laboratory index for predicting relapse in asymptomatic patients with Crohn’s disease. Gastroenterology 1986, 91(6), p. 1490-1494.
30. Boirivant, M., Leoni, M., Tariciotti, D. et al. The clinical significance of serum C reactive protein levels in Crohn’s disease. Results of a prospective longitudinal study. J. Clin. Gastroenterol. 1988, 10(4), p. 401-405.
31. Consigny, Y., Modigliani, R., Colombel, J.F. et al. Biological markers of short term relapse in Crohn’s disease (CD). Inflamm. Bowel Dis. 2006, 12(7), p. 551-557.
32. Travis, S.P., Farrant, J.M., Ricketts, C. et al. Predicting outcome in severe ulcerative colitis. Gut 1996, 38(6), p. 905-910.
33. Tibble, J.A., Sigthorsson, G., Bridger, S. et al. Surrogate markers of intestinal inflammation are predictive of relapse in patients with inflammatory bowel disease. Gastroenterology 2000, 119, p. 15-22.
34. Costa, F., Mumolo, M.G., Ceccarelli, L. et al. Calprotectin is a stronger predictive marker of relapse in ulcerative colitis than in Crohn’s disease. Gut 2005, 54(3), p. 364-368.
35. D’Inca, R., Dal Pont, E., Di Leo, V. et al. Can calprotectin predict relapse in inflammatory bowel disease? Am. J. Gastroenterol. 2008, 103(8), p. 2007-2014.
36. Bitton, A., Peppercorn, M.A., Antonioli, D.A. Clinical, biological and histological parameters as predictors of relapse in ulcerative colitis. Gastroenterology 2001, 120, p. 13-20.
37. Rutgeerts, P., Diamond, R.H., Bala, M. et al. Scheduled maintenance treatment with infliximab is superior to episodic treatment for the healing of mucosal ulceration associated with Crohn’s disease. Gastrointest. Endosc. 2006, 63, p. 433-442.
38. Frøslie, K.F., Jahnsen, J., Moum, B.A. et al. Mucosal healing in inflammatory bowel disease: results from a Norwegian population-based cohort. Gastroenterology 2007, 133, p. 412-422.
39. Røseth, A.G., Aadland, E., Grzyb, K. Normalization of faecal calprotectin: a predictor of mucosal healing in patients with inflammatory bowel disease. Scand. J. Gastroenterol. 2004, 39, p. 1017-1020.
Štítky
Praktické lekárstvo pre deti a dorast Praktické lekárstvo pre dospelých
Článok vyšiel v časopisePraktický lékař
Najčítanejšie tento týždeň
2011 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Naděje budí časná diagnostika Parkinsonovy choroby založená na pachu kůže
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
XI. Sociální rozhodování - Probiotika z pohledu praktického lékaře – klinické indikace pro podání probiotik, výsledky dotazníkového šetření mezi praktickými lékaři
- Aktinická keratóza: poznatky o biologickom správaní a klinicko-patologických aspektoch ochorenia z pohľadu bioptika
- Koordinovanost ucelené rehabilitace
- Rizikové a škodlivé pití alkoholu u mladých dospělých: demografické a sociální souvislosti
- Aktuálne odporúčania pre prevenciu a liečbu fibrilácie predsiení a jej tromboembolických komplikácií
- Kalprotektin ve stolici
- Diagnostika pľúcnej tromboembólie – úskalia CT angiografie
- Je získávání výsledků technologiemi POCT v ordinaci praktického lékaře měřením? A je vůbec potřebné? Diabetes mellitus jako příklad
- Lékaři, kteří přispěli ke vzniku nejslavnějšího díla Boženy Němcové
- Miniportréty slavných českých lékařů Profesor Václav Tošovský – dětský chirurg a ortopéd
- Slavnostní akt na Pražském hradě
- Profesor MUDr. Jan Černý, CSc.
- Seznam lékařů oceněných 28. října na Pražském hradě v letech 1993–2011
- Ocenění nejlepších lékařských publikací za rok 2010
- Profesor Ivan Raška zvolen členem Evropské molekulárně biologické organizace
- Meningokok stále ohrožuje životy
- Zpráva o průběhu kongresu LYMPHO 2011
- Proč má být robotická chirurgie nadstandard?
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Kalprotektin ve stolici
- Probiotika z pohledu praktického lékaře – klinické indikace pro podání probiotik, výsledky dotazníkového šetření mezi praktickými lékaři
- Diagnostika pľúcnej tromboembólie – úskalia CT angiografie
- Aktinická keratóza: poznatky o biologickom správaní a klinicko-patologických aspektoch ochorenia z pohľadu bioptika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



