-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Plicní segmentektomie pro nádor
Pulmonary Segmentectomy for Tumour
Background:
An analysis of outcome data of pulmonary segmentectomy focused on local efficacy in primary non small cell lung cancer and true or seeming lung metastasis.Patients and methods:
Miscellaneous series of twenty patients treated with classical open procedure involving individuals with primary or metachronous non small cell lung cancer, solitary pulmonary metastasis of extrapulmonary cancer and/or benign pulmonary lesions, lung metastasis mimicing. Thirteen patients after segmentectomy because of malignancy are separated into a group of 7 cases with NSCLC up to 20 mm in diameter, and a group of 6 persons with solitary pulmonary opacity up to 38 mm treated previously surgically for extrapulmonary cancer. Both without enlargement of hilar and/or mediastinal lymphatics proven on preoperative CT imaging. Third part of the group collects benign pulmonary lesions: chondrohamartoma, pneumonitis and pulmonary infarct. Persons involved through a ten years period are followed up at 3(4)-months intervals.Results:
No perioperative and thirty day mortality was registered. Six cases of distant recurrence were recorded, three in NSCLC and three in extrapulmonary cancer patients. Five patients died within the follow-up period, three of them through the general progression of the oncological disease. Two deaths were non-cancer related. One Rl disease was discovered in a patient with primary lung adenocarcinoma. No local recurrence was recorded in both cancer series with median age of 63 yrs (range 45–79 yrs) and median duration of follow up 35 months.Conclusion:
Lung segmentectomy seems to accomplish local control of early stage non small cell lung cancer and pulmonary metastasis of extrapulmonary cancer in selected patients.Key words:
extrapulmonary cancer – lung metastasis – non small cell lung cancer – pulmonary segmentectomy
Autori: T. Horváth 1; S. Špelda 2; I. Kocáková 2; H. Bartoňková 3; M. Číhalová 4; M. Moulis 4; B. Garajová 1; E. Straževská 5; J. Vomela 1
Pôsobisko autorov: Chirurgická klinika FN Bohunice, Lékařská fakulta Masarykovy univerzity Brno přednosta: prof. MUDr. Zdeněk Kala, CSc. 1; Masarykův onkologický ústav, Klinika Komplexní onkologické péče přednosta: prof. MUDr. Rostislav Vyzula, CSc. 2; Masarykův onkologický ústav, Oddělení radiodiagnostiky, přednostka: prim. MUDr. Helena Bartoňková 3; Ústav patologické anatomie FN Bohunice, Lékařská fakulta Masarykovy univerzity Brno přednosta: prof. MUDr. Jirka Mačák, CSc. 4; Klinika anesteziologie resuscitace a intenzivní medicíny, LF MU Brno přednosta: prof. MUDr. Pavel Ševčík, CSc. 5
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 5, s. 238-247.
Kategória: Monotematický speciál - Původní práce
Súhrn
Cíl:
Analýza výsledků plicní segmentektomie zaměřená na lokální účinnost u primární plicní rakoviny a skutečné nebo zdánlivé plicní metastázy.Pacienti a metody:
Pestrá skupina dvaceti pacientů léčená klasickou otevřenou procedurou zahrnující jednotlivce s primárním nebo metachronním nemalobuněčným plicním karcinomem (NSCLC), solitární plicní metastázou mimoplicní rakoviny anebo benigními plicními ložisky napodobujících svým vzhledem metastázu. Třináct pacientů po segmentektomii pro malignitu je rozčleněných na dvě části. Jednu část představuje 7 případů NSCLC až do průměru 20 mm, druhou 6 osob se solitární plicní opacitou až do 38 mm v průměru, léčených předtím chirurgicky pro extrapulmonální nádor. Obojí bez zvětšení hilových a mediastinálních lymfatických uzlin prokázaného na předoperační výpočetní tomografii hrudníku.Třetí část skupiny tvoří osoby s benigními plicními nálezy: chondrohamartom, pneumonitida, plicní infarkt. Zahrnuté osoby byly operovány v desetiletém období a sledovány v 3(4)měsíčních intervalech.Výsledky:
Ani v perioperačním ani 30denním pooperačním období nezemřel žádný pacient. Zaznamenali jsme 6 případů vzdálené recidivy, třikrát u NSCLC pacientů a třikrát u pacientů mimoplicní rakovinou. Pět pacientů zemřelo v průběhu sledování, tři z nich na generalizaci onkologického onemocnění. Dvě úmrtí s rakovinou nesouvisela. Jednou byla pozorována R1 nemoc u pacienta s primárním plicním adenokarcinomem. Nepozorovali jsme žádnou lokální recidivu ani v jedné ze dvou onkologických skupin se středním věkem 63 let (rozsah 45–79 let) a střední délkou sledování 35 měsíců.Závěr:
Zdá se, že u vybraných pacientů lze plicní segmentektomií dosáhnout lokální kontrolu časného NSCLC i do plic metastazujících extrapulmonálních nádorů.Klíčová slova:
nemalobuněčný plicní karcinom – mimoplicní rakovina – plicní metastáza – plicní segmentektomieÚVOD
V posledním desetiletí se vynořil zájem o sublobární anatomické plicní resekce. Měnil se k nim vztah. To pramenilo jednak z vývoje poznání a z něj plynoucího akcentu na časnou diagnostiku, dále z toho jak v ní fungují moderní zobrazovací metody i onkologie a jednak částečně souviselo s úspěšným zjišťováním výskytu plicní rakoviny v rizikových populacích [1]. Tento proud si razil cestu společně se zájmem o kvalitu života pacientů po resekcích plic s hledáním úsporného a efektivního modelu ekonomiky zdravotní péče, jehož zavedení bychom si mohli přát.
Meze klasické teorie
Chirurgická resekce zůstává jedinou kurativní léčbou nemalobuněčné plicní rakoviny (NSCLC). Základním pravidlem operační léčby je kombinace anatomické resekce a radikální stejnostranné disekce lymfatik. Tím je dosaženo kompletní resekce podle Směrnice Evropské společnosti hradních chirurgů [2]. Stěžejní myšlenka lobektomie, zlatého standardu chirurgie rakoviny plic [3–5] má stále zanícené zastánce a pozoruhodnou podpora v dobře organizovaném táboře konzervativismu, doposud soustřeďujícím četné ostřílené chirurgy. Na druhou stranu nálezy generovány pokrokem zobrazovacích metod nastolují dosud neřešená zadání a s nimi otázku jak věci řešit, když jsou nálezy malé anebo velmi malé. Tyto podporují vzrůstající tábor přesvědčených zastánců segmentektomie [6–8].
Pohled na tendence
Pokrok pneumochirurgické praxe částečně závisí na vývoji pneumoonkologického diagnostického procesu a na pokroku zobrazovacích metod. Rozlišujme reformismus od revolucionismu. Reformismus dbá na pokračování a urychlení trendu časné detekce a léčby plicních malignit přispívajíc medicíně založené na důkazech daty o výsledcích sublobárních anatomických resekcí spojených se systematickou lymfadenektomií. Zatímco revolucionismus, představuje kvalitativně odlišný koncept se snahou léčit plicní rakovinu ve stadiu T0 – tedy dříve, než vznikne [9–11]. Ještě stále zápasí s mnohostrannou složitostí premaligní problematiky, v níž hraje oficiální klíčovou roli otázka „nadměrné“ léčby, overtreatmentu. Postrádajíc více pochopení i podpory přežívá pouze ve svém uzavřeném mikrokosmu.
Kořeny rozhodnutí
Rozmach časné diagnostiky plicní rakoviny, jenž nastal začátkem devadesátých let, vede část chirurgů k přijetí koncepce časné léčby, která vzkvétala koncem stejné dekády a dominovala konferenci ve Varese organizované L. Dominionim a G. Straussem [12]. V té době průkopníci již nabízeli podněty k plodným zamyšlením [13, 6] o jejichž čistotu dbali konzervativci tvrdými výpady. Klasici měli technické detaily postupů již dávno vybroušené [14].
Segmentektomie se postupně stále zřetelněji jevila jako přípustné řešení časného stadia onemocnění nemalobuněčnou plicní rakovinou [15] i solitárních plicních metastáz mimoplicních nádorů [16]. Deklarovanou individuální výhodou byl její funkční přínos, ale její filozofie měla již od začátku širší kontext: pilovala diagnostické i onkochirurgické myšlení, usměrňovala operativu k delikátnímu zacházení s tkání. Akcentovala jemnost pneumochirurgických technik. Globálně signalizovala obrat léčebné strategie k časným stadiím nemoci, prozatím nesmělý.
Pokračujme vlastními zkušenostmi:
MATERIÁL A METODA
Vybraní pacienti, zaregistrovaní v letech 1999–2008, byli léčeni chirurgicky plicní segmentektomií z anterolaterální torakotomie. Tato skupina pestrého složení se dělí na dvě podskupiny: první z nich je formována z osob postižených primárním T1N0M0 nemalobuněčným plicním karcinomem do 20 milimetrů v průměru bez zvětšených hilových a mediastinálních uzlin na předoperačním CT vyšetření. Druhou podskupinu představují pacienti se solitární plicní opacitou až do průměru 30 milimetrů (výjimečně větší), léčeni předtím chirurgicky pro některý z mimoplicních nádorů, například kolorektální, renální anebo mammární karcinom, či maligní melanom, též bez CT průkazu patologie mízních uzliny v plicním hilu anebo mezihrudí. Tato skupina se dělí na tři části: První pozůstává z pacientů s metachronním NSCLC (jehož per-operační průkaz znamená obrat k hranici 20 mm v maximálním rozměru), druhá s metastázou extrapulmonálního nádoru do plic a třetí tvoří nemocní se suspektní plicní malignitou dešifrovanou ex post postoperačně histopatologicky jako benigní. Každý pacient byl poučen a podepsal informovaný souhlas.
Předoperační určení tumoru a postižení mízních uzlin
Počítačová tomografie (CT) plic a mezihrudí; případně břicha, retroperitoena a malé pánve, pozitronová emisní tomografie, autofluorescenční (SAFE) bronchoskopie s klešťovou anebo kartáčkovou biopsií na histologické anebo cytologické vyšetření a CT vedenou transtorakální biopsií v případě potřeby.
Předoperační vyšetření
Jsou obstarány jak kompletní interní předoperační (a příslušná fakultativní vyšetření v případě potřeby) tak předoperační pneumologické vyšetření se spirometrií a lege artis onkologické stanovení rozsahu onemocnění.
Perioperační péče
Zvyklým způsobem posuzování v komisi specialistů a osobní onkochirurgickou instruktáží ad hoc při ambulantní anebo konziliární předoperační kompletaci dat.
Příjem na nemocniční lůžko den před operací, následně pak příprava na operaci, operace, intenzivní anebo resuscitační péče, standardní oddělení a předání do ambulantní péče.
Potřebné zabezpečení peroperační histologie a postoperační imunohistochemie ve zkušených rukách.
Chirurgická technika
Po identifikaci a izolaci příslušného segmentálního bronchu a segmentální arterie při kolabované plíci je plicní parenchym insuflován a rozvinut. Segmentální bronchus je poté (jemně) zaskřípnutý. Plíce je znovu desuflována. Manévr vede ke kolapsu tkáně segmentů, které mají být ušetřeny, pomáhá k odhadnutí polohy intersegmentální plochy a k upřesnění uložení tumoru. Tahem za periferní pahýl bronchu je umožněna tupá preparace intersegmentální plochy centrálně. Dále pak šetrná preparace segmentální(ch) vény (vén) za pečlivého ošetřování okolních struktur [13, 5]. Následuje interlobární, hilová a lalokově specifická mediastinální [2] lymfadenektomie s pečlivým sběrem a značením.
Kolaps plicní tkáně není pokaždé ideální. Správné rozhodnutí se pro segmentektomii vyžaduje kromě peroperační histologie též jistou dávku chirurgického citu a odvahy. S tímto přístupem a starostlivou lymfadenektomií je možné výjimečně uvažovat i segmentektomii menších T2N0M0 tumorů s respektováním a potvrzením onkologické bezpečnosti takového počínání peroperačním histologickým vyšetřením.
Sběr dat a rozvrh dispenzární péče
Všechny podstatné předoperační, peroperační, pooperační a dispenzární údaje jsou pečlivě sbírány, tříděny, ukládány, sumarizovány a komentovány (Tab. 1–6).
Pacienti jsou sledováni klinicky a laboratorně monitorováním příslušných hladin sérových nádorových znaků (TM) v tříměsíčních intervalech první 3 roky a dále v odstupech čtyřměsíčních. Po propuštění z nemocnice přicházejí zpravidla ke klinické kontrole zajeden týden, poté za 3 a 6 týdnů. Všechny operované osoby jsou jednou ročně podrobeny kompletnímu biochemickému a hematologickému rozboru krve, chemickému vyšetření moči a vyšetření močového sedimentu. Dispenzární paraklinická vyšetření představují výpočetní tomografie (CT) hrudníku, v případě potřeby i CT břicha a retroperitonea, autofluorescenční (SAFE) bronchoskopie, ultrazvukové vyšetření jater a scintigrafie kostry (111Tc).
Další zobrazovací metody například magnetická rezonance mozku, celotělová pozitronová tomografie (PET), anebo PET/CT, octreotidový s scan jsou indikovány fakultativně.
ZKRATKY
adj – adjuvantní
ADL – plicní adenokarcinom
CHT – chemoterapie
cRT – kurativní radioterapie
C61 – karcinom prostaty
Dg – diagnóza
DgC – kód diagnózy
DRD – diagnóza vzdálené recidivy (kód)
DR1 – časový interval vzdálení recidivy po plicní operaci (v měsících)
DS – diagnostická chirurgie
EPC datum – datum chirurgického zákroku pro mimoplicní malignitu
EPC dg – extrapulmonální plicní diagnóza
EPC-PC interval – mimoplicní a plicní chirurgie v měsících
F – žena
N-P dispenzární péče
L – levý
LekselK – Lekselův gama nůž
LR – lokální recidiva
m – měsíc
M – muž
N – mízní uzlina
NSCLC – nemalobuněčný plicní karcinom
PD – progressive disease
PC datum – datum chirurgického zákroku na plicích
PC typ – typ plicní proceduru
Pt – pacient
Pts – pacienti
R – pravý
RT – radioterapie
Rl – mikroskopická reziduální nemoc
SE – segmentektomie (např. SE1R segmentektomie pravého horního segmentu pravého horního laloku)
SQL – dlaždicobuněčný karcinom plic
Td – průměr tumoru (milimetry)
Věk PC – věk v letech v čase plicní operace
VÝSLEDKY
Populace pacientů
V letech 1999–2008 bylo z onkologické indikace u dvaceti osob provedeno celkem jednadvacet plicních segmentektomií. Bylo to u dvanácti žen, medián věku 62 let (rozpětí 49–79 let) a u osmi mužů, medián věku rovněž 62 let s rozpětím 45–77 let (Tab. 1).
Tab. 1. Obecný přehled Tab. 1. General overview 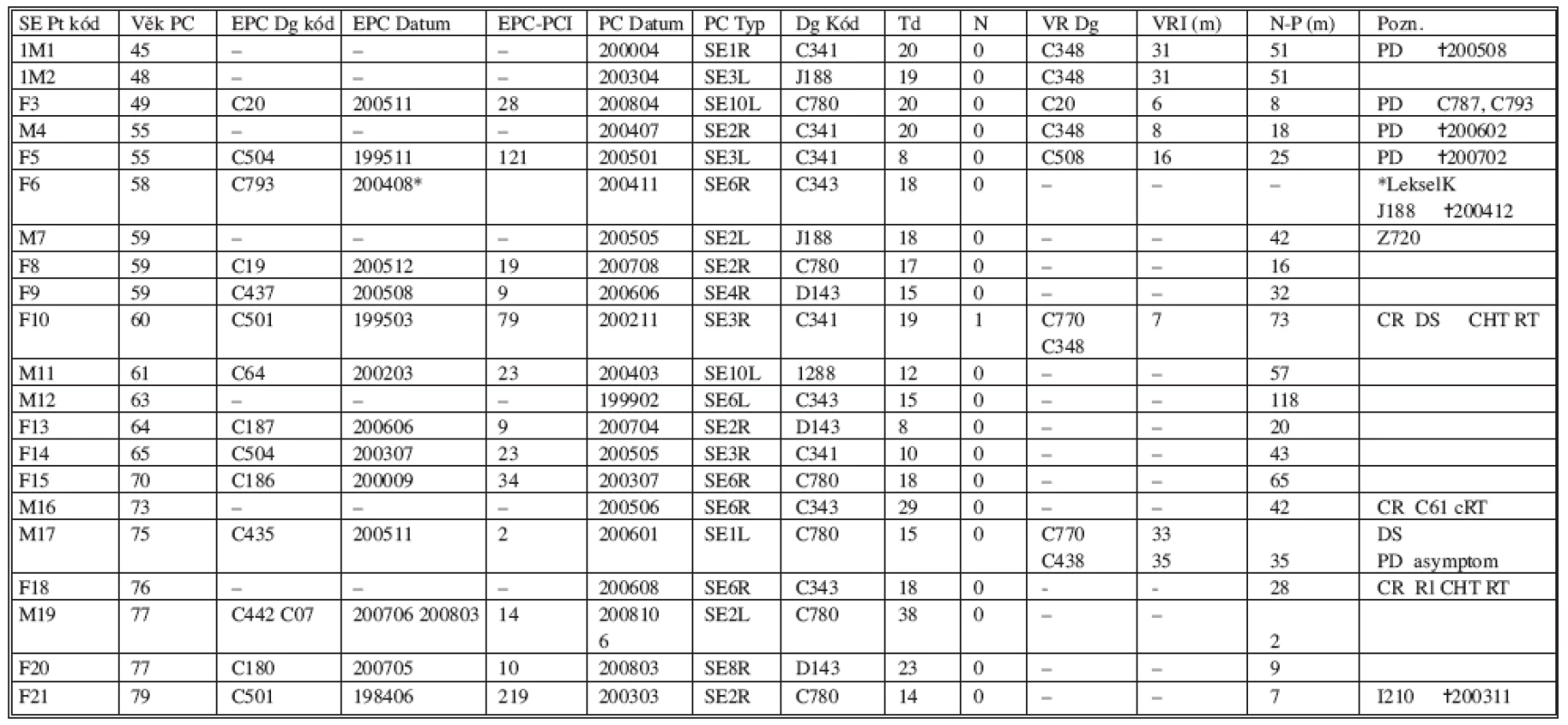
SOUHRN: 21 SE (13dx + 8sin) u 20 pts (12F + 8M)12 žen, medián věk 62 let (rozpětí 49–79 let) 8 mužů medián věk 62 let (rozpětí 45–77 let) BENIGNÍ 6 pts (3M + 3F) MALIGNÍ 15 pts (9F + 6M). PLICNÍ PRIMUM 9 pts (4M + 5F). METASTÁZA 6 pts (5F + 1M). Registrace 10 let (199901–200812). ÚMRTÍ 5 pts (3F + 2M), 3 pts PD 2 NSCLC; 1 karcinom prsu, 2 úmrtí z nemaligní příčiny. Plicní malignita byla shledána u 15 pacientů, z čehož nemalobuněčná plicní rakovina (NSCLC) byla nalezena v 9 případech a solitární metastáza mimoplicní malignity u 6 jedinců. Patnáct pacientů s malignitou reprezentuje šest mužů, střední věk 68 let (rozpětí 45–77 let) a devět žen, střední věk 60 let (rozpětí 49–79 let). Z devíti NSCLC bylo pět nádorů primárních a čtyři metachronní duplicity. Tři ze šesti metastáz představoval kolorektální karcinom, po jedné pak rakovina mléčné žlázy, maligní melanom a dlaždicobuněčný karcinom meati acustici (Tab. 2). Histologický nález byl v šesti případech překvapivě benigní (Tab. 3).
Tab. 2. Maligní plicní léze Tab. 2. Malignant lung lesions 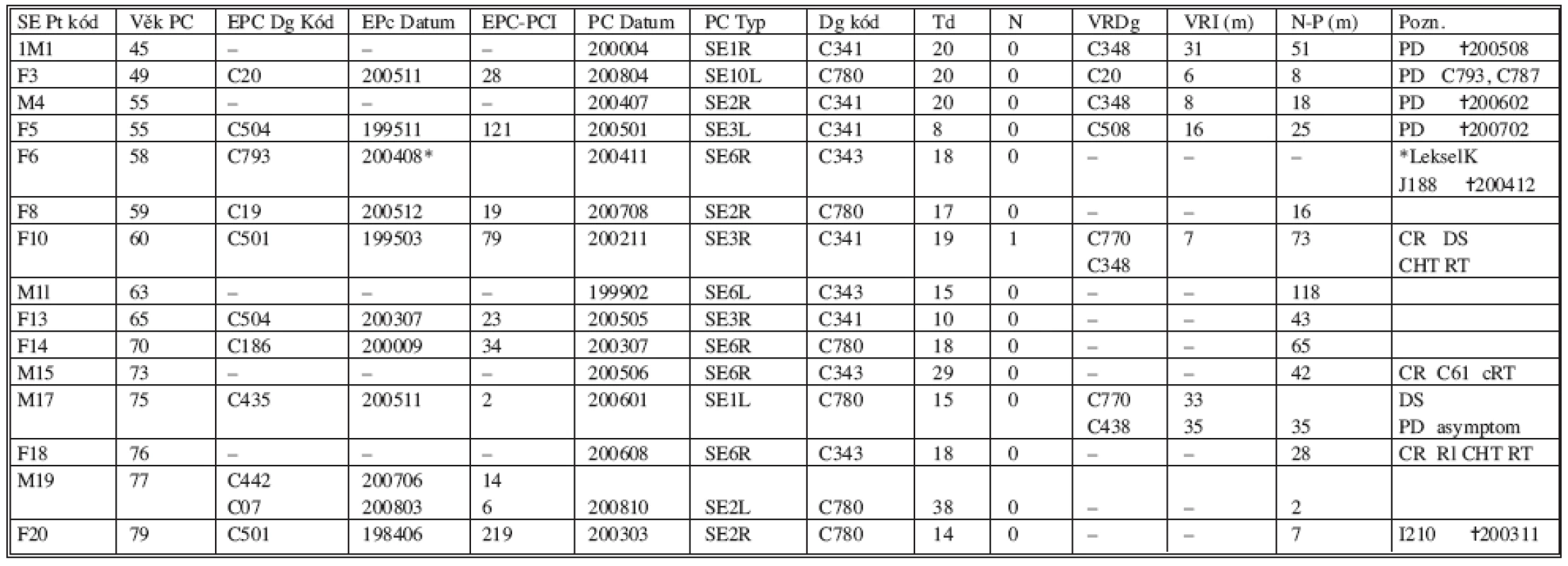
SOUHRN: 15 SE (6M + 9 F) 6 mužů, medián věku 68 let (rozpětí 45–77 let); 9 žen, medián věku 60 let (rozpětí 49–79 let) PRIMÁRNÍ PLICNÍ KARCINOM: 9 pts (5 pts první; 4 pts metachronní); METASTÁZA 6 pts – 3 karcinomy kolorekta, 1 maligní melanom, 1 rakovina prsu, a 1 spinocelulární karcinom meatus acusticus. Tab. 3. Benigní plicní leze Tab. 3. Benign lung lesions 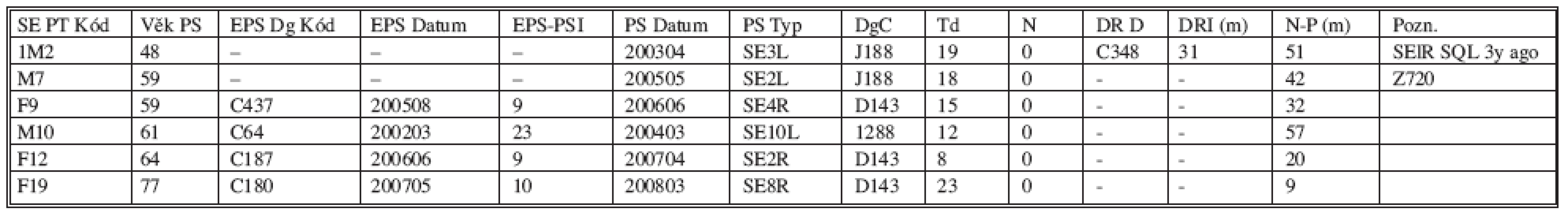
SOUHRN: BENIGNÍ PLICNÍ LEZE 6 pts (3 chondrohamartom, 2 pneumonitis, 1 plicní infarkt), 4 pts ANAM OPER PRO XTRAPULMONÁLNÍ NÁDOR (2 nádory colon, 1 renální karcinom, 1 maligní melanom), 1 pneumonitis byla diagnostikována u pacienta s SQL v osobní anamnéze a segmentektomií kontralaterální plíce před 3 lety, šestá benigní leze představuje inflamatorní tumor u těžkého kuřáka Pět pacientů s rakovinou zemřelo. Tři úmrtí byla způsobena progresí základního onemocnění s generalizací (vše NSCLC), dvě další úmrtí nebyly podmíněny nádorem. U další pacientky bylo 6 měsíců po plicní segmentektomii pro solitární metastázu karcinomu rekta diagnostikováno vícečetné metastazování do jater a mozku. Je po radioterapii a chemoterapii v paliativní onkologické péči. Její nemoc progreduje. Jeden starší muž s PET/CT prokázanou progresí maligního melanomu generalizujícího do měkkých tkání trupu a uzlin retroperitonea (35 měsíců po plicní segmentektomii) je v příznivém celkovém stavu asymptomatický. Ostatních osm pacientů je v dobrém celkovém stavu ve stadiu kompletní remise. Mezi nimi jeden muž dva roky po kurativní radioterapii karcinomu prostaty odhaleném dispenzární péčí druhý rok po plicní segmentektomii a jedna žena 28 měsíců po segmentektomii apicalis caudalis vpravo a 26 měsíců po kurativní radioterapii cílené na reziduální parenchym dolního laloku pro mikroskopickou reziduální nemoc primárního plicního adenokarcinomu v resekční linii z definitivní pooperační histologie (Tab. 2).
Bylo detekováno celkem šest benigních plicních lézí. Z toho čtyři u pacientů v jejichž předchorobí figurovala operace pro extrapulmonální rakovinu (dvakrát kolorektální karcinom, jednou maligní melanom a jednou adenokarcinom ledviny). Závěry histologických vyšetření resekovaných segmentů: třikrát chondrohamartom (dvakrát u pacientů s rakovinou kolorekta a jednou pacientky po operaci pro maligní melanom); u čtvrtého pacienta z této skupiny, muže 2 roky po nefrektomii pro renální adenokarcinom, diagnostikoval patolog plicní infarkt. Pátý nemocný, náruživý kuřák, podstoupil tři roky před levostrannou plicní segmentektomií (SE3L) s histologický diagnostikovanou pneumonitidou, pravostrannou segmentektomii (SEIR) pro dlaždicobuněčný plicní karcinom. U šestého pacienta (nyní bývalý kuřák) z této skupiny byla s segmentektomované tkáni nalezeno ložisko pneumonitidy (Tab. 3).
Vyloučíme-li všechny pacienty benigním plicním nálezem a dvě nemocné z nichž jedna zemřela 42. den po plicní operaci na oboustrannou bronchopneumonii – 4 měsíce po intervenci Lekselovým gama nožem pro solitární tumor mozku s dodatečně prokázaným plicním primem NSCLC v šestém segmentu dolního laloku vlevo – a pacientku s mikroskopickou reziduální nemocí po resekci apicalis caudalis vpravo po (kurativní) léčbě zářením (Tab. 4) zbývá celkem 13 osob dispenzarizovaných po plicní segmentektomii pro malignitu. Jedná se o šest mužů, medián věku 68 let (rozpětí 45–77 let) sedm žen, střední věk 60 let, (rozpětí 49–79 let) v tomto složení diagnóz: primární nemalobuněčná rakovina plic u sedmi osob, z toho třikrát první NSCLC nádor a čtyřikrát metachronní NSCLC duplicita. Metastáza extrapulmonální rakoviny v šesti případech, a to: třikrát kolektální karcinom, jednou maligní melanom, jednou karcinom mammy, jednou dlaždicobuněčný karcinom meatus acustici (Tab. 5).
Tab. 4. Vyloučené případy Tab. 4. Excluded/censored subjects 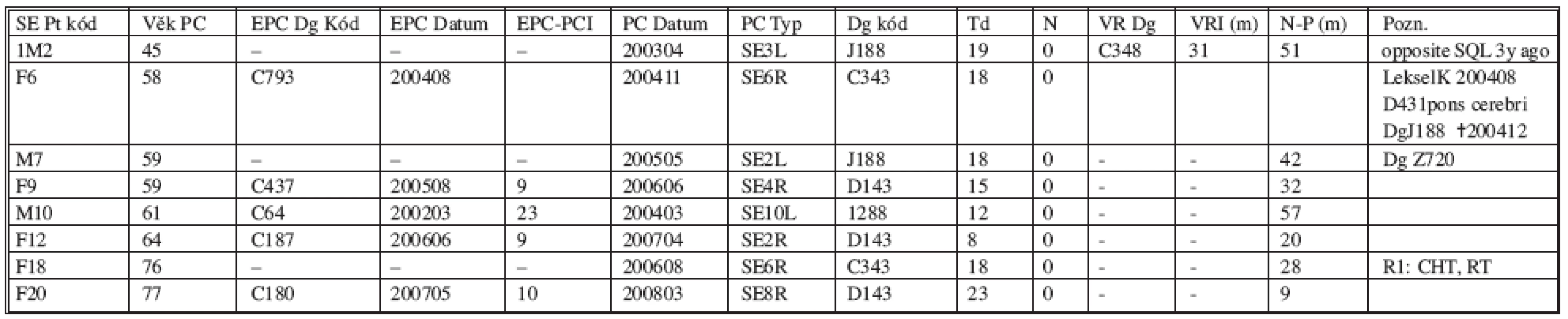
SOUHRN: Dohromady 8 případů: BENIGNÍ 6 pts; MALIGNÍ 2 pts (kód pt F6 and F18) s plicní malignitou – 1 úmrtí na pneumonii 42. den po operaci; u dalšího nalezena Rl nemoc Tab. 5. Pacienti monitorovaní po segmentektomii pro nádor. Přehled Tab. 5. Patients’ follow-up after segmentectomy for a tumor. Overview 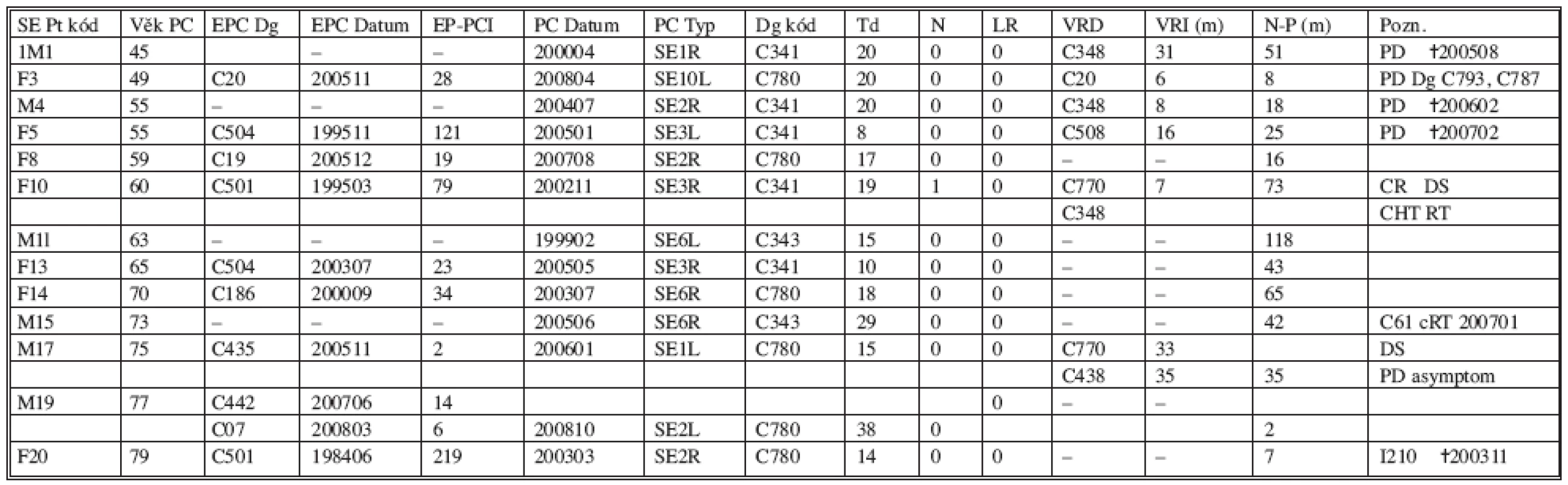
SOUHRN: 13 pts (6 mužů, medián věku 68 let, (rozpětí 45–77 let); 7 žen, medián věku 60 let (rozpětí 49–79 let). Rozdělení diagnóz: PRIMÁRNÍ PLICNÍ KARCINOM 7 pts (u 3 pts první primární u 4 pts metachronní) METASTÁZA u 6 pts – 3 pts kolorektální karcinom, 1 pt maligní melanom, 1 rakovina prsu, 1 spinocelulární karcinom meatus acusticus Chirurgické výsledky
Žádné perioperačnímu úmrtí ani 30denní mortalita nebyly zaznamenány. Chirurgický případ s těžkou komplikací představuje 58letá pacientka, nekuřačka, segmentektomovaná tři měsíce po intervenci Lekselovým gama nožem pro tumor v pons cerebri. Nepodařilo se u ní dosáhnout úplného rozvinutí operované plíce, znevýhodněné chronickou obstrukční bronchopulmonální nemocí v terénu po překonaném oboustranném zápalu plic, byť chirurgická plicní intervence (při negativní bronchoskopii i cytologii) s diagnostickou komponentou následovala téměř čtvrt roku po radiační intervenci neurochirurgické.
Relaps těžké oboustranné bronchopneumonie vedl k úmrtí nemocné 42. den po segmentektomii, s histologicky diagnostikovaným NSCLC.
Nepříjemná onkologická komplikace – mikroskopická reziduální nemoc primárního plicního adenokarcinomu se objevila u pacientky po segmentektomii šestého segmentu pravého dolního plicního laloku při histologickém vyšetření, naneštěstí až pooperačním. Byla indikována kurativní pooperační radioterapie. Pacientka je nyní 28 měsíců po operaci a 26 měsíců po ukončení RT v dobrém celkovém stavu bez známek místní anebo vzdálené recidivy onemocnění.
Malé postintervenční komplikace v podobě epizod benigní srdeční arytmie, přechodné pooperační dysfonie, přetrvávajících omalgií, torakálních posttorakotomických dysestezií, seromu v ráně a dysestezií po katetrizaci epidurálního prostoru, hypodynamie GIT a močové retence se nevymykají našemu dlouhodobému průměru kolísajícímu kolem 30 %. Nakonec uvádíme potěšitelný fakt, že během dispenzárního sledování s mediánem trvání 35 měsíců (rozsah 2–118 měsíců) jsme nezachytili žádnou lokální recidivu (Tab. 6).
Tab. 6. Lokální nález souhrnné údaje Tab. 6. Local findings. Summarized data 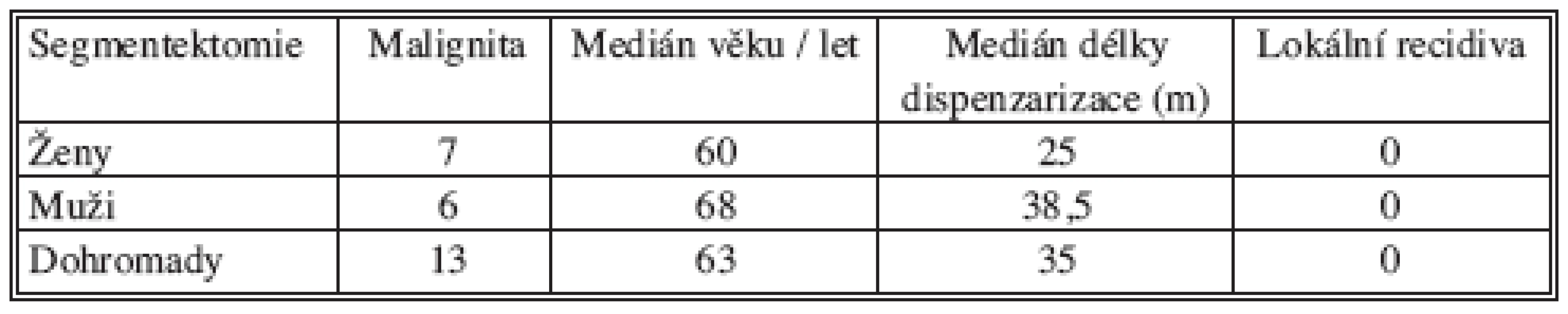
SOUHRN: Skupina 13 segmentektomií (7F a 6M) pro malignitu, medián věku 63 let. Medián trvání dispenzarizace 35 měsíců. ŽÁDNÁ LOKÁLNÍ RECIDIVA NEZAZNAMENÁNA. Reintervence
Chirurgické
Tracheotomie a dvě reinzerce hrudní drenáže v po - operačním období byly provedeny u komplikovaného případu s neúplným rozvíjením operované plíce v terénu COPD a nasedající bronchopneumonie.
V rámci následné péče byly provedeny dva drobné diagnostické zákroky v podobě exstirpace krčních uzlin. Histologické vyšetření shledalo v prvním případě metastázu NSCLC a ve druhém pak maligního melanomu (Pt kód F10; Ml7 viz Tab. 1 a Tab. 5).
První pacientka (v tabulkách kód F10) byla v čase tohoto diagnostického výkonu 8 let po parciální mastektomii pro invazivní duktální karcinom mléčné žlázy a 7 měsíců po SE3R pro metachronní duplicitu NSCLC. Poté se podrobila konkomitantní chemoradioterapii. Od té doby uplynulo dalších pět let a paní je nadále v kompletní remisi.
Druhý pacient (tabulkách kód Ml7) byl v čase diagnostického výkonu v pravém nadklíčku 33 měsíců po kontralaterální plicní segmentektomii z horního laloku pro solitárně metastázující maligní melanom.
Nechirurgické
Chemoterapií a radioterapií byl léčena osoba s jaterními a mozkovými metastázami kolorektálního karcinomu, čímž bylo přechodně dosaženo stabilizace nemoci. Nemocná je nadále pod pečlivým onkologickým dohledem.
Chemoterapie a radioterapie byla prováděna u pěti pacientů s NSCLC. Tři z nich zemřeli na progresi nádorového onemocnění, dvě pacientky jsou v kompletní remisi. Ta první z nich třináct let po parciální mastektomii pro rakovinu prsu a více než pět a půl roku po segmentektomii pro nemalobuněčnou rakovinu plic (F10: Tab. 1; 2; 5).
Ta druhá (kód F18: Tab. 1; 2; 5) je 28 měsíců po segmentektomii pro adenokarcinom s mikroskopickou reziduální nemocí a následnou radioterapií v kompletní remisi.
Příslušná dispenzární péče je prováděna u 14 osob. Je to 13 pacientů s onkologickou diagnózou a jeden muž, bývalý kuřák, u něhož byla segmentektomií odstraněna pneumonitida.
Důležité detaily
V rámci dispenzární péče byl u jedné osoby ve skupině objeven mikroinvazivní acinární karcinom prostaty 15 měsíců po plicní resekci. Pacient je v kompletní remisi po hormonální léčbě a kurativní radioterapii s normálními hladinami PSA/fPSA. Jiný starší muž ve velmi dobrém stavu přišel neočekávaně v intervalu mezi plánovanými dispenzárními kontrolami ukazujíc knoflíkovitou rezistenci v podkoží krku. Tato návštěva se odehrála 33 měsíců po segmentektomii pro solitární plicní metastázu maligního melanomu kontralaterálně. Excize prokázala malou metastázu maligního melanomu. PET/CT vyšetření pak vícečetné asymptomatické metastázy v břiše, retroperitoenu a v měkkých tkáních trupu, zatímco segmentektovaná plíce a mezihrudí jsou bez známek onemocnění. Pacient je pečlivě sledován. Systémové podání dacarbazinu nenalezlo v indikační onkologické rozvaze dostatečnou argumentační podporu.
Dále můžeme konstatovat, že žádný z případů generalizace NSCLC onemocnění v lůžku po segmentektomii nejevil lokální recidivu. A připomenout, že systémová kombinovaná léčba časně diagnostikovaného diskrétního relapsu NSCLC v mízní uzlině rámci dispenzární péče v nadklíčku se v daném případě pravděpodobně podílí na dlouhodobé kompletní remisi.
DISKUSE
Časná diagnostika zůstává v českých podmínkách, kde kolem 85 % pacientů přichází s pokročilým onemocněním a více než 40 % nemocných se neléčí, nadále Popelkou. Nejinak tomu pak musí být i s časnou léčbou, která je indikována tak zřídka, že její výpovědní síla by se bez vypjatého kontinuálního úsilí ztratila v diaspoře „velkých“ operací. Přitom ze současného poznání plyne, že chmurný osud pěti tisíců z nás ročně by mohl být přinejmenším částečně zlepšen. Je zřejmé, že chirurgie se může a chce podílet na tomto úsilí, jenž má (dokonce musí) být týmové. Nabízí svůj díl, jímž se v daném případě technicky jeví sublobární anatomické resekce spojené se systematickou lymfadenektomií. Je tomu tak i onkologicky? Jedni říkají ano, jiní ne. Zkoumejme pozorně nabytá data:
Abychom mohli studovat lokální účinnost metody z onkologického hlediska vyloučíme nejdříve všechny benigní nálezy. Ale předtím se u nich zastavme: v pěti ze šesti našich případů byl zákrok indikován u onkologického pacienta s více-méně závažným podezřením na maligní proces, který běžnými rutinními způsoby diagnostikům nepovedlo prokázat. Zkušenost napovídala, že by se o něj mohlo jednat. Čili intervenční otázka, vlastně dvě: První – je oprávněná lobektomie pro chondrohamartom, anebo drobný plicní infarkt? Druhá – je oprávněna enukleace metastázy? Legrace končí.
Skalpel máme v ruce, ale co máme dělat, nevíme. Další intervenční hlavolam plyne z peroperačního histologického vyšetření preparátu, například adenokarcinom. Jaký? Primárně plicní metachronní duplicita anebo metastatický? To se u operačního stolu někdy nedozvíme. A kolikrát to přesně nebudeme vědět ani dva týdny po operaci se všemi histochemickými sety, které má patolog k dispozici. Můžeme tu operovat bez lymfadenektomie? U NSCLC nesmíme [2, 15]. Klinické důsledky takového počínání jsou tristní. Ale ani u metastázy bychom neměli. I když klinický vliv lymfadenektomie u metastazekomie dosud není známý [17, 18]. Měli jsme raději čekat 3–6 měsíců, neobjeví-li se další ložiska ve vzdálených lokalizacích? Co když je založí právě to jedno, inkriminované, před nímž stojím odolávaje pokušení provést pohodlnou a rychlou klínovitou resekci. To směl J. Diviš u první plicní metastazektomie. V roce 1926 [16]. Dnes nezbývá, než znát předoperační CT vyšetření do podrobností a myslet rukama, upřesnit umístění tumoru v parenchymu a pak volit mezi SE a LE. Nepřekvapí-li nás peroperační uzlinový status. Jde-li o tumor primární, zdrženlivě kalkulujeme hranici 20 milimetrů k segmentektomii. Jde-li o terén předznamenaný operací primárně mimoplicního nádoru v anamnéze a je-li též zřetelně v jednom segmentu akceptujeme hranici 30 milimetrů a lze se rozhodnout pro segmentektomii s adekvátní pečlivou lymfadenektomií a peroperační histologií. Přitom stále často nevíme, jde-li o metastázu anebo metachronní plicní duplicitu, kterou v současnosti již nelze beztrestně ponechat bez lymfadenektomie, minimálně lalokově specifické. Navzdory tomu, anebo právě proto, že o vlivu lymfadenektomie na kliniku v souvislosti s odstraňováním metastáz mimoplicního nádoru z plic nemáme informace je náš přístup takový, že se snažíme o kompletní resekci. Zároveň sbíráme data, čili lymfadenektomujeme. Vede nás k tomu jak vlastní zkušenost sporadického průkazu výskytu mikroskopické infiltrace intrapulmonálních a mediastinálních lymfatik u různých mimoplicních nádorů metastazujících do plic, zprávy z literatury [18] a také koncepce Mayo Clinic, že žádný pokus o kurativní resekci by neměl být pokládán za nepotřebný [16].
Zajímavým směrem ukazují i dva nálezy pneumonitid u těžkých kuřáků (pt. lM2 a pt. M7), kde se předpoklad neoplazmatu i za nediagnostikovatelných podmínek přijímá až příliš samozřejmě. Zůstávejme i v těchto případech v sublobárním střehu, zvláště u nálezů rozměrů TlaN0.
Pokračujme u dalších onkologických nálezů:
Pro rozhodnutí lobektomie versus segmentektomie je v současnosti k dispozici málo údajů, než aby se dalo jednoznačně tvrdit, že LE je správně a SE nesprávně. Anebo naopak. Otevírá se tím prostor pro prospektivní pneumo-onkochirurgické aktivity. Všestranný rozbor současných, sice skromných, ale podrobně zaznamenávaných zkušeností lze využít jako podklad pro zlepšení rozhodování. Vědomí chyby malých čísel nevyzpytatelnou biologickou povahu primárního rakoviny plic nemění a značná část pacientů s klasicky diagnostikovaným a operovaným „chirurgickým“ onemocněním, ať již z jakýchkoliv příčin systémově léčených anebo neléčených, zemře nevyhnutelně na generalizaci, musíme si klást chirurgické otázky. Rozhoduje, anebo nerozhoduje rozsah a technika chirurgického výkonu? U kterých typů nemoci? Například v případě kódovaném F10 (viz Tab. 2). Prvně – bylo by došlo k metastazování do nadklíčku, kdybychom byli diagnostikovali N1 onemocnění peroperačně a rozšířili výkon na lobektomii? Může nějakým způsobem souviset se zvolenou operační technikou segmentektomie a intraoperační manipulace s nepříznivým průběhem nemoci dalších tří pacientů zemřelých na progresi NSCLC. Když ano, tak jakým? Když ne, tak proč? Víme, že k definitivnímu ošetření žilního zásobení se dostáváme u segmentektomie dost pozdě. I když je tato otázka nepochybně komplexnější, než redukovat ji na pouhou manipulaci s tumorem při volném odtoku krve z nádorem postižené oblasti, mohla by hrát roli. V našem souboru se generalizace onemocnění objevila v pěti případech. Tři osoby zemřely, dvě přežívají, jedna z nich ve stadiu stabilizovaná, v druhém případě nemoc progreduje. Dále zde figuruje skupina 5 osob (38 %) s mediánem sledování 43 měsíců v kompletní remisi (CR) bez epizody návratu onemocnění.
A je zajímavé, že v souboru 13 plicních segmentektomií spojených se systematickou lymfadenektomií v pestré skupině plicních malignit se střední délkou sledování 35 měsíců se neobjevila žádná lokální recidiva. I když ryze matematický (statistický) pohled na tuto skutečnost je z hlediska malých čísel identický s alternativou pozorování lokální recidivy ve všech případech, pro konkrétní osoby v kompletní remisi to znamená, že segmentektomie – zákrok, funkčně nepatrný, byť technicky a časově náročnější, pro závažnou diagnózu je pro ně z hlediska kvality života výhodný a z onkologického hlediska přijatelný.
Přenecháme-li tucty jiných, ryze onkologických otázek klinickým onkologům musíme pozorně studovat jak „chirurgickou“ povahu a chování metachronní duplicity, tak charakter jednotlivých diagnóz do plic metastazujícího onemocnění. Též úlohu, kterou sehrávají různé druhy a dávky adjuvantní chemoterapie a biologické léčby.
Je zde nepochybně daleko více otázek, než odpovědí. Což by možná ale mohla být určitá výhoda v hledání prozatímního jednoduchého a syntetizujícího chirurgického konceptu časné léčby časně diagnostikované rakoviny plic, než nás pneumologové zavalí případy s časnými nálezy z připravovaných screeningových programů.
Ze shromážděného materiálu (ani ze stavu současného pneumo-onkochirurgického poznání) neplynou, podle mého názoru, žádné podstatné výhrady vůči indikaci plicní segmentektomie ve spojení s příslušnou lymfadenektomií jako terapeutické modality T1N0 stadia nemalobuněčného plicního karcinomu do 20 mm v průměru, ani k odstranění solitárních plicních metastáz extrapulmonálních tumorů stejnou technikou až do velikosti kolem 30 mm v průměru, za předpokladu spolehlivého ověření jejich umístění a postižení mízních uzlin.
Pečlivé sledování operovaných osob a zahrnutí dalších vybraných pacientů do sledování pomůže upřesnit odpovídající roli plicní segmentektomie ve spojení s lymfadenektomií pro různé diagnózy.
Studie širšího rozsahu zaměřená na plicní segmentektomie versus lobektomie, obojí s příslušnou lymfadenektomií, v časném stadiu onemocnění rakovinou plic je žádoucí.
ZÁVĚR
- Žádnou lokální recidivu jsme v lůžku po plicní segmentektomii pro malignitu nezaznamenali.
- Dvě pětiny dlouhodobě sledovaných osob jsou v kompletní remisi.
- Plicní segmentektomie by v definovaných případech mohla být metodou volby v léčbě plicní malignity – NSCLC i do plic metastazujícího mimoplicního karcinomu.
MUDr. T. Horváth, CSc.
Oblá 79
634 00 Brno
e-mail: thorvath@fnbrno.cz
Zdroje
1. International Early Lung Cancer Action Program Committee, Henschke, C. I., et al. Survival of Patients with Stage I Lung Cancer Detected on CT Screening. N. Engl. J. Med., 2006; 355 : 1763–1771.
2. Lardinois, D., DeLeyn, P., VanSchil, P., Rami-Porta, R., Walter, D., Passlick, B., Zielinski, M., Junker, K., Rendina, E. A., Ris, H. B., Hasse, J., Detterbeck, F., Lerut, T., Weder, W. ETST guidelines for intraoperative lymph node staging in non-small cell lung cancer. Eur. J. Cardiothorac. Surg., 2006; 30 : 787–792.
3. Shields, T. W. The fate of the patient after incomplete resection of bronchial carcinoma. Surg. Gynecol. Obstet, 1974; 139 : 569–744.
4. Lung Cancer Study Group prepared by Ginsberg, R. J., Rubinstein, L. V. Randomized Trial of lobectomy versus limited resection for T1N0 non small cell lung cancer. Ann. Thorac. Surg., 1995; 60 : 614–623.
4. Korst, R. J., Ginsberg, R. J. Appropriate Surgical Treatment of Resectable Non-small-cell Lung Cancer. Word. J. Surg., 2001; 25 : 184 –
5. Kodama, K., Doi, O., Higashiyama, M., et al. Intentional limited resection for selected patients with T1N0M0 non small cell lung cancer. J. Thorac. Cardiovasc. Surg., 1997; 114 : 347–353.
6. Nonaka, M., Kadokura, M., Yamamoto, S., et al. Tumor Dimension and Prognosis in Surgically Treated Lung Cancer For Intentional Limited Resection. Am. J. Clin. Oncol., 2003; 26 : 499–503.
7. Massard, G. Quality standards for resection of non small cell lung cancer. Rev. Mal. Respir., 2007, 24 : 6S40–9.
8. Tockman, M. S., Zhukov, T., Erozan, Y. S., et al. Monoclonal Antibody Detection of Premalignant Lesions of the Lung in Biological Basis of Lung Cancer Prevention Martinez Y, Hirsch FR et al Birghauser Verlag A.G. Basel, Switzerland 1997.
9. Hirsch, F. R., Gazdar, A. F., Gabrielson, E. Histopathologic evaluation of premalignant and early malignant bronchial lesions: an intercative program based on Internet digital images of lung cancer and for monitoring chemoprevention studies. Lung Cancer, 2000; 29 : 209.
10. Horvath, T. A., Hirano, T., Horvathova, M. D., Číhalová, M., Ebihara, Y., Furukawa, K., Habanec, B., Ikeda, N., Rejthar, A., Stratil, D., Kato, H. Autofluorescence (safe) bronchoscopy and p21/ki67 immunostaining related to carcinogenesis. Photodg. Photodyn. Ther., 2004; 1 : 13–22.
11. Dominioni, L., Strauss, G. M. Consensus Statement International Conference on Prevention and Early Diagnosis of Lung Cancer. Cancer, 1999; 23 : 171–172.
12. Warren, W. H., Faber, L. P. Segmentectomy versus lobectomy in patients with stage I pulmonary carcinoma. Five-years survival and patterns of intrathoracic recurrence. J. Thorac. Cardiovasc. Surg., 1994; 107 : 1087–1094.
13. Řehák, F., Šmat, V. Chirurgie plic a mediastina, Avicenum, Praha 1986.
14. Okada, M., Koike, T., Higashiyama, M., et al. Radical sublobar resection for small-sized non small cell lung cancer: A multicenter study J. Thorac. Cardiovasc. Surg., 2006; 132 : 769–775.
15. Tsubota, N., Yoshimura, M. Skip metastasis and N2 disease in lung cancer. Surg. Today, 1996; 26 : 169–172.
16. Diviš J. Ein Beitrag zur operativen Behandlung der Lungen - geschwuelste, Acta Chir. Scand., 1927; 62 : 329–341.
17. Dominguez-Ventura, A., Nichols, F. C. III Lymphadenectomy in Metastasectomy. Thorac. Surg. Clin., 2006; 16 : 139–143.
18. Abrams, H. L., Spiro, R., Goldstein, N. Metastasis in carcinoma: analysis of 1000 autopsied cases. Cancer, 1950; 3 : 75–85.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článek Česká hrudní chirurgie
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2009 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Česká hrudní chirurgie
- Mezinárodní setkání východoevropských hrudních chirurgů – milníky na cestě vědy a přátelství
- Maligní teratom mediastina – kazuistika
- Vliv neoadjuvantní terapie na pooperační komplikace po pneumonektomii
- Otevřené pleurální okénko v léčbě pokročilého empyému hrudníku: zkušenosti s léčbou dvaceti rizikových pacientů
- Nevýhody jednostranné videotorakoskopické tymektomie
- Plicní segmentektomie pro nádor
- Využití KLS Martin Nd: YAG laseru MY 40 1.3 v plicní chirurgii
- Akutní mediastinitis – optimální diagnostická a léčebná opatření
- Mediastinální lymfadenektomie v chirurgii plicních metastáz
- Pozdně diagnostikovaná ruptura bránice – kazuistika
- Postavení peroperační neuromonitorace, neuroprotekce a preventivní karotické endarterektomie u nemocných se zvýšeným rizikem mozkové ischemie indikovaných ke kardiochirurgické operaci
- GIST ako náhla brušná príhoda
- Další možnost modifikovaného přístupu při laparoskopické cholecystektomii
- Endovenózní laserová terapie varixů dolních končetin
- Hemotorax při tupém poranění hrudníku
- Zánětlivá onemocnění hrudníku v chirurgii
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hemotorax při tupém poranění hrudníku
- Akutní mediastinitis – optimální diagnostická a léčebná opatření
- Zánětlivá onemocnění hrudníku v chirurgii
- Maligní teratom mediastina – kazuistika
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



