-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
Hybrid Procedures in the Treatment of Type IV and V Thoracoabdominal Aneurysms
Objective:
To evaluate our experience with hybrid endovascular and open surgical treatment of thoracoabdominal aneurysms.Material and methods:
Between 1996 and 2008 8 patients with thoracoabdominal aneurysm (6 Crawford type IV and 2 type V) from the total of 257 aortic aneurysms with elective endovascular repair were treated using hybrid procedure. A retrograde revascularisation of visceral and renal arteries through the open access and endovascular exclusion of aneurysms using a stent-graft were done.Results:
A primar technical success of the hybrid procedure was in all cases. There was no severe ischaemia of visceral organs, kidneys (no need of haemodialysis) or spinal cord (paraplegia). One patient died on an acute pancreatitis 14 postperative day. Further follow up (in range 16–52 monthes) showed henceforth a successful exclusion of all the aneurysms without evidence of endoleak and patency of all bypasses with a good function of revascularised organs.Conclusion:
Owing to minimal haemodynamic load and technical simplicity with a short time of organ ischaemia hybrid procedure represents an acceptable possibility of type IV and V thoracoabdominal aneurysms repair.Key words:
thoracoabdominal aortic aneurysm – hybrid procedure – endovascular exclusion – visceral revascularisation
Autori: P. Utíkal 1; M. Köcher 2; J. Koutná 3; P. Bachleda 1; P. Dráč 1; M. Černá 2; J. Herman 1; L. Kalinová 1
Pôsobisko autorov: II. chirurgická klinika FN a LF UP v Olomouci, přednosta: doc. MUDr. Petr Bachleda, CSc. 1; Radiologická klinika FN a LF UP v Olomouci, přednosta: prof. MUDr. Miroslav Heřman, Ph. D. 2; Klinika anesteziologie a resuscitace FN a LF UP v Olomouci, přednosta: † MUDr. Oldřich Marek, Ph. D. 3
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 1, s. 9-17.
Kategória: Monotematický speciál - Původní práce
Súhrn
Cíl práce:
Zhodnotit vlastní zkušenosti s kombinovanou endovaskulární a chirurgickou léčbou torakoabdominálních výdutí.Materiál a metodika:
Z 257 elektivně endovaskulárně léčených AA od roku 1996 do 2008 jsme léčili 8 nemocných s torakoabdominální výdutí (6 typu IV a 2 typu V podle Crawforda) pomocí hybridního výkonu. Z laparotomie byla založena retrográdně revaskularizace viscerálních a renálních tepen a výduť byla exkludována endovaskulárně pomocí stentgraftu.Výsledky:
HV byl primárně technicky úspěšný u všech nemocných. Nezaznamenali jsme závažnou ischemii viscerálních orgánů, ledvin (nebyla nutná podpůrná dialýza) ani míchy (paraplegie). Jeden nemocný zemřel 14 den pooperační na akutní pankreatitidu. Během dalšího sledování (v rozmezí 16–52 měsíců) byly všechny výdutě nadále úspěšně exkludovány bez známek endoleaku a všechny bypassy byly průchodné s dobrou funkcí revaskularizovaných orgánů.Závěr:
Pro svou hemodynamickou nenáročnost a technickou jednoduchost s minimální dobou orgánové ischemie představuje hybridní výkon přijatelnou možnost léčby torakoabdominálních výdutí typu IV,V.Klíčová slova:
torakoabdominální výdutě – hybridní výkon – endovaskulární exkluze – viscerální revaskularizaceÚVOD
Úspěšná léčba torakoabdominálních výdutí (TAAA) představuje stále velkou výzvu pro cévní chirurgii. Vysoký aortální klamping, hypoperfuze ledvin, viscerálních orgánů a dolní poloviny těla a celkově dlouhotrvající výkon představují hlavní riziko komplikací klasického chirurgického výkonu pro TAAA. Během doby byla vyvinuta řada operačních strategií se snahou o zrychlení výkonu a snížení času renální a viscerální ischemie. Podstata výkonu s hemodynamicky náročným vysokým uzávěrem aorty se však neměnila [1–3]. Až v devadesátých letech 20 století zasáhla významně do léčby aortálních výdutí (AA) endovaskulární léčba (EVL) [4]. Hemodynamicky nenáročný výkon (non aorta clamping method) výrazně snížil perioperační rizika. U výdutí subrenální aorty (AAA) se EVL stala během krátké doby alternativou klasické chirurgické léčby a metodou volby pro nemocné s vysokým operačním rizikem (ASA III, IV) [5, 6]. Zásadní postavení si získala EVL i v léčbě výdutí hrudní aorty (TAA) [7]. Ne u všech AA je však EVL možná. Omezení EVL vychází ze současné konstrukce stentgraft systémů a závisí na morfologii výdutě. TAAA patří mezi výdutě s komplikovanou morfologií pro standardní EVL. Stentgraft vyřadí z přímého toku krevního viscerální a renální větve, které z vaku nebo krčku TAAA odstupují. Endovaskulární revaskularizace aortálních větví je pomocí současných technik problematická. Samostatná EVL TAAA tak není běžně možná. Do popředí zájmu se proto dostala možnost léčby TAAA pomocí hybridního výkonu (HV). Obecným principem HV v léčbě AA („hybrid approach – hybrid procedure – hybrid technique, kombinovaná strategie – combined strategy – combined endovascular and surgical approach”) je primární spojení endovaskulární exkluze vaku výdutě s pomocným chirurgickým výkonem. Pomocný chirurgický výkon („primary adjunctive – additional – associated surgery“) umožní základní endovaskulární výkon provést [8]. U HV pro TAAA je endovaskulární exkluze výdutě pomocí stentgraftu spojena s chirurgickou revaskularizací viscerálních orgánů a ledvin [9–19].
TAAA typu IV („total abdominal aortic aneurysm“) podle Crawfordovy klasifikace (TAAA IV) začíná v oblasti bránice a končí v aortální bifurkaci. Z vaku výdutě odstupují truncus coeliacus (TC), horní mezenterická tepna (AMS) a reální tepny (AR). TAAA typu V podle Crawfordovy klasifikace (TAAA V) začíná v oblasti pod 6. žebrem a končí nad odstupem AR. Z vaku výdutě většinou odstupují TC a AMS [1, 2]. V našem sdělení uvádíme vlastní zkušenosti s HV u osmi nemocných s TAAA typu IV a V a shrnujeme poznatky o této problematice uvedené ve světové literatuře.
MATERIÁL A METODA
Z 257 endovaskulárně léčených AA od roku 1996 do 2008 jsme léčili elektivně 8 nemocných (6 mužů a 2 ženy) s asymptomatickým TAAA (průměr vaku výdutě 65 mm; v rozmezí 54–82) pomocí HV. Všichni nemocní (průměrný věk 63,7 let; 61–72) měli vyšší nebo vysoké operační riziko (ASA III-IV) a byli pro klasickou chirurgickou léčbu kontraindikováni. V 6 případech se jednalo o TAAA IV a ve 2 případech o TAAA V (Obr. 1a, 2a, 3a) (Tab. 1). Šestkrát byl příčinou výdutě dilatační typ aterosklerózy, jednou se jednalo o infekční výduť a jednou o paraanastomotickou výduť (PAAA) po předchozím klasickém chirurgickém výkonu pro výduť descendentní aorty. Morfologii výdutě a typ a rozměry stentgraftu k jejímu řešení jsme stanovili na základě zobrazení pomocí CT angiografie. Klasickou angiografii metodou DSA jsme použili k zhodnocení odstupů viscerálních a renálních tepen a ilických tepen. Všechny výkony jsme provedli jednodobě, v celkové anestezii a bez speciální ochrany míchy. K exkluzi výdutí jsme použili tubulární typ stentgraftu; u 7 aortoaortální a u 1 aortouniiliakální. Ve všech případech jsme použili stentgraft-systém Ella (Ella-CS, Hradec Králové, ČR). K zavedení stentgraftu jsme u 4 nemocných založili alternativní přístup (dvakrát přes aortu a dvakrát přes společnou ilickou tepnu) (Obr. 1d), u ostatních nemocných jsme zavedli stentgraft přes společnou femorální tepnu (AFC). Fixaci stentgraftu v aortě nad bifurkací jsme v jednom případě podpořili pomocí bandingu. Chirurgickou revaskularizaci jsme založili vždy retrográdně z laparotomie. Přítokovou anastomózu jsme našili v jednom případě na aortu, v ostatních případech vždy na společnou ilickou tepnu (AIC). U TAAA IV jsme u 5 nemocných založili kompletní revaskularizaci na AMS a TC s využitím obrácené bifurkační protézy s našitými odstupy pro AR (Obr. 2b, c). U jednoho nemocného s anomálním odstupem arteria hepatica communis (AHC) z AMS jsme TC nerevaskularizovali (Obr. 1b, c, e). U TAAA V jsme založili revaskularizaci pomocí bypassu na TC s odskokem pro AMS (Obr. 3b, c) (Tab. 1). Ke konstrukci bypassů jsme využili protézy z ePTFE. Před propuštěním jsme provedli pátý pooperační den kontrolní angiografii metodou DSA. Všechny nemocné jsme po výkonu sledovali klinicky a laboratorně funkčnost bypassů pomocí dopplerovské ultrasonografie; první rok každé 3 měsíce a následně je sledujeme jednou za rok. EVL jsme kontrolovali podle našeho protokolu; CT angiografii a prostý snímek břicha provádíme jednou za rok [20].
Obr. 1. Muž 61 let s vysokým operačním rizikem a TAAA IV 1a: Předoperační angiografie. Výduť začíná v oblasti bránice, zaujímá odstupy viscerálních a renálních tepen a končí v bifurkaci aorty. 1b: Předoperační angiografie. Anomální odstup AHC z AMS. 1c: Schéma kombinované léčby. K revaskularizaci levé AR je založen iliko-renální bypass z levé AIC. K revaskularizaci pravé AR je založen bypass z pravé AIC s odstupem pro AMS. Revaskularizace TC není nutná – nejdůležitější větev, AHC, odstupuje anomálně z AMS. Slezina je vyjmuta a pro zásobení žaludku a pankreatu je dostatečný kolaterální oběh z oblasti AMS. Vyřazené aortální větve jsou centrálně uzavřeny pomocí ligatury. K zavedení stentgraftu je založen přechodný alternativní přístup. Výduť je exkludována pomocí tubulárního aortoaortálního stentgraftu. Endovaskulární fixace v dolním krčku je podpořena pomocí aortálního bandingu. 1d: Peroperační pohled. Laparotomie, retroperitoneální prostor s aortou a „temporary aortic conduit“. 1e: Pooperační angiografie. Technicky úspěšná exkluze výdutě a orgánová revaskularizace. Fig. 1. Male, aged 61, with a high operative risk and TAAA IV 1a: Pre-operative angiography. The aneurysm starts in the diaphragm areas, involves the origins of the visceral and renal arteries and ends in the aortic bifurcation. 1b: Pre-operative angiography. Anomalous origin of arteria hepatica communis from SMA. 1c: Combined treatment drawing. An iliac-renal bypass from the left CIA was created for the revascularisation of the left RA. For the revascularisation of the right RA, a bypass was created from the right CIA with an attachment for SMA. No CT revascularisation is required – the most important branch, common hepatic artery, originates anomally from SMA. The spleen has been removed and the collateral circulation from SMA area is enough for supplying the stomach and pancreas. The aortic branches are centrally closed by ligation. A temporary alternative access has been created for stent-graft introduction. The aneurysm is excluded using a tubular aorto-aortic stent-graft. The endovascular fixation in the lower aortic neck is supported by aortic banding. 1d: Per-operative view. Laparotomy, retro-peritoneal space with the aorta, and temporary aortic conduit. 1e: Post-operative angiography. Technically successful aneurysm exclusion and organ revascularisation. 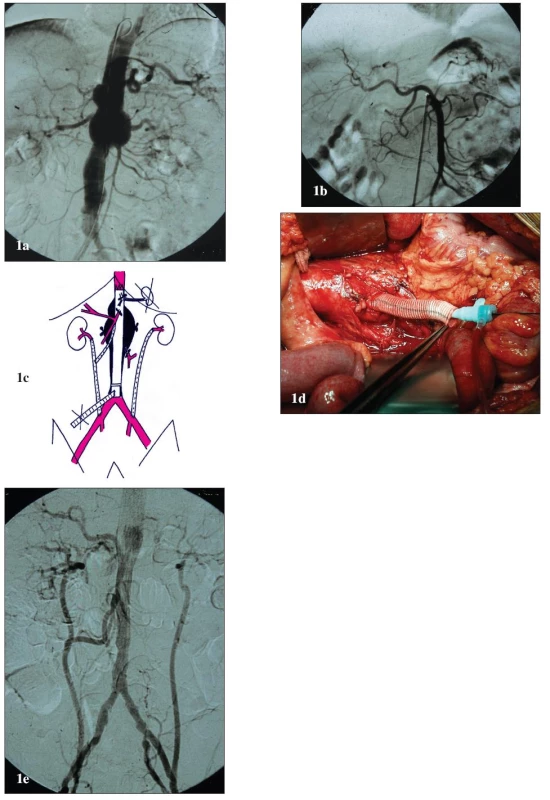
Obr. 2. Muž 55 let s vysokým operačním rizikem a TAAA IV 2a: Předoperační angiografie. Výduť začíná v oblasti bránice, zaujímá odstupy viscerálních a renálních tepen a zasahuje do bifurkace aorty. AIE jsou oboustranně obliteračně postiženy (vpravo je tepna uzavřena, vlevo stenotická). 2b: Schéma kombinované léčby. K zavedení stentgraftu a k zajištění přítoku pro revaskularizaci je založen ilikofemorální bypass vlevo. Ke kompletní extraanatomické retrográdní revaskularizaci je použita obrácená bifurkační protéza (tělo protézy je našito na protézu ilikofemorálního bypassu); levé raménko pro TC, pravé raménko pro AMS, s odstupy pro AR. Centrálně jsou vyřazené aortální větve uzavřeny pomocí ligatury. Výduť je exkludována pomocí tubulárního aortouniiliakálního stentgraftu. Pravá dolní končetina je revaskularizována extraanatomicky pomocí zkříženého femoro-femorálního bypassu. 2c: Peroperační pohled. Laparotomie, otevřený zadní list peritonea, obrácená bifurkační protéza s odstupy pro AR. Fig. 2. Male, aged 55, with a high operative risk and TAAA IV 2a: Pre-operative angiography. The aneurysm starts in the diaphragm area, involves the origins of the visceral and renal arteries and extends to the aortic bifurcation. EIA is bilaterally affected by obliteration (the artery is closed on the right and stenosed on the left). 2b: Combined treatment drawing. An iliac-femoral bypass is created on the left to allow stent-graft introduction and inflow for revascularisation. A reversed bifurcated prosthesis is used for complete extra-anatomical retrograde revascularization (the prosthesis body is sutured to the iliac-femoral bypass prosthesis); the left limb for CT, right limb for SMA, with prosthesis interponates for RA. The excluded aortic branches are centrally closed by ligation. The aneurysm is excluded using a tubular aorto-uniiliac stent-graft. The right lower extremity is revascularised using a cross over femoro-femoral bypass. 2c: Per-operative view. Laparotomy, opened posterior peritoneal lamina, reversed bifurcated prosthesis with prosthesis interponates for RA. 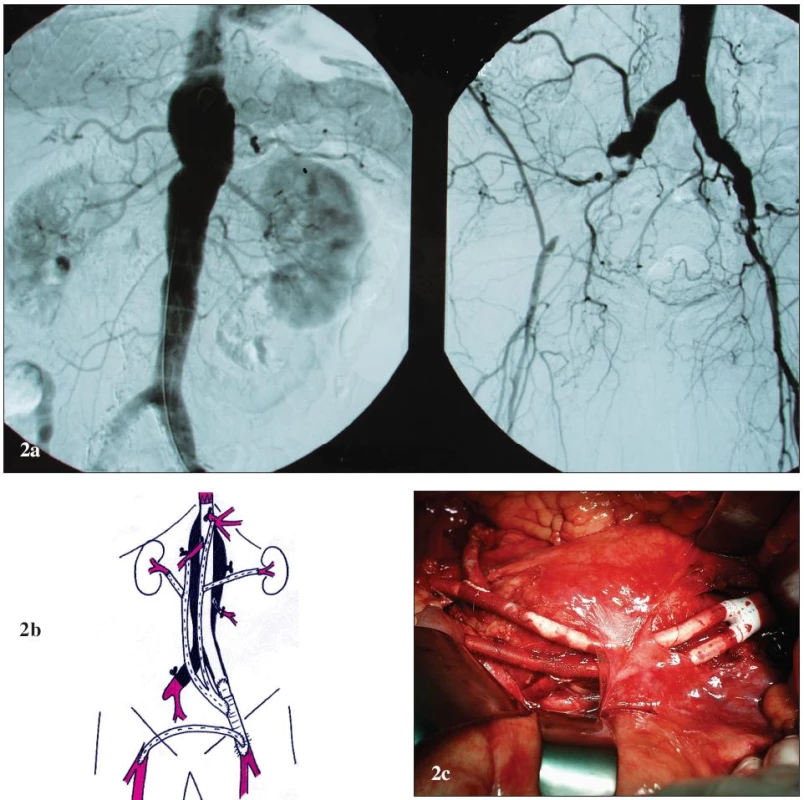
Obr. 3. Žena 59 let s vysokým operačním rizikem a TAAA V 3a: Předoperační CTA. Výduť začíná v oblasti 10 mezižebří, zaujímá odstup TC a končí nad odstupem AMS. 3b: Schéma kombinované léčby. Výduť je exkludována pomocí tubulárního aortoaortálního stentgraftu (zaveden cestou AFC). TC je revaskularizován bypassem založeným z aorty nad bifurkací s odstupem pro AMS. 3c: Pooperační CTA. Technicky úspěšná exkluze výdutě pomocí stentgraftu a orgánová revaskularizace. Fig. 3. Female, aged 59, with a high operative risk and TAAA V 3a: Pre-operative CTA. The aneurysm starts in the 10<sup>th</sup> intercostals space, involves the CT origin and ends over the SMA origin. 3b: Combined treatment scheme drawing. The aneurysm is excluded using a tubular aorto-aortic stent-graft (introduced via CFA). CT is revascularised using a bypass created from the aorta over the bifurcation, with prosthesis interponate for SMA. 3c: Post-operative CTA. Technically successful aneurysm exclusion using a stent-graft, and organ revascularisation. 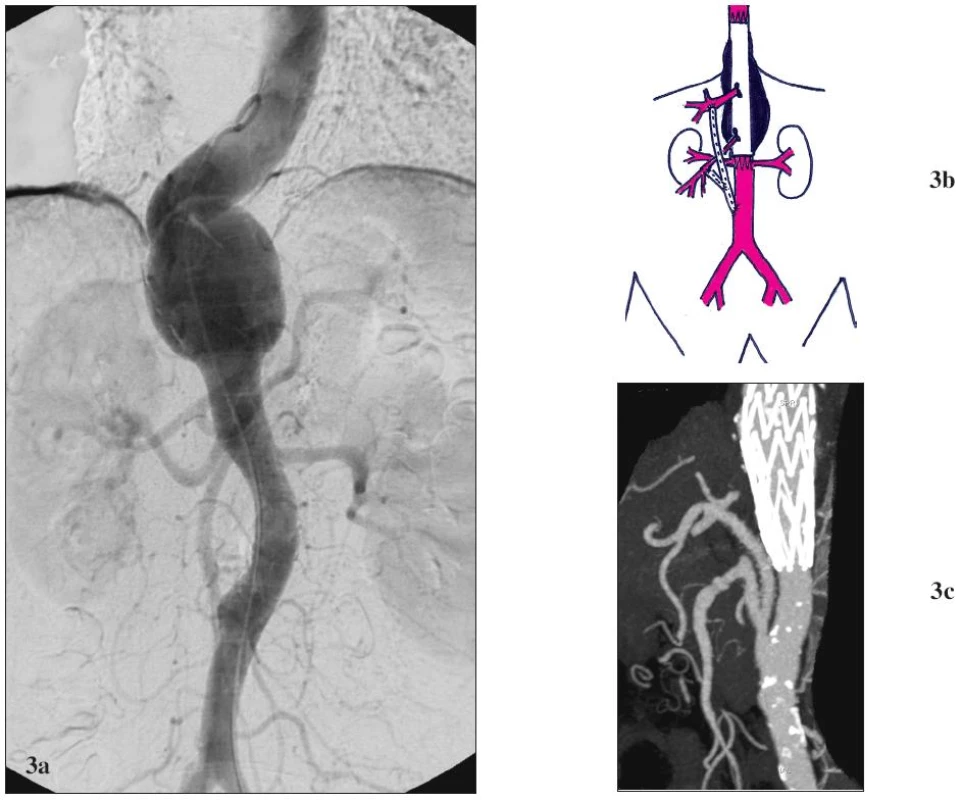
Tab. 1. Sestava nemocných s TAAA IV, V léčených hybridním výkonem Tab. 1. Group of patients with TAAA IV, V treated using the hybrid procedure 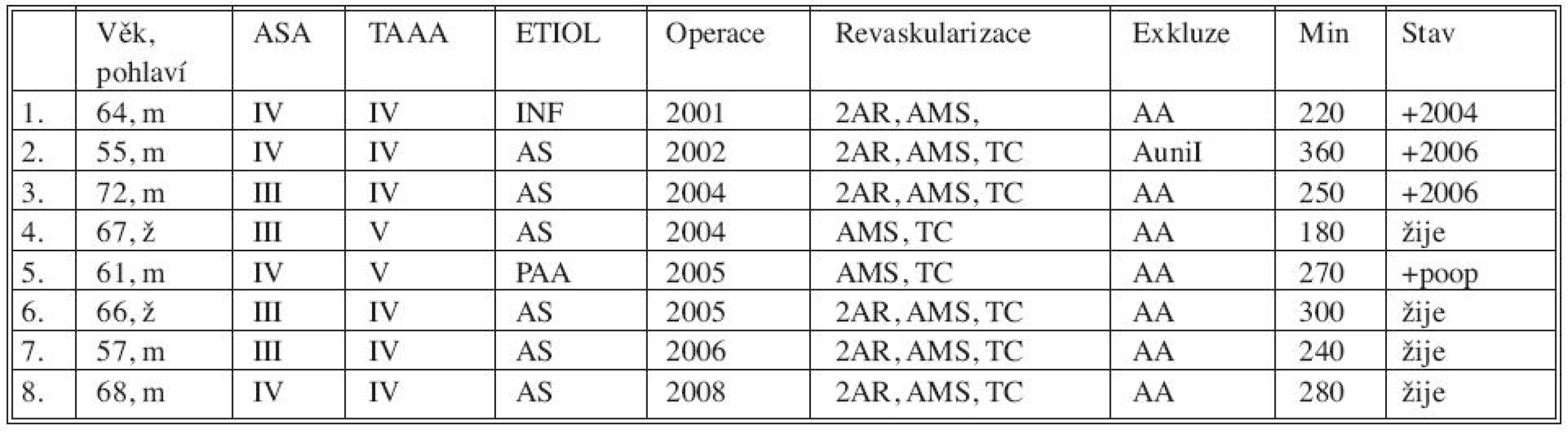
VÝSLEDKY
U všech nemocných proběhl HV technicky úspěšně. Celý výkon trval v průměru 262 minut (v rozmezí 180–360 minut). Doba ischemie jednotlivých orgánů během zakládání revaskularizačního bypassu trvala v průměru 12 minut (v rozmezí od 7 do 18 minut). Průměrná krevní ztráta činila 1600 ml (v rozmezí od 700 do 3600 ml). U žádného nemocného nebyla nutná podpůrná ventilace déle než 12 hodin. Kontrolní angiografie metodou DSA pátý pooperační den ukázala u všech nemocných technicky úspěšnou exkluzi vaku výdutě (volně průchodný stentgraft bez známek endoleaku) a volně průchodné revaskularizační bypassy. Jeden nemocný zemřel 14 den pooperační na akutní nekrotizující pankreatitidu; podíl peroperační ischemie na jejím vzniku vyloučit nešlo. U ostatních nemocných jsme nezaznamenali závažnou ischemii viscerálních orgánů, ledvin (nebyla nutná podpůrná dialýza) a míchy (paraplegie), která by se projevila výrazně klinicky a vedla k operační revizi, úmrtí nebo trvalým následkům. Ischemie viscerálních orgánů a ledvin lehkého stupně se projevila laboratorně přechodným vzestupem laktátů (průměrně 3,6 mmol/l ), transamináz (průměrně 3,2 μkat/l), porušenou koagulací a přechodným vzestupem kreatininu ( průměrně 146 μmol/l ). Během dalšího sledování, průměrná doba 32 měsíců (v rozmezí 16–52 měsíců), všechny výdutě byly nadále úspěšně exkludovány z proudu krevního bez známek endoleaku (u dvou nemocných došlo ke zmenšení vaku výdutě) a všechny revaskularizační bypassy byly volně průchodné s dobrou funkcí jimi zásobených orgánů. Tři nemocní zemřeli na progresi přidružených onemocnění (kardiální postižení) v rozmezí 2,5–4 let po úspěšném HV (Tab. 1).
DISKUSE
Předoperační vyšetření
K zobrazení aorty s výdutí provádíme angiografii pomocí CT nebo MR. Tato vyšetření poskytnou potřebné zobrazení k přesnému určení rozsahu výdutě, zhodnocení vhodnosti výdutě k EVL a stanovení typu a rozměrů stentgraftu k jejímu řešení. Pro volbu typu a taktiky revaskularizace je důležité detailní zobrazení odstupů viscerálních a renálních tepen se zaměřením na odstupové anomálie a obliterační postižení jejich kmenů. Pro volbu přístupové cesty k zavedení stentgraftu a pro volbu místa založení přítokové anastomózy revaskularizačních bypassů je nezbytné zobrazení průběhu ilických tepen a zhodnocení jejich obliteračního postižení. V případě kombinace AA s obliteračním postižením tepen má pro jejich přesné zobrazení a zhodnocení význam klasická angiografie metodou DSA. Selektivní nebo superselektivní angiografie je nezastupitelná pro zhodnocení možností viscerální kolateralizace [21].
Indikace k hybridnímu výkonu
TAAA IV („total abdominal aortic aneurysm“) mají svou lokalizací a povahou blízko k AAA a taktika obecné indikace výdutě k plánovanému výkonu je podobná. TAAA IV o průměru 5 cm a větším jsou vždy považovány za indikaci k preventivnímu výkonu [2]. TAAA V jsou hodnocena podobně. Indikace k HV se řídí dvěma hledisky: morfologií výdutě a stupněm operačního rizika. Morfologie výdutě určuje možnost bezpečného a spolehlivého zavedení a ukotvení stentgraftu. Operační riziko pak hodnotíme z pohledu schopnosti nemocného zvládnout pomocný chirurgický výkon – laparotomii a orgánovou revaskularizaci, nikoliv aortální klamping.
Operační výkon
Příprava nemocného k HV je stejná jako ke klasickému chirurgickému výkonu. Výkon provádíme na operačním sále vybaveném zobrazovací technikou (tzv. hybridní sál je optimální možností) v celkové anestezii (regionální – spinální, epidurální – anestezie je možná) za podmínek zvyklých pro cévní chirurgii ( ATB krytí, heparinizace) s důrazem na multiorgánovou ochranu a podporu během celého perioperačního období. Speciální prevence míšní ischemie během HV při nekomplikovaném průběhu není nutná [1, 2]. Pořadí jednotlivých částí HV je dáno snahou o co nejkratší dobu hypoperfuze a ischemie dolní poloviny těla, ledvin a viscerálních orgánů. U plánovaného výkonu proto provedeme jako první chirurgickou revaskularizaci. Následnou endovaskulární exkluzi výdutě je možné provést v jedné době (simultánně) nebo v odstupu několika dnů až týdnů dvoudobě (sekvenčně) [14, 19, 22–24]. Většina pracovišť dává přednost jednodobému simultánnímu výkonu [19]. Vlastní zavedení stentgraftu představuje již většinou jednoduchou a krátce trvající část celého výkonu. Otevřeného přístupu pro revaskularizaci lze navíc využít k vytvoření alternativního cévního přístupu k zavedení stentgraftu nebo k chirurgické korekci endovaskulárního výkonu, a to plánovaně nebo při peroperačně vzniklých komplikacích.
Revaskularizace
EVL TAAA IV vyžaduje kompletní revaskularizaci aortálních větví pomocí bypassů. Možností založení bypassů je celá řada a vždy volíme tu nejjednodušší a nejpřirozenější možnost, když vycházíme z individuálních anatomických a patologických poměrů v daných oblastech. Základní volbou je, jestli revaskularizaci provedeme antegrádně nebo retrográdně. Při antegrádní revaskularizaci zakládáme bypassy z hrudní aorty přístupem torakoretroperitoneálním devátým mezižebřím vlevo s uvolněním bránice v poloze nemocného na pravém boku. Výhodou této „anatomické“ revaskularizace je, že aorta je zde většinou prosta hemodynamicky významného obliteračního postižení a poskytuje vydatný krevní přítok. Nevýhodou je částečný uzávěr aorty při zakládání přítokové anastomózy (anastomóza na nástěnné svorce) a obtížnější přístup k pravé renální tepně. Problematické je použití tohoto přístupu při reoperacích po předchozím levostranném hrudním výkonu a poloha nemocného na operačím stole je nevýhodná pro zavedení stentgraftu přístupem zprava [9, 19]. Při retrográdní „extraanatomické“ revaskularizaci zakládáme bypassy z AIC nebo ze zevní ilické tepny (AIE) přístupem ze střední laparotomie transperitoneálně přes zadní list peritonea. Tento přístup je po stránce technické jednoduchý, poskytuje dostatek prostoru a přehledu pro obě části HV a založení přítokové anastomózy bypassu (uzavíráme jen jednu ilickou tepnu) je hemodynamicky zcela nezatěžující. Problematická může být retrográdní revaskularizace při hemodynamicky významném obliteračním postižení oblasti bifurkace aorty nebo ilických tepen oboustranně [13, 19]. Z hlediska bezpečnosti a dlouhodobé průchodnosti bypassů neprokázalo srovnání obou způsobů revaskularizace při řešení mezenterické ischemie významné rozdíly [25–28]. Při plánování revaskularizace mají význam odstupové anomálie AR (polární tepny) a viscerálních větví aorty (samostatný odstup arteria hepatica communis z aorty, odstup arteria hepatica communis z AMS), které ovlivní typ a počet bypassů. Někteří autoři provádějí v případě dostatečného retrográdního plnění TC přes gastroduodenální kolaterály viscerální revaskularizaci jen přes AMS [21]. Kompletní revaskularizaci zakládáme pomocí dvou hlavních samostatných bypassů na jednotlivé viscerální větve (AMS a TC) nebo použijeme bifurkační protézu, jejíž tělo tvoří společný základ. Ke straně hlavních bypassů/ramének bifurkační protézy našíváme odstupy (interponát protézy) pro napojení AR (Obr. 1, 2, 3). Přítokové anastomózy zakládáme koncem protézy ke straně aorty/ilické tepny. Výtokové anastomózy zakládáme na přístupné volné periferní části hlavních kmenů s přihlédnutím k anatomickým poměrům (přístupnosti) a jejich obliteračnímu postižení. AR a AMS napojujeme většinou koncem protézy ke konci kmene tepny. Při retrográdní revaskularizaci TC s výhodou zakládáme anastomózu ke straně jeho nejpřístupnější větve, nejčastěji na AHC. Ve snaze o nejkratší dobu orgánové ischémie se jeví nejvýhodnější následující pořadí jednotlivých kroků. Jako první vždy založíme přítokovou anastomózu. Po protažení protéz/ramének k cílovým tepnám (AMS, TC) a jejich „přiměření“, našíváme v odpovídajícím místě jejich průběhu odstupy (interponát protézy) pro napojení AR. Takto připravená protéza umožňuje postupné založení jednotlivých výtokových anastomóz s okamžitým zahájením průtoku příslušnou částí rekonstrukce. Doba ischemie jednotlivých orgánů je tak omezena jen na krátkou dobu (5–15 minut) našití výtokové anastomózy. Pořadí založení jednotlivých anastomóz je určeno jen jejich výhodnější proveditelností při práci v operačním poli. Při retrográdní revaskularizaci se nám osvědčilo jako první našít výtokové anastomózy odstupů na AR a následně pak na viscerální kmeny. Protézu k TC protahujeme retropankreaticky. Ke konstrukci bypassů používáme protézy z ePTFE odpovídajících průměrů (protéza 6-8, bifurkační protéza 14/7). Výborné dlouhodobé výsledky extranatomických rekonstrukcí viscerálních a renálních tepen s využitím ePTFE protézy potvrdila řada studií [25–31]. Centrálně od založené anastomózy kmen revaskularizované aortální větve uzavřeme. Uzávěr provádíme chirurgicky pomocí podvazu (ligatura). V případě našití výtokové anastomózy ke straně tepny je uzávěr prevencí retrográdního toku do vaku výdutě (endoleak typ II).
Revaskularizaci u EVL TAAA V provádíme vždy retrográdně z laparotomie a přítokovou anastomózu zakládáme nejčastěji na infrarenální aortě s využitím nástěnné svorky.
Endovaskulární exkluze
Endovaskulární exkluze TAAA IV, V je většinou možná pomocí aortoaortálního tubulárního stentgraftu o průměru 30–45 mm. Jeho umístění a rozvinutí není technicky složité. Problematické však může být jeho zavedení do místa určení. Velké průměry a délka stentgraftu si vyžadují zavaděče o větším průměru. Standardní přístupová cesta z třísla cestou chirurgické arteriotomie AFC přes AIE tak není většinou možná. Je nutný alternativní přístup přímo přes AIC nebo přímo do aorty, který vytvoříme s využitím dočasného vstupu (temporary access conduit) pomocí dakronové cévní protézy o průměru adekvátním zavaděči (8–10 mm) našité koncem protézy ku straně tepny (Obr. 1d) [32, 33]. Při zavádění stentgraftu se snažíme vyhnout oblasti přítokové anastomózy revaskularizačního bypassu. Při retrográdní revaskularizaci, pokud to je možné, volíme proto přístup k zavedení stentgraftu z druhé strany. Při antegrádní revaskularizaci nás vede poloha nemocného k využití levostranných přístupových cest. Při problematických poměrech dolního aortálního krčku (krátký, široký) pro spolehlivou endovaskulární fixaci aortoaortálního stentgraftu, můžeme primárně plánovat využít otevřeného přístupu a fixaci podpořit pomocí distálního aortálního bandingu (Obr. 1c) [34, 35]. K řešení TAAA IV, které zasahují až do bifurkace nebo přechází na ilické tepny volíme aortouniiliakální typ exkluze s extraanatomickou revaskularizací druhostranné končetiny zkříženým femoro-femorálním bypassem. Cílem je, aby endovaskulární exkluze výdutě byla jednoduchá a spolehlivá, a byla proveditelná rychle a bezpečně. Použití bifurkačního stentgraftu je možné, ale u tohoto typu výdutě a výkonu zbytečně složité. Větší spotřeba kontrastní látky, většinou nezbytná při zavádění složitějších stentgraftů, se může výrazně podílet na postižení revaskularizovaných orgánů (ledvin). Při exkluzi TAAA V může být problematické ukotvení stentgraftu v dolním aortálním krčku, pokud je tento krátký. Stentgraft kotvíme vždy nekrytým segmentem přes odstupy AR. Pokud výduť zasahuje až k odstupům AR, tak je musíme překotvit krytým segmentem, a předtím provést jejich revaskularizaci. Druhou možností je použít stentgraft s fenestracemi pro odstupy AR.
Srovnání HV s klasickým chirurgickým výkonem
Při endovaskulární exkluzi není nutný přechodný uzávěr aorty (princip EVL AA – non aorta clamping method) a nedochází proto k výrazným hemodynamickým změnám s nežádoucími důsledky; kardiálnímu přetížení, viscerální, renální a míšní hypoxii. Orgánová ischemie je omezena jen na krátkou dobu založení výtokové anastomózy toho kterého revaskularizačního bypassu. HV nevyžaduje rozsáhlý torakoabdominální přístup často s alterací bránice, protože nepotřebuje přímý přístup k výduti, k hornímu krčku a odstupům větví vaku výdutě. Stentgraft je zaveden ze vzdáleného místa a anastomóza stentgraftu v proximálním aortálním krčku je založena endovaskulárně. K retrográdní revaskularizaci postačí jednokomorový přístup (laparotomie) a výtokové anastomózy bypassů jsou založeny na volné periferní části aortálních větví v technicky přístupné oblasti. Hemodynamická nenáročnost a miniinvazivita HV významně snižuje riziko kardiální, riziko orgánové ischemie a riziko ranných komplikací [9–19].
Výsledky
Jednotlivá sdělení o HV v léčbě TAAA IV, V mají i v současné době charakter jen malých souborů a doba sledování nemocných po léčbě není dlouhá (v průměru tříletá). Malé počty odpovídají méně častému výskytu tohoto typu aortálních výdutí. TAAA IV, V představují jen asi 20 % z i tak malé skupiny TAAA (2–5 % z celkového spektra AA) [1, 2]. Příčinou může být i skutečnost, že na všech pracovištích, kde léčí AA, neprovádí komplexní, chirurgickou a endovaskulární, léčbu AA a nemohou tak techniky obou metod léčby kombinovat. Řada nemocných je tak z elektivní léčby TAAA zbytečně vyřazena. Po stránce technické byly HV hodnoceny jako dobře proveditelné. V publikovaných sděleních nebyly zaznamenány závažné ischemie viscerálních orgánů (jater a střeva), ledvin (nutnost podpůrné či trvalé dialyzační léčby) a míchy (paraplegie), které by se projevily klinicky a vedly k operační revizi, úmrtí nebo trvalým následkům. Ischemie lehkého stupně se projevily laboratorně (vzestup laktátů, transamináz, amyláz, kreatininu) a hodnoty se upravily během několika dnů. Akutní pooperační pankreatitidu, která vedla k úmrtí nemocného v naší sestavě, považujeme za možný důsledek perioperační ischemie kombinované s peroperační manipulací v této oblasti. Podobně nebyly zaznamenány závažné komplikace kardiopulmonální. Přijatelná zátěž HV pro nemocného se podílí na úspěchu celkové pooperační rekonvalescence a promítá se i do následné kvality života. V průběhu dalšího sledování jsou konstatovány přetrvávající technicky úspěšná exkluze výdutě, primární průchodnost extraanatomických bypassů na viscerální a renální větve s využitím ePTFE protézy a přetrvávající dobrá funkce revaskularizovaných orgánů. Technická a klinická úspěšnost EVL AA i revaskularizačních rekonstrukcí v oblasti viscerální jsou všeobecně známé a přijatelné. HV má snížit především peroperační rizika klasického chirurgického výkonu pro TAAA IV, V (kardiální zátěž a orgánová ischemie). Publikované časné výsledky (pooperační mortalita a morbidita), a ty jsou více než slibné, můžeme proto považovat pro zhodnocení přínosu HV v léčbě TAAA IV,V za dostatečné [9–19].
ZÁVĚR
HV umožní EVL TAAA IV, V, které na současném stupni vývoje endovaskulárních technik standardně endovaskulárně léčit nelze (AA s komplikovanou morfologií), a tím léčbu TAAA s přijatelným operačním rizikem i pro nemocné, jejichž polymorbidita je činí neschopné podstoupit klasickou chirurgickou úpravu (nemocní s nízkou ejekční frakcí, kontraindikovaní k vysokému aortálnímu klampingu). Pro tyto nemocné je HV metodou volby [9]. Pro svou hemodynamickou nenáročnost a technickou jednoduchost (jak endovaskulární exkluze vaku, tak založení revaskularizačních bypassů) může být HV u TAAA IV, V alternativou klasické chirurgické léčby u všech nemocných, u kterých je spolehlivé zavedení a ukotvení stentgraftu možné. V případech reoperací (paraanastomotické výdutě, recidiva výdutě, nově vzniklé TAAA IVV) umožní HV vyhnout se problémovému terénu po předchozím chirurgickém výkonu pro TAA nebo TAAA [14, 18]. Výhody HV je možné využít při řešení TAAA IVV s akutní rupturou. U akutního výkonu provedeme jako první exkluzi výdutě k zastavení krvácení a následně simultánně revaskularizaci. Vzhledem k časové ztrátě při nezbytně nutných předoperačních vyšetřeních (CTA ke zhodnocení výdutě a stanovení rozměrů stentgraftu) jsou však k akutnímu HV vhodní pouze hemodynamicky stabilní nemocní (krytá ruptura).
Zdůrazňovaná „nenáročnost a jednoduchost“ HV platí jen z pohledu k nemocnému. HV vyžadují patřičné personálně-technické zázemí a mají být prováděny v centrech obeznámenými s komplexní problematikou endovaskulární a chirurgické léčby AA.
HV představují jednoznačně současný trend v léčbě TAAA IV, V. S vývojem nových technologií a dalším zdokonalením stengraft systémů může budoucnost v léčbě TAAA patřit čistě endovaskulárním výkonům s využitím fenestrovaných („fenestrated graft“) a větvených stentgraftů („branched graft“). V současné době však nejsou tyto techniky ještě ve stadiu standardního klinického použití [36–40].
Doc. MUDr. Petr Utíkal, Ph.D.
Veverkova 2
772 00 Olomouc
e-mail: petr.utikal@fnol.cz
Zdroje
1. Svensson, L. G., Crawford, E. S., Hess, K. R., Coselli, J. S., Safi, H. J. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J. Vasc. Surg., 1993; 17 : 357–368.
2. Wahlgren, M. C., Wahlberg, E. Management of thoracoabdominal aneurysm type IV. Eur. J. Vasc. Endovasc. Surg., 2005; 29 : 116–123.
3. Ballard, J. L., Abou-Zamzam Jr, A. M., Teruya, T. H. Type III and IV thoracoabdominal aortic aneurysm repair: results of a trifurcated/two-graft technique. J. Vasc. Surg., 2002; 36(2): 211–216.
4. Parodi, J. C., Palmaz, J. C., Barone, H. D. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann. Vasc. Surg., 1991; 5 : 491–499.
5. Taufelsbauer, H., Prusa, A .M., Wolff, K., Polterauer, P., Nanobashvili, J., Prager, M., Holzenbein, T., Thurnher, S., Lammer, J., Schemper, M., Kretschmer, G., Huk, I. Endovascular stent-grafting versus open surgical operation in patients with infrarenal aortic aneurysms. A propensity score – adjusted analysis. Circulation, 2002; 106 : 782–787.
6. May, J., White, G. H., Yu, W., Ly, C. N., Waugh, R., Stehen, M. S. Concurent comparison of endoluminal versus open repair in the treatment of abdominal aortic aneurysms: analysis of 303 patients by life-table method. J. Vasc. Surg., 1998; 27 : 213–221.
7. Dake, M., Miller, D., Semba, C., et al. Transluminal placement of endovascular stent grafts for the treatment of descending thoracic aortic aneurysms. N. Engl. J. Med., 1994; 1331 : 1721–1734.
8. Chaikoff, E. L., Blankenstein, J. D., Harris, P. L., White, G. H., Zarins, Ch. K., Bernhard, V. M., Matsumura, J. S., May, J., Veith, F. J., Fillinger, M. F., Rutherford, R. B., Kent, K. G., for the Ad Hoc Committee for Standardized Reporting Practices in Vascular Surgery of the Society for Vascular Surgery/American Association for Vascular Surgery. Reporting standards for endovascular aortic aneurysm repair. J. Vasc. Surg., 2002; 35 : 1048–1060.
9. Quinones-Baldrich, W. J., Panetta, T. F., Vescera, C. L., et al. Repair of type IV thoracoabdominal aneurysm with combined endovascular and surgical approach. J. Vasc. Surg., 1999; 30 : 555–560.
10. Watanabe, Y., Ishimaru, S., Kawaguchi, S., Shimazaki, T., Yokoi, Y., Ito, M., Obitsu, Y., Ishikawa, M. Successful endografting with simultaneus visceral bypass grafting for severly calcified thorakoabdominal aortic aneurysm. J. Vasc. Surg., 2002; 35(2): 397–399.
11. Kotsis, T., Scharrer-Palmer, R., Kapfer, X., Liewald, F., Gorich, J., Sunder-Plassmann, L., Orend, K. H. Treatment of thoracoabdominal aortic aneurysms with a combined endovascular and surgical approach. Int. Angiol., 2003; 22(2): 125–133.
12. Iguro, Y., Yotsumoto, G., Ishizaki, N., Arata, K., Sakata, R. Endovascular stent-graft repair for throracoabdominal aneurysm after reconstruction of the superior mesenteric and celiac arteries. J. Thorac. Cardiovasc. Surg., 2003; 125 : 956–958.
13. Flye, M. W., Choi, E. T., Sanchez, L. A., Curci, J. A., Thompso, R. W., Rubin, B. G., Geraghty, P. J., Sicard, G. A. Retrograde visceral vessel revascularisation followed by endovascular aneurysm exclusion as an alternative to open surgical repair of thoracoabdominal aortic aneurysm. J. Vasc. Surg., 2004; 39(2): 454–458.
14. Chiesa, R., Mellisano, G., Civilini, E., Setacci, F., Tshomba, Y., Anzuini, A. Two-stage combined endovascular and surgical approach for recurrent thoracoabdominal aortic aneurysm. J. Endovasc. Ther., 2004; 11(3): 330–333.
15. Utíkal, P., Köcher, M., Bachleda, P., Dráč, P., Černá, M., Buriánková, E. Iliac-renal bypass in EVAR of AAA with renal arteries arissing from aneurysmal sac. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc, 2004; 148 : 179–181.
16. Utíkal, P., Köcher, M., Koutná, J., Bachleda, P., Dráč, P., Černá, M., Buriánková, E., Herman, J. Combined strategy in AAA elective treatment. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc, 2005; 149(1): 159–163.
17. Utíkal, P., Köcher, M., Koutná, J., Bachleda, P., Dráč, P., Černá, M., Buriánková, E., Herman, J. Treatment possibility for AAA of the visceral branches region. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc, 2005; 149(1): 165–168.
18. Bonardelli, S., De Lucia, M., Cervi, E., Pandolfo, G., Maroldi, R., Battaglia, G., Gargano, M., Matheis, A., Stefano, M. G. Combined endovascular and surgical approach (hybrid treatment) for management of type IV thoracoabdominal aneurysm. Vascular, 2005; 13(2): 124–128.
19. Fulton, J. J., Farber, M. A., Marston, W. A., Mendes, R., Mauro, M. A., Keagy, B. A. Endovascular stent-graft repair of pararenal type IV thoracoabdominal aortic aneurysms with adjunctive visceral reconstruction. J. Vasc. Surg., 2005; 41(2): 191–198.
20. Černá, M., Köcher, M., Utíkal, P., Koutná, J., Benýšek, V., Bučil, J., Heřman, M., Bachleda, P., Dráč, P. Upravený protokol sledování nemocných po endovaskulární léčbě aneuryzmatu abdominální aorty, jeho zhodnocení ve vztahu k výsledkům. Čes. Radiol., 2006; 60(3): 134–139.
21. Gawenda, M., Aleksic, M., Heckenkamp, J., Reichert, V., Grossmann, A., Brunkwall, J. Hybrid-procedures for the treatment of thoracoabdominal aortic aneurysms and dissections. Eur. J. Vas. Endovasc. Surg., 2007; 33 : 71–77.
22. Greco, F., Deriu, G. P., Stramana, R., Frigatti, P., Ragazzi, R. Type IV Thoraco-abdominal aortic aneurysm (TAAA IV) with occlusion of celiac and superior mesenteric arteries in high risk patient: successful treatment with a hybrid traditional vascular and endovascular procedure. Eur. J. Vasc. Endovasc. Surg. Extra, 2005; 9(5): 87–89.
23. Tachibana, K., Morishita, K., Kurimoto, Y., Fukada, J., Hachiro, Y., Abe, T. Endovascular stent-grafting for thoracoabdominal aortic aneurysm following bypass grafting to superior mesenteric and coeliac arteries: repot of two cases. Ann. Thorac. Cardiovasc. Surg., 2005; 11(5): 335–338.
24. Gregorie, I. D., Gupta, K., Jakobs, M.J., Poglajen, G., Suvorov, N., Dougherty, K. G., Krajcer, Z. Endovascular exclusion of a thoracoabdominal aortic aneurysm after retrograde visceral artery revascularisation. Tex. Heart. Inst. J., 2005; 32(2): 416–420.
25. Moawad, J., McKinsey, J. F., Wyble, C. W., Bassiouny, H. S., Schwartz, L. B., Gewertz, B. L. Current results of surgical therapy for chronic mesenteric ischemia. Arch. Surg., 1997; 132(6): 613–619.
26. Johnston, K. W., Lindsay, T. F., Walker, P. M., Kalman, P. G. Mesenteric arterial bypass grafts: Early and late results and suggested surgical approach for chronic and acute mesenteric ischemia. Surgery, 1995; 118(1): 1–7.
27. McMillan, W., McCarthy, W., Bresticker, M., et al. Mesenteric artery bypass: Objective patency determination. J. Vasc. Surg., 1995; 21 : 729–741.
28. Shanley, C., Ozaki, C., Zelenock, G. Bypass grafting for chronic mesenteric ischemia. Surg. Clin. North. Am., 1997; 77 : 381–395.
29. Pary, P .S., Darling, R. C., Lee, D., Chang, B. B., Roddy, S. P., Kreienberg, P. B., et al. Is prosthetic renal artery reconstruction a durable procedure? Ananalysis of 489 bypass grafts. J. Vasc. Surg., 2001; 34 : 127–132.
30. Reilly, J. M., Rubin, B. G., Thompson, R. W., Allen, B.T., Anderson, C .B., Sicard, G. A. Long term effectiveness of extraanatomic renal artery revascularisation. Surgery, 1994; 116 : 784–790.
31. Cormier, J. M., Fichelle, J. M., Laudan, C., Gigou, F., Artru, B., Ricco, J. B. Renal artery revascularisation with polytetrafluorethylene bypass graft. Ann. Vasc. Surg., 1991; 5 : 133–137.
32. May, J., White, G. N., Yu, W., Waugh, R., Harris, J. P. Treatment of complex abdominal aortic aneurysms by a combination of endoluminal and extraluminal aortofemoral grafts. J. Vasc. Surg., 1994; 19 : 924–933.
33. White, G. H., May, J., McGahan, T., Yu, W., Waugh, R. C., Stephen, M. S., Harris, J. P. Historic control comparison of outcome for matched groups of patients undergoing endoluminal versus open repair of abdominal aortic aneurysms. J. Vasc. Surg., 1996; 23 : 201–212.
34. Lawrence-Brown, M., Sieunarine, K., van Schie, G., Purchas, S., Hartley, D., Goodman, M. A., Prendergast, F. J., Semmens, J. B. Hybrid open –endoluminal technique for repair of thoracoabdominal aneurysm involving the celiac axis. J. Endovasc. Ther., 2000; 7 : 513–519.
35. Utíkal, P., Köcher, M., Bachleda, P., Dráč, P., Černá, M., Buriánková, E. Banding in aortic stent-graft fixation in EVAR. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc, 2004; 148(2): 175–178.
36. Inoue, K., Iwase, T., Sato, M., et al. Transluminal endovascular branched graft placement for a pseudoaneurysm: reconstruction of the descending thoracic aorta including the coeliac axis. J. Thorac. Cardiovasc. Surg., 1997; 114 : 859–861.
37. Kinney, E. V., Kaebnick, H. W., Mitchell, R. A., Jung, M. T. Repair of mycotic paravisceral aneurysm with a fenestrated stent-graft. J. Endovasc. Ther., 2000; 7 : 192–197.
38. Hosokawa, H., Iwase, T., Sato, M., Yoshida, Y., Oeno, K., Tamaki, S., Inoue, K. Successful endovascular repair of juxtarenal and suprarenal aortic aneurysms with a branched stent graft. J. Vasc. Surg., 2001; 33(5): 1087–1092.
39. Vos, A. W. F., Linsen, M. A. M., Wisselink, W., Rauwerda, J. A. Endovascular grafting of complex aortic aneurysms with a modular side branch stent-graft system in a porcine model. Eur. J. Vasc. Endovasc. Surg., 2004; 27 : 492–497.
40. Anderson, J. L., Adam, D. J., Berce, M., Hartley, D. E. Repair of thoracoabdominal aortic aneurysms with fenestrated and branched endovascular stent grafts. J. Vasc. Surg., 2005; 42(4): 600–607.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



