-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
Clinical Experience with Cold-Preservation of Venous and Arterial Allografts. Long-Term Outcomes
Introduction:
Venous and arterial allografts extend the possibilities of peripheral arterial disease as well as vascular prosthesis infections treatment.Material and methods:
Between 10/1997 and 1/2009 we used 112 allogeneic vessels (30 artieries, 82 veins) in 104 patients. Venous allografts were used for 82 reconstructions in 75 patients (M/F 41/34, aged 41–85 years, median 66 years) with critical limb ischemia and no suitable autogenous venous material.
Arterial allografts were used in 9 patients (M/F 8/1, aged 56–77 years, median 63 years) with aortoiliac prosthetic infections or mycotic abdominal aortic aneurysms and in 20 transplanted patients (M/F 11/9, aged 32–67 years, median 56 years) with aortoiliac atherosclerotic disease.Results:
Patients survival rate after allovenous bypasses was 92% at 1 year and 78% at 3 years. Limb salvage rate was 67% at 1 year and 53% and 3 years. Secondary patency rate was 48% at 1 year and 27% at 3 years.
Patient survival rate after alloarterial bypasses was 86% at 1 year and 69% at 3 years. No signs of arterial grafts aneurysmal formation and no need for secondary intervention of any arterial reconstruction was observed during the follow up period in any patient after alloarterial transplantation.Conclusions:
Cold-stored venous and arterial allografts are suitable alternative conduits for limb salvage procedures, vascular prosthesis infections as well as for arterial reconstructions in transplanted patients.Key words:
venous allograft – arterial allograft – immnosuppression – transplantation – prosthetic infection
Autoři: I. Matia; M. Adamec; L. Janoušek; K. Lipár; T. Marada; D. Klein; P. Baláž; M. Varga; J. Chlupáč; S. Rokošný
Působiště autorů: Klinika transplantační chirurgie, Institut klinické a experimentální medicíny, Praha, přednosta: prof. MUDr. Miloš Adamec, CSc.
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 1, s. 45-54.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Cévní alloštěpy rozšiřují možnosti léčby aterosklerotického postižení dolních končetin i možnosti řešení infekcí cévních protéz v cévní chirurgii.Cíl:
Zhodnocení výsledků použití cévních alloštěpů v Institutu klinické a experimentální medicíny.Materiál a metodika:
V období 10/1997–1/2009 jsme použili 112 cévních alloštěpů (30 tepen, 82 žil) u 104 pacientů. Žilní alloštěpy jsme použili při nepřítomnosti autologního materiálu v léčbě kritické ischemie dolních končetin u 75 pacientů (M/Ž 41/34, věk od 41 do 85 let, medián 66 let), u kterých jsme uskutečnili 82 cévních rekonstrukcí. Tepenné štěpy jsme použili v léčbě infekce aortoilických protéz nebo mykotických výdutí břišní aorty u 9 pacientů (M/Ž 8/1, věk od 56 do 77 let, medián 63 let) a v rekonstrukční chirurgii aortoilické oblasti u 20 pacientů po orgánové transplantaci (M/Ž 11/9, věk od 32 do 67 let, medián 56 let).Výsledky:
Přežívání pacientů po transplantaci žil bylo 92 % a 78 % v 1. resp. 3. roce sledování. Zachráněných končetin bylo 67 % a 53 % v 1. resp 3. roce sledování. Sekundární průchodnost allovenózních rekonstrukcí byla 48 % a 27 % v 1. resp. 3. roce sledování. Přežívání pacientů po transplantaci tepen bylo 86 % a 69 % v 1. resp. 3. roce sledování. V průběhu sledování jsme nepozorovali uzávěr ani dilataci žádné transplantované tepny.Závěr:
Použití žilních a tepenných alloštěpů je v indikovaných případech metoda rozšiřující možnosti cévní chirurgie v oblasti léčby kritické ischemie dolních končetin, závažných infekcí cévních protéz jako i v oblasti transplantací parenchymatozních orgánů.Klíčová slova:
žilní allograft – tepenný allograft – imunosuprese – transplantace – infekce protézyPráce řešena grantem MZO 00023001.
ÚVOD
Propojení cévního a transplantačního programu v Institutu klinické a experimentální medicíny v Praze umožňuje použití chladem konzervovaných tepenných i žilních alloštěpů ve specifických indikacích rekonstrukční cévní chirurgie.
V prezentované práci jsou hodnoceny výsledky použití žilních alloštěpů k infrainguinální cévní rekonstrukci u pacientů s kritickou ischemii dolních končetin bez vhodného autologního materiálu. Dále jsou prezentovány výsledky použití tepenných alloštěpů při tepenné rekonstrukci v aortoilické oblasti u transplantovaných pacientů a v léčbě infekcí cévních protéz.
Soubor z období od října 1997 do ledna 2009 se skládal ze 112 cévních alloštěpů (30 tepen, 82 žil) použitých u 104 pacientů. Všechny cévní štěpy byly odebrány v průběhu multiorgánového odběru a konzervovány v běžně užívaných roztocích při 4 °C.
ŽILNÍ ALLOŠTĚPY A INFRAINGUINÁLNÍ REKONSTRUKCE
Pacienti a metody
Chladem konzervované žilní alloštěpy (N = 82) jsme použili jako materiál k infrainguinální cévní rekonstrukci u 76 kriticky ischemických končetin u 75 pacientů (M/Ž 41/34, věk od 46 do 85 let, medián 66 let). Demografické údaje pacientů uvádíme v tabulce 1.
Tab. 1. Charakteristika skupiny 75 pacientů s kritickou ischemii dolní končetiny řešenou cévní rekonstrukcí s použitím žilních alloštěpů Tab. 1. Characteristics of a group of 75 patients with critical, lower extremity ischemia, managed using vascular reconstruction with venous allografts 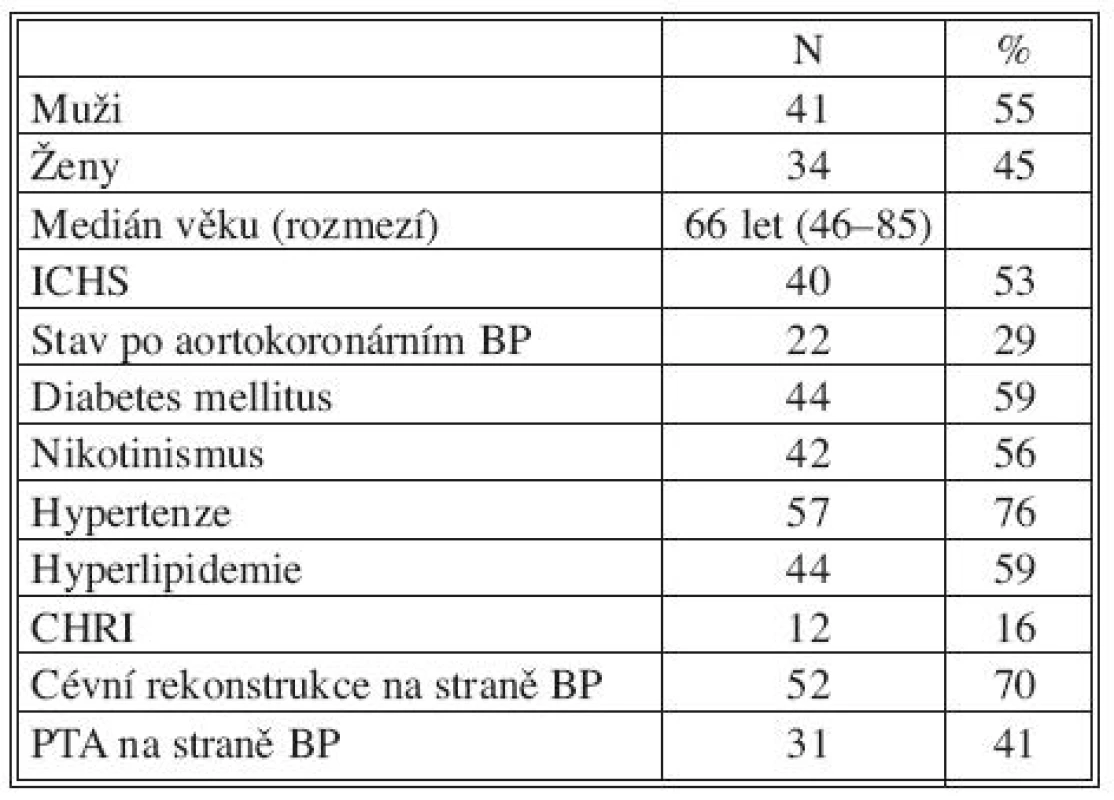
Indikací k cévní rekonstrukci žilním alloštěpem byly klidové bolesti (23 pacientů, 30 %) nebo tkáňové defekty (52 pacientů, 70 %). Cévní rekonstrukci allogenní žilou jsme indikovali jako poslední možnost záchrany končetiny u pacientů, kde nebylo možné použít jejich vlastní ipsilaterální vénu safénu magnu (VSM). Nejčastějším důvodem nepřítomnosti VSM bylo její použití k předchozím cévním rekonstrukcím (46 % pacientů).
Nejčastějším typem infrainguinální cévní rekonstrukce v této skupině 82 rekonstrukcí byl femorokrurální bypas (42,7 %). Podrobné charakteristiky jednotlivých typů allovenózních cévních rekonstrukcí uvádíme v tabulce 2.
Tab. 2. Místo umístění proximální a distální anastomózy u 82 infraingunálních rekonstrukcí žilním alloštěpem Tab. 2. The sites of proximal and distal anastomoses in 82 infrainguinal reconstructions using venous allografts 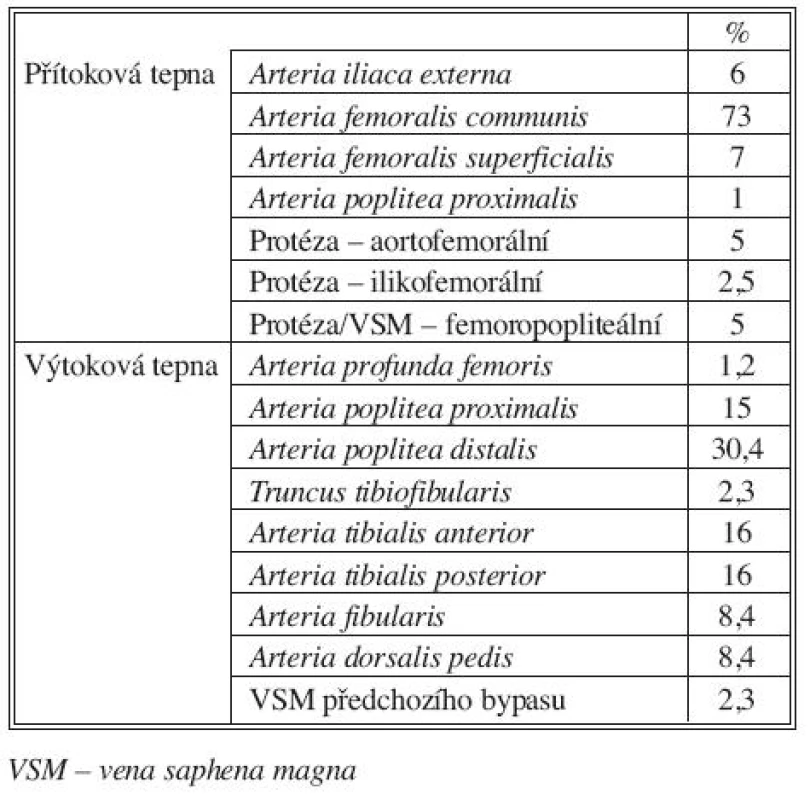
Pacienty indikované k transplantaci žíly jsme zařadili na čekací listinu. Vyžadovali jsme shodu v krevní skupině ABO systému mezi dárcem a příjemcem. HLA typizaci ani cross match jsme u těchto pacientů neprováděli. Žíly jsme získávali v průběhu multiorgánového odběru a uchovávali je v standardních konzervačních roztocích bez antibiotik. Medián věku dárce byl v této skupině pacientů 50 let (rozmezí 18–70 let). Medián času studené ischemie byl v této skupině pacientů 66 hodin (rozmezí 5–312 hodin). Medián času příjemce čekajícího na allogenní žílu po zařazení na čekací listinu byl 13 dní (rozmezí 1–137 dní).
Imunosupresivní terapie nebyla u cévních rekonstrukcí provedených v období do září 2004 (25 rekonstrukcí, 31%) standardizována. Pacienti užívali prednison, azatioprin, cyklosporín A, nebo byli bez imunosuprese.
Od září 2004 jsme začali jako imunosupresi používat takrolimus (57 rekonstrukcí, 69 %). Medián koncentrace takrolimu v době dimise po transplantaci byl 5,5 μg/l (rozmezí 2,0–11,0 μg/l). Imunosuprese byla podávána po celou dobu průchodnosti rekonstrukce.
Typy antiagregační a/nebo antikoagulační léčby u průchodných rekonstrukcí v době dimise (75 z 82 rekonstrukcí, 91,5 %) uvádíme v tabulce 3.
Tab. 3. Typy antiagregační nebo/a antikoagulační léčby u 75 infrainguinálních rekonstrukcí žilním alloštěpem průchodných v době dimise Tab. 3. Types of antiaggregation or/and anticoagulation therapy in 75 infrainguinal reconstructions using venous allografts, patent at hospital discharge 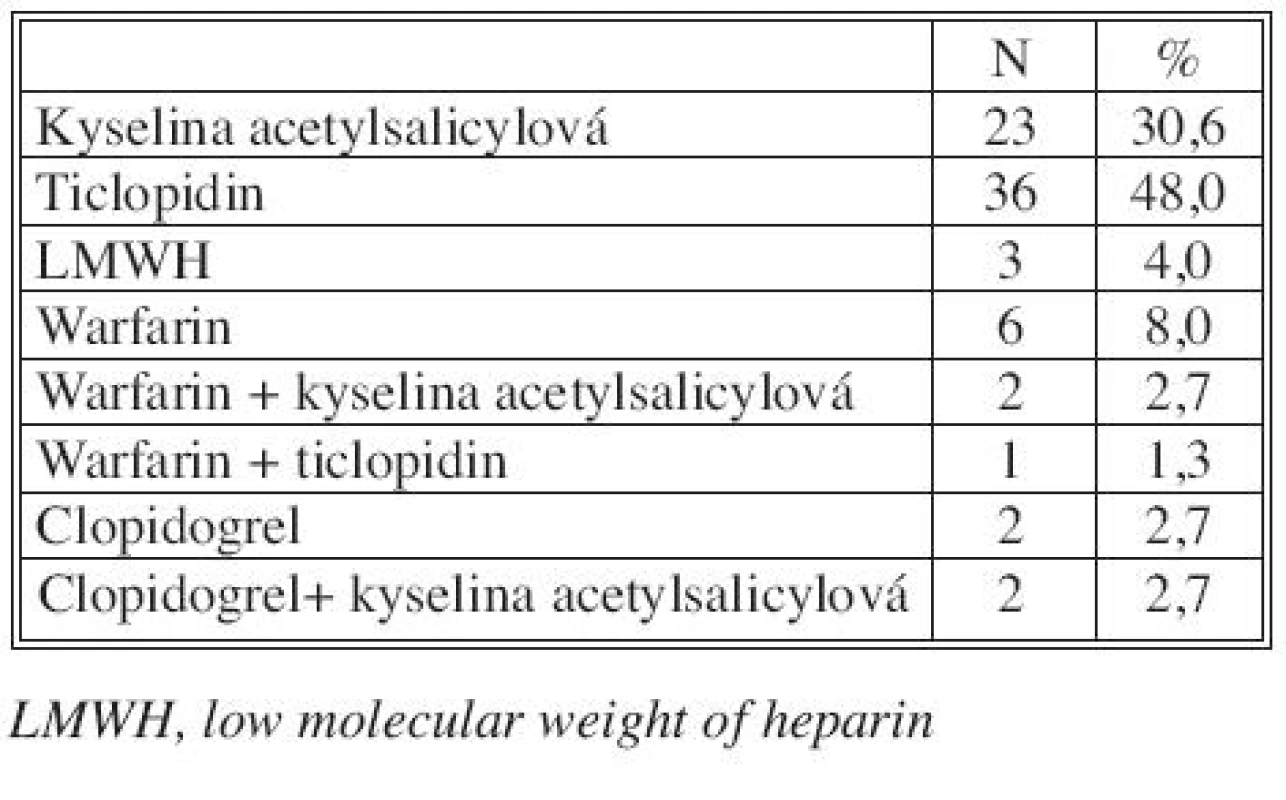
Pacienty v této skupině jsme sledovali v rozsahu 2 týdnů až 74 měsíců (medián 19 měsíců). Doba sledování byla vymezená datem operace a datem úmrtí, nebo datem poslední zaručené informace o stavu pacienta. V průběhu sledování jsme u pacientů kontrolovali klinický stav, průchodnost rekonstrukcí (klinicky, ultrasonograficky (USG), počítačovou angiografií (CTA), dále sérové koncentrace imunosuprese a renální funkce.
Výsledky
Úmrtí, morbidity a přežívání pacientů
Přežívaní pacientů, zachráněné končetiny i průchodnosti rekonstrukcí jsme analyzovali Kaplanovou-Maierovou metodou (± SE).
V průběhu hospitalizace došlo k úmrtí jednoho pacienta (1,3 %) v důsledku srdečné zástavy při hyperkalémii. U tří pacientů (4,0 %) došlo k manifestaci ischemické choroby srdce (akutní infarkt myokardu u 2 pacientů, angina pectoris u 1 pacienta). U všech proběhla intervence (aortokoronární bypas u jednoho pacienta a koronaroplastika u 2 pacientů). U jednoho pacienta (1,3 %) došlo k akutnímu krvácení z vředu žaludku, který byl řešen konzervativně.
Přežívání pacientů 6 měsíců po operaci bylo 93,6 ± 3,3 %, 12 měsíců po operaci 91,5 ± 4,0 %, 24 měsíců po operaci 82,9 ± 6,5 % a 36 měsíců po operaci 78,0 ± 8,9 %. Křivku přežití pacientů uvádíme v grafu 1.
Graf 1. Křivka přežití pacientů po tepenné rekonstrukci chladem konzervovanými žilními alloštěpy. Metoda Kaplan-Maier Graph 1. The patients survival curve, following arterial reconstructions using cold-preserved venous allografts. The Kaplan-Maier method 
Chirurgické komplikace
Po 18 rekonstrukcích (22 %) z této skupiny pacientů došlo ke chirurgickým komplikacím v období do 30 dnů po operaci. Infekci rány v třísle s jeho dehiscencí jsme pozorovali u 5 rekonstrukcí (6,1 %), krvácení v ráně bez nutnosti chirurgické revize u 2 rekonstrukcí (2,4 %), krvácení s nutností chirurgické revize u 2 rekonstrukcí (2,4 %), infekci žilního bypasu s rupturou nebo pseudovýdutí u 2 rekonstrukcí (2,4 %), časný uzávěr rekonstrukce u 6 rekonstrukcí (7,3 %), uzávěr výtokové tepny s nutností prodloužení bypasu u jedné rekonstrukce (1,2 %).
Záchrana končetiny a průchodnost žilních rekonstrukcí
Zachráněných končetin bylo po 1 měsíci 92,4 ± 3,0 %, po 6 měsících 73,0 ± 5,4 %, po 12 měsících 66,6 ± 6,0 %, po 24 měsících 59,2 ± 6,8 % a po 36 měsících 52,9 ± 9,1 %. Grafickou podobu záchrany končetiny uvádíme v grafu 2.
Graf 2. Křivka zachráněných končetin po tepenné rekonstrukci chladem konzervovanými žilními alloštěpy. Metoda Kaplan-Maier Graph 2. A curve depicting rates of saved extremities following arterial reconstructions using cold-stored venous allografts. The Kaplan-Maier method 
Primární průchodnost rekonstrukcí byla po 1 měsíci 82,9 ± 4,2 %, po 6 měsících 49,9 ± 5,8 %, po 12 měsících 37,6 ± 5,8 %, po 24 měsících 29,9 ± 5,8 % a po 36 měsících 19,4 ± 6,3 %. Grafickou podobu primární průchodnosti allovenózních rekonstrukcí uvádíme v grafu 3.
Graf 3. Primární průchodnost infrainguinálních tepenných rekonstrukci pomocí chladem konzervovaných žilních alloštěpů. Metoda Kaplan-Maier Graph 3. Primary patency of infrainguinal arterial reconstructions using cold-preserved venous allografts. The Kaplan-Maier method 
Sekundární průchodnost rekonstrukcí byla po 1 měsíci 82,9 ± 4,2 %, po 6 měsících 59,8 ± 5,8 %, po 12 měsících 47,5 ± 6,3 %, po 24 měsících 36,2 ± 7,0 % a po 36 měsících 26,9 ± 7,7 %. Grafickou podobu sekundární průchodnosti allovenózních rekonstrukcí uvádíme v grafu 4.
Graf 4. Sekundární průchodnost infrainguinálních tepenných rekonstrukci pomocí chladem konzervovanými žilních alloštěpů. Metoda Kaplan-Maier Graph 4. Secondary patency of infrainguinal arterial reconstructions using cold-preserved venous allografts. The Kaplan-Maier method 
TEPENNÉ ALLOŠTĚPY V LÉČBĚ PROTETICKÝCH INFEKCÍ A MYKOTICKÝCH VÝDUTÍ
Pacienti a metody
Tepenné štěpy (N = 10) jsme použili v léčbě infekcí aortoilických protéz nebo mykotických výdutí břišní aorty u 9 pacientů (M/Ž 8/1, věk od 56 do 77 let, medián 63 let). Indikací k cévní rekonstrukci tepenným štěpem byla infekce cévní protézy (N = 6), infekce stentgraftu (N = 1) nebo mykotická výduť břišní aorty (N = 3). Podrobné charakteristiky jednotlivých pacientů, operačních výkonů, transplantovaných tepen a doby sledování uvádíme v tabulce 4 a 5.
Tab. 4. Charakteristika pacientů s infekcí cévní protézy nebo stentgraftu léčených transplantací tepny Tab. 4. Characteristics of patients with vascular prosthesis or stentgraft infections, managed by arterial transplantation 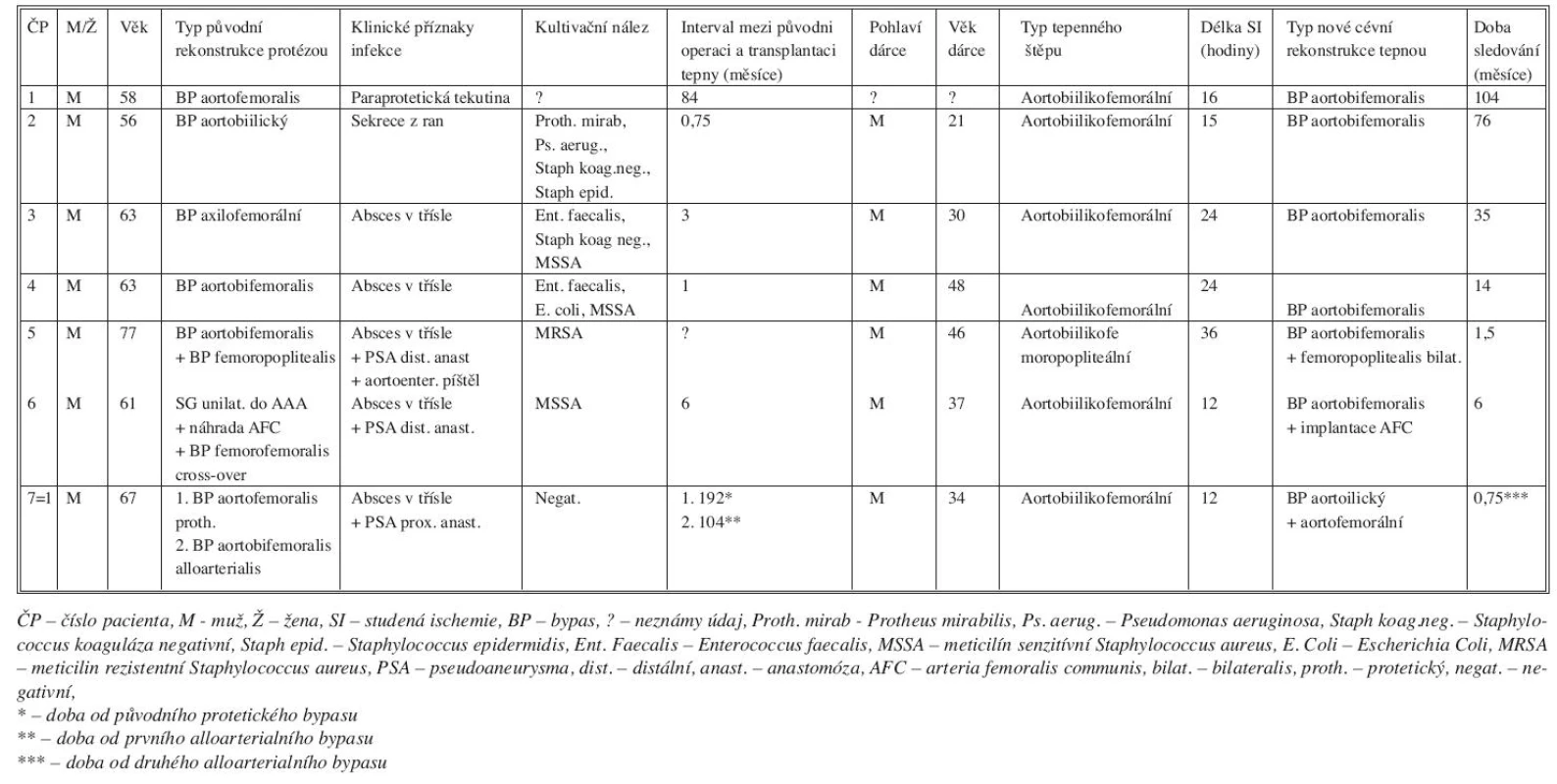
Tab. 5. Charakteristika pacientů s mykotickou výdutí břišní aorty léčených transplantací tepny Tab. 5. Characteristics of patients with mycotic AAA, treated with arterial transplantation 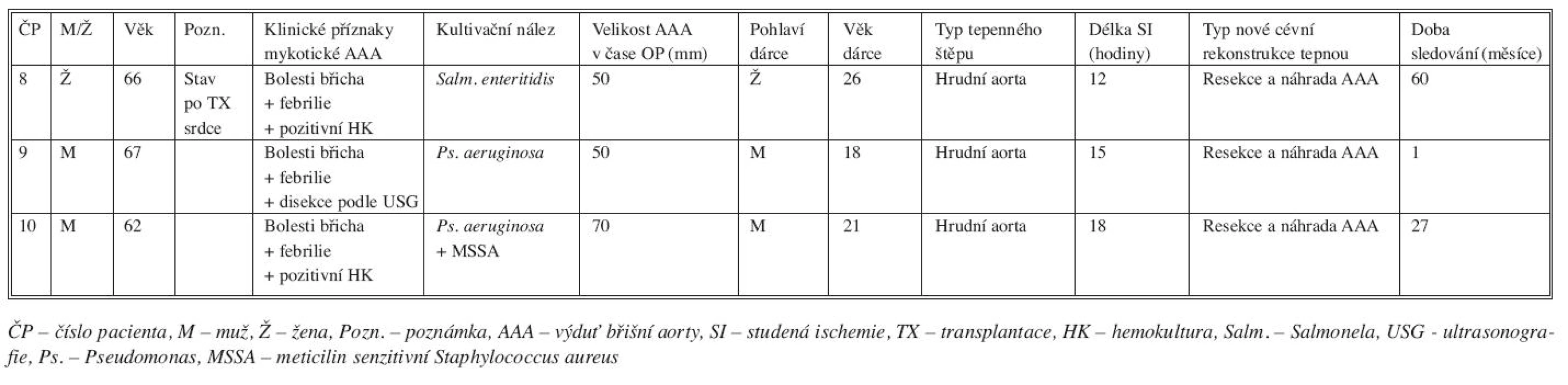
Pacienty indikované k transplantaci tepny jsme zařadili na čekací listinu. Vyžadovali jsme shodu v krevní skupině ABO systému mezi dárcem a příjemcem. HLA typizaci ani cross match jsme u těchto pacientů neprováděli. Tepny jsme získávali v průběhu multiorgánového odběru a uchovávali v standardních konzervačních roztocích bez antibiotik. Medián věku dárce byl v této skupině pacientů 30 let (rozmezí 18–48 let). Medián času studené ischemie byl v této skupině pacientů 15,5 hodiny (rozmezí 12–36 hodin).
V pooperačním období jsme pacientům podávali imunosupresivní léčbu. Do září 2004 jsme používali cyklosporín A, který užívalo 5 pacientů (včetně pacientky po transplantaci srdce (pacient 8), která byla suprimována ještě prednisonem a mykofenolát mofetilem). Medián koncentrace cyklosporinu A v prvním roce po transplantaci byl 102 ng/ml (rozmezí 73–189 ng/ml). U dvou pacientů (pacient 2, pacient 10) jsme v 13. resp. 15. měsíci nahradili cyklosporin A, vzhledem k jeho nefrotoxickým účinkům, sirolimem.
Od září 2004 jsme začali jako imunosupresi používat takrolimus. Takto jsme léčili 3 pacienty propuštěné po operaci do domácí péče. Medián koncentrace takrolimu v prvním roce po transplantaci byl 6,0 μg/l (rozmezí 2,2–16,6 μg/l).
Jako antitrombotickou léčbu u pacientů propuštěných do domácí péče (N = 8) jsme použili kyselinu acatylsalicilovou (N = 5), tiklopidin (N = 2), nebo indobufen (N = 1).
Pacienty v této skupině jsme sledovali v rozsahu 6 týdnů až 104 měsíců (medián 27 měsíců). Doba sledování byla vymezená datem operace a datem úmrtí, nebo datem poslední zaručené informace o stavu pacienta. V průběhu sledování jsme u pacientů kontrolovali klinický stav, průchodnost rekonstrukcí (klinicky, ultrasonograficky (USG), počítačovou angiografií (CTA), dále sérové koncentrace imunosuprese a renální funkce.
Výsledky
Úmrtí
V průběhu sledování zemřelo do ledna 2009 6 pacientů (66 %).
Pacient u kterého jsme použili 2 tepenné allografty s odstupem 103 měsíců (pacient 1 i 7), zemřel 3 týdny po druhé transplantaci na multiorgánové selhání při protrahovaném septickém stavu. V období mezi transplantacemi se u něho 2x objevily abscesy v levém třísle. Důvodem byla ponechaná malá část původního protetického bypasu v oblasti proximální anastomózy, na které docházelo k opakovaným exacerbacím infekce. Původní tepenný štěp byl při jeho explantaci rovněž se známkami infekce.
Jeden pacient po resekci a náhradě mykotické AAA s disekcí (pacient 9) s komplikovaným pooperačním průběhem ve smyslu opakovaných revizí pro krvácení a močové píštěle, zemřel při šesté revizi pro chirurgicky neošetřitelné krvácení při ruptuře tepenného štěpu 6 týdnů po primární operaci.
Jeden pacient po našití aortobifemoropopliteálního bypasu pro infekci původního aortobifemorálního a femoropopliteálního bypasu (pacient 5) s rozvojem aortoduodenální píštěle spolu s pozitivním nálezem meticilín rezistentního Stafylokoka aurea (MRSA) v ranách a s opakovanými revizemi pro krvácení po transplantaci tepny zemřel na multiorgánové selhání při protrahovaném septickém stavu 6 týdnů po transplanataci.
Jeden pacient po extrakci infikované protézy a její náhradě aortobifemorálním tepenným štěpem (pacient 4) zemřel na následky cévní mozkové příhody 14 měsíců po transplantaci.
Jeden pacient po náhradě mykotické AAA hrudní aortou dárce (pacient 10) zemřel pro tumor pankreatu 27 měsíců po operaci.
Pacientka po transplantaci srdce a následné náhradě mykotické AAA (pacient 8) zemřela na bronchopneumonii 60 měsíců po tepenné transplantaci.
Chirurgické komplikace
U jednoho pacienta (pacient 2) se po náhradě infikovaného aortobifemorálního protetického bypasu tepenným štěpem rozvinula v časném pooperačním období výrazná lymfatická sekrece z drénů s hypoalbuminémií a otoky, která byla léčená konzervativně. V dalším průběhu došlo k rozvoji kýly v jizvě po retroperitoneotomii, kterou jsme ošetřili plastikou síťkou 16 měsíců po transplantaci tepny.
U pacienta s infekcí axilofemorálního protetického bypasu (pacient 3) se po transplantaci aortobifemorálního tepenného štěpu rozvinula lymfatická sekrece v tříslech, která si vynutila chirurgickou revizi 2 týdny po transplantaci.
U dalšího pacienta po transplantaci aortobiilikofemorálního štěpu pro infekci původního protetického bypasu (pacient 4) došlo peroperačně k poranění močovodu s nutností jeho rekonstrukce na JJ stentu s dobrým klinickým efektem.
Pacient s infekcí unilaterálního stentgraftu implantovaného do AAA s jeho následnou extrakcí a našitím tepenného aortobifemorálního bypasu spolu s implantací pravé renální tepny (pacient 6) byl revidován časně po transplantaci pro krvácení z oblasti proximální anastomózy a levé renální tepny. V dalším průběhu došlo k dehiscenci rány v třísle s nutností transpozice musculus sartorius a resutury rány.
Průchodnost tepenných rekonstrukcí
V průběhu sledování byla primární průchodnost rekonstrukcí 100%. Ani u jedné transplantované tepny jsme nepozorovali její aneuryzmatickou dilataci známou z historie použití tepen v této indikaci.
TEPENNÉ ALLOŠTĚPY A AORTOILICKÉ REKONSTRUKCE U TRANSPLANTOVANÝCH PACIENTŮ
Pacienti a metody
Chladem konzervované tepenné alloštěpy (N = 20) jsme použili jako materiál k cévní rekonstrukci v aortoilické oblasti u 20 transplantovaných pacientů (M/Ž 11/9, věk od 32 do 67 let, medián 56 let).
Indikací k cévní rekonstrukci byla klinicky manifestní aortoilická stenóza resp. okluze (14 pacientů) nebo výduť břišní aorty (6 pacientů).
U 13 pacientů z této skupiny jsme provedli aortoilickou rekonstrukci současně s transplantací kadaverózní ledviny. U zbylých 7 pacientů jsme uskutečnili aortoilickou rekonstrukci až s určitým časovým odstupem po orgánové transplantaci.
Podrobné charakteristiky jednotlivých skupin pacientů, operačních výkonů a transplantovaných tepen uvádíme v tabulce 6 a 7.
Tab. 6. Charakteristika pacientů s výdutí břišní aorty řešené její resekci a náhradou tepenným alloštěpem Tab. 6. Characteristics of patients with AAA, managed by resection and arterial allograft implantation 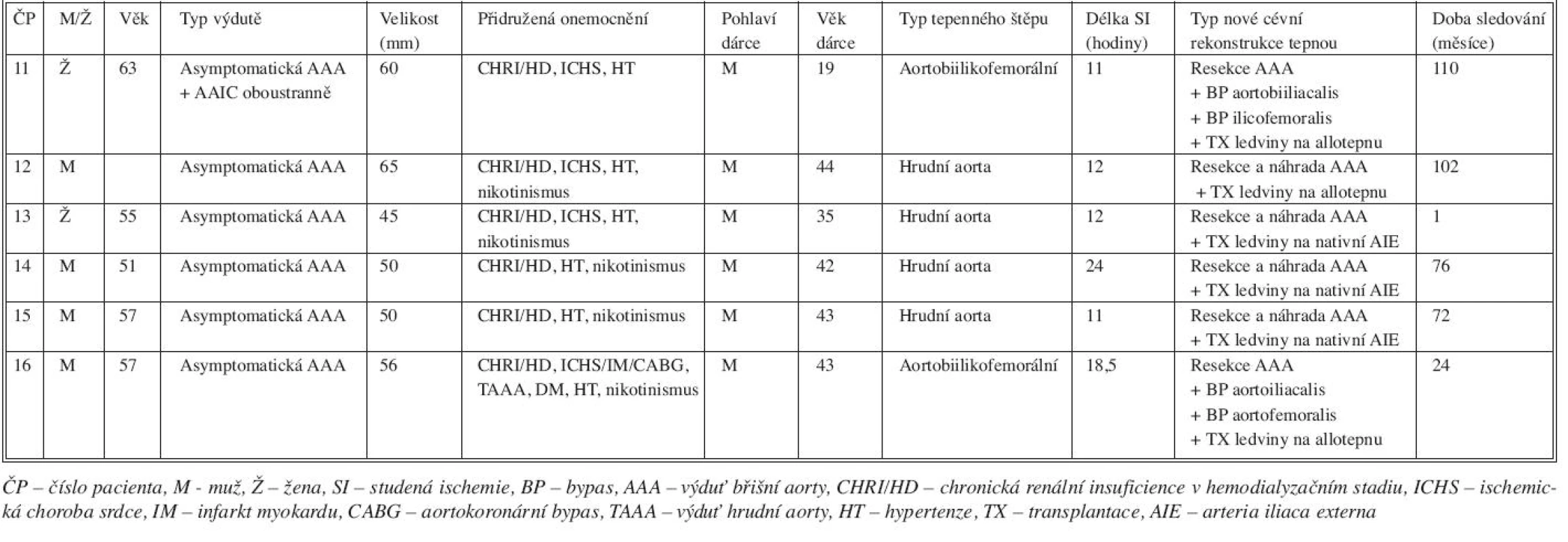
Tab. 7. Charakteristika skupiny 14 pacientů se stenózou nebo okluzí pánevních tepen řešených cévní rekonstrukcí s použitím tepenných alloštěpů Tab. 7. Characteristics of a group of 14 patients with stenosis or occlussion of pelvic arteries, managed by vascular reconstructions with arterial allografts 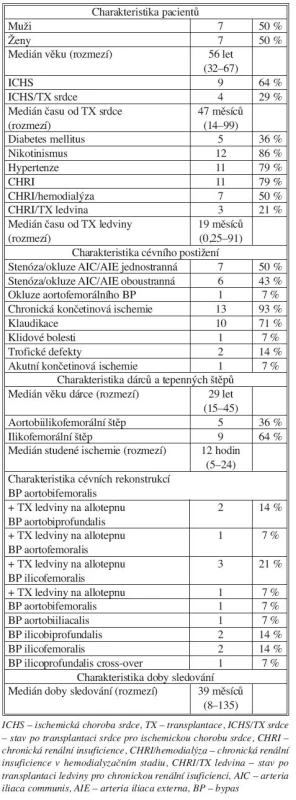
Pacienty indikované k současné transplantaci tepny a ledviny jsme zařadili na čekací listinu do zvláštního pořadí. Ledvinu i tepnu k transplantaci jsme použili od stejného dárce. Mezi dárcem a příjemcem jsme vyžadovali shodu v krevní skupině ABO systému. HLA typizace dárce a cross match mezi příjemcem a dárcem jsme prováděli až po transplantaci. U pacientů s již transplantovaným srdcem nebo ledvinou jsme HLA typizaci ani cross match nevyžadovali.
Tepny i ledviny jsme získávali v průběhu multiorgánového odběru, uchovávali je v standardních konzervačních roztocích bez antibiotik. Medián věku dárce byl v této skupině pacientů 35 let (rozmezí 15–45 let). Medián času studené ischemie tepen byl v této skupině pacientů 12 hodin (rozmezí 5–24 hodin). Medián studené ischemie ledvin u pacientů se současnou transplantací tepny a ledviny byl 14 hodin (rozmezí 7–26 hodin).
Imunosupresivní schemata se u těchto pacientů řídila podle druhu transplantovaného orgánu (ledvina, srdce). Transplantace tepny neměla na výběr imunosuprese vliv.Typy imunosupresivních protokolů u všech 20 pacientů v čase propuštění do domácí péče uvádíme v tabulce 8.
Tab. 8. Typy imunosupresivní terapie u 20 pacientů s transplantovaným orgánem (ledvina, srdce) a cévní rekonstrukcí tepenným alloštěpem Tab. 8. Types of immunosuppression therapy in 20 patients with organ transplants (kidney, lungs) and vascular reconstructions with arterial allografts 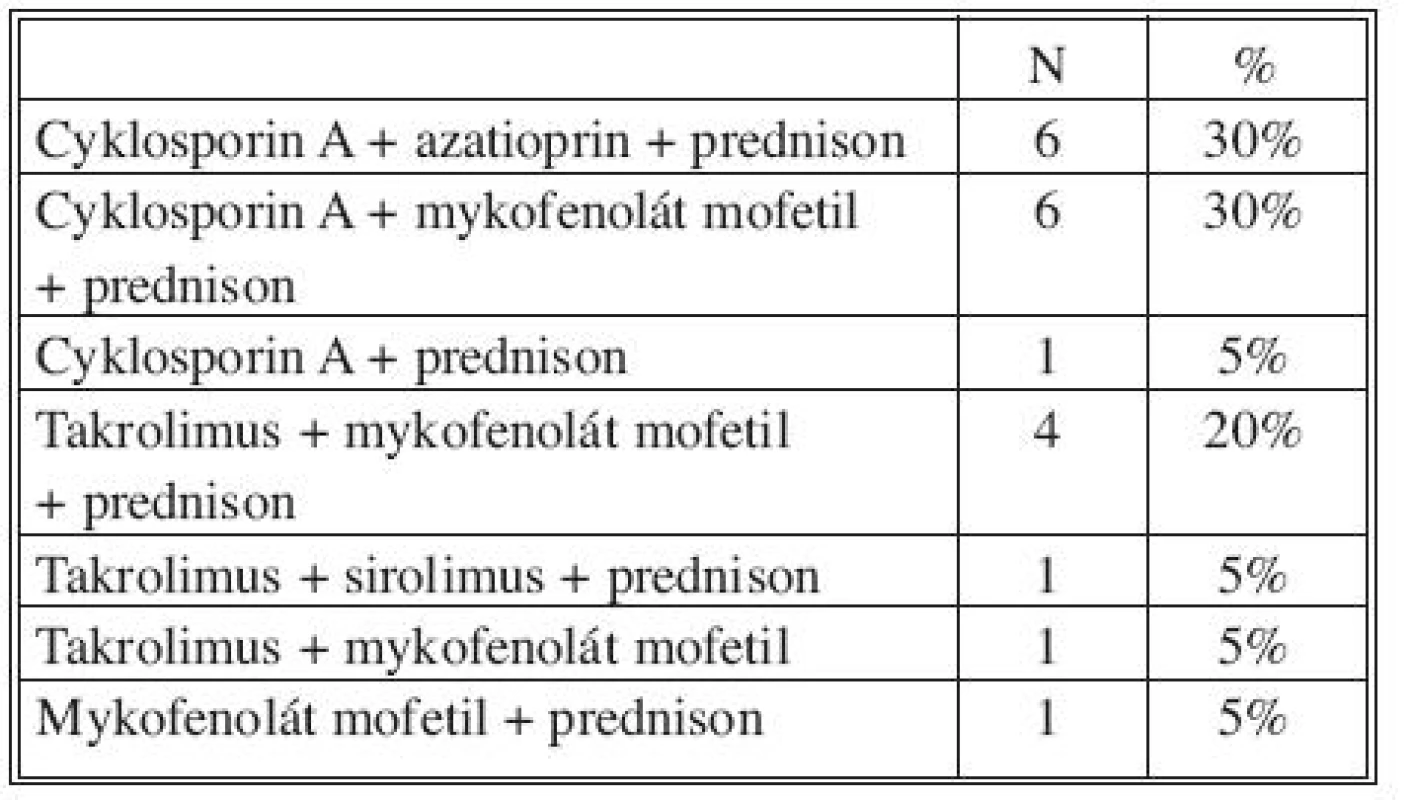
V antitrombotické léčbě u pacientů propuštěných do domácí péče z této skupiny (N = 20) jsme použili kyselinu acatylsalicilovou (N = 12), tiklopidin (N = 1), indobufen (N = 2), warfarin (N = 1), sulodexid (N = 1). Tři pacienti byli při propuštění bez antiagregační terapie.
Pacienty v této skupině jsme sledovali v rozsahu 1 týdne až 135 měsíců (medián 47,5 měsíce). Doba sledování byla vymezená datem operace a datem úmrtí, nebo datem poslední zaručené informace o stavu pacienta. V průběhu sledování jsme u pacientů kontrolovali klinický stav a průchodnost rekonstrukcí (klinicky, ultrasonograficky (USG), počítačovou angiografií (CTA).
Výsledky
Úmrtí
V průběhu sledování zemřelo do ledna 2009 10 pacientů (50 %).
Pět pacientů (3 s transplantovanou ledvinou, 2 s transplantovaným srdcem) zemřeli na maligní novotvar 8, 26, 37, 63 a 103 měsíců po cévní rekonstrukci tepenným alloštěpem.
Dva pacienti po současné cévní rekonstrukci a transplantaci ledviny zemřeli v důsledku perforovaného nebo krvácejícího gastroduodenálního vředu 1 a 32 měsíců po operaci.
Jeden pacient po současném aortofemorálním bypasu a transplantaci ledviny zemřel 27 měsíců po operaci na následky cévní mozkové příhody
Jedna pacientka po ilikoprofundálním BP zemřela na multiorgánové selhání při septickém stavu v důsledku infekce amputačního pahýlu 19 měsíců po tepenné transplantaci.
U jedny pacientky po transplantaci srdce s následným ilikofemorálním bypasem došlo k náhlému úmrtí 67 měsíců po srdeční a 53 měsíců po tepenné transplantaci. Přesnou příčinu smrti se nám nepodařilo zjistit.
Chirurgické komplikace
U 6 pacientů (30 %) z této skupiny došlo ke chirurgickým komplikacím v časném pooperačním průběhu.
U 3 pacientů po současné pánevní rekonstrukci a transplantaci ledviny se rozvinula porucha hojení rány (2x dehiscence s nutností revize a resutury, 1x lymfatická sekrece řešená konzervativně).
U 2 pacientů po primární cévní rekonstrukci v oblasti pánve došlo k rozvoji akutní ischemie končetin s nutností periferní rekonstrukce. U jednoho pacienta po simultánním aortofemorálním allotepenném bypasu a transplantaci ledviny spolu s kontralaterální plastikou arteria profunda femoris allotepennou záplatou došlo k uzávěru v místě plastiky s nutností provedení femoropopliteálního protetického bypasu 10 dní po primární operaci. U jedné pacientky s ilikobiprofundálním allotepenným bypasem provedeným akutně týden po transplantaci ledviny došlo k prohlubováni ischemie dolní končetiny ve včasném období po allotepenné rekonstrukci. Tu jsme řešili novým krurálním bypasem allovenozním štěpem s dobrým efektem.
U jednoho pacienta po resekci a náhradě AAA tepenným štěpem a současné transplantaci ledviny došlo k rozvoji ischemické kolitídy. Komplikaci jsme řešili subtotální kolektomii s přechodnou ileostomií. I přes závažný peroperační nález sterkorální peritonitídy se nám podařilo zachránit nejen pacienta, ale i tepenný a ledvinný štěp. Tuto kazuistiku jsme v minulosti již publikovali [1].
Pozdní chirurgické komplikace jsme pozorovali u 4 pacientů (20 %).
Kýla v ráně po laparo - nebo retroperitoneotomii se rozvinula u 3 pacientů (z toho u dvou, kteří měli pooperační poruchu hojení rány).
U jedné pacienty po ilikoprofundálním allotepenném bypasu pro gangrénu palce došlo i přes cévní rekonstrukci ke zhoršování ischemie s nutností amputace ve stehně 4 měsíce po pánevní rekonstrukci.
Průchodnost tepenných rekonstrukcí
V průběhu sledování byla primární průchodnost rekonstrukcí 100%. Ani u jedné transplantované tepny jsme opět nepozorovali její dilataci.
DISKUSE
V prezentované práci hodnotíme naše zkušenosti s chladem konzervovanými tepennými a žilními alloštěpy v cévní chirurgii. Tyto štěpy znamenaly nové možnosti v léčbě aterosklerotického postižení dolních končetin i řešení infekčních komplikací po použití klasických umělých protéz.
Využití cévních alloštěpů není v chirurgii novinkou. Cévní alloštěpy vlastně stály při zrodu rekonstrukční chirurgie tepen na začátku 20. století [2, 3, 4]. Špatné dlouhodobé výsledky z 50. a 60. let minulého století ale vedly ke ztrátě zájmu o tuto náhradu a cévní chirurgii ovládly umělé cévní protézy [5, 6]. V 80. letech minulého století ale život ohrožující infekce právě umělých cévních protéz znamenaly renesanci zájmu o allogenní cévní materiál [7, 8].
V současnosti se na žilní i tepenné alloštěpy již hledí jako na tkáň vyvolávající imunitní odpověď podobnou rejekčním procesům vznikajícím u pacientů po transplantaci parenchymatózních orgánů [9, 10]. Jejich imunogenicita je podmíněná zejména expresí HLA antigenů třídy I i II v jejich stěně [11]. I přesto není použití imunosuprese po jejich transplantaci ve světě všeobecně běžné a přístup jednotlivých center se pohybuje od jejího absolutního odmítání [8] až po použití v trojkombinaci obdobně jako je tomu po orgánové transplantaci [12].
Naše pracoviště se vzhledem ke klinickým [1, 13–17] i experimentálním zkušenostem s tepennými [18] i žilními štěpy (zatím nepublikovaná studie) jednoznačně kloní k použití imunosuprese po transplantaci chladem konzervovaných cév. Podrobně o této problematice i o výhodách použití imunosupresiva takrolimu (FK506) v cévní chirurgii diskutujeme v našich předchozích publikacích [18, 15].
Na celkový výsledek transplantace cévních alloštěpů má kromě imunosuprese vliv také kvalita štěpů v době transplantace. Ta je ovlivněná zejména časem studené ischemie [19]. V našem souboru byl medián času studené ischemie tepen 15 hodin. Tato doba je bezpečná i pro transplantaci ledviny. Proto nepředpokládáme, že by měla významně ovlivnit výsledky transplantace tepen. U žilních alloštěpů byl medián času studené ischemie podstatně vyšší, a to 66 hodin. Tento fakt je způsoben organizací odběrů a transplantací orgánů, kdy transplantace parenchymatózních orgánů je nutné provést co nejdříve v přesně definovaných časových intervalech. Žilní transplantace je tak prováděná jako poslední. Délka studené ischemie je proto určitě jeden z faktorů, který negativně ovlivňuje celkové výsledky cévních rekonstrukcí žilními alloštěpy. Podrobně o této problematice diskutujeme v naší předchozí publikaci [15].
Pacienti po transplantaci životně důležitých orgánů jsou vzhledem k doživotnímu podávání imunosuprese vhodnými příjemci allogenních cév. V současnosti dáváme přednost použití tepenných allograftů v aortoilické oblasti a použití žilních allograftů v oblasti infrainguinální. Tuto problematiku podrobně diskutujeme v naších předchozím publikacích [13, 14, 17].
ZÁVĚR
Závěrem lze konstatovat, že použití chladem konzervovaných tepen a žil má pevné místo v našich současných léčebných metodách. Při použití imunosupresivní terapie po těchto výkonech se opíráme o vlastní klinické i experimentální zkušenosti.
Seznam zkratek
AAA - výduť břišní aorty AFC - arteria femoralis communis AIC - arteria iliaca communis AIE - arteria iliaca externa anast. - anastomóza bilat. - bilateralis BP - bypas CABG - aortokoronární bypas dist. - distální E. Coli - Escherichia Coli Ent. Faecalis - Enterococcus faecalis HK - hemokultura HT - hypertenze CHRI - chronická renální insuficience CHRI/HD - chronická renální insuficience v hemodialyzačním stadiu CHRI/TX ledvina - stav po transplantaci ledviny pro chronickou renální isuficienci, ICHS – ischemická choroba srdce ICHS/TX srdce - stav po transplantaci srdce pro ischemickou chorobu srdce IM - infarkt myokardu LMWH - low molecular weight of heparin – nízkomolekulární heparin MRSA - meticilin rezistentní Staphylococcus aureus MSSA - meticilin senzitivní Staphylococcus aureus negat. - negativní proth. - protetický Proth. mirab - Protheus mirabilis Ps. - Pseudomonas Ps. aerug. - Pseudomonas aeruginosa PSA - pseudoaneuryzma PTA - perkutánní transluminální angioplastika Salm. - Salmonela SE - standard error SI - studená ischemie Staph epid. - Staphylococcus epidermidis Staph koag.neg. - Staphylococcus koaguláza negativní TAAA - výduť hrudní aorty TX - transplantace USG - ultrasonografie VSM - vena saphena magna MUDr. Ivan Matia, Ph.D.
U Kamýku 284/11
142 00 Praha 4
e-mail: ivmi@ikem.cz
Zdroje
1. Matia, I., Adamec, M., Fronek, J., et al. Ischemia of the large intestine after simultaneous kidney transplantation and aortic replacement with a fresh graft in an abdominal aortic aneurysm. Rozhl. Chir., 2004; 83 : 121–127.
2. Carrel, A. Ultimate results of aortic transplantation. J. Exp. Med., 1912; 15 : 389–398.
3. Gross, R. E., Bill, A. H., Jr., Peirce, E. C., Jr. Methods for preservation and transplantation of arterial grafts; observations on arterial grafts in dogs; report of transplantation of preserved arterial grafts in nine human cases. Surg. Gynecol. Obstet, 1949; 88 : 689–701.
4. Dubost, C., Allary, M., Oeconomos, N. Resection of an aneurysm of the abdominal aorta: Reestablishment of the continuity by a preserved human arterial graft, with result after five months. AMA Arch. Surg., 1952; 64 : 405–408.
5. Szilagyi, D. E., Rodriguez, F. J., Smith, R. F. et al. Late fate of arterial allografts. Observations 6 to 15 years after implantation. Arch. Surg., 1970; 101 : 721–733.
6. Meade, J. W., Linton, R. R., Darling, R. C., et al. Arterial homografts. A long-term clinical follow-up. Arch. Surg., 1966; 93 : 392–399.
7. Bahnini, A., Ruotolo, C., Koskas, F., et al. In situ fresh allograft replacement of an infected aortic prosthetic graft: Eighteen months_ollow-up. J. Vasc. Surg., 1991; 14 : 98–102.
8. Kieffer, E., Gomes, D., Chiche, L., et al. Allograft replacement for infrarenal aortic graft infection: Early and late results in 179 patients. J. Vasc. Surg., 2004; 39 : 1009–1017.
9. Carpenter, J. P., Tomaszewski, J. E. Human saphenous vein allograft bypass grafts: Immune response. J. Vasc. Surg., 1998; 27 : 492–499.
10. Mirelli, M., Stella, A., Faggioli, G. L., et al. Immune response following fresh arterial homograft replacement for aortoiliac graft infection. Eur. J. Vasc. Endovasc. Surg., 1999; 18 : 424–429.
11. Lopez-Cepero, M., Sanders, C. E., Buggs, J. et al. Sensitization of renal transplant candidates by cryopreserved cadaveric venous or arterial allografts. Transplantation, 2002; 73 : 817–819.
12. Prager, M., Holzenbein, T., Aslim, E., et al. Fresh arterial homograft transplantation: A novel concept for critical limb ischaemia. Eur. J. Vasc. Endovasc. Surg., 2002; 24 : 314–321.
13. Adamec, M., Matia, I., Janousek, L., et al. Renal transplantation in patients with abdominal aortic aneurysm – a new surgical approach. Transpl. Int., 2004; 17 : 647–650.
14. Matia, I., Adamec, M., Janousek, L., et al. Fresh arterial grafts as conduits for vascular reconstructions in transplanted patients. Eur. J. Vasc. Endovasc. Surg., 2006; 32 : 549–556.
15. Matia, I., Janousek, L., Marada, T., et al. Cold-stored venous allografts in the treatment of critical limb ischaemia. Eur. J. Vasc. Endovasc. Surg., 2007; 34 : 424–431.
16. Matia, I., Adamec, M., Varga, M., et al. Aortoiliac reconstruction with allograft and kidney transplantation as a one-stage procedure: Long term results. Eur. J. Vasc. Endovasc. Surg., 2008; 35 : 353–357.
17. Matia, I., Pirk, J., Lipar, K., et al. Successful surgical treatment of multilevel aortic aneurysms combined with renal transplantation. J. Vasc. Surg., 2009; 50 : 198–201.
18. Matia, I., Lodererova, A., Adamec, M. Delayed administration of FK 506 is sufficient to suppress acute rejection changes after aortal transplantation in rats. Transpl. Int., 2007; 20 : 371–380.
19. Stadler, P., Sebesta, P., Klika, T., et al. Allografts in the vascular surgery. Rozhl. Chir., 2005; 84 : 350–355.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Prevence endoleaku II. typu pomocí peroperačního coilingu vaku aneuryzmatu abdominální aorty během implantace stentgraftu
- Případ kombinace endoleaku Ib a IIIa typu po zavedení stentgraftu pro subrenální výduť aorty
- Současné možnosti roboticky asistované cévní chirurgie
- Příspěvek k diagnostice infekce cévní protézy
- Autogenní vena femoralis superficialis jako náhrada infikované aorto-iliako-femorální cévní protézy
- Operace na vnitřních karotidách v lokoregionální anestezii na chirurgické klinice v Plzni za uplynulých 7 let. Diskuse nad AHA a ESVS guidelines
- Klinické zkušenosti s použitím chladem konzervovaných žilních a tepenných alloštěpů: dlouhodobé výsledky
- Pedální bypass – desetileté zkušenosti
- Vícenásobná sekvenční revaskularizace infrapopliteálních tepen při záchraně kriticky ischemické končetiny
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Výsledky kombinované chirurgické a endovaskulární léčby žilního thoracic outlet syndromu v letech 2000 – 2007 na II. chirurgické klinice VFN a 1. LF UK v Praze
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Infekce av spojky k hemodialýze založené ePTFE interponátem. Léčba na základě zkušeností nebo podle nálezů moderních vyšetřovacích metod?
- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Hybridní výkony v léčbě torakoabdominálních výdutí typu IV, V
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Cévní protézy: 50 let vývoje od syntetických k tkáňovému inženýrství a buněčné terapii
- Úspešné kombinované riešenie aneuryzmy aberantnej retroezofageálne prebiehajúcej arteria subclavia dextra (arteria lusoria). Kazuistika
- Chronická žilní insuficience a možnosti moderní chirurgické léčby v oblasti povrchního systému
- Pedální bypass – desetileté zkušenosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



