-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Transplantace allogenního kostního štěpu v léčbě rozsáhlých post-sternotomických defektů – 6 let zkušeností s metodou
Transplantation of allogeneic bone graft in the therapy of massive post-sternotomy defects – 6 years of experience with the method
Introduction:
Early complications due to deep sternal wound infection pose a serious problem in cardiac surgery, with an up to 40% risk of mortality. Massive loss of sternum bone tissue and adjacent ribs results in major chest wall instability difficult to resolve using classical AO osteosynthesis procedures, causing respiratory insufficiency making the disconnection from artificial pulmonary ventilation difficult, and additional defects of soft tissue healing. Based on orthopaedic experience with bone defect replacement, we used the allogeneic bone graft method to reconstruct the chest wall.Methods:
In the period of 2011−2015 we performed the transplantation of an allogeneic bone graft in 13 patients. In 10 cases, an allograft of the sternum was used, in one case an allograft of the calva bone and in two cases the crushed spongy bone was used. After primary cardiac surgery, a massive post-sternotomy defect of the chest wall developed in all the 13 patients due to deep sternal infection and osteomyelitis of the sternum and adjacent ribs. Vacuum wound drainage was applied in the treatment of all the patients. To stabilize the chest and the graft, transverse titanium plates were used, fixed using bicortical screws. The bone allograft was prepared by the official Tissue Centre. Crushed allogeneic spongy bone was applied to reinforce the line of contact of the graft and the edges of the residual skeleton. In 12 cases, the soft tissue was closed by direct suture of mobilized pectoral flaps. In one case, V-Y transposition of the pectoral flap was performed.Results:
In 8 cases, healing of the reconstructed chest wall occurred without further complications. In 4 cases, additional re-suture of soft tissues and skin in the lower pole of the wound was needed while the patients were still in the hospital. However, excellent chest wall stability along with adjustment of respiratory insufficiency and a very good cosmetic effect in the wound were achieved in all the 12 cases. In two cases, explantation of the plates was required. In one case, severe concomitant complications and no healing of the wound resulted in death within half a year after the reconstruction. The median follow-up period of all patients in the series was 21 months (1−36). In 5 cooperating patients, scintigraphy of the chest wall was performed repeatedly during the follow-up period showing a high healing activity of the graft and particularly of the crushed spongy bone.Conclusion:
Our existing results show that allogeneic bone graft transplantation is a promising and easily applied method in the management of serious tissue loss in sternal dehiscence with favourable functional and cosmetic effects.Key words:
sternotomy − deep sternal wound infection − massive post-sternotomy defect − allogeneic bone graft
Autoři: M. Kaláb 1; J. Karkoška 2; M. Kamínek 3; P. Šantavý 1
Působiště autorů: Kardiochirurgická klinika Lékařské fakulty Univerzity Palackého a FN Olomouc, přednosta: prof. MUDr. V. Lonský, Ph. D. 1; Národní centrum tkání a buněk, Brno, primář: MUDr. D. Hrůzová 2; Klinika nukleární medicíny Lékařské fakulty Univerzity Palackého a FN Olomouc, přednosta: doc. MUDr. P. Koranda, Ph. D. 3
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 11, s. 398-406.
Kategorie: Původní práce
Souhrn
Úvod:
Ranné komplikace na podkladě hlubokého sternálního infektu představují v kardiochirurgii vážný problém, s rizikem mortality až 40 %. V případě rozsáhlé ztráty kostního materiálu sterna a přilehlých žeber vzniká závažná nestabilita hrudní stěny, obtížně řešitelná klasickými postupy AO osteosyntézy. Nestabilita hrudníku je příčinou respirační insuficience s obtížným odpojením od umělé plicní ventilace a dalších poruch hojení měkkých tkání. Na základě zkušeností ortopedie s náhradami kostních defektů jsme k rekonstrukci hrudní stěny zvolili metodu allogenního kostního štěpu sterna.Metody:
V období 2011−2015 jsme u 13 pacientů provedli transplantaci allogenního kostního štěpu. V 10 případech byl použit allogenní štěp sterna, v 1 případě allogenní štěp calvy, ve 2 případech allogenní drcená kostní spongióza. U všech pacientů v sérii došlo po primárním kardiochirurgickém výkonu k rozvoji rozsáhlého poststernotomického defektu hrudní stěny na podkladě hlubokého sternálního infektu a osteomyelitidy sterna a přilehlých žeber. V rámci léčby byl u všech zaveden protokol podtlakové drenáže rány. Ke stabilizaci hrudníku a štěpu byly použity transverzální titanové dlahy s fixací bikortikálními šrouby. Kostní allograft byl připraven, dle platné legislativy, tkáňovým centrem. K posílení linie kontaktu štěpu a okrajů reziduálního skeletu sterna a žeber byla použita drcená allogenní kostní spongióza. K uzávěru měkkých tkání byla ve 12 případech provedena přímá sutura mobilizovaných pektorálních laloků, v 1 případě byl proveden V-Y posun pektorálního laloku.Výsledky:
V 8 případech došlo ke zhojení rekonstruované hrudní stěny bez dalších komplikací. Ve 4 případech byla ještě za hospitalizace nutná dodatečná resutura měkkých tkání a kůže v dolním pólu rány. Vždy však bylo dosaženo vysoké stability hrudní stěny s úpravou respirační insuficience a velmi dobrým kosmetickým efektem rány. Ve 2 případech byla nutná explantace dlah. V 1 případě došlo k závažným průvodním komplikacím a nezhojení rány s úmrtím půl roku po rekonstrukci. Průměrná doba sledování všech pacientů v sérii byla 21 měsíců (1−36). U 5 spolupracujících pacientů bylo v pooperačním sledování opakovaně provedeno scintigrafické vyšetření skeletu hrudní stěny s průkazem vysoké hojivé aktivity štěpu a zejména drcené kostní spongiózy.Závěr:
Dle našich dosavadních zkušeností se transplantace allogenního kostního štěpu jeví jako nadějná metoda řešení zvláště závažných ztrátových dehiscencí sternotomie, snadno aplikovatelná, s příznivým funkčním a kosmetickým efektem.Klíčová slova:
sternotomie − hluboký sternální infekt − rozsáhlý poststernotomický defekt − allogenní kostní štěpÚVOD
Podélná střední sternotomie zůstává od svého širšího uvedení do klinické praxe v roce 1957 stále nejpoužívanějším operačním přístupem v kardiochirurgii [1]. Její provedení je rychlé, poskytuje široký přehled v operačním poli a incidence poruch hojení je nízká. Ranné komplikace sternotomie jsou však v případě svého vzniku jednou z významných příčin morbidity a mortality v kardiochirurgii [2,3]. Hluboký sternální infekt (z angl. deep sternal wound infection, DSWI), případně s rozvojem mediastinitidy, je život ohrožující komplikací. Zvláště závažná situace nastává při současné ztrátě kostního materiálu sterna a přilehlých žeber na podkladě osteomyelitidy. Rozsáhlý defekt přední hrudní stěny zvyšuje riziko poranění pravé komory srdeční a našitých bypassů. Kvůli mechanické nestabilitě hrudní stěny jsou zhoršeny respirační funkce, často s nutností prolongované umělé plicní ventilace. Nedostatečný mechanický podklad také zhoršuje hojení měkkých tkání podkoží a kůže.
Použitím titanových dlah dle principů AO osteosyntézy, fixovaných na povrch sterna a přiléhajících žeber, lze bezpečně dosáhnout vysokého stupně stability hrudního koše s minimalizací rizika poranění srdce a našitých bypassů [4]. V případech rozsáhlých poststernotomických kostních defektů však chybějící kostní materiál nezajistí náležitou oporu dlah a vzrůstá riziko selhání osteosyntézy [5].
Na základě zkušeností z léčby kostních defektů v ortopedické chirurgii jsme vypracovali původní, pro kardiochirurgii zcela novou techniku aplikace allogenního kostního štěpu, allogenní drcené kostní spongiózy a transverzálních titanových dlah pro léčbu rozsáhlých poststernotomických defektů hrudní stěny. Ve sdělení popisujeme zkušenosti za 6 let používání nového postupu léčby.
METODY
Při stanovení infekčních komplikací hojení sternotomie vycházíme z následujících kritérií [6,7]:
- a) Je přítomna sekrece z operační rány s klinickým a mikrobiologickým potvrzením ranného infektu. Mikrobiologický průkaz je prováděn ze stěru z povrchu rány a také ze vzorků tkání.
- b) Povrchový ranný infekt je lokalizován na oblast kůže a/nebo podkožních tkání.
- c) Hluboký sternální infekt zasahuje sternum, může být přítomná nestabilita sterna, nedochází však k obnažení mediastina.
- d) Pro potvrzení osteomyelitidy sterna vycházíme z klinického nálezu v průběhu chirurgického výkonu, doplněnho o pozitivní mikrobiologické vyšetření kosti nebo chrupavky.
- e) Pro diagnózu mediastinitidy vycházíme z klinického nálezu kompletní dehiscence sternotomie, pozitivního mikrobiologického vyšetření sekretů nebo vzorků tkání mediastina.
- f) Ze systémových známek infekce jsou hodnoceny: horečka nad 38 °C, bolesti hrudní stěny, nestabilita hrudní stěny, hnisavá sekrece z rány a průkaz mikroorganismů v odebraných hemokulturách.
- g) Dle doporučení může být hodnocen abnormální nález na RTG, CT scan, MRI, případně scintigrafie hrudníku.
Pro doplnění uvádíme výskyt ranných komplikací na našem pracovišti v letech 2011−2015. Ve sledovaném období bylo na našem pracovišti odoperováno celkem 3240 pacientů. Výskyt všech ranných komplikací po primární sternotomii byl 2,87 %, DSWI se vyskytl u 0,93 % pacientů. Incidence rozsáhlého defektu hrudní stěny řešeného následnou transplantací kostního štěpu byla 0,40 %.
Protokol léčby hlubokého sternálního infektu
Na našem pracovišti je standardně a dlouhodobě používán systém podtlakové drenáže rány (V.A.C.®, KCl, Inc, San Antonio, TX, USA) [8]. Revize rány je prováděna ve většině případů v den stanovení diagnózy ranné komplikace, nejpozději v den následující. Převazy ran v kategorii DSWI jsou prováděny v celkové anestezii na operačním sále, dle aktuálního klinického nálezu s frekvencí 2–3x týdně. Při každém převazu jsou pro mikrobiologické vyšetření odebrány stěry ze spodiny rány, vzorky měkkých tkání, kosti a žeberní chrupavky. V případě nezvratitelné sternální dehiscence při uvolnění či prořezání materiálu použitého k uzávěru sternotomie – v našem případě drátěné kličky nebo systém sternálních pásků na bázi poly-ether-ether-ketonu ZipFix® (Synthes-DePuy, Johnson&Johnson, USA) − je tento odstraněn. Pečlivě jsou odstraněny devitalizované okraje měkkých tkání, kosti a chrupavky. Toileta rány je prováděna ředěným roztokem povidone-iodine (Betadine®, Mundipharma A.G., Basilej, Švýcarsko).
Polyuretanová pěna V.A.C.® systému je vymodelována do aktuálního tvaru rány a je aplikována v jedné nebo dvou vrstvách. Pro ochranu obnažené pravé komory srdeční a našitých bypassů ukládáme do spodiny rány Mepilex® (Mölnlycke Health Care, Švédsko) v jedné nebo dvou vrstvách. Celý systém je překryt sterilní fólií a je napojen na sací zařízení s podtlakem v rozmezí od -75 do -125 mmHg.
V rámci komplexního přístupu léčby DSWI je indikováno celkové intravenózní podání jednoho nebo více antibiotik, striktně dle doporučení antibiotického centra.
Cílem léčby je dosáhnutí tří po sobě jdoucích negativních výsledků veškerých mikrobiologických vyšetření rány. Makroskopicky je hodnocena vitalita měkkých tkání a kosti. Je požadována absence teplot, pokles hladiny C reaktivního proteinu a leukocytů v krvi.
K uzávěru defektu hrudní stěny jsme zvolili variantu allogenního kostního štěpu. V prvním případě jsme použili štěp calvy, aktuálně jediný volně dostupný v rezervě tkáňové banky. V dalších případech již byla vypracována technika použití allogenního štěpu sterna. Před výkonem je vždy vyžadován informovaný souhlas pacienta.
Odběr a zpracování kostního štěpu
Allogenní kostní štěp musí splňovat legislativní kritéria České republiky a Evropské asociace tkáňových bank [9,10]. Odběr je realizován v rámci multitkáňového odběru od zemřelého dárce. Každý dárce je prověřen v národním registru nesouhlasů s odběrem orgánů a tkání pro transplantaci. Vyřazeni jsou dárci léčení v době úmrtí pro infekční onemocnění, sepsi, malignitu a autoimunitní onemocnění. Krevní sérum dárce je testováno na protilátky anti-HIV 1 a 2, HBsAg, anti-HCV, anti-HTLV I a II. Odběr štěpu a veškeré další manipulace s ním jsou prováděny za přísně sterilních podmínek týmem Národního centra tkání a buněk v Brně. Již při odběru štěpu, a průběžně i při dalším zpracování, jsou prováděny kontrolní mikrobiologické stěry. Po prvním ošetření je štěp zamrazen a skladován při teplotě -80 °C. Před klinickým použitím je po dobu 12 hodin rozmražen při teplotě 4−6 °C, ošetřen v 1% roztoku gentamicinu, opracován do konečné podoby, znovu zamražen a dlouhodobě skladován při -80 °C. Před vlastní transplantací je rozmražen po dobu 12 hodin při teplotě 4−6 °C. Na operačním sále je ještě jednou ošetřen koupelí v 1% roztoku gentamicinu (Obr. 1).
Obr. 1. Allogenní kostní štěp sterna před transplantací Fig. 1: Allogeneic bone graft of the sternum before surgery 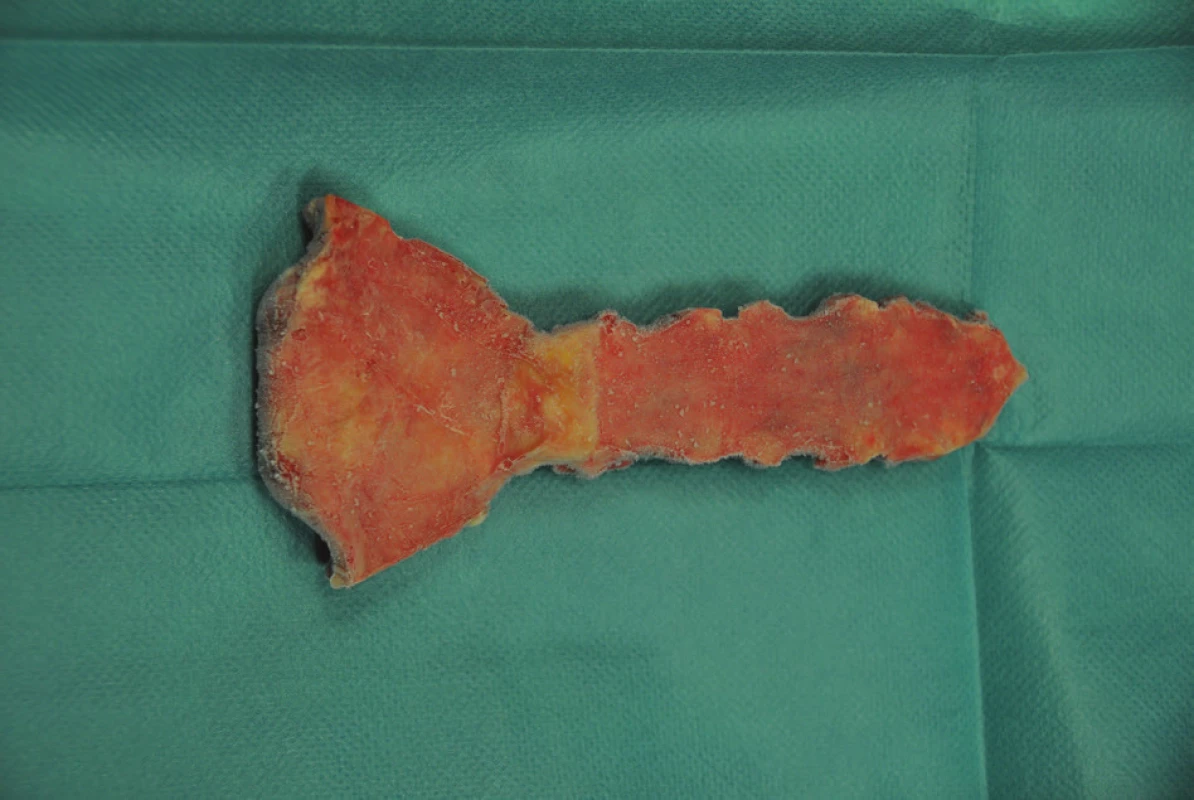
Operační technika
Prvním krokem operace je bilaterální uvolnění prsních svalově-kožních laloků od spodiny skeletu hrudního koše, obvykle do úrovně medioklavikulárních čar. Pokud je to možné, snažíme se šetřit krevní zásobení svalového laloku zprostředkované mezižeberními cévními perforátory. Poté následuje resekce reziduálních okrajů sterna a žeber v bezpečnostní linii 1–2 cm do zdravé tkáně.
Kostní štěp je opracován přibližně dle tvaru defektu. Fixaci štěpu a současně stabilizaci celé hrudní stěny provádíme pomocí transverzálních, ve dvou rovinách tvarovatelných titanových dlah (Synthes-De Puy, Johnson&Johnson, USA). Uchycení dlah k povrchu skeletu hrudního koše provádíme bikortikálně zavedenými samovrtnými šrouby adekvátní délky. Po obou stranách každé dlahy se snažíme o fixaci alespoň čtyřmi šrouby. Jedním nebo dvěma šrouby nejkratší možné délky je fixován i kostní štěp.
Linii kontaktu mezi reziduálními okraji skeletu a kostním štěpem vyplňujeme drcenou kostní spongiózou získanou jednak ze zbytků původního štěpu, jednak z přiloženého allogenního štěpu hlavice či kondylu femuru nebo tibie.
Standardně zakládáme 2 silnější subpektorální Redonovy drény pod oba pektorální svalově kožní laloky. Další, slabší Redonův drén ukládáme na spodinu rány pod štěp.
Uzávěr měkkých tkání lze s výhodou provést přímou suturou bilaterálně uvolněných pektorálních laloků. V případě nedostatku měkkých tkání je nutné provést ve spolupráci s plastickým chirurgem některý z rozsáhlejších výkonů (v našem jednom případě šlo o V−Y transpozici pektorálního laloku).
Pooperační péče
Pacienti jsou po výkonu sledováni a extubováni na jednotce intenzivní péče. Pooperačně je kladen důraz na prevenci kašle, dočasné omezení zátěže horních končetin a dechovou rehabilitaci. V případě přímé sutury uvolněných pektorálních laloků je možné použít hrudní pás. Drény ponecháváme z důvodu prevence tvorby serózních výpotků po dobu 6 až 7 dnů. Antibiotickou terapii ponecháváme v rámci komplexní léčby osteomyelitidy sterna po dobu tří týdnů od rekonstrukce hrudní stěny.
Sledování po propuštění z nemocnice
Sledování probíhá formou klinických kontrol v rozmezí 2, 6 a 12 měsíců, u déle sledovaných pak jednou ročně. Po dosažení 3 let od rekonstrukce hrudní stěny jsou žijící pacienti vyřazeni.
Pro získání dalších informací o dynamice hojení allogenního kostního štěpu bylo u pěti spolupracujících pacientů provedeno s odstupem 2−3 a 18−22 měsíců od rekonstrukce hrudní stěny její scintigrafické vyšetření. Planární celotělový kostní scan a SPECT/CT hrudníku byly provedeny po podání 750 MBq Technecium 99 m-bisfosfonátu s použitím GE Infinia Hawkey gamma kamery osazené nízkoenergetickým kolimátorem s vysokým rozlišením. Planární snímky byly pořízeny v matici 1024x256. SPECT/CT data byla získána pomocí nízce dávkovaného CT pro korekci na zeslabení a morfologickou korelaci v matici 128x128.
VÝSLEDKY
V období mezi srpnem 2011 a prosincem 2015 jsme léčili 6 mužů (ø 67,33 roku; 47−80 let) a 7 žen (ø 73,5 roku; 62−83 let) s rozsáhlým defektem hrudní stěny na podkladě DSWI. 9 pacientů bylo operováno pro ischemickou chorobu srdeční, z toho 5 urgentně. Pro konstrukci koronárního bypassu na RIA byla vždy odebrána levá vnitřní mammární tepna (z angl. internal mammary artery, IMA). Oboustranný odběr IMA nebyl proveden v žádném případě. U dalších 4 pacientů byla provedena náhrada aortální chlopně bioprotézou, u 1 pacienta byl proveden kombinovaný výkon náhrada mitrální a plastika trikuspidální chlopně. 12 výkonů bylo provedeno v mimotělním oběhu s průměrnou dobou trvání 80,6 min. (52–141 min.), průměrný čas aortální svorky byl 52,3 min. (23−96 min.). Jeden pacient s revaskularizací myokardu byl operován na bijícím srdci, bez použití mimotělního oběhu.
Z předoperačních rizikových faktorů byly zastoupeny: obezita (n=9, ø BMI 32,2; 28,2−40), diabetes mellitus (n=8, 5 léčených inzulinem, 3 perorálními antidiabetiky), chronická renální insuficience (n=6), chronická obstrukční plicní nemoc (n=4), kouření (n=3). Z peroperačních rizikových faktorů byla ve 4 případech zastižena těžká osteoporóza sterna. Paramediánně provedená sternotomie ani peroperační fragmentace sterna nebyly zaznamenány. Doba trvání mimotělního oběhu nad 100 minut byla přítomna ve 4 případech. K uzávěru sternotomie byla v 8 případech použita klasická cerclage pomocí 7−8 jednotlivých drátěných kliček, v 5 případech byl použit nově dostupný systém sternálních pásků ZipFix® (Synthes-De Puy, Johnson&Johnson, USA).
V časném pooperačním průběhu bylo nutné u 3 pacientů provést revizi pro krvácení nebo srdeční tamponádu, z toho ve 2 případech opakovaně: u 1 pacienta dvakrát po sobě v průběhu 24 hodin po primární operaci, u 1 pacientky pro pozdní tamponádu opakovaně 6. a 8. pooperační den.
Průměrné celkové krevní ztráty po primární operaci byly 2371 ml (500−7800). Průměrný počet jednotek krevních transfuzí podaných po primární operaci byl 7,5 (1−26). Průměrné hodnoty následujících časových intervalů byly: doba umělé plicní ventilace po primární operaci 33,1 hodiny (10−168), doba pobytu na JIP 5,8 dne (2−15 dnů).
Diagnóza DSWI a osteomyelitidy sterna byla postavena na klinickém nálezu a mikrobiologickém vyšetření stěrů z povrchu rány, vzorků kosti, chrupavky a měkkých tkání. CT scany ani MRI vyšetření nebyly provedeny. Z mikrobiologických původců ranného infektu byly zastoupeny: Staphylococcus epidermidis (n=9), Klebsiella pneumonie (n=3), Staphylococcus aureus (n=1) a Morganella morgani (n=1). V rámci protokolu léčby DSWI bylo provedeno průměrně 8,2 (5−15) převazu s použitím podtlakové drenáže rány. Po radikálním odstranění infikovaných tkání došlo u všech případů ke vzniku kostního defektu v rozsahu více než 3/4 plochy původního sterna a ztrátovému poškození chrupavčité části žeber, převážně na straně odběru levé IMA.
V případě použitého štěpu calvy byl uzávěr měkkých tkání proveden pomocí V-Y posunu muskulo-kutánního pektorálního laloku. V 10 dalších případech byl již použit allogenní štěp sterna. Linie kontaktu mezi štěpem a původními kostěnými okraji byly vyplněny drcenou kostní spongiózou z allogenního štěpu kondylu femuru nebo tibie (Obr. 2). Ve 2 posledních případech byla k vyplnění defektu použita pouze drcená allogenní kostní spongióza. Uzávěr měkkých tkání se u 12 případů podařilo provést přímou suturou bilaterálně mobilizovaných pektorálních svalových laloků.
Obr. 2. Rekonstrukce hrudní stěny kostním štěpem sterna a drcenou kostní spongiózou Fig. 2: Reconstruction of the chest wall using the sternal bone graft and crushed spongy bone 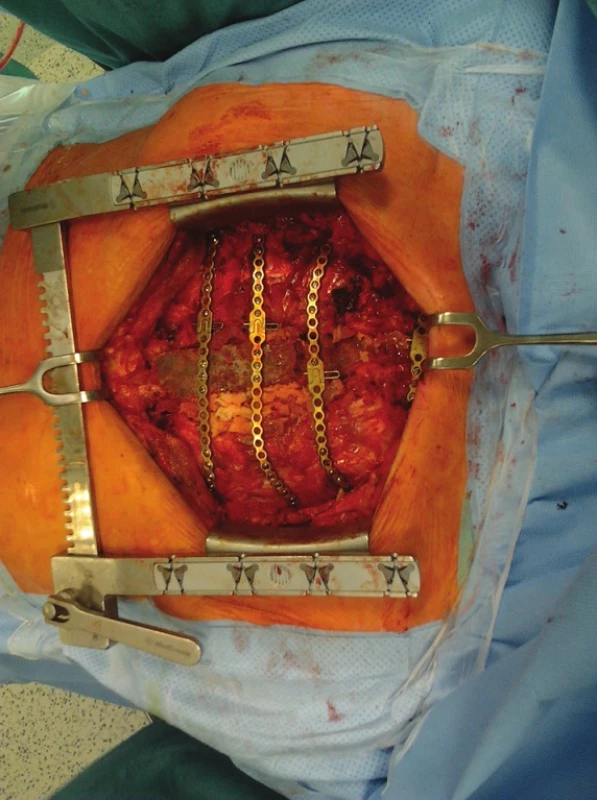
Průměrné doby intervalů po rekonstrukci hrudní stěny byly: umělá plicní ventilace ø 69,3 hodiny (3–310), pobyt na JIP ø 13,3 dne (3−36 dnů), celková hospitalizace ø 70,3 dne (42−140), z toho hospitalizace po rekonstrukci hrudníku ø 32,4 dne (8−96).
Kompletního zhojení rány bez dalších komplikací a s plnou stabilitou hrudní stěny se podařilo dosáhnout v 8 případech. U 4 pacientů byla provedena dodatečná resutura měkkých tkání a kůže dolního pólu rány. Hrudní stěna však byla i v těchto případech plně stabilní. U 2 pacientů bylo nutné provést explantaci dlah. V prvním případě pro infekt nasedající na cizí materiál, hrudní stěna však již byla plně stabilní a rána byla dohojena pomocí dodatečného protokolu podtlakové drenáže a resutury měkkých tkání. Ve druhém případě bylo důvodem mechanické poškození dlah s vytržením ze skeletu po pádu pacientky z lůžka, což se stalo příčinou dalších, již nezvladatelných a níže popsaných komplikací hojení.
Z ostatních pooperačních komplikací byl ve 2 případech zaznamenán pneumotorax a v 1 případě došlo k dočasnému snížení citlivosti kůže přední strany hrudníku.
Průměrná doba sledování po propuštění je prozatím 21 měsíců (1−36). 4 plně zhojení pacienti byli z pravidelného sledování po 36 měsících vyřazeni.
Planární celotělové a SPECT/CT scintigrafické vyšetření skeletu hrudní stěny bylo provedeno u 5 spolupracujících pacientů. Opakovaně byla u všech vyšetřených případů prokázána vysoká hojivá aktivita štěpu, především pak v liniích kontaktu s aplikací drcené kostní spongiózy (Obr. 3).
Obr. 3. Celotělová planární scintigrafie (A) a SPECT (B) hrudní stěny 18 měsíců po transplantaci kostního štěpu sterna Fig. 3: Whole-body planar scitigraphy (A) and SPECT (B) 18 months after the transplantation of the sternal bone graft 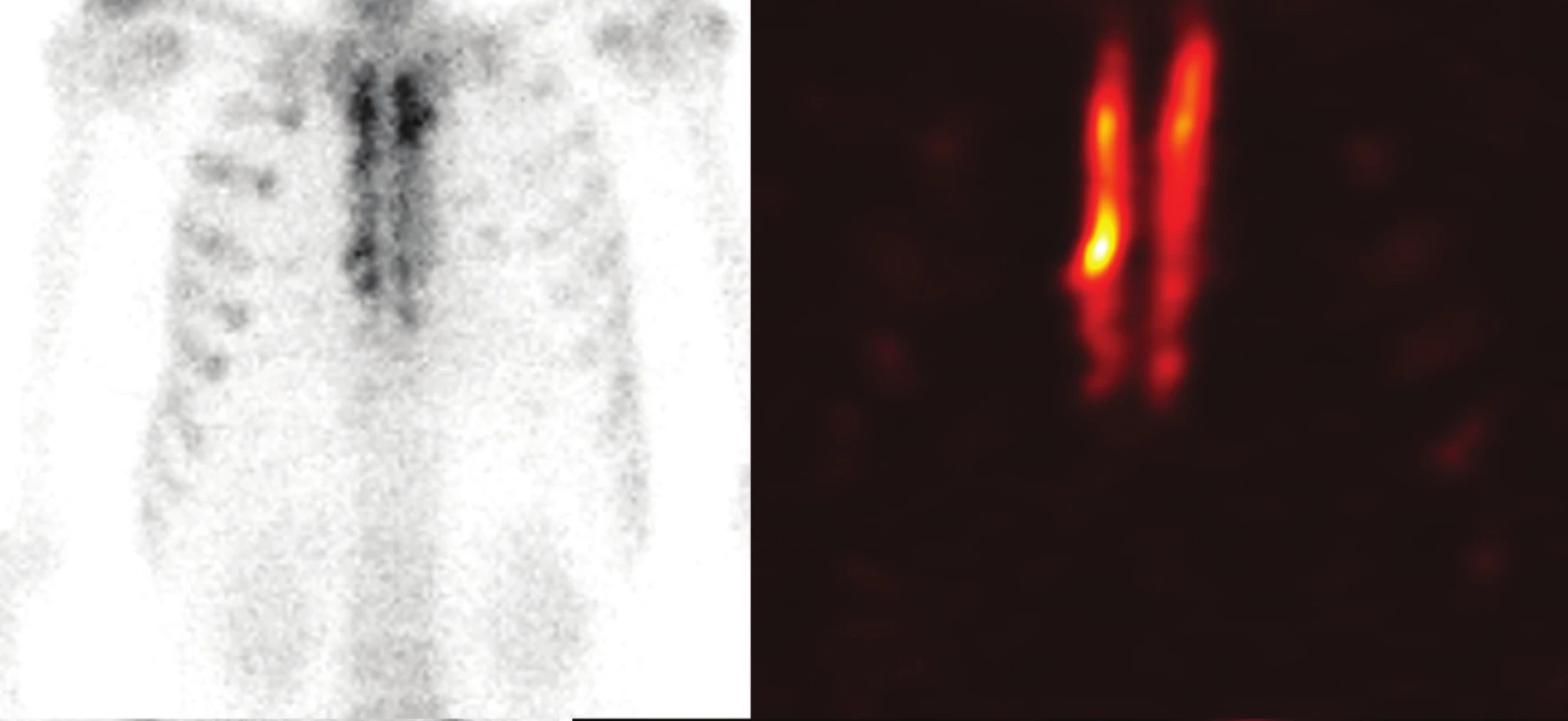
Hodnocení mortality
Ve 2 případech došlo po propuštění z našeho pracoviště k úmrtí z jiných příčin: u 1 pacienta po 15 měsících z důvodu rozsáhlé mozkové mrtvice, u dalšího pak po 10 měsících z důvodu srdečního selhání. V obou případech však byla rána zhojená a hrudní stěna stabilní.
V jednom případě došlo k úmrtí 36 dnů po rekonstrukci hrudní stěny, těsně před plánovaným ukončením naší hospitalizace, při náhlém propuknutí závažné bronchopneumonie u obézní (BMI 40), špatně rehabilitující diabetičky. Následná pitva prokázala kompletní zhojení rekonstruované hrudní stěny (Obr. 4).
Obr. 4. Biopsie hrudní stěny, pohled z horní (pektorální) strany Fig. 4: Biopsy of the chest wall; view from the upper (pectoral) side 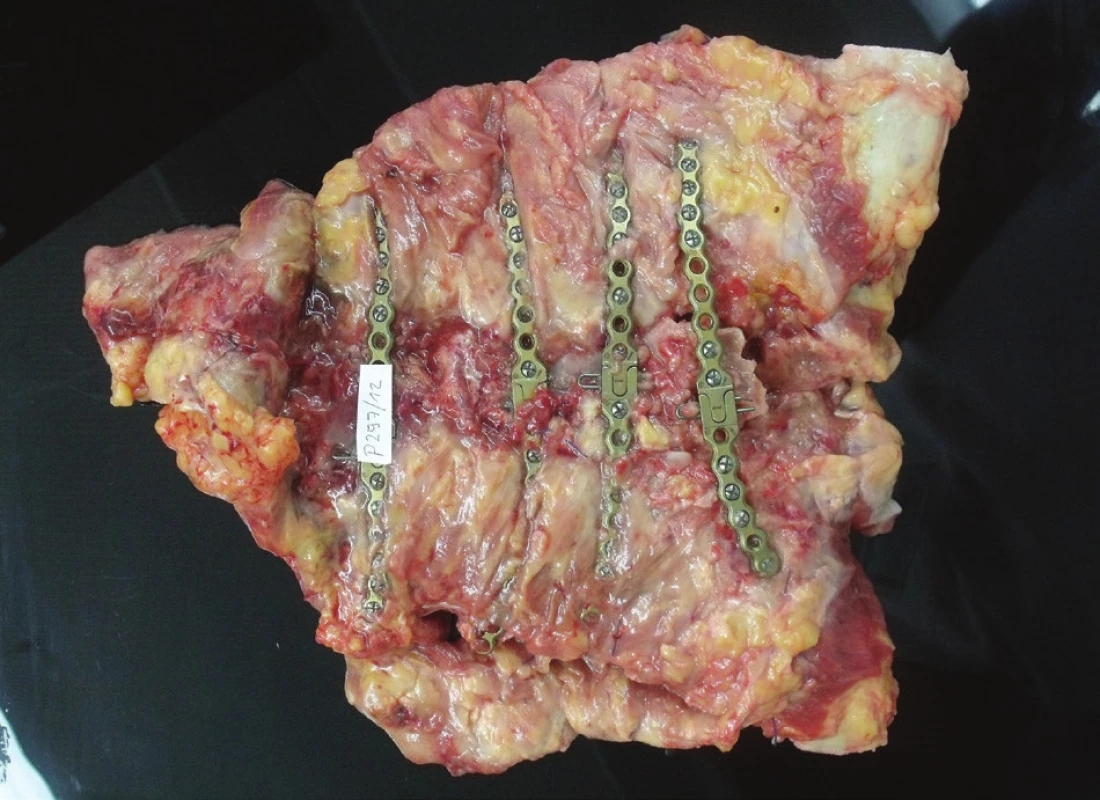
Velmi závažný průběh byl zaznamenán u 82leté, obézní (BMI 38), inzulin dependentní diabetičky, po urgentní revaskularizaci myokardu pro NSTEMI, s následným rozvojem DSWI. 23 dnů po rekonstrukci hrudní stěny pacientka spadla z lůžka na přední stěnu hrudníku se zapřením o horní končetiny. Došlo k vytržení dlah, disrupci měkkých tkání a tvorbě masivního sero-sangvinolentního výpotku. Při urgentní revizi rány byla nutná kompletní explantace dlah. Štěp sterna však již byl pevně přihojený a byl ponechán v ráně k zajištění stability hrudní stěny. Vzniklý defekt měkkých tkání řešil plastický chirurg pomocí přesunu laloku m. latissimus dorsi. Pro krvácení do laloku byly provedeny další dvě revize rány. Nasedající ranný infekt měkkých tkání vedl k nutnosti dlouhodobé podtlakové drenáže rány. Reziduální defekt měkkých tkání byl řešen pouze sekundárním hojením a pacientka byla přeložena do spádu. Při celkově velmi špatném prospívání s dalšími přidruženými komplikacemi (meléna při krvácení ze žaludečního vředu, renální insuficience s nutností trvalé hemodialýzy, špatná rehabilitace) pacientka zemřela z důvodů akcelerace celkové sepse 6 měsíců po rekonstrukci hrudní stěny.
Náklady na léčbu
Posledním kritériem, které jsme v naší sérii pacientů hodnotili, byly finanční náklady na léčbu ztrátové dehiscence sternotomie. Do výsledné sumy každého pacienta byly zahrnuty: celková doba pobytu na jednotce intenzivní péče, převody krevních derivátů, převazy na operačním sále včetně aplikace systému podtlakové drenáže, osteosyntetický materiál a tkáňové štěpy k rekonstrukci hrudní stěny, hospitalizace na standardním oddělení a rehabilitace. Časový interval pro výpočet byl stanoven od data diagnózy ranné komplikace do propuštění z kliniky.
Průměrná výše finančních nákladů dosáhla hodnoty 1 383 048 Kč (452 736–2 770 929). Průměrné náklady za kompletní péči u nekomplikovaného kardiochirurgického pacienta se v našich podmínkách pohybují v rozmezí 150 000–200 000 Kč.
DISKUZE
Podélná střední sternotomie zůstává stále dominantním operačním přístupem v kardiochirurgii již od dob svého uvedení do praxe Julianem v roce 1957. Výskyt ranných komplikací se dle literatury pohybuje v akceptovatelném rozmezí 0,5−5 %. Dehiscence sternotomie, vzniklá na podkladě DSWI, je však hrozivou komplikací a s ní spojená mortalita, i přes pokrok v chirurgické prevenci ranných komplikací, se stále pohybuje v rozmezí 14−47 % [3]. V průběhu posledních let se poměrně výrazně změnila skladba pacientů podstupujících kardiochirurgické operace. Operováni jsou výrazně častěji polymorbidní pacienti ve vysokém věku, s přítomností více předoperačních rizikových faktorů současně. Efekt jednotlivých rizik se pak sčítá.
V literatuře je pravidelně zmiňována celá řada rizikových faktorů hojení sternotomie. Z předoperačních jsou nejčastěji referovány obezita, diabetes mellitus, chronická obstrukční plicní nemoc, kouření, chronická renální insuficience a dlouhodobé užívání steroidů. Jako rizikový předoperační faktor pro hojení sternotomie byla v literatuře zmíněna také nadměrná velikost prsou u žen [11].
Z peroperačních rizikových faktorů je nutné zmínit především paramediánní provedení sternotomie, fragmentaci křehkého sterna, bilaterální odběr mammárních arterií pro konstrukci tepenných kompozitních bypassů, zejména pak v případě obézního diabetika, operace s dlouhou dobou trvání mimotělního oběhu, nadměrné použití kostního vosku, nadměrné plošné použití elektrokoagulace při stavění krvácení a suboptimální postavení obou polovin sterna při uzávěru hrudníku.
Mezi nejvýznamnější pooperační rizikové faktory se řadí především zvýšená potřeba krevních transfuzí, chirurgická revize pro krvácení nebo tamponádu, prolongovaná umělá plicní ventilace a prodloužená doba pobytu na jednotce intenzivní péče [3,12].
Spektrum poruch hojení sternotomie zahrnuje sterilní mechanickou dehiscenci sternotomie, povrchový ranný infekt zahrnující kůži a měkké tkáně podkoží, hluboký sternální infekt postihující i povrch kosti bez instability sterna a hluboký sternální infekt s nestabilitou sterna [3].
Nestabilní a vzájemně se pohybující okraje sterna jsou živnou půdou pro progresi zánětu, zvýšenou sekreci z rány, tvorbu výpotků a sekundární rannou infekci se snadnějším prostupem do hlubších vrstev rány. Komplikujícím faktorem může být i fragmentace sterna při prořezání drátěných kliček. Ve zvláště závažných případech může být hluboký sternální infekt s progresí osteomyelitidy provázen rozsáhlou ztrátou kosti a přiléhajících chrupavek žeber. Vzniká pak různě rozsáhlý defekt přední hrudní stěny. Kromě infekčních ranných komplikací jsou pacienti kompromitováni také těžkou respirační insuficiencí, často s následkem pneumonie a obtížného odpojení od umělé plicní ventilace v důsledku nestabilní hrudní stěny.
V rámci léčby chirurgických ranných komplikací se již od poloviny 90. let 20. století uplatňuje metoda podtlakové drenáže rány. Její terapeutický efekt je zdůvodněn snížením bakteriálního osídlení spodiny rány, stimulací prokrvení měkkých tkání a růstu granulací, zmenšením objemu rány, kontinuálním odváděním sekretu a zmenšením otoku měkkých tkání. Velmi důležitá je také mechanická stabilizace hrudní stěny a tím i zlepšení respiračních parametrů. Výhodou je i snížená frekvence převazů, které je možné provádět dle klinického stavu rány 2−3x týdně [13]. Relativní nevýhodou je nutnost četnějších převazů v celkové anestezii u odolnějšího ranného infektu. Pro úspěšnost dalšího kroku léčby je však nezbytná absence mikrobiálního infektu v ráně, nejlépe dvakrát až třikrát po sobě potvrzená.
V případě rozsáhlejších poststernotomických defektů je také nutné brát zřetel na riziko poranění pravé komory a našitých bypassů. Kromě již zmíněné protekce spodiny rány pomocí vrstvy Mepilexu® také velmi pečlivě revidujeme a odstraňujeme ostré či do rány prominující okraje sterna, žeber a chrupavky.
V současné době jsou pro uzávěr sternální dehiscence stále ještě poměrně hojně používány různé metody prostého předrátování, nejčastěji varianty dle Robiczeka [14]. Úspěšnost této rychlé a levné metody však limituje především kvalita sterna, které bývá často značně fragmentované, křehké nebo zcela chybí. Rizikem je i možnost poranění srdce a našitých bypassů při existenci velmi pevných tkáňových srůstů v prostoru pod sternem.
Moderním způsobem řešení sternálních dehiscencí bez výraznější ztráty kostního materiálu je použití ve dvou rovinách tvarovatelných titanových dlah dle zásad AO osteosyntézy. Dlahy lze použít dle aktuální potřeby jak pro příčnou, tak také pro podélnou stabilizaci sterna. Fixace dlah se provádí prostřednictvím bikortikálně umístěných samořezných nebo samovrtných šroubů adekvátní délky. Aplikace samovrtných šroubů je rychlejší, bez nutnosti předvrtávání a z tohoto důvodu je i preferujeme. Výhodou AO osteosyntézy je její snadná a bezpečná aplikace s výraznou redukcí rizika poranění srdce a bypassů a vysoký stupeň stability hrudní stěny. Pacientům přináší vysoký stupeň komfortu dýchání. Dokonale stabilní hrudní stěna představuje důležitý moment v hojení měkkých tkání a kůže. Rizika metody jsou: krvácení po rozsáhlé preparaci měkkých tkání pektorálních laloků, pooperační pneumotorax při použití příliš dlouhých šroubů, poranění in situ ponechané IMA nebo žeberní tepny. V pooperačním průběhu může dočasně docházet ke tvorbě subpektorálních reaktivních výpotků, proto ponecháváme subpektorálně uložené Redonovy drény po dobu 6−7 dnů. V některých případech se může vyskytnout snížená citlivost kůže přední stěny hrudníku. U příliš laterálně zasahujících transverzálních dlah mohou přetrvávat bolestivé dechové exkurze hrudní stěny, což může být s odstupem důvod pro explantaci dlah [4,5].
V případě rozsáhlých poststernotomických defektů však může prostá AO osyteosyntéza selhat. Komplexní působení střižných sil vznikajících při dechových pohybech hrudní stěny v kombinaci s nedostatečným kostním podkladem pro fixaci hrozí destrukcí dlah. Uvolněný osteosyntetický materiál a vznik dalších kostěných fragmentů enormně zvyšuje riziko poranění nekrytého srdce a závažného krvácení. Lze rovněž předpokládat opětovné zhoršení respirační insuficience, vznik další dehiscence měkkých tkání a tvorbu reaktivních výpotků.
V literatuře se objevila celá řada postupů k řešení rozsáhlých defektů hrudní stěny vzniklých za různých okolností. S ohledem na malou četnost výskytu těchto případů a individuální podmínky konkrétního pacienta lze asi stěží prosazovat některou z níže uvedených metod jako zlatý standard léčby.
Zdánlivě nejjednodušším popsaným řešením je prosté překrytí kostního defektu některou z možností svalově kožního laloku, např. jednoho nebo obou pektorálních svalových laloků či svalového laloku přímého břišního svalu [15,16]. Tyto způsoby však nestabilizují skelet hrudní stěny. Přetrvává tak zvýšené riziko zhoršených respiračních funkcí, často s problematickým odpojováním od umělé plicní ventilace. Nestabilita hrudní stěny může být důvodem dalších dehiscencí a píštělí měkkých tkání, diskutabilní je rovněž kosmetický efekt abnormality hrudní kontury.
Další možností je výplň defektu pomocí laloku velkého omenta, kdy je s výhodou využit vysoký angiogenetický a hojivý stupeň jeho tkáně [17]. Nevýhodou je nutnost zásahu do peritoneální dutiny a rozšíření operační rány, s fatálními následky při infekčních komplikacích. Do doby vytvoření dostatečně zhojené vazivové vrstvy mezi okraji sterna a žeber zůstává hrudní stěna nadále nestabilní se všemi již jmenovanými důsledky.
Defekty sterna menšího rozsahu lze řešit s pomocí autologního štěpu. Byly publikovány práce s využitím kostního štěpu fibuly, žebra nebo Achillovy šlachy [18,19,20]. Výhodou metody je použití vlastního materiálu tkáně s dobrým hojivým potenciálem. Nevýhodou je omezené množství dostupného materiálu a nutnost provedení dalšího operačního přístupu k odběru autologního materiálu.
Ze syntetických materiálů byly využity materiály jako např. methyl-metacrylát nebo polytetrafluorethylen. Použití na míru vytvořeného titanového implantátu bylo publikováno po resekci sterna postiženého primárním tumorem nebo metastázou [21].
Syntetické materiály jsou však obecně značně rigidní, existuje riziko plošných erozí nebo dokonce poranění při kontaktu s okolními tkáněmi. Existuje zde také obava ze zvýšeného rizika infekčních komplikací nebo imunologické reakce v přítomnosti nadměrného množství cizího materiálu. Nelze také pominout riziko nepřijetí cizího materiálu tkáněmi [22]. V případě „na míru“ vyráběných implantátů na bázi titanu je limitujícím faktorem vysoká cena použitého materiálu.
V literatuře bylo popsáno zatím ojedinělé použití allogenního kostního štěpu při rekonstrukci rozsáhlých defektů hrudní stěny vzniklých po resekci pro zhoubný tumor či metastatické postižení [23,24].
Štěp sterna je velmi dobře mechanicky zpracovatelný, snadno se fixuje do rány. Poskytuje dostatečné množství materiálu k rekonstrukci defektů hrudní stěny většího rozsahu, s velmi uspokojivým kosmetickým defektem zachované hrudní kontury. Avitální allogenní štěp slouží jako „vodič – scafold“ pro prorůstání fibroblastů příjemce a tkáňovou angiogenezi. Není nutné řešit otázky imunokompatibility, i když se jedná o transplantaci tkáně.
V naší sérii pacientů jsme začali využívat allogenní štěpy sterna připravené tkáňovou bankou bez původních měkkých tkání. Tento způsob urychluje aplikaci štěpu, není nutné jeho dodatečné čištění na operačním sále. K zesílení linie kontaktu mezi štěpem a reziduálními okraji hrudního skeletu využíváme drcenou allogenní kostní spongiózu. Na základě scintigrafického vyšetření skeletu jsme zjistili vysoký hojivý potenciál v místě její aplikace, což urychluje přihojení štěpu.
Nezbytnou podmínkou úspěchu léčby je absence mikrobiální kontaminace rány. Z tohoto důvodu, i přes opakovaná negativní mikrobiologická vyšetření, provádíme profylaktickou resekci reziduálních okrajů sterna a žeber. Snaha o čistotu rány je v některých případech naší série i důvodem prodloužení doby podtlakové drenáže rány.
I přes veškerá preventivní opatření se stále jedná o transplantaci biologického materiálu. Existuje, i když zcela minimální, riziko přenosu virové či bakteriální infekce z dárce na příjemce.
ZÁVĚR
Naše zkušenosti s transplantací allogenního štěpu sterna a dosavadní výsledky ze sledování pacientů se zatím jeví jako nadějná varianta léčby těchto zvláště komplikovaných případů. Z chirurgického hlediska jde o metodu snadno aplikovatelnou, s přijatelným funkčním i kosmetickým výsledkem. Velkým přínosem metody je, dle nás, podstatné snížení mortality v příčinné souvislosti s nezhojením sternotomie.
I přesto, že námi publikovaná série patří v literatuře k těm rozsáhlejším, zásadní limitací pro detailnější srovnání s ostatními postupy a pro zhodnocení dlouhodobých výsledků je relativně malý počet pacientů s tak závažnou rannou komplikací.
Věnováno prim. MUDr. Janu Smetkovi, svému prvnímu průvodci v širokém světě chirurgie.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Kaláb
Balbínova 12
796 01 Prostějov
e-mail: martin1.kalab@gmail.com
Zdroje
1. Julian OC, Lopez-Belio M, Dye WS, et al. The median sternal incision in intracardiac surgery with extracorporeal circulation: a general evaluation of its use in heart surgery. Surgery 1957;42 : 753.
2. Losanoff JE, Richman BW, Jones JW. Disruption and infection of median sternotomy: a comprehensive review. Eur J Cardiothorac Surg 2002;21 : 831−9.
3. El Oakley RM, Wright JE. Postoperative mediastinitis: classification and management. Ann Thorac Surg 1996;61 : 1030−6.
4. Gaudreau G, Costache V, Houde C, et al. Recurrent sternal infection following treatment with negative pressure wound therapy and titanium transverse plate fixation, Eur J Cardiothorac Surg 2010;37 888−92.
5. Voss B, Bauernschmitt R, Will A, et al. Sternal reconstruction with titanium plates in complicated sternal dehiscence, Eur J Cardiothorac 2008;34 : 139−45.
6. Tarzia V, Carrozzini M, Bortolussi G, et al. Impact of vacuum-assisted closure therapy on outcomes of sternal wound dehiscence. Interact Cardiovasc Thorac Surg 2014;19 : 70−5. doi: 10.1093/icvts/ivu101.
7. Horan TC, Andrus M, Dudeck MA. CDC/NHSN surveillance definition of health care-associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control 2008;36 : 309−32.
8. Simek M, Hajek R, Fluger I, et al. Superiority of topical negative pressure over closed irrigation therapy of deep sternal wound infection in cardiac surgery. J Cardiovasc Surg (Torino). 2012;53 : 113−2.
9. Sbírka zákonů České republiky. Act No. 296/2008 Zákon o lidských tkáních a buňkách. Praha 2008.
10. European Association of Tissue Banks. General Standards for Tissue Banking, ÖBIG-Transplant, Vienna 1995.
11. Copeland M, Senkowski C, Ulcickas M, et al. Breast size as a risk factor for sternal wound complications following cardiac surgery. Arch Surg 1994;129 : 757−9.
12. Loop FD, Lytle BW, Cosgrove DM, et al. Maxwell Chamberlain memorial paper: sternal wound complications after isolated coronary artery bypass grafting: early and late mortality,morbidity and cost of care. Ann Surg 1990;49 : 179−87.
13. Song DH, Wu LC, Lohman RF, et al. Vacuum assisted closure for the treatment of sternal wounds: the bridge between debridement and definitive closure. Plast Reconstr Surg 2003;111 : 92−7.
14. Robicsek F, Fokin A, Cook J, et al. Sternal instability after midline sternotomy. Thorac Cardiovasc Surg 2000;48 : 1–8. doi:10.1055/s-2000-9945.
15. Wettstein R, Erni D, Berdat P, et al. Radical sternectomy and primary musculocutaneous flap reconstruction to control sternal osteitis. J Thorac Cardiovasc Surg 2002;123 : 1185−90.
16. Shibata T, Hattori K, Hirai H, et al. Rectus abdominis myocutaneous flap after unsuccessful delayed sternal closure. Ann Thorac Surg 2003;76 : 956−8.
17. Lee Jr AB, Schimert G, Shaktin S, et al. Total excision of the sternum and thoracic pedicle transposition of the greater omentum; useful strategems in managing severe mediastinal infection following open heart surgery. Surgery 1976;80 : 433−6.
18. Nahabedian MY, Riley LH, Greene PS, et al. Sternal stabilization using allograft fibula following cardiac transplantation. Plastic Reconstr Surg 2001;108 : 1284−8.
19. Chai Y, Zhang G, Shen G. Autogenous rib grafts for reconstruction of sternal defects after partial resection: a new surgical technique. Plast Reconstr Surg 2008;121 : 353−5.
20. De Feo M, Carozza A, Della Corte A, et al. Achilles tendon for sternal synthesis in the treatment of mediastinitis. Ann Thorac Surg 2005;79 : 359−60.
21. Demondion P, Mercier O, Kolb F, et al. Sternal replacement with a custom-made titanium plate after resection of a solitary breast cancer metastasis.Interact Cardiovasc Thorac Surg. 2014;18 : 145–7. doi: 10.1093/icvts/ivt456.
22. Rocco G. Overview on current and future materials for chest wall reconstruction. Thorac Surg Clin 2010;20 : 559−62.
23. Marulli G, Hamad AM, Cogliati E, et al. Allograft sternochondral replacement after resection of large sternal chondrosarcoma. J Thorac Cardiovasc Surg 2010;139:e69−70.
24. Stella F, Dell’Amore A, Dolci G, et al. Allogenic sternal transplant after sternectomy for metastasis of ovarian carcinoma. Ann Thorac Surg 2012;93:e 71−2.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2016 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Chirurgie z několika pohledů
- Možnost eliminace axilárních disekcí u pacientek s karcinomem prsu pomocí neoadjuvantní léčby
- Zlomeniny celého glenoidu
- Karcinom štítné žlázy, desetiletý soubor
- Transplantace allogenního kostního štěpu v léčbě rozsáhlých post-sternotomických defektů – 6 let zkušeností s metodou
- Zemřel profesor Pavel Firt
- Neobvyklý případ mezenteriální abscedující lymfadenitidy
- Vzácné maligní nádory apendixu: léčba metastáz do jater − kazuistiky
- Mechanický ileus jako následek jizevnaté stenózy tenkého střeva
- ESCP 2016 – Milano
- 40th World Congress of the International College of Surgeons
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Neobvyklý případ mezenteriální abscedující lymfadenitidy
- Vzácné maligní nádory apendixu: léčba metastáz do jater − kazuistiky
- Zlomeniny celého glenoidu
- Transplantace allogenního kostního štěpu v léčbě rozsáhlých post-sternotomických defektů – 6 let zkušeností s metodou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



