-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Alarminy a chirurgické trauma
Alarmins and surgical injury
Surgical intervention is an inseparable part of the management of serious surgical disease. However, surgery also presents a potential risk related to the so-called surgical injury causing immune response. When dysregulated the immune activation is able to cause local complications (i.e. wound dehiscence, impaired healing). Systemic decompartmentization of the immunologic disturbance can negatively influence long-term outcomes (i.e. hospital length of stay, mortality). Due to aseptic conditions in the operating room, such an immune activation is almost always of sterile nature. This involves the release of alarmins, protein-based molecules of the damage-associated molecular patterns family. The group includes e.g. high-mobility group box 1, heat-shock proteins, proteins S100A, and more. Under normal conditions, alarmins fulfil their physiologic intracellular functions. When the cell is stressed and/or damaged, alarmins are released into the extracellular space where they probably play their cytokine-like roles activating preferably the innate immune system. A number of experimental and clinical publications have been published concerning the role of alarmins in various acute and chronic diseases. However, to date a potential relationship between alarmins and surgical injury has not been extensively studied. Identification of alarmins that influence the pathological physiology of surgical trauma might play a role in the improvement of monitoring and predicting outcomes after major surgery.
Key words:
alarmins − immune response − major surgery − sterile injury
Autoři: J. Máca 1; M. Peteja 2
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, FN Ostrava přednosta: prof. MUDr. P. Ševčík, CSc. 1; Chirurgická klinika, FN Ostrava-Poruba přednosta: doc. MUDr. P. Zonča, PhD. FRCS. 2
Vyšlo v časopise: Rozhl. Chir., 2017, roč. 96, č. 3, s. 105-113.
Kategorie: Souhrnné sdělení
Souhrn
Nedílnou součástí řešení závažného chirurgického onemocnění je provedení operačního zákroku. Intervence ovšem pro pacienta zároveň znamená i potenciální riziko související především s tzv. chirurgickým traumatem, které vyvolává imunologickou reakci. Ta pak při své dysregulaci může na jednu stranu vést zprvu k rozvoji lokálních komplikací (např. dehiscence operační rány, porucha hojení), na druhou stranu může, při své systémové dekompartmentizaci, negativně ovlivnit dlouhodobé klinické výsledky (délka hospitalizace, mortalita). Zmíněná aktivace imunitního systému má, vzhledem k asepsi operačních sálů, zpočátku téměř vždy charakter sterilního zánětu, na kterém se podílejí tzv. alarminy, látky z rodiny tzv. damage-associated molecular patterns. Patří k nim např. high-mobility group box 1, heat-shock proteiny, proteiny S100A a další. Alarminy za normální situace plní fyziologickou funkci v buňkách. Při zátěži nebo poškození buňky jsou tyto látky uvolněny extracelulárně, kde pravděpodobně hrají roli při aktivaci vrozeného imunitního systému. Existuje řada experimentálních a klinických prací, které se zabývají postavením alarminů v rámci některých akutních i chronických zánětlivých stavů. Nicméně vztah alarminů a chirurgického traumatu doposud extenzivně zkoumán nebyl. Identifikace alarminů, které ovlivňují patofyziologii chirurgického traumatu, by mohla vést ke zpřesnění monitorace a předpovědi klinického výsledku pacientů po velkých operačních výkonech.
Klíčová slova:
alarminy − imunitní odpověď − chirurgický výkon – sterilní zánětÚvod
Počet rozsáhlých chirurgických zákroků (major surgery, MS) se celosvětově zvyšuje [1−3]. Každý rok je provedeno téměř 234 milionů případů MS, což představuje přibližně 1000 úmrtí a 4000 závažných komplikací každou hodinu. Je odhadováno, že až 50 % těchto komplikací lze zabránit [4]. Typickým příkladem tzv. high-risk chirurgie jsou rozsáhlé resekční a rekonstrukční výkony na gastrointestinálním traktu (angl. major abdominal surgery MAS). Mezi klíčové faktory negativně ovlivňující klinický výsledek (outcome) zahrnuje věk, přidružená onemocnění, extenzivní a urgentní MS [5,6]. Některé charakteristiky chirurgického zákroku se také mohou podílet na výsledném klinickém stavu pacienta. Podle literatury délka zákroku významně neovlivňuje outcome [7], nicméně zvyšuje riziko vzniku hluboké žilní trombózy [8]. Negativní ovlivnění klinického výsledku (mortality) přináší velikost perioperační krevní ztráty [9,10] a použití vazoaktivní terapie v traumatologické chirurgii [11]. Výsledky týkající se vztahu perioperační tekutinové nálože a bilance nejsou jednoznačné [12].
Chirurgický výkon přináší, kromě nesporného očekávaného pozitivního ovlivnění základního onemocnění, i řadu rizik. Jedním z nich je i tzv. chirurgické trauma, které je spojeno s přímým mechanickým poškozením tkání, lokálním krvácením a ischemií způsobující hypoxemický buněčný stres. Ten pak vede k následnému reperfuznímu poškození [13]. Lokální traumatizace obvykle aktivuje mechanismy vrozené a v případě nutnosti i adaptivní, imunitní odpovědi. To za fyziologické situace vede k odklizení tkáňového detritu, zabránění rozvoje rané infekce a následně ke strukturální a funkční reparaci tkání [14]. Pokud je inzult nadměrný anebo protrahovaný, může dojít k dysregulaci této imunologické reakce. Intenzita této dysregulace je navíc ovlivněna i dalšími individuálními faktory pacienta, jako jsou například genetická predispozice a aktuální klinický stav pacienta. Pokud dojde k tzv. dekompartmentizaci zánětu na systémovou úroveň (systemic inflammatory response syndrome, SIRS), zvyšuje se frekvence infekčních komplikací, narušuje hojení ran a může negativně ovlivnit parametry klinického výsledku, např. délku pobytu v nemocnici, mortalitu, a z dlouhodobého hlediska způsobit i pokles kognitivních funkcí [14−16].
Existuje celá řada možností, jak monitorovat míru zánětlivé reakce po chirurgickém zákroku. V klinické praxi jde např. o sledování vitálních funkcí, jako jsou dechová frekvence, tepová frekvence, tělesná teplota a stav vědomí. Z laboratorních parametrů lze zmínit především stanovení počtu leukocytů a jejich diferenciální rozpočet, některých markerů akutní fáze, např. C-reaktivního proteinu (CRP) a albuminu, popř. měření hladiny vybraných interleukinů, např. IL-6. Výpovědní hodnota jak klinických, tak laboratorních parametrů je ovšem omezená [17−20]. V současnosti neexistuje žádný spolehlivý parametr, na jehož podkladě by bylo možné uspokojivě odhadnout míru chirurgického traumatu.
Alarminy jsou poměrně heterogenní skupina látek, převážně proteinové podoby, které patří mezi tzv. danger-associated molecular patterns (DAMPs). DAMPs signalizují imunitnímu systému nebezpečí (poškození) neinfekčního a částečně i infekčního charakteru, aktivují a modulují typ imunitní odpovědi. Alarminy jsou v normálním stavu lokalizovány intracelulárně a plní zde svoje specifické funkce. Nadměrný mechanický stres a inflamace, které způsobují poškození buňky, pak vedou k vyplavení nebo aktivní sekreci alarminů extracelulárně. Tam alarminy plní svou tzv. cytokine-like funkci. Jejich působení je realizováno skrze stimulaci tzv. pattern recognition receptors (PRRs) na cílových buňkách především vrozeného imunitního systému, které se účastní zánětlivé odpovědi a reparace, např. fagocyty, a dále buňky endotelií a epitelií [21,22]. Byla publikována řada prací poukazujících na možnou roli alarminů v tumorigenezi, progresi nádorového onemocnění a metastázování [23−25].
Vztah alarminů a chirurgického poškození doposud nebyl extenzivně studován. Některé alarminy by teoreticky mohly sloužit nejen k posouzení míry inzultu, ale také k predikci komplikací a klinického výsledku především po extenzivní MS. Cílem tohoto přehledového článku je představení a shrnutí současných poznatků o alarminech a jejich vztahu k velkým chirurgickým výkonům.
Danger model a alarminy
Základní funkcí imunitního systému je rozpoznání patologických signálů, které vznikají při poškození tkání, při němž dochází k narušení homeostázy organismu. Pro imunocyty je takto signalizováno „nebezpečí“, popřípadě „poškození“. Inzult, který je schopen vyvolat imunologickou reakci, může mít infekční (mikrobiální) i neinfekční (mechanický a fyzikální) původ. Signál je poté rozpoznán obvykle v prvé řadě vrozeným imunitním systémem.
Vlastní rozpoznávání signálů je důležitou schopností živých organismů (včetně rostlin). Jde o ontogeneticky konzervativní procesy důležité pro typ výsledné reakce. Ta může na jednu stranu vést ke snaze o eliminaci vyvolávajícího podnětu, anebo na druhé straně ke vzniku imunologické tolerance.
V 50. letech minulého století byla formulována teorie popisující principy aktivace imunitního systému. Její podstatou bylo, že imunitní systém rozpoznává pouze tělu cizí podnět, zatímco tělu vlastní struktury jsou tolerovány, tzn. self/non-self (SNS) model. Autoři Burnet a Medawar byli za tuto teorii v roce 1960 oceněni Nobelovou cenou. V posledních dvou desetiletích pozvolna získává popularitu novější koncept, tzv. danger model (DM), formulovaný Polly Matzingerovou, který za aktivátory imunitního systému považuje stimuly signalizující nebezpečí. DM je schopen oproti SNS vysvětlit řadu specifických situací, např. když vrozená imunita toleruje tělu cizí antigeny (bakteriémie při čištění zubů, novorozenecká tolerance mateřského mléka apod.), a naopak situace, kdy dochází k intoleranci tělu vlastních buněk a tkání (autoimunita). Je často citován výrok Polly Matzingerové v New York Times z roku 1998: „Představte si komunitu, ve které policie akceptuje kohokoliv, koho zná od základní školy, a zabije každého nového imigranta a turistu. To je SNS model. V DM jsou imigranti a turisté tolerováni, dokud nezačnou rozbíjet okna. V té chvíli policie zakročí a eliminuje je. V podstatě je vcelku jedno, jestli okna rozbíjejí cizinci nebo členové vlastní komunity.“ [26]
Aktuální názvosloví rozlišuje základní skupinu patologických signálů, tzv. damage/danger-associated molecular patterns (DAMPs), která zahrnuje dvě podskupiny: 1) tzv. pathogen-associated molecular patterns (PAMPs), spojené především s invazivně se chovajícími mikroorganismy, a 2) alarminy, endogenní signály, uvolňující se z buněk především při neinfekčním (sterilním) poškození tkáně [21,27]. Zjednodušeně je vztah těchto skupin orientačně zobrazen ve Schématu 1.
Schéma 1: Signální systémy a imunitní odpověď Scheme 1. Signaling systems and immune response 
Vysvětlivky: DAMPs signalizují potenciální hrozbu (danger), popř. vznikající poškození (damage). Exogenní stimuly infekčního původu vyvolávající imunitní reakci jsou označovány jako PAMPs. Endogenní molekuly aktivující imunitní systém se označují jako alarminy. Zkratky: DAMPs, damage-associated molecular patterns; MAMPs, microbial-associated molecular patterns; PAMPs, pathogen-associated molecular patterns; RAMPs, restitution-associated molecular patterns; LPS, lipopolysaccharide; HSPs, heat-shock proteins; HMGB1, high mobility group box 1; fMLP, N-fomylated methionine-leucyl-phenylalanine Alarminy jsou endogenní látky neinfekčního charakteru, které mají schopnost modulovat imunitní odpověď. Ovlivňují nejen funkci antigen-prezentujících buněk (např. monocyty/makrofágy, dendritické buňky), ale i eozinofilů, žírných buněk a neutrofilních granulocytů. Mohou vyvolat zánět buďto přímo (alarminy), nebo jako kofaktory (koalarminy), případně jako chaperony (funkčně pomocné molekulární struktury pro antigeny infekčního původu) [28]. Postupně byla popsána řada látek, které splňují definici alarminu. Patří mezi ně: high-mobility group box 1 (HMGB1), heat-shock proteiny (HSP), proteiny S100A, mitochondriální alarminy (mitochondrial DNA, mtDNA, formylated N-methionine-leucyl-phenylalanine, fMLP), extracelulární ATP a další. Mírně stranou stojí látky původně extracelulární lokalizace, které po své „aktivaci“, tzn. změnou své molekulární struktury vlivem zevních podnětů, mohou také vyvolat imunologickou reakci. Patří sem především tzv. matrikiny (heparan sulfát, fragmenty kyseliny hyaluronové apod.), krystaly kyseliny močové, fibrinogen a další [28,29].
Alarminy signalizují přes tzv. pattern recognition receptors (PRRs), membránové molekuly na povrchu cílových buněk, přes které probíhá také PAMPs signalizace (např. lipopolysacharid, LPS). Existuje celá řada PRRs s různou lokalizací a funkcí. Nejznámější jsou tzv. toll-like receptory (TLRs), které patří evolučně k velmi starým a konzervativním receptorovým systémům. Jsou lokalizovány nejen na povrchu buněk, ale také intracelulárně. Jejich stimulace vede obvykle ke zvýšení produkce cytokinů aktivací nukleárního faktoru kappa B a aktivace některých intracelulárních proteinkináz [21,30]. Dalším typem receptorů, často zmiňovaným v souvislosti s alarminy, jsou tzv. receptors for advanced glycation endproducts (RAGE) [31]. Schematické znázornění signalizace alarminů přes PRRs viz Schéma 2.
Schéma 2: Schéma transdukce infekčního a neinfekčního signálu Scheme 2: Scheme of infectious and sterile signal transduction 
Vysvětlivky: Infekční a neinfekční inzult vede ke zvýšení hladin exogenních (PAMPs) a endogenních (alarminy) signálních molekul, které se vážou na příslušné receptory PRRs (TLRs, RAGE) lokalizované v cytoplazmatické membráně, popřípadě intracelulárně. To vede např. ke zvýšené produkci bioaktivních látek (cytokinů) cestou aktivace NF-κB a IRFs. Zkratky: DAMPs, damage-associated molecular patterns; TLRs, toll-like receptors; HMGB1, high mobility group box 1; RAGE, receptor for advanced glycation end-products; LPS, lipopolysaccharide; LTA, lipoteichoid acid; mtDNA, mitochondrial DNA; fMLP, N-formyl methionine-leucyl-phenylalanine; NF-κB, nuclear factor kappa B; IRFs, interferon-regulatory factor; ecATP, extracellular adenosine triphosphate; HSPs, heat shock proteins; DNA, deoxyribonucleic acid; RNA, ribonucleic acid Po rozpoznání signálu může dojít k různým typům buněčné reakce, viz Tab. 1. Prozatím není zcela objasněno, co rozhoduje o tom, k jakému typu reakce dojde. Svou roli může hrát typ signálu (různé PAMPs vyvolávající různý typ reakce), odlišná buněčná lokalizace a typ receptoru (PRRs), variabilní kombinace signálů (PAMPs + alarmin, PAMPs + matrikin), typ buňky realizující odpověď, vliv lokálních mikroprostředí a cytoarchitektoniky apod. [32].
Tab. 1. Tab. 1: Typy buněčné reakce po rozpoznání signálu cestou pattern recognition receptors (PRRs) Tab. 1: Types of cellular reaction after signal recognition through pattern recognition receptors (PRRs) 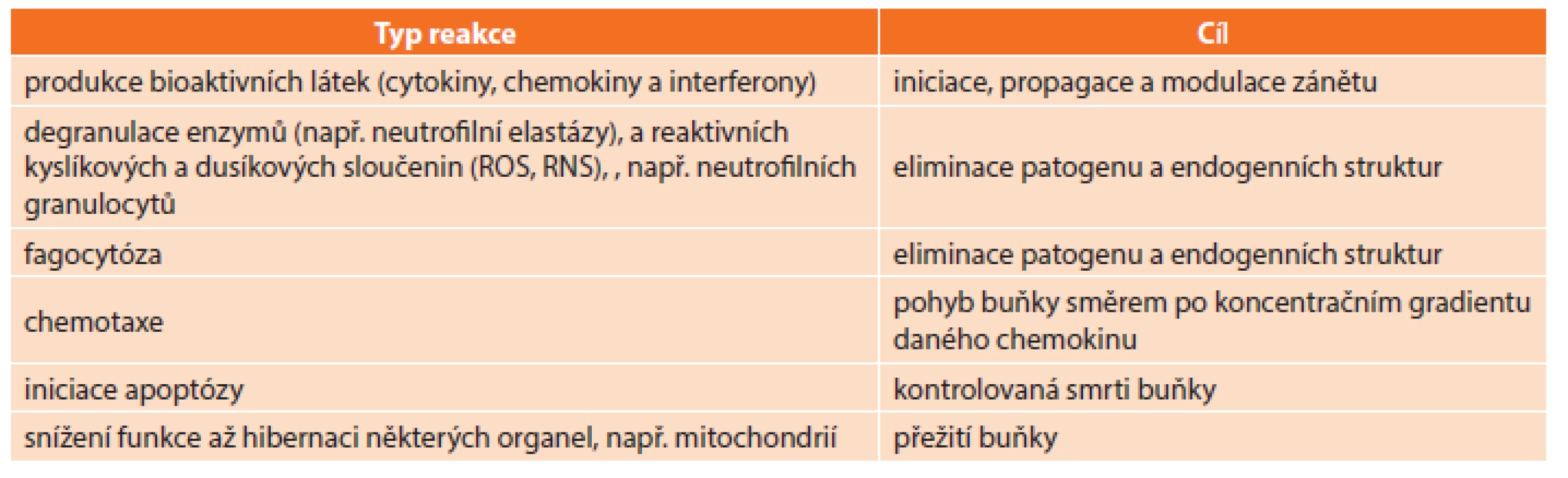
Za rizikovou situaci je považována dysregulace inflamatorní odpovědi, která následuje po nadměrném či protrahovaném inzultu a může u predisponovaných osob vést až ke vzniku tzv. syndromu systémové zánětlivé odpovědi (angl. systemic inflamatory response syndrome – SIRS) [33,34] a následně k rozvoji multiorgánového selhávání (angl. multiple-organ dysfunction syndrome – MODS, resp. multiple organ failure – MOF), viz Schéma 3.
Schéma 3: Zjednodušené schéma rozvoje sepse, SIRS a MODS Scheme 3: Simplified scheme of sepsis, SIRS and MODS development 
Vysvětlivky: Při infekčním inzultu dochází ke zvýšení hladin PAMPs a alarminů, zatímco u sterilního poškození jsou stimulem pro aktivaci imunitního systému alarminy. Při nadhraničním anebo protrahovaném působení lokálního infekčního, popř. sterilního zánětu může u predisponovaného jedince dojít k dekompartmentizaci inflamace a následně k rozvoji vzdálených orgánových dysfunkcí. Zkratky: PAMPs, pathogen associated molecular patterns; LPS, lipopolysaccharide; MODS, multiple organ dysfunction syndrome; SIRS, systemic inflammatory response syndrome Stručná charakteristika vybraných skupin alarminů
Fyziologické intracelulární funkce alarminů a zároveň jejich extracelulární role v rámci modulace imunitního systému je doposud zkoumána především na experimentální úrovni.
HMGB1 (high mobility group box 1) je ubikvitérní chromozomální protein, lokalizovaný v jádru buňky v těsném funkčním kontaktu s chromatinem (tzv. nuclear/chromatin-associated protein). Jeho základní rolí je pomoc při replikaci, transkripci a reparaci jaderné DNA, spolu s indukcí buněčné migrace a diferenciace [35]. Po jeho vyplavení do systémové cirkulace má proinflamatorní efekt v podobě potenciace cytokinové produkce. V tomto případě se pravděpodobně jedná o jeho roli chaperonu, tzn. facilitace imunitní odpovědi po rozpoznání některých PAPMs přímo navázaných na molekulu HMGB1, např. lipopolysacharidu (LPS). HMGB1 má význam i v expresi různých adhezivních molekul na povrchu endoteliálních buněk (ICAM-1, VCAM-1) a hraje roli také v integraci zánětlivé odpovědi a tkáňové reparaci. Podání HGMB1 intravenózně i intratracheálně vedlo k proinflamatorní odpovědi s rozvojem akutního plicního poškození (ALI), charakterizované nahromaděním neutrofilních granulocytů v plicním parenchymu, rozvoji plicního edému, elevací plicní produkce cytokinů (IL-1β, TNF-α) a chemokinů pro neutrofilní granulocyty (macrophage-inflammatory protein-2) [36]. HMGB1 je rozpoznáván buňkami, které exprimují na svém povrchu TLR 2 a 4 a RAGE. HMGB1 byl v posledních letech extenzivně studován u akutních i chronických zánětlivých onemocnění [37–39]. Někteří autoři ovšem význam HMGB1 jako cytokinu v poslední době spíše zpochybňují. Důvodem je absence proinflamatorní aktivity vysoce purifikovaných preparátů HMGB1 při zachovalé biologické aktivitě [35].
HSPs (heat shock proteins) jsou ubikvitérní intracelulární proteiny (cytoplazma, jádro, mitochondrie). Za fyziologických podmínek se vážou na nascentní polypeptidové řetězce, chrání je proti chybnému prostorovému poskládání a podporují jejich požadované konformační změny [40]. Jejich hlavní rolí je ochrana buňky proti nepříznivým vnějším vlivům, např. mechanickému, chemickému, ale především termickému stresu [41]. HSPs fungují, podobně jako HMGB1, jako kofaktory interakce mezi PAMPs (mikrobiální produkty – LPS, flagellin, lipopolypetidy apod.) a imunokompetentními buňkami. Jejich vlastní proinflamatorní aktivita byla také zpochybněna, a jejich role u čistě neinfekčního SIRS tedy není zcela jasná [35]. Signalizace HSP je převážně cestou TLR 2 a TLR 4.
S100A proteiny jsou velkou skupinou skládající se z více než 20 zástupců. Obsahují ve své struktuře specifický EF-hand motiv, který je složen ze dvou polypeptidových helixů propojených můstkem s afinitou pro kalcium (Ca 2+). Název celé skupiny byl odvozen od jejich 100% rozpustnosti v amonium sulfátu [42]. S100A se nachází převážně v buňkách myeloidní řady, např. S100A8 (calgranulin A) a S100A9 (calgranulin B) v granulocytech, monocytech a časných stadiích diferenciace makrofágů [43]. Za normálního stavu se podílejí na mnoha fyziologických buněčných funkcích (transkripce, intracelulární homeostáza kalcia, fosforylace proteinů, funkce cytoskeletu, růst a diferenciace buněk apod.). Při zánětu lze expresi těchto proteinů vysledovat i v epiteliálních buňkách a keratinocytech [44]. S100A12 (calgranulin C) se vyskytuje především v granulocytech [45,46]. Produkce S100A je realizována převážně aktivně mimo klasickou cestu přes Golgiho aparát. Tato cesta je typická pro řadu alarminů, jejichž primární rolí je podíl na udržování intracelulární homeostázy [47]. Fyziologická funkce S100A proteinů spočívá v regulaci funkce a intracelulárního transportu Ca2+. Některé S100A vážou i atomy zinku a mědi. Extracelulární funkce proteinů S100A je zaměřena na antibakteriální a antiparazitární imunitu. Jsou zvýšeně produkovány v místě zánětu a jejich hladina koreluje s mírou inflamace [47–49]. Některé prvky této rodiny, zejména subtyp A (A8, A9, A12), jsou považovány za potenciální alarminy, protože jsou schopny interakce s TLR4 a RAGE [43].
Mitochondriální alarminy svým efektem nejlépe odpovídají definici endogenního nebezpečného signálu, protože jejich detekce je spojena nejen s narušením integrity cytoplazmatické membrány, ale především se závažnějším stupněm poškození buňky, tzn. destrukcí vitálně důležitých organel, mitochondrií. Patří sem např. mitochondriální DNA (mtDNA), alarmin, který byl detekován extracelulárně u pacientů po traumatu. Dalším je N-formylovaný peptid Met-Leu-Phe (fMLP), který působí stimulačně na neutrofilní granulocyty. V experimentu bylo prokázáno, že aplikace mitochondriálních alarminů dokáže vyvolat plicní poškození podobné syndromu akutní dechové tísně (acute respiratory distress syndrome, ARDS). Signalizace mtDNA signalizuje přes TLR 9, zatímco fMLP se váže na formyl peptide receptor (FPR1) [50,51].
Extracelulární ATP (ecATP) působí jako signál nebezpečí zejména lokálně v místě poškození. V nízkých extracelulárních koncentracích má ecATP funkci chemoatraktanu a ko-alarminu, který potencuje inflamatorní reakci na některé bakteriální produkty, např. LPS. Ve vyšších koncentracích naopak ecATP syntézu proinflamatorních cytokinů blokuje [51].
Metodika výběru článků
Za účelem zjištění současného stavu poznání týkajícího se alarminů jako markerů sterilního tkáňového poškození a chirurgického traumatu v humánní medicíně bylo provedeno systematické vyhledávání abstraktů v databázi PubMed. Byla použita následující kombinace klíčových slov a operátorů: DAMPs OR damage-associated molecular patterns OR alarmins [Mesh] OR alarmins AND „surgery and trauma“ OR „surgical injury“ OR „surgical injuries„ OR “intraoperative complications“ [Mesh]. Interval pro vyhledávání nebyl časově omezen. Hledání poskytlo celkem 69 výsledků.
Byla přečtena abstrakta a doplněny některé publikace na podkladě prostudování referencí všech nalezených článků týkajících se chirurgie a alarminů. Výsledkem hledání bylo, že zkoumanou problematikou, tzn. vztahem chirurgie a alarminů, se relevantně zabývalo pouze 5 publikací, z nichž jedna se zabývala hepatobiliární operativou, především poškozením jater ischemicko/reperfuzním inzultem v rámci transplantace jater [52], tři se týkaly kardiochirurgie [53−55] a jedna elektivní abdominální chirurgie [56]. Vývojový diagram (flow-chart) selekce relevantních článků v rámci rešeršní práce je prezentován jako Schéma 4. Jiné typy chirurgických výkonů, např. hrudní a cévní chirurgie, a jejich vztah k alarminům nejsou aktuálně v literatuře dostupné.
Schéma 4: Vývojový diagram výběru článků Scheme 4: Flow chart of articles selection 
Alarminy a chirurgický výkon
Z naší rešeršní práce vyplývá, že je jen několik skupin chirurgických výkonů, u nichž byl v humánní medicíně zkoumán vztah alarminů a vlastního chirurgického traumatu.
Z klinických studií dominuje problematika kardiochirurgické operativy. Interpretace výsledků ovšem není jednoznačná. Demidov a kol. ve své již relativně starší práci zkoumali vztah hladiny HSP70 (konkrétně podjednotek inducibilní HSP72 a konstitutivní heat-shock cognate protein 73, HSC73) v krvi z pravé srdeční síně a v periferních leukocytech a poškození myokardu u skupiny 51 pacientů po kardiopulmonálním bypassu. Elevace hladin HSP72 byla pozorována u 40 % subjektů. Vyšší hladiny HSP72 indukované po provedení bypassu byly nalezeny u pacientů s anamnézou koronárního onemocnění (stenokardie, infarkt myokardu) trvajícího déle než jeden rok oproti pacientům s příznaky trvajícími jen kratší dobu. Pacienti, kteří měli vyšší předoperační hladinu HSP72, měli po výkonu nižší známky postoperačního poškození myokardu v podobě nižších hladin aspartát aminotransferázy (AST), laktát dehydrogenázy (LDH) a kreatinkinázy (CK) spolu s její myokardiálně specifickou subfrakcí, CK-MB. HCS73 nekorelovala s markery operačního stresu. Autoři uzavírají, že vyšší hladiny HSP72 hrají protektivní roli v prekondici myokardu před operačním výkonem, zatímco elevace konstitutivního HCS73 v pooperačním období může hrát roli v příznivém ovlivnění restituce myokardu po chirurgickém stresu [53]. To by mohlo svědčit o odlišné roli HSP70 ve srovnání s např. HMGB1 a proteiny S100A. Vyšší hladiny HSP70 odrážejí podle autorů spíše lepší schopnost tkání bránit se chirurgickému traumatu, v tomto případě ischemii, než míru vlastního poškození. McGrath a kol. se ve své práci zabývají dynamikou hladiny HSP72 v bioptickém materiálu myokardu u 12 pacientů před a po kardiochirurgickém bypassu. Autoři popisují vyšší hladiny HSP72 v humánním myokardu ve srovnání s jinými druhy savců, ale nenacházejí signifikantní zvýšení hladin HSP72 po výkonu. Závěrem práce je, že vyšší hladiny HSP72 mohou souviset s mírou předchozího kardiálního onemocnění anebo medikací a že nejsou rozdíly v perioperační dynamice hladin HSP72 [55]. Tato skutečnost by tento parametr diskvalifikovala jako potenciální marker poškození. Na druhou stranu Taggart a kol. prokázali v Tru-Cut biopsii myokardu u skupiny 4 subjektů několikanásobné zvýšení hladin HSP72/HSC73 po krátkodobém normotermickém ischemicko-reperfuzním traumatu myokardu, zatímco u protrahovaného hypotermického inzultu hladiny zůstaly bez významné elevace [54]. Tento výsledek, ač se nezabývá cytoprotektivitou HSP70, opět svědčí pro možnou roli tohoto alarminu jako markeru míry chirurgického traumatu. Při interpretaci výsledků uvedených studií je ovšem třeba brát v úvahu významné riziko bias u takto malých vzorků zařazených subjektů.
Další skupinou chirurgických zákroků, kde byla zkoumána role alarminů, je ischemicko-reperfuzní trauma po hepatobiliární operativě, konkrétně po transplantaci jater. Ilmakunas a kol. na malém vzorku 20 subjektů prokázali, že po zrušení klampu portální žíly u graftu dochází k významnému vzestupu hladin HMGB1 v kavální krvi ve srovnání s hladinami v portální žíle. Vyšší hladiny HMGB1 poté přetrvávaly a byly nezávislé na hladinách IL-6 a TNF-α. Hladiny dále korelovaly s mírou postoperační steatózy jater a elevací alanin aminotransferázy (ALT), což dle autorů naznačuje roli HMGB1 jako markeru hepatálního poškození při transplantaci jater [52].
Náš tým v pilotní studii sledoval sérové hladiny alarminů S100A5, S100A6, S100A8, S100A9, S100A11, S100A12, HMGB1 a HSP70 po elektivní extenzivní abdominální chirurgii (major abdominal surgery) u 82 pacientů. Krevní vzorky byly odebírány tři následující dny po operačním výkonu. Cílem bylo zhodnocení vztahu mezi sérovou hladinou alarminů a vybranými charakteristikami chirurgického zákroku a dále posouzení schopnosti alarminů predikovat klinický výsledek operace. Závěrem práce bylo, že hladina HMGB1 odráží závažnost chirurgického výkonu (délka, krevní ztráta a intraoperační nálož tekutin) a protein S100A8 je možno považovat za dobrý prediktor morbidity (délka pobytu na JIP) a mortality (JIP a hospitalizační) po extenzivní abdominální chirurgii [56]. Relativně nízký počet zařazených subjektů a heterogenita výkonů prozatím bohužel ztěžují generalizaci výsledků na obecnou populaci chirurgických pacientů podstupujících abdominální výkony. Jedním z dalších faktorů ztěžujících interpretaci výsledků je, že resekční výkony na trávicí trubici, především na dolním GIT, nelze považovat za striktně sterilní, a to i přesto, že pacienti podstupují lokální přípravu a je jim perioperačně podávána ATB profylaxe. Nelze tedy vyloučit ani podíl signálních molekul bakteriálního původu. Další práce zabývající se vztahem mezi extenzivním resekčním výkonem na GIT a alarminy, které by mohly doplnit a rozšířit poznatky naší studie, prozatím v literatuře dostupné nejsou.
Alarminy jsou významnou součástí aktivace imunitního systému v případech neinfekčního (sterilního) poškození a účastní se i signalizace při infekčních onemocněních. Jejich primární smyslem je upozornit na potenciální nebo již existující poškození tkání a společně s ostatními obrannými mechanismy (neurovegetativní a humorální obranné systémy), iniciovat fyziologické procesy především imunologické povahy. Tím se stávají součástí komplexního souboru fyziologicko-patofyziologických mechanismů vedoucích k odstranění patologického stavu, strukturální a funkční restituci na buněčné a tkáňové úrovni, a tím k opětovnému nastolení homeostázy organismu a zajištění jeho přežití.
V současné době je možné stanovit sérovou hladinu celé řady alarminů. Většina z nich byla extenzivně zkoumána v posledních desetiletích, a to jak z pohledu patofyziologie různých onemocnění, tak i jako potenciální klinické biomarkery anebo jako možné cíle terapeutických intervencí, např. HMGB1.
Specifikem skupiny molekul alarminů je jejich značná heterogenita zejména z hlediska lokalizace v buňce, vlastní molekulární struktury, ale také primární fyziologické funkce. Jsou popsány cytoplazmatické alarminy (např. proteiny S100A, HSPs), proteiny nacházející se v jádře buněk (HMGB1) a mitochondriální molekuly (mtDNA, fMLP). Alarmovat imunocyty mohou navíc i produkty intermediárního metabolismu (např. extracelulárně vyplavené molekuly ATP), ale i primárně extracelulárně lokalizované molekuly, u nichž dojde k narušení jejich přirozené molekulární struktury vlivem patologického procesu, tzv. matrikiny, jejich představiteli jsou fragmenty některých proteoglykanů, např. versicanu. Dalším typickým rysem alarminů je to, že se za normálního stavu nacházejí pouze v buňkách a mimo buňku se prakticky nevyskytují. Jejich zvýšená detekce extracelulárně (respektive v séru) je tedy známkou různých patologických stavů, např. chronického zánětlivého stavu [47], probíhajícího nádorového onemocnění [57], posttraumatického stavu [58] apod.
Problémem zůstávají nejasnosti stran uvolňování alarminů z buněk. Původní myšlenka, že alarminy se uvolňují jen z buňky poškozené nebo nekrotické, byla poupravena vzhledem k tomu, že některé alarminy mohou být i aktivně secernovány buňkami po jejich aktivaci (např. aktivované granulocyty vylučují HMGB1) [37]. Dalším problémem jsou některé aspekty extracelulární funkce alarminů. Bylo prokázáno, že vysoce purifikované preparáty HMGB1 a HSPs vykazují v podstatě jen minimální biologickou aktivitu [35] a fungují pravděpodobně především jako kofaktory nebo chaperony pro jiné molekuly (převážně mikrobiálního původu, např. LPS). To značně narušuje celý koncept jejich samostatného významu pro stimulaci imunitního systému. Někteří autoři dokonce poukazují na možnost aktivní sekrece některých „typických“ alarminů (S100A8/9 a S100A12) po stimulaci infekčním agens (prozatím nepublikovaná data, osobní komunikace, Holub 2015).
Rozsáhlý chirurgický výkon lze poměrně volně definovat jako zákrok s očekávanou dobou trvání více než dvě hodiny, nebo očekávanou krevní ztrátou více než 500 ml [59]. Takovýto zákrok v mnoha případech nevede jen k žádoucímu odstranění patologického stavu (např. k evakuaci abscesu, odstranění nádorového ložiska, sutuře krvácející cévy), ale je také často zdrojem poškození okolní zdravé tkáně. To v řadě případů vede k akutnímu neinfekčnímu systémovému zánětu, popř. až ve formě závažné dysregulace imunitní odpovědi.
Z pohledu signalizace tkáňového poškození by měla nadále být základní snahou operatéra standardní optimalizace chirurgického zákroku ve smyslu: 1) snížení invazivity výkonu, především v podobě minimalizace lokálního poškození, tzv. fyziologické operování, 2) maximální zkrácení operační doby, a 3) efektivní intraoperační hemostáza spojená s minimální krevní ztrátou.
Významnou součástí péče v časném pooperačním období zůstává časné rozpoznání komplikací. Kromě vlastního rizika chirurgických komplikací, jako jsou např. dehiscence operační rány, pooperační krvácení a sekundární rané infekce, se jedná především o identifikaci zjevně či skrytě probíhajících patologických procesů, např. SIRS a tkáňové hypoperfúze při larvovaném šokovém stavu. Rozpoznání těchto rizikových situací je významné pro včasné zahájení adekvátních terapeutických intervencí s cíle co nejrychlejší stabilizace klinického stavu a zajištění rychlé a efektivní reparace poškozených tkání. To pak vede k požadovanému zlepšení klinických výsledků chirurgických pacientů.
Závěr
Aktuální úroveň vědeckých důkazů zatím neumožňuje vytvořit praktické závěry týkající se vztahu alarminů a chirurgického traumatu v humánní medicíně. Průkaz toho, že sérové hladiny vybraných alarminů odrážejí míru chirurgického traumatu a/nebo mají adekvátní prognostickou roli v predikci klinického výsledku, např. u některých závažných pooperačních komplikací (dehiscence operační rány, resp. anastomóz), by mohl vést ke zpřesnění perioperační diagnostiky, zlepšení managementu a prognózy chirurgických pacientů.
Seznam zkratek
ACCP American College of Chest Physicians
ALI acute lung injury
ALT alanin aminotranferáza
AST aspartát aminotransferáza
APACHE II Acute Physiology And Chronic Health Evaluation II
ARDS acute respiratory distress syndrome
ATP adenosine triphosphate
CK kreatin kináza
CLI capillary leak index
CRP C-reactive protein/C reaktivní protein
DAMPs damage/danger-associated molecular patterns
DM danger model
ecATP extracellular adenosine triphosphate
FiO2 inspiratory fraction od oxygen
fMLP formylated Met-Leu-Phe
FN fakultní nemocnice
FPR1 formyl peptide receptor 1
GIT gastrointestinal tract/ gastrointestinální trakt
GRP78 glucose regulated protein 78
HMGB1 high mobility group box 1
HSP 70, 72 heat-shock protein 70, 72
HSC73 heat-shock cognate protein 73
IAP intraabdominal pressure/ intraabdominální tlak
IBW ideal body weight
ICAM intercellular adhesive molecule
IL-6 interleukin 6
JIP jednotka intenzivní péče
LDH laktát dehydrogenáza
LPS lipopolysaccharide
MAMPs microbial-associated molecular pattern
MODS multi-organ dysfunction syndrome
MOF multi-organ failure
mtDNA mitochondrial deoxyribonucleic acid
NF-κB nuclear factor kappa B
PAMPs pathogen-associated molecular pattern
PEEP positive end-expiratory pressure
PRRs pattern recognition receptors
RAMPs restitution-associated molecular pattern
RNS reactive nitrogen species
ROS reactive oxygen species
SCCM Society of Critical Care Medicine
SIRS systemic inflammatory response syndrome
SNS self/nonself
RAGE receptor for advanced glycation end-products
TLRs toll-like receptors
VCAM vascular cell adhesion molecule
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jan Máca
Přední Padělky 3268/9
723 00 Ostrava Martinov
e-mail: jan.maca@fno.cz
Zdroje
1. Barie PS, Hydo LJ. Epidemiology of multiple organ dysfunction syndrome in critical surgical illness. Surg Infect (Larchmt) 2000;1 : 173−85.
2. Jakobson T, Karjagin J, Vipp L, et al. Postoperative complications and mortality after major gastrointestinal surgery. Medicina (Kaunas). 2014;50 : 111−7.
3. Khuri SF, Henderson WG, DePalma RG, et al. Participants in the VA National Surgical Quality Improvement Program. Determinants of long-term survival after major surgery and the adverse effect of postoperative complications. Ann Surg 2005; 242 : 326−41.
4. Dobson GP, Longnus S, Miceli A, et al. Addressing the global burden of trauma in major surgery. Front Surg 2015;2 : 43.
5. Jhanji S, Thomas B, Ely A, et al. Mortality and utilization of critical care resources amongst high-risk surgical patients in a large NHS trust. Anaesthesia 2008; 63 : 695−700.
6. Pearse RM, Harrison DA, James P, et al. Identification and characterisation of the high-risk surgical population in the United Kingdom. Crit Care. 2006;10:R81.
7. Chu D, Bakaeen FG, Wang XL, et al. Does the duration of surgery affect outcomes in patients undergoing coronary artery bypass grafting? Am J Surg 2008;196 : 652−6.
8. Kim JY, Khavanin N, Rambachan A, et al. Surgical duration and risk of venous thromboembolism. JAMA Surg 2015;150 : 110−7.
9. Spence RK, Carson JA, Poses R, et al. Elective surgery without transfusion: influence of preoperative hemoglobin level and blood loss on mortality. Am J Surg 1990;159 : 320–4.
10. Wu WC, Trivedi A, Friedmann PD, et al. Association between hospital intraoperative blood transfusion practices for surgical blood loss and hospital surgical mortality rates. Ann Surg 2012;255 : 708−14.
11. Van Haren RM, Thorson CM, Valle EJ, et al. Vasopressor use during emergency trauma surgery. Am Surg 2014;80 : 472−8.
12. Bamboat ZM, Bordeianou L. Perioperative fluid management. Clin Colon Rectal Surg 2009;22 : 28−33.
13. Weigand K, Brost S, Steinebrunner N, et al. Ischemia/reperfusion injury in liver surgery and transplantation: Pathophysiology. HPB Surg 2012; availeble from: https://www.ncbi.nlm.nih.gov/pubmed/22693364
14. Marik PE, Flemmer M. The immune response to surgery and trauma: Implications for treatment. J Trauma Acute Care Surg 2012;3 : 801–8.
15. NeSmith EG, Weinrich SP, Andrews JO, et al. Systemic inflammatory response syndrome score and race as predictors of length of stay in the intensive care unit. Am J Crit Care 2009;18 : 339–46.
16. Eriksson LI, Kramer JH, Leung JM, et al. Perioperative cognitive decline in the aging population. Mayo Clin Proc 2011;86 : 885–93.
17. Bertsch T, Triebel J, Bollheimer C, et al. C-reactive protein and the acute phase reaction in geriatric patients. Z Gerontol Geriatr 2015;48 : 595-600.
18. Okeny PK, Ongom P, Kituuka O. Serum interleukin-6 level as an early marker of injury severity in trauma patients in an urban low-income setting: a cross-sectional study. BMC Emerg Med.2015;15 : 1–7.
19. Norberg Å, Rooyackers O, Segersvärd R, et al. Albumin kinetics in patients undergoing major abdominal surgery. PLoS One 2015; 10:e0136371.
20. Lamm G, Auer J, Weber T, et al. Postoperative white blood cell count predicts. J Cardiothorac Vasc Anesth 2006;20 : 51–6.
21. Bianchi ME. DAMPs, PAMPs and alarmins: all we need to know about danger. J Leukoc Biol 2007;81 : 1–5.
22. Pugin J. How tissue injury alarms the immune system and causes inflammatory response syndrome. Ann Intensive Care 2012;2 : 27.
23. Coffelt SB, Scandurro AB. Tumors sound the alarmin(s). Cancer Res. 2008;68 : 6482−5.
24. Salama I, Malone PS, Mihaimeed F, et al. A review of the S100 proteins in cancer. Eur J Surg Oncol 2008;34 : 357–64.
25. Sims GP, Rowe DC, Rietdijk ST, et al. HMGB1 and RAGE in inflammation and cancer. Annu Rev Immunol 2010;28 : 367−88.
26. Matzinger P. The danger model: a renewed sense of self. Science 2002;296 : 301−5.
27. Chan JK, Roth J, Oppenheim JJ, et al. Alarmins: awaiting a clinical response. J Clin Invest 2012; 122 : 2711−9.
28. Krysko DV, Agostinis P, Krysko O, et al. Emerging role of damage-associated molecular patterns derived from mitochondria in inflammation. Trends Immunol 2001;32 : 157−64.
29. Rocco PR, Dos Santos C, Pelosi P. Lung parenchyma remodeling in acute respiratory distress syndrome. Minerva Anestesiol 2009;75 : 730−40.
30. Arslan F, Keogh B, McGuirk P, et al. TLR2 and TLR4 in ischemia reperfusion injury. Mediators Inflamm 2010; availeble from: http://dx.doi.org/10.1155/2010/704202.
31. Chavakis T, Bierhaus A, Nawroth PP. RAGE (receptor for advanced glycation end products): a central player in the inflammatory response. Microbes Infect 2004;6 : 1219−25.
32. Matzinger P, Kamala T. Tissue-based class control: the other side of tolerance. Nat Rev Immunol 2011;11 : 221−30.
33. NeSmith EG, Weinrich SP, Andrews JO, et al. Systemic inflammatory response syndrome score and race as predictors of length of stay in the intensive care unit. Am J Crit Care 2009;18 : 339−46.
34. Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992;101 : 1644−55.
35. Tsan MF. Heat shock protein and high mobility group box 1 protein lack cytokine function. J Leukoc Biol 2011;89 : 847−53.
36. Lotze MT, Deisseroth A, Rubartelli A. FOCiS on damage associated molecular pattern molecules. Clin Immunol 2007;124 : 1−4.
37. Lotze MT, Tracey KJ. High-mobility group box 1 protein (HMGB1): nuclear weapon in the immune arsenal. Nat Rev Immunol 2005; 5 : 331−42.
38. Yanai Ban T, Taniguchi T. High-mobility group box family of proteins: ligand and sensor for innate immunity. Trends Immunol 2012;33 : 633−40.
39. Cohen MJ, Brohi K, Calfee CS, et al. Early release of high mobility group box nuclear protein 1 after severe trauma in humans: role of injury severity and tissue hypoperfusion. Crit Care 2009; availeble from:https://www.ncbi.nlm.nih.gov/pubmed/19887013.
40. Hartl FU, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein. Science 2002; 295 : 1852−8.
41. Caderwood SK, Mambula SS, Gray PJ Jr. Exracellular heat shock proteins in cell signaling and immunity. Ann N Y Acad Sci 2007;1113 : 28−39.
42. Heizmann CW, Fritz G, Schafer BW. S100 proteins: structure, functions and pathology. Front. Biosci 2002;7;1356−68.
43. Foell D, Wittkowski H, Vogl T, et al. S100 proteins expressed in phagocytes: a novel group of damage-associated molecular pattern molecules. J Leukoc Biol 2007;81 : 28−37.
44. Frosch M, Metze D, Foell D, et al. Early activation of cutaneous vessels and epithelial cells is characteristic of acute systemic onset juvenile idiopathic arthritis. Exp Dermatol 2005;14 : 259−65.
45. Vogl T, Pröpper C, Hartmann M, et al. S100A12 is expressed exclusively by granulocytes and acts independently from MRP8 and MRP14. J Biol Chem 1999;274 : 25291−6.
46. Pietzch J, Hoppmann S. Human S100A12: a novel key player in inflammation? Amino Acids 2009;36 : 381−9.
47. Foell, D, Roth J. Proinflammatory S100 proteins in arthritis and autoimmune disease. Arthritis Rheum 2004;50 : 3762–71.
48. Meijer B, Gearry RB, Day AS. The role of S100A12 as a systemic marker of inflammation. Int J Inflam 2012; availeble from: https://www.hindawi.com/journals/iji/2012/907078/
49. Shrikrishna G, Panneerselvam K, Westphal V, et al. Two proteins modulating transendothelial migration of leukocytes recognize novel carboxylated glycans on endothelial cells. J Immunol 2001;166 : 4678−88.
50. McIlroy DJ, Bigland M, White AE, et al. Cell necrosis-independent sustained mitochondrial and nuclear DNA release following trauma surgery. J Trauma Acute Care Surg 2015;78 : 282−8.
51. Pugin J. How tissue injury alarms the immune system and causes inflammatory response syndrome. Ann Intensive Care 2012;2 : 27.
52. Ilmakunnas M, Tukiainen EM, Rouhiainen A, et al. High mobility group box 1 protein as a marker of hepatocellular injury in human liver transplantation. Liver Transpl 2008;14 : 1517-25.
53. Demidov ON, Tyrenko VV, Svistov AS, et al. Heat shock proteins in cardiosurgery patients. Eur J Cardiothorac Surg 1999;16 : 444−9.
54. Taggart DP, Bakkenist CJ, Biddolph SC, et al. Induction of myocardial heat shock protein 70 during cardiac surgery. J Pathol 1997;182 : 362−6.
55. McGrath LB, Locke M, Cane M, et al. Heat shock protein (HSP72) expression in patients undergoing cardiac operations. J Thorac Cardiovasc Surg 1995;109 : 370−6.
56. Máca J, Burša F, Ševčík P, et al. Alarmins and clinical outcomes after major abdominal surgery − a prospective study. J Invest Surg 2016;30 : 1−10.
57. Chen H, Xu C, Jin Q, et al. S100 protein family in human cancer. Am J Cancer Res 2014; 4 : 89−115.
58. Kimura F, Shimizu H, Yoshidome H, et al. Immunosuppression following surgical and traumatic injury. Surg Today 2010;40 : 793−808.
59. Davies SJ, Francis J, Dilley J, et al. Measuring outcomes after major abdominal surgery during hospitalization: reliability and validity of the Postoperative Morbidity Survey. Perioper Med (Lond) 2013;2 : 1.
Štítky
Chirurgia všeobecná Ortopédia Urgentná medicína
Článok vyšiel v časopiseRozhledy v chirurgii
Najčítanejšie tento týždeň
2017 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Lux et veritas past, present, and future
- Alarminy a chirurgické trauma
- Kompletní miniinvazivní Ivor-Lewisova resekce jícnu
- Laparoskopická protektivní ileostomie v chirurgii karcinomu rekta
- Dodržování publikačních standardů v časopisu Rozhledy v chirurgii
- Rizika retroperitoneoskopické adrenalektomie
- Poranění levé hepatické vény v průběhu laparoskopické fundoplikace pro velkou paraezofageální hiátovou kýlu
- Wilkieho syndrom – vzácná příčina obstrukce duodena u dospělé pacientky
- Rozhledy v chirurgii
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Wilkieho syndrom – vzácná příčina obstrukce duodena u dospělé pacientky
- Laparoskopická protektivní ileostomie v chirurgii karcinomu rekta
- Kompletní miniinvazivní Ivor-Lewisova resekce jícnu
- Rizika retroperitoneoskopické adrenalektomie
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



