-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
DNA mikročipy (microarrays) v diagnostice folikulárního lymfomu: cesta k terapii „šité na míru“ nebo slepá ulička?
DNA microchips (microarrays) in follicular lymphoma diagnostics: the pathway to „tailor-made“ therapy or to impasse?
Follicular lymphoma (FL), an indolent B-lymphoproliferative disorder, is characterized by a long median survival of 8 to 10 years. Transformation to more aggressive lymphoma with poor prognosis occurs in 25–60% of patients with FL. Up to now; FL is considered to be an incurable disease with unpredictable individual course. Translocation t(14;18), the traditional genetic hallmark of FL, is of limited clinical importance only. Prognostic and laboratory parameters actually used have not been successful in individual stratification of FL patients as well. DNA microarrays enables analyses of the genomic expression program providing new insights into molecular pathogenesis of tumours. Gene expression profiling can reveal morphologically indistinguishable subgroups with different clinical behaviour in the frame of single disease, new important genes or prognosis based on molecular features. In principle, DNA microarrays are based on hybridization of tested nucleic acids (in expression microarrays RNA) with complementary oligonucleotide probes immobilized on the matrix of microarrays. The quantity of data generated by these techniques (usually thousands to tens of thousands genes) requires statistical analysis. There are several studies analysing gene expression profiling in FL from various aspects, published results generally indicate, that expression profiling of FL is relatively homogenous, transformed FL is clonally identical with its original indolent counterpart and its expression signature is more similar to those observed in FL than to those observed in de novo DLBCL. Transformation is heterogeneous process proceeded probably by at least two pathways. The nature of infiltrating non-B-cells of microenvironment seems to be of a great importance, concerning behaviour and prognosis of FL.
Key words:
follicular lymphoma, diagnosis, prognosis, gene expression profiling, DNA microarrays
Autoři: A. Janíková 1; K. Staňo-Kozubík 2; B. Tichý 2; J. Mayer 1; Z. Král 1; J. Michalka 1; I. Vášová 1; Š. Pospíšilová 2
Působiště autorů: Interní hematoonkologická klinika FN Brno Bohunice a LF Masarykovy univerzity Brno 1; Centrum molekulární biologie a genové terapie Interní hematoonkologické kliniky FN Brno Bohunice a LF Masarykovy univerzity Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 4, p. 188-194.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Folikulární lymfom (FL) je indolentní B-lymfoproliferace, jehož medián přežití se pohybuje mezi 8–10 lety. U 25–60 % nemocných však dochází k transformaci do agresivního lymfomu s velmi špatnou prognózou. FL se dosud pokládá za nevyléčitelné onemocnění, jehož individuální průběh lze jen těžko určit. Translokace (14;18) je tradičně spojována s FL, avšak její klinický význam je relativně malý. Rovněž dosud používané klinické a laboratorní parametry jsou nedostatečné v individuální stratifikaci pacientů s FL. Stanovení profilu genové exprese s využitím DNA mikročipů nabízí další možnost studia nádorů na molekulární úrovni. Takto lze diferencovat v rámci známé histopatologické diagnózy nové podjednotky, klinicky významné geny, nebo korelovat genovou expresi s prognostickými parametry. Podstatou DNA mikročipu je hybridizace testované nukleové kyseliny (u expresních čipů RNA) s komplementárními oligonukleotidovými sondami pevně lokalizovanými na čipu. Vzhledem k vysokému počtu současně vyšetřovaných genů (obvykle tisíce až desítky tisíc) je nedílnou součástí vyšetření genové exprese statistická analýza. Z výsledků studií zabývajících se významem profilu genové exprese u FL v různém kontextu této diagnózy lze konstatovat, že FL je z pohledu genové exprese relativně homogenní entita, transformovaný FL je klonálně identický s původním FL a liší se od de novo DLBCL. Transformace FL je heterogenní proces, který se děje více mechanismy. Z hlediska chování FL a prognózy mají zřejmě velký význam změny expresního profilu non-B-buněk mikroprostředí uzliny.
Klíčová slova:
folikulární lymfom, diagnóza, prognóza, profil genové exprese, DNA mikročipyÚvod
Folikulární lymfom (FL) tvoří zhruba 20–40 % všech nehodgkinských lymfomů (NHL) (1). Je typickým představitelem indolentní lymfoproliferace s mediánem přežití mezi 8–10 lety, nicméně zhruba 10-20 % pacientů zmírá do 2 let od stanovení diagnózy. FL stadia III nebo IV, který tvoří asi 85 % všech nemocných, se stále považuje za nevyléčitelné onemocnění. Ačkoliv je pro FL charakteristická dobrá senzitivita k léčbě, opakované návraty choroby jsou téměř pravidlem. Odhaduje se, že u 25–60 % nemocných dochází časem k transformaci do difuzního velkobuněčného B-lymfomu (DLBCL) (2), který se vyznačuje velmi špatnou prognózou (3). Transformace a rezistence k léčbě jsou nejčastější příčinou úmrtí na FL. Variabilita klinického chování vedla k úsilí o podrobnější stratifikaci pacientů na základě nejrůznějších klinických či laboratorních parametrů.
Morfologická klasifikace WHO rozlišuje dle podílu centroblastů a difuzní infiltrace FL grade: 1, 2, 3a a 3b. Ačkoli stratifikace vypadá jednotná a objektivní, její reprodukovatelnost kolísá i mezi zkušenými hematopatology v rozmezí 61 % až 73 % (4). Histologický grading koreluje sice s celkovým přežitím a přežitím bez nemoci (5), jeho hodnota pro konkrétního nemocného je však nízká, zvláště s přihlédnutím ke skutečnosti, že naprostá většina nemocných bývá grade 1 nebo 2 (4).
Klinický index FLIPI (= Follicular Lymphoma International Prognostic Index), který byl vytvořen pro potřeby stratifikace pacientů s folikulárním lymfomem (6, 7), je v praxi hojně využíván. Jeho diskriminační hodnota je však omezená, neboť většina pacientů „spadne“ do skupiny nízkého nebo středního rizika (8, 9, 10).
Folikulární lymfom je asociován s chromozomální přestavbou t(14;18), která je příčinou zvýšené exprese antiapoptotického proteinu bcl-2. Zdá se, že t(14;18) je sice důležitým, ale nikoli klíčovým krokem v patogeneze FL, neboť sama o sobě maligní transformaci nevyvolá. T(14;18)-pozitivní buňky lze nadto prokázat jak u benigních lymfoidních afekcí tak u ,,zdravých“ lidí (11, 12). Z uvedeného vyplývá, že dosavadní používané stratifikace a laboratorní markery nejsou dostatečné pro stanovení individuální prognózy pacienta s FL.
DNA microarrays (= DNA mikročipy) reprezentují novou metodu poznání nádorů, která umožňuje stratifikaci pacientů podle molekulární charakteristiky (profilu genové exprese) v rámci jediné histopatologické diagnózy. Pokusili jsme se, na základě publikovaných výsledků, systematizovat aktuálně dostupná data a polemizovat o přínosu DNA mikročipů v diagnostice a terapii folikulárního lymfomu. I když je téma úzce vymezeno, úvodní část je věnována obecné charakteristice, principu a způsobech interpretace dat získaných z DNA mikročipů, dále následuje výčet nejvýznamnějších studií, který je pro lepší orientaci členěn do několika podkapitol.
Na tomto místě bychom rádi učinili drobnou poznámku k terminologii. V anglicky psané literatuře se vyšetření profilu genové exprese na principu hybridizace testované a referenční DNA (= deoxyribonukleová kyselina) označuje termínem ,,DNA microarray“. Vzhledem k aktuálnímu nedostatku zavedeného českého ekvivalentu jsme si k překladu vybrali relativně stručné a výstižné spojení ,,DNA mikročip“.
DNA mikročipy
DNA mikročipy jsou novou molekulárně biologickou metodou, stále častěji využívanou v lékařství. Stanovení profilu genové exprese vychází z úvahy, že ačkoliv všechny somatické buňky organismu obsahují tutéž výbavu DNA, vždy pouze určitá její část je u dané buněčné subpopulace přepisována do mediátorové RNA (mRNA) a jako templát je využita k proteosyntéze. Na čipech je lokalizováno velké množství (tisíce až statisíce) sond, které reprezentují specifické sekvence DNA. Sondami mohou být komplementární DNA (cDNA) nebo oligonukleotidy o různých délkách. DNA mikročipy umožňují paralelní hodnocení úrovně exprese (přepisu) velkého počtu genů v určitém čase u dané buněčné populace. U expresních čipů je z testovaného vzorku nejprve lýzou a extrakcí izolována ribonukleová kyselina (celková RNA) a pomocí reverzní transkriptázy je získána cDNA. Po fluorescenčním značení sledovaného a kontrolního (referenčního) vzorku je provedena hybridizace s čipem, kdy dochází k vazbě komplementárních sekvencí ze vzorku s příslušnými sekvencemi na čipu. Intenzita a barva fluorescence testované RNA je snímána laserovým skenerem a je úměrná expresi daného genu. Získaná data lze využít různým způsobem (viz tab. 1).
Tab. 1. Přehled potenciálních výstupů, které lze získat vyšetřením DNA mikročipy. 
Na podobném principu jsou založeny i CGH mikročipy (CGH – komparativní genomová hybridizace) pro detekci chromozomových aberací. Fluorescenčně označená testovaná a referenční DNA hybridizuje s komplementárními sondami na podložním skle CGH mikročipu. Tato metoda poskytuje podrobnější informace o lokalizaci a rozsahu nebalancovaných chromozomových aberací než klasická cytogenetická CGH.
Nedílnou a klíčovou součástí čipových analýz je normalizace získaných dat a statistické vyhodnocení výsledků s cílem odlišit odchylky charakteristické pro dané patologické procesy od náhodných změn (šumu). Jedním za zásadních biostatistických přístupů jsou shlukovací (clusterové) analýzy dat. Clusterové analýzy lze provádět v zásadě dvojím způsobem. První z nich využívá myšlenky, že data mohou být vypovídající sama o sobě bez dalších informací. Tento postup je označován jako „unsupervised approach“ a nejčastěji je v tomto případě využita technika hierarchického klastrování („hierarchical clustering“). Zde je využito spontánního sdružování (= klastrování) vzorků na základě podobné nebo shodné genové exprese. Příkladem může být objev dvou odlišných podskupin v rámci DLBCL označovaných jako ABC (activated B-cell-like) a GCB (germinal-center-B-cell-like) profil, které vynikají odlišným biologických chováním a klinickým průběhem (13).
Druhá metoda analýzy je založena na koncepci, že získaná data musí být vztažena ke známým biologickým proměnným a je označována jako „supervised analysis“. Příkladem tohoto přístupu může být stanovení rozdílné genové exprese u předem definovaných podskupin pacientů s CLL na základě jejich mutačního statusu (14).
DNA analýza buněčných linií t(14;18) -pozitivních buněk
Ve snaze vnést světlo do patogeneze FL se autoři několika studií pokusili využít DNA mikročip ke srovnání genového profilu t(14;18)-pozitivních buněčných linií s nemaligními B-buňkami nebo s B-buňkami jiných lymfoproliferací.
Analýza genové exprese na cDNA mikročipu odlišila hierarchickým klastrováním linie t(14;18)-pozitivních buněk (DLBCL) od linií t(11;14)-pozitivních buněk (MCL = mantle cell lymphoma) a purifikovaných nemaligních tonzilárních B-buněk. Při srovnání t(14;18)-pozitivních buněk s tonzilárními B-buňkami bylo nalezeno 137 genů s odlišnou expresí: 68 genů se zvýšenou expresí (geny proliferace, přežití a metabolismu) a 69 genů se sníženou expresí (negativní regulátory buněčné aktivace a růstu, geny apoptózy, buněčné adheze, cytoskeletu, hlavního histokompatibilního komplexu apod.), přičemž 29 z těchto genů (20 %) mělo neznámou funkci (15).
V jiné studii byly srovnány profily genové exprese různých buněčných linií B-lymfomů. 9 linií transformovaného FL (tFL), 5 linií EBV+Burkitova lymfomu, 6 linií EBV-Burkitova lymfomu a 5 linií de novo DLBCL. Hierarchické klastrování odlišilo jednoznačně uvedené typy lymfomů (tFLvs EBV+Burkit vs EBV-Burkit vs DLBCL) navzájem a také od nemaligních B-buněk. De novo DLBCL vykazovaly poměrně variabilní genovou expresi a profil de novo DLBCL se lišil od tFL (16).
Výsledky získané na buněčných liniích mohou být zkresleny oproti reálným tumorům, avšak závěry studie CGH a expresních čipů srovnávající FL s liniemi t(14;18)-pozitivních buněk dokládají jejich překvapivou vzájemnou shodu. Distribuce a četnost většiny cytogenetických odchylek se vyskytovala v podobné míře jak u FL tak u buněčných linií, u linií byla však pozorována výrazně častěji zvýšená exprese c-MYC (17).
Profil genové exprese folikulárního lymfomu versus nemaligní lymfoidní tkáně
Z hlediska patogenezy folikulárního lymfomu je extrémně zajímavé sledovat změny na úrovni genové exprese mezi benigní lymfoidní tkání, folikulární hyperplázií a tkání folikulárního lymfomu.
Globální rozdíly v profilu genové exprese byly ve studii zkoumány mezi směsnými vzorky buněk benigní lymfoidní hyperplázie, folikulárního lymfomu, MCL a CLL/SLL (chronická lymfatická leukemie/malobuněčný lymfom). Autoři izolovali postupně mRNA od jednotlivých pacientů, kterou následně v rámci jedné diagnózy smísili, čímž dostali v určitém smyslu slova “zprůměrovaný” vzorek. Pomocí cDNA mikročipu (celkem cca 15 000 spotů/7500 unikátních genů) bylo identifikováno více než 120 genů s různou expresí mezi diagnózami, po validaci jich bylo definováno 23, avšak nebyl nalezen žádný profil charakteristický výhradně pro FL ani profil odlišující FL od hyperplázie (18).
Husson a kolektiv srovnávali profil genové exprese B-buněk u 6 vzorků uzlin FL se 6 vzorky folikulární hyperplazie. B-buňky byly izolovány imunomagnetickou deplecí, profil genové exprese byl získán na cDNA mikročipu o 588 genech, validace byla provedena RQ-PCR (real-time polymerase chain reaction). Zvýšenou expresi u FL (oproti hyperplázii) mělo 24 genů významných pro regulaci buněčného cyklu, diferenciaci B-buněk, cytokinových receptorů a celulárních interakcí; 7 genů vykázalo u FL sníženou expresi (geny negativní regulace buněčného cyklu a geny uplatňující se v mezibuněčných interakcích) (19). Obdobné výsledky byly potvrzeny i jinou studií (13 ).
Studie zaměřená na expresi genů (cDNA mikročip) různých chemokinů a jejich receptorů byla provedena na 5 vzorcích FL a 5 vzorcích reaktivní folikulární hyperplazie (RFH). Mezi FL a RFH byla nalezena významná diference v profilu genové exprese pro cytokiny a jejich receptory (u RFH byla exprese globálně nižší). Nejvýraznější rozdíl byl pozorován v genu pro IL-3Rα, který byl masivně exprimován u všech vzorků FL. Pozoruhodné je, že dle imunohistochemie byla tato exprese lokalizována do non-B-buněk, respektive do dendritických buněk uzliny (20).
Zajímavá práce srovnávala profil genové exprese B - a non-B-buněk ve vzorcích FL a vzorcích nemaligních uzlin. Na oligonukleotidovém mikročipu (Affymetrix) bylo testováno celkem 35 vzorků (26 FL a 9 nemaligních uzlin). ,,Unsupervised“ analýza odlišila 4 buněčné populace: B-buňky FL, non-B-buňky FL, B-buňky nemaligních uzlin, non-B-buňky nemaligních uzlin. ,,Supervised“ analýza nalezla významně odlišnou expresi mezi FL a nemaligní tkání uzliny jak mezi B-buňkami, tak i mezi non-B-buňkami. U FL byly v B-buňkách zvýšeně exprimovány onkogeny (bcl2, AURK2), geny germinálního centra, naopak snížená exprese byla u interferonem – stimulovaných genů. V non-B-buňkách byly u FL zvýšeně exprimovány geny T - helperů a aktivovaných T-buněk (21).
Genová exprese indolentního versus transformovaného folikulárního lymfomu
Transformace FL je spojena s velmi špatnou prognózou a je obvykle provázena dalšími cytogenetickými změnami. Tato fakta byla impulzem pro hledání rozdílů v genové expresi mezi ,,indolentním” a ,,transformovaným/agresivním” folikulárním lymfomem a snahou definovat ,,rizikový” profil časné transformace. Několik studií analyzovalo profil genové exprese na párových vzorcích folikulárních lymfomů před a v transformaci.
Analýza 12 párových vzorků provedená metodou mikročipové komparativní genomové hybridizace (,,genome-wide microarray based CGH”) doplněná expresním cDNA mikročipem potvrdila shodný klonální původ indolentních a transformovaných FL. Transformace byla u všech vzorků provázena sekundárními cytogenetickými změnami, avšak značně heterogenními. V rámci tFL bylo možné pozorovat dva různé profily: 1. skupina se zvýšenou proliferací a expresí MYC, 2. skupina se sníženou expresí MYC. (17). Výsledky v plném rozsahu potvrdila i podobně koncipovaná studie s využitím ,,Lymphochipu”, kde byly srovnány profily genové exprese u 20 párových vzorků FL a tFL. I zde byly identifikovány dva odlišné profily. První charakteristický zvýšenou mírou proliferace a zvýšenou expresí c-MYC (při současně snížené expresi genů dendritických a T-buněk) a druhý – alternativní profil bez zvýšené proliferace (22, 23). Dále byl nalezen výrazný rozdíl v expresi genů mezi tFL a de novo DLBCL (24).
Obdobně bylo v analýze 12 (testovacích) a 20 (validačních) párových vzorků FL vs tFL/DLBCL zjištěno, že FL i tFL jsou klonálně identické. tFL odpovídají profilem genové exprese spíše buňkám germinálního centra a odlišují se od de novo DLBCL. Proces transformace byl i zde provázen změnami genové exprese, zejména v genech receptorů pro růstové faktory. Analýzou na 3D-modelu odlišily FL od tFL pouhé tři geny: PLA2, PDGFRß, Rab6. Pozoruhodná byla zvýšená exprese genu pro p38MAPK u tFL. Nález byl ověřen i imunohistochemickým průkazem proteinu a význam v patogeneze FL byl potvrzen zastavením růstu t(14;18)+ linií po farmakologické inhibici p38MAPK (25).
Profil genové exprese korelující s agresivitou folikulárního lymfomu se pokusila definovat studie 80 vzorků FL (grade 1–3b). Exprese na cDNA mikročipu o 19 200 spotech byla korelována s ,,indolentním“ nebo ,,agresivním“ průběhem FL stanoveného na základě klinických, laboratorních a histologických kritérií. ,,Unsupervised“ analýza se ukázala jako nedostačující pro rozlišení podtypů v rámci FL. ,,Supervised“ analýza nalezla 81 genů s výrazně odlišnou expresí mezi indolentními a agresivními FL. Korelace vybraných genů s histologickým typem a klinickým průběhem byla excelentní, velmi slabá však s IPI (= International Prognostic Index). Geny se zvýšenou expresí u ,,agresivního“ FL byly geny buněčného cyklu, DNA syntézy a buněčného metabolismu. Geny se zvýšenou expresí u ,,indolentního“ FL byly geny infiltrujících T-buněk a makrofágů (26). Autoři pokračovali v navazující studii, jejímž cílem bylo stanovit profil genové exprese předpovídající časnou transformaci FL. Genová exprese byla korelována s typem biologického chování FL: 31 FL s časnou transformací do 3 let od diagnostické biopsie, 35 FL s dlouhodobě indolentním průběhem (≥ 7 let) a 24 vzorků tFL/DLBCL. Součástí práce bylo i imunohistochemické hodnocení párových parafinových bloků. ,,Unsupervised“ analýza odlišila FL od tFL/ /DLBCL, nicméně nerozlišila v rámci FL žádné podskupiny. Dle ,,supervised“ analýzy vykazovaly časně transformující FL překvapivě podobnost s profilem folikulární hyperplazie. Imunohistochemickým vyšetřením nebyl zjištěn žádný výrazný rozdíl v celkové distribuci a počtu tumor-infiltrujících, především T-buněk. Naopak byl pozorován rozdíl v distribuci na úrovni jednotlivých podtypů T-lymfocytů. U časně transformujících FL byly CD4+ buňky dominantně intrafolikulárně, zatímco u indolentních FL dominantně interfolikulárně. Aktivační marker T-buněk CD 69 byl asociován s časně transformujícími FL (27).
Genová exprese a význam mikroprostředí uzliny
Charakteristickou vlastností folikulárního lymfomu je nejen pomalý růst a rekurentní průběh, ale i spontánní regrese či remise. U FL lze předpokládat, že výsledné klinické chování je dáno nejen agresivitou nádorových buněk, ale také interakcí s ostatními elementy imunitního systému.
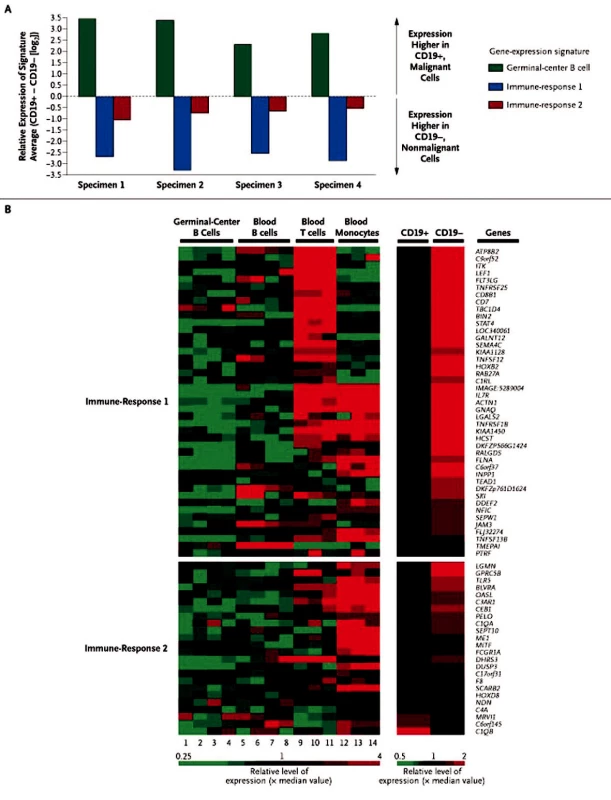
Prognostický význam tumor-infiltrujících buněk (non-B-buněk) pozorovali autoři rozsáhlé analýzy 191 vzorků nově diagnostikovaných folikulárních lymfomů. Expresní profil byl získán na celogenomovém oligonukleotidovém mikročipu (Affymetrix). Multivariantní analýza genové exprese a přežívání byla provedena na „testovacím“ souboru 95 vzorků a ověřena na souboru dalších 96 vzorků. V závislosti na celkovém přežívání byly geny s odlišnou expresí rozděleny do dvou profilů, autory označené jako „immune response“ (imunitní odpověď). Profil ,,immune-response 1“ (IR-1) s příznivou prognózou zahrnuje geny pro T-buněčné markery, geny aktivace mikrofágů (ACTN1 a TNFSF13B). Profil ,,immune-response 2“ (IR-2) s nepříznivou prognózou zahrnuje dominantně geny aktivace makrofágů, dendritických buněk. Z analýzy genové exprese provedené zvlášť pro CD19+ a CD19 - buňky plyne, že za rozdíly v profilech (IR-1, IR-2) jsou odpovědné non-B-buňky tvořící mikroprostředí uzliny (viz obr. 1) (28). Funkčnost tohoto modelu byla ověřena také na souboru 170 pacientů s FL, s tím, že pro celkové přežití je model platný, méně přesný je pro určení rizika časné transformace (29).
Prognosticky příznivou roli infiltrace T-buněk dokládají výsledky i jiných studií (26, 27, 30). T-infiltrace bývá asociována více s indolentním typem FL (26) a také s nižším rizikem brzké transformace (27). Situace však není rozhodně jednoduchá, expresní profily získané různými studiemi se jen velmi málo překrývají. Imunohistochemickým vyšetřením párových vzorků bylo navíc zjištěno, že exprese genů T-buněk neodpovídá kvantitě morfologicky definované T-infiltrace, ale spíše jde o míru aktivace jisté podskupiny T-buněk a typ jejich distribuce. Podle některých autorů je pozoruhodný význam takzvaných lymfom-asociovaných mikrofágů (LAM) a T-regulačních buněk (TREG; FOXP3+). Vysoká poměrná zastoupení LAM i TREG ve vzorcích představují negativní prognostické faktory. Rizikovým faktorem časné transformace je folikulární typ infiltrace TREG (FOXP3+ buňky), toto pozorování však nebylo potvrzeno v jiné studii (31, 27). V některých studiích byl pozorován negativní prognostický význam aktivace makrofágů (gen pro CCR1 – marker monocytární aktivace, CD68+) (30).
Genová exprese a léčebná odpověď
Využitím profilu genové exprese v předpovědi léčebné odpovědi u folikulárního lymfomu se zabývají níže uvedené práce. V jedné studii byla genová exprese na cDNA mikročipu a ,,Lymphochipu“ korelována s léčebnou odpovědí po rituximabu v monoterapii u 24 vzorků pacientů s relabujícím FL (grade 1–3). Na základě odlišné exprese 2037 genů byly identifikovány dvě skupiny FL. Jedna podskupina byla spíše podobná nemaligní lymfoidní tkáni, druhá se od ní expresním profilem výrazně lišila. Pozoruhodné je, že pacienti se špatnou odpovědí na rituximab měli genovou expresi spíše podobnou profilu normální sleziny nebo tonzily. ,,Supervised“ analýza (dle odpovědi na rituximab) ukázala, že 71 genů s vyšší expresí u pacientů se špatnou odezvou na rituximab figuruje v buněčné imunitní odpovědi, kóduje cytokiny, TNF, TCR apod., neboli tyto geny odpovídají spíše genům non-B-buněk (32).
Další studie hodnotila profil genové exprese (Affymetrix) v závislosti na léčebné odpovědi po CHOP (cyklofosfamid, adriamycin, vinkristin, prednizon) u 57 FL (grade 1–3). ,,Supervised“ analýzou bylo nalezeno 14 genů s významně zvýšenou expresí u pacientů s dobrou odpovědí na CHOP, 11 z těchto genů hraje roli v G2/M přechodu buněčného cyklu, mitóze a DNA modulaci, 3 geny měly neznámou funkci. Nejsilnějším a nezávislým prognostickým faktorem léčby po CHOP se jevila exprese CCNB1 (cyklin B1) (33).
Korelace léčebné odpovědi po RCHOP (rituximab+ +CHOP) s profilem genové exprese byla hodnocena ve studii u 66 FL (grade 1–3). ,,Unsupervised“ analýza na oligonukleotidovém čipu (Agilent/ 18 716 spotů) potvrdila relativní homogenitu genové exprese u FL. ,,Supervised“ analýza nalezla rozdíly v genové expresi mezi příznivou (doba do selhání léčby > 36 měsíců) a nepříznivou léčebnou odpovědí (doba do selhání léčby < 23 měsíců). S příznivou odpovědí a delším přežitím bez progrese (PFS = progression free survival) je asociována vysoká exprese genu EPHA1, snížená exprese SMAD1 a MARCO. Změna exprese uvedených genů byla však zjištěna mimo nádorové buňky v infiltrujících granulocytech a endoteliích (34).
Diskuse
Jaké praktické závěry lze na základě dostupných výsledků učinit? Mnohé studie se shodují na tom, že tzv. unsupervised analýzy nejsou schopny definovat v rámci FL žádné významnější podskupiny, z pohledu genové exprese je tedy FL relativně homogenní entita (26, 27). Je zřejmé, že FL se liší genovou expresí od nemaligní lymfoidní tkáně i od folikulární hyperplazie a to jak na úrovni B - tak i non-B-buněk (21). FL se ostře vyděluje profilem genové exprese oproti jiným B-lymfoproliferacím. Nelze však hovořit o existenci jakéhokoli charakteristického profilu genové exprese pro FL, který lze využít například v diferenciální diagnostice (18).
Ze studií je rovněž patrné, že transformovaný FL je klonálně identický s původním indolentním lymfomem (17, 24, 25). Genová exprese tFL se dle některých prací podobá profilu buněk germinálního centra a liší se od de novo DLBCL (25). Transformace je pravděpodobně heterogenní proces, který může probíhat různými patogenetickými cestami. U části tFL byla identifikována zvýšená exprese genů buněčné proliferace (zejména c-MYC) (17, 22, 23). Pro tFL je také charakteristická snížená exprese genů pro dendritické a T-buňky, kterou však lze vysvětlit pouhým vytěsněním původní T-buněčné populace převažujícími B-buňkami agresivního lymfomu (v korelaci s histologickým nálezem T-infiltrace, která se u FL pohybuje mezi 40 až 70 %, ale jen mezi 20 % až 50 % u DLBCL) (26). Poněkud překvapivé a obtížně vysvětlitelné je zjištění, že molekulární profil FL s rizikem časné transformace je blízký profilu folikulární hyperplazie (27). Podobně i rituximab-rezistentní FL měly molekulární profil podobný spíše nemaligní hyperplázii (32).
V současné době výsledky imunohistochemických studií a studií genové exprese podporují model folikulárního lymfomu jako choroby imunonologicky funkčních buněk, kde vzájemná interakce vlastních nádorových a okolních nenádorových buněk určuje klinické chování FL jako celku. Buněčné složení nemaligního mikroprostředí má vztah k prognóze, ale mechanismus, jakým funguje, není dosud znám (26–29). Předpokládá se, že specifické genové alterace buněk FL předurčují funkční kompozici mikroprostředí nádorově změněné uzliny. Tyto úvahy odráží zajímavé výsledky recentních prací zkoumajících rozdíly v genové expresi mezi buňkami FL a jejich vliv na distribuci a chování T-buněk okolí (35, 36).
Interpretace a srovnání výsledků DNA čipové analýzy (nejen v případě folikulárního lymfomu) naráží na značnou různorodost v pojetí jednotlivých prací. Úskalí spočívají kromě vlastní koncepce studie, v použité metodice (typu DNA čipu, skladbě a počtu genů na čipu), různých kritériích výběru pacientů a zejména použití odlišných statistických algoritmů. Je třeba si uvědomit, že dosud není zaveden žádný „zlatý standard“ ve statistickém zpracování dat získaných na DNA čipech (37). V neposlední řadě je třeba vzít v úvahu relativně nízké počty vzorků (většinou v řádu několika málo desítek), kterými naprostá většina studií s FL disponuje.
Technologie DNA mikročipů je nepochybně dalším kvalitativním krokem v poznání nádorových chorob a potažmo i folikulárního lymfomu. Aplikace DNA čipů u agresivních lymfomů přinesla záhy elegantní výsledky s rozlišením podtypů DLBCL, Burkittova lymfomu a podobně. Tento optimismus byl v případě folikulárního lymfomu prozatím vystřídán spíše rozpaky a jistým zklamáním z nejednoznačných výsledků. Lze předpokládat, že využití DNA čipů u FL pro nejbližší budoucnost pravděpodobně nepřekročí práh experimentálních laboratoří a význam této technologie v rutinní klinické praxi bude nutné teprve stanovit.
Tato práce byla podpořena výzkumným záměrem MŠMT – MSM0021622430 a grantem NF Elpida-Nucleus.
MUDr. Andrea Janíková, Ph.D.
Interní hematoonkologická klinika
FN Brno Bohunice
Jihlavská 20
625 00 Brno
e-mail: ajanikova@fnbrno.cz
Doručeno do redakce: 2. 7. 2008
Přijato: 10. 7. 2008
Zdroje
1. Harris NL, Jaffe ES, Diebold J, et al. World Health Organization classification of neoplastic diseases of hemopoietic and lymphoid tissues: report of the Clinical Advisory Comittee meeting-Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835–49.
2. Lossos I., Levy R. Higher grade transformation of follicular lymphoma: phenotypic tumor progression associated with diverse genetic lesions. Seminars in Cancer Biology 2003; 13 : 191–202.
3. Horning SJ. Natural history of and therapy for the indolent non-Hodgkin’s lymphomas. Semin Oncol 1993; 20 (suppl 5): 75–88.
4. The Non-Hodgkin’s Lymphoma Classification Project: A clinical evaluation of the International Lymphoma Study Group of non-Hodgkin’s lymphoma. Blood 1997; 89 : 3909–3918.
5. Nathwani BN, Harris NL, Weisenburger D. Follicular lymphoma. In: Pathology an genetics of tumours of haematopoietic and lymphoid tissues. Jaffe ES, Harris NL, Stein H et al (eds.) Lyon, France, IARC Press 2001; 162–167.
6. Federico M, Vitolo U, Zinzani PL, et al. Prognosis of follicular lymphoma: a predective model based on a retrospective analysis of 987 cases. Intergruppo Italiano Linfomi. Blood 2000; 95 : 783–789.
7. Solal-Céligny P, Roy P. Follicular lymphoma International Prognostic Index (FLIPI). Blood 2004; 104 : 1258–65.
8. Decaudin D, Lepage E, Brousse N, et al. Low-grade stage III-IV follicular lymphoma: multivariate analysis of prognostic factors in 484 patients – a study of the groupe d’Étude des lymphomes de l’Adulte. J Clin Oncol 1999; 17 : 2499–2505.
9. Radojkovic M, Ristic S, Colovic M, Mihaljevic B, Cemerikic-Martinovic V. Predictive Value of Prognostic Indices in Patients with Follicular Lymphomas. Med Oncol 2006; 23 : 533–42.
10. Vose JM, Bierman PJ, Loberiza FR, et al. Long-term outcomes of autologous stem cell transplantation for follicular Non-Hodgkin’s Lymphomas: Effect of histological grade and Follicular Lymphoma International Prognostic Index. Biol Blood Marrow Transplant 2008; 14 : 36–42.
11. Limpens J, de Jong D, van Krieken JH, et al. Bcl-2/JH rearragements in benign lymphoid tissues with follicular hyperplasia. Oncogene 1991; 6 : 2271–2276.
12. Obořilová A, Dvořáková D, Mayer J. Translokace t(14;18) a její význam ve sledování minimální zbytkové nemoci u folikulárního lymfomu. Transfuze a hematologie dnes 2004; 10 : 51–61.
13. Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature 2000; 403 : 503–511.
14. Rosenwald A, Alizadeh AA, Widhopf G, et al. Relation of gene expression phenotype to immunoglobulin mutation genotype in B cell chronic lymphocytic leukemia. J Exp Med 2001; 194 : 1639–1647.
15. Robetorye RS, Bohling S, Morgan JW, Fillmore GC, Lim MS, Elenitoba-Johnson KS. Microarray analysis of B-cell lymphoma cell lines with t(14;18). Journal of Molecular Diagnostics 2002; 4 : 123–136.
16. Maesako Y, Uchiyama T and Ohno H. Comparison of gene expression profiles of lymphoma cell lines from follicular lymphoma, Burkitt’s lymphoma and de novo DLBCL. Cancer Sci 2003; 94 : 774–781.
17. Martinez-Climent JA, Alizadeh AA, Segraves R, et al. Transformation of follicular lymphoma to diffuse large cell lymphoma is associated with heterogenous set of DNA copy number and gene expression alterations. Blood 2003; 101 : 3109–3117.
18. Schmechel SC, LeVasseur RJ, Yang KHJ, Koehler KM, Kussick SJ, Sabath DE. Identification of genes whose expression patterns differ in benign lymphoid tissue and follicular, mantle cell, and small lymphocytic lymphoma. Leukemia 2004; 18 : 841–855.
19. Husson H, Carideo EG, Neuberg D, et al. Gene expression profiling of follicular lymphoma and normal germinal center B cells using cDNA arrays. Blood 2002; 99 : 282–289.
20. Fujii A, Oshima K, Hamasaki M, et al. Differential expression of cytokines, chemokines, and their receptors in follicular lymphoma and reactive follicular hyperplasia: Assessment by complementary DNA microarray. Oncology Reports 2005; 13 : 819–824.
21. Tarte K, Pangault C, de Vos J, et al. Gene expression profiling of highly purified malignant and non-malignant cells: characterization of the tumor-microenvironment cellular synapse in de novo follicular lymphoma (FL). Blood 2007; 110 : 111a (abstr No 355).
22. Davies AJ, Rosenwald A, Wright G, et al. Transformation of follicular lymphoma to diffuse large B-cell lymphoma proceeds by distinct oncogenic mechanisms. Blood 2007; 136 : 286–293.
23. de Vos S, Hofmann WF, Grogan TM, et al. Gene expression profile of serial samples of transformed B-cell Lymphomas. Lab Invest 2003; 83 : 271–285.
24. Lossos IS, Alizadeh AA, Diehn M, et al. Transformation of follicular lymphoma to diffuse large-cell lymphoma: Alternative patterns with increased or decreased expression of c-myc and its regulated genes. PNAS 2002; 99 : 8886–8891.
25. Elenitoba-Johnson KSJ, Jenson SD, Abbott RT, et al. Involvement of multiple signaling pathway in follicular lymphoma transformation: p38-mitogen-activated protein kinase as a target for therapy. PNAS 2003; 100 : 7259–7264.
26. Glas AM, Kersten MJ, Delahaye LJMJ, et al. Gene expression profiling in follicular lymphoma to assess clinical aggressiveness and to guide the choice of treatment. Blood 2005; 105 : 301–307.
27. Glas AM, Knoops L, Delahaye L, et al. Gene-expression and immunohistochemical study of specific T-cell subsets and accessory cell types in the transformation and prognosis of follicular lymphoma. J Clin Oncol 2007; 25 : 390–398.
28. Dave SS, Wright G, Tan B, et al. Prediction of survival in follicular lymphoma based on molecular features of tumor-infiltrating immune cells. N Engl J Med 2004; 351 : 2159–69.
29. Johnson NA, Nayar T, Dave SS, et al. Gene expression model of survival and transformation in follicular lymphoma (FL) a study by the LLMPP. Blood 2007; 118 : 767a (abstr No 2606).
30. Byers RJ, Sakhinia E, Preethi J, et al. Clinical measurement of prognostic immune signature in follicular lymphoma by RT-PCR based gene expression profiling and immunohistochemistry demonstrates favourable T-cell and unfavourable macrophage infiltration. Blood 2007; 110 : 112a (abstr No 359).
31. Farinha P, Al-Tourah A, Connors JM, Gascoyne RD. The architectural pattern of POXP3+ T-cells predicts risk of transformation in patients with follicular lymphoma (FL). Blood 2007; 110 : 112a (abstr 358).
32. Bohen SP, Troyanskaya OG, Alter O, et al. Variation of gene expression patterns in follicular lymphoma and the response to rituximab. PNAS 2003; 100 : 1926–1930.
33. Björck E, Ek S, Landgren O, et al. High expression of cyclin B1 predicts a favourable outcome in patients with follicular lymphoma. Blood 2005; 105 : 2908–2915.
34. Harjunpää A, Taskinen M, Nykter M, et al. Differential gene expression in non-malignant tumour microenvironment is associated with outcome in follicular lymphoma patients treated with rituximab and CHOP. BJH 2006; 135 : 33–42.
35. Irish JM, Hsu FY, Sharman JP, et al. A profile of 648 signaling network events identifies cell subsets with diverse, abnormal responses to lymphocyte stimuli within follicular lymphoma tumors. lood 2007; 110 : 111a (abstr No 356).
36. Leich E, Salaverria I, Bea S, et al. Follicular lymphomas with and without translocation t(14;18) differ in gene expression profiles and genetic alterations. Blood 2007; 110 : 113a (abstr No 360).
37. Lossos IS, Morgensztern D. Non-Hodgkin’s lymphoma in the microarray era. Clinical Lymphoma 2004; 128–129.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2008 Číslo 4- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
- Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
- Vyhledávání příbuzenského dárce krvetvorných buněk – koordinace procesu a výsledky jednoho centra
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- DNA mikročipy (microarrays) v diagnostice folikulárního lymfomu: cesta k terapii „šité na míru“ nebo slepá ulička?
- Autotransfuze v České republice v roce 2007
- GRATULUJEME
- Vybrané odborné akce v roce 2009
- OBSAH ROČNÍKU 14/2008 Transfuze a hematologie dnes
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučený postup
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy