-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
Imatinib in the first-line treatment of chronic myelogenous leukemia in chronic phase
Imatinib has changed the paradigm of chronic myelogenous leukemia (CML) treatment. Moving imatinib into the first-line CML therapy is based predominantly on excellent results of IRIS trial. Population-based real-life data, however, are still scarce. The aim of the study was to describe the efficacy and toxicity of imatinib in the first-line setting on an unselected population of CML patients. Data about CML patients in the first chronic phase who were treated with imatinib were prospectively collected into the database called INFINITY. One of the main goals was to include all consecutive patients treated in two large hematooncological centers in Prague and Brno. 105 patients (pts) have been included (51 males and 54 females) aged 54 years (median; 20–77). Median follow-up at the date of the analysis was 16 months (0.3–50). The median actually administered imatinib dose was 400 mg. After 12 months of therapy, the response rates were: complete hematological response 94 %, complete cytogenetic response 70 %, partial cytogenetic response 14 % and major molecular response 42 % with 4 % of complete molecular responses; at twelve months Bcr-Abl expression was 0.15 % (median; 0 %–31 %). In total, 15 patients stopped the treatment for various reasons: 5 pts underwent allogeneic hematopoietic stem cell transplantation, 7 pts changed the tyrosine kinase inhibitor for imatinib failure (dasatinib, n = 6; nilotinib, n = 1), and 3 patients were switched to dasatinib for intolerable non-hematological toxicity. There was only one death, however, linked to the alcohol intoxication.
Key words:
chronic myelogenous leukemia, imatinib, treatment
Autoři: J. Mayer 1; H. Klamová 2; D. Žáčková 1; P. Cetkovský 2; M. Doubek 1; J. Moravcová 2; J. Rulcová 2; K. Machová 2; D. Dvořáková 1; T. Jurček 1; J. Březinová 2; K. Michalová 2,3; Z. Zemanová 3; A. Oltová 4
Působiště autorů: Interní hematoonkologická klinika FN a LF Masarykovy univerzity, Brno, 2Ústav hematologie a krevní transfuze, Praha, 3Centrum nádorové cytogenetiky ÚKBLD VFN a 1. LF UK, Praha, 4Oddělení lékařské genetiky FN, Brno, Česká leukemická skupina – pro život (Th 1
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 4, p. 150-158.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Imatinib změnil přístup k léčbě pacientů s chronickou myeloidní leukemií (CML). Na základě vynikajících výsledků studie IRIS se stal u nemocných s CML lékem první volby. Nicméně dat o účincích imatinibu na neselektované populaci pacientů je stále poskrovnu. Cílem studie bylo popsat účinnost a toxicitu imatinibu jako léku první volby u neselektované skupiny nemocných s CML, kteří byli prospektivně zařazováni do databáze INFINITY. V databázi jsou evidováni všichni po sobě přicházející nemocní s CML v 1. chronické fázi, léčení imatinibem na dvou velkých hematoonkologických pracovištích v Praze a Brně. Analyzována byla data od 105 pacientů (51 mužů a 54 žen), medián věku 54 let (20-77). Medián sledování byl k datu analýzy 16 měsíců (0,3–50). Medián průměrné denní dávky imatinibu pro pacienta byl 400 mg. Po 12 měsících léčby byly zjištěny následující léčebné odpovědi: kompletní hematologická remise 94 %, kompletní cytogenetická odpověď 70 %, parciální cytogenetická odpověď 14 %, velká molekulární odpověď 42 % se 4 % kompletních molekulárních odpovědí. Medián exprese Bcr-Abl transkriptu ve 12. měsíci léčby byl 0,15 % (0–31 %). Celkem 15 nemocných léčbu imatinibem během sledování ukončilo: 5 podstoupilo alogenní transplantaci krvetvorných buněk, u 7 nemocných byl imatinib nahrazen jiným tyrosinkinázovým inhibitorem pro léčebné selhání (6 dasatinib, 1 nilotinib) a u 3 nemocných byl imatinib nahrazen dasatinibem pro závažnou nehematologickou toxicitu. Během sledování bylo zaznamenáno pouze jedno úmrtí, jehož příčinou však nebyla CML, ale intoxikace alkoholem.
Klíčová slova:
chronická myeloidní leukemie, imatinib, léčbaÚvod
Chronická myeloidní leukemie (CML) je poměrně vzácné onemocnění, jehož vyléčení je stále problematické. Od začátku nového tisíciletí je však k dispozici moderní terapie, která dosavadní léčebné postupy zcela změnila, o čemž bylo i v naší literatuře opakovaně referováno (1, 2). Jde o inhibitory BCR-ABL tyrosinkinázy, z nichž se jako první do klinického používání dostal imatinib. In extenso bylo o tomto novém postupu poprvé referováno v roce 2001 (3, 4) a od té doby následovala záplava dalších sdělení. Důležité jsou zprávy o významu imatinibu u nemocných v akcelerované fázi CML a po selhání interferonu (5, 6). Zásadní studií potvrzující vysokou účinnost imatinibu byla tzv. IRIS studie (International Randomized Study of Interferon and STI571 Trial), testující imatinib jako léčbu 1. linie u nově diagnostikovaných nemocných oproti kombinaci interferon alfa a cytarabin. Studie přinesla vynikající výsledky úvodní léčby imatinibem (7–9), i když jako každá terapie není ani imatinib prost vedlejších účinků (3, 4, 10).
V rámci České leukemické skupiny – pro život (THE CZECH LEUKEMIA STUDY GROUP – FOR LIFE, CELL) probíhá několik projektů, které se snaží některé postupy v rámci ČR standardizovat a také kontinuálně sbírat data o léčebných postupech a porovnávat je s výsledky zahraničních prací. Jedním z projektů je léčba imatinibem v první linii u nově diagnostikovaných nemocných s CML. V této práci předkládáme první podrobnou analýzu tohoto projektu.
Soubor nemocných a metody
Prospektivní analýza zahrnuje prvních 105 po sobě jdoucích nemocných s nově diagnostikovanou CML v chronické fázi (11), vyšetřených a léčených imatinibem na Ústavu hematologie a krevní transfuze Praha (55 pacientů) a na Interní hematoonkologické klinice Brno (50 pacientů).
Léčba
Podle klinického stavu a podle rozhodnutí konkrétního lékaře byla léčba zahájena hydroxyureou (HU) a nebo leukaferézou. Nemocní byli poté léčeni standardní dávkou imatinibu 400 mg jedenkrát denně. Jedenáct nemocných bylo léčeno imatinibem v rámci německé randomizované studie, která obsahuje i rameno s 800 mg imatinibu. Tuto dávku nakonec ale dostali jen 2 pacienti. Při výskytu nežádoucích účinků byly dávky upravovány podle platných preskribčních informací (10). V případě nedostatečné léčebné odpovědi bylo postupováno podle rozvahy ošetřujícího lékaře v intencích platných doporučení (11, 12). Pravidelná vyšetření byla také prováděna podle platných doporučení (11) a nemocní byli v prvním roce léčby kontrolováni minimálně jedenkrát za 3 měsíce. Kromě klinického a základního laboratorního vyšetření vč. krevního obrazu a analýzy BCR-ABL bylo provedeno také kontrolní vyšetření kostní dřeně s cytogenetickou analýzou, a to v prvním roce ve 3měsíčních, poté v 6měsíčních intervalech.
Databáze
Informace o nemocných a průběhu léčby jsou průběžně ukládány do databáze INFINITY (tyrosine kinase Inhibitors iN the FIrst aNd followIng CML Treatment). Nemocní zařazení do klinických studií podepsali informovaný souhlas se zařazením do těchto studií, písemný souhlas se zařazením do databáze nebyl požadován. Na obou pracovištích byly lokálně instalovány identické verze databáze, které jsou plněny daty. Pro následné analýzy bývají data spojena. Hlavní položky databáze jsou následující:
- Identifikace nemocného a základní anamnestická data: datum narození, pohlaví, věk při diagnóze, podávání hydroxyurey, ev. další terapie vč. provedení leukaferézy, kuřáctví.
- Fyzikální vyšetření, vč. performance stavu (Karnofsky, ECOG).
- Kompletní krevní obraz a diferenciální rozpočet leukocytů v %.
- Vyšetření kostní dřeně cytologické nebo histologické.
- Stanovení prognózy podle Sokala a Hasforda (11).
- Cytogenetické vyšetření: přítomnost Ph+ buněk v %, přítomnost jiných cytogenetických změn, přítomnost dalších cytogenetických změn v Ph+ buňkách.
- Molekulárně genetické vyšetření: určení přestavby Bcr-Abl transkriptu (kvalitativní multiplex PCR), monitorování hladiny Bcr-Abl transkriptu (real-time kvantitativní RT-PCR (RQ-PCR), kvalitativní nested RT-PCR), detekce a charakterizace mutací v kinázové doméně BCR-ABL.
- Léčba: průměrná denní dávka imatinibu ve sledovaném 3měsíčním období, nehematologické a hematologické toxicity podle CTC, resp. CTCAE (13), vysazení imatinibu a jeho důvod.
- Léčebná odpověď podle doporučení expertů Evropské leukemické sítě (ELN) a kritérií užitých ve studii IRIS (11).
- Další osud nemocných: transplantační léčba, blastický zvrat, úmrtí.
Jen u menšiny nemocných nebyla z rozmanitých příčin některá data k dispozici.
Cytogenetické vyšetření
Klasické cytogenetické vyšetření buněk kostní dřeně bylo prováděno na obou pracovištích obdobně po 24hodinové kultivaci v médiu RPMI. Bylo hodnoceno 22 mitóz (Praha, barvení dle Wrighta) a nebo 20 mitóz (Brno, barvení Giemsa-Romanowski). Karyotypy byly popsány podle ISCN nomenklatury (14).
V některých případech (logistické, technické příčiny, při nemožnosti obdržet kvalitní nález klasickou technikou) byla použita metoda FISH, někdy byly provedeny obě metody současně. Pražské pracoviště používalo při FISH analýze komerčně dodávanou sondu LSI BCR/ABL Dual Color, Dual Fusion Translocation Probe (Abbott VYSISTM) a protokol doporučený výrobci. Sonda je značená SpectrumOrange (gen ABL) a SpectrumGreen (gen BCR). U každého pacienta bylo hodnoceno 10 mitóz a 100 interfázních jader. Jako pozitivní byl brán nález fúzního genu nejméně ve 2,5 % jader. Brněnské pracoviště používalo komerčně dodávanou sondu LSI BCR/ABL ES Dual Color Translocation Probe (Abbott VYSISTM) se stejně značenými geny jako u DNA sondy používané v Praze. Hodnoceno bylo 150 interfázních jader a 10 mitóz, za pozitivní nález byla považována 2 % interfázních jader s fúzním signálem BCR-ABL.
Molekulárně genetické vyšetření
1. Rutinní analýzy
Praha: Celková RNA byla extrahována z GITC (quanidium isothiokyanát) lyzátu celkových leukocytů (5 mil. buněk) z periferní krve pacientů metodou kyselé fenol-chloroformové extrakce (15). cDNA byla syntetizována pomocí náhodných hexamerů a reverzní transkriptázy MMLV (Promega, Madison, USA). RQ-PCR pro fúzní gen BCR-ABL a kontrolní gen beta-2mikroglobulin (B2M) probíhala na přístroji RotorGene 3000 (Corbett Research, Sydney, Austrálie) (16). Primery, próby a plazmidové standardy (Ipsogen, Marseille, Francie) byly připraveny podle protokolů Europa Against Cancer (17, 18). Vzorky, u kterých nebyla pomocí RQ-PCR zjištěna přítomnost Bcr-Abl transkriptu nebo jejich Ct bylo vyšší než Ct plazmidového standardu nesoucího 10 kopií BCR-ABL, byly testovány nested RT-PCR, která je asi 10x citlivější (0,001 % BCR-ABL) než RQ-PCR (0,01 % BCR-ABL). Teprve vzorky, u kterých byla nepřítomnost transkriptu Bcr-Abl potvrzena nested RT-PCR, byly označeny za negativní.
Brno: Celková RNA byla izolována z celkových leukocytů periferní krve pacientů pomocí kitu RNeasy Mini Kit (Qiagen, Hilden, Německo). RNA byla reverzně transkribována s použitím náhodných hexamerů a MuLV reverzní transkriptázy (RNA-PCR Core Kit, Applied Biosystems, USA). Pro RQ-PCR fúzního transkriptu BCR-ABL a kontrolního genu ABL byla použita TaqMan technologie podle standardizovaného protokolu (17, 18). Plazmidové standardy pro sestavení standardních křivek pro BCR-ABL a kontrolní gen ABL byly zakoupeny od firmy Ipsogen (Marseille, France). Výsledek exprese BCR-ABL genu byl normalizován k expresi genu ABL. RQ-PCR byla provedena na přístroji 7300 SDS (Applied Biosystems, USA).
2. Externí kontrola kvality
Na obou pracovištích proběhla externí kontrola kvality. Obě pracoviště si vzájemně vyměnila vzorky, které podrobila svým RQ-PCR analýzám (viz výše). Výsledky byly vzájemně porovnány. Příprava vzorků: Lyzáty buněk K562 v lyzačním pufru GITC (107 buněk/ml) byly ředěny lyzátem leukocytů zdravého dárce (107 buněk/ml), kdy množství Bcr-Abl transkriptu bylo snižováno přes 6 řádů (ředění 10x, 100x,…,106x).
Výsledky
Do analýzy bylo zahrnuto 105 nemocných (51 mužů a 54 žen) ve věku 20–77 let (medián 54 let). 103 zahájilo terapii HU a 13 leukaferézou s tím, že všichni nemocní, kteří měli leukaferézu, měli také HU. Medián doby od stanovení diagnózy do zahájení terapie imatinibem byl 1,8 měsíců (0–15,3). Medián sledování k datu analýzy byl 16 měsíců (0,3–50). Počty sledovaných nemocných v jednotlivých časových intervalech plánovaných kontrol a záznamů do databáze byly k datu analýzy následující: 3. měsíc 101, 6. měsíc 95, 9. měsíc 92, 12. měsíc 76, 18. měsíc 46, 24. měsíc 34, 30. měsíc 23, 36. měsíc 14 a 48. měsíc 2.
Rozložení pacientů podle rizika bylo následující: skóre podle Hasforda: nízké riziko 34 %, střední riziko 52 %, vysoké riziko 14 %; skóre podle Sokala: nízké riziko 42 %, střední riziko 36 %, vysoké riziko 22 %. Hasfordovo a Sokalovo skóre bylo možné vypočítat u 104 ze 105 našich nemocných, což je podstatně více než ve studii IRIS (7). Rozložení transkriptů Bcr-Abl bylo takovéto: b3a2 63,6 %, b2a2 33,3 %, e1a2 2,1 % a b3a3 1 %.
Výsledky dynamiky řady laboratorních a klinických parametrů jsou přehledně uvedeny v tabulkách 1–4. Hmotnost nemocných zůstávala stabilní, v průběhu prvního roku se zmenšovala slezina a docházelo také ke zlepšování performance stavu (tab. 1). Normalizace parametrů krevního obrazu a nálezu v kostní dřeni byla promptní. Do 3 měsíců dosáhlo kompletní hematologické remise (jen dle parametrů krevního obrazu) 96,8 % nemocných (tab. 2). Procento dosažených kompletních a parciálních cytogenetických remisí bylo ve 12. měsíci 70 % a 14 % a ve 24. měsíci 81 % a 5 % (tab. 3). Pokles hladin patologického transkriptu Bcr-Abl byl strmý a dosažení velké a kompletní molekulární odpovědi bylo ve 12. měsíci 38 % a 4 % a ve 24. měsíci 36 % a 13 % (tab. 4).
Tab. 1. Vývoj některých parametrů fyzikálního vyšetření a performance stavu (PS) v průběhu léčby imatinibem. 24 měsíců bylo sledováno jen 34 nemocných, proto data v tomto a po tomto měsíci mohou být méně přesná. 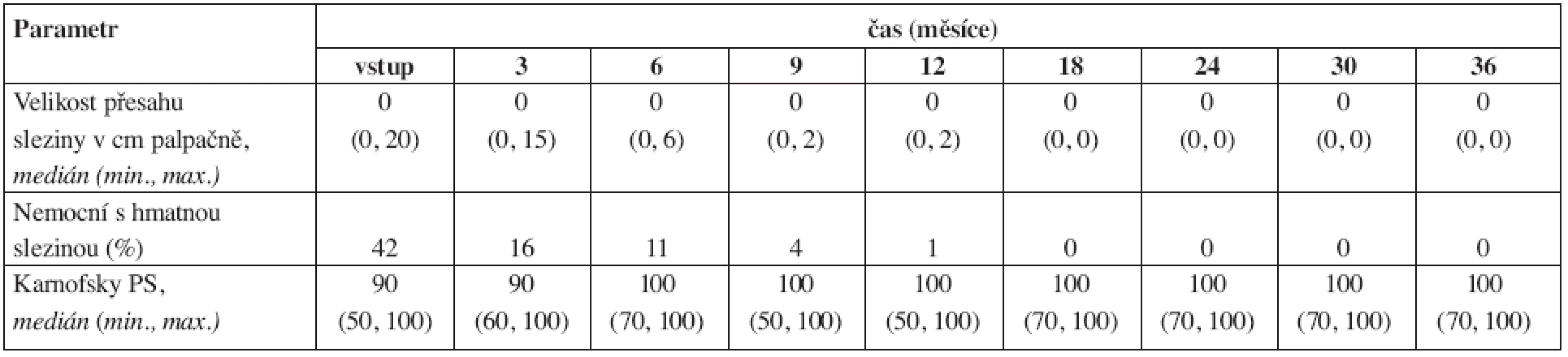
Tab. 2. Vývoj některých parametrů krevního obrazu v průběhu léčby imatinibem. 24 měsíců bylo sledováno jen 34 nemocných, proto data v tomto a po tomto měsíci mohou být méně přesná. ELN = kritéria podle European LeukemiaNet (11), IRIS = kritéria podle IRIS studie. Vysoké hodnoty trombocytů byly zaznamenány u pacienta, který měl kromě chronické myeloidní leukemie prokázanou i JAK2 V617F pozitivní myeloproliferativní nemoc. 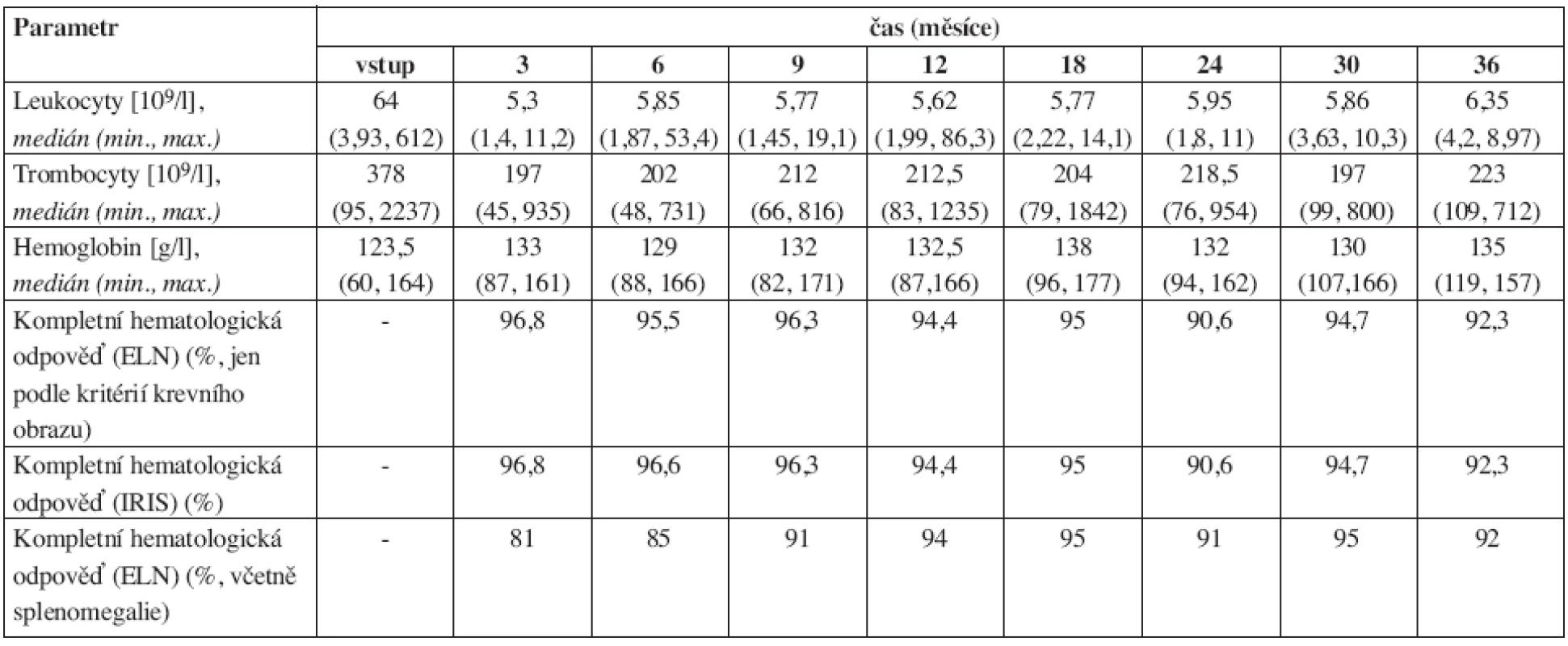
Tab. 3. Vývoj některých parametrů cytogenetického nálezu v průběhu léčby imatinibem. 24 měsíců bylo sledováno jen 34 nemocných, proto data v tomto a po tomto měsíci mohou být méně přesná. ELN = kritéria podle European LeukemiaNet (11), IRIS = kritéria podle IRIS studie. CgR = cytogenetická odpověď (cytogenetic response), C = kompletní (complete), P = parciální, M = velká (major). 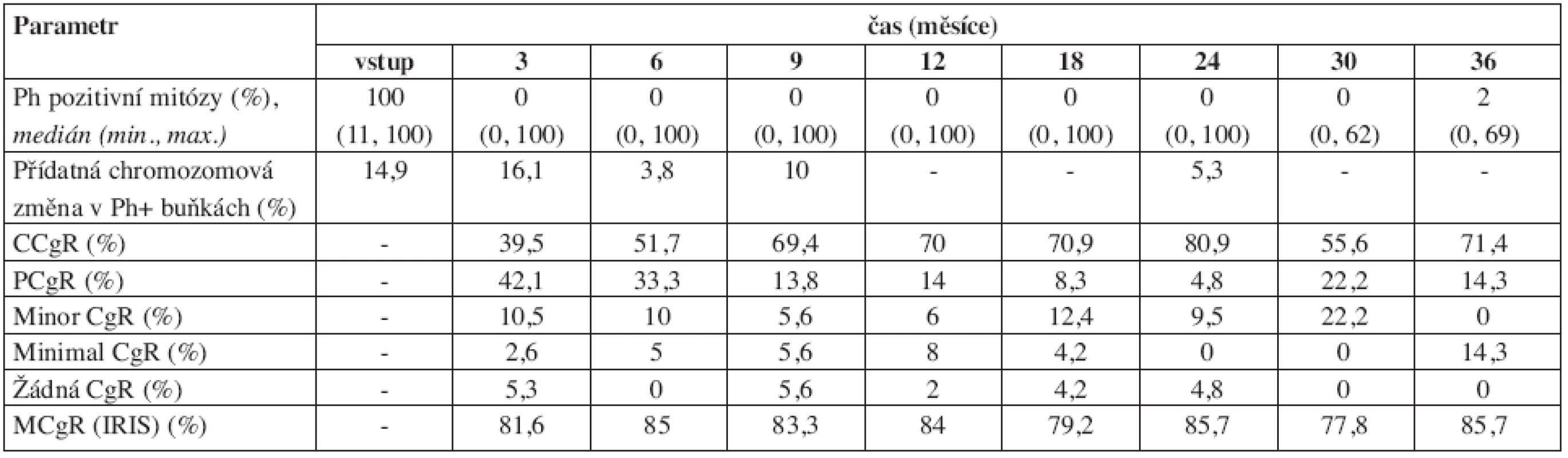
Tab. 4. Vývoj dynamiky Bcr-Abl transkriptu (RQ-PCR) v průběhu léčby imatinibem. 24 měsíců bylo sledováno jen 34 nemocných, proto data v tomto a po tomto měsíci mohou být méně přesná (ve 36 měsících bylo vyšetřeno jen 12 nemocných). ELN = kritéria podle European LeukemiaNet (11). MolR = molekulární odpověď (response), C = kompletní (complete), M = velká (major), Progrese = více než dvojnásobný vzestup hladiny BCR-ABL transkriptů. Pozn.: Vysoké % progresí v tabulce v měsíci 36 připisujeme malému počtu hodnocených pacientů v tomto měsíci. 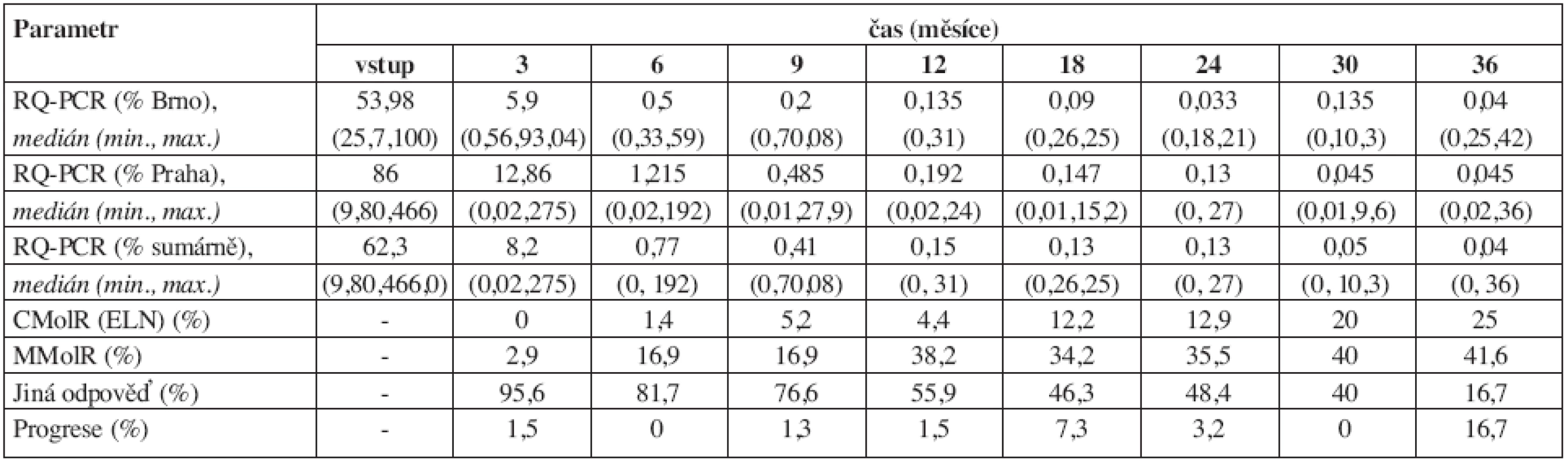
Porovnání molekulárně genetických metod ke stanovení kvantity Bcr-Abl a používajících jako kontrolní gen B2M nebo ABL ukázalo jejich velmi dobrou korelaci a možnost porovnat výsledky z obou laboratoří. Nicméně metoda RQ-PCR s použitím kontrolního genu ABL je lineární pouze do 10 % transkriptu Bcr-Abl (obr. 1). V této oblasti jsou výsledky z obou pracovišť zcela srovnatelné. Pro oblast linearity byl stanoven orientační přepočtový koeficient jehož hodnota se blížila 1, tudíž nebylo nutné data přepočítávat. Toto zjištění bylo potvrzeno i externí kontrolou kvality v rámci ELN, kde obě pracoviště získala preliminární přepočtový koeficient ~ 1 platný pro lineární oblast metody, tj. do 10 % transkriptu Bcr-Abl.
Obr. 1. Výsledek (linearita) porovnání molekulárních metod ke stanovení kvantity Bcr-Abl transkriptu používajících jako kontrolní gen B2M (Praha) nebo ABL (Brno). Křivky znázorňují naměřené množství Bcr- Abl ve vzorcích externí kontroly kvality (ředění od 10x do 106x na úrovni buněčného lyzátu, přesněji viz metody). 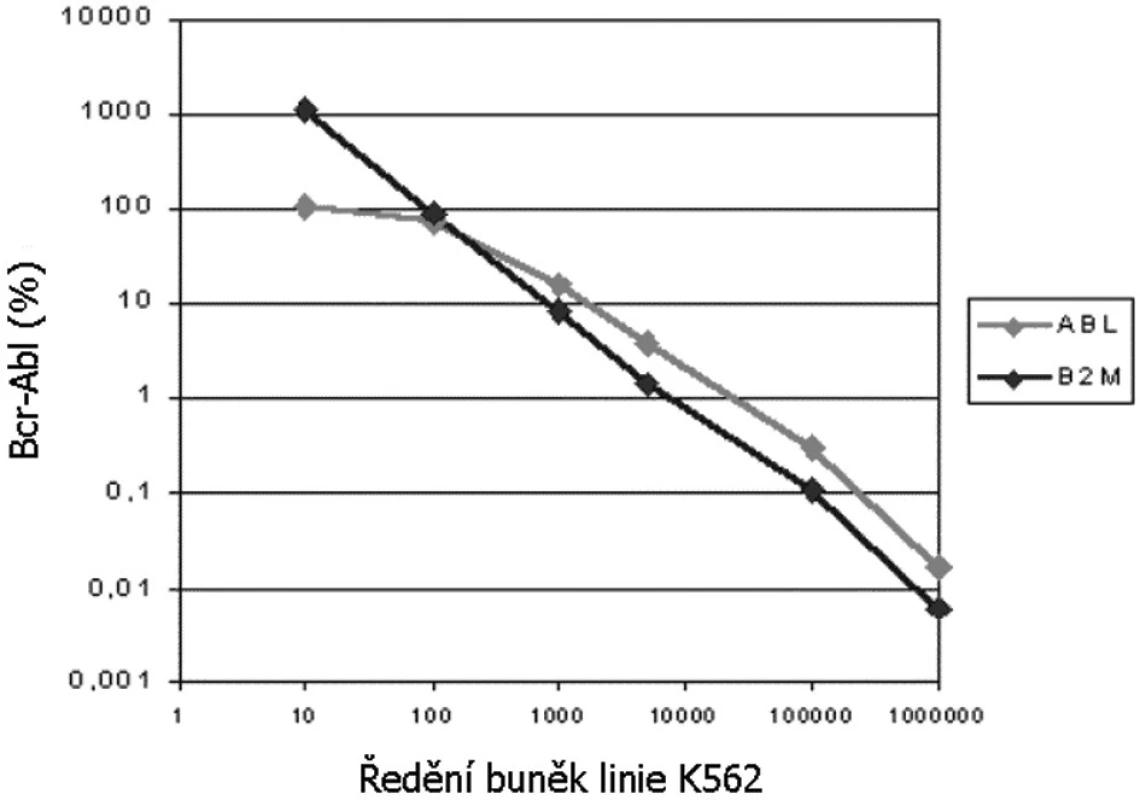
Toxicita léčby imatinibem je uvedena v tabulkách 5 a 6. Nehematologická toxicita byla relativně častá, ale v průběhu terapie mizela. Mezi častější projevy nehematologické toxicity patřily nevolnost, retence tekutin, svalové křeče a bolesti hlavy. Převažovaly toxicity stupně 1 a 2. Hematologická toxicita měla podobný trend jako nehematologická: byla častější v úvodu terapie a většinou mírného stupně.
Tab. 5. Nehematologická toxicita léčby imatinibem v průběhu prvních dvou let léčby. CTC - National Cancer Institute Common Terminology Criteria for Adverse Events v3.0. 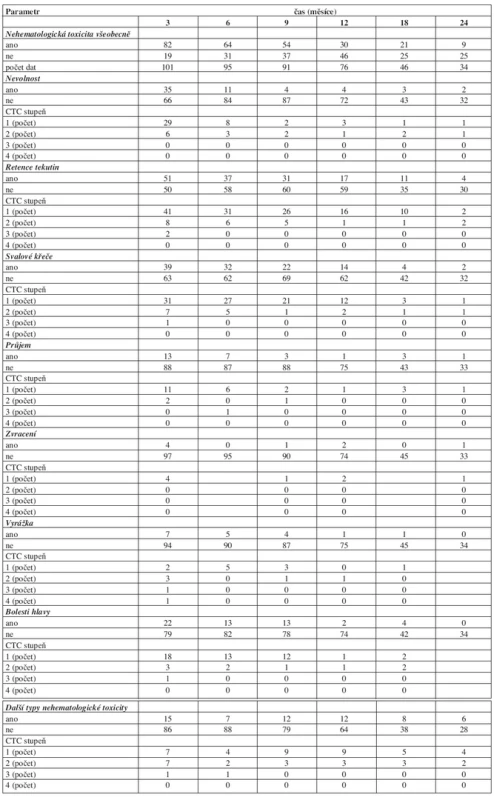
Tab. 6. Hematologická toxicita terapie v průběhu prvních dvou let léčby imatinibem. Stupně toxicity podle National Cancer Institute Common Terminology Criteria for Adverse Events v3.0. 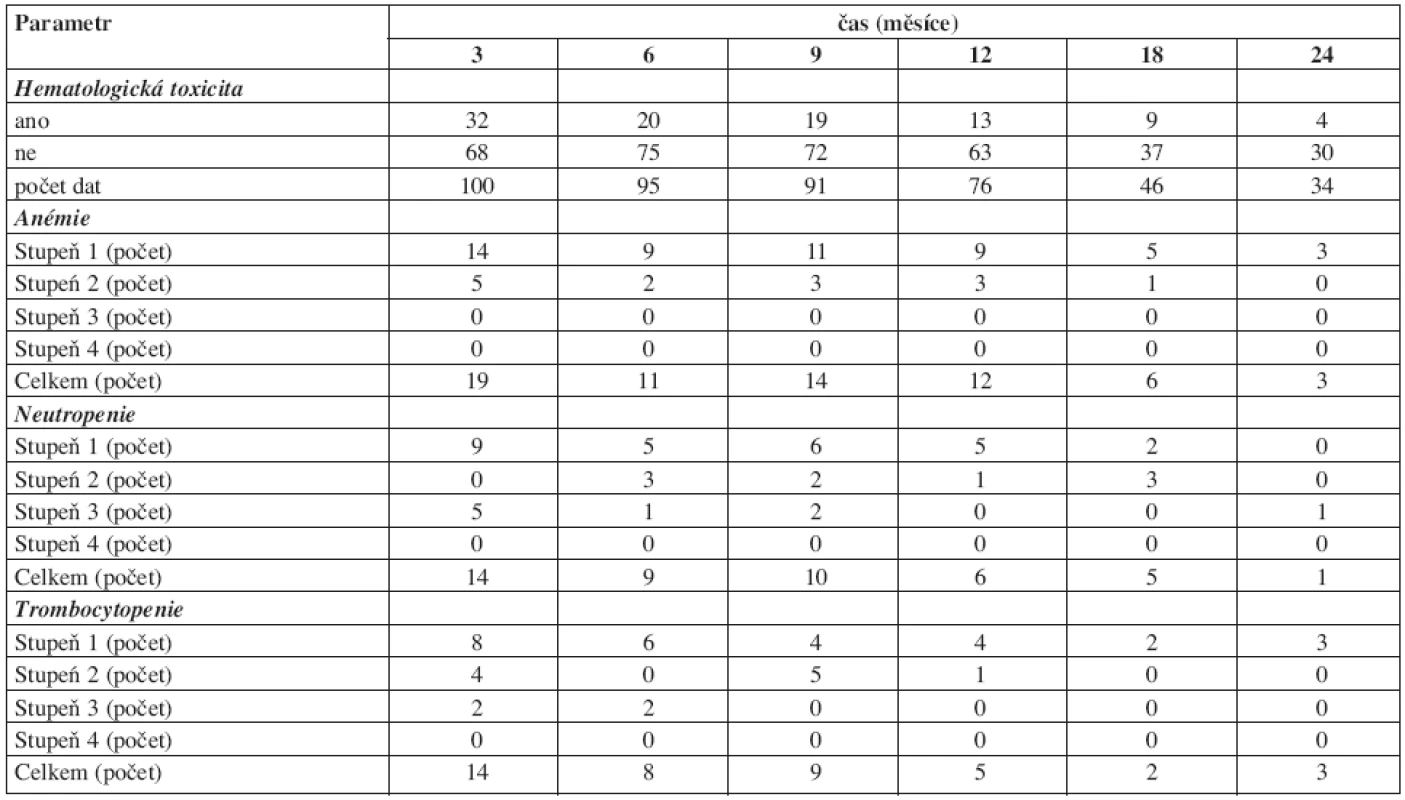
Tabulka 7 ukazuje dávky imatinibu. Jak je vidět, medián průměrné denní dávky byl 400 mg. Nižší dávky byly voleny z důvodu toxicity, vyšší zpravidla pro nedostatečnou léčebnou odpověď, výjimečně z důvodů randomizace pro vyšší dávkování (německá studie CML IV). Tabulka 8 ukazuje dosažené léčebné odpovědi definované jak podle kritérií ELN tak podle studie IRIS.
Tab. 7. Průměrné denní dávky imatinibu v průběhu času od zahájení léčby. 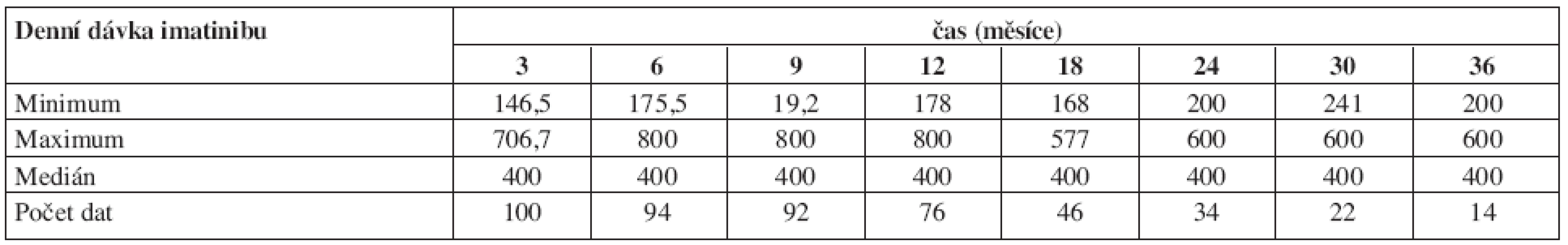
Tab. 8. Dosažené léčebné odpovědi definované jednak podle kritérií Evropské leukemické sítě (ELN) a jednak podle studie IRIS. Pozn.: V 6. měsíci nebyla zohledněna velikost sleziny, viz diskuse. 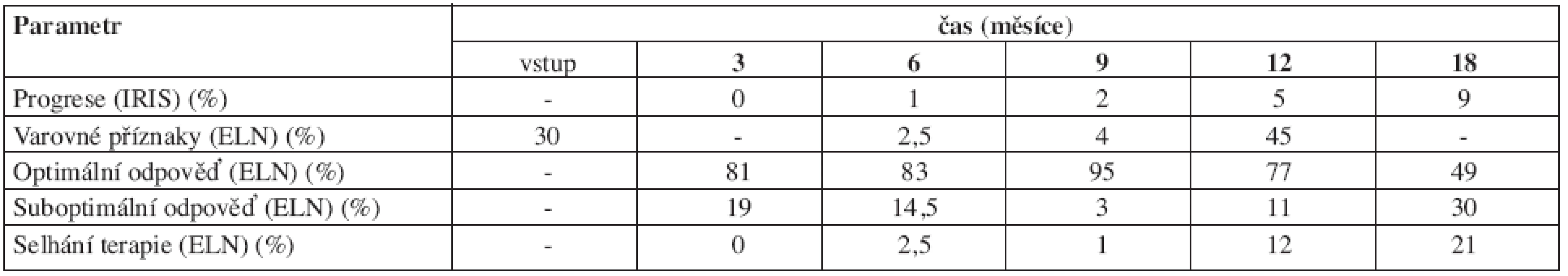
Dosud z celé skupiny nemocných zemřela jen jedna pacientka. Příčinou úmrtí byla alkoholová intoxikace velmi pravděpodobně bez souvislosti s terapií nebo základní nemocí. Křivka celkového přežívání pacientů je na obrázku 2.
Obr. 2. Křivka celkového přežívání 105 pacientů v databázi INFINITY léčených imatinibem v první linii. 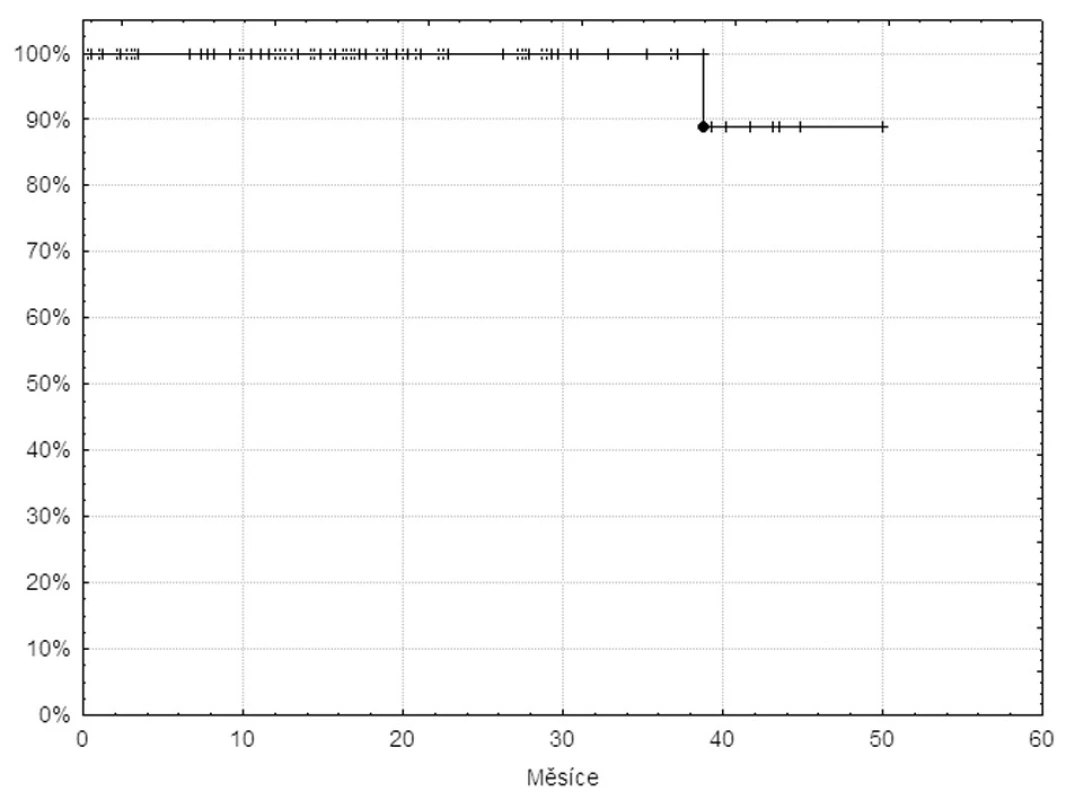
Během sledování změnilo terapii 15 nemocných. Křivka času do alternativní terapie je na obrázku 3. Důvody změny terapie byly následující: selhání imatinibu (ve 2 případech primární cytogenetická rezistence, ve 4 případech cytogenetický relaps a v 1 případě přímá progrese do akcelerované fáze) a převedení nemocného na dasatinib (6krát) nebo nilotinib (1krát), rozhodnutí nemocného podstoupit alogenní transplantaci krvetvorných buněk (5krát) – vesměs se jednalo o mladší nemocné se shodným sourozencem – a závažná nehematologická toxicita, přičemž následující terapie dasatinibem byla velmi dobře tolerovaná (3krát).
Obr. 3. Křivka času do alternativní terapie 105 pacientů v databázi INFINITY léčených imatinibem v první linii. 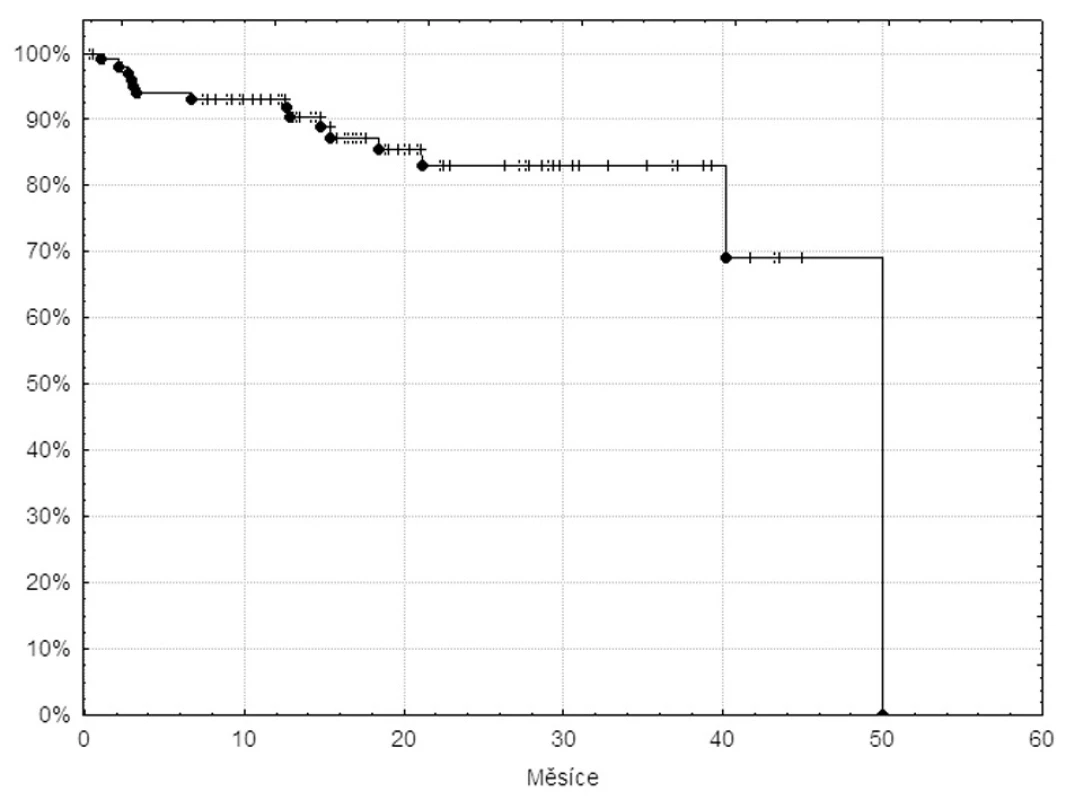
Diskuse
Jedním z cílů této práce bylo porovnat výsledky léčby imatinibem v České republice u zcela neselektované skupiny všech konsekutivních nemocných s výsledky zásadní studie IRIS (7–9). Sledované parametry zobrazují situaci, která může být odlišná od informací ze studií. Kvalitní data z reálního života jsou důležitá, neboť moderní terapie imatinibem je nejen mimořádně nákladná, ale imatinib také zcela změnil přístup k léčbě první linie u CML – alogenní transplantace krvetvorných buněk ztratila svoje privilegované postavení (11). Například pro akutní myeloidní leukemii existují data, která ukazují, že nemocní zařazení do studií nemusí reprezentovat celou populaci a že tedy výsledky studií nemohou být jednoduše extrapolovány na všechny nemocné s touto chorobou (19).
Kritéria pro zařazení do databáze INFINITY byla samozřejmě mnohem volnější, než byla vstupní kritéria studie IRIS. Je to vidět již z toho, že náš nejstarší zařazený nemocný měl 77 let (věkový limit studie IRIS byl 70 let), a také vstupní performance stav nebyl limitován jen do hodnoty 2 dle kritérií ECOG. Naši nemocní měli lehce vyšší medián věku (50 let v IRIS studii, 54 let v naší studii), a také vyšší skóre rizika (v závorkách jsou data z IRIS studie): podle Hasforda: nízké riziko 34 % (45,6 %), střední riziko 52 % (44,3 %), vysoké riziko 14 % (10,1 %); skóre podle Sokala: nízké riziko 42 % (52,5 %), střední riziko 36 % (29 %), vysoké riziko 22 % (18,5 %), i když to může být zkresleno tím, že ne u všech nemocných v IRIS studii bylo možné skóre podle Sokala nebo Hasforda vypočítat (7). Vyšší je také procento našich nemocných se vstupní splenomegalií (42 % vs. 23 %) a podstatně vyšší medián vstupní leukocytózy. Tyto parametry by mohly modifikovat výsledky naší práce, neboť je známo, že rizikovější nemocní vykazují horší léčebnou odpověď (9). Naše výsledky jsou snadno srovnatelné s dřívější analýzou IRIS studie, která měla medián sledování 19 měsíců (7).
Podobně jako v IRIS studii i u našich nemocných byl medián podávané dávky imatinibu 400 mg a imatinib byl poměrně dobře tolerován (viz tab. 5, 6 a 7). V IRIS studii vysadilo terapii imatinibem z různých příčin 14,3 % nemocných, což odpovídá procentu přerušení léčby v INFINITY (14,2 %). I u našeho souboru nemocných bylo dosaženo velmi rychle hematologické odpovědi (tab. 2 a 3). Porovnatelná byla také procenta dosažených kompletních hematologických remisí v 18. měsíci terapie. Jak je vidět z tabulky 2, tato léčebná odpověď byla velmi obdobná, ať již byla hodnocena podle kritérií ELN nebo IRIS, vezmeme-li v úvahu pouze parametry krevního obrazu. V ELN definici se vyskytuje také jednoznačně uvedená nehmatná slezina. Tento parametr by ovšem výrazně snižoval procento dosažených kompletních hematologických remisí (viz data v tab. 1), a také modifikoval léčebné odpovědi dosažené podle ELN kritérií. Jak je vidět například z tabulky 8, jen u 2,5 % nemocných bylo možné říct, že u nich terapie selhala v 6. měsíci; zvětšená slezina ale v tomto hodnocení není zohledněna. Kdybychom toto kritérium vzali striktně v potaz, bylo by procento kompletních hematologických remisí výrazně nižší a tedy i zastoupení nemocných se selháním terapie vyšší. V 6. měsíci byla slezina hmatná u 11 % nemocných, i když její největší přesah byl již jen 6 cm. Domníváme se, že hodnocení významu hmatné sleziny a dynamiky zmenšování sleziny v průběhu terapie imatinibem musí být ještě věnována další pozornost.
Procento velkých cytogenetických odpovědí v 18. měsíci terapie bylo také velmi dobře srovnatelné s IRIS (87 % IRIS, 79,2 % INFINITY, viz tab. 3). Překvapivě podobná data jsme obdrželi také při hodnocení progrese podle IRIS kritérií ve 12. měsíci (tab. 8). Dvě další analýzy IRIS studie (8, 9) se dotýkaly i významu dosažení kvalitní molekulární odpovědi během pětiletého sledování. Vzhledem k tomu, že sledování našich nemocných je zatím výrazně kratší, není možné naše data se zralejšími daty IRIS studie porovnávat. Problematika hodnocení molekulárních odpovědí u CML je mimořádně komplikovaná a stále nedořešená i přes různá doporučení a mnohé standardizační snahy (20, 21). Obě námi používané metody mezinárodní doporučení respektují a v jednoduché komparaci se ukázaly jako srovnatelné. Z praktických důvodů jsme ponechali výsledky obou pracovišť v té podobě, v jaké je laboratoře vydávají. Nepřepočítávali jsme je a podle doporučení za velkou molekulární odpověď, adekvátní tzv. redukci o 3 logaritmy podle IRIS studie, považovali výsledek z lokální laboratoře menší nebo roven 0,1 % (tab. 4). I zde je obdivuhodná shoda s výsledky IRIS studie, která popisuje 39 % nemocných po 12 měsících léčby s touto prognosticky příznivou odpovědí, přičemž podle našich dat takové odpovědi dosáhlo 42 % nemocných. Zde se také nabízí otázka, zdali ELN kritéria nejsou pro hodnocení terapie imatinibem příliš „tvrdá“. Imatinib evidentně nemá potenci dosahovat rychle masivních molekulárních odpovědí. Proto je možné např. ve 12. měsíci léčby pozorovat podle ELN vysoké procento varovných příznaků nebo později mnoho suboptimálních odpovědí.
Za zdůraznění také stojí zlepšování performance stavu pacientů při terapii imatinibem. Byť je to velmi orientační hodnocení, nedosahující preciznosti různých detailních systémů hodnocení kvality života, i v tomto ohledu můžeme podotknout, že naše zjištění je v souladu se závěry IRIS studie (22).
K podobným výsledkům jako my přišli i autoři z Hammersmith Hospital, kteří nedávno publikovali analýzu podobnou naší, analýzu 205 konsekutivně imatinibem léčených pacientů s CML. V 5 letech byla kumulativní incidence CCgR a MMolR 82,7 % a 50,1 %. Očekávané celkové přežití a přežití bez progrese byly 83,2 % a 82,7 %. Do 5. roku sledování ukončilo 25 % nemocných léčbu imatinibem pro nedostatečnou odpověď nebo toxicitu. Pravděpodobnost 5letého setrvání v CCgR byla 62,7 % (23).
Závěr
Na rozdíl od IRIS studie je naše analýza analýzou dat všech konsekutivních nemocných, kteří byli léčeni imatinibem pro nově diagnostikovanou CML a jejichž celkový zdravotní stav umožňoval zahájení léčby. Dosáhli jsme obdivuhodně podobných léčebných výsledků v parametrech rychlosti dosažení a procenta kompletních hematologických odpovědí, velkých cytogenetických odpovědí, velkých molekulárních odpovědí a v parametrech tolerance imatinibu. Naše práce tak potvrzuje, že imatinib představuje zásadní pokrok v léčbě CML.
Otázka hodnocení splenomegalie při fyzikálním vyšetření by měla být ještě dále podrobněji řešena. Studována by měla být i dynamika zmenšování sleziny při terapii imatinibem. Přetrvávající mírná splenomegalie výrazně snižuje procento kompletních hematologických remisí podle ELN kritérií a striktně vzato, může vést i k označení léčebné odpovědi za selhání, přestože u nemocných je jinak pozorován vynikající efekt terapie. Podobně je problematické hodnocení nedosažení velké molekulární odpovědi ve 12. měsíci jako varování, neboť tohoto typu odpovědi v té době nedosáhne ani polovina nemocných.
Prof. MUDr. Jiří Mayer, CSc.
Interní hematoonkologická klinika LF MU a FN
Jihlavská 20
625 00 Brno
e-mail: jmayer@fnbrno.cz
Doručeno do redakce: 28. 7. 2008
Přijato: 2. 10. 2008
Zdroje
1. Mayer J. Chronická myeloidní leukemie jako model moderní necytostatické léčby maligních chorob. Od Virchowa po STI571. Vnitřní lék 2002; 48 : 45–49.
2. Mayer J, Žáčková D, Klamová H, Doubek M. Léčba chronické myeloidní leukemie. Méně běžný pohled na moderní postupy. Čas lék čes 2008; 147 : 206–210.
3. Druker BJ, Talpaz M, Resta DJ, et al. Efficacy and safety of a specific inhibitor of the BCR-ABL tyrosine kinase in chronic myeloid leukemia. N Engl J Med 2001; 344 : 1031–7.
4. Druker BJ, Sawyers CL, Kantarjian H, et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of the chronic myeloid leukemia and acute lymphoblastic leukemia with the philadelphia chromosome. N Engl J Med 2001; 344 : 1038–42.
5. Talpaz M, Silver RT, Druker BJ, et al. Imatinib induces durable hematologic and cytogenetic responses in patients with accelerated phase chronic myeloid leukemia: results of a phase 2 study. Blood 2002; 99 : 1928–37.
6. Hochhaus A, Druker B, Sawyers C, et al. Favorable long-term follow-up results over 6 years for response, survival, and safety with imatinib mesylate therapy in chronic-phase chronic myeloid leukemia after failure of interferon-α treatment. Blood 2008; 111 : 1039–43.
7. OęBrien SG, Guilhot F, Larson R et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med 2003; 348 : 994–1004.
8. Hughes TP, Kaeda J, Branford S, et al. Frequency of major molecular responses to imatinib of interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349 : 1423–32.
9. Druker BJ, Guilhot F, O’Brien SG, et al. Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355 : 2408–17.
10. Glivec. Summary of product characteristics. www.glivec.com, stav k 10. 4. 2008.
11. Baccarani M, Saglio G, Goldman J, et al. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net. Blood 2006; 108 : 1809–20.
12. NCCN Clinical Practice Guidelines in Oncology, Chronic myelogenous leukemia, V.3.2008. www.nccn.org.
13. National Cancer Institute Common Terminology Criteria for Adverse Events v3.0 (CTCAE). http://ctep.cancer.gov/forms/CTCAEv3.pdf
14. Shaffer LG, Tommerup N, editors. An International System for Human Cytogenetic Nomenclature. S. Karger AG, Basel, 2005; 130 s.
15. Moravcová J, Lukášová M, Starý J, Haškovec C. Simple competitive two-step RT-PCR assay to monitor minimal residual disease in CML patients after bone marrow transplantation. Leukemia 1998; 12 : 1303–12.
16. Rulcová J, Zmeková V, Zemnová Z, Klamová H, Moravcová J. The effect of total-ABL, GUS and B2M control genes on BCR-ABL monitoring by real-time RT-PCR. Leuk Res 2007; 31 : 483–91.
17. Gabert J, Beillard E, van der Velden VH, et al. Standardization and quality control studies of ‘real-time’ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia - a Europe Against Cancer Program. Leukemia 2003; 17 : 2318–57.
18. Beillard E, Pallisgaard N, van der Velden VH, et al. Evaluation of candidate control genes for diagnosis and residual disease detection in leukemic patients using ‘real-time’ quantitative reverse-transcriptase polymerase chain reaction (RQ-PCR) - a Europe Against Cancer Program. Leukemia 2003; 17 : 2474–86.
19. Mengis C, Aebi S, Tobler A, et al. Assessment of differences in patients populations selected for of excluded from participation in clinical trials phase III acute myelogenous leukemia trials. J Clin Oncol 2003; 21 : 3933–39.
20. Müller MC, Saglio G, Lin F, et al. An international study to standardize the detection and quantitation of BCR-SABL transcripts from stabilized peripheral blood preparations by quantitative RT-PCR. Haematologica 2007; 92 : 970–3.
21. Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results. Blood 2006; 108 : 28–37.
22. Hahn EA, Glendenning A, Sorensen MV, et al. Quality of life in patients with newly diagnosed chronic phase chronic myeloid leukemia on imatinib versus interferon alfa plus low-dose cytarabine: results from the IRIS study. J Clin Oncol 2003; 21 : 2138–46.
23. de Lavallade H, Apperley JF, Khorashad JS, et al. Imatinib for newly diagnosed patients with chronic myeloid leukemia: incidence of sustained responses in an intention-to-treat analysis. J Clin Oncol 2008; 26 : 3358–63.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2008 Číslo 4- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
- Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
- Vyhledávání příbuzenského dárce krvetvorných buněk – koordinace procesu a výsledky jednoho centra
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- DNA mikročipy (microarrays) v diagnostice folikulárního lymfomu: cesta k terapii „šité na míru“ nebo slepá ulička?
- Autotransfuze v České republice v roce 2007
- GRATULUJEME
- Vybrané odborné akce v roce 2009
- OBSAH ROČNÍKU 14/2008 Transfuze a hematologie dnes
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučený postup
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



