-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
Second national study AML-BFM 98 improved remission rate and overall survival in children with acute myeloid leukemia in the Czech Republic
Between 1998 and 2004 the Czech Republic participated with Germany, Austria and Switzerland in the international AML-BFM 98 study on the treatment of children with acute myeloid leukemia (AML). Both standard risk and high risk patients received 5 blocks of intensive chemotherapy including 2 blocks of high-dose cytosine arabinoside, prophylactic cranial irradiation and maintenance treatment lasting for one year. Randomized phase of treatment compared the classical consolidation of BFM protocols lasting for 6-weeks with two short blocks and assessed the role of G-CSF in the early phases of therapy. Treatment results were evaluated in 70 children divided into the standard risk (n = 34) and high risk (n = 36) groups according to the leukemia phenotype, genotype and early treatment response. Six children (9%) had Down syndrome. Remission was achieved in 60 children (85.7%) representing 12% improvement in comparison with the previous AML-BFM 93 study. Five children (7%) underwent either allogeneic (n = 4) or autologous (n = 1) bone marrow transplantation in the first remission. Nine children (15%) died in remission and 18 children (30%) suffered from relapse. Two children developed secondary leukemia (sMDS and sALL); both were rescued by unrelated bone marrow transplantation. Five-year EFS/OS was 44.3/57.1% for the whole group of patients with a median follow-up 6.9 years (4.1-9.3 y). EFS/OS in standard risk patients was 52.9/70.6%, in high risk 36.1/44.4%. The previous AML-BFM 93 study achieved 5-year EFS/OS 42.6/45.9% in the Czech Republic. Altogether, 473 patients were enrolled in the international AML-BFM 98 study and 88% of them achieved complete remission with 5-year OS 62%. G-CSF reduced the duration of neutropenia but did not reduce the number and severity of infectious complications. EFS of both consolidation arms was similar but length of the treatment and toxic deaths rate were reduced using blocks instead of classical consolidation. The participation in the international study increased requirements for the diagnostics and documentation and exposed the treatment results to the comparison with one of the world leading leukemia groups.
Key words:
acute myeloid leukemia, AML-BFM 98, children
Autori: J. Starý 1; V. Vávra 1; P. Gajdoš 1; H. Hrstková 2; L. Kopečná 2; J. Štěrba 3; D. Dembická 3; D. Mendelová 3; V. Mihál 4; D. Pospíšilová 4; Z. Novák 4; B. Blažek 5; H. Ptoszková 5; J. Hak 6; K. Toušovská 6; D. Procházková 7; Z. Černá 8; Y. Jabali 9; P. Timr 9; P. Smíšek 1; K. Zdráhalová 1; P. Sedláček 1; L. Šrámková 1; P. Keslová 1; R. Formánková 1; V. Komrska 1; E. Mejstříková 1; A. Vrzalová 1; K. Kramarzová 1; K. Michalová 10; Z. Zemanová 10; M. Jarošová 11; J. Housková 12; A. Zámková 12; J. Zuna 1; O. Hrušák 1; J. Trka 1; J. Schwarz 13; U. Creutzig 14
Pôsobisko autorov: Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha, 2I. dětská interní klinika LF MU a FN Brno, 3Klinika dětské onkologie FN Brno, 4Dětská klinika LF UP a FN Olomouc, 5Klinika dětského lékařství FN Ostrava, 6Dětská klinika FN Hradec Králové 1; Centrum nádorové cytogenetiky, Ústav klinické biochemie a laboratorní diagnostiky, VFN a 1. LF UK, Praha, 11Hemato-onkologická klinika LF UP a FN Olomouc, 12Oddělení klinické hematologie FN Motol 10; Ústav hematologie a krevní transfuze, Praha, 14Universitätskinderklinik, Päd. Hematologie/Onkologie Münster, Německo 13
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 4, p. 166-174.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Léčba dětí s akutní myeloidní leukemií (AML) probíhala v České republice v období 7/1998–2/2004 v mezinárodní léčebné studii AML-BFM 98 ve spolupráci s Německem, Rakouskem a Švýcarskem, se společnou databází v německém Münsteru a centrální randomizací. Pacienti standardního (SR) i vysokého (HR) rizika byli léčeni pěti bloky intenzivní chemoterapie (dva bloky obsahovaly vysokodávkovaný AraC), preventivním ozářením krania a jeden rok trvající udržovací léčbou. Randomizovaná fáze léčby srovnávala klasickou šestitýdenní konsolidaci BFM protokolů s dvěma krátkými bloky a roli G-CSF v časných fázích léčby. Výsledky léčby byly hodnotitelé u 70 dětí, 34 bylo řazeno do SR a 36 dětí do HR skupiny podle fenotypu a genotypu leukemie a časné odpovědi na léčbu. Šest dětí (9 %) mělo Downův syndrom. Remisi dosáhlo 60 dětí (85,7 %), což je o 12 % více ve srovnání s předchozí studií AML-BFM 93. Pět dětí (7 %) podstoupilo alogenní (n = 4) nebo autologní (n = 1) transplantaci kostní dřeně v první remisi. Devět dětí (15 %) zemřelo v remisi a 18 dětí (30 %) prodělalo relaps leukemie. Dvě děti vyvinuly sekundární malignitu (sMDS a sALL), obě žijí po nepříbuzné transplantaci. Pětileté přežití do selhání (EFS) a celkové přežití (OS) celé skupiny pacientů je s mediánem doby sledování 6,9 r (4,1–9,3r) 44,3 %, resp. 57,1 %, ve skupině standardního rizika 52,9 %, resp. 70,6 % a vysokého rizika 36,1 %, resp. 44,4 %. Předchozí protokol léčby AML (AML-BFM 93)dosáhl 5letý EFS/OS 42,6/45,9 %. Do mezinárodní studie AML-BFM 98 bylo celkem zařazeno 473 pacientů, z nichž 88 % dosáhlo remise a 5leté přežití činilo 62 %. G-CSF zkrátil délku neutropenie, ale nesnížil výskyt infekcí. EFS obou konsolidačních ramen léčby byl stejný, ale doba léčby bloky byla zkrácena a počet toxických smrtí snížen. Účast v mezinárodní studii zvýšila nároky na diagnostiku a dokumentaci a vystavila výsledky léčby srovnání s jednou z vedoucích světových leukemických skupin.
Klíčová slova:
akutní myeloidní leukemie, protokol AML-BFM 98, dětiAkutní myeloidní leukemie (AML) je u dětí onemocněním, jehož biologie jeví určité odlišnosti od stejné nemoci dospělých. Děti mladší 5 let mají častěji monocytární typ leukemie, přestavbu MLL genu a vyšší výskyt extramedulární leukemie (1). Děti s Downovým syndromem mají v prvních pěti letech života vysoké riziko vzniku leukemie, která vychází z megakaryocytární řady a blasty nesou mutaci GATA1 genu (2). Akutní promyelocytární leukemie má vyšší zastoupení M3 variantní formy a vyšší iniciální počet leukocytů než stejné onemocnění dospělých (3). Výskyt leukemií s prognosticky nepříznivými změnami karyotypu (monosomií chromozomu 7 nebo delecí dlouhých ramen chromozomu 5) je výjimečný (4, 5, 6, 7). Biologie dětské AML spolu s pokroky v podpůrné léčbě, umožňujícími zvýšit dávkovou intenzitu chemoterapie, vedly k významnému zlepšení prognózy tohoto onemocnění v posledních 20 letech. Šanci na vyléčení má více než 50 % dětí s AML.
Pracovní skupina dětské hematologie sjednotila léčbu AML u dětí v České republice v roce 1993 podle německého protokolu AML-BFM 93. Děti standardního rizika (SR) byly léčeny čtyřmi (jeden blok obsahoval vysokodávkovaný cytosin-arabinosid) a děti vysokého rizika (HR) pěti bloky chemoterapie (dva bloky s vysokodávkovaným cytosin-arabinosidem). Indukce ADE se skládala z cytosin-arabinosidu (AraC), daunorubicinu a etoposidu. První dva konsolidační bloky byly tvořeny prednizonem, vinkristinem, adriamycinem, cytosin-arabinosidem, thioguaninem a cykolofosfamidem. Třetí konsolidační blok HAV obsahoval vysokodávkovaný AraC (HD-AraC) a etoposid. Děti vysokého rizika dostaly navíc blok s HD-AraC a mitoxantronem (HAM). Všechny děti byly preventivně ozářeny na kranium ložiskovou dávkou 18 Gy a všechny děti absolvovaly roční udržovací léčbu thioguaninem a pulsy AraC. Celková doba léčby byla 18 měsíců. V období 1993-98 bylo takto léčeno 61 dětí, pravděpodobnost přežití do „selhání“ (EFS) v 5 letech od diagnózy byla 42,3 % a celkového přežití (OS) 45,3 %. Prognóza dětí standardního rizika (EFS 62,5 %) byla významně lepší než dětí vysokého rizika (EFS 29,7 %; p = 0,03) (8).
Léčba podle nového protokolu AML-BFM 98 byla zahájena ve FN Motol pilotní studií 1. 7. 1998 a od 1. 1. 1999 navázala ve všech centrech České republiky. Česká republika přistoupila účastí v této studii k BFM konsorciu tvořenému Německem, Rakouskem a Švýcarskem. Prospektivní mezinárodní multicentrická studie AML-BFM 98 řešila tři výzkumné projekty formou randomizovaných fází léčby, společná databáze se nacházela v ústředí studie v německém Münsteru, odkud byla rovněž prováděna centrálně randomizace.
Pacienti a metody
Do studie byly zařazeny děti s primární AML ve věku do 18 let, které byly v období 1998-únor 2004 diagnostikovány a léčeny v sedmi pracovištích dětské hematologie České republiky. Pacienti se sekundární AML a s myelodysplastickým syndromem (MDS) byli ze studie vyloučeni. Morfologická diagnóza, časná odpověď na léčbu a relapsy byly konfirmovány v referenční laboratoři Oddělení klinické hematologie FN Motol. Iniciální diagnóza AML a zařazení do podtypů byly provedeny na základě doporučení FAB klasifikace (9). Pro definici podtypu M0 a M7 byla vždy vyžadována konfirmace imunofenotypem (10, 11). Vyšetření karyotypu s využitím standardních technik bylo provedeno v cytogenetických laboratořích spolupracujících s regionálními centry. Komplexní karyotyp byl definován přítomností tří nebo více numerických a/nebo strukturálních chromozomových aberací v karyotypu (12).
Molekulární screening tří nejčastějších fúzních genů PML-RARaaa, AML1-ETO a CBFbbb-MYH11 byl proveden centrálně v laboratoři vedené dr. Schwarzem v ÚHKT Praha pomocí jednokrokové RT-PCR(13, 14). Vyšetření imunofenotypu blastů panelem monoklonálních protilátek bylo provedeno centrálně ve FN Motol. Pracoviště průtokové cytometrie v Praze, Vídni a Münsteru uskutečnila v rámci AML-BFM 98 protokolu prospektivní studii detekce minimální residuální nemoci (MRN) v čtyřech časových bodech léčby (kostní dřeň d15, d28 před druhým blokem, před třetím a čtvrtým blokem léčby) průkazem s leukemií asociovaného imunofenotypu čtyřbarevnou cytometrií (15).
Hodnocení léčebné odpovědi
Časná odpověď na léčbu byla hodnocena v kostní dřeni 15. den po zahájení prvního bloku chemoterapie. Kompletní remise byla definována podle kritérií CALGB jako regenerující nebo normocelulární kostní dřeň s méně než 5 % blastů v diferenciálu a vymizení extramedulární leukemie (16). Termín časná smrt byl dle doporučení pediatrické leukemické pracovní skupiny I-BFM-SG použit pro smrt do 6 týdnů od zahájení léčby bez dokumentované remise v kostní dřeni (17). Jako relaps byl hodnocen nárůst blastů v kostní dřeni nad 5 % ve dvou po sobě následujících aspiracích v odstupu 2 týdnů nebo objevení se extramedulární leukemie na jakémkoliv místě.
Stratifikace pacientů do rizikových skupin
Do standardního rizika byli zařazeni pacienti s nálezem translokace/fúzního genu t(15;17)/PML-RARα, t(8;21)/AML1-ETO, inv(16)/CBFβ-MYH11 za předpokladu redukce blastů pod 5% v kostní dřeni 2 týdny od zahájení léčby (neplatí pro M3 leukemii). Do vysokého rizika byli zařazeni všichni ostatní pacienti. Při neprovedeném (nezdařeném) screeningovém molekulárně genetickém vyšetření výše uvedených fúzních genů nebo nezdařeném vyšetření cytogenetickém byli pacienti řazeni do rizikové skupiny podle morfologického podtypu. Do SR patřili pacienti s M1/M2 leukemií a nálezem Auerových tyčí, M3 a M4eo leukemií za předpokladu příznivé časné odpovědi na léčbu.
Léčebný protokol
Pacienti SR i HR byli léčeni pěti bloky intenzivní chemoterapie, z nichž dva obsahovaly HD-AraC. V předchozí studii AML-BFM 93 dostávali HAM blok pouze HR pacienti a jejich prognóza se zlepšila. Zařazení HAM bloku i pro SR mělo za cíl zlepšit prognózu pacientů standardního rizika. Schéma léčby včetně kumulativní dávky antracyklinů a AraC je na obrázku 1. Složení jednotlivých bloků a dávky cytostatik jsou v tabulce 1.
Obr. 1. Schéma protokolu AML-BFM 98. 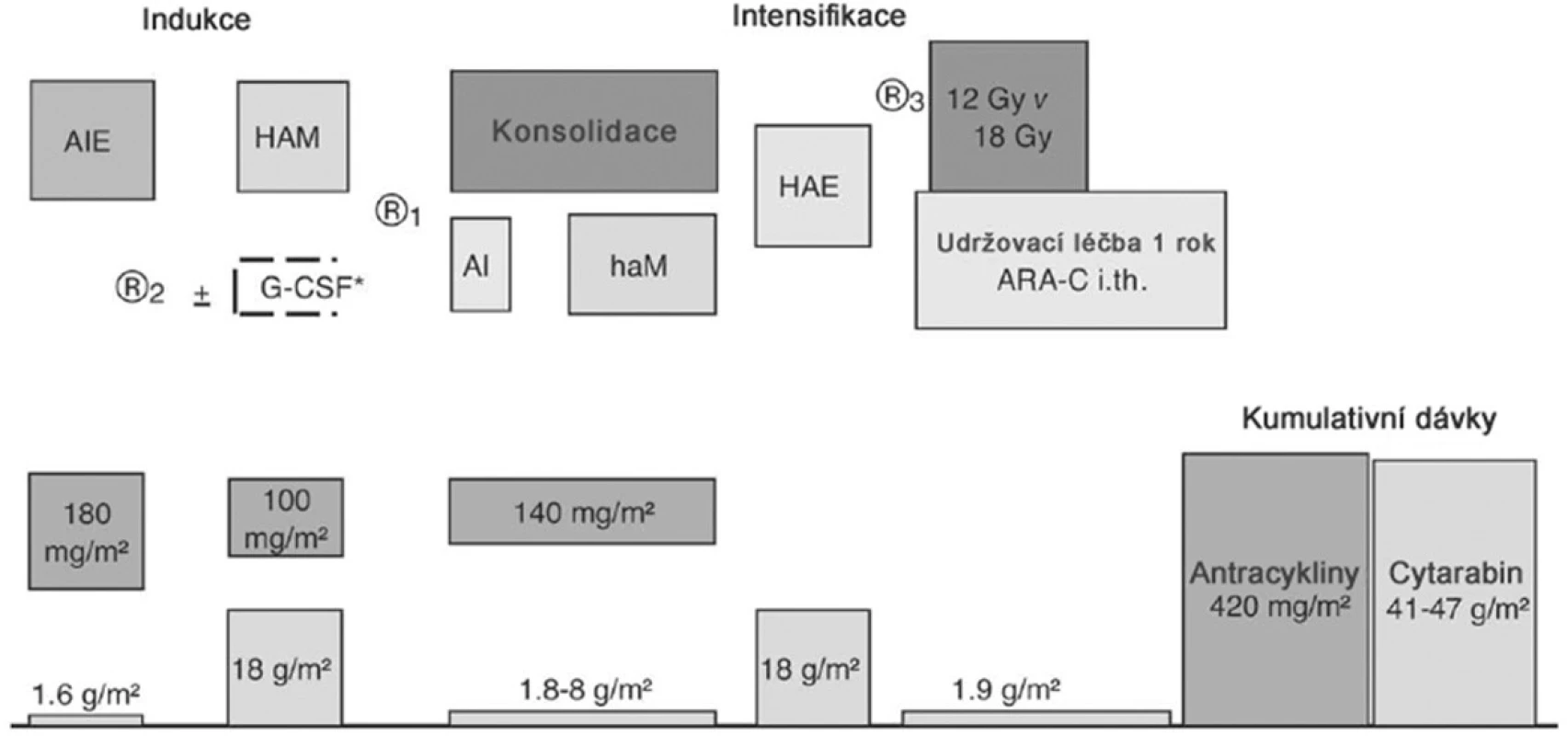
Tab. 1. Protokol AML-BFM 98. 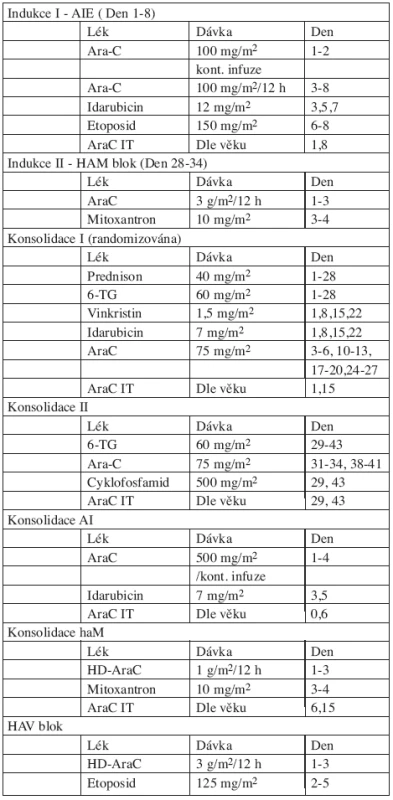
Poznámky: Konsolidace AI + haM je randomizována s klasickou konsolidací I+II. Ozáření krania v dávce 18 Gy vs. 12 Gy (randomizace) u dětí starších 1 roku, současně AraC 4 x IT Udržovací léčba: 6-TG 40 mg/m2/den + AraC 40 mg/m2/4 dny sc. každé 4 týdny.
V protokolu byly tři randomizované fáze léčby. První po skončení prvního bloku pro pacienty s méně než 5 % blastů v kostní dřeni 2 týdny od zahájení léčby (KD d15). Pacienti byli randomizováni k preventivní léčbě růstovým faktorem G-CSF, který byl podáván ode dne 15 protokolu po dobu 5–8 dnů a pak opět ode dne 15 po skončení bloku HAM až do vzestupu granulocytů 500/mm3 krve. Cílem bylo snížit výskyt infekčních komplikací v dřeňové aplázii. Druhá randomizace se týkala konsolidační léčby, která byla prováděna buď aplikací klasické konsolidace BFM protokolů, obsahující prednizon a vinkristin, nebo bloky, obsahujícími středně vysoké dávky AraC (AI, haM). Cílem bylo zlepšit prognózu. Třetí randomizovanou otázkou byla dávka profylaktického ozáření mozku. Dávka 18 Gy, která byla používána v předchozích protokolech, byla srovnána s dávkou 12 Gy. Cílem bylo snížení toxicity při zachování léčebné odpovědi. Následovala udržovací léčba. Celková délka léčby byla 18 měsíců.
Pacienti s M3 leukemií byli první 3 dny léčeni pouze kyselinou all-trans-retinoidovou (ATRA), 4. den byl zahájen blok AIE. HAM blok byl vynechán. ATRA byla podávána až do dosažení remise (d28-45 od začátku léčby). V případě pozitivního nálezu PML-RAR genu po skončení intenzifikace (HAV blok) byly tyto děti indikovány k alogenní transplantaci kostní dřeně od HLA identického sourozence nebo k další intenzifikaci léčby podáním bloku HAM a znovu zahájením léčby all-trans-retinoidovou kyselinou.
Pacienti s morbus Down měli redukovánu dávku antracyklinů na 2/3 kumulativní dávky, vynechán HAM blok a nebyli ozařováni.
K alogenní transplantaci kostní dřeně (SCT) od HLA identického sourozence byli indikováni pacienti vysokého rizika po skončení konsolidace (po 4 blocích), v případě pomalé odpovědi na léčbu (≥ 5 % blastů v KD d15) až po HAV bloku (po 5 blocích). Pacienti, kteří nedosáhli remise po skončení druhého bloku (HAM), byli indikováni k SCT i od alternativního dárce.
Statistická analýza
Křivky přežití byly konstruovány podle metody Kaplana-Meiera a rozdíly byly počítány pomocí testu log-rank (18, 19). Pro stanovení přežití do selhání (EFS) byly jako selhání hodnoceny časná smrt před dosažením remise, nedosažení remise (non-responder), smrt v remisi, relaps nebo sekundární malignita. Pro hodnocení pravděpodobnosti celkového přežití (OS) byl jako selhání hodnocen exitus.
Výsledky
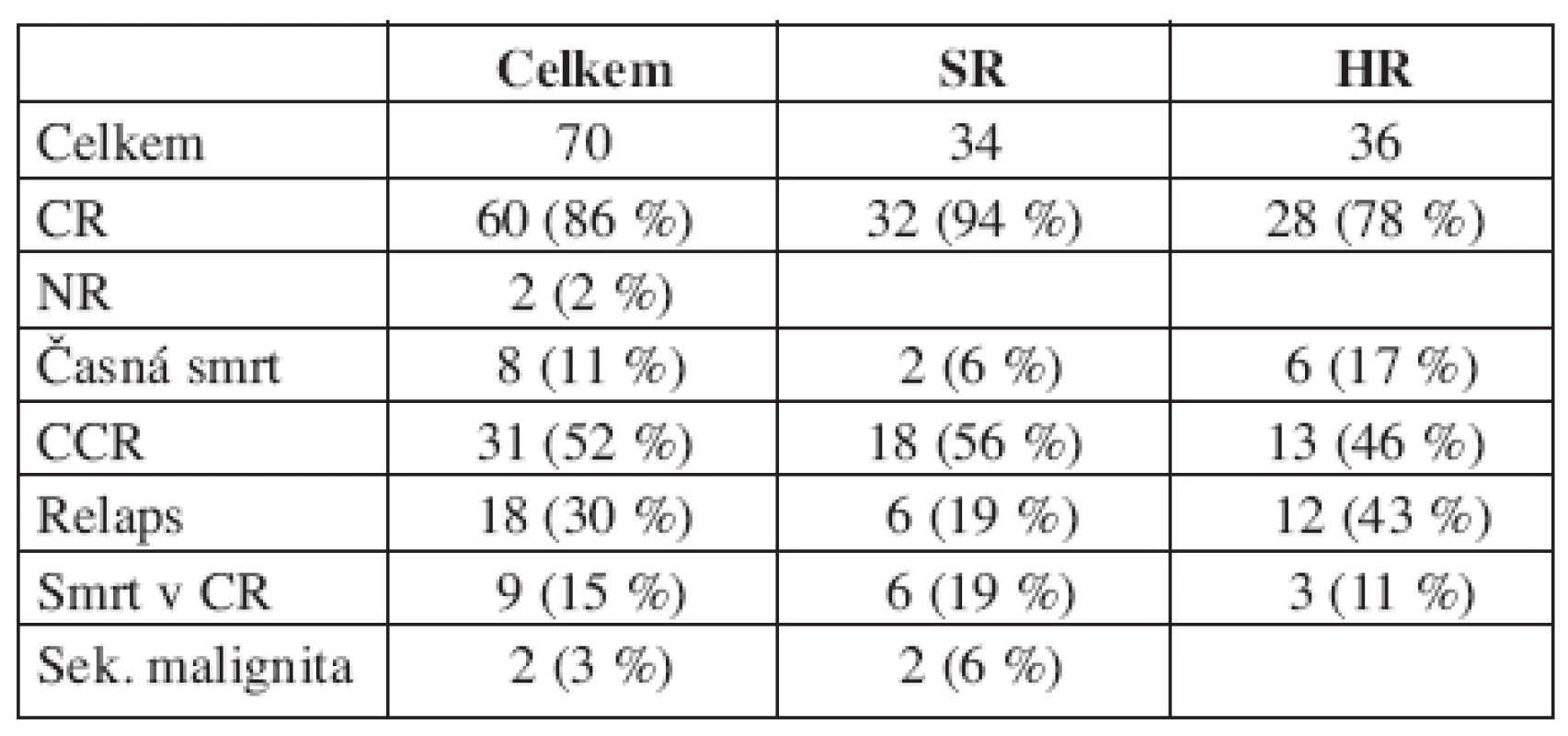
Akutní myeloidní leukemie byla v České republice v období 1. 7. 1998 – 28. 2. 2004 diagnostikována u 75 dětí a do studie bylo zařazeno 70 z nich. Důvodem vyřazení 5 pacientů bylo: odmítnutí léčby u dítěte s Downovým syndromem (n = 1), AML vzniklá progresí z MDS (n = 1) (pacient zařazen do studie léčby MDS), sekundární leukemie (n = 2) po předchozí léčbě maligního lymfomu a smrt před zahájením léčby (n = 1).
Medián věku 70 do studie zařazených dětí byl 10,3 roku (0,5–17,4 r), chlapců bylo 37, tři děti (4 %) měly iniciální leukemickou infiltraci centrálního nervového systému. Šest dětí (9 %) mělo Downův syndrom. Do standardního rizika bylo zařazeno 34 dětí (49 %), do vysokého rizika 36 dětí (51 %). Medián doby sledování souboru byl 6,9 roku (4,1–9,3 r).
Rozložení morfologických podtypů dle FAB klasifikace je v tabulce 2. Nejčastějším typem leukemie byla M1/M2 leukemie následovaná monocytární leukemií M4/M5. Jedno dítě mělo izolovaný myelosarkom oblasti klíční kosti s fúzním genem AML1-ETO bez postižení kostní dřeně. Ze 6 dětí s Downovým syndromem bylo 5 mladších 4 let při diagnóze a všechny měly megakaryocytární leukemii M7, jediné starší dítě mělo promyelocytární leukemii M3. Z 9 dětí s promyelocytární leukemií měly dvě variantní formu M3v. Medián počtu leukocytů u pacientů s M3 leukemií byl 6,7x109/l (0,75–7 x 109/l).
Tab. 2. Zastoupení podtypů AML dle FAB klasifikace. 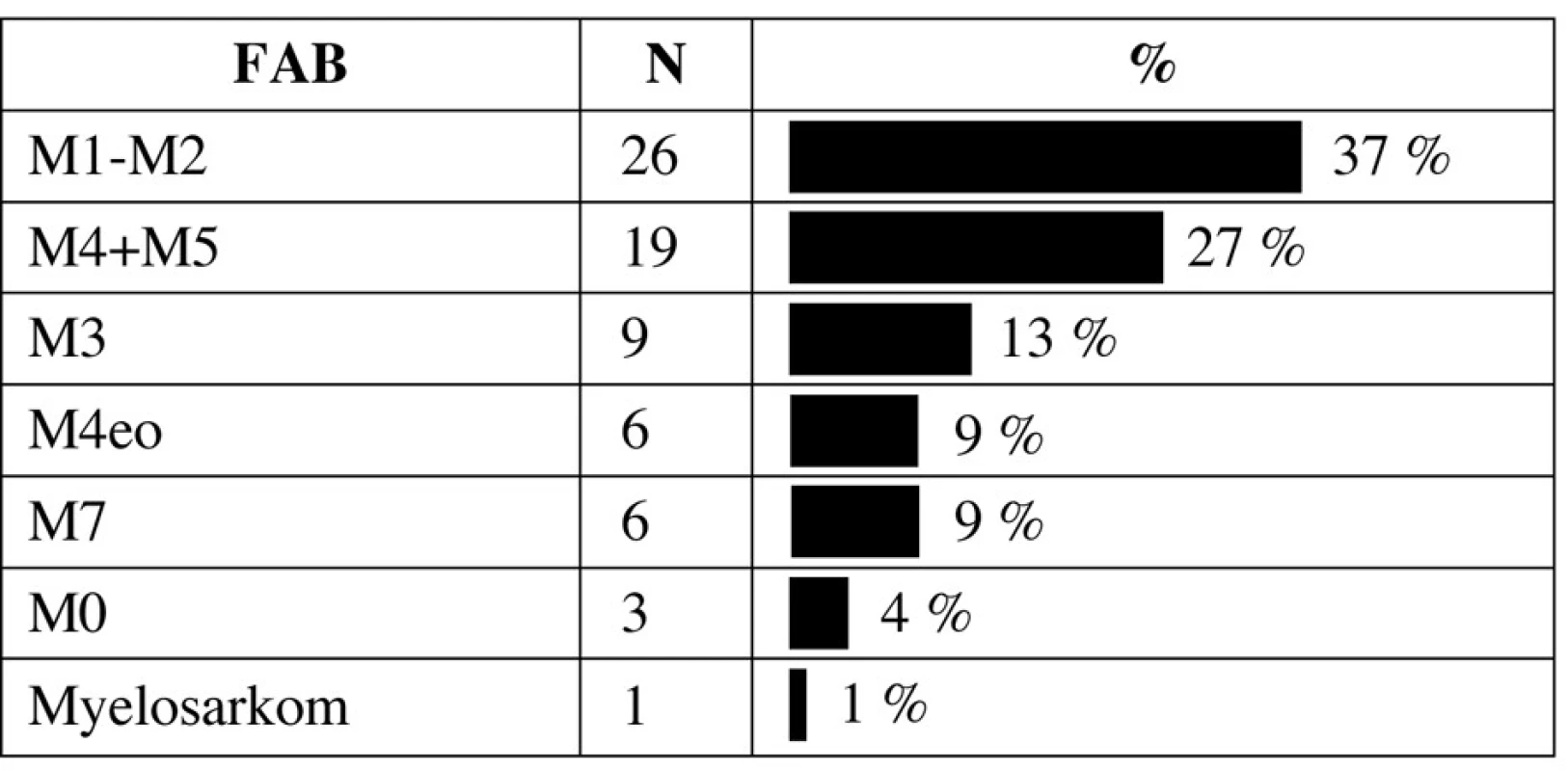
Molekulární screening tří nejčastějších chromozomových aberací byl proveden u 65 dětí souboru. Cytogenetické vyšetření bylo úspěšné rovněž u 65 dětí (93 %). Pouze jeden pacient měl současně neúspěšné cytogenetické vyšetření a neprovedený screening. Výsledky vyšetření genotypu leukemie jsou v tabulce 3. Nejčastější chromozomovou změnou byla přestavba MLL genu v chromozomové oblasti 11q23 u 23% (n = 16) dětí. Nejčastěji se jednalo o translokaci t(9;11)(q34;q23) (n = 6), pět dětí mělo t(10;11)(p12;q23), tři pacienti t(6;11) (q27;q23) a dva t(11;19)(q23;p13.3). S jednou výjimkou (M1 leukemie u pacienta s fúzním genem MLL-AF6) měly všechny děti monocytární M4 nebo M5 typ leukemie. Tři prognosticky příznivé translokace AML1-ETO, CBFß-MYH11 a PML-RARα byly nalezeny u 36 % dětí (n = 25). Všech 9 dětí s PML-RARα mělo M3 fenotyp leukemie, 10 dětí s AML1-ETO M2 leukemii a všech 6 pacientů s CBFß-MYH11 fenotyp M4eo. Pouze jeden pacient měl monozomii 7, jedno dítě deleci 7q, jeden pacient deleci 5q. Šestnáct dětí (25 % z vyšetřených) – včetně čtyř s nálezem „příznivých“ fúzních genů – mělo komplexní karyotyp.
Tab. 3. Rozdělení pacientů dle karyotypu. 
Výsledky léčby
Pravděpodobnost přežití do selhání (EFS) 5 let od diagnózy je v celém souboru pacientů 44,3 % (SE 6 %) a pravděpodobnost celkového přežití (OS) je 57,1 % (SE 6 %) (graf 1). Pacienti standardního rizika mají EFS v 5 letech od diagnózy 52,9 % (SE 9 %) a OS 70,6 % (SE 8 %), pacienti vysokého rizika mají EFS 36,1 % (SE 8 %) a OS 44,4 % (SE 8 %) (grafy 2 a 3). Rozdíl mezi oběma skupinami není statisticky významný.
Graf 1. Přežití do selhání (EFS) a celkové přežití (OS) celé skupiny pacientů (N=70). 
Graf 2. Srovnání 5letého EFS pacientů standardního a vysokého rizika. 
Graf 3. Srovnání 5letého OS pacientů standardního a vysokého rizika. 
Celkové výsledky léčby jsou uvedeny v tabulce 4. Kompletní remise dosáhlo 86 % dětí (n = 60), časnou smrtí zemřelo 11 % pacientů (n = 8) a 3 % bylo non-responderů (n = 2), z nichž jeden zemřel a druhý byl transplantován od nepříbuzného dárce v parciální remisi, prodělal relaps a absolvoval druhou transplantaci od stejného dárce, po níž žije v remisi 3,5 roku. U dětí, které zemřely časnou smrtí (n = 8), byly příčinou komplikace základního onemocnění u tří dětí (všechny měly monocytární leukemii a leukocytózu ≥ 200 000/μl, příčinou úmrtí bylo krvácení a multiorgánové selhání) a pět dětí zemřelo v aplázii dřeně po prvním bloku: stafylokoková sepse a neutropenická enterokolitida u dítěte s Downovým syndromem a M3 leukemií (n = 1), ATRA syndrom u promyelocytární leukemie (n = 1) a krvácení u kojence s megakaryocytární leukemií (n = 1) nebo po druhém bloku chemoterapie: stafylokoková a pseudomonádová sepse u dvou dětí s M0 leukemií, které nedosáhly remise po prvním bloku.
Z 60 dětí, které dosáhly remise, zemřelo 9 pacientů (15 %) v remisi na toxické komplikace léčby. Dvě děti zemřely po druhém bloku chemoterapie (HAM), tři po 3. bloku, jedno po čtvrtém a tři po pátém bloku (HAV). Příčinou úmrtí byla ve všech případech bakteriální sepse (Klebsiela: 4, Pseudomonas aeruginoza: 2, E. coli: 1, Salmonela: 1, etiologie neznámá: 1).
Alogenní transplantaci od HLA identického sourozence v první remisi podstoupily 3 děti (5 % dětí, které dosáhly remise). Dvě žijí v první remisi, jedno prodělalo relaps a zemřelo. Nepříbuznou transplantaci podstoupil pacient non-responder (viz výše). Jeden pacient byl léčen autologní transplantací kostní dřeně místo pátého bloku chemoterapie z důvodu předchozí neurotoxicity HD-AraC, relaboval a zemřel.
Relapsy a sekundární malignity
Relaps AML postihl 18 dětí (30 %). Časný relaps do roku od diagnózy se vyskytl u 9 dětí, pozdní relaps déle než 1 rok od diagnózy rovněž u 9 dětí (ve druhém roce 7 relapsů, ve třetím jeden, ve čtvrtém rovněž jeden relaps). Nejdelší interval mezi diagnózou a relapsem byl 3,6 roku. U 16 dětí se jednalo o izolovaný dřeňový relaps, u dvou dětí o kombinovaný relaps v kostní dřeni a kůži.
Dvě dívky s promyelocytární leukemií prodělaly sekundární malignitu. První pacientka vyvinula MDS-RAEB s normálním karyotypem 4 roky od diagnózy, podstoupila nepříbuznou transplantaci kostní dřeně a žije v remisi. Druhá dívka onemocněla sekundární akutní lymfoblastickou leukemií (ALL) s přestavbou MLL genu a leukocytózou 364 000/μl 2,5 roku od diagnózy, absolvovala chemoterapii pro vysoce rizikovou ALL a transplantaci kostní dřeně od nepříbuzného dárce. Žije v remisi.
Prognostické faktory
Výsledky léčby jednotlivých genotypů AML jsou uvedeny v tabulce 5. Z 5 dětí s Downovým syndromem a megakaryocytární leukemií všechny dosáhly remise, jedno zemřelo v remisi na sepsi a čtyři žijí v první remisi. Dítě s monozomií 7 prodělalo relaps a zemřelo, pacienti s nálezem 7q - a 5q - podstoupili transplantaci kostní dřeně v první remisi od HLA identického sourozence. Dítě s 5q - prodělalo relaps, podstoupilo druhou transplantaci a zemřelo v druhém relapsu. Pacient se 7q - žije v remisi.
Tab. 5. Výsledky léčby dle genotypu (5letý EFS/OS). 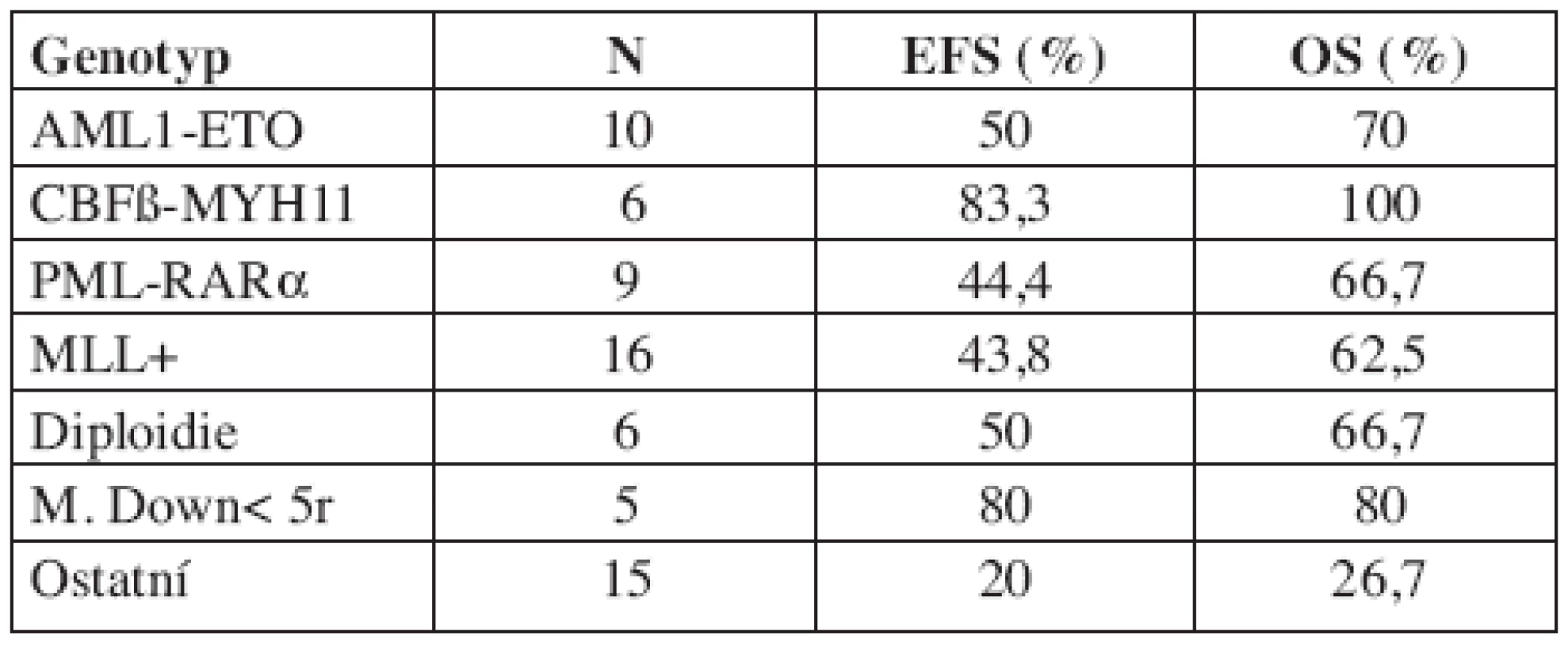
Při hodnocení jednorozměrnou analýzou byla jediným signifikantním prognostickým faktorem pro EFS iniciální leukocytóza. Časná odpověď na léčbu hodnocená v kostní dřeni 2 týdny od začátku léčby, pohlaví, riziková skupina, přítomnost tří prognosticky příznivých fúzních genů AML1-ETO, CBFβ-MYH11 a PML-RARα, komplexní karyotyp a věk svůj význam pro prognózu naší skupiny pacientů neprokázaly (tab. 6).
Tab. 6. Prognostické faktory a EFS/OS. 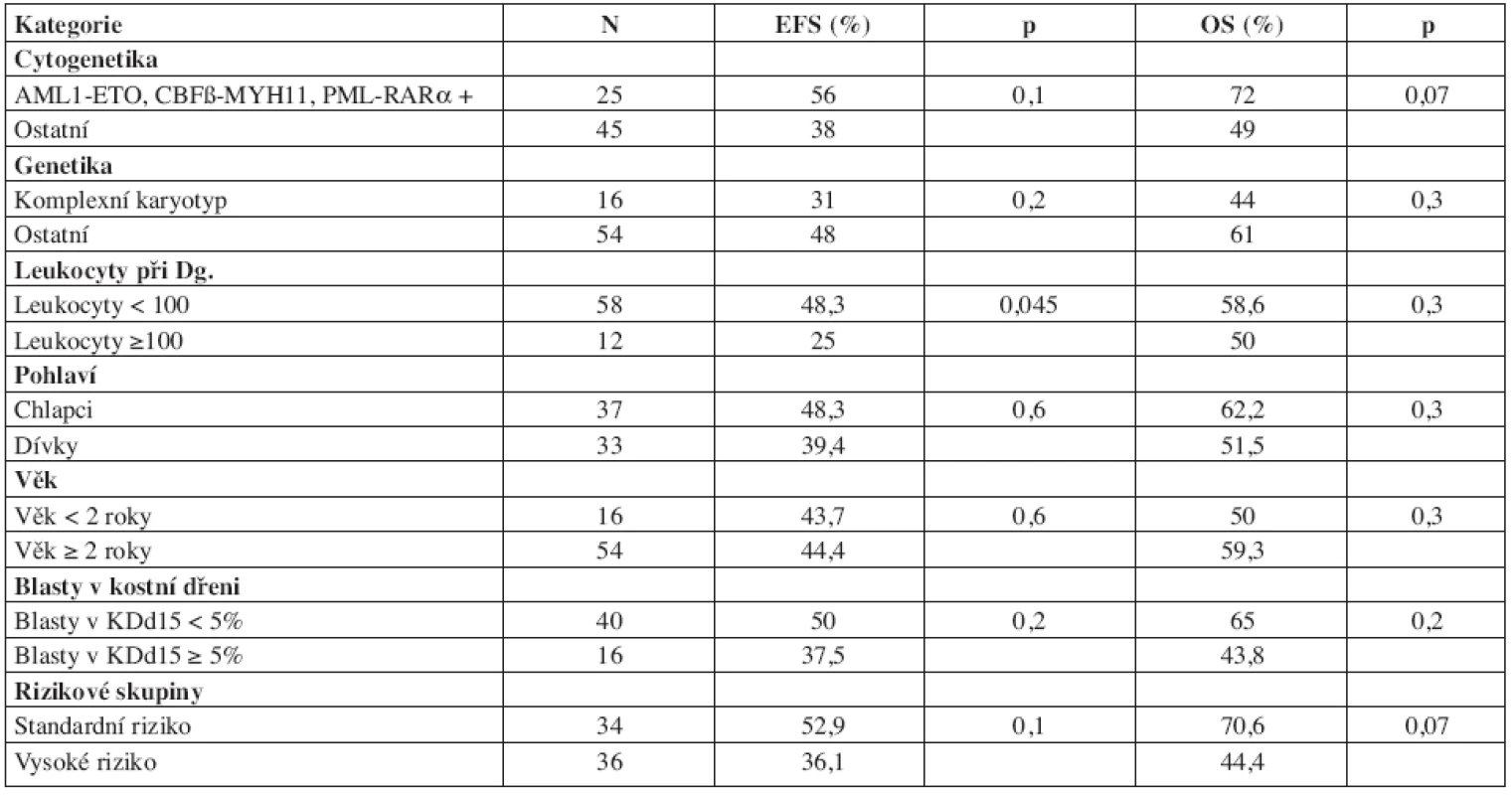
Diskuse
Nová studie AML-BFM 98 nepřinesla pro Českou republiku zásadní zlepšení výsledků léčby ve srovnání s předchozím protokolem AML-BFM 93 (EFS 44,3 % vs. 42,3 %; p = 0,7), i když se zvýšila úspěšnost v dosažení remise (86 % vs. 74 %), mírně poklesl výskyt relapsů (30 % vs. 33,6 %) a zlepšilo se celkové přežití (OS 57,1 % vs. 45,3 %; p = 0,2). Stejná situace platila i pro mezinárodní studii BFM 98 (n = 473, včetně českých pacientů), která ve srovnání s předchozí studií BFM 93 nezlepšila významně EFS (50 % vs. 48 %; p = 0,9) ani OS (62 % vs. 58 %; p = 0,09) při zvýšení úspěšnosti v dosažení remise z 82 % na 88 % (20).
Stagnace léčebných výsledků v mezinárodní studii nám poskytla šanci dosáhnout srovnatelných výsledků léčby našich pacientů se zahraničními centry, což se nám v minulém protokolu AML-BFM 93 nepodařilo. Hlavním důvodem nevýznamného zlepšení našich výsledků v současné studii (a nadále horších výsledků ve srovnání se zahraničními účastníky studie) byl příliš vysoký výskyt toxických smrtí. Zatímco počet časných smrtí klesl ve srovnání s předchozím protokolem z 18 % na 11 % a počet non-responderů z 8,2 % na 3 %, výskyt smrtí v remisi se zvýšil z 9 % na 15 %. Tyto výsledky ostře kontrastují s mezinárodní BFM 98 studií, kde postihla časná smrt pouze 3,3 % dětí a v remisi zemřelo 3,5 % pacientů (včetně českých pacientů). Naše neuspokojivé výsledky jsou dokladem faktu, že období získávání zkušeností s velice intenzivní chemoterapií AML protokolů přesáhlo v České republice délku jedné studie (21). Jednou z příčin je jistě skutečnost, že relativně malý počet 70 nově diagnostikovaných pacientů za 5 let trvání studie znamenal, že v jednotlivých pracovištích (7 center) se ročně léčil velmi malý počet dětí a není tak jednoduché získat dostatečnou zkušenost se zvládáním komplikací, které náročnou léčbu AML provází. Rozhodující příčinou úspěchu německých (BFM) a britských (MRC AML) protokolů léčby AML je dávková intenzita indukčních, ale i konsolidačních bloků. Obě studie jsou charakterizovány velmi intenzivní iniciální léčbou a dosahují lepších výsledků než například postupy pracovních skupin amerických, které nižší dávkovou intenzitu počátečních fází léčby „dohánějí“ častější indikací k transplantaci kostní dřeně v první remisi, která na rozdíl od výše uvedených studií zlepšovala výsledky léčby (22–25). Týdny trvající aplázie kostní dřeně, opakující se po každém ze 4–5 bloků léčby, jsou pravidelně provázeny výskytem bakteriálních infekcí. Rovněž riziko vzniku systémových mykotických infekcí je v léčbě AML logicky vysoké (dlouhodobé neutropenie, opakovaná léčba širokospektrými antibiotiky) (26). Britská skupina MRC snížila v průběhu studie AML 10 v devadesátých letech výskyt smrtí na komplikace léčby z iniciálních 17,8 % na 9,6 % v závěru studie (27). Američtí kolegové ve studii CCG 2961 (1996–2002) zvýšili po britském vzoru intenzitu léčby, mimo jiné zařazením bloku Ida-FLAG (kombinace vysokých dávek AraC, idarubicinu a fludarabinu). Rázem se významně zvýšila úmrtnost na infekční komplikace (11 %). Více než polovinu infekčních úmrtí způsobily systémové mykotické infekce, významnou roli hrály i infekce vyvolané G+ koky, vzácností nebyla polybakteriální infekce jako příčina úmrtí. Polovina dětí prodělávala G+ infekce po každém bloku léčby, 20–30 % dětí infekce gram negativní a 20 % infekce plísňové (28). Ve studii rovněž prodělali fázi učení se zvládat komplikace nové náročné léčby. Toxická úmrtí klesla z počátečních 19 % na 12 % v závěrečných 20 měsících. EFS v 5 letech od diagnózy činil pro velikou skupinu 901 dětí 42 % a celkové přežití 52 % (29). V naší studii BFM 98 zemřelo na infekční komplikace 12 dětí (17 %), 9 z nich na gram negativní sepse, dvě na G+ infekci a v jednom případě nebylo etiologické agens zachyceno. Nepřítomnost mykotické infekce jako příčiny úmrtí jistě neznamená, že nás tato z nejobávanějších komplikací léčby AML mine i ve studiích příštích. Podmínkou zlepšení celostátních výsledků léčby AML v příštím protokolu je tedy zásadní posun v úspěšnosti zvládání infekčních komplikací. Dvě z pracovišť léčících pacienty ve studii BFM 98 již děti s AML neléčí. Koncentrace pacientů s AML do méně pracovišť dává šanci na rychlejší získání zkušeností s touto náročnou léčbou. Podobně je otázkou zkušenosti i zvládání iniciálních projevů leukemie (koagulopatie a multiorgánové selhání) typických pro pacienty s monocytární leukemií, výraznou hepatosplenomegalií a leukocytózou > 100 000/μl (21). Tři takové děti zemřely časnou smrtí i v naší studii.
Zlepšení celkového přežití ve srovnání s předchozím protokolem AML-BFM 93 nebylo dosaženo zlepšením přežití do „selhání“, ale celkového přežití. Z 22 dětí se selháním léčby (non-responder: 2, relaps: 18, sekundární malignita: 2) žije 8 dětí (36 %), všechny po transplantaci kostní dřeně.
Přítomnost fúzních genů AML1-ETO, CBFß-MYH11 a PML-RARα, hodnocená v jednorozměrné analýze, nebyla v naší skupině signifikantním příznivým prognostickým faktorem. Toxické smrti se bohužel nevyhnuly ani této skupině pacientů a ovlivnily tak její výsledky léčby. Celostátní screening těchto tří podtypů AML zvýšil jejich zastoupení z 15 % ve studii AML-BFM 93 na 36 % všech dětí s AML. Děti s AML1-ETO + či CBFβ-MYH11+ leukemií prodělávají relapsy, jejich šance na vyléčení je ale i v této situaci relativně vysoká ve srovnání s jinými typy AML (22, 23). Akutní promyelocytární leukemie je nemocí, jejíž prognóza se i v BFM protokolech významně zlepšila se zařazením all-trans-retinoidové kyseliny. Mann uvádí EFS/OS 76 % / 87 % u 22 dětí léčených ve studii AML-BFM 93 (30). Přesto se jedná o záludné onemocnění, jehož léčba vyžaduje zkušenost. Jediné dítě, které zemřelo ve studii před léčbou, mělo M3 leukemii, jeden pacient zemřel na komplikace ATRA syndromu, dvě děti na infekční komplikace a dvě prodělaly sekundární malignitu. Žádné neprodělalo relaps. Dvě sekundární malignity jsou pravděpodobně náhodou malých čísel, žádné jiné z 27 dětí s M3 leukemií zařazených do mezinárodní studie BFM 98 sekundární malignitu neprodělalo. Nicméně i tak je možné diskutovat, není-li léčba promyelocytární leukemie v BFM protokolech příliš intenzivní ve srovnání s protokoly italskými či španělskými, které kombinují dlouhodobou léčbu all-trans-retinoidovou kyselinou s relativně vysokými dávkami antracyklinů, ale významně nižší potřebou jiných léků včetně AraC při velmi dobrých výsledcích (31, 32). Dalším zajímavým zjištěním o M3 leukemii u českých dětí je její dlouhodobě vysoké (13 %) zastoupení mezi AML, srovnatelné s výskytem u dětí v Itálii či Španělsku a významně vyšší než v SRN, Skandinávii či Velké Británii (~6%).
MLL přestavba se spojuje s monocytární leukemií, v dětském věku postihuje zejména velmi malé děti mladší dvou let a její prognóza je intermediární, což plně platilo i pro soubor našich 16 pacientů. Všichni pacienti měli detailním vyšetřením nalezeného partnera MLL genu, nejčastěji se rovněž v souladu s literaturou jednalo o t(9;11). Do diskuse, jedná-li se o prognosticky příznivější nález ve srovnání s jinými translokacemi MLL genu jsme pro malý počet pacientů nemohli zasáhnout (33). Ze 6 dětí s t(9;11) žijí v první remisi 3, z 10 dětí s ostatními změnami čtyři. Komplexní karyotyp se vyskytl u 25 % dětí s úspěšně provedeným cytogenetickým vyšetřením včetně čtyř dětí s „příznivými“ fúzními geny. Jejich prognóza se nelišila od dětí bez tohoto nálezu (tři z nich prodělaly relaps). Negativní význam komplexních chromozomových změn pro prognózu dětské AML není na rozdíl od dospělých potvrzen (7, 29). Roli může hrát malý počet publikovaných pacientů.
Jedno až dvě procenta dětí s Downovým syndromem (DS) onemocní leukemií, nejčastěji v prvních 5 letech života a to leukemií megakaryocytární. Ve 20–30 % předchází vzniku tohoto typu leukemie tzv. transientní myeloproliferativní reakce – leukemický obraz v krvi i dřeni u novorozenců, který většinou spontánně bez léčby ustoupí v průběhu měsíců a následně se po bezpříznakovém intervalu rozvine AML (34). Obě stadia nemoci jsou charakterizována megakaryocytárními blasty a průkazem mutace genu pro transkripční faktor GATA1. Z našeho souboru 5 dětí s megakaryocytární leukemií měl dokumentovanou myeloproliferativní reakci jeden pacient. Výsledky léčby dětí s Downovým syndromem a megakaryocytární leukemií jsou velmi dobré i při redukci intenzity chemoterapie. Klíčovým lékem se zdá být AraC. V mezinárodní BFM 98 studii bylo léčeno 67 dětí s Downovým syndromem, jejich 3letý EFS/OS byl 89 % / 91 %, relaps byl výjimečnou událostí (35). Osud starších dětí (≥ 5 r) s DS a AML je naopak horší než u pacientů bez DS. Chybí predilekce megakaryocytární leukemie a toxicita léčby je vysoká (36). Osud našeho jediného pacienta z této věkové kategorie byl s tímto pozorováním v souladu.
Alogenní transplantace kostní dřeně neznamená pro děti vysokého rizika výhodu ve srovnání s chemoterapií v protokolech německé (BFM) či britské (MRC AML) pracovní skupiny, jejichž léčba je velmi intenzivní (22, 23). V současném, v České republice používaném protokolu AML-BFM 2004 jsou v první remisi indikovány k alogenní transplantaci od sourozeneckých či alternativních dárců pouze děti, které nedosáhnou remise po dvou indukčních blocích léčby.
Součástí studie AML-BFM 98 byly tři randomizované fáze léčby. Zařazení G-CSF po prvním a druhém bloku zkrátilo délku neutropenie o 5 dní, avšak výskyt febrilní neutropenie, mikrobiologicky dokumentované infekce a s infekcí spojené mortality se nesnížil. EFS obou skupin pacientů se nelišil (37). Srovnání klasické konsolidace BFM protokolů s dvěma bloky AI a haM přineslo srovnatelný EFS a o 15 dní kratší délku léčby v „blokovém“ rameni, ve kterém byla rovněž zaznamenána nižší mortalita na komplikace (38). V novém protokolu BFM 2004 nahradily bloky haM a AI klasickou konsolidaci s prednizonem a vinkristinem. Třetím randomizovaným projektem bylo srovnání účinnosti ozáření krania dávkou 12 Gy vs. standardní dávkou 18 Gy. Tato studie pokračuje i v současném protokolu BFM 2004. Profylaktické ozáření CNS je problematickou součástí BFM protokolů, zdůvodňovanou vyšším výskytem systémových relapsů u neozářených pacientů při nerandomizovaném srovnání s profylakticky ozářenými dětmi ve studii AML-BFM 87 (39). Prakticky žádný jiný současný respektovaný protokol léčby dětské AML profylaktické záření mozku nepoužívá a dokladuje výsledky a výskyt relapsů srovnatelný se studií BFM (23). V připravované studii AML-BFM 2009 bude velmi pravděpodobně ozáření mozku opuštěno. Druhou diskutabilní komponentou BFM protokolů je roční udržovací léčba, která je rovněž většinou jiných pracovních skupin opuštěna. Francouzská pracovní skupina LAME neprokázala formou randomizované studie ve srovnatelně intenzivním protokolu výhodu udržovací léčby. Naopak přežití pacientů léčených bez udržovací léčby bylo vyšší díky úspěšnější léčbě relapsu (40). BFM skupina v novém protokolu velmi pravděpodobně na podání udržovací léčby rezignuje.
Prospektivní detekce MRN pomocí průtokové cytometrie byla provedena u 150 dětí a hodnotitelná u 145 z nich. Pacienti s pozitivní MRN ve 3 a více časových bodech (13 %) tvořili skupinu se špatnou prognózou s EFS 31 %. Statisticky významný rozdíl v EFS ve 3 letech od diagnózy mezi MRN pozitivními a MRN negativními pacienty byl před zahájením druhého bloku chemoterapie (EFS 71 % vs. 48 %, p = 0,03). V mnohorozměrné analýze ale MRN význam neprokázala a nezlepšila stratifikaci pacientů do rizikových skupin podle BFM doporučení (15).
Závěr
Zařazení druhého bloku s vysokodávkovaným AraC do léčby dětí standardního rizika jejich prognózu na rozdíl od pacientů vysokého rizika v předchozí studii BFM 93 nezlepšilo. Na rozdíl od dětí SR, kde se zdají být možnosti současné chemoterapie vyčerpány, pacienti s vysokým rizikem mohou v příští studii těžit z dalšího zvýšení intenzity léčby. Současné protokoly léčby dětské AML jsou schopny dosáhnout u 50 % pacientů dlouhodobých remisí a se zařazením transplantace kostní dřeně do léčby relapsu je možné vyléčit 60–65 % všech dětí. Úkolem České pracovní skupiny pro dětskou hematologii je snížit výskyt úmrtí na komplikace léčby. Snížení toxicity léčebných schémat je úkolem na mezinárodním poli. Může mu napomoci lepší poznání biologie dětské AML a zařazení léků cílené léčby do protokolů chemoterapie.
Poděkování
Děkujeme pracovníkům laboratoří morfologie, průtokové cytometrie a cytogenetickým laboratořím jednotlivých nemocnic za provedení vstupních vyšetření při diagnóze a v relapsu. Rovněž děkujeme lékařům a sestrám jednotlivých center za péči o dětské pacienty a spolupráci při získávání klinických a laboratorních dat. Aleši Lukšovi děkujeme za technickou spolupráci na přípravě rukopisu. Studie byla částečně podpořena výzkumnými záměry MSM 0021620813, MSM 6198959216, MZO 00064203/6719 a LC 535 - MSMT.
Prof. MUDr. Jan Starý, DrSc.
Klinika dětské hematologie a onkologie
UK 2. LF a FN Motol Praha
V Úvalu 84
150 06 Praha 5
jan.stary@lfmotol.cuni.cz
Doručeno do redakce: 25. 8. 2008
Přijato: 25. 9. 2008
Zdroje
1. Webb DKH, Harrison G, Stevens RF, et al. Relationships between age at diagnosis, clinical features, and outcome of therapy in children treated in the Medical Research Council AML 10 and 12 trials for acute myeloid leukemia. Blood 2001; 98 : 1714–1720.
2. Ahmed M, Sternberg A, Hall G, et al. Natural history of GATA1 mutations in Down syndrome. Blood 2004; 103 : 2480–2489.
3. De Botton S, Coiteux V, Chevret S, et al. Outcome of childhood acute promyelocytic leukemia with all-trans-retinoic acid and chemotherapy. J Clin Oncol 2004; 22 : 1404–1412.
4. Grimwade D, Walker H, Oliver F, et al The importance of diagnostic cytogenetics on outcome in AML: analysis of 1,612 patients entered into the MRC AML 10 trial. Blood 1998; 92 : 2322–2333.
5. Raimondi SC, Chang MN, Ravindranath Y, et al. Chromosomal abnormalities in 478 children with acute myeloid leukemia: clinical characteristics and treatment outcome in a cooperative Pediatric Oncology Group Study-POG 8821. Blood 1999; 94 : 3707–3716.
6. Forestier E, Heim S, Blennow E, et al. Cytogenetic abnormalities in childhood acute myeloid leukaemia: a Nordic series comprising all children enrolled in the NOPHO-93-AML trial between 1993 and 2001. Br J Haematol 2003; 121 : 566–577.
7. Hasle H, Alonzo TA, Auvrignon A, et al. Monosomy 7 and deletion 7q in children and adolescents with acute myeloid leukemia: an international retrospective study. Blood 2007; 109 : 4641–4647.
8. Starý J, Gajdoš P, Blažek B, et al. Sjednocení léčby dětí s akutní myeloidní leukemií v České republice podle protokolu AML-BFM 93. Čas Lék čes 2004; 143 : 257–263.
9. Bennett JM, Catovsky D, Daniel MT, et al. Proposed revised criteria for the classification of acute myeloid leukemia. Ann Intern Med 1985; 103 : 626–629.
10. Bennett JM, Catovsky D, Daniel MT, et al. Criteria for the diagnosis of acute leukemia of megakaryocyte lineage (M7): a report of the French-American-British Cooperative Group. Ann Intern Med 1985; 103 : 460–462.
11. Bennett JM, Catovsky D, Daniel MT, et al. Proposal for the recognition of minimally differentiated acute myeloid leukemia (AML-M0). Br J Haematol 1991; 78 : 325–329.
12. Zemanová Z, Michalová K, Šindelářová L, et al. Prognostic value of structural chromosomal rearrangements and small cell clones with high hyperdiploidy in children with acute lymphoblastic leukemia. Leukemia Res 2005; 29 : 273–281.
13. Schwarz J, Kačírková P, Marková J, et al. Urgentní stav v hematologii: akutní promyelocytární leukemie – principy diagnostiky. Vnitř lék 2008; v tisku.
14. Trnková Z, Bedrníková R, Marková J, et al. Semiquantitative RT-PCR evaluation of the MDR1 gene expression in patients with acute myeloid leukemia. Neoplasma 2007; 54 : 383-390.
15. Langebrake C, Creutzig U, Dworzak M, et al. Residual disease monitoring in childhood acute myeloid leukemia by multiparameter flow cytometry: the MRD-AML-BFM study group. J Clin Oncol 2006; 24 : 3686–3692.
16. Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the international working group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia. J Clin Oncol 2003; 21 : 4642–4649.
17. Creutzig U, Kaspers GJL. Revised recommendations of the international working group for diagnosis, standardization of response criteria, treatment outcomes, and reporting standards for therapeutic trials in acute myeloid leukemia. Letter to Editor. J Clin Oncol 2004; 22 : 3432–3433.
18. Kaplan EL, Meier P. Nonparametric estimation from incomplete observations. J Am Stat Assoc 1958; 53 : 457–481.
19. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep 1966; 50 : 163–170.
20. Creutzig U, Zimmermann M, Lehrnbecher T, et al. Results of study AML-BFM 98 in children and adolescents with acute myeloid leukemia after a median follow-up of five years. Klin Pediatr 2008; submitted.
21. Creutzig U, Zimmermann M, Reinhardt D, et al. Early deaths and treatment-related mortality in children undergoing therapy for acute myeloid leukemia: analysis of the multicenter clinical trials AML-BFM 93 and AML-BFM 98. J Clin Oncol 2004; 22 : 4384–4393.
22. Creutzig U, Zimmermann M, Ritter J, et al. Treatment strategies and long-term results in paediatric patients treated in four consecutive AML-BFM trials. Leukemia 2005; 19 : 2030–2042.
23. Gibson BES, Wheatley K, Hann IM, et al. Treatment strategy and long-term results in paediatric patients treated in consecutive UK AML trials. Leukemia 2005; 19 : 2130–2138.
24. Smith FO, Alfonzo TA, Gerbing RB, et al. Long-term results of children with acute myeloid leukemia: a report of three consecutive phase III trials by the Children’s Cancer Group: CCG 251, CCG 213, CCG 2891. Leukemia 2005; 19 : 2054–2062.
25. Ravindranath Y, Chang M, Steiner CP, et al. Pediatric Oncology Group studies of acute myeloid leukemia: a review of four consecutive childhood AML trials conducted between 1981 and 2000. Leukemia 2005; 19 : 2101–2116.
26. Lehrnbecher T, Varwig D, Kaiser J, et al. Infectious complications in pediatric acute myeloid leukemia: analysis of the prospective multi-institutional clinical trial AML-BFM 93. Leukemia 2004; 18 : 72–77.
27. Riley LC, Hann IM, Wheatley K, et al. Treatment-related deaths during induction and first remission of acute myeloid leukaemia in children treated on the Tenth Medical Research Council acute myeloid leukemia trial (MRC AML 10). Br J Haematol 1999; 106 : 436–444.
28. Sung L, Lange BJ, Gerbing RB, et al. Microbiologically documented infections and infection-related mortality in children with acute myeloid leukemia. Blood 2007; 110 : 3532–3539.
29. Lange BJ, Smith FO, Feusner J, et al. Outcomes in CCG-2961, a Children’s Oncology Group phase 3 trial for untreated pediatric acute myeloid leukemia: a report from the Children’s Oncology Group. Blood 2008; 111 : 1044–1053.
30. Mann G, Reinhardt D, Ritter J, et al. Treatment with all-trans retinoic acid in acute promyelocytic leukemia reduces early deaths in children. Ann Hematol 2001; 80 : 417–422.
31. Testi AM, Biondi A, Lo Coco F, et al. GINEMA-AIEOP AIDA protocol for the treatment of newly diagnosed acute promyelocytic leukemia (APL) in children. Blood 2005; 106 : 447–453.
32. Ortega J, Madero L, Martin G, et al. Treatment with all-trans-retinoic acid and anthracycline monochemotherapy for children with acute promyelocytic leukemia: a multicenter study by the PETHEMA group. J Clin Oncol 2005; 23 : 7632–7640.
33. Rubnitz JE, Raimondi SC, Xin Tong, et al. Favorable impact of the t(9;11) in childhood acute myeloid leukemia. J Clin Oncol 2002; 20 : 2302–2309.
34. Massey GV, Zipursky A, Chang MN, et al. A prospective study of the natural history of transient leukemia in neonates with Down syndrome: Children’s Oncology Group study POG 9481. Blood 2006; 107 : 4606–4613.
35. Creutzig U, Reinhardt D, Diekamp S, et al. AML patients with Down syndrome have a high cure rate with AML-BFM therapy with reduced dose intensity. Leukemia 2005; 19 : 1355–1360.
36. Gamis AS, Woods WG, Alfonzo TA, et al. Increased age at diagnosis has a significantly negative effect on outcome in children with Down syndrome and acute myeloid leukemia: a report from the Children’s Cancer Group Study 2891. J Clin Oncol 2003; 21 : 3415–3422.
37. Lehrnbecher T, Zimmermann M, Reinhardt D, et al. Prophylactic human granulocyte colony-stimulating factor after induction therapy in pediatric acute myeloid leukemia. Blood 2007; 109 : 936–943.
38. Creutzig U, Zimmermann M, Lehrnbecher T, et al. Less toxicity by optimizing chemotherapy, but not by addition of granulocyte colony-stimulating factor in children and adolescents with acute myeloid leukemia: results of AML-BFM 98. J Clin Oncol 2006; 24 : 4499–4506.
39. Creutzig U, Ritter J, Zimmermann M, et al. Does cranial irradiation reduce the risk for bone marrow relapse in acute myelogenous leukemia? Unexpected results in the Childhood Acute Myelogenous Leukemia Study BFM-87. J Clin Oncol 1993; 11 : 279–286.
40. Perel Y, Auvrignon A, Leblanc T, et al. Impact of addition of maintenance therapy to intensive induction and consolidation chemotherapy for childhood acute myeloblastic leukemia: results of a prospective randomized trial LAME 89/91. J Clin Oncol 2002; 20 : 2774–2782.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2008 Číslo 4- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
- Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
- Vyhledávání příbuzenského dárce krvetvorných buněk – koordinace procesu a výsledky jednoho centra
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- DNA mikročipy (microarrays) v diagnostice folikulárního lymfomu: cesta k terapii „šité na míru“ nebo slepá ulička?
- Autotransfuze v České republice v roce 2007
- GRATULUJEME
- Vybrané odborné akce v roce 2009
- OBSAH ROČNÍKU 14/2008 Transfuze a hematologie dnes
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučený postup
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy