-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Non-Hodgkinęs lymphomas in childhood in Slovak republic – the incidence and treatment results
Background:
The aim of the study is to evaluate the incidence and treatment results in children and adolescent with non-Hodgkin’s lymphomas in Slovak republic since the treatment was unificated in three centers of pediatric oncology and to compare these results with those in previous period and with results in progressive international groups. Patients and methods: In a retrospective study the incidence, subgroups of lymphomas in individual centers, treatment results, relapses, cause of death, transplantation activity in patients treated according to protocols NHL BFM 95, EURO-LB 02, B-NHL BFM 04 a ALCL 99 is analyzed during the period between November 1996 to December 2008. Results: Incidence of lymphomas is analysed in 102 patients and treatment results in 99 eligible patients. There are 26 patients (25.5%) with lymphoblastic lymphoma, 55 (53.9%) with mature B-cell lymphomas, 18 (17.7%) with anaplastic large cell lymphoma and 3 (2.9%) with another lymhomas. Complete remission was achieved in 83 children (83.8%) of the whole group of patients and in 25 (96 %) of lymphoblastic lymhoma, 42 (76.3%) of mature B-cell lymphomas and 16 (88.9%) of anaplastic large cell lymphoma subgroups. Relapse occurred in 5 patients (5.1%), 18 patients died (18.2%) and 81 patients (81.2%) are alive in period of 2–144 months (median 50 months). 5 patient were transplanted. 5-year event free survival is 0.75 in the whole group, in lymphoblastic lymphoma, mature B-cell lymphomas and anaplastic large cell lymphoma 0.78; 0.72; 0.77. 5-year overall survival is 0.81 in the whole group, in lymphoblastic lymphoma, mature B-cell lymphomas and anaplastic large cell lymphoma 0.92; 0.75; 0.81. Conclusions: The results in the study group has improved in comparison to the previous period, but they still have not reached the results of other multicenter international groups. In order to improve the results an effort to decrease the number of toxic deaths should be pursued as the first option.Key words:
non-Hodgkin’s lymphomas, childhood, treatment results
Autoři: E. Bubanská 1; E. Kaiserová 2; I. Oravkinová 3; J. Horáková 4; D. Petržalková 2
Působiště autorů: Klinika pediatrickej onkológie a hematológie SZU v DFNsP, Banská Bystrica 1; Detská onkologická klinika LF UK a DFNsP, Bratislava 2; Oddelenie detskej hematológie a onkológie DFN, Košice 3; Transplantačná jednotka kostnej drene II. Detskej kliniky LF UK a DFNsP, Bratislava 4
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 1, p. 6-16.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Východisko:
Cieľom práce je zhodnotiť výskyt a výsledky liečby nehodgkinovských lymfómov v detskom a adolescentom veku v Slovenskej republike po zjednotení liečebných postupov v troch detských onkologických centrách a výsledky porovnať s výsledkami v predchádzajúcom období a s výsledkami medzinárodných skupín. Súbor a metódy: V čase od novembra 1996 do decembra 2008 sa hodnotí výskyt nehodgkinovských lymfómov, zastúpenie podtypov a ich rozdelenie medzi jednotlivé onkocentrá a výsledky liečby podľa protokolu NHL BFM 95, EURO-LB 02, B-NHL BFM 04 a ALCL 99. Analyzujú sa relapsy, úmrtia a transplantačná aktivita. Výsledky: Výskyt lymfómov sa hodnotí u 102 pacientov, výsledky liečby sa analyzujú u 99 pacientov. Lymfoblastický lymfóm bol diagnostikovaný u 26 detí (25,5 %), zrelé B-bunkové lymfómy u 55 detí (53,9 %), anaplastický veľkobunkový lymfóm u 18 detí (17,7 %) a iné u 3 detí (2,9 %). Kompletnú remisiu dosiahlo 83 detí (83,8 %), 25 detí (96 %) s lymfoblastickým lymfómom, 42 detí (76,3 %) so zrelým B-bunkovým lymfómom, 16 detí (88,9 %) s anaplastickým veľkobunkovým lymfómom. Relaps prekonalo 5 detí (5,1 %), zomrelo 18 detí (18,2 %), žije 81 detí (81,2 %) v čase 2–144 mesiacov s mediánom 50 mesiacov. Transplantáciu podstúpilo 5 pacientov. 5-ročný event free survival je pre celý súbor 0,75 a pre lymfoblastický, zrelé B-bunkové a anaplastický veľkobunkový lymfóm 0,78; 0,72; 0,77. Celkové prežitie v celom súbore je 0,81 a pre lymfoblastický, zrelé B-bunkové a anaplastický veľkobunkový lymfóm 0,92; 0,75; 0,81. Záver: Výsledky v hodnotenom súbore sú oproti predchádzajúcemu obdobiu výrazne zlepšené, nedosahujú však výsledky medzinárodných pracovných skupín. Možnosti zlepšenia sú hlavne v znížení toxických úmrtí.Kľúčové slová:
nehodgkinovské lymfómy, detský vek, výsledky liečbyÚvod
Malígne lymfómy (ML) sú zhubné nádorové ochorenia, ktoré vznikajú nádorovou klonálnou transformáciou buniek lymfocytového radu v rôznom štádiu vývoja lymfocytov, resp. ich diferenciácie. Aj z toho dôvodu sa rozdeľujú na ML z prekurzorových buniek (lymfoblastov), ktoré zodpovedajú včasným diferenciačným štádiám a na ML zo „zrelých“ (periférnych) buniek, ktoré zodpovedajú lepšie diferencovaným bunkám lymfocytového radu. S tým súvisí zvláštnosť morfologického obrazu buniek malígneho lymfómu, v ktorom na rozdiel od iných zhubných nádorov väčšinou chýbajú výraznejšie atypie, či črty anaplázie nádorových buniek a individuálne bunky väčšiny ML sú viac-menej morfologicky podobné ich fyziologickým náprotivkom (1).
Malígne lymfómy sa klasifikujú podľa klasifikácie lymfoproliferatívnych ochorení SZO (WHO) z roku 2001 (2) a v súčasnosti je od roku 2008 k dispozícii aj jej inovovaná forma, ktorá túto klasifikáciu ďalším poznaním doplňuje, resp. upravuje. Na rozdiel od predošlých klasifikačných systémov, tento klasifikačný systém rozdeľuje ML na podklade nielen morfologických a imunofenotypových znakov, ale zohľadňuje aj genetické a molekulovo-biologické parametre nádorových buniek a rovnako tiež klinické prejavy jednotlivých subtypov. ML sa naďalej delia na Hodgkinove malígne lymfómy (HL) a na nehodgkinovské malígne lymfómy (NHL).
Pre určenie biologickej povahy nádoru typu malígneho lymfómu a z klinického hľadiska je prognosticky významné delenie na tzv. indolentné, agresívne a vysokoagresívne typy lymfómov. Neliečení pacienti s indolentnými ML prežívajú rádovo roky, s agresívnymi lymfómami rádovo mesiace a s vysokoagresívnymi lymfómami, ak nie sú liečení, žijú rádovo len týždne (1).
Malígne lymfómy sú po leukémiách a nádoroch CNS tretia najčastejšia malignita v detskom veku a tvoria 6-10 % malignít, pričom HL sú častejšie ako NHL (3, 4). Viac ako 95 % detských NHL patrí do skupiny agresívnych až vysoko agresívnych lymfómov podľa SZO klasifikácie a tvoria ich štyri hlavné podtypy: Burkittov lymfóm (BL) 40 %, lymfoblastický lymfóm (LL) 30 %, difúzny veľkobunkový B-lymfóm (DLBCL) 15–20 % a anaplastický veľkobunkový lymfóm (ALCL) 10–15 %. Vzácne sa v detskom veku môžu vyskytnúť niektoré formy indolentných lymfómov (folikulový, lymfoplazmocytový, lymfómy MALT), primárne kožné lymfómy a agresívny periférny T-bunkový lymfóm. Prognóza detí sa za obdobie ostatných 30 rokov výrazne zlepšila vo všetkých podtypoch NHL. Deti a adolescenti s lokalizovaným ochorením (1. a 2. štádium) majú viac ako 95 % a deti a adolescenti s pokročilým ochorením (3. a 4. štádium s infiltráciou kostnej drene a CNS) 80–90 % šancu na prežitie pri liečbe kombinovanou chemoterapiou, bez potreby súčasne podávanej rádioterapie. Stále však ostávajú podskupiny s horšou prognózou, kde sa celkové prežívanie (OS) dosiahne len v 50–70 %. Medzi tieto podskupiny patrí BL so súčasným postihnutím kostnej drene a CNS, primárny mediastinálny B-lymfóm a časť detí so systémovým ALCL (5). Jedným z kľúčových bodov vo vývoji efektívnych liečebných stratégií liečby NHL v detskom veku bolo poznanie, že rôzne biologické podtypy vyžadujú rôzne liečebné modality (6, 7).
Lymfoblastické lymfómy sú malignity z nezrelých alebo prekurzorových lymfoidných buniek. V súčasnosti je najefektívnejšia liečba LL podľa protokolov, ktoré sú podobné, ak nie identické s protokolmi pre liečbu ALL, podáva sa aj udržiavacia liečba a celková liečba trvá dva roky (5–8). Naproti tomu zrelé B-NHL (BL a DLBCL) sa liečba pomerne krátkou, veľmi intenzívnou liečbou podávaním blokov kombinovanej chemoterapie v krátkych časových intervaloch v závislosti od štádia, veľkosti nádorovej masy a rýchlosti odpovede na liečbu (9–14). Liečebná stratégia ALCL je rôzna – od protokolov podobných ako pri liečbe ALL/LL – až po krátku, intenzívnu liečbu podobnú liečbe B-NHL (15–18).
Liečba detí a adolescentov s malignitami sa v Slovenskej republike uskutočňuje v troch centrách detskej onkológie, ktorými sú: Detská onkologická klinika DFNsP a LF UK Bratislava, Klinika pediatrickej onkológie a hematológie SZU v DFNsP Banská Bystrica a Oddelenie detskej hematológie a onkológie DFN Košice.
Liečba NHL podľa protokolov BFM sa v jednotlivých centrách v SR zavádzala postupne v priebehu 90-tych rokov minulého storočia – následne po uvedení týchto protokolov do liečby akútnych leukémií. Protokol NHL BFM 95 sa v liečbe NHL použil 1 x v detskom onkocentre v Banskej Bystrici v novembri 1996 a od februára 1998 sa podľa neho liečili aj deti v Bratislave a Košiciach.
Po zjednotení liečebných postupov pri liečbe detských malignít v troch centrách detskej onkológie v Slovenskej republike je cieľom práce predložiť analýzu súboru detí a adolescentov s NHL liečených podľa protokolu NHL BFM 95 a po ňom nasledujúcich (ALCL 99, EURO-LB 02 a B-NHL BFM 04).
Súbor pacientov a metódy
Od novembra 1996 do decembra 2008, t.j. 144 mesiacov (12 rokov a 2 mesiace), sa podľa uvedených protokolov liečilo 102 detí – 72 chlapcov a 30 dievčat. Pre analýzu výsledkov liečby je hodnotených 99 detí. Od roku 1998, kedy sa liečba zjednotila, pribudlo ročne 4–14 (priemerne 9) detí s diagnózou NHL.
Zastúpenie jednotlivých podtypov NHL: lymfoblastický lymfóm 26 detí (25,5 %), zrelé B-bunkové lymfómy 55 detí (53,9 %), anaplastický veľkobunkový lymfóm 18 detí (17,7 %) a iné typy 3 deti (2,9 %).
Vek detí v čase diagnózy bol v skupine LL 0,75–18 rokov (medián 9,4 roka) pri zrelých B-NHL 2,75–18,75 rokov (medián 11 rokov) a v skupine ALCL 3,5–17 rokov (medián 13,2 roka).
Diagnostika
Ochorenie bolo diagnostikované na základe histologického vyšetrenia – v úvode hodnotené patológom v regionálnom centre, pri problémoch, resp. v posledných rokoch pravidelne, bol materiál odosielaný do Konzultačného centra bioptickej diagnostiky v Ústave patologickej anatómie Martinskej fakultnej nemocnice. Klasifikácia NHL vychádzala v úvode z Kielskej klasifikácie upravenej podľa návrhu REAL/WHO, neskôr podľa WHO klasifikácie. Okrem histologického a imunohistochemického vyšetrenia materiálu sa v ostatných rokoch využívali aj genetické vyšetrenia – FISH a molekulárne metódy. U časti pacientov bola pre riziko odberu vzorky na histologické vyšetrenia stanovená diagnóza na základe tenkoihlovej cytológie a analýzy výpotkov (morfológia a prietoková cytometria).
Laboratórne vyšetrenia a zobrazovacie metódy
Všetci pacienti mali vyšetrený kompletný krvný obraz, biochemické vyšetrenia včítane hladiny laktátdehydrogenázy (LD), hladinu imunoglobulínov, virologické odbery na zistenie prítomnosti hepatitídy A, B, C a infekcie EBV a CMV, USG vyšetrenie krku a brucha, rentgenovú snímku hrudníka v predozadnej projekcii, CT vyšetrenie hrudníka, punkciu kostnej drene a vyšetrenie mozgomiešneho moku. Zobrazovacie metódy sa v prípade potreby rozšírili o CT, prípadne MR vyšetrenie postihnutej oblasti, USG vyšetrenie postihnutej oblasti, scintigrafiu skeletu, u niektorých pacientov bola použitá PET. U časti pacientov bola realizovaná trepanobiopsia kostnej drene.
Za účelom určenia štádia ochorenia bol použitý štádiový systém zo St. Jude podľa Murphyovej.
Liečba
Podľa protokolu NHL BFM 95 boli pacienti liečení v troch terapeutických skupinách (TG – therapeutic group) a neskôr podľa ďalej uvedených protokolov.
- v TG I – pre lymfoblastický lymfóm............pokračovaním je protokol EURO LB 02
- v TG II – pre zrelé B-NHL..............pokračovaním je protokol B-NHL BFM 04
- v TG III – pre ALCL...........pokračovaním je protokol ALCL 99
Pacienti v protokoloch neboli randomizovaní.
Protokol NHL BFM 95:
I. terapeutická skupina: Pacienti v 1. a 2. klinickom štádiu boli liečení v SR skupine a liečba pozostávala z prednizónovej predfázy, protokolu I (indukcia), protokolu M (konsolidácia) a udržiavacej liečby, pacienti v 3. a 4. klinickom štádiu boli liečení v MR skupine a mali pred udržiavacou liečbou podaný ešte protokol II (reindukcia). Celá liečba trvala 2 roky. V prípade, že pri hodnotení terapeutickej odpovede deň 33 po skončení 1. fázy protokolu I bol reziduálny tumor ≥ 30 % pôvodnej veľkosti, alebo bola prítomná ≥ 5 % infiltrácia kostnej drene alebo blasty v likvore, pacienti sa následne liečili v HR skupine (intenzívna konsolidácia pozostávajúca zo šiestich 6-dňových blokov chemoterapie, následne protokol II, ožiarenie neurokránia 12,0 Gy a udržiavacia liečba) (obr. 1).
Obr. 1. Protokol NHL BFM 95 – I. terapeutická skupina. <strong>Indukcia:</strong> prednizón, vinkristín, daunorubicin, l-asparagináza, cyklofosfamid, cytarabín, 6-merkaptopurín, metotrexát i.th. <strong>Protokol M:</strong> 6-merkaptopurín, metotrexát 5 g/m<sup>2</sup> v 24-hodinovej infúzii + leukovorín, metotrexát i. th. <strong>Protokol II:</strong> dexametazón, vinkristín, doxorubicín, l-asparagináza, cyklofosfamid, cytarabín, 6-tioguanín, metotrexát i. th. <strong>RT</strong> - rádioterapia 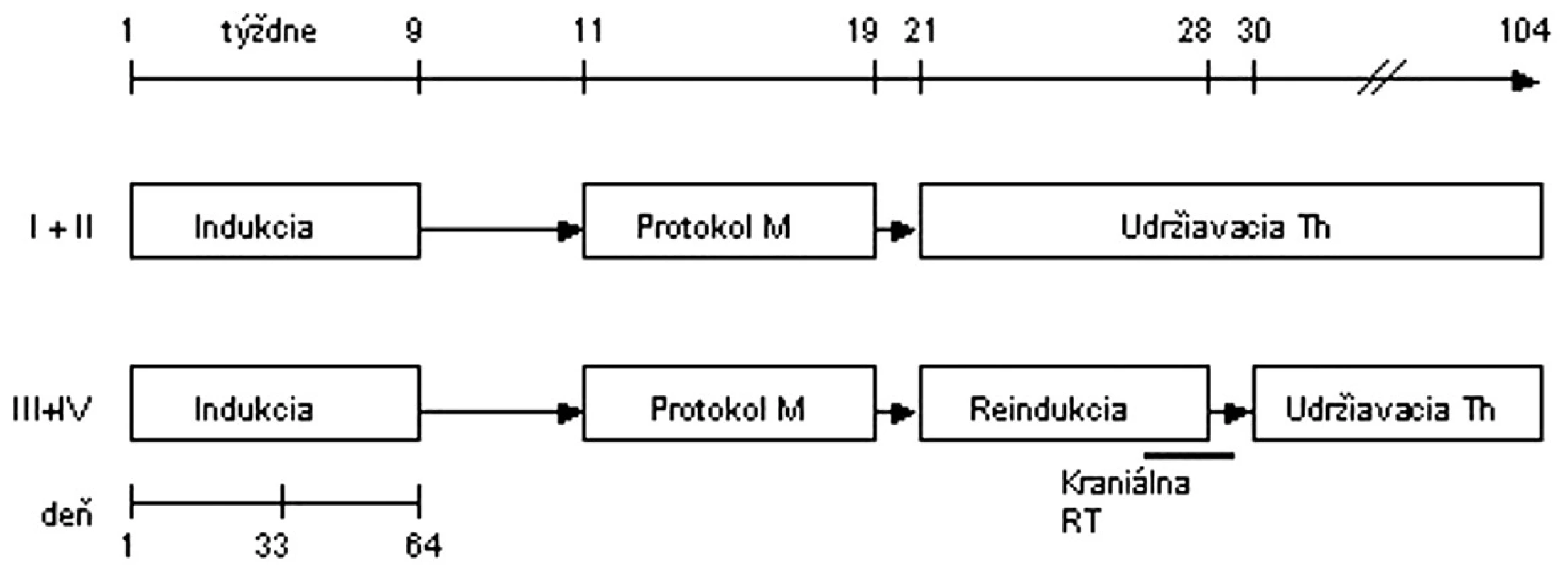
V nasledujúcom protokole EURO-LB 02 je stratégia liečby v nerandomizovanom ramene identická.
V II. terapeutickej skupine boli liečené deti so zrelými B-lymfómami (Burkittov lymfóm, difúzny veľkobunkový B-lymfóm a primárny mediastinálny B-lymfóm) v štyroch rizikových skupinách (R1 – R4). Kritériom pre zaradenie do rizikovej skupiny bolo klinické štádium, resekovateľnosť nádoru, veľkosť nádorovej masy vyjadrenej hodnotou hladiny laktát dehydrogenázy (LD) a postihnutie kostnej drene a CNS. V jednotlivých rizikových skupinách je rozdielny počet cyklov aj intenzita liečby, v úvode je cytoreduktívna predfáza. V protokole sa nepodávala žiadna rádioterapia (obr. 2).
Obr. 2. Protokol NHL BFM 95 – II. terapeutická skupina Upravená schéma protokolu. <strong>V</strong>: predfáza: dexametazón, cyklofosfamid, i. th: metotrexát, cytarabín, prednizolón <strong>A<sup>24</sup>:</strong> dexametazón, vincristín, metotrexát 1 g/m<sup>2</sup> v 24-hod. inf. + leukovorín, ifosfamid, cytarabín, etopozid, i. th metotrexát, cytarabín, prednizolón <strong>AA<sup>24</sup>:</strong> dexametazón, vincristín, metotrexát 5 g/m<sup>2</sup> v 24-hod. + leukovorín, ifosfamid, cytarabín, etopozid, i. th metotrexát, cytarabín, prednizolón <strong>B<sup>24</sup>:</strong> dexametazón, vincristín, metotrexát 1 g/m<sup>2</sup> v 24-hod. inf. + leukovorín, cyklofosfamid, doxorubicín, i. th metotrexát, cytarabín, prednizolón <strong>BB<sup>24</sup>:</strong> dexametazón, vincristín, metotrexát 5 g/m<sup>2</sup> v 24-hod. + leukovorín, cyklofosfamid, doxorubicín, i. th metotrexát, cytarabín, prednizolón <strong>CC:</strong> dexametazón, vindezín, cytarabín, etopozid, i. th metotrexát, cytarabín, prednizolón 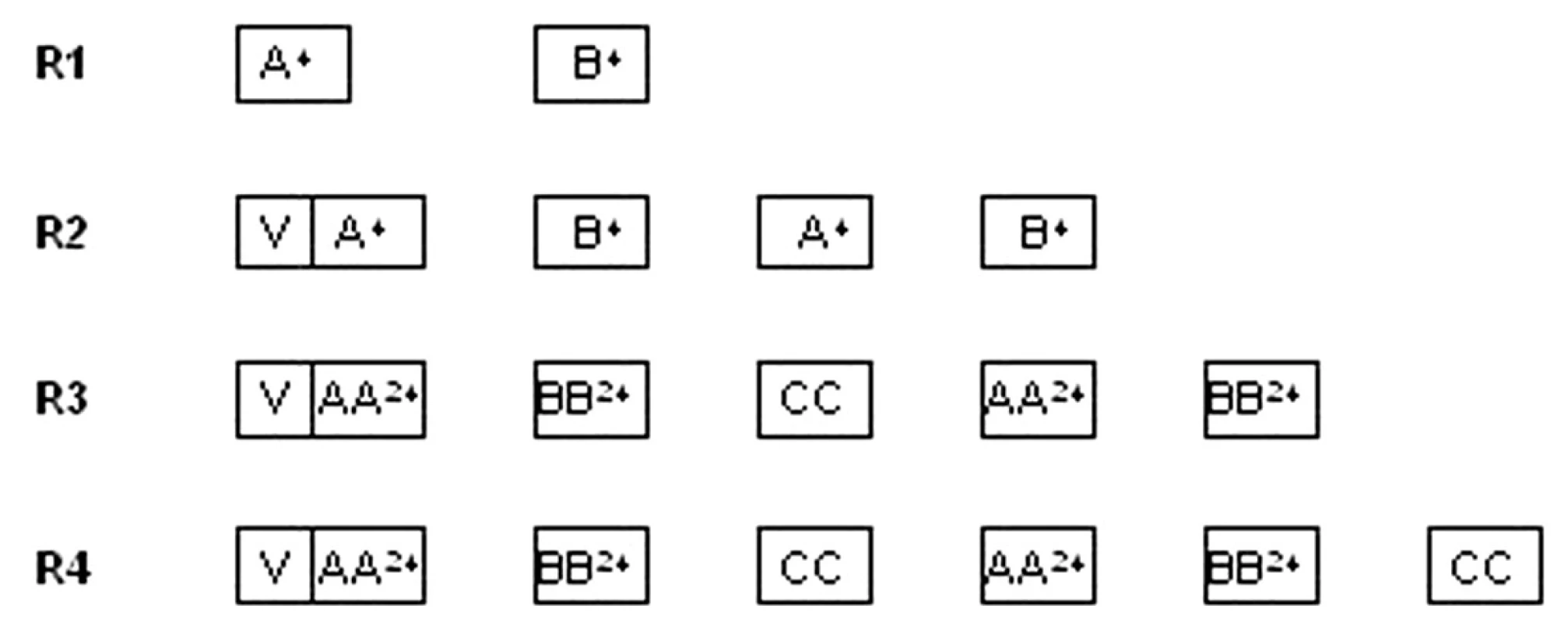
V protokole B-NHL BFM 2004 bola liečba identická.
V III. terapeutickej skupine sa deti liečili v troch rizikových skupinách (K1-K3). Pri zaradení do rizikovej skupiny a zohľadnilo klinické štádium ochorenia, resekovateľnosť nádoru a prítomnosť rizikových faktorov. V K1 a K2 boli liečení pacienti bez prítomnosti rizikového faktora, v K3 pacienti v IV. klinickom štádiu a aj všetci s nižším štádiom, ale s prítomnosťou rizikových faktorov: multilokulárne postihnutie kostí, sekundárny ALCL, postihnutie kože, pľúc a podtyp lymfohistiocytárny lymfóm. V každej rizikovej skupine bola podávaná predfáza. Pacienti nedostávali žiadnu rádioterapiu (obr. 3).
Obr. 3. Protokol NHL BFM 95 – III. terapeutická skupina. K1, K2, K3 – rizikové skupiny, V – predfáza, a, b, AA, BB, CC – jednotlivé cykly chemoterapie V: predfáza: dexametazón, cyklofosfamid, i. th: metotrexát, cytarabín, prednizolón a: dexametazón, metotrexát 500 mg/m<sup>2</sup> v 24-hod. + leukovorín, ifosfamid, cytarabín, etopozid, i. th metotrexát, cytarabín, prednizolón AA: dexametazón, vincristín, metotrexát 5g/m<sup>2</sup> v 24-hod. inf. + leukovorín, ifosfamid, cytarabín, etopozid, i. th metotrexát, cytarabín, prednizolón b: dexametazón, metotrexát 500 mg/m<sup>2</sup> v 24-hod. inf. + leukovorín, cyklofosfamid, doxorubicín, i. th metotrexát, cytarabín, prednizolón BB: dexametazón, vincristín, metotrexát 5g/m<sup>2</sup> v 24-hod. inf. + leukovorín, cyklofosfamid, doxorubicín, i. th metotrexát, cytarabín, prednizolón CC: dexametazón, vindezín, cytarabín, etopozid, i. th metotrexát, cytarabín, prednizolón 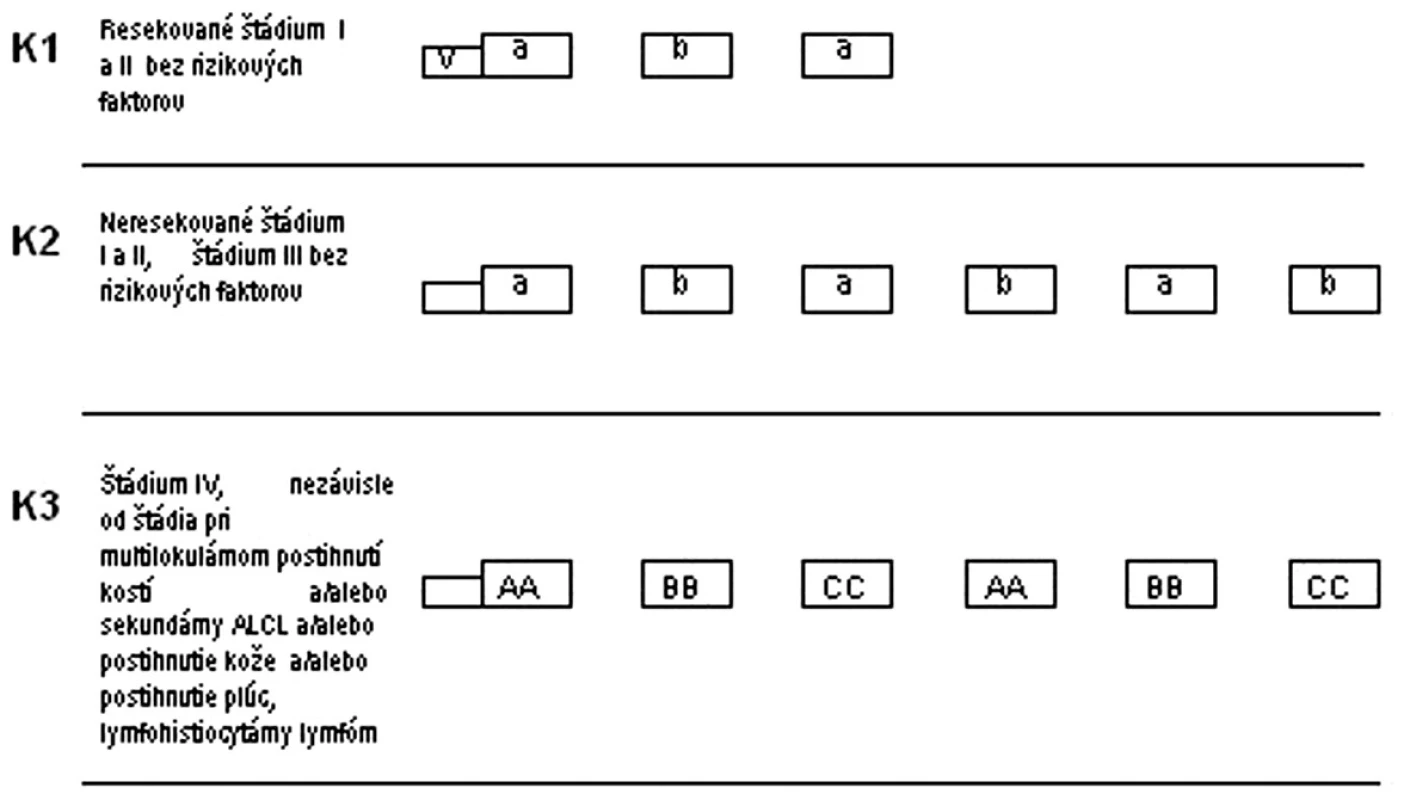
Pacienti, ktorí boli liečení podľa protokolu ALCL 99 v skupine Low risk (LR) mali podanú predfázu a 3 bloky A-B-A, v skupine štandardného aj vysokého rizika (SR, HR), pretože neboli randomizovaní, mali podanú predfázu a 6 cyklov CHT: A-B-A-B-A-B. Kritériá pre LR - štádium 1. kompletne resekované, SR : > l. štádium kompletne resekované, bez postihnutia kože, mediastína, pečene, sleziny alebo pľúc, HR – postihnutie kože (nie však izolované) alebo mediastína, pečene, sleziny, pľúc. Predfáza je identická s predfázou v protokole NHL BFM 95, v blokoch A a B sa podával metotrexát v dávke 1 g/m2 v 24-hodinovej infúzii a leukovorín, ďalšie cytostatiká sa podávali v rovnakej dávke a čase ako v cykloch AA, resp. BB podľa protokolu NHL BFM 95 v II. terapeutickej skupine.
Definície a štatistika
- Kompletná remisia (KR) – úplné vymiznutie všetkých prejavov ochorenia
- Parciálna remisia (PR) – nekompletný ústup prejavov ochorenia v časovom bode hodnotenia, bez objavenia sa novej manifestácie ochorenia
- Non responder (NR) – pretrvávanie, resp. progresia ochorenia počas podávanej terapie
- Relaps – objavenie nových prejavov ochorenia po predchádzajúcom dosiahnutí kompletnej remisie
- Event free survival (EFS) – prežitie od diagnózy do 1. udalosti (udalosť: smrť v indukcii, non responder, smrť v kompletnej remisii, relaps, sekundárna malignita)
- Overall survival – celkové prežitie (OS) – prežitie od diagnózy po úmrtie, resp. k stanovenému dňu hodnotenia – v danom súbore ku dňu 31. 12. 2008.
- Pravdepodobnosť prežívania bola spracovaná podľa Kaplana a Meiera.
Výsledky
Zo 106 detí uvedených v tabuĺke 1 za sledované obdobie od začiatku používania protokolu NHL BFM 95 je pre analýzu výskytu ochorenia v SR hodnotených 102 detí. 4 deti uvedené v zátvorkách v stĺpci „Košice“ už v analýze výsledkov liečby nehodnotíme. Rodičia buď liečbu po čase odmietli, alebo deti boli stratené zo sledovania. Rovnako do analýzy výsledkov liečby nie sú zaradené ďalšie 3 deti s podtypmi NHL, ktoré sú v detskom veku zriedkavé. Výsledky liečby hodnotíme u 99 pacientov.
Tab. 1. Počet nových diagnóz NHL v centrách od začiatku liečby podľa protokolu NHL BFM 95. 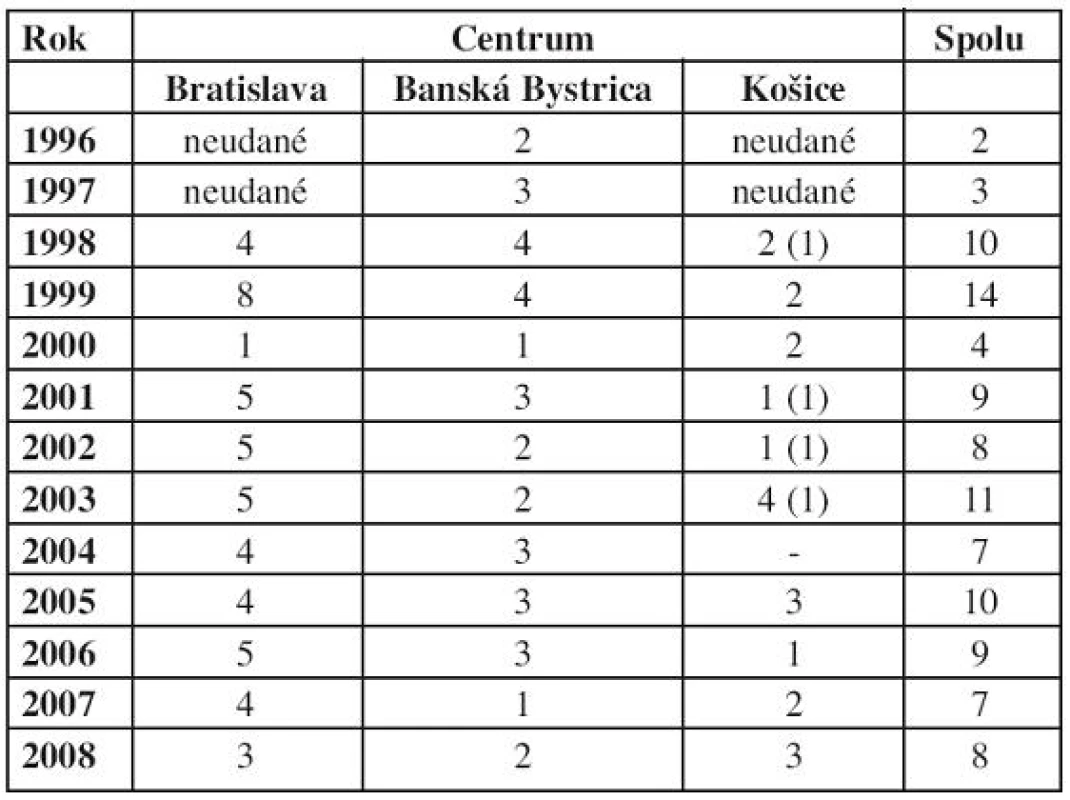
Výskyt NHL
Skupina 102 hodnotených pacientov je rozdelená do základných podtypov NHL, ktoré sú pre detský a adolescentný vek charakteristické: lymfoblastický lymfóm (LL) T alebo pre-B pôvodu – 26 detí (25,5 %), zrelé B-bunkové lymfómy (B-NHL) – Burkittov lymfóm, difúzny veľkobunkový B-lymfóm (DLBCL) a primárny mediastinálny B-bunkový lymfóm (PMLCL) – 55 detí (53,9 %), anaplastický veľkobunkový lymfóm (ALCL) T alebo null pôvodu – 18 detí (17,7 %) a iné typy v detskom veku vzácne – 3 deti (2,9 %) folikulový lymfóm (FL) 1 dieťa, periférny T-bunkový lymfóm (PTCL) 1 dieťa a lymfóm zo skupiny MALT l dieťa (obr. 4).
Obr. 4. Zastúpenie jednotlivých podtypov lymfómov. 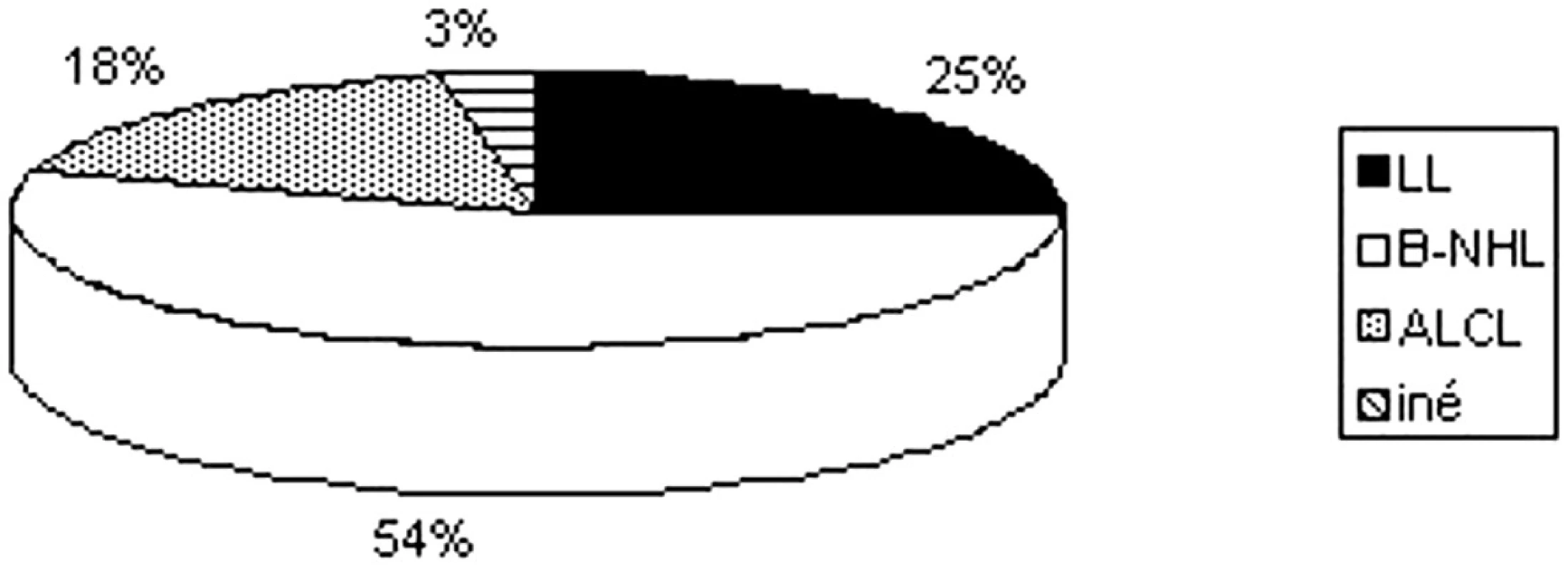
Výskyt lymfómov podľa podtypov bol v jednotlivých centrách rôzny. Kým v Bratislave sa liečilo najvyššie percento detí s lymfoblastickým lymfómom – 35,4 %, v Banskej Bystrici sa liečilo najvyššie percento detí so zrelým B-NHL – 66,7 % (obr. 5).
Obr. 5. Percentuálny výskyt jednotlivých typov NHL v centrách. 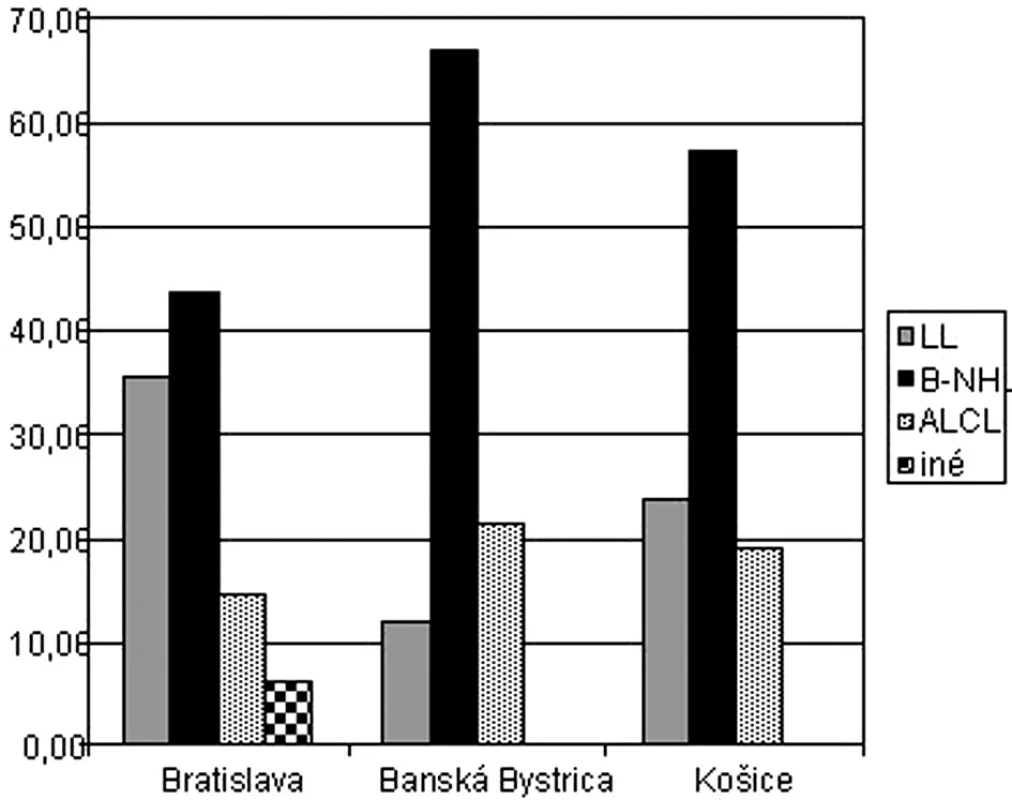
Grafické znázornenie výskytu NHL podľa veku je na obrázku 6. Kým v prvých troch rokoch života je výskyt NHL nízky, prvý vzostup sa pozoruje vo veku 8 rokov a druhý v období adolescencie. Pri analýze veku detí v čase diagnózy bol pozorovaný rozdiel v jednotlivých podtypoch NHL – medián veku v čase diagnózy pri lymfoblastickom lymfóme bol 9,4 roka, B-NHL 11 rokov a najvyšší vek bol u detí v podskupine s ALCL – 13,2 roka (tab. 2). NHL postihujú častejšie chlapcov a v hodnotenej skupine pacientov je pozorovaný aj rozdiel pri jednotlivých typoch lymfómov. Najväčšia prevaha chlapcov bola pri Burkittovom lymfóme (tab. 3).
Obr. 6. Výskyt NHL podľa veku. 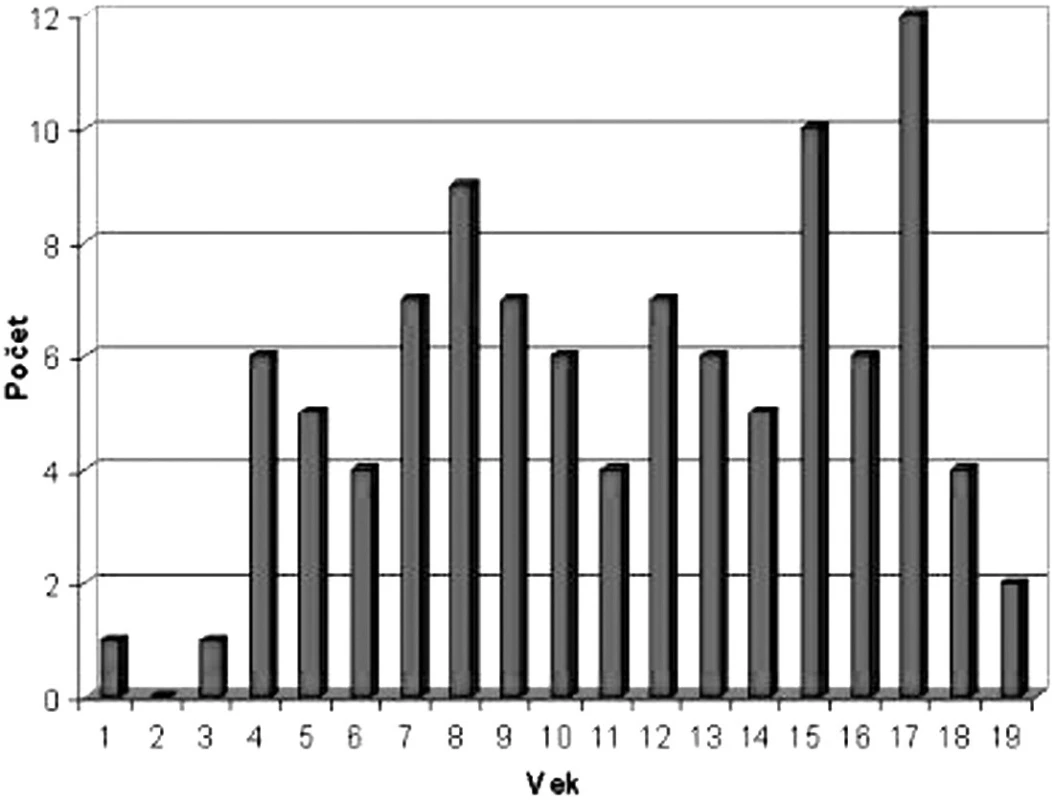
Tab. 2. Vek v čase diagnózy pri jednotlivých typoch NHL. 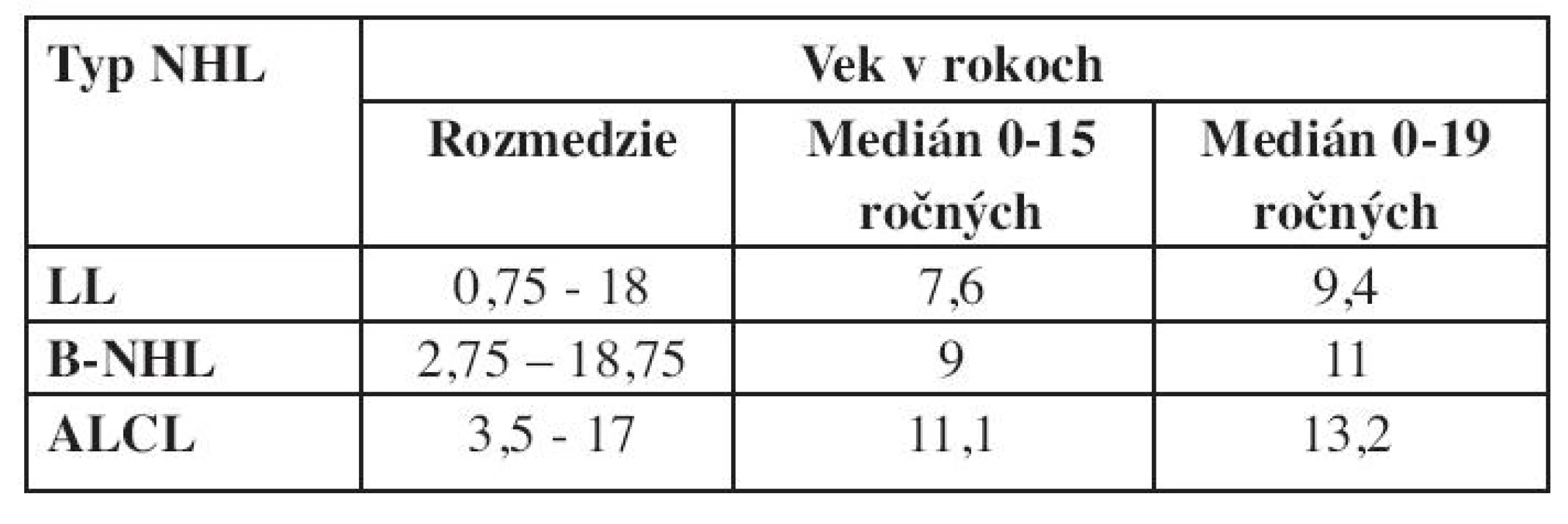
Tab. 3. Výskyt jednotlivých typov lymfómov podľa pohlavia. 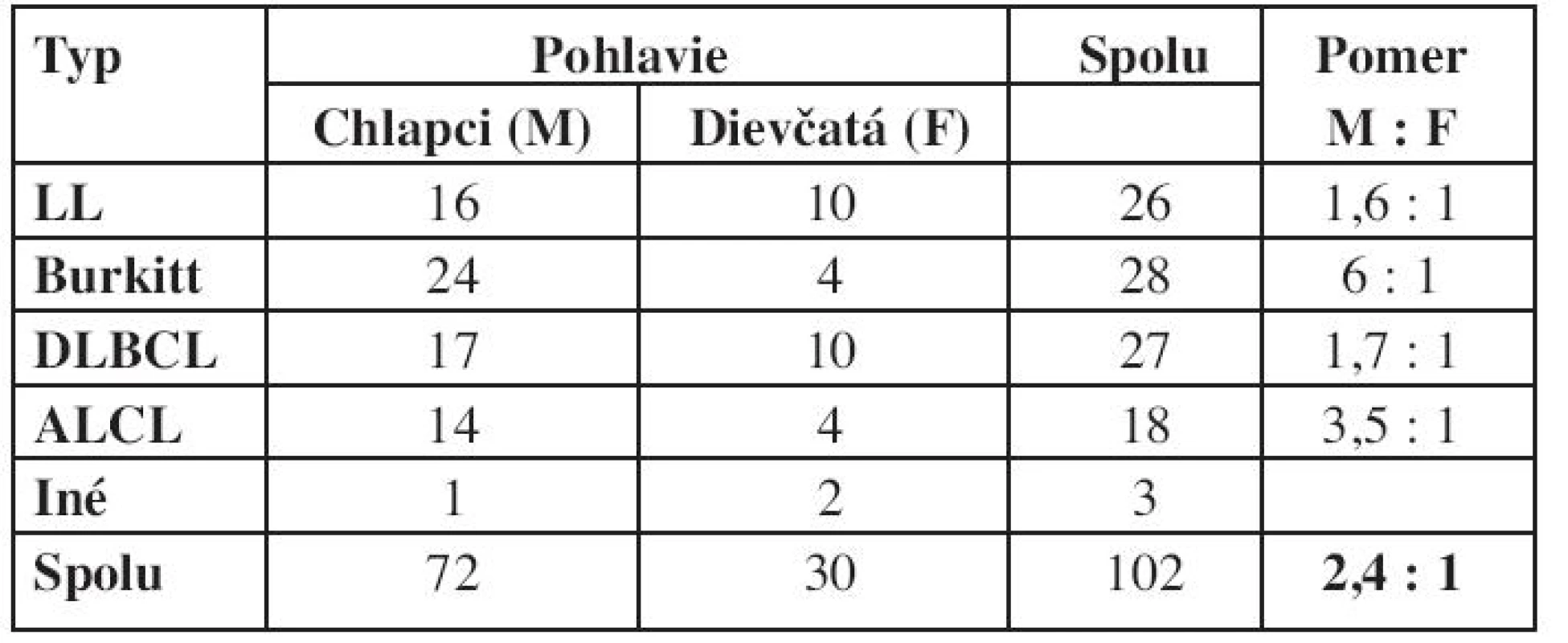
NHL je ochorenie s vysokou proliferačnou aktivitou a včasným šírením do celého organizmu. Väčšina prípadov sa diagnostikuje už v pokročilom štádiu ochorenia a výnimku netvoria ani deti v hodnotenom súbore (tab. 4). Pri všetkých podtypoch bolo ochorenia najčastejšie diagnostikované v 3. klinickom štádiu (59,6 % detí), a v pokročilom 3. a 4. štádiu malo diagnózu stanovenú až 76,8 % detí, teda viac ako 3/4.
Tab. 4. Štádium ochorenia pri diagnóze podľa Murphyovej (n = 99. 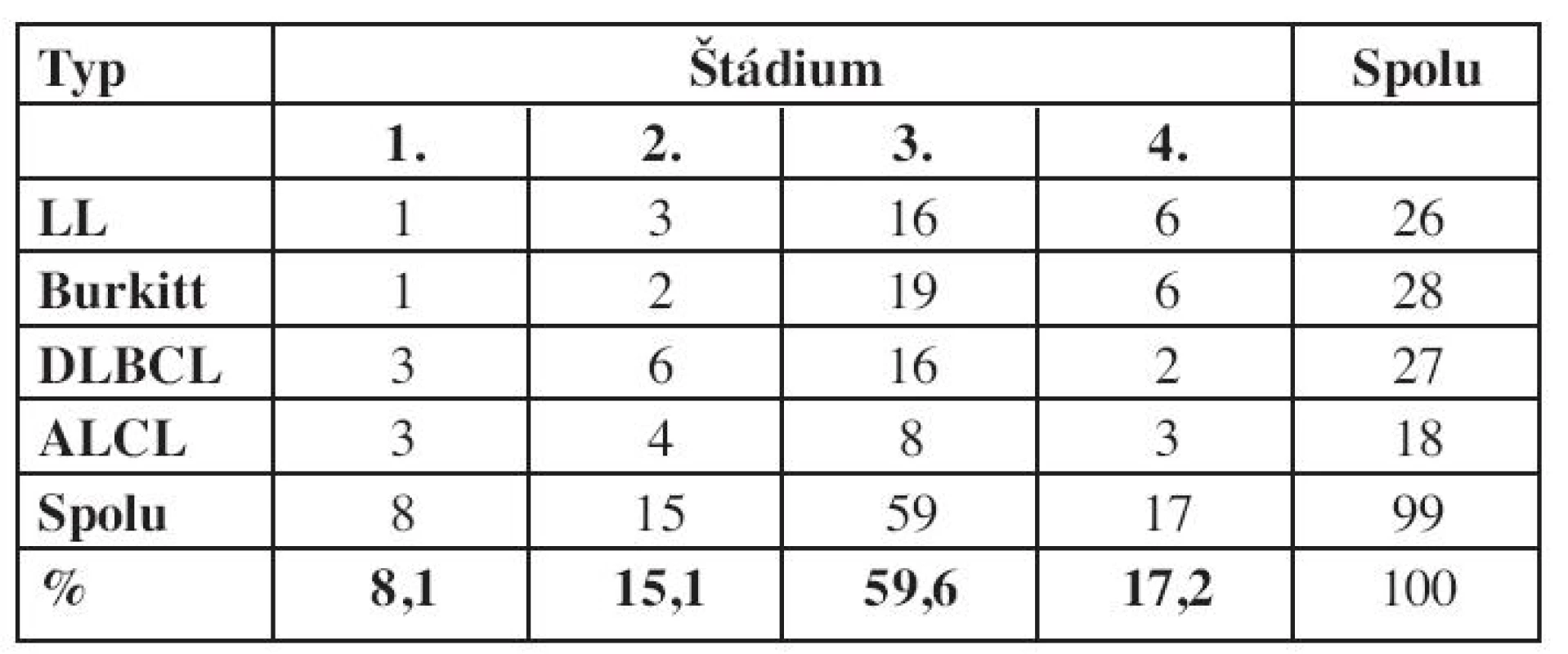
Klinická manifestácia ochorenia v čase diagnózy
Jednotlivé histologické typy lymfómov majú určité charakteristické klinické správanie a lokalizáciu, aj keď to neplatí úplne jednoznačne. Kým lymfoblastický lymfóm T sa prezentuje najčastejšie ako nádorová masa v mediastíne, zrelé B-NHL majú svoju najčastejšiu prezentáciu v oblasti brucha. Vzhľadom na rýchlu generalizáciu ochorenia je potom často problematické určiť miesto primárneho postihnutia a ochorenie sa už v štádiu diagnózy považuje za diseminované. V hodnotenom súbore pacientov sa prejavilo ochorenie v nasledujúcich lokalizáciách:
Lymfoblastický lymfóm T: postihnutie mediastína sa vyskytlo u 18 z 22 detí (81,8 %), často v sprievode s fluidotoraxom, prípadne aj s výpotkom v perikarde. Pri veľkých tumoroch bol prítomný syndróm hornej dutej žily, veľké fluidotoraxy bolo nutné evakuovať a bunky z punktátu slúžili ako diagnostický materiál. Pri hodnotení ďalších lokalít súčasne s mediastínom bolo najčastejšie prítomné postihnutie lymfatických uzlín na krku. U ďalších detí sa ochorenie manifestovalo ako generalizovaná lymfadenopatia, postihnutie orbity, oblasti pyramídy s intra-aj extrakraniálnym šírením.
Lymfoblastický lymfóm z prekurzorových B-buniek sa prejavil ako generalizovaná lymfadenopatia aj s postihnutím parenchymatóznych orgánov, kože a kostí. Infiltráciu kostnej drene mali v čase diagnózy 4 deti s T-LL a 2 deti s pre-B-LL, žiadne dieťa nemalo prítomnú infiltráciu CNS.
Difúzny veľkobunkový B lymfóm (DLBCL) sa manifestoval najčastejšie ako nádor v bruchu (resekovateľný alebo neresekovateľný) – u 10 z 27 detí (37 %), 4 deti mali primárne postihnutie krčných lymfatických uzlín a 3 deti oblasť tonzíl, nazo - a orofaryngu. 1 x bolo ochorenie diagnostikované z tumoru príušnej žľazy alebo štítnej žľazy, 2 deti mali generalizované ochorenie. 4. klinické štádium mali v tejto skupine prítomné 2 deti – 1 x postihnutie kostnej drene a 1 x CNS (pacient s generalizovaným ochorením, ktoré bolo ako sekundárna malignita po liečbe Hodgkinovho lymfómu). Vzácne sa nádory B-pôvodu môžu vyskytnúť aj v oblasti mediastína. Vyskytli sa u 6 z 27 detí s DLBCL, pričom klinické a histologické charakteristiky primárneho mediastinálneho B lymfómu mali 4 deti.
Burkittov lymfóm sa prejavil ako abdominálna masa u 20 z 28 detí (71,4 %), u väčšej časti z nich ako inoperabilný nádor s veľmi rýchlym rastom, často v sprievode s ascitom. Postihnutie lymfatických uzlín na krku bolo u 4 detí, ďalšie miesta boli orbita, paranazálne dutiny, generalizované postihnutie kostí, resp. generalizované ochorenie na mnohých miestach, včítane paravertebrálnej lokality a postihnutia CNS – blasty v likvore. Ďalších 5 detí malo 4. klinické štádium s postihnutím kostnej drene, 4 z nich až pod obrazom ALL-L3 FAB. Veľká a rýchlo proliferujúca nádorová masa bola často v sprievode s metabolickými komplikáciami pred liečbou a po jej začatí – syndróm nádorovej lýzy, často s renálnym zlyhaním, u časti detí aj s nutnosťou hemodialýzy.
Veľkobunkový anaplastický lymfóm sa najčastejšie prejavil ako postihnutie na viacerých miestach – mediastínum, lymfatické uzliny, s častým extralymfatickým postihnutím: pľúca – 2 deti, koža – 5 detí, kosti – 2 deti, mäkké tkanivá – 2 deti, tonzily 1 dieťa. Deti s ALCL mali často prítomnú B-symptomatológiu, hlavne teploty a potenie.
Protokoly pri liečbe NHL
V tabulke 5 je uvedený počet detí podľa podtypov NHL a použitých liečebných protokolov. Väčšina detí bola liečená podľa protokolu NHL BFM 95.
Tab. 5. Použité protokoly v súbore hodnotených pacientov 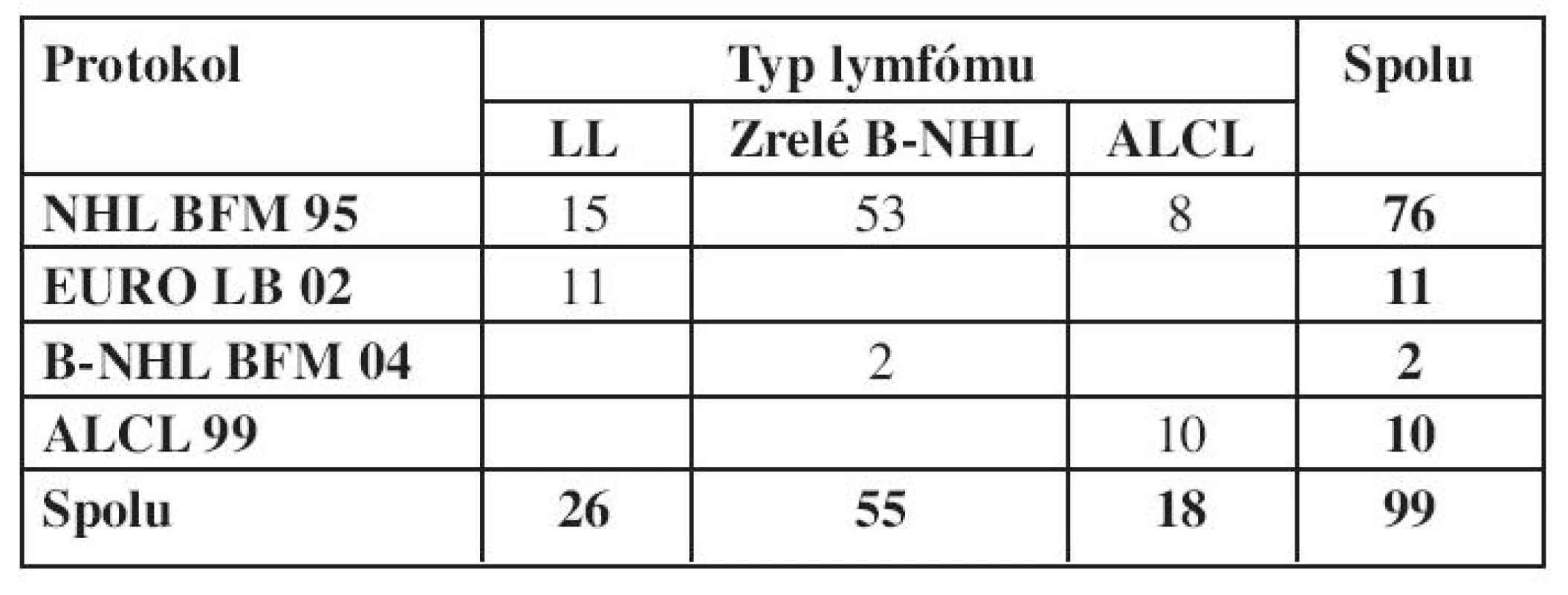
Výsledky liečby
Základným predpokladom priaznivého priebehu ochorenia je dosiahnutie kompletnej remisie. Dosiahnutie remisie sa pri ALL hodnotí v konkrétnom časovom bode – pri liečbe podľa protokolov BFM skupiny deň 33 indukčnej liečby. Pri lymfoblastických lymfómoch, ktoré sa liečia podľa protokolov prakticky identických s liečbou ALL, sa dosiahnutie kompletnej remisie (KR) hodnotí tiež deň 33, avšak pri nekompletnej remisii 33. deň liečby (parciálna remisia – PR) je po absolvovaní 2. fázy indukčnej liečby v prevažnej väčšine prípadov následne dosiahnutá kompletná remisia.
V prípade zrelých B-NHL a ALCL, kde sa liečba podáva vo forme vysokodávkovanej blokovej liečby, sa odpoveď na liečbu posudzuje pred každým novým blokom. Vzhľadom na často prítomné rozsiahle ochorenie s množstvom postihnutých miest je mnohokrát problematické hodnotiť skutočnú kompletnú remisiu a skôr sa hodnotí rýchlosť odpovede na liečbu. Pre hodnotenie úspešnosti liečby je však nevyhnutná prítomnosť kompletnej remisie po skončení liečby, ktorá prináležala pacientovi podľa rozsahu ochorenia pri diagnóze (štádium a riziková skupina) (tab. 6).
Tab. 6. Výsledky liečby - dosiahnutie kompletnej remisie 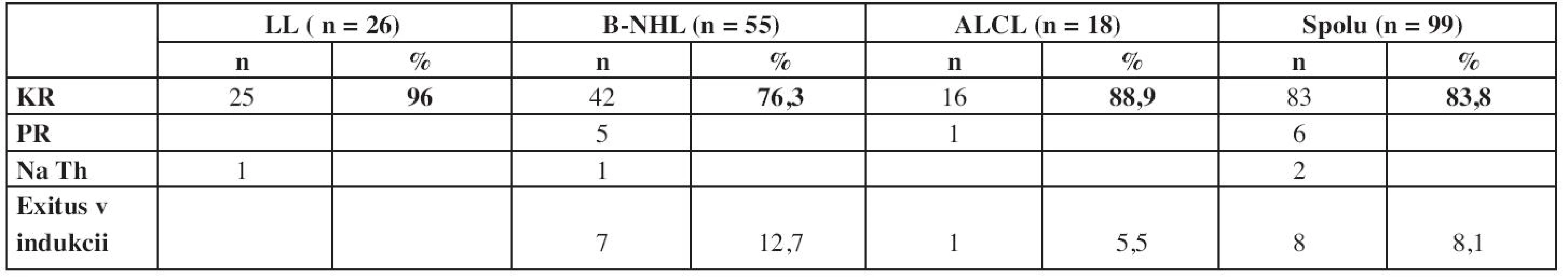
Najvyšší počet dosiahnutých kompletných remisií je v skupina lymfoblastických lymfómov, kde kompletnú remisiu dosiahlo až 96 % detí. V tejto skupine však kompletnú remisiu 33. deň liečby dosiahlo len 16 detí, t.j. 61,5 %, ďalších 9 pacientov ju následne dosiahlo po skončení 2. fázy indukcie. Najčastejšie išlo o pretrvávanie rezidua v oblasti mediastína. Najnižší počet dosiahnutých KR je v skupine zrelých B-NHL – 76,3 %, a to na vrub úmrtia pacientov v indukcii na metabolické komplikácie a toxicitu liečby.
V ďalšom priebehu sa hodnotí pretrvávanie kompletnej remisie, relapsy, sekundárne malignity (SM) a úmrtia (tab. 7).Najviac relapsov bolo v skupine ALCL – 11,1 %, najviac exitov v skupine B-NHL – 23,6 %.
Tab. 7. Výsledky liečby – ďalší priebeh 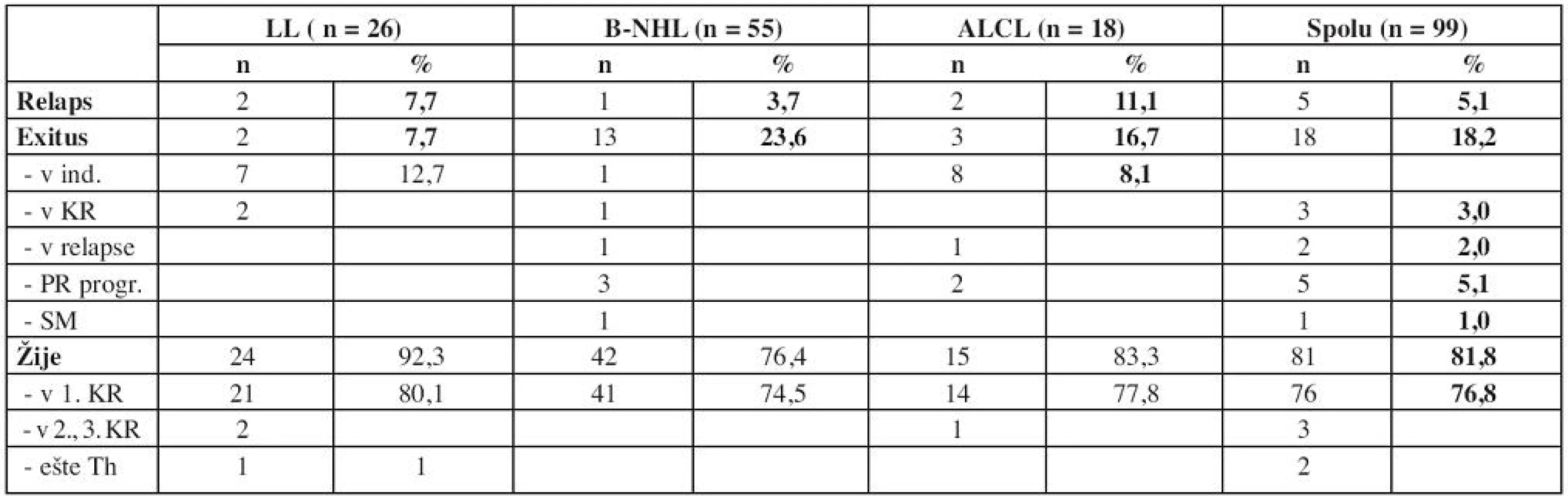
Pacienti so zrelými B-NHL – DLBCL a Burkittov lymfóm – sa napriek odlišnej biológii nádorov liečia rovnakou liečbou. Pri hodnotení výsledkov liečby v týchto dvoch podtypoch sa však nájdu rozdiely. Viac exitov bolo u pacientov s Burkittovým lymfómom (8 detí, t.j. 28,6 %), oproti skupine s DLBCL (5 detí, t.j. 17,8 %).
Pri spracovaní doby prežívania podľa Kaplana a Meiera je v celom súbore zrelých B-NHL 5-ročný event free survival (EFS) 75 % celkové prežitie (OS) 81 % s mediánom doby sledovania 50 mesiacov (graf 1, 2, 3).Vzhľadom na nízke počty pacientov v 1. a 2. klinickom štádiu neboli tieto analyzované samostatne, u týchto detí ani nevznikla žiadna udalosť a EFS aj OS sú 100 %.
Graf 1. Pravdepodobnosť prežívania v celom súbore 99 detí s NHL v SR (nov. 1996-dec. 2008). 5-ročný EFS - 0,75 5-ročný OS - 0,81 
Graf 2. EFS podľa jednotlivých podtypov NHL súbore 99 detí s NHL v SR (nov. 1996-dec. 2008). 5-ročný EFS - lymfoblastický lymfóm 0,78 (n = 26) - zrelé B-NHL 0,72 (n = 55) - ALCL 0,77 (n = 18) 
Graf 3. OS podľa jednotlivých typov NHL súbore 99 detí s NHL v SR (nov. 1996-dec. 2008). 5-ročný OS - lymfoblastický lymfóm 0,92 (n = 26) - zrelé B-NHL 0,75 (n = 55) - ALCL 0,81 (n = 18) 
Analýza relapsov
Relaps v priebehu liečby aj po skončení liečby NHL predstavuje veľmi nepriaznivú známku a bez úspešnej transplantácie kmeňových buniek je pri LL a B-NHL prakticky neliečiteľný. V skupine 99 hodnotených pacientov sa vyskytol u 5 detí, t.j. 5,1 %.
Relaps prekonali 2 deti s T-lymfoblastickým lymfómom. 1 dieťa malo v čase diagnózy 9 mesiacov a 4. klinické štádium ochorenia (generalizované ochorenie aj s postihnutím kostnej drene), 2. pacientka mala v čase diagnózy 15,1 roka a 3. KŠ. Relapsy vznikli 22, resp. 27 mesiacov od stanovenia diagnózy, teda u 2. pacientky až 3 mesiace po skončení liečby. Obe deti boli v relapse liečené podľa protokolu REZ ALL BFM 2002 v S 3/4 skupine a dosiahli 2. kompletnú remisiu. 1. pacient prekonal 2. relaps a následne bola uskutočnená súrodenecká alogénna transplantácia periférnych kmeňových buniek. Dieťa prežíva po transplantácii v 3. KR 119 mesiacov (9,9 roka). 2. pacientka podstúpila alogénnu nepríbuzenskú transplantáciu a prežíva po nej v 2. KR 7 mesiacov.
V skupine B-NHL sa relaps vyskytol u 1 dieťaťa s DLBCL, vek v čase diagnózy 6,3 roka, 3. KŠ ochorenia s postihnutím brucha. Relaps vznikol 2 mesiace po skončení liečby a bol na ďalšiu liečbu rezistentný, dieťa zomrelo 2 mesiace po diagnóze relapsu.
Relapsy v skupine ALCL vznikli u 2 detí, ktoré mali v štádiu diagnózy 6,25 a 13,8 roka, 3. klinické štádium ochorenia s postihnutím viacerých miest v čase diagnózy, u oboch až po skončení liečby – 7 mesiacov od diagnózy. Iniciálna liečba v relapse bola u oboch pacientov podľa protokolu ALCL relapse, obaja mali realizovaná autológnu transplantáciu PKB, následne prekonali ďalšie 2 relapsy. 1. pacient žije v 3. relapse na paliatívnej terapii vinblastínom 43 mesiacov od diagnózy prvého relapsu. 2. pacient bol v 2. relapse pripravovaný na nepríbuzenskú transplantáciu. Liečba v relapse musela byť pre komplikáciu – rozpadnutú ranu v inguine – prerušená, vznikol 3. relaps. Pacient zomrel na pseudomonádovú sepsu po skončení kondicioningu pred plánovanou haploidentickou transplantáciou od matky (nepríbuzenský darca v konečnom štádiu darcovstvo odmietol). Od prvého relapsu prežil 16 mesiacov.
Analýza exitov
Zomrelo 18 detí, t.j. 18,2 %; 8 detí v indukcii, 3 v kompletnej remisii, 2 v relapse, 5 detí v skupine s dosiahnutím len PR a 1 dieťa na sekundárnu malignitu.
Úmrtia v indukcii sú najčastejším problémom pri liečbe pokročilého ochorenia v skupine B-NHL, v hodnotenom súbore 7 detí, najčastejšie u detí s Burkittovým lymfómom v 3. a 4. klinickom štádiu, ktoré boli liečené v R-3 a R-4 rizikovej skupine. Všetky deti zomreli po 1. AA bloku vysokodávkovanej chemoterapie v čase poliekovej pancytopénie a generalizovanej mukozitídy. Príčina úmrtia bola u 6 detí sepsa s jej následkami – septický šok, ARDS, akútna renálna insuficiencia a multiorgánové zlyhanie. Niekoľko detí malo v čase exitu uvádzané metabolické komplikácie a krvácanie, 1 dieťa akútnu renálnu insuficienciu.
V skupine ALCL zomrel 1 pacient už po predfáze. Pacient bol do centra odoslaný neskoro, s generalizovaním postihnutím, ložisko v kalve sa do stanovenia histologickej diagnózy rýchlo šírilo intrakraniálne a pacient zomrel na progresiu ochorenia so známkami ICH.
Exity v kompletnej remisii sa vyskytli u 2 detí s lymfoblastickým lymfómom. 1 pacient zomrel na pľúcnu aspergilózu 8 mesiacov od diagnózy a druhý pacient pri sepse v protokole II na krvácanie do pľúc, 7 mesiacov od diagnózy. Neskorý exitus v KR sa vyskytol u pacienta s Burkittovým lymfómom 41 mesiacov od diagnózy. Dieťa zomrelo po operácii náhlej brušne príhody v spádovej oblasti, nie je známa súvislosť zo základným ochorením.
Exity v relapse: 1 dieťa s DLBCL na rezistentný relaps a l dieťa s ALCL na pseudomonádovú sepsu pred transplantáciou po absolvovaní kondicioningu.
Exity v parciálnej remisii – 5 detí. 1 dieťa na aspergilovú infekciu (pľúca, mozog, oko) a 4 deti na progresiu základného ochorenia.
Exitus na sekundárnu malignitu – pri pretrvávaní kompletnej remisie NHL - pacient vyvinul SM – alveolárny rabdomyosarkóm panvového dna – 16 mesiacov od diagnózy Burkittovho lymfómu. SM sa nepodarilo liečebne ovplyvniť a pacient zomrel 4 mesiace od jeho diagnózy, 20 mesiacov od diagnózy NHL.
Transplantácia ako súčasť liečby rezistentného, resp. relapsového ochorenia
V súbore 99 pacientov s NHL bola transplantácia uskutočnená pri liečbe primárne rezistentného ochorenia 1 x a pri liečbe relapsu 4 x. Všetky transplantácie sa vykonali na Transplantačnej jednotke II. detskej kliniky LF UK a DFNsP v Bratislave. Išlo o nasledovné výkony: 1. T-lymfoblastický lymfóm v 3. kompletnej remisii – alogénna súrodenecká – žije, 2. T-lymfoblastický lymfóm v 2. kompletnej remisii – alogénna nepríbuzenská – žije, 3. primárny mediastinálny B-lymfóm – po absolvovaní liečby – parciálna remisia s viabilným reziduom po skončení liečby (+ PET, + biopsia). Plánovaná autológna transplantácia, po AA bloku odber periférnych kmeňových buniek... následne BB, CC blok... po ňom progresia... liečba RICE.... progresia. Z toho dôvodu bola navrhnutá alogénna súrodenecká transplantácia aspoň v PR. V liečbe boli podané znova bloky AA-BB-AA a následne realizovaná transplantácia, po nej ešte RT na mediastínum. Pacientka žije v KR 55 mesiacov od transplantácie, 4. ALCL v 1. relapse, autológna transplantácia PKB, po nej relaps. Žije po 3. relapse na liečbe, 5. ALCL v 1. relapse, autológna transplantácia PKB, po nej relaps. Zomrel po 3. relapse, pred plánovanou alogénnou haploidentickou transplantáciou v sepse po kondicioningu.
Diskusia
V práci je analyzovaný doteraz najväčší súbor detských pacientov s NHL v Slovenskej republike, ktorí boli liečení jednotnou terapiou. Ak vychádzame z počtu nových diagnóz tohto ochorenia za rok (priemerne 9 detí ročne za posledných 11 rokov, incidencia 7 detí na 100 000 za rok), je zrejmé, že tento počet pacientov môže vzniknúť až pri zjednotení liečby v troch existujúcich centrách detskej onkológie. Pri spracovaní údajov sú výsledky stále ovplyvnené nízkym počtom prípadov.
Prevažná časť detských NHL patrí do skupiny B-lymfómov, túto prevahu sme zaznamenali aj v našom súbore pacientov. Pozoruhodne vysoké je však zastúpenie podtypu DLBCL, ktorý tvorí až polovicu B-NHL v našom súbore. Rovnako vyšší podiel prípadov bol v skupine ALCL. Zo súboru 2 084 pacientov liečených podľa protokolov NHL BFM 86, 90 a 95 bolo 432 (20,7 %) s lymfoblastickým lymfómom, 1217 (58,4 %) s B-NHL a 215 (10,3 %) s ALCL. V skupine B-NHL však bola zreteľná prevaha nádorov typu BL/ALL-L3 FAB - až 82,5 % (6).
Až do 2. polovice 90-tych rokov minulého storočia bola liečba detí s NHL v SR značne nejednotná. Podľa publikovaných údajov jedného onkocentra (19) sa od roku 1980 deti liečili podľa niekoľkých protokolov uvedených v časovom slede: NHL 6380, NHL 6481, protokol podľa talianskej skupiny podľa Gaspariniho a spol., Total Therapy B (Murphy-Bowman), RT 0486, MACOP-B-IA VP-16, od roku 1994 NHL BFM 90 a 95. Výsledky liečby neboli uspokojivé hlavne v skupine zrelých B-lymfómov, čo bol dôvod pre rozhodnutie liečiť tieto deti intenzívnejšou terapiu. Výsledky liečby sa postupne zlepšovali. Pri analýze za roky 1980–1996 bol 5-ročný EFS 0,62 a OS 0,63 (20), v roku 2006 pri analýze pacientov z 3 detských onkocentier liečených od roku 1998 podľa protokolu NHL BFM 95 bol 5-ročný EFS pre celú skupinu NHL 0,74 a OS 0,81, pri hodnotení podľa jednotlivých terapeutických skupín bol 5-ročný EFS v TG I – 0,79, TG II – 0,73, TG III – 0,70 a OS v TG I – 0,87, TG II – 0,78, TG III – 0,86 (21). Ďalšie publikované výsledky uvádzajú v skupine 37 detí liečených v rokoch 2000–2003 podľa protokolov NHL BFM 95 a ALCL 99 4-ročný EFS 0,74 a OS 0,78 (4).V terajšom celom súbore pacientov je 5-ročný EFS 0,75 a OS 0,81.
Výsledky v skupine detí s lymfoblastickým lymfómom uvádzané pri súčasnej analýze: 5-ročný EFS 0,78 a OS 0,92 sú stále ešte menej priaznivé, keď už výsledky štúdie NHL BFM 90 dosahovali 5-ročný EFS nad 90 % (8).
Výsledky liečby zrelých B-bunkových NHL sú v analyzovanom súbore doteraz neuspokojivé. 5-ročný EFS 0,72 a OS 0,75 sú hodnoty výrazne nižšie ako na pracoviskách, ktoré už intenzívne protokoly na báze BFM a SFOP používajú roky (10–14). V štúdii NHL BFM 90 dosiahli 6-ročný EFS 89 % pri BL a 95 % pri DLBCL (10).
Výsledky v podskupine ALCL: 5-ročný EFS 0,77 a OS 0,81 sú zrovnateľné s údajmi v literatúre. Doteraz je značná nejednotnosť v názoroch na optimálny typ liečby tohto ochorenia (15–18). BFM skupina počnúc protokolom NHL BFM 90 vytvorila pre pacientov s ALCL samostatnú terapeutickú skupinu (TG III) s intenzitou terapie na báze liečby B-NHL a dosiahla 5-ročný EFS 76 % (16), v CCG-5941 štúdii bola použitá agresívna kombinovaná liečba pre T-bunkové malignity a dosiahli 5-ročný EFS 68 % a OS 80 % (18). Vzhľadom na nízky výskyt tohto podtypu lymfómov a nejednotnosť v terapii budú potrebné ďalšie štúdie, súčasne prebieha štúdia ALCL 99. Zistilo sa, že pri rozdeľovaní detských pacientov s ALCL do rizikových skupín nie je tak podstatný faktor štádium ochorenia podľa St. Jude, ale prítomnosť rizikových faktorov, ako sú postihnutie kože, pľúc, pečene a sleziny, B-symptómy....atď. Jednotlivé skupiny však pri štatistickom hodnotení zistili rôznu mieru dôležitosti jednotlivých rizikových faktorov pre zlyhanie. Pri univariantnej analýze v štúdii NHL BFM 90 zistili vysoké riziko relapsu pri postihnutí pľúc, sleziny alebo B-symptómoch, naproti tomu v multivariantnej Cox regresnej analýze bolo zvýšené riziko zlyhania len pri prítomnosti B-symptómov (16). Iní autori uvádzajú ako vysoko rizikový faktor postihnutie kostnej drene a už detekcia minimálnej choroby pomocou RT-PCR pri diagnóze predstavuje 71 % riziko relapsu (22). „European Intergroup Study for ALCL“ zozbierala údaje od 235 pacientov z BFM, UKCCSG a SFOP štúdií. V multivariantnej analýze zistili, že postihnutie mediastína, orgánové postihnutie - pečeň, slezina a pľúca a postihnutie kože, sú všetky prognosticky závažné. Pacienti v HR skupine (postihnutie aspoň jednej z uvedených lokalít) majú 5-ročný EFS 61 % a pacienti v LR (žiadne z týchto miest postihnutia) až 89 % (23).
Najzávažnejším faktorom, ktorý zhoršuje výsledky liečby v hodnotenom súbore pacientov sú úmrtia v indukcii – 8 detí, t.j. 8,1 %, s najväčším podielom týchto úmrtí v skupine B-NHL – 7 detí, t.j. 12,7 %. Všetky úmrtia v skupine B-NHL boli u pacientov v 3. a 4. klinickom štádiu, ktorí boli liečení v R-3 a R-4 rizikovej skupine. Manažment týchto detí so závažnými metabolickými komplikáciami v súvislosti s veľkou nádorovou masou (u niektorých s potrebou hemodialýzy, u časti pacientov bola použitá rekombinantná urátoxidáza), síce tieto deti previedol cez úskalia syndrómu náhlej lýzy tumoru, deti následne zomreli na komplikácie toxicity liečby – všetky po 1. AA bloku chemoterapie. Najčastejšie išlo o generalizovanú mukozitídu v pancytopénii komplikovanú septickým stavom s ARDS, multiorgánovým zlyhaním, DIC a krvácaním, u časti detí aj s pretrvávajúcou poruchou vnútorného prostredia. Percento úmrtí na toxicitu je v štúdiách, ktoré majú značné skúsenosti s použitím liečby s vysokou intenzitou nízke: SFOP LMB89 – 1,2 % (11), BFM 90 –3,4 % (10), ale POG 8617 v začiatkoch používania intenzívnej liečby pre 4. št. a B-ALL až 11,3 % (24).
Druhou najčastejšou príčinou úmrtia v súbore bolo refraktérne ochorenie u pacientov v skupine zrelých B-NHL a ALCL - celkovo 5,1 %.
Relapsov bolo málo – celkovo 5 (5,1 %) a ako príčina úmrtia boli len v 2 %. Relapsy v skupine B-NHL a ALCL vznikli krátko po skončení liečby v 1. roku od diagnózy, v skupine LL koncom udržiavacej liečby a 3 mesiace po jej skončení v 22. a 27. mesiaci od diagnózy. Obe deti s LL prežívajú po alogénnej transplantácii. Autológna transplantácia u 2 detí s ALCL priniesla len krátkodobý efekt a pacienti prekonali ďalší relaps. Kým relapsy v skupine lymfoblastických lymfómov aj B-NHL predstavujú prognosticky veľmi nepriaznivú udalosť a bez úspešnej transplantácie sú prakticky neliečiteľné (25), relapsy v skupine ALCL sú potenciálne zvládnuteľné aj ďalšou chemoterapiou, často identickou s liečbou v primárnej línii alebo aj menej intenzívnou ako bola primárna liečba a pacienti môžu prežívať aj na paliatívnej liečbe (26, 27). Súčasne prebieha štúdia ALCL relapse, ktorá zohľadňuje v stratégii liečby relapsu imunologický fenotyp vyjadrený prítomnosťou CD3, čas vzniku relapsu a použitie vinblastínu v primárnej liečbe. Podľa rizika je súčasťou liečby alogénna alebo autológna transplantácia.
Alogénna transplantácia umožnila aj prežitie pacientky s PMBCL, u ktorej boli predchádzajúce chemoterapie, včítane režimu RICE s použitím monoklonálnej anti-CD20 protilátky (rituximab) neúspešné. Vysoká intenzita liečby B-NHL už v prvej línii prakticky neumožňuje zvládnuť rezistentné alebo relapsové ochorenie ďalším zvyšovaním intenzity chemoterapie. Včasné zaradenie transplantácie môže zvrátiť nepriaznivý priebeh ochorenia a odpoveď na záchrannú liečbu v relapse (dosiahnutie KR alebo aspoň PR) je pri multivariantnej analýze jediný prognostický faktor pre úspešnosť transplantácie (25, 28). Ďalšie možnosti ovplyvnenia liečby NHL je selektívna cieľová terapia. Rituximab – chimérická IgG1 protilátka, ktorá sa špecificky viaže na povrchový antigén B-buniek CD20, sa používa už v prvolíniovej liečbe DLBCL u dospelých pacientov (29, 30). Protilátka navodí lýzu lymfómových buniek imunologickými mechanizmami ako je na protilátke dependentná bunková cytotoxicita (ADCC) a komplement-dependentná cytoxoticita (CDC) alebo priamou indukciou apoptózy a pôsobí synergicky s chemoterapiou. Kombinácia Rituximab + ICE (Ifosfamid, Carboplatina, Etoposid) sa používa už niekoľko rokov u dospelých pacientov s relapsovými a refraktérnymi lymfómami s CD20 pozitivitou (31) a efektivitu tejto kombinácie zisťovala pre detský vek COG. Odpoveď na liečbu je prítomná u 60 % pacientov a deti s následnou úspešnou transplantáciou krvotvorných buniek majú 3-ročný OS 40 % (32). Prospektívna štúdia B-NHL BFM Rituximab/04 prebieha aj v BFM skupine od roku 2004 už pri prvolíniovej liečbe.
Záver
Prognóza detí s NHL sa v posledných 30 rokoch výrazne zlepšila a v súčasnosti sa podarí vyliečiť 70–100 % detí v závislosti od histologického typu a klinického štádia ochorenia. Na základe rozdielnej biológie a klinického správania jednotlivé histologické typy vyžadujú rozličnú stratégiu liečby. Vysoká intenzita liečby prináša so sebou závažnú toxicitu, preto sa hľadajú možnosti jej znižovania redukciou intenzity liečby u pacientov s nízkym rizikom zlyhania a hľadajú sa možnosti cielenej terapie. Zlepšenie prežívania aj pri vysokej intenzite liečby je možné dosiahnuť redukciou morbidity a mortality, čo je možné pri použití adekvátnej suportívnej terapie a nadobudnutím dostatočných skúseností pri liečbe pomocou intenzívnych protokolov a hlavne zvládnutím komplikácií tejto terapie. Hlavné úlohy do budúcnosti sú objavenie bunkovej a molekulárnej patogenézy malígnej transformácie (lymfomogenézy) a hľadanie stratégie prevencie, včasnej identifikácie malignity a nájdenie cielenejšej terapie.
MUDr. Eva Bubanská, Ph.D., h.doc.
Klinika pediatrickej onkológie a hematológie SZU DFNsP
Nám. L. Svobodu 4
974 09 Banská Bystrica
Slovenská republika
Zdroje
1. Lymfómová skupina Slovenskej republiky: Stratégia liečby malígnych lymfómov. Princípy klasifikácie, diagnostiky a liečby malígnych lymfómov.1. vydanie-január 2007, 7-79.
2. Jaffe ES, Harris NL, Stein H et al. Pathology and genetics of tumours of haematopoietic and lymphoid tisssues: World Health Organization classification of tumours. Lyon, France, IARC Press, 2001.
3. Kaatsch P, Spix C. German Childhood Cancer Registry, annual report 2003. German Childhood Cancer Registry, Mainz, Germany, 2004.
4. Kaiserová E, Bubanská E, Oravkinová I, Stančoková T, Šubová Z, Plank L. Incidencia a kurabilita nádorov v detskom veku v Slovenskej republike. Onkológia 2006; 3 : 180-186.
5. Cairo MS, Raetz E, Lim MS, et al. Childhood and adolescent Non-Hodgkin lymphoma: new insights in biology and critical challenges for the future. Pediatr Blood Cancer 2005; 45 : 753-769.
6. Burkhardt B, Zimmermann M, Oschlies I, et al. The impact of age and gender on biology, clinical features and treatment outcome of non-Hodgkin lymphoma in childhood and adolescence. Br J Haemat 2005; 131 : 39-49.
7. Pinkerton CR. The continuing challenge of treatment for non-Hodgkin’s lymphoma in children. Br J Haemat 1999; 107 : 220-234.
8. Grenzebach J, Schrappe M, Ludwig WD, et al. Favorable outcome for children and adolescents with T-cell lymphoblastic lymphoma with an intensive ALL-type therapy without local radiotherapy. Ann Hematol 2001; 80(Suppl. 3): B73-B76.
9. Oillon M, Di Tullio MT, Garaventa A, et al. Long-term results of the first Italian association of pediatric hematology and oncology protocol for the treatment of pediatric B-cell non-Hodgkin lymphoma (AIEOP LNH92). Cancer 2004; 101 : 385-394.
10. Reiter A, Schrappe M, Tiemann M, et al. Improved treatment results in childhood B-cell neoplasms with tailored intensification od therapy: A report of the Berlin-Frankfurt-Műnster group trial NHL-BFM 90. Blood 1999; 94 : 3294-3360
11. Patte K, Auperin A, Michon J, et al. The Société Francaise d’Oncologie Pédiatrique LMB89 protocol: highly effective multiagent chemotherapy tailored to the tumor burden and initial response in 561 unselected children with B-cell lymphomas and L3 leukemia. Blood 2001; 97 : 3370-3379.
12. Atra A, Imeson JD, Hobson R, et al. Improved outcome in children with advanced stage B-cell non-Hodgkin’s lymphoma (B-NHL): results of the United Kingdom Children Cancer Study Group (UKCCSG) 9002 protocol. Br J Cancer 2000; 82 : 1396-1402.
13. Patte K, Auperin A, Gerrard M. et al. Results of the randomized international FAB/LMB96 trial for intermediate risk B-cell non-Hodgkin lymphoma in children and adolescents: it is possible to reduce treatment for the early responding patients. Blood 2007; 109 : 2773-2780.
14. Woessmann W, Seidemann K, Mann G, et al. The impact of the methotrexate administration Schedule and dose in the treatment of children and adolescents with B-cell neoplasms: a report of the BFM Group Study NHL-BFM95. Blood 2005; 105 : 948-958.
15. Rosolen A, Pillon M, Garaventa A, et al. Anaplastic large cell lymphoma treated with a leukemia-like therapy. Cancer 2005; 104 : 2133-2140.
16. Seidemann K, Tiemann M, Schrappe M, et al. Short-pulse B-non-Hodgkin lymphoma-type chemotherapy is efficacious treatment for pediatric anaplastic large cell lymphoma: a report of the Berlin-Frankfurt-Műnster Group trial NHL-BFM 90. Blood 2001; 97 : 3699-3706.
17. Williams DM, Hobson R, Imeson J, et al. Anaplastic large cell lymphoma in childhood: analysis of 72 patients treated on the United Kingdom Children’s Cancer Study Group chemotherapy regimens. Br J Haematol 2002; 117 : 812-820.
18. Lowe EJ, Sposto R, Perkins SL, et al. Intensive chemotherapy for systemic anaplastic large cell lymphoma in children and adolescents: Final results of Children’s Cancer Group Study 5941. Pediatr Blood Cancer 2009; 52 : 335-339.
19. Bubanská E, Stančoková T, Škripková Š. Príčiny neúspechov pri liečbe NHL v súbore detského onkocentra Banská Bystrica. Čes-slov Pediat 2002; 57 : 647
20. Bubanská E, Stančoková T, Škripková Š, Oravcová Z, Dluholucký S. Results of the treatment of malignant lymphomas in childhood – a review of 16 years period. Med Pediat Oncol 1997; 29 : 470.
21. Bubanská E, Kaiserová E, Oravkinová I, Petržalková D, Horáková J. in: Zborník abstraktov: XVI. konferencia detských hematológov a onkológov SR a ČR, 3.-5. nov. 2006, Podbanské. Banská Bystrica, PRO, 2006; 92.
22. Damm-Welk C, Busch K, Burkhardt B, et al. Prognostic significance of circulating tumor cells in bone marrow or peripheral blood as detected by quantitative PCR in pediatric NPM-ALK positive anaplastic large-cell lymphoma. Blood 2007; 110 : 670-677.
23. Le Deley MC, Reiter A, Williams D, et al. Prognostic factors in childhood anaplastic large cell lymphoma: Results of a large European intergroup study. Blood 2008; 111 : 1560-1566.
24. Bowman WP, Shuster JJ, Cook B, et al. Improved survival for children with B-cell acute lymphoblastic leukemia and stage IV small noncleaved cell lymphoma: a pediatric oncology group study. J Clin Oncol 1996; 14 : 1252-1261.
25. Attarbaschi A, Dworzak M, Steiner M, et al. Outcome of children with primary resistant or relapsed non-Hodgkin lymphoma and mature B-cell leukemia after intensive first-line treatment: A population-based analysis of the Austrian cooperative study group. Pediatr Blood Cancer 2005; 44 : 70-76.
26. Brugieres L, Quartier P, Le Deley MC, et al. Relapses of childhood anaplastic large-cell lymphoma: Treatment results in a series of 41 children - a report from French Sosiety of Pediatric Oncology. Ann Oncol 2000; 11 : 53-58.
27. Stockklausner C, Behnisch W, Mechterscheimer G, et al. Long-term remission of children with relapsed and secondary anaplastic large cell non-hodgkin lymphoma (ALCL) following treatment with pulsed dexamethasone and low dose etoposide. Pediatr Blood Cancer 2008; 50 : 126-129.
28. Fujita N, Mori T, Mitsui T, et al. The role of hematopoietic stem cell transplantation with relapsed or primary refractory childhhood B-cell Non-Hodgkin Lymphoma and mature B-cell leukemia: A retrospective analysis of enrolled cases in Japan. Pediatr Blood Cancer 2008; 51 : 188-192.
29. Feugier P, Van Hoff A, Sebban C, et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: A study by the Groupe dęEtude des Lymphomes de lęAdulte. J Clin Oncol 2005; 23 : 4117-4126.
30. Pfreundschuh M, Trűmper L, Ősterborg A, et al. CHOP-like chemotherapy plus rituximab prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006; 7 : 379-391.
31. Kewalramani T, Zelenetz AD, Nimer SD, et al. Rituximab and ICE as second-line therapy before autologous stem cell transplantation for relapsed or primary refractory diffuse large B-cell lymphoma. Blood 2004; 103 : 3684-3688.
32. Griffin TC, Weitzman S, Weinstein H, et al. A study of Rituximab and Ifosfamide, Carboplatin and Etoposide chemotherapy in children with recurrent/refractory B-cell (CD20+) non-Hodgkin lymphoma and mature B-cell acute lymphoblastic leukemia: A report from the Children’s Oncology Group. Pediatr Blood Cancer 2009; 52 : 177-181.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2010 Číslo 1- Nejasný stín na plicích – kazuistika
- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2010_06 ze dne 1. 3. 2010 verze 2 (2010_04)
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Úvod
- Vzpomínka na prof. James R. McArthura, M.D., čestného člena České hematologické společnosti ČLS JEP
- „Nová protinádorová léčiva a léčebné strategie v onkologii“ autorů prof. MUDr. P. Klenera, DrSc. a MUDr. P. Klenera jr., Ph.D.
- Methotrexate /6-mercaptopurine maintenance therapy influences the risk of a second malignant neoplasm after childhood acute lymphoblastic leukemia: results from the NOPHO ALL – 92 study
- The spectrum of Evans syndrome in adults: new insight into the disease based on the analysis of 68 cases
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



