-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
BCR-ABL mutation analysis allovos to provide „tailored therapy” for CML patients resistant to imatinib
Chronic myeloid leukemia (CML) becomes a disease, treatment of which represents typical example of tailored therapy. Despite the fact that first line therapy of CML using imatinib revolutionized the treatment of this disease, it became clear that during 5 years 25–35 % of the patients require change in the therapy due to the development of imatinib resistance or intolerance. The most frequent mechanism responsible for imatinib resistance is development of mutation in BCR-ABL kinase domain. Mutations cause different level of imatinib resistance and while some of them can be overcome by increased dose of imatinib (M351T), others seem to be resistant to nilotinib (P-loop mutations, F359C/V) and others are more resistant to dasatinib (F317L/V a V299L). This review is focused only to clinically most important mutations occurring in 15 amino-acid substitutions, which account for more than 85 % of all BCR-ABL mutations. It has been shown recently that advances in molecular methods enable to better understand disease itself, weigh the benefit to risk ratio of the therapy, individualize therapeutic approach and eventually adjust CML therapy earlier in order to minimize the risk of CML progression to advanced phases.
Key words:
chronic myeloid leukemia, tyrosine kinase inhibitors, imatinib, dasatinib, nilotinib, BCR-ABL domain mutations, imatinib resistance, tailored therapy
Autoři: M. Šťastný 1; K. Machová Poláková 2; H. Klamová 2; D. Žáčková 3; J. Voglová 4; M. Karas 5; J. Moravcová 2; E. Faber 6
Působiště autorů: Bristol-Myers Squibb Czech Republic, 2Ústav hematologie a krevní transfuze Praha, 3Interní hematoonkologická klinika FN a LF Masarykovy univerzity Brno, 4II. interní klinika – oddělení klinické hematologie, LF UK a FN Hradec Králové, 5Hematologicko-onkolo 1
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 1, p. 47-54.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Chronická myeloidní leukemie (CML) se stává chorobou, jejíž léčba je typickým příkladem terapie šité na míru. Přestože léčba imatinibem v první linii CML představovala obrovský průlom v léčbě této choroby, ukazuje se, že 25-35 % pacientů potřebuje v průběhu 5 let změnu terapie z důvodu intolerance či selhání léčby. Nejčastějším mechanismem zodpovědným za rezistenci k imatinibu u pacientů s CML je rozvoj mutací v BCR-ABL kinázové doméně. Tyto mutace vyvolávají různou míru rezistence k imatinibu a zatímco některé mohou reagovat na zvýšení dávky imatinibu (M351T), jiné jsou rezistentní k nilotinibu (mutace v P-smyčce, F359C/V) a další vykazují zvýšenou míru rezistence k dasatinibu (F317L/V a V299L). Toto přehledné sdělení se věnuje pouze klinicky nejdůležitějším mutacím v 15 aminokyselinových zbytcích, kde se vyskytuje více než 85 % všech mutací. Ukazuje se, že pokroky v molekulárních metodách umožňují porozumět lépe podstatě choroby, zvážit prospěch a riziko terapie, individualizovat terapeutický přístup a přizpůsobit léčbu CML včas tak, aby se minimalizovalo riziko progrese CML do pokročilých fází.
Klíčová slova:
chronická myeloidní leukemie, tyrosinkinázové inhibitory, imatinib, dasatinib, nilotinib, BCR-ABL mutace, rezistence k imatinibu, terapie šitá na míruÚvod
Terapie „šitá na míru“ (tailored therapy) je termín, který obecně znamená, že se použije „správná dávka správného léku pro správnou indikaci u správného pacienta v pravý čas“. Jinými slovy jde o individualizovanou léčbu přizpůsobenou konkrétnímu pacientovi. Tento typ terapie se čím dál častěji cituje především v souvislosti se stoupajícími náklady na zdravotní péči, které velmi úzce souvisejí se zvyšujícími se náklady farmaceutických firem na testování nových léčiv. Odhaduje se, že uvedení nového léku na farmaceutický trh dosahuje v současné době astronomické částky téměř 1 miliardy USD (1). Tyto obrovské náklady se nutně musí odrazit v cenách léků. Roční terapie jednoho pacienta (obzvláště u onkologických indikací) se pohybuje v řádu milionu korun. Za dané situace je velmi důležité, aby se takto drahý lék dostal především k těm pacientům, kteří budou z léčby profitovat, a omezila se jeho spotřeba v indikacích, kde je pravděpodobnost odpovědi minimální.
Jedním z prvních příkladů individuální léčby byla identifikace estrogenových receptorů (ER) jako model hormonálně-cílené terapie (2). Tamoxifen signifikantně zlepšil přežívání pacientů s ER-pozitivním karcinomem prsu, jak v adjuvanci, tak v paliativním podání (3). Dalším příkladem individualizované péče je použití trastuzumabu u pacientek s karcinomem prsu pozitivním na HER2 (receptor pro lidský epidermální růstový faktor 2). Na základě analýzy mnoha studií se vytvořila doporučení léčit trastuzumabem pacientky, které vykazují zvýšenou expresi HER2. Tento přístup minimalizuje riziko toho, že by nebyli léčeni pacienti, kteří mohou z trastuzumabu profitovat, a tato drahá terapie nebude zbytečně vynakládána na pacienty, u nichž je velmi nízká pravděpodobnost odpovědi na léčbu (4). V poslední době se do popředí zájmu dostala role mutačního stavu genu KRAS při léčbě pacientů s metastatickým kolorektálním karcinomem (MKK) pomocí monoklonálních protilátek proti receptoru pro epidermální růstový faktor (EGFR). Na základě klinických studií byly nedávno schváleny anti-EGFR protilátky pro použití v kombinaci s chemoterapií u pacientů s MKK exprimujících EGFR s nemutovaným genem KRAS (5).
CML a terapie šitá na míru v éře tyrosinkinázových inhibitorů
Chronická myeloidní leukemie (CML) patří z molekulárního hlediska k nejlépe prostudovaným neoplaziím. A právě znalost molekulární podstaty onemocnění umožňuje označit CML jako chorobu, kde se stále více uplatňuje „terapie šitá na míru“. CML je myeloproliferativní choroba charakterizovaná expanzí klonu hematopoetických buněk, které nesou Philadelphia (Ph) chromozom (6). Ph chromozom vzniká reciprokou translokací mezi dlouhými raménky chromozomů 9 a 22, t(9;22)(q34;q11). Na molekulární úrovni tak vzniká nový fúzní gen BCR-ABL, který kóduje konstitutivně aktivní tyrosinkinázu. Imatinib je relativně specifický inhibitor tyrosinkinázy BCR-ABL, který zcela revolučním způsobem změnil léčbu a prognózu pacientů s CML (7). Imatinib se stal „zlatým standardem“ léčby CML a pacienti léčení imatinibem v první linii dosahují vysokého procenta kompletních hematologických (CHR) a cytogenetických (CCyR) odpovědí. Navzdory těmto vynikajícím výsledkům dochází u části pacientů s chronickou fází CML k relapsu či k rozvoji rezistence, přičemž v pokročilých fázích je rozvoj rezistence spíše pravidlem než výjimkou.
Většina dostupných dat o dlouhodobé účinnosti imatinibu u pacientů s CML pochází z multicentrické studie IRIS (International Randomized Study of Interferon and STI571). Po 18 měsících léčby dosáhlo 76 % pacientů CCyR, což znamená, že dle současných doporučených postupů (9) léčba selhala u 24 % pacientů (8, 10). Rezistence k imatinibu může být rozdělena na primární/vrozenou (od zahájení léčby pacient nedosáhne hematologickou či cytogenetickou odpověď), a sekundární/získanou rezistenci, kdy u pacienta po počáteční odpovědi na terapii dojde k její ztrátě a eventuální progresi choroby.
Primární rezistence k imatinibu
Primární hematologická rezistence je méně častá, vyskytuje se jen asi u 5 % CML pacientů léčených imatinibem v 1. linii. Cytogenetická rezistence se vyskytuje častěji, cca u 30 % pacientů. Mechanismy zodpovědné za primární rezistenci nejsou stále ještě zcela detailně prozkoumány, nicméně čím dál více poznatků se objevuje k mechanismům sekundární rezistence (11).
Sekundární rezistence k imatinibu
Mechanismy získané rezistence mohou být rozděleny na BCR-ABL závislé a na BCR-ABL nezávislé (11). Mezi BCR-ABL závislé mechanismy patří: a) mutace v BCR-ABL, které ovlivňují vazbu imatinibu; b) duplikace, amplifikace či zvýšená exprese BCR-ABL. Mezi BCR-ABL nezávislé mechanismy patří: a) snížená intracelulární koncentrace imatinibu z důvodu nižšího influxu léku (nízká exprese influxního proteinu hOCT, který přenáší imatinib do buňky) či z důvodu vyššího efluxu léku z buňky (vyšší exprese P-glykoproteinu, který snižuje intracelulární koncentrace řady cytostatik); b) zvýšená exprese kináz rodiny Src (buňka obchází blokovanou signalizaci přes BCR-ABL zvýšenou expresí a signalizací přes alternativní kinázy rodiny Src); c) nezávislost buňky na BCR-ABL (klidové, neproliferující kmenové CML buňky); d) přídatné chromozomální aberace.
V dalším textu se budeme věnovat výhradně mutacím kinázové domény (KD) BCR-ABL, jako nejčastěji uváděnému mechanismu získané rezistence na imatinib (40–60 % v chronické fázi CML (CP-CML), ale i více u pokročilých stadií CML) (11). Počet popsaných mutací v KD BCR-ABL se neustále zvyšuje a v současné době je známo více než 50 pozic, kde dochází k substituci aminokyselin (AK) vedoucí ke vzniku více než 70 individuálních mutací s různou mírou rezistence k imatinibu (11,12).
Mutace se vyskytují nejčastěji ve 4 oblastech KD BCR-ABL:
- v tzv. P-oblasti, kde dochází k vazbě ATP (mutace G250E, Q252R, Y253F/H a E255K/V)
- v místě vazby imatinibu k BCR-ABL – substituce AK za jinou naruší van der Waalsovy interakce léku s proteinem (mutace V289A, F311L, T315I a F317L)
- v oblasti katalytické domény BCR-ABL (mutace M351T a E355G)
- v oblasti aktivační smyčky, která kontroluje aktivní stav kinázy (H396R/P).
Citlivost mutací k imatinibu lze rozlišit na základě koncentrace IC50 (koncentrace léku, která inhibuje růst buněčné linie z 50 %) dle in vitro testů následovně: buněčná IC50 zvýšena ≤ 2x platí pro mutace s mírnou rezistencí, silnou rezistenci vykazují mutace s IC50 zvýšenou > 5x. Mutace T315I je příkladem úplné rezistence ke všem dostupným tyrosinkinázovým inhibitorům (TKI). Některé detekované záměny nukleotidů v cDNA řetězci KD BCR-ABL nevedou ke změně smyslu kodonu, tudíž nedochází k substituci AK v proteinovém řetězci. Takové mutace nevyvolávají změnu citlivosti BCR-ABL k imatinibu. Jednobodové záměny nukleotidů nemusí vždy znamenat, že byla detekována mutace, nýbrž jednobodový polymorfismus (SNP), který nemusí mít klinický význam.
Přestože se frekvence jednotlivých mutací liší, nejčastěji mutovanou oblastí BCR-ABL je tzv. P-smyčka (ATP-vazebná oblast), kde se vyskytuje 36 % až 48 % všech mutací (13-15). Záměny AK v sedmi pozicích proteinového řetězce (G250, Y253, E255, T315, M351, F359, H396) tvoří 66 % reportovaných mutací. 85 % všech mutací se vyskytuje v 15 AK - z těchto důvodů se v dalším přehledu budeme věnovat těmto 15 nejčastěji detekovaným mutacím BCR-ABL ( obr. 1) (11, 13).
Obr. 1. Frekvence a místo 15 nejčastějších mutací v BCR-ABL u pacientů s CML 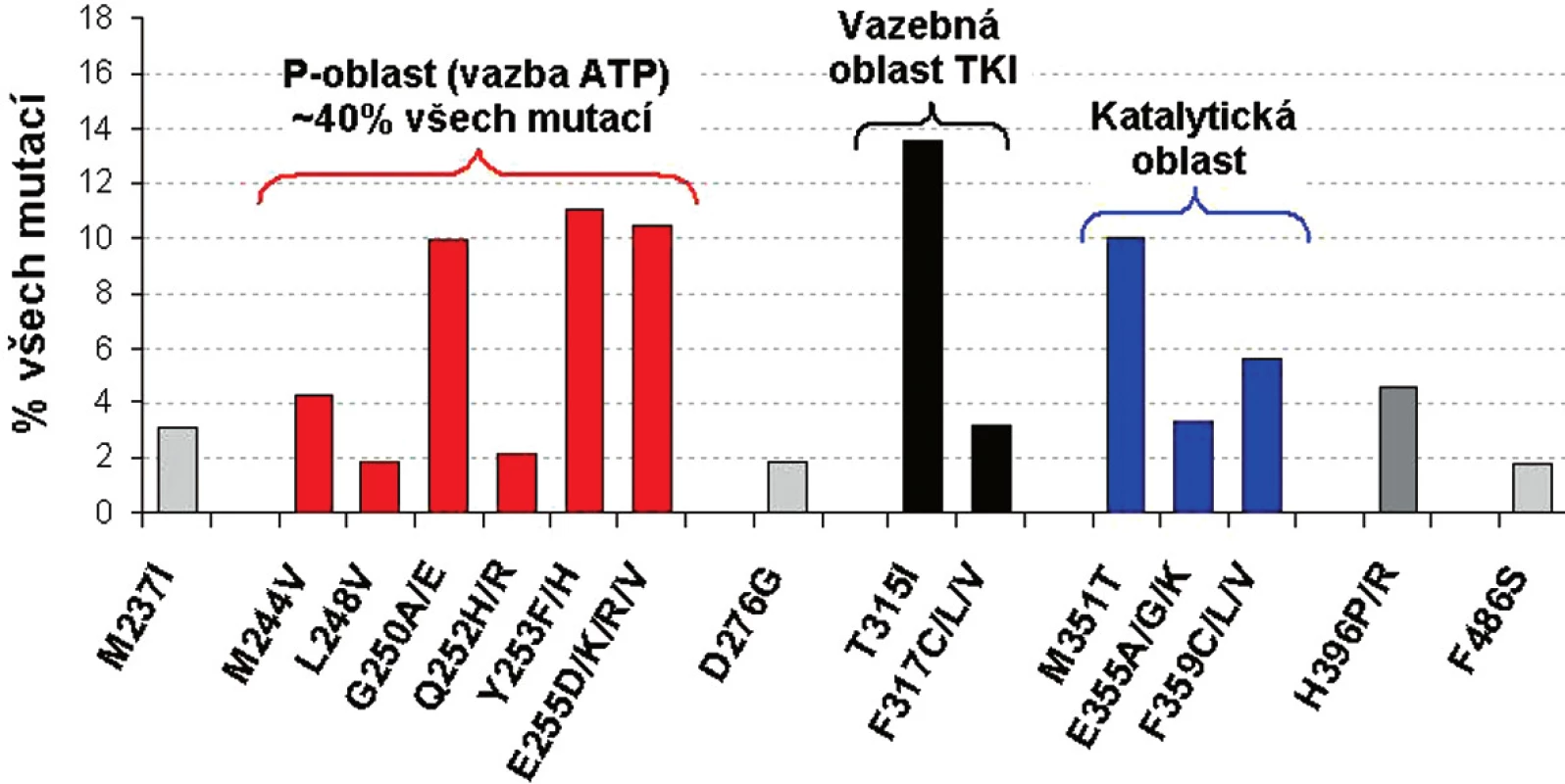
Individualizovaná terapie podle typu rezistence k imatinibu
Určitým pomocným vodítkem k tomu, jakou terapii zvolit v případě, že se objeví mutace v BCR-ABL, mohou představovat in vitro testy buněčných linií s vnesenou konkrétní mutací BCR-ABL. Tyto testy mohou dát určitou představu o tom, jaká je míra rezistence buněk s určitou mutací BCR-ABL vůči imatinibu či dalším TKI (dasatinib, nilotinib) na základě stanovení koncentrace IC50 – obrázek 2 (16–18). Je nutné mít na zřeteli fakt, že koncentrace IC50 a určená míra rezistence (poměr IC50 BCR-ABLmut ku IC50BCR-ABLwt) se v různých studiích liší (16, 18). Tyto diskrepance souvisejí s použitím různých buněčných linií, experimentálních podmínek, způsobech vyhodnocování atp.
Obr. 2. Frekvence 15 nejčastějších mutací BCR-ABL a jejich citlivost k imatinibu podle IC<sub>50</sub> v porovnání s nemutovanou BCR-ABL (červeně silná rezistence >5x IC<sub>50</sub>, žlutě střední rezistence 3-5x IC<sub>50</sub>; zeleně senzitivní mutace s < 3x IC<sub>50</sub>) - adaptováno dle ref. 16, 18, 19. 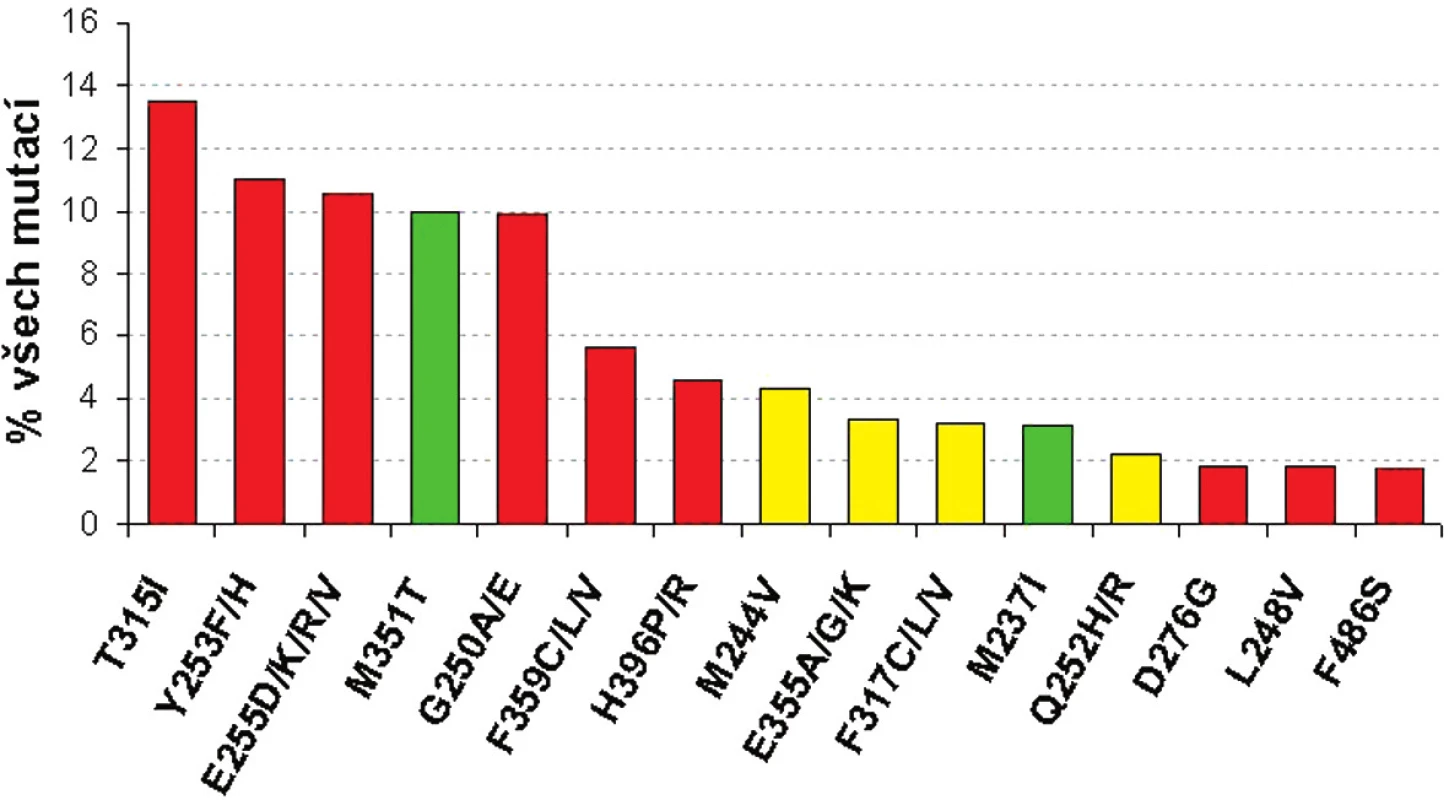
Polymorfismus v BCR-ABL
Některé mutace v BCR-ABL mohou být sice spojeny se záměnou jedné AK za jinou, ale tato změna neovlivní funkci BCR-ABL, ani nemusí znamenat rezistenci k imatinibu. Typickým příkladem je mutace nalezená v P-oblasti (K247R), která vede k záměně argininu za lyzin (20). Mělo se za to, že mutace v této oblasti vyvolává u pacientů horší odpověď na imatinib. Biochemické a buněčné analýzy zkoumající citlivost této mutace k imatinibu a dasatinibu však neprokázaly změny v koncentraci IC50 v porovnání s nemutovanou formou BCR-ABL. Zjistilo se, že v tomto případě jde zřejmě o tzv. jednonukleotidový polymorfismus (SNP; single nucleotide polymorphism), který nemá vliv na signalizační funkci BCR-ABL, ani na její schopnost vázat TKI (20). Objevení se podobných mutací tedy nemusí nutně vést ke změně terapie, pokud samozřejmě jiné markery monitorující stav pacienta nevypovídají jinak.
Mutace s nízkou rezistencí (IC50 < 3x vyšší než u nemutované BCR-ABL)
Příkladem mutací s nízkou rezistencí jsou mutace M351T (IC50 ~ 3x vyšší než nemutovaná forma BCR-ABL) nebo mutace M237I (IC50 ~ 2x vyšší) (16, 19). Na základě in vitro dat lze u těchto mutací zvažovat zvýšení dávky imatinibu na 600–800 mg, aby bylo dosaženo terapeutické odpovědi (snížení narůstajícího transkriptu BCR-ABL, návrat do CCyR). Vysoká dávka imatinibu je považována za léčebnou možnost u pacientů s méně než optimální odpovědí na imatinib v první linii jak v doporučeních ELN (European LeukemiaNet), tak NCCN (National Cancer Comprehensive Network) (9, 21). Avšak použití vysoké dávky imatinibu po selhání standardní dávky 400 mg je kontroverzní; může jít o vhodnou strategii pro některé pacienty, ale klinický benefit rozhodně není dosažen u všech. Míra CCyR se pohybuje od 10 % do 40 % a odpovědi jsou často transientní, přičemž dávka 800 mg může být spojena s nižší tolerabilitou.
Jediná randomizovaná studie, která porovnávala jiný TKI s 800 mg imatinibu, je studie START-R (dasatinib 2 x 70 mg vs. imatinib 800 mg u pacientů rezistentních k imatinibu 400–600 mg). V této randomizované studii se po 15 měsících sledování ukázalo, že dosažení velké cytogenetické odpovědi (MCyR) bylo vyšší po dasatinibu oproti 800 mg imatinibu jak u pacientů bez vstupních mutací (58 % vs. 34 %), tak u pacientů s jakoukoliv mutací BCR-ABL (46 % vs 27 %) (22). Navíc tato studie prokázala, že pacienti v CP-CML, kteří na standardní dávce imatinibu nedosáhli cytogenetickou odpověď, neprofitovali z léčby vysokou dávkou imatinibu (MCyR 7 % po 800 mg imatinibu vs. 49 % po dasatinibu; P = 0,0006) (22). Porovnání dasatinibu a imatinibu 800 mg po 2 letech léčby ukazuje tabulka 1 (23).
Tab. 1. Porovnání dasatinibu a imatinibu 800 mg po 2 letech léčby pacientů s CP-CML s rezistencí k imatinibu 400–600 mg (23). 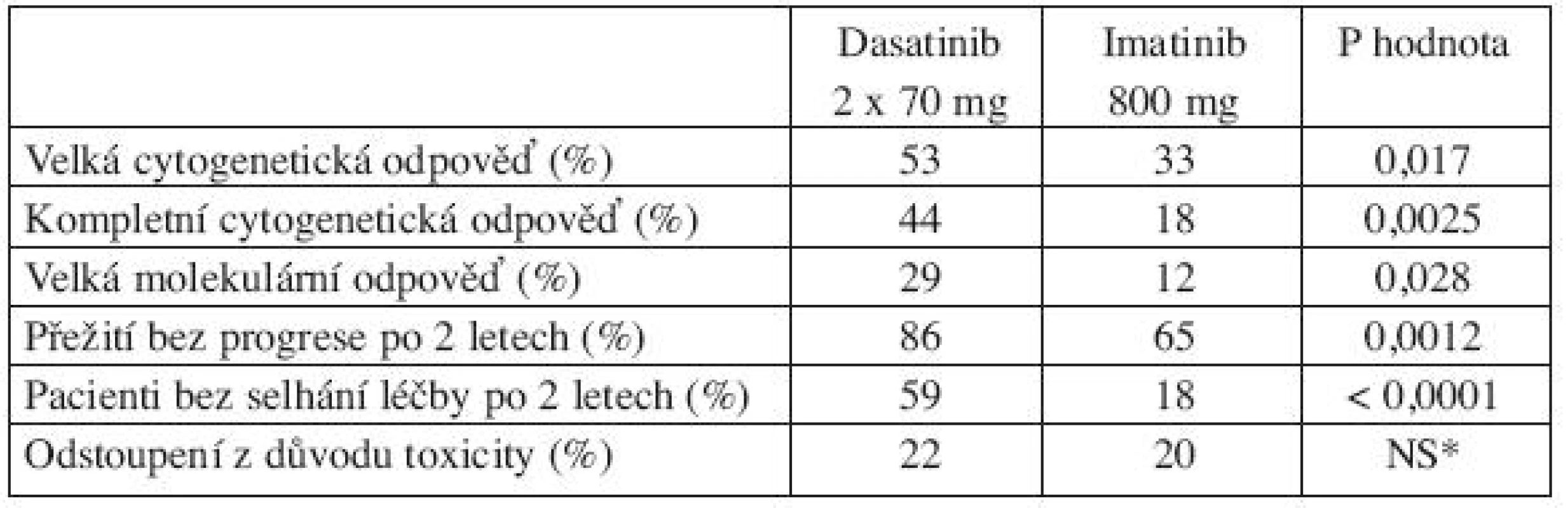
*NS = nesignifikantní rozdíl Mutace se střední rezistencí (IC50 3–5x vyšší než u nemutované BCR-ABL)
Příkladem BCR-ABL mutací se střední rezistencí k imatinibu jsou mutace M244V, F317L či Q252H. Zvýšení dávky imatinibu by snad u některých pacientů mohlo znamenat alespoň přechodnou odpověď, nicméně dlouhodobý prospěch pro pacienty je diskutabilní. Protože jsou k dispozici další dva inhibitory BCR-ABL (dasatinib a nilotinib), lze na základě in vitro dat a dostupných klinických zkušeností tvrdit, že vhodnější bude v tomto případě záměna imatinibu za TKI 2. generace.
Mutace M244V vykazuje IC50 koncentraci imatinibu 3,4x (19) až 8x vyšší (16), zatímco IC50 je u dasatinibu zvýšena 2x a u nilotinibu 3x (16). Můžeme tedy předpokládat účinnost obou TKI 2. generace. Klinická data ukazují, že pacienti s mutací s IC50 < 3 nM dasatinibu (kam M244V patří), měli při léčbě dasatinibem CHR 94 % a CCyR 47 % (24). Pacienti s mutací s IC50 < 100 nM nilotinibu (kam M244V patří) měli při léčbě nilotinibem CHR 77 % a CCyR 37 % (25). Příklad pacienta s mutací M244V na nilotinibu ukazuje obrázek 3.
Obr. 3. Individualizovaná péče o pacienta s mutací M244V v BCR-ABL (data z ÚHKT). 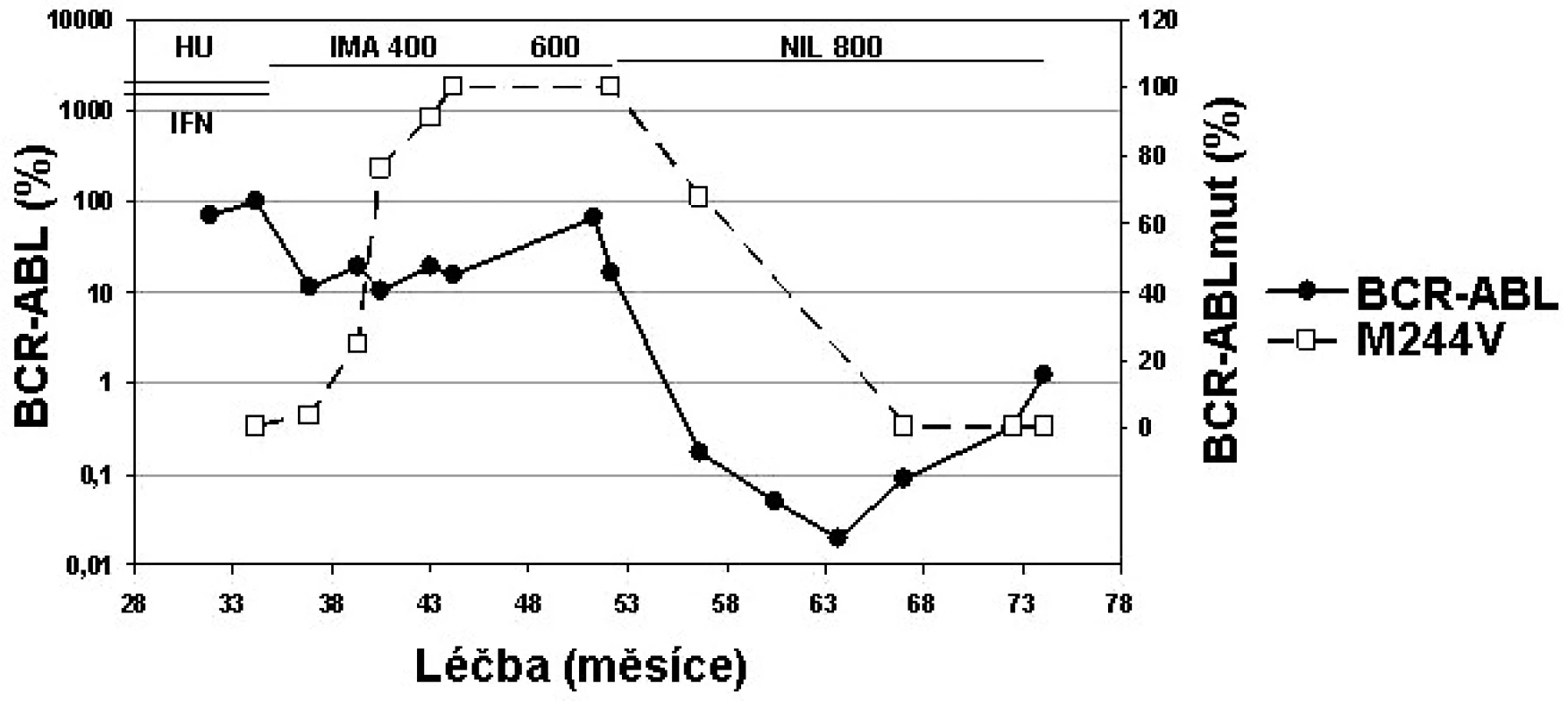
F317L mutace se zdá být citlivá k nilotinibu (IC50 zvýšena jen 4x, zatímco u dasatinibu 9x) (16). Populace pacientů s mutací F317L dosahovala při léčbě nilotinibem vysokého procenta MCyR (26). Naopak tato mutace se zdá rezistentní k dasatinibu a ačkoliv se míra CHR pohybovala kolem 90 %, procento CCyR bylo minimální (24).
U mutace Q252H je situace komplikovanější, IC50 je zvýšena 5x pro imatinib a 4x pro dasatinib (3,4 nM) i nilotinib (70 nM) (16). Jedná se ovšem o mutaci v P-oblasti, což je oblast mutací spíše silně rezistentních k imatinibu. Proto lze v tomto případě považovat TKI 2. generace zřejmě za lepší volbu a při výběru TKI postupovat i podle individuálních komorbidit pacientů (diabetes, kardiální komplikace, pleurální efuze, jaterní dysfunkce). Preklinická data naznačují, že by tato mutace mohla být citlivá také na další TKI ve vývoji, např. na bosutinib (18).
Mutace s vysokou rezistencí (IC50 > 5x vyšší než u nemutované BCR-ABL)
Mutace v P-oblasti a dále mutace na pozici F359, H396, D276, L248 a F486 jsou na základě hodnoty IC50 definovány jako silně rezistentní k imatinibu. V případě těchto mutací je tedy na místě zvažovat změnu terapie na některý z TKI 2. generace. Zatímco frekvence mutací F359, H396, D276, L248 a F486 se pohybuje od 2–5 %, mutace v P-oblasti jsou velmi časté (36–48 % všech mutací) a proto se jim budeme věnovat podrobněji (14, 15).
Mutace v P-oblasti
Jak již bylo řečeno, mutace v P-oblasti, kde dochází k vazbě ATP na BCR-ABL, představují nejčastější mutace, které se objevují u pacientů rezistentních na imatinib (14, 15). Jelikož různí autoři definují P-oblast různým způsobem, např. oblast AK 250–255 (14) nebo 248–255 (27), pro účely tohoto článku budeme používat definici dle publikace Jabbour a spol., která P-oblast definuje mezi AK 244-255 (28).
Z několika nezávislých studií se zdá, že pacienti s mutacemi v P-oblasti BCR-ABL mají nejen nižší míru odpovědi, ale i rychlejší progresi choroby a kratší dobu přežití (14, 28). Brandfordová a spol. ukázali, že pacienti s mutací v P-oblasti měli medián přežití 4,5 měsíce, pacienti s mutacemi mimo P-oblast 11 měsíců (14). Kromě toho Nicolini a spol. analyzovali 89 pacientů s CML (64 % v chronické fázi) sledovaných v mediánu 39 měsíců a zjistili, že celkové přežívání bylo signifikantně horší u pacientů s mutacemi v P-oblasti (medián přežití 28,3 měsíce) v porovnání s ostatními mutacemi (medián přežití nedosažen po 39 měsících) (27). Také recentní studie z Hammersmith Hospital potvrzuje, že mutace v P-oblasti (mimo pozici 244) jsou spojeny s vyšším rizikem progrese v porovnání s mutacemi v jiných místech či v porovnání s pacienty bez mutací (29). Tato data se zdají být v souladu s in vitro testy, které ukazují, že některé mutace jsou více onkogenní v porovnání s nemutovanou formou či jinými mutacemi v BCR-ABL. Prokázala se zvýšená transformační schopnost mutací Y253F a E255K s následující schopností onkogenní transformace: Y253F > E255K > nemutovaná BCR-ABL ≥ T315I > H396P > M351T (30). Dohromady lze říci, že vývoj mutací v P-smyčce indikuje rezistenci na imatinib s hrozbou rychlého rozvoje hematologického relapsu. Jejich časnější detekce v průběhu léčby pacienta může přispět k rychlejší terapeutické intervenci, což umožní předejít pravděpodobnému relapsu choroby (15, 30).
In vitro studie prokázaly, že nilotinib inhibuje všechny mutace BCR-ABL s výjimkou mutace T315I. Stejné studie ovšem prokázaly i to, že určité mutace v P-oblasti (Y253F/H, E255K/V) a v pozici F359 – jsou 10–35x méně citlivé k nilotinibu v porovnání s nemutovanou formou BCR-ABL (16, 18). Klinické studie pak odrážejí tyto in vitro nálezy, kdy u pacientů selhávajících na nilotinibu jsou nejčastěji nacházeny mutace v pozicích Y253, E255, T315 či F359 (26, 32, 33). Ve studii fáze II. nilotinibu u CP-CML nebyly u pacientů s těmito mutacemi zaznamenány CCyR (26,31). Tento fakt je do určité míry překvapující, vzhledem k nejvyšším a „steady-state“ koncentracím nilotinibu v plazmě (3,7 μM a 1,7 μM) (25). Vysvětlením může být, že nilotinib je z 98 % vázán na proteiny plazmy a tudíž farmakologicky účinná koncentrace volného léčiva bude výrazně nižší (34).
S postupným získáváním klinických dat se ukazuje, že odpověď na dasatinib není u pacientů s mutacemi v oblasti P-smyčky a při mutaci F359 snížena (MCyR 60-65 %, CCyR ~ 50 %). V těchto případech je zřejmě dasatinib lékem volby (15, 24, 31, 33, 35–37). Z reálné klinické praxe se též ukazuje, že u pacientů s rezistencí k imatinibu se častěji objevují mutace rezistentní na nilotinib v porovnání s dasatinibem (33). Tento fakt může souviset právě s vyšší frekvencí mutací v P-oblasti BCR-ABL.
H396P/R mutace jsou podle in vitro testů označovány za silně rezistentní k imatinibu a citlivé k dasatinibu i nilotinibu (16). Ve studiích fáze II/III dasatinibu u více než 2000 pacientů s CML rezistentních či intolerantních k imatinibu bylo nalezeno 33 pacientů s mutací H396R. Z nich ~ 40 % dosáhlo CCyR a 50 % MCyR (24). Příklad pacienta s touto mutací je uveden na obrázku 4.
Obr. 4. Individualizovaná péče o pacienta s mutací H396R v BCR-ABL (data z FN Hradec Králové). 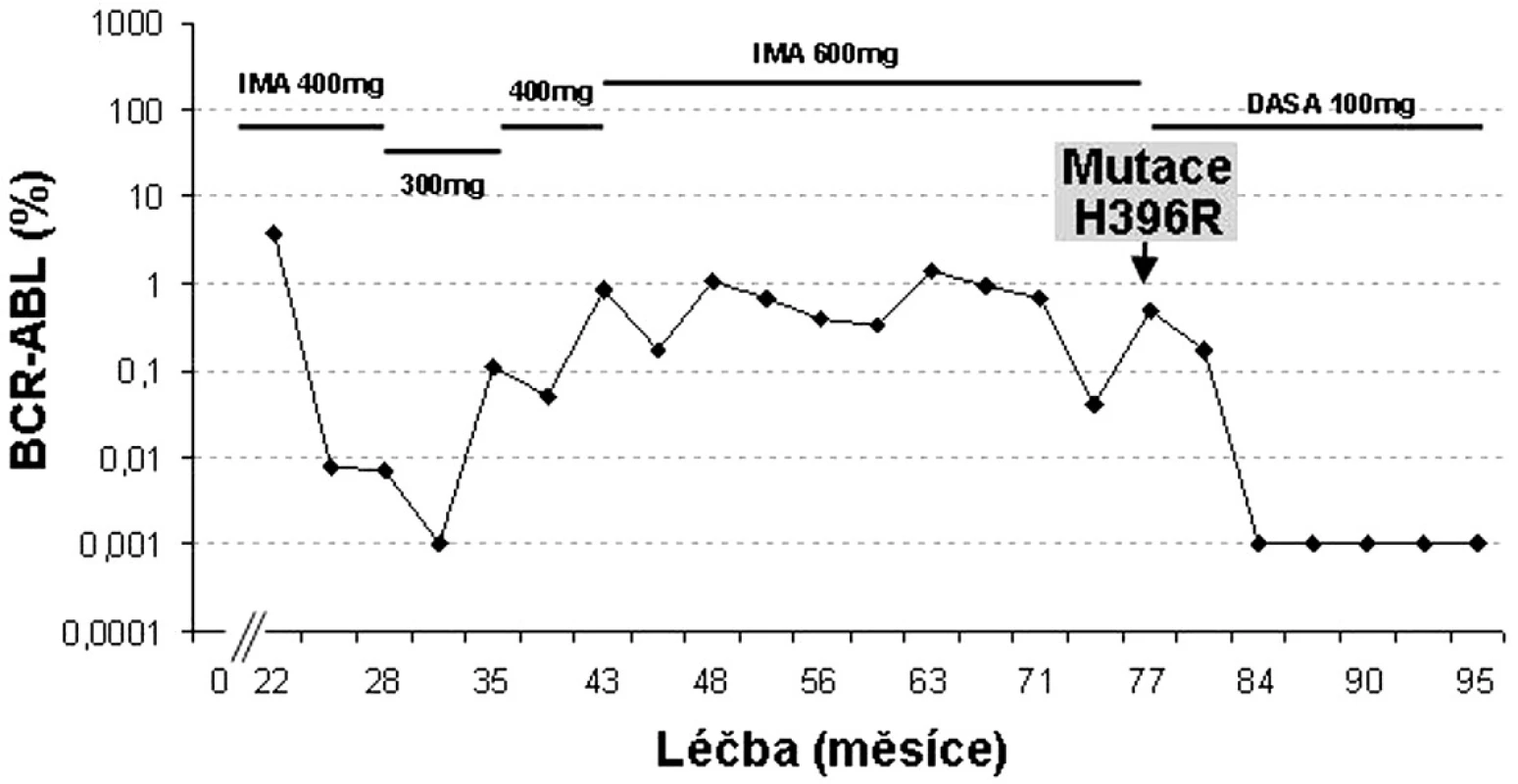
Mutace D276G, L248V a F486S jsou relativně málo časté (každá z nich má výskyt do 2 % všech mutací) a konkrétní klinická data jsou omezená. Mutace D276G je silně rezistentní k imatinibu, avšak 2/2 pacientů s touto mutací u Ph+ALL dosáhli po dasatinibu MCyR, 1/2 pacientů na nilotinibu dosáhl MCyR (19). Mutace L248V se zdá být silně rezistentní k imatinibu a středně rezistentní k nilotinibu (19); in vitro data k dasatinibu chybí, nicméně z reálné klinické praxe se zdá, že tato mutace je k dasatinibu citlivá (19). F486S je dle IC50 koncentrace mutací se silnou rezistencí k imatinibu, ale zdá se být citlivá k nilotinibu; in vitro data k dasatinibu chybí. Klinická data se u této mutace omezují na jednotlivé pacienty jak u dasatinibu, tak u nilotinibu (19).
Mutace T315I
Ačkoliv odpověď pacientů na TKI je především u CP-CML extrémně dobrá, mutace T315I stále představuje významný klinický problém, protože se jedná o mutaci, která je rezistentní ke všem komerčně dostupným TKI. Mutace T315I znemožňuje vazbu všech tří TKI k BCR-ABL. Záměna treoninu za hydrofobnější izoleucin odstraní z BCR-ABL důležitý vodíkový můstek, který má pro vazbu TKI klíčovou důležitost a dochází k tomu, že se TKI nemohou navázat do ATP-vazebného místa. Několik studií se pokoušelo zjistit, jestli tato mutace mění transformační schopnost BCR-ABL kinázy. Zatímco se v některých studiích zjistilo, že mutace T315I má slabě redukovanou kinázovou aktivitu v porovnání s nemutovanou formou BCR-ABL (30), jiná studie naopak ukázala na zvýšenou aktivitu mutované BCR-ABL kinázy (38).
Někteří autoři ukazují, že mutace T315I je spojena s vysoce agresivním průběhem choroby a se špatnou prognózou pacientů, pokud nedojde k rychlému terapeutickému zásahu a změně terapie (27, 39). Studie Nicoliniho et al. (přestože má limitace v retrospektivním sledování a v nevelkém počtu pacientů; n = 27), ukázala, že mutace T315I se objevuje v kategorii pacientů s horšími iniciálními prognostickými znaky (vysoké Sokalovo skóre, další chromozomální abnormality), většinou v pokročilých fázích choroby (39). Naproti tomu jiná studie z poslední doby naznačuje, že pacienti s mutací T315I mají podobnou prognózu jako pacienti s jinými mutacemi či bez mutací (40). Ačkoliv je tedy mutace T315I spojena s rezistencí ke všem dostupným TKI, studie uzavírá, že přežívání pacientů s mutací T315I závisí především na stadiu choroby. I z tohoto důvodu má zásadní důležitost včasná identifikace rezistence i její příčiny. Čím časněji je mutace identifikovaná, tím větší naději na úspěch má alternativní léčba.
Při zjištění mutace T315I je v současné době vhodné urychleně hledat dárce a připravovat nemocného na alogenní transplantaci krvetvorných buněk. Někteří autoři doporučují při vývoji mutace T315I vysadit TKI (39),aby polevil selekční tlak, a nasadit hydroxyureu. To může zpomalit progresi choroby a získat čas pro vyhledání vhodného dárce nebo umožnit pacientovi vstup do studií s aurora kinázovými inhibitory (např. MK 0457, PHA-739358, MLN8237). MK-0457 (VX-680) je schopen vazby jak na nemutovanou formu BCR-ABL, tak na BCR-ABL s mutací T315I a ukázalo se, že inhibuje T315I-BCR-ABL v primárních pacientských buňkách v nízkých mikromolárních koncentracích. Studie fáze I s touto molekulou prokázaly účinnost u pacientů v pokročilé fázi CML a Ph+ALL (41), avšak náběr pacientů do studií fáze II. byl pozastaven z důvodu neočekávané toxicity. Dalším zajímavým kandidátem je molekula PHA-739358 (danusertib), která zasahuje jak Aurora kinázy, tak nemutované i mutované formy BCR-ABL (45). Nedávno začaly zkoušky fáze II s touto molekulou u pacientů s CML, včetně pacientů s pan-rezistentní mutací T315I (NCT00335868; ww.clinicaltrial.gov).
Diskuse a závěr
Imatinib (400 mg/denně) představuje v současné době jedinou schválenou terapii u CML v první linii. Pacienti by měli být velmi pozorně monitorováni dle doporučení ELN či NCCN a v případě selhání imatinibu či při suboptimální odpovědi by léčba měla být odpovídajícím způsobem upravena či změněna. Výběr TKI terapie ve druhé linii by měl být individualizován pro každého pacienta, přičemž by se měla brát v úvahu jak účinnost léku vzhledem ke zjištěné mutaci BCR-ABL, tak bezpečnost léku. Zatímco v případě léčby kolorektálního karcinomu (KRAS mutace) či karcinomu prsu (zvýšená exprese HER2) se jedná spíše o rozhodování typu ANO-NE, v případě CML už můžeme zcela jistě hovořit o terapii „šité na míru“.
Ne každá mutace v BCR-ABL přispívá stejnou měrou ke vzniku rezistence na imatinib. Proto je pravděpodobné, že „terapie šitá na míru“ pacientům s CML bude aplikována tak, aby pacient s individuální mutací dostal takovou terapii, která mu poskytne největší pravděpodobnost úspěšné léčby, v ideálním případě s eradikací mutovaného klonu a návratu do kompletní cytogenetické odpovědi či do velké molekulární odpovědi. Ukazuje se například, že dasatinib může být vhodnou volbou pro pacienty s mutacemi v P-oblasti (např. Y253H) a mutací F359C/V, protože tyto mutace se nejčastěji vyskytují u pacientů rezistentních na nilotinib (15, 16, 25, 31, 36, 37). Oproti tomu u pacientů s mutací F317L/V a V299L je odpověď na dasatinib nepravděpodobná a v těchto případech může být vhodnou volbou nilotinib (15, 16, 24, 33, 36, 37).
Hodnoty kompletních hematologických a cytogenetických odpovědí u jednotlivých mutací podle IC50 koncentrace pro dasatinib uvádí tabulka 2, pro nilotinib tabulka 3.
Tab. 2. Odpověď na dasatinib podle IC50 in vitro u jednotlivých mutací BCR-ABL (24). 
*NR = neuvedeno Tab. 3. Odpověď na nilotinib podle IC<sub>50</sub> <i>in vitro</i> u jednotlivých mutací BCR-ABL (25). 
Ukazuje se také, že podání TKI 2. generace automaticky neznamená vyčerpání možnosti vrátit se k původnímu TKI v první linii. Alespoň v případě dasatinibu, který není chemicky příbuzný s imatinibem, se při rezistenci objevují mutace (kromě T315I), které mohou být citlivé k opětovnému podání imatinibu - mutace T315A a F317L jsou středně citlivé k imatinibu, mutace V299L má IC50 porovnatelnou s nemutovanou formou BCR-ABL (16, 19, 31, 36, 37).
Všechny v současné době používané TKI jsou neúčinné proti mutaci T315I a zdá se, že přežívání pacientů s touto mutací závisí především na tom, zda se ji podaří zachytit co nejdříve (nejlépe ve stadiu molekulární nebo při nejhorším cytogenetické progresi). Tito pacienti budou zřejmě profitovat z alogenní transplantace v případě, že jim to dovolí jejich biologický věk, zdravotní stav a lze včas najít vhodného dárce (36, 37, 42).
U pacientů, kteří nereagují optimálně na terapii imatinibem, by měla být zvážena možnost modifikace či změny terapie ještě předtím, než dojde k progresi do pokročilé fáze CML (36, 37, 43). Proto by nejúčinnější terapie měla být nasazena co nejdříve (36). Nedávno publikovaná studie ukazuje, že 72 % pacientů dosáhlo CCyR, pokud byl dasatinib nasazen při ztrátě MCyR na imatinibu, ale jen 42 %, pokud byl dasatinib nasazen později až při ztrátě jak MCyR, tak CHR. Stejně tak 2leté přežívání bez události (transformace do akcelerované či blastické fáze CML, ztráta CHR či MCyR, zvýšení počtu leukocytů u pacientů bez CHR či úmrtí) bylo vyšší (89 % vs. 29 %), pokud byl lék nasazen dříve (44). Ukazuje se, že pokroky v molekulárních metodách umožňují porozumět lépe podstatě choroby, zvážit prospěch a riziko terapie, individualizovat terapeutický přístup (obr. 5) a umožňují zejména včasnou změnu léčby CML s cílem zabránit hematologické progresi (36, 43, 44).
Obr. 5. Příklad „terapie šité na míru“ u pacientky s chronickou fází CML v průběhu léčby trvající 120 měsíců: od hydroxyurey (HU), přes interferon alfa (IFN), imatinib, opět IFN* v průběhu těhotenství, následně imatinib 400 a 600 mg až po dasatinib 140 mg a 100 mg při objevu mutace Y253H v P-smyčce BCR-ABL (data z ÚHKT). 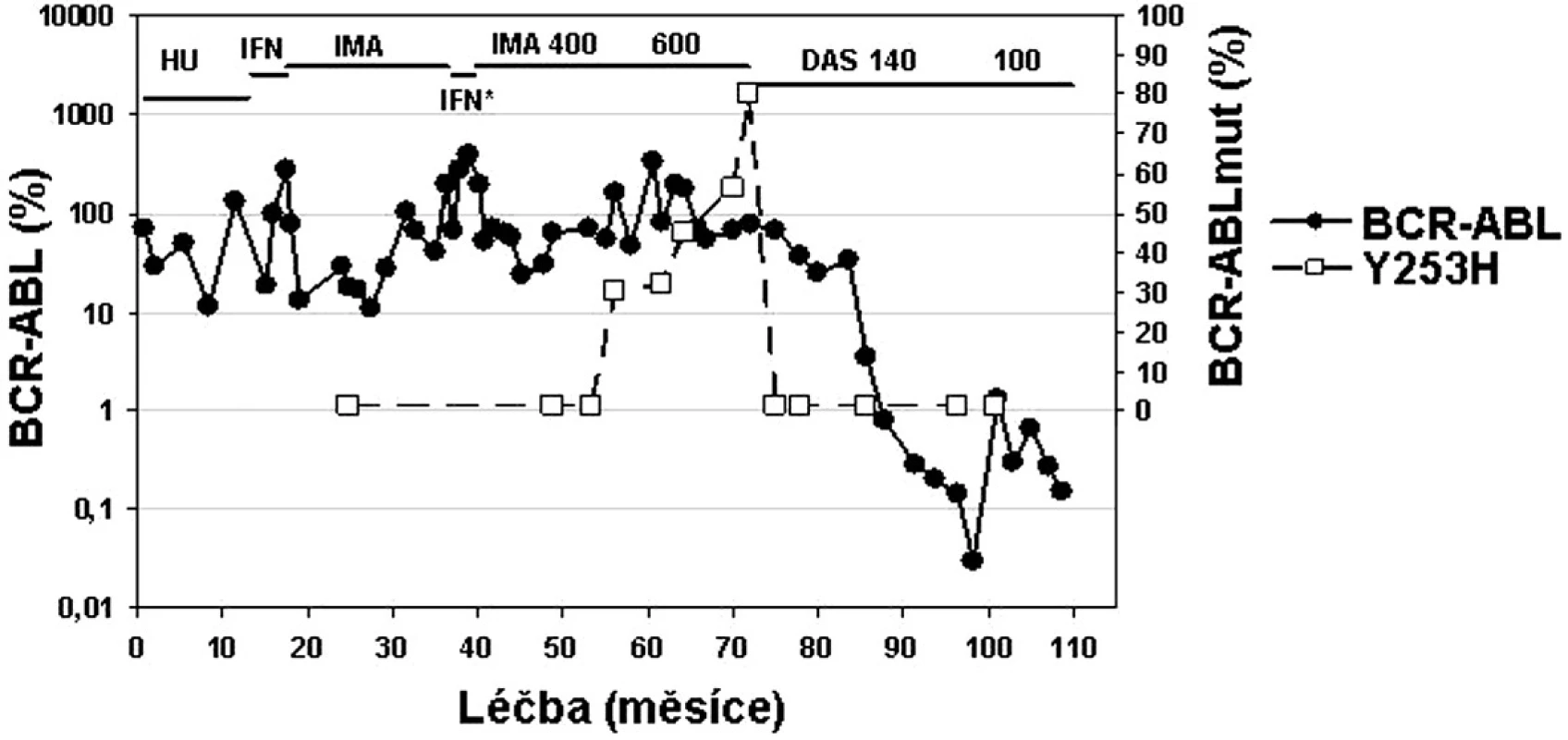
Přispění autorů k článku: MŠ vytvořil publikaci, KMP, HK, JV a JM poskytli klinická data k pacientům, KMP, HK, DŽ, JV, MK, JM a EF analyzovali data a provedli revizi článku.
Seznam použitých zkratek
- AK - aminokyselina
- CCyR - kompletní cytogenetická odpověď
- CHR - kompletní hematologická odpověď
- CML - chronická myeloidní leukemie
- CP-CML - chronická fáze CML
- DAS - dasatinib
- EGFR - receptoru pro epidermání růstový faktor
- ER - estrogenový receptor
- FISH - fluorescence in-situ hybridization
- HER2 - receptor pro lidský epidermální růstový faktor 2
- IFN - interferon alfa
- IMA - imatinib
- KD - kinázová doména
- MCyR - velká cytogenetická odpověď
- MKK - metastatický kolorektální karcinom
- NIL - nilotinib
- Ph - Philadelphia chromozom
- SNP - jednobodový polymorfismus (single nucleotide polymorphism)
- TKI - tyrosinkinázový inhibitor
MUDr. Marek Šťastný, PhD.
Bristol-Myers Squibb Czech Republic
Olivova 4
110 00 Praha 1
e-mail: marek.stastny@bms.com
Zdroje
1. Rawlins MD. Cutting the cost of drug development? Nature Reviews Drug Discovery 3, 360–364.
2. Jensen EV, Jordan VC. The estrogen receptor: a model for molecular medicine. Clin Cancer Res 2003; 9 : 1980–1989.
3. Speirs V, Carder PJ, Lane S, et al. Oestrogen receptor b: what it means for patients with Brest cancer. Lancet Oncol 2004; 5 : 174–181.
4. Hudis CA. Trastuzumab – mechanism of action and use in clinical practice. N Engl J Med 2007; 357 : 39–51.
5. European Medicines Agency. Summary of product characteristics – erbitux. Available at
http://www.emea.europa.eu/humandocs/PDFs/EPAR/erbitux/H-558-PI-en.pdf, accessed Nov 15, 2008.
6. Nowell PC, Hungerford DA. A minute chromosome in human chronic granulocytic leukemia. Science 1960; 132 : 1497.
7. Druker BJ, Sawyers CL, Kantarjian H, et al. Activity of a specific inhibitor of the BCR-ABL tyrosine kinase in the blast crisis of chronic myeloid leukemia and acute lymphoblastic leukemia with the Philadelphia chromosome. N Engl J Med 2001; 344 : 1038–1042.
8. O’Brien SG, Guilhot F, Larson RA, et al. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed CP-CML. N Engl J Med 2003; 348 : 994–1004.
9. Baccarani M, Saglio G, Goldman J, et al. European Leukemia Net. Evolving concepts in the management of chronic myeloid leukemia: recommendations from an expert panel on behalf of the European Leukemia Net Blood 2006; 108 : 1809–1820.
10. Druker BJ, Guilhot F, O’Brien SG, et al. Five-year follow; up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med 2006; 355 : 2408–2417.
11. Apperley J. Part I: Mechanisms of resistance to imatinib in chronic myeloid leukaemia. Lancet Oncol 2007; 8 : 1018–1029.
12. Shah NP, Nicoll JM, Nagar B, et al. Multiple BCR-ABL kinase domain mutations confer polyclonal resistance to the tyroxine kinase inhibitor imatinib (STI571) in chronic phase and blast crisis chronic myeloid leukemia. Cancer Cell 2002; 2 : 117–25.
13. Deininger MWN. Optimizing therapy of chronic myeloid leukemia. Experimental Hematol 2007; 35 : 144–154.
14. Branford S, Rudzki Z, Walsh S, et al. Detection of BCR-ABL mutations in patients with CML treated with imatinib is virtually always accompanied by clinical resistance, and mutations in the ATP phosphate-binding loop (P-loop) are associated with a poor prognosis. Blood 2003; 102 : 276–283.
15. Cang S, Liu D. P-loop mutations and novel therapeutic approaches for imatinib failures in chronic myeloid leukemia. J Hematol Oncol 2008; 1 : 15.
16. O’Hare T, Walter DK, Stoffregen EP, et al. In vitro Activity of BCR-ABL inhibitors AMN107 and BMS-354825 against clinically relevant imatinib-resistant Abl kinase domain mutants. Cancer Res 2005; 65 : 4500–4505.
17. Baccarani M, Pane F, Saglio G. Monitoring treatment of chronic myeloid leukemia. Haematologica 2008; 93 : 161–169.
18. Redaelli S, Piazza R, Rostagno R, et al. Activity of bosutinib, dasatinib, and nilotinib against 18 imatinib-resistant BCR/ABL mutants. J Clin Oncol 2009; 27 : 469–471.
19. Guidelines for mutation analysis of BCR/ABL kinase domain: interpreting TKI-resistance mutations in CML patients. West Midlands Regional Genetics Laboratory. (http://www.bwhct.nhs.uk/regionalgenetics/downloads/TKI%20Sensitivities%20Final.pdf)
20. Crossman LC, O’Hare T, Lange T, et al. A single nucleotide polymorphism in the coding region of ABL and its effects on sensitivity to imatinib. Leukemia 2005; 19 : 1859–1862.
21. National Comprehensive Cancer Network Clinical Practice Guidelines in Oncology. CML v2.2009. http://www.nccn.org/professionals/physician_gls/PDF/cml.pdf.Accessed February 9, 2009.
22. Kantarjian H, Pasquini R, Hamerschlak N, et al. Dasatinib or high-dose imatinib for chronic-phase chronic myeloid leukemia after failure of first-line imatinib: a randomized phase 2 trial. Blood 2007; 109 : 5143–5150.
23. Rousselot PH, Facon T, Paquette R, et al. Dasatinib or high-dose imatinib for patients with chronic myelogenous leukemia chronic-phase (CML-CP) resistant to standard-dose imatinib: 2-year follow-up data from START-R. J Clin Oncol 2008; 26(suppl): abstract 7012.
24. Müller MC, Cortes J, Kim DW, et al. Dasatinib efficacy in patients with chronic myeloid leukemia in chronic phase (CML-CP) and pre-existing BCR-ABL mutations. Blood (ASH Annual Meeting Abstracts), Nov 2008; 112: abstract 449.
25. Kantarjian HM, Giles F, Gattermann N, et al. Nilotinib (formerly AMN107), a highly selective BCR-ABL tyrosine kinase inhibitor, is effective in patients with Philadelphia chromosome positive chronic myelogenous leukemia in chronic phase following imatinib resistance and intolerance. Blood 2007; 110 : 3540–3546.
26. Hughes T, Saglio G, Martinelli G, et al. Responses and disease progression in CML-CP patients treated with nilotinib after imatinib failure appear to be affected by the BCR-ABL mutation status and types. Blood (ASH Annual Meeting Abstracts) 2007; 110: Abstract 320.
27. Nicolini FE, Corm S, Lź QH, et al. Mutation status and clinical outcome of 89 imatinib mesylate-resistant chronic myelogenous leukemia patients: a retrospective analysis from the French intergroup of CML (Fi(phi)-LMC GROUP). Leukemia 2006; 20 : 1061–1066.
28. Jabbour E, Kantarjian H, Jones D, et al. Frequency and clinical and significance of BCR-ABL mutations in patients with chronic myeloid leukemia treated with imatinib mesylate. Leukemia 2006; 20 : 1767–1773.
29. Khorashad JS, de Lavallade H, Apperley JF, et al. Finding of kinase domain mutations in patients with chronic phase chronic myeloid leukemia responding to imatinib may identify those at high risk of disease progression. J Clin Oncol 2008; 26 : 4806–4813.
30. Griswold IJ, MacPartlin M, Bumm T, et al. Kinase domain mutants of BCR-ABL exhibit altered transformation potency, kinase activity, and substrate utilization, irrespective of sensitivity to imatinib. Mol Cell Biol 2006; 26 : 6082–6093.
31. Jabbour E, Cortes JE, Kantarjian HM. Suboptimal response to or failure of imatinib treatment for chronic myeloid leukemia: what is the optimal strategy? Mayo Clin Proc. 2009; 84 : 161–169.
32. Hochhaus A, Kim DW, Martinelli G, et al. Nilotinib efficacy according to baseline BCR-ABL mutations in patients with imatinib-resistant chronic myeloid leukemia in chronic phase (CML-CP). Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 3216.
33. Deininger MW, Mauro MJ, Matloub Y, et al. Prevalence of T315I, dasatinib-specific resistant mutations (F317L, V299L, and T315A), and nilotinib-specific resistant mutations (P-loop and F359) at the time of imatinib resistance in chronic-phase chronic myeloid leukemia (CP-CML). Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 3236.
34. Jarkowski A and Sweeney RP. Nilotinib: A new tyrosine kinase inhibitor for the treatment of chronic myeloid leukemia. Pharmacotherapy 2008; 28 : 1374–1382.
35. Hochhaus A, Kantarjian HM, Baccarani M, et al. Dasatinib induces notable hematologic and cytogenetic responses in chronic-phase chronic myeloid leukemia after failure of imatinib therapy. Blood 2007; 109 : 2303–2309.
36. Mauro MJ. Tailoring tyrosine kinase inhibitor therapy in chronic myeloid leukemia. Cancer Control 2009; 16 : 108–121.
37. Jabbour E, Cortes J, Kantarjian HM. Treatment selection after imatinib resistance in chronic myeloid leukemia. Targ Oncol 2009; 4 : 3–10.
38. Yamamoto M, Kurosu T, Kakihana K, et al. The two major imatinib resistance mutations E255K and T315I enhance the activity of BCR/ABL fusion kinase. Biochem Biosphys Res Commun 2004; 319 : 1272–1275.
39. Nicolini FE, Hayette S, Corm S, etal. Clinical outcome of 27 imatinib mesylate-resistant chronic myelogenous leukemia patients harboring a T315I BCR-ABL mutation. Haematologica 2007; 92 : 1238–1241.
40. Jabbour E, Kantarjian H, Jones D, et al. Characteristics and outcomes of patients with chronic myeloid leukemia and T315I mutation following failure of imatinib mesylate therapy. Blood 2008; 112 : 53–55.
41. Giles FJ, Cortes JE, Jones D, et al. MK-0457, a novel kinase inhibitor, is active in patients with chronic myeloid leukemia or acute lymphocytic leukemia with the T315I BCR-ABL mutation. Blood 2007; 109 : 500–502.
42. Miething C, Mugler C, Grundler R, et al. Phosphorylation of tyrosine 393 in the kinase domain of BCR-ABL influences the sensitivity towards imatinib in vivo. Leukemia 2003; 17 : 1695–1699.
43. Marin D, Milojkovic D, Olavarria E, et al. European LeukemiaNet criteria for failure or sub-optimal response reliably identify patients with CML in early chronic phase treated with imatinib whose eventual outcome is poor. Blood 2008; 112 : 4437–4444.
44. Quintás-Cardama A, Cortes JE, O’Brien S, et al. Dasatinib early intervention after cytogenetic or hematologic resistance to imatinib in patients with chronic myeloid leukemia. Cancer 2009; Apr 28. [Epub ahead of print].
45. Gontarewicz A, Balabanov S, Keller G, et al. Simultaneous targeting of Aurora kinases and Bcr-Abl kinase by the small molecule inhibitor PHA-739358 is effective against imatinib-resistant BCR-ABL mutations including T315I. Blood 2008; 111 : 4355–64.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2010 Číslo 1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2010_06 ze dne 1. 3. 2010 verze 2 (2010_04)
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Úvod
- Vzpomínka na prof. James R. McArthura, M.D., čestného člena České hematologické společnosti ČLS JEP
- „Nová protinádorová léčiva a léčebné strategie v onkologii“ autorů prof. MUDr. P. Klenera, DrSc. a MUDr. P. Klenera jr., Ph.D.
- Methotrexate /6-mercaptopurine maintenance therapy influences the risk of a second malignant neoplasm after childhood acute lymphoblastic leukemia: results from the NOPHO ALL – 92 study
- The spectrum of Evans syndrome in adults: new insight into the disease based on the analysis of 68 cases
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



