-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
News in classification of MDS and evaluation of prognosis by WPSS
Myelodysplastic syndromes represent a heterogenous group of clonal hematopoietic disorders. Accurate classification and prediction of survival are essential for selection of optimal therapy. The WHO classification-based prognostic scoring system permits more useful dynamic estimation of survival and risk of AML transformation in individual patients not only at the time of diagnosis but also throughout the course of their disease.
Key words:
myelodysplastic syndrome, classification
Autori: M. Žídková; J. Voglová; P. Bělohlávková; F. Vrbacký
Pôsobisko autorov: II. interní klinika- oddělení klinické hematologie, Fakultní nemocnice Hradec Králové a LF UK
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 1, p. 42-46.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Myelodysplastický syndrom představuje heterogenní skupinu klonálních hematopoetických onemocnění. Pro optimální léčbu je důležitá správná klasifikace a určení prognózy. Na WHO klasifikaci založený prognostický skórovací systém slouží k přesnějšímu odhadu mediánu celkového přežití a progrese do akutní myeloidní leukemie nejen v době stanovení diagnózy, ale také v celém dalším průběhu onemocnění.
Klíčová slova:
myelodysplastický syndrom, klasifikaceÚvod
Myelodysplastický syndrom (MDS) je skupina heterogenních klonálních hematopoetických onemocnění, charakterizovaná postupným selháním kostní dřeně s neefektivní hematopoézou, morfologickou dysplazií a zvýšenou pravděpodobností vzniku akutní myeloidní leukemie (AML) (1, 2). MDS se dělí na primární, de novo vzniklý a sekundární, např. po léčbě cytostatiky. Incidence MDS narůstá s věkem. Jednotlivé jednotky se mezi sebou statisticky významně liší mediánem celkového přežití a pravděpodobností vývoje v akutní leukemii, proto správná klasifikace a určení prognózy je stěžejní ke zvolení optimálního terapeutického postupu.
Klasifikace MDS
Nejznámější a doposud mnohými lékaři stále používaná je FAB klasifikace (Francouzko-Americko-Britská) z roku 1982 viz tabulka 1.
Tab. 1. FAB klasifikace. 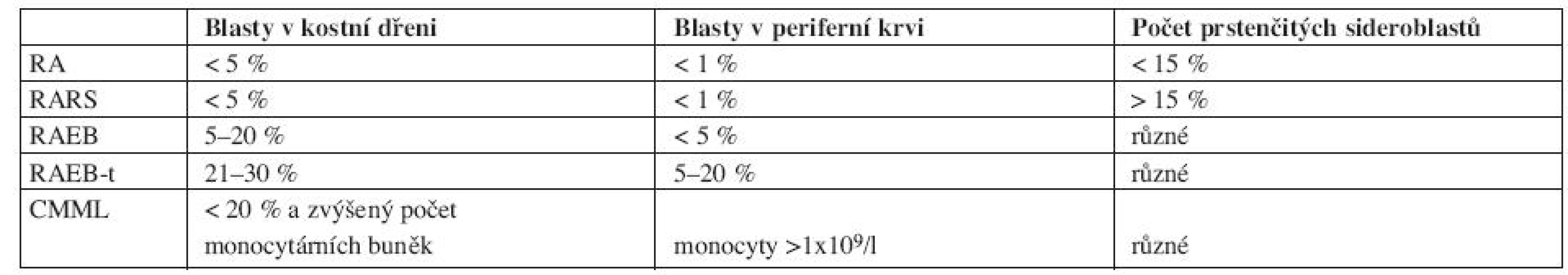
Vysvětlivky: RA- refrakterní anémie, RARS-refrakterní anémie s prstenčitými sideroblasty, RAEB-refrakterní anémie s nadbytkem blastů, RAEBt-refrakterní anémie s nadbytkem blastů v transformaci, CMML- chronická myelomonocytární leukemie. FAB klasifikace rozděluje MDS do pěti subtypů na základě procenta blastů v periferní krvi, kostní dřeni a procenta prstenčitých sideroblastů. Nevýhodou FAB klasifikace je, že i v rámci jednoho subtypu obsahuje heterogenní jednotky, které se od sebe statisticky významně liší mediánem celkového přežití a pravděpodobností vývoje do akutní leukemie. To je dáno zejména tím, že FAB klasifikace nerozlišuje počet jednotlivých dysplastických linií a uvnitř jednotlivých subtypů je široké rozmezí blastů, zejména pak ve skupině RAEB. Novější je klasifikace z roku 2002, tzv. WHO klasifikace (World Health Organization), viz tabulka 2.
Tab. 2. WHO klasifikace (Vardiman, 2002). 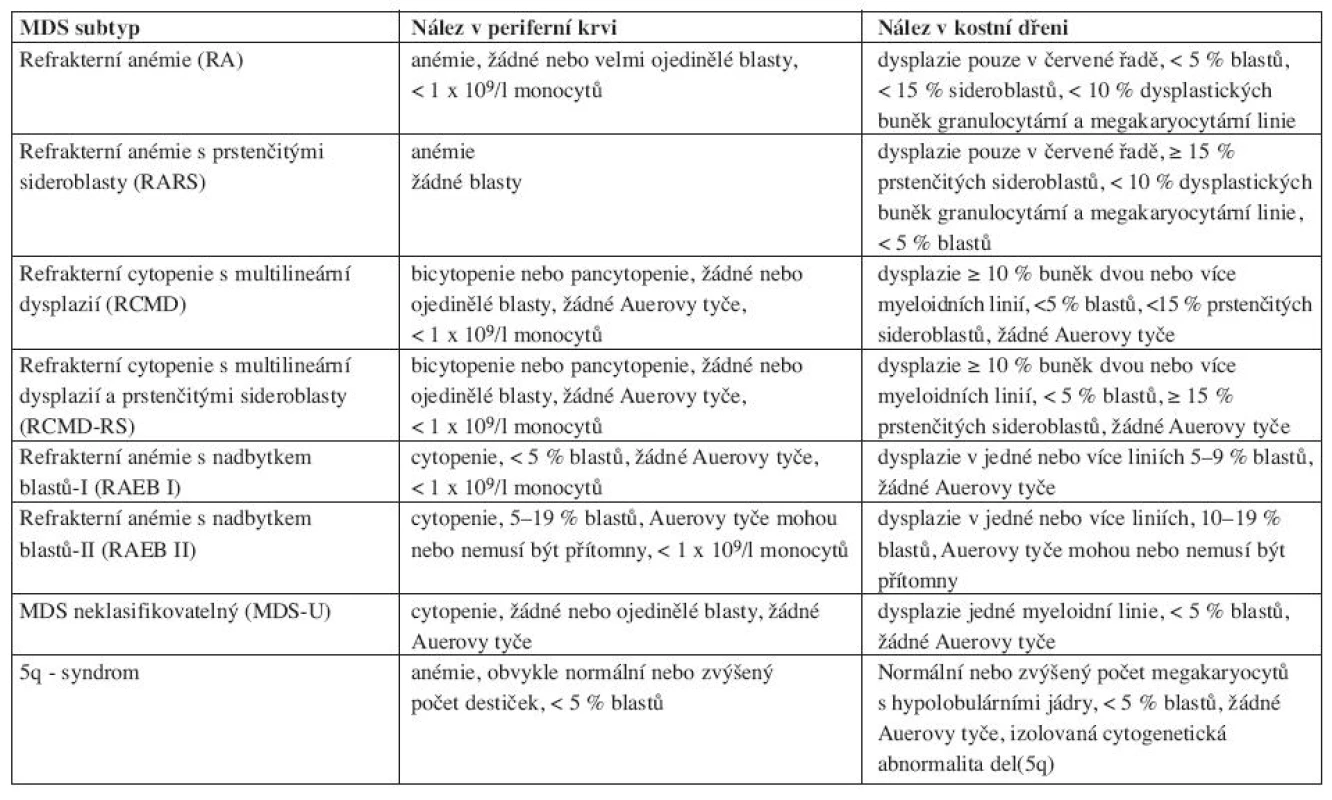
WHO klasifikace již rozlišuje dysplazie v jedné či více myeloidních řadách. Ve skupině onemocnění RAEB rozlišuje na základě procenta blastů v kostní dřeni typ RAEB I a RAEB II. WHO klasifikace MDS má nižší kritérium pro počet blastů v kostní dřeni, které již splňují podmínky pro vznik akutní myeloidní leukemie a to 20 % versus 30 % (dle FAB), proto vypouští jednotku RAEBt, která již dle WHO klasifikace splňuje kritéria pro akutní myeloidní leukemii. Dále je chronická myelomonocytární leukemie (CMML) nově zařazena mezi překryvné (overlap) myelodysplastické-myeloproliferativní stavy. CMML se dříve rozdělovala na myelodysplastický a myeloproliferativní podtyp, kdy hranicí byl počet leukocytů 13 x 109/l. Vzhledem k tomu, že nejdůležitějším prognostickým faktorem pro celkové přežití je považován počet blastů v kostní dřeni a periferní krvi, dělí se nyní CMML na CMML-1 s počtem blastů pod 5 % v periferní krvi a pod 10% v kostní dřeni a na CMML-2 s počtem blastů v periferní krvi 5–19 % a v kostní dřeni 10–19 %. Nově je ve WHO klasifikaci zařazen MDS neklasifikovatelný a tzv. 5q minus syndrom (5q-syndrom).
5q - syndrom
5q - syndrom je jediná podjednotka MDS charakterizovaná pomocí cytogenetiky a to izolovanou delecí dlouhého raménka chromozomu 5 v místě 5q31-q32. V kostní dřeni u 5q - syndromu je přítomno pod 5 % blastů, typická dysmegakaryopoéza s hypolobulárními jádry (viz obr. 1) a makrocytární anémie v periferní krvi.
Obr. 1. Hypolobulární megakaryocyt u 5q minus syndromu. 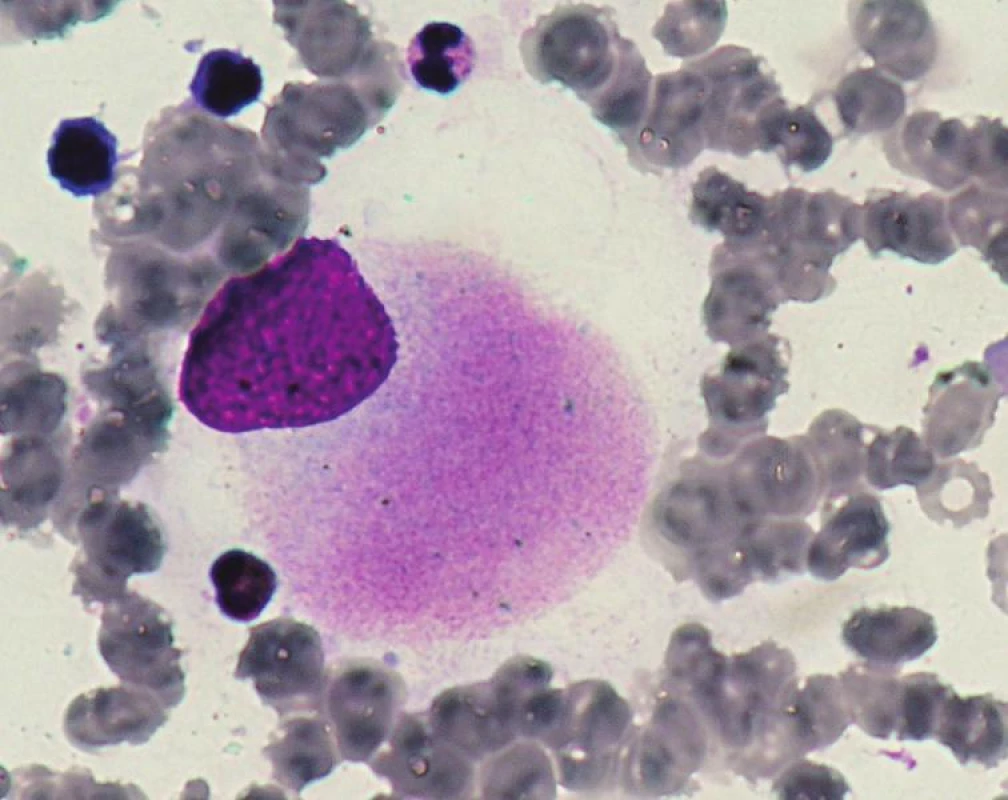
Pacienti mají velmi dobrou prognózu, medián přežití je 145 měsíců a jen 10 % progreduje do AML. Avšak často mívají závažnou makrocytární anémii, v jejíž léčbě se v poslední době uplatňuje lenalidomid (chorobu modifikující lék, používaný v terapii mnohočetného myelomu) (8, 17). V rámci 5q - syndromu byla provedena analýza deletovaného segmentu, bez nálezu mutovaného genu, a proto se předpokládá, že právě haploinsuficience některého genu v tomto úseku by mohla hrát roli. V tomto úseku se nacházejí mimo jiné dva kandidátní geny a to SPARC a RPS14. SPARC je tumor-supresor účastnící se regulace vazby buňky na extracelulární matrix, kterou negativně ovlivňuje. Zároveň však negativně ovlivňuje i buněčnou proliferaci, angiogenezi a působí proapoptoticky. Haploinsuficience genu SPARC tak může napomáhat zvýšené adhezi maligního klonu k podpůrným buňkám stromatu a usnadňovat proliferaci maligního klonu. Gen RPS14 kóduje jeden z proteinů malé podjednotky ribozomů, jehož haploinsuficience blokuje vyzrávání erytroidních prekurzorů. Společně se tyto změny mohou významně podílet na klinickém obrazu 5q - syndromu (4).
WHO klasifikace 2008
Nová WHO klasifikace MDS z roku 2008 již rozlišuje ve skupině refrakterních cytopenií jednotlivé dysplastické linie a vytváří tak novou jednotku – refrakterní cytopenie s dysplazií v jedné řadě, kam spadá refrakterní anémie, refrakterní neutropenie a refrakterní trombocytopenie (20). Pro tuto diagnózu je nutno 10 a více procent dysplastických buněk v jedné z myeloidních linií v kostní dřeni a cytopenie v jedné nebo dvou řadách (ale ne pancytopenie) v periferní krvi. Případy s refrakterní neutropenií a refrakterní trombocytopenií byly dle starší WHO klasifikace řazeny mezi MDS neklasifikovatelný. Ve skupině refrakterních anémií s nadbytkem blastů přítomnost Auerových tyčí dle WHO 2008 zařazuje jednotku do více pokročilé skupiny RAEBII bez ohledu na procento blastů v kostní dřeni či periferní krvi. Ve skupině refrakterní cytopenie s multilineární dysplazií se již dále nerozlišuje, zda jsou přítomny či chybí prstenčité sideroblasty. MDS neklasifikovatelný podle WHO 2008 zahrnuje pacienty s pancytopenií a dysplazií v jedné řadě. Pod MDS neklasifikovatelný patří i pacienti s dysplazií pod 10 % v jedné či více myeloidních řadách a cytogenetickým nálezem, který je považován za předpokládaný důkaz pro přítomnost MDS (tab. 3 (19, 20)). Dále 5q - syndrom je nově přejmenován na MDS s izolovanou delecí 5q (tab. 4 (7, 18)).
Tab. 3. Chromozomální abnormality považované za předpokládaný důkaz MDS za podmínek cytopenie a chybění dostatečných morfologických znaků pro diagnózu MDS. 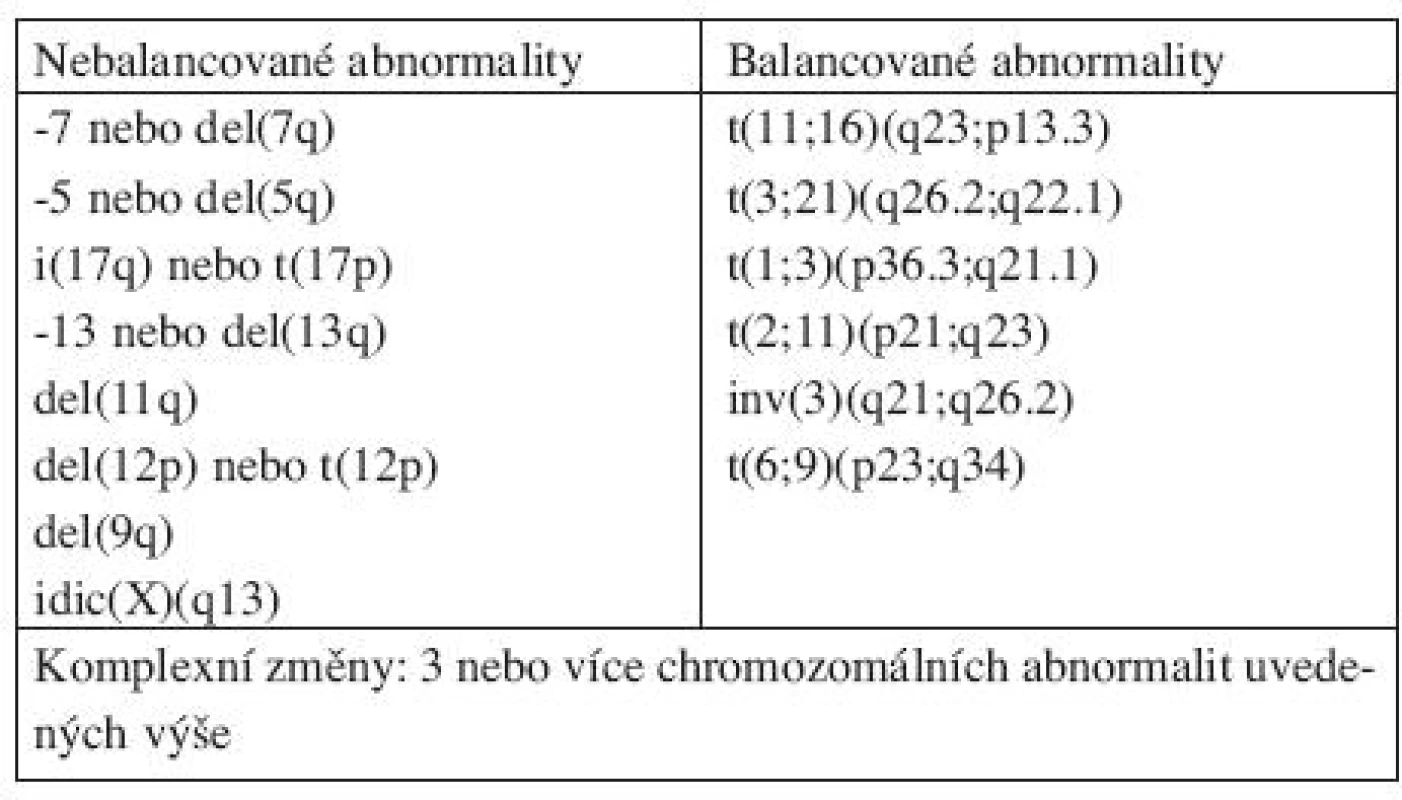
Tab. 4. WHO klasifikace 2008. 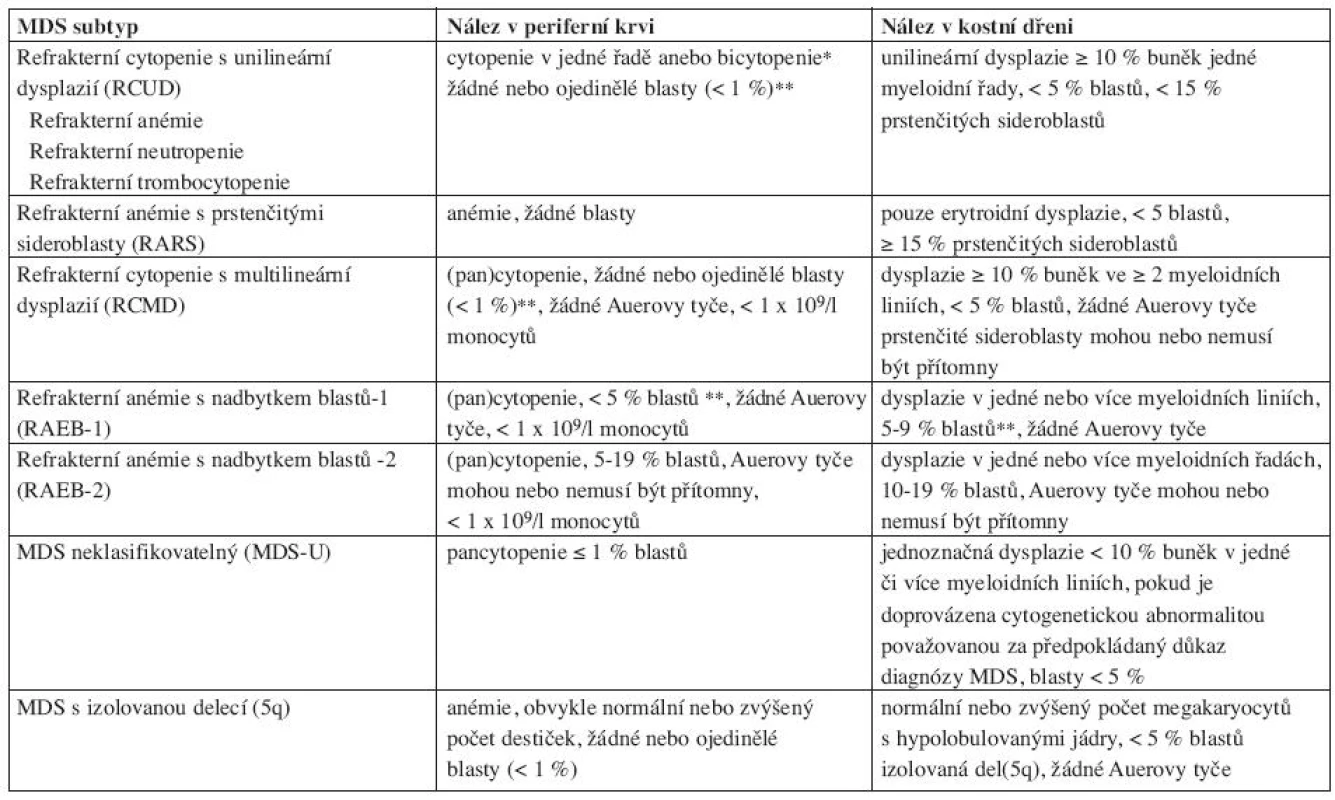
*bicytopenie může být příležitostně pozorována, případy s pancytopenií by se měly klasifikovat jako MDS-U. **jestliže jsou blasty ve dřeni pod 5 %, ale je přítomno 2–4 % blastů v periferní krvi, jde o RAEB-1. Jednotky RCUD a RCMD s 1% blastů v periferní krvi by se měly klasifikovat jako MDS-U. pokud je < 5 % blastů v periferní krvi a méně jak 10 % blastů ve dřeni a jsou přítomny Auerovy tyče, jednotka by se měla zařadit pod RAEB-2. Ačkoliv přítomnost 5–19 % blastů v periferní krvi odpovídá RAEB-2, případy RAEB-2 mohou mít < 5 % blastů v periferní krvi, pokud jsou přítomny Auerovy tyče anebo 10 %-19 % blastů ve dřeni. Podobně případy RAEB-2 mohou mít < 10 % blastů v kostní dřeni, jestliže je přítomno 5–19 % blastů v periferní krvi anebo Auerovy tyče. Ve skupině překryvných MDS/MPD syndromů v podjednotce refrakterní anémie s prstenčitými sideroblasty a významnou trombocytózou (RARST) snižuje WHO 2008 práh počtu trombocytů z 600 na 450x109 /l. U této jednotky byl také v přibližně 50 % případů zjištěn výskyt mutace V617F kinázy JAK2, což podtrhuje její částečný myeloproliferativní původ (7, 9–13). Rozdělení chronické myelomonocytární leukemie na CMML-1 a CMML-2 zůstává zachováno. Termín myeloproliferativní onemocnění byl nahrazen termínem myeloproliferativní neoplazie (19).
Určení prognózy, IPSS, WPSS
Pro správné určení rizika a zvolení optimální léčebné strategie je klíčový prognostický skórovací systém. V minulosti nepříliš rozšířené byly např. Bournemouth, Spanish, Düsseldorf nebo Lille skóre (5). Doposud používaným ,,zlatým standardem“ se stal až International Prognostic Scoring System (IPSS) z roku 1997 (6). IPSS vychází z FAB klasifikace a rozlišuje pacienty podle procenta blastů v kostní dřeni, počtu dysplastických linií a karyotypu do čtyř rizikových skupin, které se mezi sebou statisticky významně liší mediánem celkového přežití a vývoje v AML (tab. 5 a 6).
Tab. 5. IPSS (International Prognostic Scoring System). 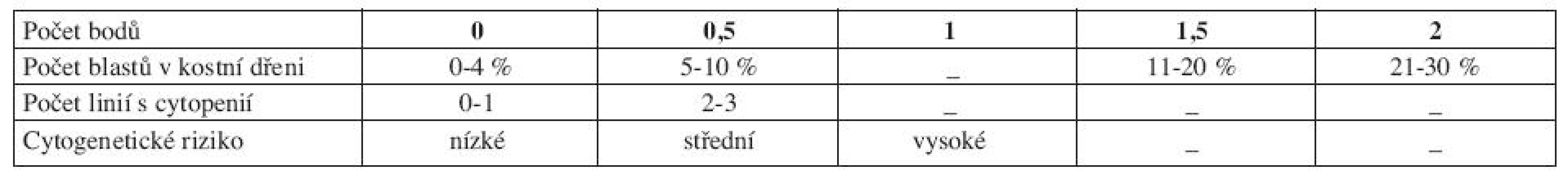
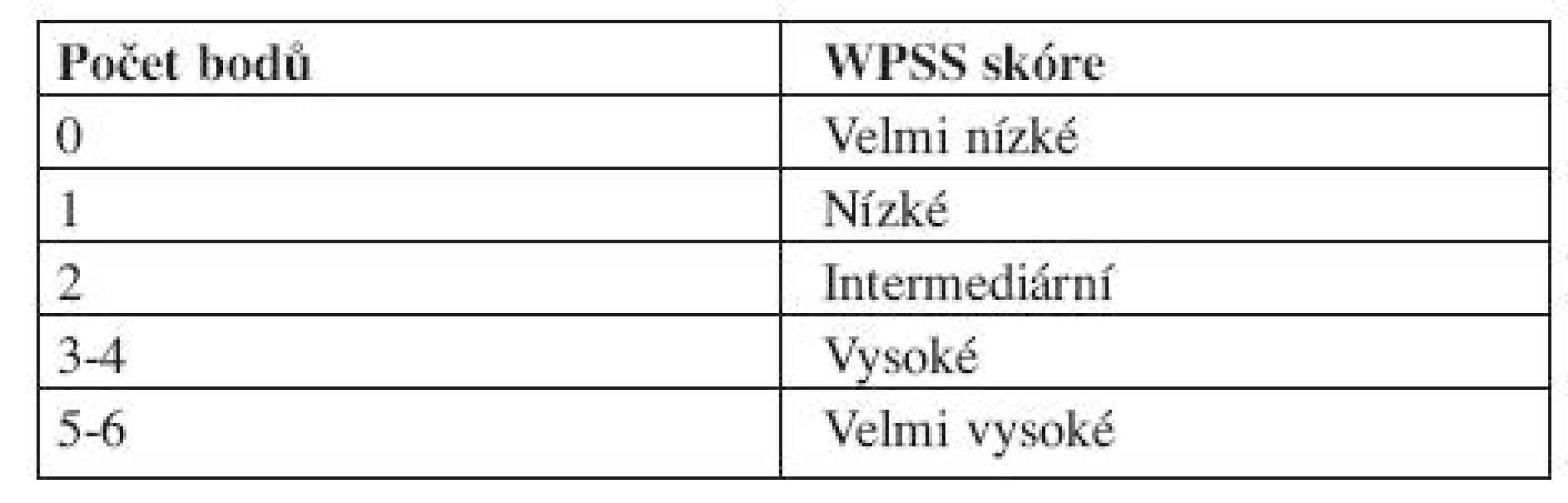
Vysvětlivky: Cytopenie: hemoglobin < 100 g/l; neutrofily < 1,8 x 109/l, trombocyty < 100 x 109/l Cytogenetické riziko: nízké - normální karyotyp, izolovaná delece chromozomuY, izolovaná del(5q), izolovaná del(20q) střední - abnormality jiné, než v ostatních kategoriích vysoké - komplexní změny (3 a více změn), abnormality chromozomu 7 Výpočet rizika dle IPSS - součet jednotlivých bodů ve třech položkách IPSS však hodnotí riziko a medián přežití pouze v čase stanovení diagnózy, nerespektuje progresi choroby, což mnohdy znesnadňuje rozhodování ohledně další léčebné strategie. IPSS je založen na FAB klasifikaci, což v současné době s platnou WHO klasifikací poněkud ztrácí na významu. Z toho důvodu vytvořil Luca Malcovati a spol. dynamický prognostický skórovací systém – tzv. WHO Classification Based Prognostic Scoring System, na WHO klasifikaci založený prognostický systém (WPSS). WPSS vychází z retrospektivní studie, která si kladla za cíl nalézt nejvýznamnější prognostické faktory pro MDS a to nejen v čase stanovení diagnózy, ale také v průběhu choroby a vytvořit tak dynamický skórovací systém k předpovědi rizika pro MDS v libovolném časovém bodě (3). Ve studii byly zahrnuty dvě kohorty pacientů, italská skupina de novo diagnostikovaných MDS pacientů (426 pacientů), na které byly rizikové faktory stanoveny a německá validační skupina 739 de novo diagnostikovaných MDS pacientů, na které byly rizikové faktory validovány. Diagnóza MDS byla překlasifikována dle WHO klasifikace z roku 2002. Data se sbírala nejen v době stanovení diagnózy, ale u určitého počtu pacientů také opakovaně v průběhu onemocnění. Na základě opakovaných odběrů dat se WPSS riziko v čase měnilo v 55 % případů pro změnu ve WHO klasifikaci, v 11 % pro změnu cytogenetického rizika a v 30 % pro závislost na krevních transfuzích (3). Tato retrospektivní analýza, uveřejněná v roce 2007, označila, že mezi nejvýznamnější rizikové faktory patří WHO klasifikace, karyotyp a počet transfuzí erytrocytů (tab. 7 a 8 (3)).
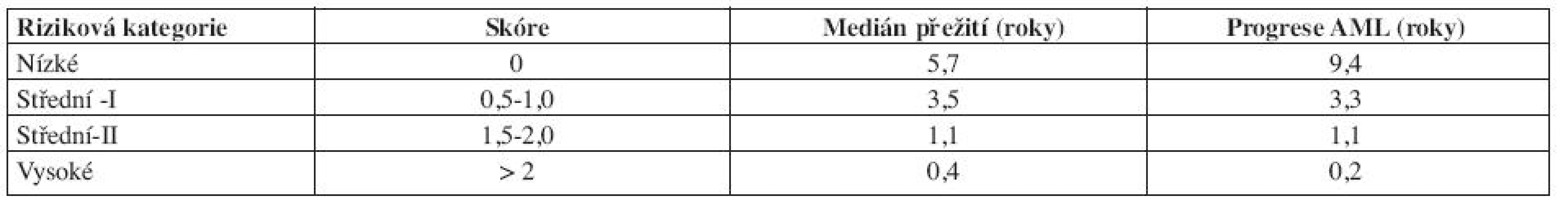
Tab. 7. WHO Classification-Based Prognostic Scoring System, WPSS. 
Vysvětlivky: Cytogenetické riziko: nízké - normální karyoryp, izolovaná delece chromozomuY, izolovaná del(5q), izolovaná del(20q) střední - abnormality jiné, než v ostatních kategoriích vysoké - komplexní změny (3 a více změn), abnormality chromozomu 7 Potřeba transfuzí: alespoň jedna transfuze erytrocytů každých 8 týdnů v průběhu 4 měsíců. Výpočet rizika dle WPSS- součet jednotlivých bodů všech tří položek. Počet transfuzí odráží závažnější stupeň anémie a tím i agresivnější průběh choroby, statisticky významně snižuje celkové přežití a zvyšuje riziko vývoje v akutní leukemii (16). V průběhu onemocnění se však projevuje nežádoucí efekt přetížení železem. Nejpodstatněji je potřeba transfuzí jako negativní rizikový faktor vyjádřena u nízkého rizika (3). Dle WPSS skóre jsou pacienti rozděleni do pěti prognostických skupin (tab. 9). Obě skupiny pacientů (italská a německá) se mezi sebou statisticky významně nelišily. WPSS je tak dynamický skórovací systém, který umožňuje odhadnout riziko nejen v době stanovení diagnózy, ale také v průběhu choroby. Pacienti zůstávají v určitém riziku tak dlouho, jak dlouho je jejich onemocnění stabilní. Pokud dojde k progresi choroby a splní kritéria pro rizikovější skupinu, přesunou se do této skupiny a medián přežití i pravděpodobnost vývoje v AML odpovídá nově určenému riziku (3, 14). Dále bylo zjištěno, že u pacientů s velmi nízkým rizikem, se délka celkového přežití statisticky významně neliší od běžné populace, proto tito pacienti profitují z odložení terapie do doby, než splní kritéria přeřazení do více rizikové skupiny (3).
Tab. 9. Medián celkového přežití a pravděpodobnost progrese do AML dle WPSS. 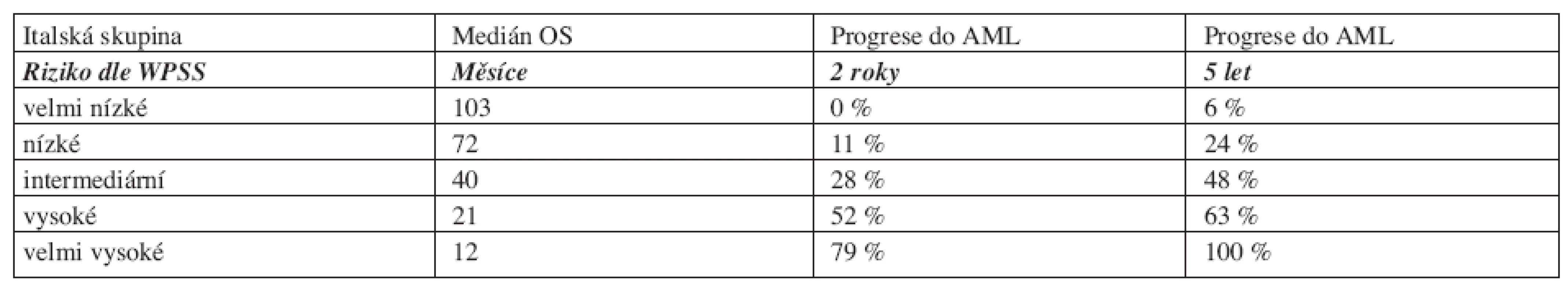
Závěr
V součastné době by měl být MDS syndrom zařazený dle WHO klasifikace a zhodnocena příslušná riziková skupina. Jen tak lze správně zvolit optimální léčebnou strategii. WPSS přestavuje dynamický skórovací systém, sloužící k přesnějšímu odhadu rizika a zvolení léčebného postupu (3, 15).
MUDr. Marie Žídková
Oddělení klinické hematologie
Fakultní nemocnice v Hradci Králové
Sokolská 581
500 05 Hradec Králové
e-mail: marie.zidkova@post.cz
Zdroje
1. Malcovati L, Nimer S. Myelodysplastic syndromes: diagnosis and staging. C Cont 2008; 15 : 4–13.
2. Mufti GJ, Bennet JM, Goasguen J, et al. Diagnosis and classification of myelodysplastic syndrome: International Working Group on Morphology of myelodysplastic syndrome (IWGM-MDS) consensus proposals for the definition and enumeration of myeloblasts and ring sideroblasts. Haematol 2008; 93 : 1712–1717.
3. Malcovati L, Germing U, Kuendgen A, et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25 : 3503–3510.
4. Jädersten M, Hellström-Lindberg E. Myelodysplastic syndromes: biology and treatment. J Int Med 2008; 265 : 307–322.
5. Muller-Berndorf H, Hass PS, Kunzmann R, et al. Comparison of five prognostic scoring systems, the FAB and WHO classifications in patients with myelodysplastic syndromes: results of a single-center analysis. Ann Hematol 2006; 85 : 502–513.
6. Greenberg P, Cox C, LeBeau M, et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079–2088.
7. Hellström-Lindberg E, Cazzola M. The role of JAK2 mutations in RARS and other MDS. Hematology Am Soc Hematol Educ Program 2008 : 52–59.
8. Mufti GJ, Chen TL. Changing the treatment paradigm in myelodysplastic syndromes. C Cont 2008; 15(Suppl. 4): 14–27.
9. Szpurka H,Tiu R, Murugesan G, et al. Refractory anemia with ringed sideroblasts associated with marked thrombocytosis (RARS-T), another myeloproliferative condition characterized by JAK2 V617F mutation. Blood 2006; 108 : 2173–2181.
10. Schmitt-Graeff A, Teo SS, Olschewski M, et al. Jak2 V617F mutation status identifies subtypes of refractory anemia with ringed sideroblasts associated with marked thrombocytosis. Haematol 2008; 93 : 34–40.
11. Malcovati L, Cazzola M. Myelodysplastic/myeloproliferative disorders. Haematol 2008; 9 : 4–6.
12. Remacha AF, Nomdedeu JF, Puget G, et al. Occurrence of the JAK2 V617F mutation in the WHO provisional entity: myelodysplastic/myeloproliferative disease, unclassifiable–refractory anemia with ringed sideroblasts associated with marked thrombocytosis. Haematol 2006; 91 : 719–720.
13. Steensma DP, Caudill JSC, Pardanani A, et al. MPL W515 and JAK2 V617 mutation analysis in patients with refractory anemia with ringed sideroblasts and an elevated platelet count. Haematol 2006; 91 : 155–156.
14. Breccia M, Cannella L, Stefanizzi C, et al. WPSS versus simplified myelodysplastic syndrome risk score: Which is the best tool for prediction of survival in myelodysplastic patients? Leukemia Res 2008; 33 : 93–94.
15. Alessandrino EP, Della Porta MG, Bacigalupo A, et al. WHO classification and WPSS predict post-transplant outcome in patients with myelodysplastic syndrome: a study from the Gruppo Italiano Trapianto di Midollo Osseo (GITMO). Blood 2008; 112 : 895–902.
16. Malcovati L, Della Porta MG, Cazzola M. Predicting survival and leukemic evolution in patients with myelodysplastic syndrome. Haematol 2006; 91 : 1588–1590.
17. Nimer SD. Myelodysplastic syndromes. Blood 2008; 111 : 4841–4851.
18. Brunning RD, Orazi A, Germing U, et al. Myelodysplastic syndromes. In: Swerdlow SH, Campo E, Harris NL, et al.WHO classification of tumours of haematopoietic and lymphoid tissues. 4th edition. Lyon, IARC, 2008; 87–103.
19. Bennett JM. Myelodysplastic syndromes: update on classification. Leukemia Res 2009; 3: S6–S8.
20. Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood 2009; 114 : 937–951.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2010 Číslo 1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2010_06 ze dne 1. 3. 2010 verze 2 (2010_04)
- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Analýza absolutního počtu lymfocytů a dalších faktorů ovlivňujících přežívání pacientů s Hodgkinovým lymfomem po autologní transplantaci periferních kmenových buněk
- Koncentrace hepatocytárního růstového faktoru a trombospondinu predikuje léčebnou odpověď u pacientů s mnohočetným myelomem
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Analýza mutací BCR-ABL u CML pacientů rezistentních k imatinibu umožňuje poskytnout „terapii šitou na míru“
- Úvod
- Vzpomínka na prof. James R. McArthura, M.D., čestného člena České hematologické společnosti ČLS JEP
- „Nová protinádorová léčiva a léčebné strategie v onkologii“ autorů prof. MUDr. P. Klenera, DrSc. a MUDr. P. Klenera jr., Ph.D.
- Methotrexate /6-mercaptopurine maintenance therapy influences the risk of a second malignant neoplasm after childhood acute lymphoblastic leukemia: results from the NOPHO ALL – 92 study
- The spectrum of Evans syndrome in adults: new insight into the disease based on the analysis of 68 cases
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Neočekávané vedlejší nálezy při 18F-FDG-PET/CT hodnocení léčebné odpovědi či následném sledování pacientů léčených pro ne-hodgkinský lymfom
- Zmeny názvoslovia, klasifikácie a diagnostických kritérií myeloproliferatívnych ochorení podľa WHO klasifikácie 2008
- Novinky v klasifikaci MDS a stanovení prognózy dle WPSS
- Nehodgkinovské lymfómy v detskom veku v Slovenskej republike – výskyt a výsledky liečby
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy