-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Léčba relabovaného a refrakterního Hodgkinova lymfomu
Treatment of relapsed and refractory Hodgkin lymphoma
Hodgkin lymphoma (HL) is usually cured by first-line therapy:
in patients in initial stages with unfavorable features relapses occur in 10-15 % of cases and in up to 20 % of patients in advanced stages of HL. The most important prognostic factor at first relapse is chemosensitivity to salvage therapy. No standard salvage regimen is currently recommended, but cisplatinum or carboplatinum based regimens are most widely used. Autologous stem cell transplantation (ASCT) is superior over conventional chemotherapy and remains the standard of treatment in relapsed/refractory Hodgkin lymphoma patients. Tandem transplantation is indicated in poor-risk patients at relapse. ASCT failures occur in approximately 50% of these patients during the follow-up. Experimental approaches after ASCT failure include new agents. The second ASCT is another experimental method. The role of myeloablative allogeneic SCT in multiple relapses of HL is still unclear due to its high treatment-related mortality. Allogeneic transplantation with reduced intensity regimens reduced transplant-related mortality, but even this therapy did not prevent relapses/progressions in about a half or two-thirds of patients.Key words:
Hodgkin lymphoma, relapse, progression, autologous stem cell transplantation, allogeneic stem cell transplantation.
Autoři: H. Mociková
Působiště autorů: Oddělení klinické hematologie, Fakultní nemocnice Královské Vinohrady, Praha
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 2, p. 82-88.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Hodgkinův lymfom (HL) je ve většině případů vyléčen první linií terapie. Relapsy se vyskytují u 10–15 % pacientů v časných stadiích s nepříznivými prognostickými faktory a u 20 % pacientů s pokročilým HL. Při prvním relapsu je nejdůležitějším prognostickým faktorem odpověď lymfomu na záchrannou léčbu (chemosenzitivita). V léčbě se nejčastěji používají režimy na bázi cisplatiny nebo karboplatiny. Autologní transplantace periferních kmenových buněk (ASCT) dosahuje lepších výsledků ve srovnání s konvenční chemoterapií a je standardním léčebným postupem. Tandemová ASCT je určena pro relabující/refrakterní pacienty s vysokým rizikem selhání druhé linie léčby. Přesto asi u 50 % pacientů léčba ASCT selhává. Standardní strategie léčby relapsu po ASCT není jednoznačně určena. Experimentálně se zkoušejí nové léky. Za experimentální postup se považuje i druhá ASCT. Alogenní transplantace s myeloablativním režimem u opakovaných relapsů HL má vysokou potransplantační úmrtnost. Alogenní transplantace užívající režimy s redukovanou intenzitou snížily potransplantační úmrtnost, ale ani tato léčba nezabrání progresi a/nebo relapsu u poloviny až 2/3 pacientů.
Klíčová slova:
Hodgkinův lymfom, relaps, progrese, autologní transplantace kmenových buněk, alogenní transplantace kmenových buněkÚvod
Časná stadia Hodgkinova lymfomu (HL) s příznivými prognostickými faktory jsou obvykle vyléčena první linií léčby, relapsy se objevují zřídka (1). U pacientů s časnými stadii HL s nepříznivými prognostickými faktory (v názvosloví Německé studijní skupiny pro Hodgkinův lymfom - German Hodgkin Study Group (GHSG) – intermediární stadia) se relapsy objevují v 10–15 % (2). Přibližně 20 % pacientů s pokročilými stadii HL po první linii léčby progreduje nebo relabuje (3). Primárně refrakterní pacienti jsou ti, u kterých po 4–6 cyklech chemoterapie s antracykliny bylo dosaženo regrese o méně než 50 % a pacienti s progresí lymfomu v průběhu nebo do 90 dní po ukončení prvoliniové léčby (4). Primárně refrakterních pacientů je ve stadiích I/II asi 2–5 % a ve stadiích III/IV přibližně 5–10 %. Dlouhodobě přežívá pouze 30 % z nich (5). Longo ve studii National Cancer Institute uvádí, že z pacientů s primárně progredujícím HL nepřežil žádný více než 8 let. Dlouhodobé remise (20 let sledování) dosáhlo jen 11 % pacientů s časným relapsem (do 12 měsíců) a 22 % pacientů s pozdním relapsem (nad 12 měsíců) (6). Vysokodávkovaná léčba a autologní transplantace periferních kmenových buněk (ASCT) je v současné době standardní léčbou u pacientů s relabovaným HL (7, 8).
Prognostické faktory u relabovaných a refrakterních HL
Věk je jedním z prognostických faktorů mezinárodního prognostického skóre (IPS) u pokročilého stadia primárního HL, ale není uveden jako prognostický faktor ve studiích druhé linie léčby s ASCT. V literatuře je uváděno několik skórovacích systémů s prognostickými faktory, které mohou ovlivnit další prognózu pacientů po ASCT. Francouzská pracovní skupina Société Francaise de Greffe de Moelle (SFGM) vytvořila skórovací systém na základě prospektivního hodnocení 245 pacientů s prvním relapsem HL. SFGM hodnotila následující rizikové faktory: časný relaps po ukončené primární léčbě ≤ 12 vs. pozdní relaps > 12 měsíců, klinické stadium relapsu III/IV a relaps v ozářené oblasti. Výsledky studie byly statisticky významné. V mediánu sledování 51 měsíců u vysoce rizikových pacientů se dvěma rizikovými faktory bylo přežití bez události (EFS) 46 % a celkové přežití (OS) 57 %. U pacientů s intermediárním rizikem, tj. jen s jedním rizikovým faktorem bylo EFS 76 % a OS 85 % (9). Josting a spol. na základě retrospektivního hodnocení souboru 422 pacientů s relapsem HL vypracoval prognostické skóre se 3 nezávislými prognostickými faktory: doba do relapsu: ≤ 12 vs. > 12 měsíců, klinické stadium relapsu III/IV a anémie: muži s Hb < 120 g/l; ženy s Hb < 105 g/l. V mediánu sledování 45 měsíců bylo přežívání bez druhého selhání (Freedom from second failure, FF2F) 45 %, 32 % a 18 % u pacientů s 0–1, 2 nebo 3 prognostickými faktory (10). Moskowitz v prospektivní studii se 65 pacienty definoval 3 prognostické faktory: B symptomy, extranodální postižení při relapsu a trvání kompletní remise < 1 rok. V mediánu sledování 43 měsíců bylo EFS u pacientů s 0–1 rizikovým faktorem 83 %, se 2 rizikovými faktory 27 % a se 3 rizikovými faktory 10 % (11). V dalších studiích jsou jako rizikové faktory označovány opakované relapsy, více než 2 předchozí linie chemoterapie a také i vyšší věk a Karnofského skóre < 90.
Záchranná chemoterapie a hodnocení odpovědi na záchrannou léčbu
Odpověď lymfomu na záchrannou léčbu (chemosenzitivita) je nejdůležitějším prognostickým faktorem pro další přežívání pacientů s relapsem HL (8, 12). Záchranný režim má při maximální možné účinnosti co nejméně zvyšovat kumulativní nehematologickou toxicitu (např. kardiální nebo plicní) a zároveň umožnit dostatečný sběr periferních kmenových buněk. Pacienti s časným relapsem nebo primárně refrakterní pacienti by měli být léčeni chemoterapeutickým režimem s kombinací cytostatik, které nebyly použity v první linii, tj. léky, na které nejsou zatím rezistentní. Záchranné chemoterapeutické režimy používané v léčbě relapsů HL jsou shrnuty v tabulce 1. Odpověď HL na záchrannou léčbu se pohybuje podle literárních údajů v rozmezí 60–88 %. V jednotlivých studiích jsou zařazeni pacienti s různou prognózou: rezistentní pacienti, pacienti s časným i pozdním relapsem nebo opakovanými relapsy. Proto je mnohdy obtížné výsledky srovnávat. Odpověď HL na jednotlivé záchranné režimy je závislá na prognostických faktorech relapsu danného pacienta. Např. při použití režimu MINE (mitoguazon, ifosfamid, vinorelbin, etoposid) byla u primárně rezistentních pacientů odpověď 60 % a u pacientů s relapsem 89 % (5). Chybí randomizované prospektivní porovnání účinnosti jednotlivých záchranných cytostatických režimů. V současné době se klade důraz na zhodnocení odpovědi HL po 2 cyklech záchranné léčby. Doporučuje se režim změnit, pokud pacient nedosáhne ani parciální remise po druhém cyklu. Dexa-BEAM (dexametason, karmustin, etoposid, cytarabin, melfalan) a mini-BEAM (karmustin, etoposid, cytarabin, melfalan) jsou poměrně intenzivní režimy se značnou hematologickou toxicitou. Jsou spojené s déletrvající cytopenií a s relativně vysokou mortalitou 2–5 %. Oba režimy poškozují kmenové buňky krvetvorby a jejich sběr je posléze obtížný (13). Vzhledem k vyšší morbiditě, mortalitě a toxickému působení na kmenové buňky jsou ve srovnání s ostatními režimy méně vhodné jako záchranné předtransplantační režimy. Nejčastěji používané platinové režimy: DHAP (dexametazon, cytarabin, cisplatina), ESHAP (etoposid, metylprednizolon, cytarabin, cisplatina) a ASHAP (doxorubicin, metylprednizolon, cytarabin, cisplatina) jsou méně toxické a mají stejné procento odpovědí jako Dexa-BEAM (12, 14, 15). GHSG v prospektivní studii se 102 pacienty s progresí/relapsem HL hodnotila účinnost 2 cyklů chemoterapie DHAP: celkem bylo dosaženo odpovědi u 89 % pacientů včetně 65 % odpovědí u primárně progredujícího HL. Nevyskytly se závažné infekce nebo úmrtí v důsledku léčby a sběr periferních kmenových buněk byl úspěšný u 96 % pacientů (12). Snaha o snížení nehematologické toxicity, která se vyskytuje po cisplatinových režimech, vedla k použití režimu ICE (ifosfamid, karboplatina, etoposid) ve dvoutýdenním intervalu. Sběr periferních kmenových buněk byl prováděn po třetím cyklu (11). Pacienti s více než 25% redukcí tumoru byli dále léčeni vysokodávkovanou chemoterapií s následnou ASCT a radioterapií. Celkem odpovědělo na léčbu ICE 88 % pacientů (z toho 26 % kompletní remise). Medián počtu nasbíraných CD34+ kmenových buněk po ICE byl dostatečný (7x106/kg). V režimu IVE je dávka ifosfamidu a etoposidu vyšší ve srovnání s ICE (ifosfamid: 9 g/m2 vs. 5 g/m2, etoposid: 600 mg/m2 vs. 300 mg/m2). Celková dosažená odpověď u HL byla 93 %, pětileté OS 62 % a EFS 52 % (16). IVE je sice účinný při mobilizaci periferních kmenových buněk, ale současně má významnou hematologickou toxicitu, většina pacientů je hospitalizovaná pro febrilní neutropenie. Nově používané záchranné režimy zařazují do terapie i relativně málo toxický purinový analog gemcitabin. Gemcitabin v kombinaci s cisplatinou a dexametasonem (GDP) dosáhl celkové odpovědi 69 % s úspěšným sběrem periferních kmenových buněk u všech pacientů (17). V retrospektivní studii, která porovnávala režimy GDP a mini-BEAM, byla dosažena srovnatelná celková odpověď u obou režimů (62 % u GDP a 68 % u mini-BEAM), ale 1,5roční přežití bez progrese (PFS) bylo signifikantně vyšší po režimu GDP (74 % vs. 35 %) a navíc sběr periferních kmenových buněk byl úspěšný u 97 % pacientů po GDP ve srovnání s 57 % po režimu mini-BEAM (18). Kombinace vinca alkaloidu vinorelbinu s gemcitabinem a liposomálním doxorubicinem byla s úspěchem použita v režimu GVD: celková dosažená odpověď 70 % (kompletní remise 19 %, parciální remise 51 %) a 4leté EFS 52 % u pacientů bez předchozí ASCT (19). Tolerance režimu byla dobrá s nízkým výskytem febrilní neutropenie (7 %). Kombinaci gemcitabinu a vinorelbinu spolu s ifosfamidem použila italská skupina v režimu IGEV (ifosfamid, gemcitabin, vinorelbin, prednizon) (20). Po 4 cyklech režimu IGEV byla celková odpověď 81 % (kompletní remise u 54 %) bez závažné toxicity v průběhu léčby a 90 % pacientů podstoupilo ASCT. 3leté PFS a OS bylo 53 % a 70 %. Sběr periferních kmenových buněk proběhl u všech pacientů po 1–3 cyklech chemoterapie. Eskalovaný BEACOPP je v současnosti nejúčinnější léčbou v první linii (3), ale je možné ho použít i v léčbě relapsu. GHSG srovnávala výsledky léčby COPP/ABVD a eskalovaného BEACOPP u 107 relabovaných pacientů, kteří byli v první linii léčeni radioterapií. Kompletní remisi dosáhlo 87 % pacientů. V mediánu sledování 45 měsíců byl FF2F 81 % a OS 89 % (21). Cavalieri srovnával účinnost eskalovaného BEACOPP u 10 refrakterních pacientů a u 13 pacientů v relapsu po prvoliniové léčbě. 3leté OS, PFS a kumulativní výskyt relapsu bylo ve skupině refrakterních pacientů 90, 50, a 33,3 %, a ve skupině relabovaných HL 61, 31, a 37,5 % (22).
Tab. 1. Záchranné režimy u Hodgkinova lymfomu. 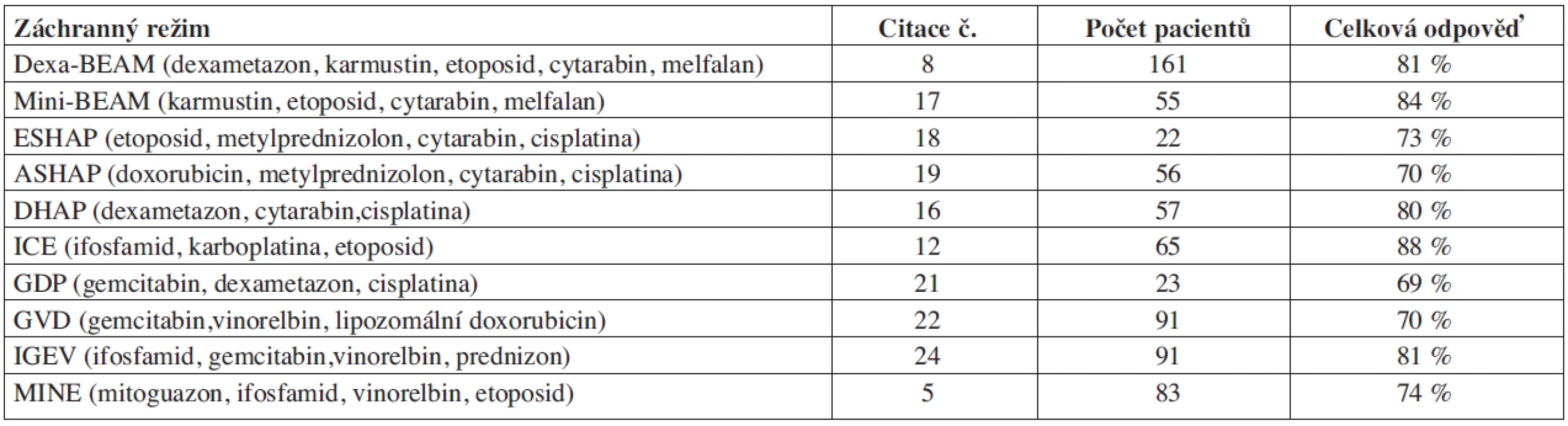
Pozitronová emisní tomografie (PET) po záchranné léčbě před ASCT umožňuje odlišit aktivní zbytkový nádor od rezidua s nenádorovou tkání. Negativní PET nález před transplantací je spojen s významným snížením rizika relapsu (23, 24). Jabbour vyhodnotil výsledky PET vyšetření u 68 pacientů s HL po záchranné léčbě před ASCT: z 25 PET pozitivních pacientů 18 (72 %) následně relabovalo a ze 43 PET negativních pacientů 10 (23 %) relabovalo po ASCT (24). Sekundární rizikové skóre spolu s PET ovlivňuje výsledky léčby druhé linie u pacientů s relabujícími lymfomy včetně HL (10, 25).
Radioterapie
V současné době chybí prospektivní data na větších souborech pacientů, která by zhodnotila výhody samotné radioterapie nebo kombinace chemoterapie a radioterapie před nebo po ASCT se zaměřením na kumulativní pozdní toxicitu léčby. Přesto, že není mnoho literárních údajů, involved field (IF) radioterapie může zlepšit prognózu u pacientů, kteří předtím nebyli léčeni zářením (26). U relabovaných a refrakterních HL se samotná radioterapie (RT) používá zřídka. Důvodem je skutečnost, že část pacientů byla již léčena radioterapií v rámci první linie léčby a také se předpokládá, že návrat onemocnění je spojen s diseminací lymfomu. Samotnou radioterapii je možné aplikovat u pacientů s lokálním pozdním relapsem bez rizikových faktorů a bez B symptomů v celkově dobrém stavu (26). Kombinaci 2 cyklů záchranné chemoterapie ICE a IF RT před ASCT na uzlinové postižení v době relapsu > 5cm nebo na reziduální nádor použil Moskowitz ve studii se 65 pacienty (11). 88 % dosáhlo odpověď na ICE/RT a prakticky všichni podstoupili ASCT. V mediánu sledování 43 měsíců bylo EFS 68 % a OS 83 %. Ze 17 pacientů, u kterých léčba selhala, se pouze u 3 relaps objevil v ozařovaných místech. IF RT je zařazována po ASCT u pacientů s bulky postižením v relapsu. Radioterapii je možno zahrnout také do přípravného režimu před ASCT. Ozáření všech uzlinových lokalizací (TLI) nebo IF s následnou autologní transplantací kostní dřeně použil Yahalom u 156 pacientů (27). V mediánu sledování 7 let bylo EFS 42 %.
Vysokodávkovaná léčba a autologní transplantace kmenových buněk
Autologní transplantace periferních kmenových buněk (ASCT) dosahuje lepších výsledků (PFS) oproti konvenční chemoterapii a je standardem druhé linie léčby u pacientů s progresí/relapsem HL. ASCT asi u 50 % pacientů v různém časovém odstupu selhává (7, 8). V britské studii byli pacienti s relapsem HL léčeni jednak záchrannou léčbou mini BEAM (karmustin, etoposid, cytarabin, melfalan) samotnou anebo po této léčbě následovala vysokodávkovaná léčba BEAM a ASCT (20 pacientů v obou skupinách). 3leté EFS bylo signifikantně vyšší ve skupině s ASCT ve srovnání se samotnou chemoterapií mini BEAM (53 % vs. 10 %) (7). GHSG a European Group for Blood and Marrow Transplantation (EBMT) výsledky potvrdily v další studii, ve které byli pacienti léčeni 2 cykly záchranné léčby dexaBEAM a následně buď dalšími 2 cykly dexaBEAM, nebo vysokodávkovanou chemoterapií BEAM s ASCT. Vzhledem ke značné toxicitě chemoterapie dexa BEAM ze 161 randomizovaných pacientů bylo pouze 117 schopných druhé randomizace. 3leté FF2F bylo signifikantně lepší ve skupině s ASCT oproti samotnému ramenu bez ASCT (55 % vs. 34 %). Rozdíl se ale neprojevil v OS při dlouhodobém sledování pacientů. Tuto skutečnost lze vysvětlit relativně malým počtem pacientů ve studiích a nízkým počtem statisticky vyhodnotitelných událostí. Výsledky ovlivnilo i to, že většina pacientů byla v dalších relapsech léčena vysokodávkovanou chemoterapií následovanou ASCT (8). Několik retrospektivních studií prokázalo, že v mediánu sledování 5 let po ASCT je PFS 40–50 % a OS 50–60 % (5, 28).
V období 2000–2009 bylo v ČR transplantovaných 214 pacientů s HL a z nich bylo statisticky vyhodnoceno celkem 194 pacientů. Dosažené výsledky jsou srovnatelné s výše uvedenými studiemi: 5leté OS po ASCT bylo 71 % a PFS 54 %.
Dosud nebyla publikována studie srovnávající přípravné režimy před transplantací kmenových buněk (SCT) u relabovaných HL. Retrospektivní studie z Fred Hutchinson Cancer Research Center s 92 pacienty porovnala režim s celotělovým ozářením (TBI) (TBI/cyklofosfamid/etoposid) s režimem s kombinací busulfan/melfalan/thiotepa (29). Srovnání režimu s TBI a režimu se samotnou chemoterapii neprokázalo významný rozdíl v 5letém OS (57 % vs. 52 %) ani v EFS (49 % vs. 42 %). Vzhledem ke zvýšení rizika vzniku sekundárních malignit a myelodysplastického syndromu po TBI upřednostňují nyní transplantační centra režimy jen se samotnou chemoterapií.
Tandemová autologní transplantace
Tandemová autologní transplantace byla zavedena s cílem aplikovat maximální dávku léčby. Tento postup zahrnuje podání 2 vysokodávkovaných terapií s následnými ASCT v odstupu 1–3 měsíce mezi nimi. U vysoce rizikových pacientů s relapsem HL se 2leté PFS a OS pohybují v rozmezí 34–40 % a 53–58 % (12). Ve francouzské prospektivní multicentrické studii GELA/SFGM H96 bylo 245 pacientů s HL léčeno jednu nebo tandemovou transplantací v závislosti na počtu rizikových faktorů (30). Do skupiny s vysokým rizikem (primárně refrakterní nebo se 2 nebo více rizikovými faktory relapsu: časný relaps < 12 měsíců, stadium relapsu III/ IV, relaps v místě předchozího ozařování) bylo zařazeno 150 pacientů, u 105 z nich byla indikovaná tandemová transplantace. Do skupiny s intermediárním rizikem (1 rizikový faktor v relapsu) bylo zařazeno 95 pacientů, z nich 92 bylo léčeno jen jednou ASCT. U tandemové transplantace první přípravný režim představovala vysokodávkovaná chemoterapie CBV (cyklofosfamid, karmustin, etoposid) a mitoxantron 30 mg/m2 nebo alternativně BEAM. Jako druhý přípravný režim byly použity TBI 12 Gy v 6 frakcích nebo busulfan 12 mg/kg. Po druhé ASCT následovala radioterapie 36 nebo 20 Gy na postižené uzliny > 5 cm (v době diagnózy relapsu) nebo na reziduální tumor. Pacienti s jednou transplantací dostali přípravný režim BEAM a následně radioterapii na iniciálně postižené uzlinové lokalizace v relapsu > 5 cm nebo na reziduální tumor. Ve skupině s intermediárním rizikem bylo 5leté FF2F 73 % a OS 85 %, ve skupině s vysokým rizikem bylo 5leté FF2F 46 % a OS 57 %. U chemorezistentních pacientů se zvýšilo 5leté OS na 46 % oproti předchozím studiím, kde bylo 30 % (5, 30). Jedna autologní transplantace je dostatečná pro pacienty s intermediárním rizikem a pro pacienty s vysokým rizikem, kteří dosáhli kompletní remisi po záchranné léčbě před ASCT. U ostatních pacientů s vysokým rizikem je vhodné zvážit tandemovou ASCT (30).
Relaps po ASCT
Ve většině studií s relabovanými pacienty po ASCT jsou zahrnuty různé podskupiny pacientů se zcela odlišnou prognózou: primárně refrakterní, refrakterní na záchrannou léčbu, kteří původně po léčbě první linie dosáhli remise a refrakterní na záchrannou léčbu po ASCT. Do skupiny relabovaných pacientů jsou zahrnuty časné i pozdní relapsy. Medián přežití u pacientů, kteří relabují po ASCT je kolem 2 let a nejdůležitější faktor, který ovlivňuje další prognózu, je odpověď na další záchrannou léčbu (31). Ve studii Moskowitzové, s 202 zařazenými pacienty relabovalo po ASCT celkem 71 z nich. Špatnou prognózu měli pacienti s relapsem onemocnění do 6 měsíců po ASCT a s primárně refrakterním HL. Ze 71 pacientů další dlouhodobou remisi dosáhlo pouze 26 %. Lepší prognózu měli jen ti pacienti, kteří byli schopni podstoupit druhou transplantaci (32).
Studie s jednotlivými léky včetně rituximabu a kombinace chemoterapie v relapsu po ASCT jsou uvedeny v tabulce 2 (33–38). Jde o studie s malými počty pacientů, ze kterých nelze dělat definitivní závěry pro použití záchranné léčby v relapsu po ASCT. Výběr léčby navíc ovlivňuje fakt, že jde o předléčené pacienty a je nutno počítat s vyšší toxicitou. Odpověď na chemoterapeutické režimy s gemcitabinem u relabovaných pacientů po ASCT je kolem 20 % (39). Na základě experimentálních studií monoklonální protilátka anti CD20 zasahuje buňky v nenádorovém zánětlivém infiltrátu HL, které udržují funkčnost RS buněk. Younes léčil pomocí rituximabu (anti CD20) celkem 22 relabovaných pacientů s HL a z nich 22 % pacientů odpovědělo na léčbu s mediánem trvání odpovědi 7,8 měsíce (36). Kombinace rituximabu s gemcitabinem vedla k odpovědi u 48 % pacientů (49). Ve výše uvedených studiích byla odpověď na rituximab omezena jen na uzlinové postižení. Galiximab je monoklonální protilátka anti CD80, která reguluje funkci T-lymfocytů. CD80 se vyskytuje na RS buňkách a galiximab se zkouší v léčbě folikulárních NHL a relabovaných nebo refrakterních HL. Odpověď na chimérickou monoklonální protilátku anti CD30 SGN-30 a na humanizovanou anti CD30 monoklonální protilátku MDX-060 v této indikaci je minimální (celková odpověď 6 %). V preklinických studiích jsou slibné výsledky s protilátkou SGN 30 konjugovanou s monometyl auristatinem E v kombinaci s ABVD nebo s gemcitabinem. Z imunotoxinů se zkouší anti CD19 u relabujících NHL a HL (fáze I). V léčbě relapsů HL po ASCT se zkoušejí inhibitory histon deacetylázy (LBH589 a MGCD0103) a inhibitory mTOR RAD001 (everolimus) a temsirolimus, dále kombinace inhibitoru histon deacetylázy a inhibitoru m TOR. Bortezomib je u pacientů s relabovaným HL po ASCT neúčinný (38), zkouší se jeho kombinace s chemoterapií ICE. Imunomodulační látky jako thalidomid a lenalidomid blokují angiogenezi a předpokládá se, že působí imunomodulačně na zánětlivý infiltrát kolem RS buněk. Thalidomid v kombinaci s vinblastinem dosáhl odpovědi v 36 % (fáze II studie) u předléčených pacientů s HL (40). Ve studiích je testován také lenalidomid. Z dalších nově zkoušených léků je to JAK2 inhibitor. Prospektivní studie, které srovnávají účinnost nových léků a jejich kombinace na větším souboru pacientů, zatím chybí.
Tab. 2. Léčba relapsu po ASCT. 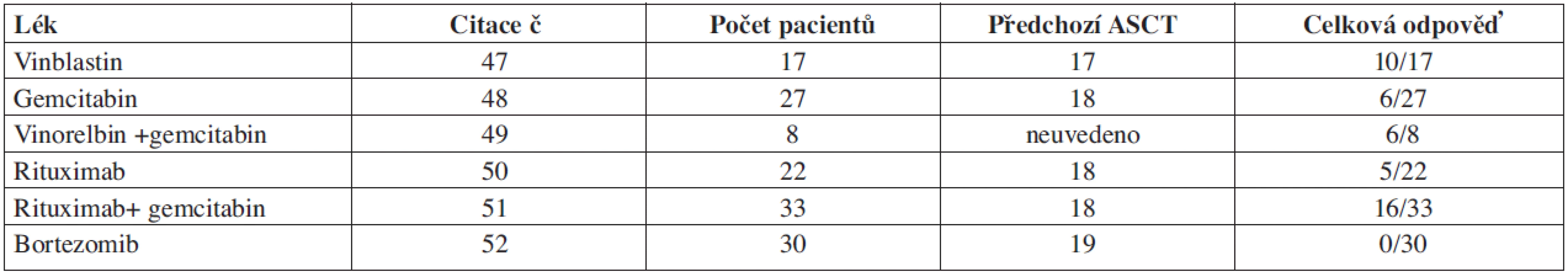
ASCT, autologní transplantace periferních kmenových buněk Imunoterapie infuzemi LMP2A – specifických autologních cytotoxických T lymfocytů je omezena na EBV pozitivní pacienty, kteří tvoří pouze 30–40 %. Ve studii Bollarda a spol. ze 14 pacientů 5 dosáhlo kompletní remisi s trváním odpovědi 40 měsíců po léčbě a jeden parciální remisi (41).
Druhá autologní transplantace
Význam druhé autologní transplantace u relabovaných a refrakterních HL zatím není zhodnocen pro nízký počet pacientů, kteří byli tímto způsobem léčeni. Zatím je druhá ASCT považovaná za experimentální postup. Ve studii s 21 relabovanými HL a 19 NHL po 1. ASCT bylo 5leté PFS 30 % a OS 30 %, výsledky u HL a NHL byly shodné (42). Druhá ASCT byla spojena s nižší úmrtností (11 %) oproti alogenní SCT a je možné ji zvážit u pacientů s pozdním relapsem po 1. ASCT, kteří jsou v dobrém celkovém stavu a nádor je chemosenzitivní i v další linii léčby. Pacienti refrakterní na druhou záchrannou léčbu jsou nevhodní k další ASCT.
Alogenní transplantace
Role alogenní transplantace u relabovaných a refrakterních HL je nadále nejasná. Studie s myeloablativními alogenními SCT u relabovaných HL vedla k vysoké úmrtnosti 43–61 % (43,44) s 3letým přežíváním bez nemoci 15 % a OS 21 % (43). Peniket uvádí analýzu 167 relabovaných pacientů z registru EBMT: u pacientů léčených autologní transplantací bylo v mediánu sledování 4 roky OS signifikantně lepší než u pacientů s alogenní transplantací (60 % vs. 24 %), proto se alogenní transplantace v této indikaci nedoporučovala (44). Podle některých studií se účinek štěpu vůči HL (GVHL) uplatňuje v závislosti na stupni reakce štěpu vůči hostiteli (GVHD), tj. při stupni ≥ 2 (44, 45). Vzhledem k vysoké úmrtnosti po myeloablativní alogenní SCT se začala v této indikaci uplatňovat alogenní transplantace s použitím režimů s redukovanou intenzitou (46, 47, 48, 49, 50) (viz tab. 3). Tyto rozdílně účinné režimy se liší intenzitou dávky i různým složením. Některé mají pouze imunomodulační účinek (fludarabin a nízká dávka TBI), jiné naopak přímo ničí nádor (fludarabin s melfalanem). Po zavedení přípravných režimů s redukovanou intenzitou došlo k poklesu potransplantační mortality do 100 dní na 4–17 % včetně transplantací od nepříbuzenských dárců. Typ dárce (HLA shodný příbuzenský nebo nepříbuzenský) neovlivňuje PFS ani OS (46, 51). Z prognostických faktorů před alogenní SCT je opět nejvýznamnější chemosenzitivita onemocnění a dále celkový stav pacienta (51, 52). S cílem maximálně zredukovat nádorovou masu ještě před alogenní transplantací Carella a spol. použil dvojitou transplantaci: ASCT, po které následovala alogenní transplantace s redukovanou intenzitou (53). Ve studii s 15 refrakterními a těžce předléčenými pacienty (10 HL a 5 NHL) celkem 10 pacientů přežívalo a z nich 5 dosáhlo kompletní remise. Dlouhodobé remise je možno dosáhnout přibližně u jedné třetiny až poloviny pacientů. U 55–63 % pacientů dochází k další progresi/relapsu v důsledku rezistence HL (48, 50, 51). Nutné jsou další prospektivní studie s větším počtem pacientů, které v budoucnu objasní, zda tato léčebná modalita rezistenci nádorových buněk překoná.
Tab. 3. Alogenní transplantace s režimem s redukovanou intenzitou u relabovaných pacientů s Hodgkinovým lymfomem. 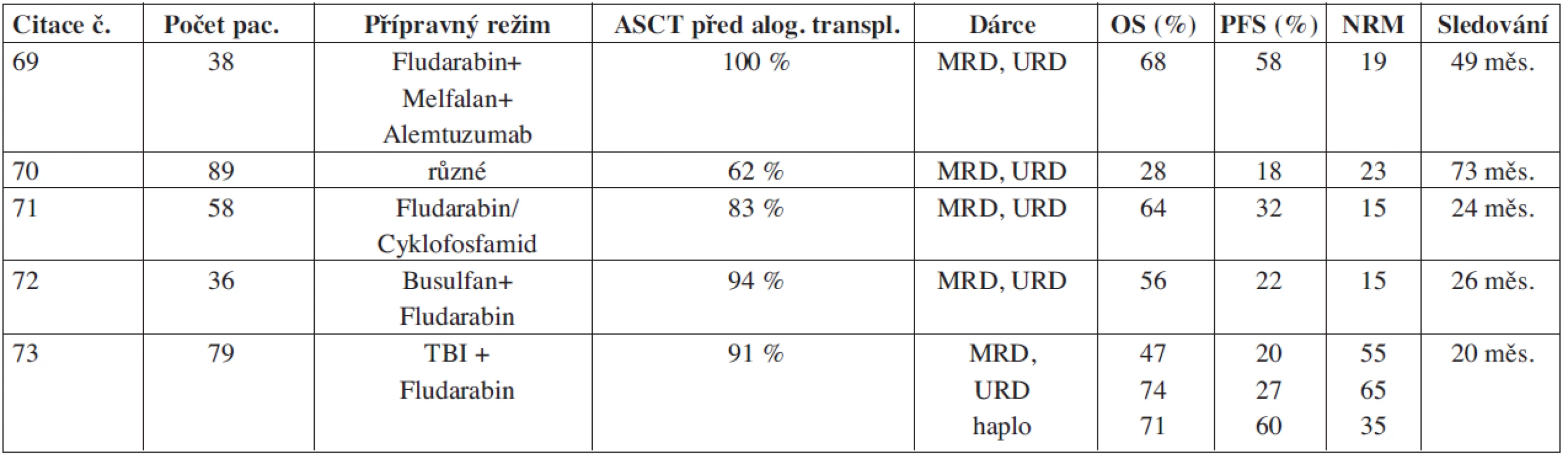
TBI = celotělové ozáření, ASCT = autologní transplantace periferních kmenových buněk, MRD = HLA shodný příbuzenský dárce, URD = HLA shodný nepříbuzenský dárce, OS = celkové přežívání, PFS = přežívání bez relapsu, NRM = úmrtnost kromě relapsu Ze souboru 194 autologně odtransplantovaných pacientů s HL v ČR v letech 2000–2009 zrelabovalo 70, z nich bylo 25 alogenně transplantovaných (23 s režimem s redukovanou intenzitou a 2 s myeloablativním režimem). 64 % bylo chemorezistentních před alogenní SCT. Po transplantaci zemřelo 9 (36 %) pacientů v důsledku progrese HL a u 6 (24 %) pacientů byla příčina úmrtí jiná než progrese HL. 10 (40 %) pacientů žije, z nich je 8 v remisi. Ve skupině alogenně transplantovaných pacientů byl trend lepšího PFS a OS oproti těm, kteří zrelabovali po ASCT a nebyli alogenně transplantovaní (medián PFS 12,4 vs. 9,2 měsíců a medián OS 31,8 vs. 12,4 měsíců), ale tyto rozdíly nebyli statisticky signifikantní (P = 0,14 a P = 0,21).
Infuze dárcovských lymfocytů (DLI)
Principem účinku DLI je navození reakce štěpu vůči HL u pacientů relabujících po alogenní transplantaci. Podání DLI u 19 pacientů s reziduálním nebo progredujícím HL vedlo k navození GVHD u 33 % pacientů s úmrtností 11 %, odpověď dosáhlo 9 z 16 pacientů (56 %) (51). Zkoumá se možnost podání DLI na základě pozitivního PET a zvyšování dávek DLI. Vzhledem k relativně nízkému počtu pacientů léčených DLI a krátkému intervalu sledování jde nadále o experimentální postup obdobně jako alogenní transplantace. Optimální použití a postavení DLI v léčbě relabovaných HL si vyžaduje zhodnocení v prospektivních randomizovaných studiích.
Závěr
ASCT je v současnosti standardní léčbou u pacientů s relapsem HL a u primárně refrakterních pacientů může ASCT prodloužit remisi. U chemosenzitivních pacientů po záchranné léčbě je vyšší pravděpodobnost dosažení vyléčení HL. Radioterapie je doplňující léčbou v případě velké masy nádoru nebo reziduálního lymfomu, kterou je možné aplikovat před nebo po ASCT. Alogenní transplantace je nadále experimentální léčbou pro pacienty ve druhém a dalším relapsu, proto je vhodné zařadit tyto pacienty do prospektivních randomizovaných studií. Pacienty s progresí nebo relapsem HL do 6 měsíců od ASCT je doporučeno jejich zařazení do studií s nově vyvíjenými léky.
MUDr. Heidi Móciková, Ph.D.
Oddělení klinické hematologie
Fakultní nemocnice Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: heidi.mocikova@seznam.cz
Doručeno do redakce: 31. 10. 2009
Přijato do tisku: 15. 12. 2009
Zdroje
1. Sieniawski M, Franklin J, Nogova L, et al. Outcome of patients experiencing progression or relapse after primary treatment with two cycles of chemotherapy and radiotherapy for early-stage favorable Hodgkin’s lymphoma. J Clin Oncol 2007; 25 : 2000-2005.
2. Fermé C, Eghbali H, Meerwaldt JH, et al. Chemotherapy plus involved-field radiation in early-stage Hodgkin’s disease. N Engl J Med 2007; 357 : 1916-1927.
3. Diehl V, Franklin J, Pfreundschuh M, et al. Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin’s disease. N Eng J Med 2003; 348 : 2386-2395.
4. Josting A, Reiser M, Rueffer U, et al. Treatment of primary progressive Hodgkin’s and aggressive non-Hodgkin’s lymphoma: is there a chance for cure? J Clin Oncol 2000; 18 : 332-339.
5. Fermé C, Mounier N, Diviné M, et al. Intensive salvage chemotherapy with high-dose chemotherapy for patients with advanced HD in relapse or failure after initial chemotherapy: results of the GELA H89 trial. J Clin Oncol 2002; 20 : 467-475.
6. Longo DL, Puffey PL, Zouny RC, et al. Conventional dose salvage combination chemotherapy in patients relapsing with Hodgkin’s disease after combination chemotherapy: the low probability for cure. J Clin Oncol 1992; 10 : 210-218.
7. Linch DC, Winfield D, Goldstone AH, et al. Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin’s disease, results of a BNLI randomised trial. Lancet 1993; 341 : 1051-1054.
8. Schmitz N, Pfistner B, Sextro M, et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet 2002; 359; 2065-2071.
9. Brice P, Bouabdallah R, Moreau P, et al. Prognostic factors for survival after high-dose therapy and ASCT for patients with relapsing Hodgkinęs Disease: analysis of 280 patients from the French Registry. Bone Marrow Transplant 1997; 20 : 21-26.
10. Josting A, Franklin J, May M, et al. New prognostic score based on treatment outcome of patients with relapsed Hodgkin’s lymphoma registered in the database of the German Hodgkin’s Lymphoma Study Group. J Clin Oncol 2002; 20 : 220-231.
11. Moskowitz CH, Nimer SD, Zelentz AD, et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood 2001; 97 : 616-623.
12. Josting A, Rudolph C, Mapara M, et al. Cologne high-dose sequential chemotherapy in relapsed and refractory Hodgkin lymphoma: results of a large multicenter study of the German Hodgkin Lymphoma Study Group (GHSG). Ann Oncol 2005; 16 : 116-123.
13. Martin A, Fernandez-Jimenez MC, Caballero MD, et al. Long-term follow-up in patients treated with Mini-BEAM as salvage therapy for relapsed or refractory Hodgkin’s disease. Br J Haematol 2001; 113 : 161-171.
14. Aparicio J, Segura A, Garcerá S, et al. ESHAP is an active regimen for relapsing Hodgkin’s disease. Ann Oncol 1999; 10 : 593-595.
15. Rodriguez J, Rodriguez MA, Farad L, et al. ASHAP: a regimen for cytoreduction of refractory or recurrent Hodgkin’s disease. Blood 1999; 93 : 3632-3636.
16. Bishton MJ, Lush RJ, Byrne JL, et al. Ifosphamide, etoposide and epirubicin is an effective combined salvage and peripheral blood stem cell mobilisation regimen for transplant-eligible patients with non-Hodgkin lymphoma and Hodgkin disease. Br J Haematol 2007; 136 : 752-761.
17. Baetz T, Belch A, Couban S, et al. Gemcitabine, dexamethasone and cisplatin is an active and non-toxic chemotherapy regimen in relapsed or refractory Hodgkin’s disease: a phase II study by the National Cancer Institute of Canada Clinical Trials Group. Ann Oncol 2003; 14 : 1762-1767.
18. Kuruvilla J, Nagy T, Pintilie M, et al. Similar response rates and superior early progression-free survival with gemcitabine, dexamethasone, and cisplatin salvage therapy compared with carmustine, etoposide, cytarabine, and melphalan salvage therapy prior to autologous stem cell transplantation for recurrent or refractory Hodgkin lymphoma. Cancer 2006; 106 : 353-360.
19. Bartlett N, Niedzwiecki D, Johnson J, et al. Gemcitabine, vinorelbine and pegylated liposomal doxorubicin (GVD), a salvage regimen in relapsed Hodgkin’s lymphoma: CALGB59804. Ann Oncol 2007; 18 : 1071-1079.
20. Santoro A, Magnagnoli M, Spina M, et al. Ifosfamide, gemcitabine and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin’s lymphoma. Haematologica 2007; 92 : 35-41.
21. Rueffer JU, Ballova V, Glossmann J, et al. BEACOPP and COPP/ABVD as salvage treatment after primary extended field radiation therapy of early stage Hodgkins disease - Results of the German Hodgkin Study Group. Leuk Lymphoma 2005; 46 : 1561-1567.
22. Cavalieri E, Matturro A, Annechini G, et al. Efficacy of the BEACOPP regimen in refractory and relapsed Hodgkin lymphoma. Leuk Lymphoma 2009; 50 : 1803-1808.
23. Svoboda J, Andreadis C, Elstrom R, et al. Prognostic value of FDG-PET scan imaging in lymphoma patients undergoing autologous stem cell transplantation. Bone Marrow Transplant 2006; 38 : 211-216.
24. Jabbour E, Hosing C, Avers G, et al. Pretransplant positive positron emission tomography/gallium scan predict poor outcome in patients with recurrent/refractory Hodgkin’s lymphoma. Cancer 2007; 109 : 2481-2489.
25. Schot BW, Zijlstra JM, Sluiter WJ, et al. Early FDG-PET assessment in combination with clinical risk scores determines prognosis in recurring lymphoma. Blood 2007; 109 : 486-491.
26. Josting A, Nogova L, Franklin J, et al. Salvage radiotherapy in patients with relapsed and refractory Hodgkin’s lymphoma: a retrospective analysis from the German Hodgkin Lymphoma Study Group. J Clin Oncol 2005; 23 : 1522-1529.
27. Yahalom J, Gulati SC, Toia M, et al. Accelerated hyperfractionated total-lymphoid irradiation, high-dose chemotherapy, and autologous bone marrow transplantation for refractory and relapsing patients with Hodgkin’s disease. J Clin Oncol 1993; 11 : 1062-1070.
28. Sirohi B, Cunningham D, Powles R, et al. Long-term outcome of autologous stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma. Ann Oncol 2008; 19 : 1312-1319.
29. Gutierez-Delgado F, Holmberg L, Hooper H, et al. Autologous stem cell transplantation for Hodgkin’s disease: busulfan, melphalan and thiotepa compared to a radiation-based regimen. Bone Marrow Transplant 2003; 32 : 279-285.
30. Morschhauser F, Brice P, Fermé C, et al. Risk-adapted salvage treatment with single or tandem autologous stem-cell transplantation for first relapse/refractory Hodgkin’s lymphoma: results of the prospective multicenter H96 trial by the GELA/SFGM study group. J Clin Oncol 2008; 26 : 5980-5987.
31. Crump M. Management of Hodgkin lymphoma in relapse after autologous stem cell transplant. Hematology Am Soc Hematol Educ Program 2008 : 326-333.
32. Moskowitz AJ, Perales MA, Kewalramani T, et al. Outcomes for patients who fail high dose chemoradiotherapy and autologous stem cell rescue for relapsed and primary refractory Hodgkin lymphoma. Br J Haematol 2009; 146 : 158-163.
33. Little R, Wittes RE, Longo DL, et al. Vinblastine for recurrent Hodgkin’s disease following autologous bone marrow transplant. J Clin Oncol 1998; 16 : 584-588.
34. Venkatesh H, Di Bella N, Flynn TP, et al. Results of a phase II multicenter trial of single-agent gemcitabine in patients with relapsed or chemotherapy-refractory Hodgkin’s lymphoma. Clin Lymphoma 2004; 5 : 110-115.
35. Spencer A, Reed K, Artur C. Pilot study of an outpatient-based approach for advanced lymphoma using vinorelbine, gemcitabine and filgrastim. Intern Med J 2007; 37 : 760-766.
36. Younes A. Romaguera J, Hagemeister F, et al. A pilot study of rituximab in patients with recurrent, classic Hodgkin disease. Cancer 2003; 98 : 310-314.
37. Oki Y, Pro B, Fayad LE, et al. A phase 2 study of gemcitabine in combination with rituximab in patients with recurrent or refractory Hodgkin lymphoma. Cancer 2008; 112 : 831-836.
38. Trelle S, Sezer O, Neumann R, et al. Bortezomib in combination with dexamethasone for patients with relapsed Hodgkin’s lymphoma: results of a prematurely closed phase II study (NCT00148018). Haematologica 2007; 92 : 568-569.
39. Oki Y, Younes A. Current role of gemcitabine in the treatment of Hodgkin lymphoma. Leuk Lymphoma 2008; 49 : 883-889.
40. Kuruvilla J, Song K, Miller P, et al. A phase II study of thalidomide and vinblastine for paliative patients with Hodgkin’s lymphoma. Hematology 2006;11 : 25-29.
41. Bollard CM, Aguilar L, Straathof KC, et al. Cytotoxic T lymphocyte therapy for Epstein-Barr virus+ Hodgkin’s disease. J Exp Med 2004; 200 : 1623-1633.
42. Smith SM, van Besien K, Carreras J, et al. Second autologous stem cell transplantation for relapsed lymphoma after a prior autologous transplant. Biol Blood Marrow Transplant 2008; 14 : 904-912.
43. Gajewski JL, Phillips GL, Sobocinski KA, et al. Bone marrow transplants from HLA-identical siblings in advanced Hodgkin’s disease. J Clin Oncol 1996; 14 : 572-578.
44. Peniket AJ, Ruiz de Elvira MC, Taghipour G, et al. An EBMT registry matched study of allogeneic stem cell transplants for lymphoma: allogeneic transplantation is associated with a lower relapse rate but a higher procedure-related mortality rate than autologous transplantation. Bone Marrow Transplant 2003; 31 : 667-678.
45. Milpied N, Fielding AK, Pearce R, et al. Allogeneic bone marrow transplant is not better than autologous transplant for patients with relapsed Hodgkin’s disease. J Clin Oncol 1996; 14 : 1291-1296.
46. Thomson KJ, Peggs KS, Smith P, et al. Superiority of reduced-intensity allogeneic transplantation over conventional treatment for relapse of Hodgkin’s lymphoma following autologous stem cell transplantation. Bone Marrow Transplant 2008; 41 : 765-770.
47. Sureda A, Robinson S, Canals C, et al. Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26 : 455-462.
48. Anderlini P, Saliba R, Acholonu S, et al. Fludarabine-melphalan as a preparative regimen for reduced-intensity conditioning allogeneic stem cell transplantation in relapsed and refractory Hodgkin’s lymphoma: the updated M.D. Anderson Cancer Center experience. Haematologica 2008; 93 : 257-264.
49. Armand P, Kim HT, Ho VT, et al. Allogeneic transplantation with reduced-intensity conditioning for Hodgkin and non-Hodgkin lymphoma: importance of histology for outcome. Biol Blood Marrow Transplant 2008; 14 : 418-425.
50. Burroughs LM, O’Donnell PV, Sandmaier BM, et al. Comparison of outcomes of HLA-matched related, unrelated, or HLA-haploidentical related hematopoietic cell transplantation following nonmyeloablative conditioning for relapsed or refractory Hodgkin Lymphoma. Biol Blood Marrow Transplant 2008; 14 : 1279-1287.
51. Peggs KS, Hunter A, Chopra R, et al. Clinical evidence of a graft-versus-lymphoma effect after reduced-intensity allogeneic transplantation. Lancet 2005; 365 : 1906-1908.
52. Robinson SP, Sureda A, Canals C, et al. Reduced intensity conditioning allogeneic stem cell transplantation for Hodgkin’s lymphoma: identification of prognostic factors predicting outcome. Haematologica 2009; 94 : 230-238.
53. Carella AM, Cavaliere M, Lerma Em et al. Autografting followed by nonmyeloablative immunosuppressive chemotherapy and allogeneic peripheral-blood hematopoietic stem-cell transplantation as treatment of resistant Hodgkin’s disease and non-Hodgkin’s lymphoma. J Clin Oncol 2000; 18 : 3918-3924.
Štítky
Hematológia Interné lekárstvo Onkológia
Článek VZDĚLÁVACÍ AKCE IPVZČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek Zprávy odborných společnostíČlánek VZDĚLÁVACÍ AKCE IPVZČlánek VZDĚLÁVACÍ AKCE IPVZ
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2010 Číslo 2- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Výběr z tisku a zprávy o knihách
- Úspěšný odběr periferních krvetvorných buněk u pacientky s chronickou myeloidní leukemií léčenou nilotinibem. Kazuistika
- VZDĚLÁVACÍ AKCE IPVZ
- Recenze knihy „Diferenciální diagnostika plicních infiltrátů a pokroky v léčbě mykotických infekcí u imunokompromitovaných pacientů“ autorského kolektivu vedeného Petrem Cetkovským a Michalem Koubou
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Zprávy odborných společností
- Zprávy odborných společností
- Zprávy odborných společností
- Zprávy odborných společností
- In memoriam Za docentem MUDr. Zdeňkem Churým, CSc.
- Vzpomínka na přednostu MUDr. Vladimíra Chudomela, CSc.
- Konsenzuální návrh České lékařské společnosti J. E. Purkyně na novelizaci vyhlášky 185/2009 Sb., o specializačním vzdělávání lékařů
- Konsenzuální návrh České lékařské společnosti J. E. Purkyně
- Globální hodnocení funkce hemostázy – část I. Trombin generační test
- VZDĚLÁVACÍ AKCE IPVZ
- Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
- Výběr z tisku a zprávy o knihách
- Použití chladicích gelových pouzder při zpracování kmenových buněk
- Léčba relabovaného a refrakterního Hodgkinova lymfomu
- Stručné morfometrické poznámky k heterogenitě lymfocytů periferní krve („minireview“ s vlastními výsledky)
- VZDĚLÁVACÍ AKCE IPVZ
- Vliv vysokodávkované chemoterapie s podporou autologní transplantace kmenových buněk na proliferační a apoptotické vlastnosti plazmatických buněk u mnohočetného myelomu
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba relabovaného a refrakterního Hodgkinova lymfomu
- Globální hodnocení funkce hemostázy – část I. Trombin generační test
- Detekce poškození genu TP53 u pacientů s chronickou lymfocytární leukemií
- Stručné morfometrické poznámky k heterogenitě lymfocytů periferní krve („minireview“ s vlastními výsledky)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



