-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
A practical view of the role of HLA matching in unrelated donor haematopoietic stem cell transplantation
The therapeutic effect of unrelated donor stem cell transplantation (SCT) is predominantly determined by genetic non-identity – HLA-mismatch – between recipient and donor. This facilitates both the desirable graft versus leukaemia (GVL) effect, which reduces the risk of relapse in malignancies as well as the graft-versus-host disease (GVHD), which increases mortality. This paper attempts to summarize the current view on the overall significance of HLA match and to interpret the qualitative and quantitative effect of mismatches in individual HLA genes on the outcome of SCT from an unrelated adult donor, particularly in malignant diseases. The current standard involves an effort to find an allele-level matched donor at least in HLA-A,-B,-C,-DRB1, because isolated mismatch in each of these genes increases mortality by approximately 10% and multiple mismatches actually have a negative synergistic effect. However, the consequences of incompatibility are significantly influenced by disease stage, as in high-risk patients these are much less significant or even negligible because of the accentuated GVL response. With the possible exception of the HLA-C locus, mismatches either on allelic or antigenic level seem to be comparably tolerated in peripheral blood stem cell transplantation. If it is necessary to accept a mismatched donor, then in the case of bone marrow it is best to avoid mismatches in HLA-A and DRB1, while in the case of peripheral blood stem cells the worst tolerated “antigenic” mismatch involves HLA-C. Apart from HLA match, there are many factors on the donor side that affect SCT outcome. These especially include timely transplantation, as the speed of finding an unrelated donor and SCT within the shortest possible time are almost as important as the degree of HLA-compatibility.
Key words:
HLA, transplantation, haematopoietic stem cells, unrelated
Autori: P. Jindra
Pôsobisko autorov: Hematologicko-onkologické oddělení FN Plzeň
Vyšlo v časopise: Transfuze Hematol. dnes,19, 2013, No. 2, p. 70-75.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Terapeutický efekt nepříbuzenské transplantace krvetvorných buněk (TKB) je nejvíce určován genetickou – HLA – neshodou mezi příjemcem a dárcem. Ta umožňuje jak u malignit žádoucí reakci štěpu proti leukemii (GVL – graft versus leukemia effect) snižující riziko relapsu, tak reakci štěpu proti hostiteli (GVHD-graft versus host disease) zvyšující mortalitu. Práce se snaží shrnout současný pohled na celkový význam HLA shody a interpretovat kvalitativní a kvantitativní efekt neshod v individuálních HLA genech na výsledek TKB od dospělého nepříbuzného dárce a to především u maligních onemocnění. Standardem je v současnosti snaha nalézt dárce alelicky shodného minimálně v HLA-A,-B,-C a–DRB1, protože izolovaná neshoda v každém z těchto genů zvyšuje mortalitu o přibližně 10 % a vícečetné neshody mají dokonce synergický negativní vliv. Efekt neshody je však významně ovlivněn stadiem základního onemocnění, protože u vysoce rizikových nemocných je v důsledku akcentované GVL reakce mnohem méně významný či dokonce zanedbatelný. S možnou výjimkou HLA-C lokusu u transplantace periferními krvetvornými buňkami jsou neshody na alelické i antigenní úrovni zřejmě srovnatelně tolerované. Je-li nutné akceptovat neshodného dárce, pak u kostní dřeně je lépe vyhnout se neshodám v HLA-A či DRB1, u periferních krvetvorných buněk je nejhůře tolerovanou „antigenní“ neshoda v HLA-C. Mimo HLA shodu existuje celá řada faktorů na straně dárce, které ovlivňují výsledek TKB a zde nutno zdůraznit především včasnost provedení transplantace, protože rychlost nalezení nepříbuzného dárce a neprodlené provedení TKB je takřka stejně důležité jako stupeň shody.
Klíčová slova:
HLA, transplantace, krvetvorné buňky, nepříbuzenskéÚvod
Genetická neshoda mezi příjemcem a dárcem krvetvorných buněk je klíčem k imunitně (aloreaktivně) podmíněné terapeutické účinnosti transplantace krvetvorných buněk (TKB), která se projevuje jako reakce štěpu proti leukemii (graft versus leukemia effect, dále GVL). Na druhé straně je ale i podkladem rozvoje reakce štěpu proti hostiteli (GVHD), jež zásadně limituje úspěšnost TKB. Již studie na přelomu 60. a 70. let prokázaly, že právě neshoda v tzv. MHC regionu (Major Histocompatibility Complex), jmenovitě v HLA (anti)genech kódovaných na krátkém raménku 6. chromozomu jsou hlavním faktorem rozvoje GVHD a tudíž i transplantační mortality (1). Snaha zlepšit výsledky nepříbuzenských TKB byla tedy nevyhnutelně spojena i se snahou lépe definovat HLA geny (lokusy), respektive jejich proteinové produkty – HLA antigeny. Stanovit tedy jednak význam jednotlivých HLA genů pro rozvoj GVHD i GVL efektu a současně definovat technické požadavky na stanovení HLA shody mezi dárcem/příjemcem. Tím rozumíme požadovanou hloubku a typ vyšetření HLA genů, kteroužto proceduru nazýváme souhrnně HLA typizací. V současnosti je obecně akceptován fakt, že právě pokroky v HLA typizaci a standardizace kritérií HLA kompatibility spolu s pokroky v podpůrné terapii přispěly ke zlepšení výsledků alogenních transplantací od nepříbuzného dárce v poslední dekádě. Tento text shrnuje jednak aktuální požadavky na rozsah a hloubku HLA typizace u pacienta a dospělého nepříbuzného dárce (URD = „unrelated donor“) a jednak význam shody (či neshody) v jednotlivých HLA genech (lokusech) pro výsledek TKB s URD.
HLA typizace – techniky a rozsah
Ještě před 15–20 lety byla HLA shoda stanovována sérologickým stanovením produktů MHC genů I. třídy a to především HLA-A a -B, pouze malý význam byl přikládán HLA-C lokusu. Shoda v HLA genech II. třídy – jmenovitě HLA-DR – byla určována smíšenou lymfocytární kulturou, HLA-DQ lokus se prakticky netypizoval. V současnosti se stupeň shody určuje výhradně molekulárně-genetickými technikami, přičemž zlatým standardem je přímá sekvenace HLA genů, respektive jejich vybraných exonů. Cílem je vybrané HLA geny typizovat na úrovni tzv. vysokého rozlišení, někdy též nazývaného alelické rozlišení (2). Ani tímto „vysokým“ rozlišením však nemusí být vždy možné kompletně rozlišit mezi některými podobnými HLA alelami. Současné techniky typizace vysokým rozlišením se proto zaměřují pouze na alely, které kódují proteiny lokalizované na povrchu buněk (jsou tudíž imunologicky „aktivní“) a na exony genů kódující tzv. „antigen poznávající oblast“ (ARS - antigen recognition site) (3). ARS je „aktivní“ částí HLA molekuly, která váže peptidový antigen a současně se na ní váže T-buněčný receptor. Tato část molekuly HLA antigenu je u I. třídy kódována exony 2 a 3 příslušného HLA genu a u II. třídy pouze exonem 2 genu. Dosavadní data ukazují, že alely identické v ARS nejsou, pokud jde imunoreaktivitu, rozdílné. Výsledek HLA typizace tedy může ukazovat rozdílné alely u pacienta a dárce, či může obsahovat několik možností alel se stejným ARS pro daný HLA lokus, nicméně v klinické praxi tento pár můžeme považovat za HLA shodný, neboť rozdílné alely nejsou vzájemně aloreaktivní. Typickým příkladem je například dvojice alel B*44 : 02 a B*44 : 27 či HLA-DRB1*14 : 01 a *14 : 54 (4). Lze tedy s určitým zjednodušením shrnout, že pro stanovení kompatibility mezi pacientem a nepříbuzným dárcem musíme u obou získat co nejúplnější informaci o DNA sekvencích v exonech 2+3 pro geny HLA-A, -B, -C a v exonu 2 pro gen HLA-DRB1 (případně i HLA-DQB1 a -DPB1). Schématicky toto znázorňuje obrázek 1 (5). Je nutno mít na paměti, že zmíněné požadavky představují celkově sekvenci přibližně 1900–2000 nukleotidů pro haploidní genom, což představuje přibližně tisícinu kompletní sekvence celého MHC (5)! Hovoříme-li tedy o HLA identitě či kompatibilitě páru pacient-URD, pak hovoříme o doložené shodě (či přibližné identitě) ve velmi malé (=1 tisícině) části tohoto MHC či HLA genomu. Z toho samozřejmě plyne i určitá nedostatečnost a nejednoznačnost dat o významu HLA shody pro výsledek TKB uvedených níže.
Obr. 1. Výběr nepříbuzného dárce zahrnuje sekvenování specifických exonů minimálně u 4 různých genů na krátkém raménku chromozomu 6. Obrázek znázorňuje současně i lokalizaci HLA genů na chromozomu. Většina transplantačních center rutinně typizuje i exon 2 DQB1 genu, zatímco DPB1 gen se obvykle v procesu selekce nepříbuzného dárce rutinně nevyšetřuje. Převzato z Warrena et al. (5). 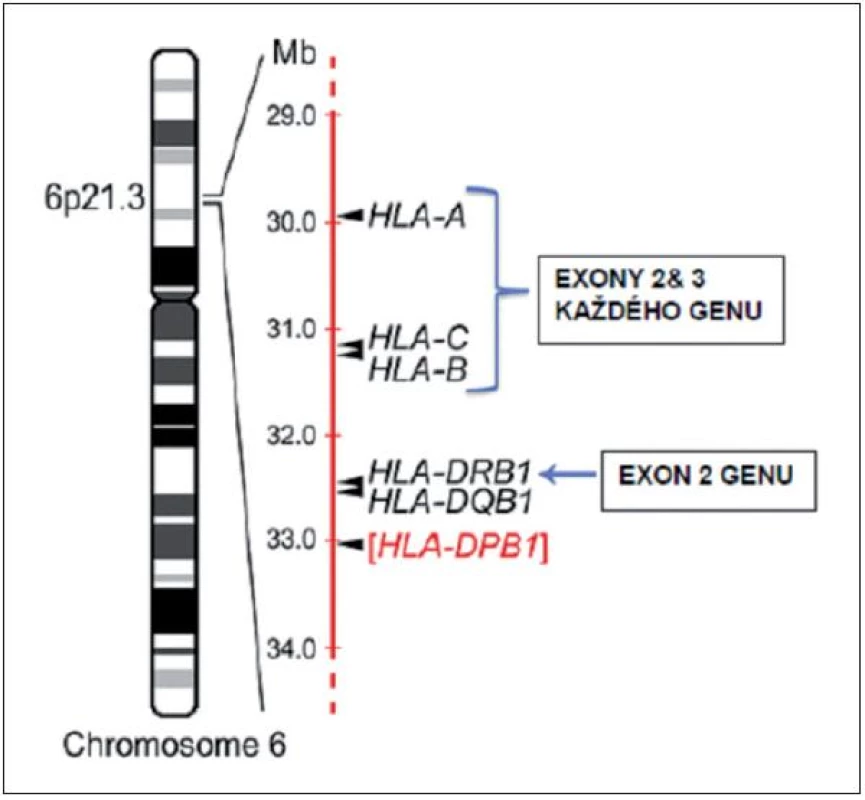
Vliv HLA shody pro výsledek TKB
Teoretický základ a literární zdroje
Význam HLA shody pro nepříbuzenské TKB nelze bohužel jednoduše „kvantifikovat“ a považovat jej za „lineární“, statický faktor aplikovatelný univerzálně pro každou nepříbuzenskou transplantaci. TKB je totiž nesmírně komplexní procedurou a její výsledek je ovlivněn celou řadou faktorů, které ve spojitosti se stupněm HLA shody mohou mít u individuálního pacienta zcela rozdílný efekt. Logicky bude význam HLA shody ovlivněn typem onemocnění, kdy u nemaligního a nerizikového maligního onemocnění bude negativní vliv HLA neshody zřejmě více vyjádřen než u agresívní, prognosticky nepříznivé malignity. Tady pozitivní vliv GVL efektu akcentovaného HLA inkompatibilitou nepochybně převáží morbiditu a mortalitu spojenou s GVHD. Vliv HLA kompatibility bude přirozeně jiný u štěpů kostní dřeně a periferních krvetvorných buněk, protože mají zcela rozdílné složení transplantovaných T-lymfocytů. Analogicky má význam i předtransplantační příprava, kdy myeloablativní na rozdíl od nemyeloablativní víceméně kompletně zlikviduje imunitní buňky příjemce. Zásadním vlivem je i případná in vivo T-deplece (podání antithymocytárního globulinu – ATG), která v závislosti na množství a dávce podaného ATG snižuje aloreaktivitu danou HLA neshodou jak ve smyslu GVHD, tak, bohužel, i ve smyslu GVL.
V současnosti existuje velké množství studií analyzující roli HLA shody na výsledek nepříbuzenské TKB, řada z nich však s poměrně zásadními rozdíly pokud jde o jejich závěry (6–10). Tyto rozdíly jsou dány pravděpodobně variabilitou v designu jednotlivých studií (např. počet pacientů, složení diagnóz, etnické pozadí populace, rozdíly v definici a kategorizaci HLA neshod či stadií nemocí) a jsou analyzovány a shrnuty jinde (2). Zde prezentovaná doporučení jsou založena především na datech velkých recentních studií CIBMTR (Center for International Blood and Marrow Transplant Research) či NMDP (National Marrow Donor Program), jež zahrnují několik tisíc analyzovaných párů. Jmenovitě jde o studii Lee a kolektivu, která analyzuje efekt HLA shody na výsledek nepříbuzenské transplantace u 3857 pacientů transplantovaných pro hematologické malignity (11) a studii Wolfreyové a kol. (12) prezentující podobná data u 1933 transplantovaných pacientů. Zásadním rozdílem u obou studií je zdroj krvetvorných buněk a pak složení diagnóz transplantovaných pacientů. Zatímco u první studie byla ve více než 90 % štěpem kostní dřeň, příprava byla myeloablativní a základní diagnózou byla přibližně u 1/3 chronická myeloidní leukemie (CML) (11), u studie Wolfreyové byly štěpem výhradně periferní krvetvorné buňky, nemyeloablativní příprava byla u 1/3, většina transplantovaných měla akutní leukemii a věk pacientů byl vyšší (12). Přestože tato studie je co do počtu analyzovaných párů pouze poloviční oproti studii Lee a kol., věkové složení pacientů, diagnóz a typu štěpu více odráží současnou transplantační praxi. Problémem většiny studií (včetně dvou výše zmíněných) je bohužel to, že pacienti s nemaligním onemocněním (těžká aplastická anémie apod.) nejsou vůbec či jen okrajově zastoupeni. Je tedy nutné interpretaci dat a následná doporučení považovat za platné primárně pro hematologická maligní onemocnění. V případě nemaligních onemocnění se jedná o extrapolaci, která není jednoznačně doložená podobně silnými daty jako u malignit.
Význam HLA shody – souhrn reprezentativních dat k roku 2012
Přes zmíněné rozdílnosti v designu a výsledcích jednotlivých studií je lze sumarizovat a interpretovat do těchto obecně aplikovatelných závěrů (6–12):
1. Existuje přímá úměra mezi počtem HLA neshod a rizikem mortality po TKB.
TKB s dárce plně shodným v 8 z 8 analyzovaných „transplantačních“ HLA-genů na úrovni vysokého rozlišení (shoda 8/8) má nižší mortalitu než transplantace s dárce shodným 7/8. Velice zhruba lze říci, že v závislosti na typu malignity klesá přežití o 5–10 % s každou neshodou (11). Zdá se, že efekt vícečetných neshod je kumulativní či dokonce synergistický.
2. Negativní efekt HLA neshody je vyjádřen především u nízce rizikových malignit.
Je evidentní, že stadium onemocnění v tobě TKB výrazně modifikuje vliv HLA neshody. Výraznější GVL efekt částečně kompenzuje mortalitu spojenou s GVHD. U malignit s vysokým rizikem relapsu nese HLA neshoda maximálně 5% zvýšenou mortalitu oproti přibližně 10 % u nízce rizikové nemoci (11). HLA neshodu tudíž nutno hodnotit vždy v kontextu se základním onemocněním a nedostupnost HLA-shodného dárce nekontraindikuje TKB s neshodným dárcem.
3. HLA neshoda má srovnatelný negativní efekt bez ohledu na to, je-li na úrovni antigenu (sérologické) či je-li na úrovni alelické (vysoké rozlišení).
Prakticky to znamená, že např. u pacienta s HLA-A genotypem *02:05, 24 : 02 je jedno, použijeme-lidárce s genotypem HLA-A* 02:01, 24 : 02 nebo dárce s genotypem HLA-A*03 : 01, 24 : 02. Výjimkou je zřejmě pouze HLA-C lokus, kde v obou zásadních studiích byly neshody na úrovni alel tolerovány lépe nežli neshody na úrovni antigenu (11, 12). Například neshoda HLA-C*03:03 versus *03:04 je lépe tolerována než neshoda C*03 : 03 versus C*04 : 01. Toto je celkem spolehlivě doloženo u příjemců kostní dřeně, u příjemců PBSC zásadní studie naznačuje, že alelické neshody jsou snad lépe tolerovány než „antigenní“ (12).
4. Pro výsledek TKB je klíčová především shoda v HLA-A, -B, -C a -DRB1 genech (lokusech).
Většina studií jednoznačně dokládá, že pouze shoda/neshoda ve zmiňovaných genech má signifikantní význam pro výsledek TKB. Přesto některé publikace ukazují, že HLA-DQB1 neshoda může být významná, zvláště je-li spojena s neshodou ve výše uvedených HLA genech, tedy potencuje její efekt (9, 13). S ohledem na silnou asociaci HLA-DQB1 alel k DRB1 alelám genu vídáme izolovanou DQB1 neshodu zřídka, naopak je typicky spojena s DRB1 neshodou a tedy potenciálně může zvýrazňovat její negativní vliv. V reálné klinické praxi většina transplantačních center při výběru URD typizuje i HLA-DQB1 gen a shoda je uváděna pro všech 5 genů tj. 10 alel diploidního genomu (například 10/10 pro úplnou shodu či 9/10 pro neshodu).
5. Významnost shody v jednotlivých HLA genech (hierarchii neshod) nelze t.č. jednoznačně spolehlivě definovat.
Protože ne všichni pacienti naleznou HLA shodného URD, je důležité optimalizovat výběr dárce mezi těmi neshodnými. S ohledem na již zmíněnou komplexnost TKB a současně polymorfismus HLA systému je spolehlivá kategorizace a hierarchizace vlivu jednotlivých HLA genů či dokonce jednotlivých HLA alel prakticky nemožná, neboť vyžaduje soubor o mnoha tisíci párech. Recentní publikace dospěla k závěru, že k identifikaci tzv. permisivních („dovolených“) neshod v HLA-A lokusu na základě retrospektivních dat by bylo třeba analyzovat minimálně 11 000 párů u frekventních alel, u vzácnějších alel pak více než 1 000 000 párů (13)! Taková studie nebude reálně nikdy proveditelná. Dosavadní data naznačují, že u příjemců kostní dřeně se zdají být neshody v HLA-B a/nebo -C lépe tolerované než neshody v HLA-A a -DRB1 (11). Oproti tomu u transplantací periferních krvetvorných buněk jsou pravděpodobně alelické neshody výhodnější než neshody na úrovni antigenů (čili neshody na úrovni nízkého rozlišení – sérologie) a nejhůře tolerovanou je neshoda v HLA-C „antigenu“ (12). S ohledem na relativně nízký počet neshodných párů v této studii, však tato data čekají na definitivní potvrzení.
Význam ostatních HLA genů (lokusů)
Prakticky se jedná pouze o alely HLA-DPB1 genů a neshody v těchto alelách ve většině studií nemají efekt na celkové přežití po TKB (7–12). Řada studií však doložila přímou asociaci mezi DPB1 neshodami a rozvojem akutní GVHD, nicméně toto je kompenzováno nižším rizikem relapsů, takže efekt DPB1 neshod na přežití je nulový. Pro praktické využití těchto neshod například u nemocných s vysokým rizikem relapsu je nutno vzít v potaz, že DPB1 neshoda je přítomná 80–85 % párů s HLA shodou 10/10!
Význam ostatních non HLA faktorů při výběru dárce
Mimo HLA shodu existuje celá řada faktorů na straně dárce, které ovlivňují výsledek TKB a zde nutno zdůraznit především včasnost provedení transplantace. Přestože v současnosti najdeme akceptabilního (tj. s HLA shodou 9–10/10) nepříbuzného dárce pro takřka 90 % pacientů s běžným evropským („kavkazoidním“) HLA fenotypem, takřka třetina těchto nemocných se nedočká TKB (14). Důvodem je zhoršení stavu pacienta, obvykle dané progresí základního onemocnění. Je tedy evidentní, že rychlost identifikace HLA kompatibilního URD a neprodlené provedení TKB je takřka stejně důležité jako stupeň shody. Pamatujme, že proces nepříbuzenské transplantace je relativně organizačně a tudíž i časově náročný neboť se na něm kromě transplantačního centra podílí řada subjektů, často z různých zemí i kontinentů. Zahrnuje totiž aktivaci potenciálních dárců, jejich „fyzické“ nalezení s odběrem vzorku, HLA typizaci a následně stanovení typu a data odběru s předtransplantačním vyšetřením dárce (tzv. „work-up“). Celý tento proces obvykle trvá minimálně 2–3 měsíce, což je nutné vzít v potaz při plánování TKB u pacienta s malignitou.
Mezi další významné faktory patří především věk dárce, CMV status, pohlaví, jeho váha a u některých malignit i genotyp KIR („killer imunoglobulin-like receptors“). Tyto faktory jsou typicky zvažovány, je-li možnost výběru mezi více dárci se srovnatelnou HLA shodou. Jejich podrobnější analýza by byla nad rámec tohoto textu a je shrnuta jinde (2, 15).
Závěr – souhrn praktických doporučení pro výběr nepříbuzného dárce
Na základě výše uvedených dat lze pro klinickou praxi shrnout tato doporučení pro optimální výběr dospělého nepříbuzného dárce s HLA shodou či akceptabilní neshodou:
- Vyhledávání URD musíme zahájit co nejdříve a je vhodná úzká spolupráce s expertem v oblasti HLA.
- Vždy stanovit priority: jde nám více o rychlé nalezení byť ne zcela shodného URD nebo dokonalou HLA shodu? Je zřejmé, že transplantovat pacienta v relapsu či v již refrakterním onemocnění s 10/10 HLA shodným dárcem je horší než transplantovat v remisi s 9/10 shodným URD.
- Od počátku hledat akceptabilního URD. Tedy nesnažit se nalézt výhradně kompletně (tj. 10/10) HLA shodného, ale pří nízkých šancích na nalezení 10/10 dárce současně vyhledávat i dárce s 1 neshodou (tj. shodou 9/10).
Doporučení stran typizace jednotlivých HLA genů a jejich význam pro výsledek TKB shrnuje tabulka 1.
Tab. 1. Doporučení pro typizaci příjemce a nepříbuzného dárce a vliv na výsledek TKB. 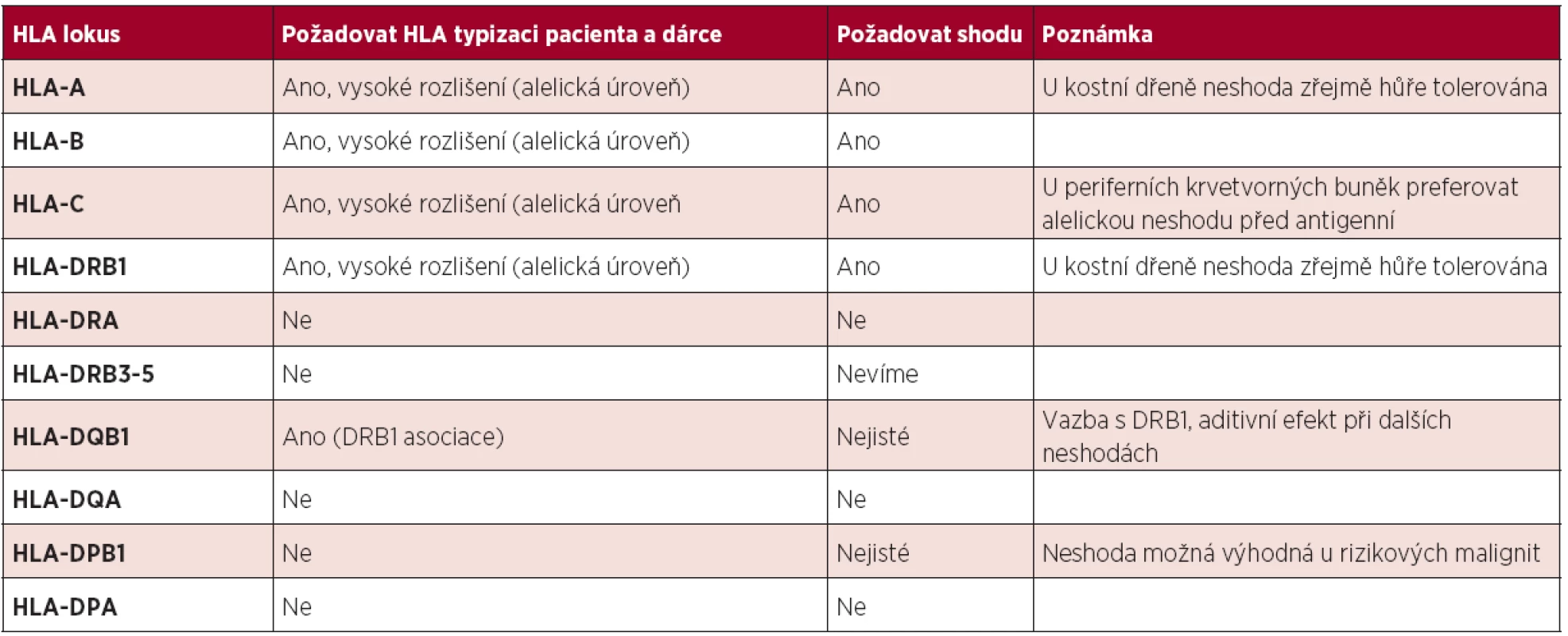
- U potenciálních URD hledat shodu minimálně v 8 HLA genech (lokusech) – HLA-A, -B, -C, -DRB1, optimální je typizovat i HLA-DQB1.
- Každá HLA-neshoda průměrně zvýší mortalitu TKB o 10 %. Více u nízce rizikových malignit, méně u vysoce rizikových malignit.
- Pro všechny zmíněné HLA geny hledat „alelickou“ shodu – shodu na úrovni vysokého rozlišení – ve všech zmíněných lokusech.
- Musíme-li použít URD s neshodou, nelze t. č. spolehlivě stanovit klinický význam neshody pro jednotlivé HLA geny a na úrovni alela-antigen. Pouze u TKB s periferními krvetvornými buňkami je u HLA-C genu výhodnější neshoda v alele oproti neshodě v antigenu. Je možné, ale ne spolehlivě prokázané, že:
- U TKB s kostní dření je výhodnější neshoda HLA-B a -C než v HLA-A a -DRB1.
- U TKB s periferními krvetvornými buňkami jsou výhodnější alelické neshody před antigenními (u HLA-C jsou data průkaznější).
Uvedené schéma výběru URD je sice založeno na relativně rozsáhlých publikovaných souborech, nicméně nebylo a pravděpodobně ani nebude prospektivně validováno a platí především pro transplantace u hematologických malignit. Není možné jej považovat za rigidní doporučení, naopak pro specifického pacienta je nutné postupovat přísně individuálně.
Doručeno do redakce: 21. 1. 2013
Přijato po recenzi: 14. 2. 2013
MUDr. Pavel Jindra, Ph.D.
Hematologicko-onkologické oddělení FN Plzeň
Alej Svobody 80
304 60 Plzeň
&
Český Národní Registr Dárců Dřeně
Na Roudné 123/212
301 00 Plzeň
e-mail: jindra@fnplzen.cz
Zdroje
1. Thomas E, Storb R, Clift RA, et al. Bone-marrow transplantation (first of two parts). N Engl J Med 1975; 292(16): 832-843.
2. Bray RA, Hurley CK, Kamani NR, et al. National marrow donor program HLA matching guidelines for unrelated adult donor hematopoietic cell transplants. Biol Blood Marrow Transplant 2008; 14(9 Suppl): 45-53.
3. Nunes E, Heslop H, Fernandez-Vina M, et al. Definitions of histocompatibility typing terms. Blood 2011; 118(23): e180-e183.
4. Xiao Y, Lazaro AM, Masaberg C, et al. Evaluating the potential impact of mismatches outside the antigen recognition site in unrelated hematopoietic stem cell transplantation: HLA-DRB1_1454 and DRB1_140101. Tissue Antigens 2009; 73(6): 595-598.
5. Warren EH, Zhang XC, Li S, et al. Effect of MHC and non-MHC donor/recipient genetic disparity on the outcome of allogeneic HCT. Blood 2011; 120(14): 2796-2806.
6. Morishima Y, Sasazuki T, Inoki H, et al. The clinical significance of human leukocyte antigen (HLA) allele compatibility in patients receiving a marrow transplant from serologically HLA-A, HLA-B, and HLA-DR matched unrelated donors. Blood 2002; 99(11): 4200-4206.
7. Petersdorf EW, Gooley TA, Anasetti C, et al. Optimizing outcome after unrelated marrow transplantation by comprehensive matching of HLA class I and II alleles in the donor and recipient. Blood 1998; 92(10): 3515-3520.
8. Petersdorf EW, Gooley T, Malkki M, et al. The biological significance of HLA-DP gene variation in haematopoietic cell transplantation. Br J Haematol 2001; 112(4): 988-994.
9. Petersdorf EW, Anasetti C, Martin PJ, et al. Limits of HLA mismatching in unrelated hematopoietic cell transplantation. Blood 2004; 104(9): 2976-2980.
10. Petersdorf EW, Gooley T, Malkki M, et al. Clinical significance of donor-recipient HLA matching on survival after myeloablative hematopoietic cell transplantation from unrelated donors. Tissue Antigens 2007; 69(S1): 25-30.
11. Lee SJ, Klein J, Haagenson M, et al. High resolution donor-recipient HLA matching contributes to the success of unrelated donor marrow transplantation. Blood 2007; 110(13): 4576-4583.
12. Woolfrey A, Klein JP, Haagenson M, et al. HLA-C antigen mismatch is associated with worse outcome in unrelated donor peripheral blood stem cell transplantation. Biol Blood Marrow Transplant 2011; 17(6): 885-892.
13. Baxter-Lowe LA, Maiers M, Spellman SR, et al. HLA-A disparities illustrate challenges for rating the impact of HLA mismatches on bone marrow transplant outcomes in the United States. Biol Blood Marrow Transplant 2009; 15(8): 971-981.
14. Oudshoorn M, van Walraven SM, Bakker JNA, et al. Hematopoietic stem cell donor selection: The Europdonor experience. Hum Immunol 2006; 67 : 405-412.
15. Spellman SR, Eapen M, Logan BR, et al. A perspective on the selection of unrelated donors and cord blood units for transplantation. Blood 2012; 120(2): 259-265.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2013 Číslo 2- Subkutánne vs. intravenózne imunoglobulíny u pacientov s CLL
- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
-
Všetky články tohto čísla
- Diagnostika a léčba hemofilie
- XXVII. Olomoucké hematologické dny s mezinárodní účastí
- Clinical aspects and pathogenesis of congenital dyserythropoietic anemias: from morphology to molecular approach
- New autoimmune diseases after cord blood transplantation: a retrospective study of EUROCORD and the Autoimmune DiseaseWorking Party of the European Group for Blood and Marrow Transplantation
- Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique
- Safety and efficacy of eltrombopag for treatment of chronic immune thrombocytopenia: results of the long-term, open-label EXTEND study
- Extramedullary relapse of acute myeloid leukemia following allogeneic hematopoietic stem cell transplantation: incidence, risk factors and outcomes
- Characteristics and outcome of early-onset, severe forms of Wiskott-Aldrich syndrome
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Klinické a biologické prognostické faktory u maligních lymfomů
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
-
Standardy péče o nemocné s hemofilií
1. revize, vydání 2012
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Praktický pohled na význam HLA shody pro transplantaci krvetvorných buněk od dospělých nepříbuzných dárců
- Separace plné krve a výroba krevních složek gravitací soupravou ErySep® s filtrem z dutých vláken
- Diagnostika a léčba hemofilie
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



