-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kazuistika (ne)chelatovaného polytransfundovaného pacienta s 5q minus syndromem
Case report: (non)chelated, poly-transfused patient with 5q minus syndrome
The authors present a case of a 60-year-old patient with incidentally uncovered significant macrocytic anaemia and thrombocytosis. Myelodysplastic syndrome, namely 5q - syndrome was diagnosed. From the beginning, the patient was dependent on red blood cell transfusions. Chelation was initially successful, but later it failed especially due to the patient’s non compliance. At the time when treatment with lenalidomide was clearly indicated, it was not possible to obtain this medication. At 53 months from diagnosis, the disease progressed to RAEB. The patient died of liver and renal failure without developing acute leukaemia. Severe hemosiderosis of the organs, especially the liver and heart, was one of the causes of death. The article includes the autopsy report and photographs of the relevant histological slides, showing hemosiderosis of the vital organs and pathological-anatomical changes that led to their failure. The paper shows severe organ damage that occurs in patients with untreated iron overload. However, haematologists can currently prevent fatal organ damage in long-term transfused patients suffering from myelodysplastic syndrome with the aid of timely and consistent iron chelator therapy and by attempting to elimi-nate the dependence on transfusions using erythropoietin or in case of its failure by administering lenalidomide.
Key words:
5q-syndrome, iron overload, iron chelation
Autoři: E. Kadlčková 1; R. Neuwirtová 2; P. Salajka 3; Červínek L.⁴; A. Jonášová 2
Působiště autorů: Hematologicko-transfuzní oddělení Krajské nemocnice T. Bati, Zlín 1; I. interní klinika hematologie Všeobecné fakultní nemocnice Praha, 1. lékařská fakulta Univerzity Karlovy, Praha 2; Patologicko-anatomické oddělení Krajské nemocnice T. Bati, Zlín ⁴Interní hematoonkologická klinika Fakultní nemocnice, Brno-Bohunice 3
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 3, p. 136-142.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Autoři předkládají případ 60letého pacienta s náhodně zjištěnou výraznou makrocytovou anémií a trombocytózou. Za pomoci paraklinických vyšetření je diagnostikován myelodysplastický syndrom (MDS) typu 5q - syndromu. Pacient je od počátku závislý na transfuzích erytrocytů, zprvu úspěšná chelatace selhává zejména pro neochotu pacienta spolupracovat. V době, kdy je u pacienta jednoznačně indikován lenalidomid, nedaří se pro něj tento preparát získat. Po 53 měsících od diagnózy choroba progreduje do MDS typu RAEB. Aniž by došlo k rozvoji akutní leukemie, umírá pacient pod obrazem hepatorenálního selhání. Na příčině smrti se podílí těžká sideróza orgánů, především jater a srdce. Součástí sdělení je pitevní zpráva a fotodokumentace histologických preparátů post mortem, které dokládají jak hemosiderózu životně důležitých orgánů, tak i patologicko-anatomické změny vedoucí k jejich selhání. Práce ukazuje těžké poškození orgánů, ke kterému dochází u neléčených pacientů při přetížení železem. Dnes však může hematolog u dlouhodobě transfundovaných nemocných s MDS předejít fatálnímu poškození orgánů včas indikovanou a důsledně dodržovanou terapií chelátory železa a pokusit se odstranit závislost na transfuzích podáním erytopoetinu, případně při neúspěchu této léčby podat lenalidomid.
Klíčová slova:
5q-syndrom, přetížení železem, chelatace železaÚVOD
5q - syndrom je podjednotka myelodysplastického syndromu (MDS) charakterizovaná izolovanou delecí dlouhého ramene 5. chromozomu, jež zahrnuje konstantně oblast v místě 5q31-q32 (resp. 33) [1]. Základních šest kritérií, charakterizujících tento podtyp MDS, popsal v r. 1974 van den Berghe [2]. Kromě výše uvedené izolované del(5q) jde o makrocytovou anémii, normální nebo zvýšený počet trombocytů, hypoplazii červené řady, normální počet blastů a zvláštní hypolobulizované megakaryocyty. Častější výskyt je zaznamenán u žen [3]. 5q - syndrom patří k podtypům MDS s nejpříznivější prognózou, dlouhou celkovou délkou života a pozdní transformací do akutní myeloidní leukemie (AML). Pokud jsou ale pacienti s touto diagnózou dlouhodobě závislí na transfuzích a zároveň rezistentní na erytropoetin, zkracuje jim život sideróza důležitých orgánů (zejména jater a srdce). V posledních letech jsou však naštěstí k dispozici chelátory železa, kterými dovedeme zmírnit ukládání železa v orgánech. Navíc, zejména u pacientů s 5q - syndromem, představuje v současnosti účinnou cílenou léčbu imunomodulační látka lenalidomid [4, 5]. Uvádíme kazuistiku nemocného jako typický případ pacienta s refrakterní anémií s rozvojem těžké siderózy po opakovaných transfuzích, který nebyl z různých důvodů adekvátně léčen a u kterého je názorně dokumentováno poškození orgánů hromaděním železa.
POPIS PŘÍPADU
Náš pacient (*1946) byl v srpnu 2006 odeslán k vyšetření makrocytové anémie do Hematologické ambulance Krajské nemocnice T. Bati ve Zlíně (HA KNTB). Tou dobou byl hospitalizován na Interním oddělení Městské nemocnice Slavičín k aplikaci analgetických infuzí pro radikulární bolesti. V osobní anamnéze měl tento pacient kromě vertebrogenního algického syndromu také stav po hematemeze při abúzu analgetik a při ezofagitidě a incipientní nefropatii na podkladě nadužívání analgetik. Abúzus alkoholu pacient opakovaně popíral. Při přijetí k hospitalizaci si stěžoval na únavnost, námahovou dušnost a perimaleolární otoky.
Vyšetření v HA KNTB potvrdilo nejen výraznou makrocytovou anémii (htc 0,254, hgb 87 g/l, MCV 101 fl), bez deficience hematinik (Fe 46,9 µmol/l, transferin 1,98 g/l, celková vazebná kapacita železa (TIBC) 50 µmol/l, feritin 573 µg/l, foláty 11,2 ng /ml, vitamin B12 571,9 pg/ml), ale také významnou trombocytózu (903 x 10⁹/l). Bílý krevní obraz byl bez pozoruhodností (tab. 1). Hladina sérového erytropoetinu byla zvý-šena na 560 IU/l. Základní biochemická vyšetření byla v normě, patrná byla pouze hraniční elevace ALT (0,86 mmol/l). Diferenciálně diagnosticky bylo zvažováno myeloproliferativní onemocnění s trombocytózou (MPO-T) nebo reaktivní změny v krevním obraze při suspektní malignitě nebo těžším zánětu. Vyšetření na mutaci V617F genu JAK-2 a fúzní gen BCR-ABL byla negativní. Sonografické vyšetření břicha potvrdilo mírnou hepatomegalii, vs. steatózu a drobné korové a intrasinusové cysty pravé ledviny. Echokardiografické vyšetření prokázalo drobný perikardiální výpotek za zadní stěnou levé komory, jinak normální nález s EF 0,67. Vyšetření na protilátky anti-HAV, anti-HCV a HBsAg byla negativní, prokázána byla pozitivita anamnestických protilátek proti EBV a CMV. Výsledek trepanobiopsie nepomohl k určení diagnózy, neboť v poškozeném vzorku dřeně bylo možno stanovit jen silně hypocelulární dřeň s redukovanou erytro - a granulocytopoézou a zmnoženými megakaryocyty. Zato v nátěru kostní dřeně byly nalezeny charakteristické unilobulární megakaryocyty. Erytropoéza zde činila jen 7 % a byla bez výraznějších morfologických odchylek. Řada bílá byla výrazně hypogranulovaná, ojediněle bylo vidět pseudopelgeroidní tyčky. Blasty nebyly zmnoženy, čítaly jen 1,6 %. Megakaryocyty byly zmnoženy, nebyly v trsech, obsahovaly polymorfní, často dysplastická jádra, nejvíce však převládala malá unilobulární jádra (obr. 1). Diagnózu 5q - syndromu později potvrdil výsledek cytogenetického vyšetření kostní dřeně z Laboratoře molekulární cytogenetiky v Brně: 46, XY, del(5)(q14 q35.2), FISH 5q31: delece oblasti 5q31 v 82 % interfázních jader. Toto vyšetření také umožnilo zařadit pacienta do rizikové skupiny podle mezinárodního prognostického skórovacího systému (IPSS 0, WPSS 1, IPSS-R 1,5).
Tab. 1. Vývoj krevního obrazu a sérového feritinu u pacienta v čase 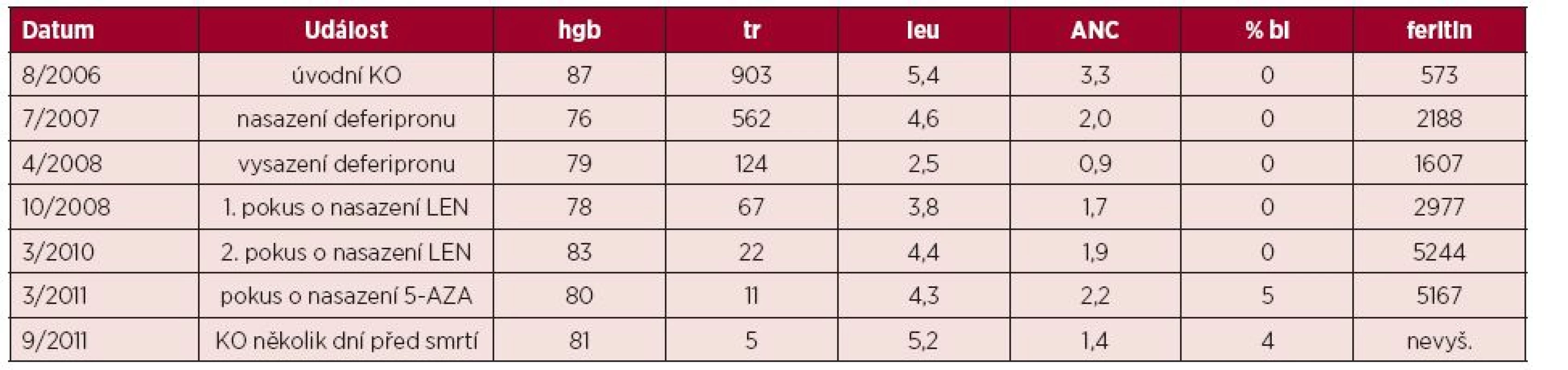
Legenda: KO – krevní obraz, hgb – hemoglobin v g/l, tr – počet trombocytů x 10⁹/l, leu – počet leukocytů x 10⁹/l, ANC – absolutní počet neutrofilů x 10⁹/l, % bl – procento blastů v nátěru obvodové krve, feritin – sérový feritin v μg/l, LEN – lenalidomid, 5-AZA – 5-azacytidin Obr. 1. Unilobulární megakaryocyty v panopticky obarveném nátěru kostní dřeně 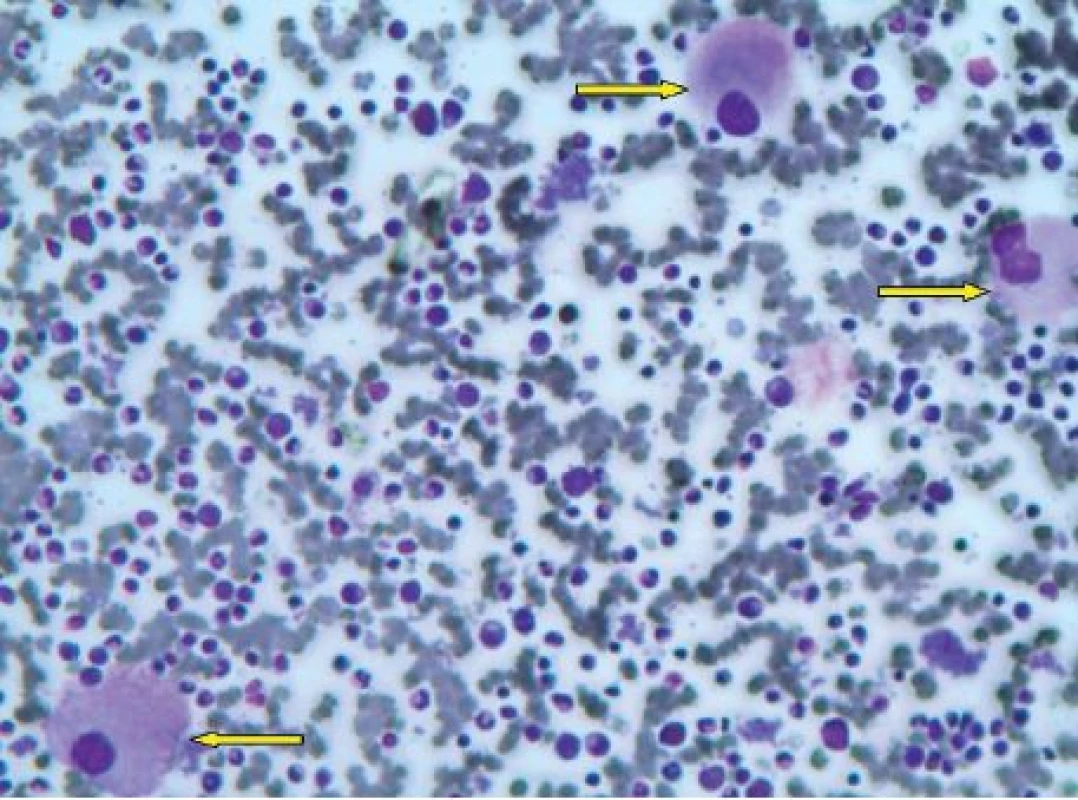
Pacient užíval pyridoxin 3 x 2 tbl a byl od počátku závislý na transfuzích (měsíčně cca 4 T.U. erytrocytových transfuzních přípravků (ETP). Erytropoézu stimulující proteiny (ESP) nebyly v léčbě pacienta použity jednak vzhledem k nízké pravděpodobnosti léčebné odpovědi, jednak z ekonomických důvodů.
V době od července 2007 do dubna 2008 byl úspěšně chelatován preparátem deferipron v dávce 2–6 tbl denně. Feritin klesl z 2 188 na 1 607 µg/l. Tato léčba byla bohužel ukončena pro polékovou leukopenii s neutropenií a progredující trombocytopenii (viz tab. 1). Při superkonziliárním vyšetření v červenci 2008 v Hematologické ambulanci Interní hematoonkologické kliniky Fakultní nemocnice Brno-Bohunice byl pacientovi nasazen deferasirox v dávce 2 tbl denně. Kontrolní hodnoty feritinu však byly neuspokojivé (5258….4425….5252…..6072 µg/l) a při pohovorech v naší ambulanci vyšlo najevo, že si pacient tuto léčbu sám snižoval, až nakonec přestal lék užívat docela a už nikdy se nepodařilo ho přesvědčit, že je tato léčba nutná. Stejně tak opakovaně odmítl i kontinuální infuzi deferoxaminu za hospitalizace.
Ve snaze pacienta zbavit závislosti na transfuzích byla v říjnu 2008 podána prof. Doubkem žádost o povolení lenalidomidu, která byla pojišťovnou zamítnuta s odůvodněním, že je lenalidomid povolen jen pro léčbu myelomu. Pacient byl tedy dále pouze transfundován, při kontrolních vyšetřeních byla pozorována rychle progredující trombocytopenie, zatímco nález v obvodové krvi zůstával bez záchytu blastů mikroskopicky. V polovině března 2010 byl pacient odeslán k superkonziliárnímu vyšetření a eventuálnímu zahájení léčby lenalidomidem v rámci compationate use programu do Hematologické ambulance Všeobecné fakultní nemocnice (HA VFN) v Praze. Při tomto vyšetření byla v krevním obraze zřejmá pokračující bicytopenie (viz tab. 1) a provedená trepanobiopsie prokázala těžce hypocelulární kostní dřeň s myelodysplastickými změnami, bez zmnožení blastů, s přítomností ALIP fenoménu a hypolobulizovaná jádra megakaryocytů. V cytogenetickém nálezu bylo zachyceno: 46, XY, del(5)(q14q35.2) [10], mBAND: del(5)(q14q35.2) [6], FISH bez delece 7, přítomna delece v oblasti 5q31 v 60,5 % interfázních jader. Pacient nebyl do studie s lenalidomidem zařazen pro trombocytopenii. Nadále je tedy transfundován na stacionáři HTO KNTB Zlín, přibývá diagnóza diabetes mellitus II. typu kompenzovaného dietou a primární hypothyreózy v terénu difuzní lymfoidní thyreoiditidy.
Při kontrole v polovině března 2011 bylo nalezeno 5 % blastů v nátěru obvodové krve (viz tab. 1), při vyšetření periferní krve průtokovým cytometrem bylo identifikováno 7 % blastů myeloidní linie. Pacient byl proto objednán k vyšetření a případnému zahájení léčby 5-azacytidinem do HA VFN k dr. Jonášové. Při tomto vyšetření je verifikována progrese do MDS typu RAEB II (10,3 %, resp. 13,8% myeloblastů ve vyšetření kostní dřeně a periferní krve průtokovou cytometrií, podle trepanobiopsie hypoplastická kostní dřeň s dysplastickými změnami ve všech 3 řadách, v cytogenetickém nálezu 0 mitóz, FISH nebyla provedena). Pacient nakonec nesouhlasí se zařazením do studie a je dále ambulantně transfundován.
V květnu 2011 je hospitalizován na Interní klinice Krajské nemocnice T. Bati Zlín pro horečnatou infekci a hlubokou trombocytopenii (tab. 1). Při přijetí je zjištěna koagulopatie (aPTT-R 1,4, INR 1,52, fbg 1,8 g/l), patologie jaterních testů (bilirubin celkový 21 µmol/l, ALT 2,98 µkat/l, AST 1,82 µkat/l, GMT 1,6 µkat/l, ALP 1,08 µkat/l) a lehká hypalbuminemie dosahující 30,7 g/l. Protilátky anti-HAV a anti-HCV, HBsAg a genetická vyšetření na hemochromatózu jsou negativní. Další laboratorní vyšetření identifikují anamnestické protilátky proti CMV a EBV a normální hladinu sérového ceruloplasminu. Při ultrazvukovém vyšetření břicha je popsáno jednak zvětšení jater na 15–16 cm, s vyšší a zrnitější echogenitou, jednak splenomegalie více než 16 cm v dlouhé ose. CT vyšetření konstatuje hepatomegalii bez zřetelných ložiskových či jiných fokálních změn, splenomegalii dosahující 19 cm v dlouhé ose, známky počínající portální hypertenze a ascites. Biopsie jater není s ohledem na těžkou trombocytopenii a koagulopatii provedena a diagnóza je uzavřena jako cirhóza jater, v. s. na podkladě hemosiderózy u polytransfundovaného pacienta, stupně B podle Childovy-Pughovy klasifikace. Koncem září 2011 je potom pacient pro progredující ascites, známky metabolického rozvratu a těžkou bicytopenii (viz tab. 1) znovu odeslán k hospitalizaci, během níž odmítá jídlo, tekutiny i veškerou medikaci a po několika dnech umírá.
Patologicko-anatomická pitva
V pitevním protokolu jsou jako základní onemocnění označeny myelodysplastický syndrom typu RAEB II a difuzní mikronodulární cirhóza jater. Játra jsou zde popsána jako velikostí přiměřená, avšak s hrbolatým povrchem, tuhé konzistence, se setřelou strukturou na řezu a s malým prokrvením. Mezi komplikacemi jsou na prvním místě uvedeny hemosideróza jater, pankreatu a sleziny vysokého stupně. Makroskopicky je pankreas popisován jako přiměřeně velký, hrubě zrnitý a tukem prorostlý, zatímco slezina je zvětšená na 570 g, s napjatým a ztluštělým pouzdrem a nezřetelnými lymfatickými uzlíky. Dále jsou přítomny známky hemoragické diatézy v podobě disperzních kožních petechií a sufuzí, plicních hemoragií a mnohočetných ekchymóz sliznice žaludku. Mezi komplikacemi figurují také edém plic vysokého stupně, kolaps levé plíce, levostranný hydrotorax a ascites. Za příčinu smrti je označeno selhání jater a ledvin. Pitevní nález shledává obě ledviny makroskopicky intaktní, avšak mikroskopický nález dokládá hemosiderinová depozita jak v ledvinných glomerulech, tak i v kanálcích. Depozita hemosiderinu jsou rovněž patrna i v buňkách srdečního svalu, zatímco srdce je popisováno jako velikostí přiměřené, s malým množstvím jantarové tekutiny v perikardu. Chlopně pravého i levého srdce jsou intaktní. Svalovina pravé komory činí 2 mm a je bez ložiskových změn, svalovina levé komory je 10 mm silná, tuhá a má hnědočervenou barvu. Na výstelce hrudní aorty jsou vidět ojedinělé vazivové pláty a věnčité tepny jsou jemné, bez zúžení průsvitu. V závěrečné epikríze je uvedeno, že 65letý muž s MDS RAEB II a jaterní cirhózou zmírá na selhání jater a ledvin, dále je přítomna hemosideróza jater, sleziny a pankreatu vysokého stupně.
DISKUSE
Navzdory pokrokům ve farmakoterapii MDS, jakými jsou použití lenalidomidu nebo hypometylačních látek, zůstává pilířem léčby podpůrná terapie, včetně podávání transfuzních přípravků [6]. Opakované transfuze erytrocytů však s sebou přinášejí problém přetížení železem. Jedna T. U. ETP totiž představuje přísun asi 200–250 mg volného Fe. Náš pacient, který za svoji transfuzní „kariéru“ dostal 244 T. U. ETP, tedy obdržel neuvěřitelných 48,8–61,0 gramů volného železa, což při denní exkreci Fe 1–1,5 mg a bez chelatační terapie muselo zákonitě vést k těžké sideróze.
Situaci našeho pacienta, stejně jako i mnoha dalších MDS nemocných, mohlo ještě dále zhoršovat zvýšené uvolňování železa z buněk při inefektivní erytropoéze a zvýšená resorpce Fe z gastrointestinálního traktu, která je způsobená sníženou hladinou hepcidinu. Podle některých autorů bývá exprese hepcidinu v případě MDS pacientů blokována dřeňovým růstovým diferenciačním faktorem 15 (GDF 15), jež se zvýšeně uvolňuje v kostní dřeni při inefektivní erytropoéze [7]. Tento mechanismus však u našeho pacienta, který měl hypoplastickou erytropoézu, ustupuje poněkud do pozadí. Na jeho nízké hladině hepcidinu však mohla participovat i postupně se prohlubující hepatopatie. Zde šlo vlastně o bludný kruh: čím méně hepcidinu játra vyprodukovala, tím více se vstřebalo Fe a tím více docházelo k dalšímu poškozování jater, až nakonec pacient dospěl od preexistující jaterní steatózy při stavu po prodělaných infekcích EBV a CMV k jaterní cirhóze a selhání jater.
U nemocných s hromaděním železa katalyzuje volné netransferinové Fe vznik kyslíkových radikálů (ROS-reactive oxygen species), které následně vedou k oxidativnímu stresu buňky a narušení makromolekul proteinů, DNA a peroxidaci lipidů [8]. Následuje poškození buněčných organel, membrán, zánik buňky a poškození tkání a orgánů. Současně dochází ke zvýšené syntéze kolagenu v důsledku indukce tvorby transformačního růstového faktoru beta 1 (TGFβ1) [7]. K poškození orgánů u chorob provázených přetížením Fe rovněž přispívá ukládání nadměrného množství nerozpustných komplexů Fe v tkáních a orgánech [8]. V rámci siderózy je v povědomí kliniků dobře známé poškození jater, kde dochází k hemosideróze, fibróze a cirhóze. Méně známé je, že dochází k sideróze myokardu, rozvíjí se kardiomyopatie, která zejména u starších osob přispívá k selhání srdce [7, 8]. Chronická expozice netransferinovému Fe vede totiž k inhibici myokardiálních Tn kanálů, jež má za následek přetížení kalciem, vznik arytmií a rozvoj diastolické a systolické dysfunkce myokardu [9]. V případě našeho pacienta lze tedy na základě histologického průkazu hemosiderinových depozit v buňkách srdečního svalu a tuhé konsistence svaloviny levé komory popsané v pitevním protokolu dovozovat, že se na bezprostřední příčině smrti mohly podílet také arytmie a srdeční selhání při restriktivní kardiomyopatii. Pohotovost ke vzniku arytmií mohla umocnit i iontová a minerálová dysbalance v rámci metabolického rozvratu, který byl jedním z důvodů poslední hospitalizace pacienta, a také hypoxemie myokardu při anémii. Kromě jater a myokardu se nadbytečné železo ukládá i v pankreatu s rozvojem bronzového diabetu a také v dalších endokrinních orgánech [7, 8, 10]. Je tedy možné, že se na rozvoji diabetu u našeho pacienta mohlo podílet poškození pankreatu netransferinovým železem. Ve shodě s uvedenými údaji jsou fotografie histologických preparátů z jednotlivých orgánů post mortem (obr. 2–5).
Obr. 2. Cirhotický nodulus s hnědými depozity hemosiderinu, hematoxylin-eosin 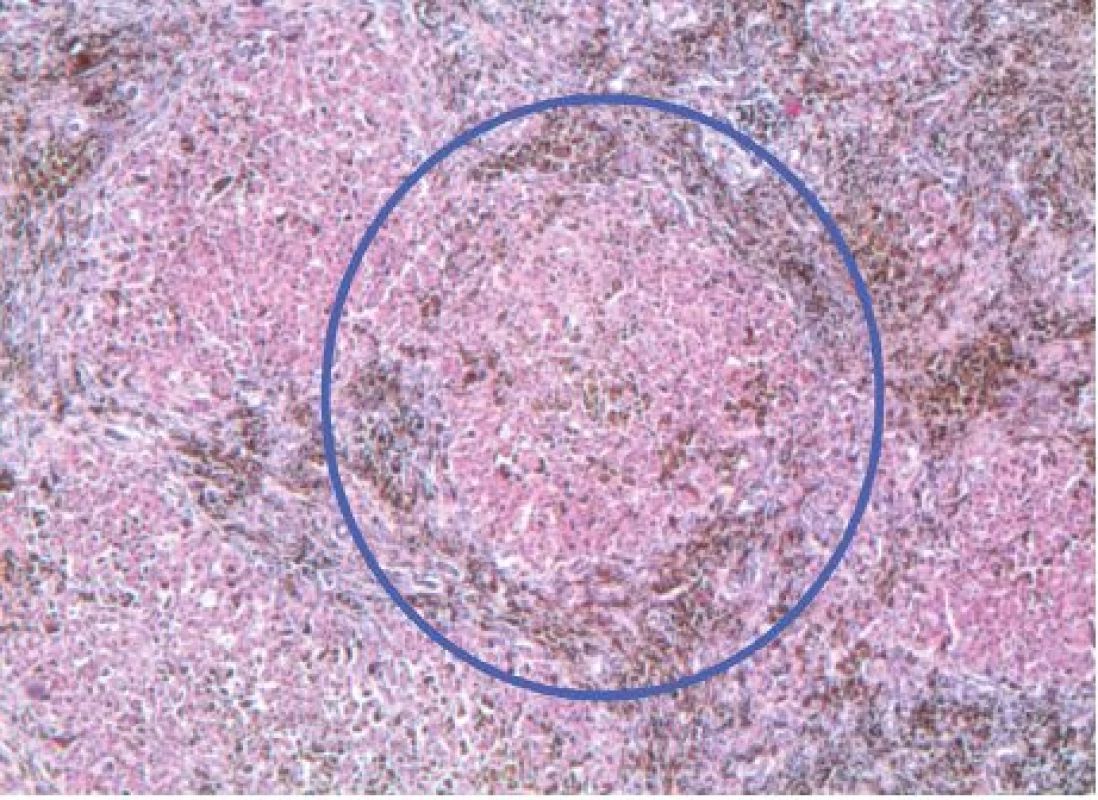
Obr. 3. Depozita hemosiderinu v buňkách srdečního svalu, hematoxylin-eosin 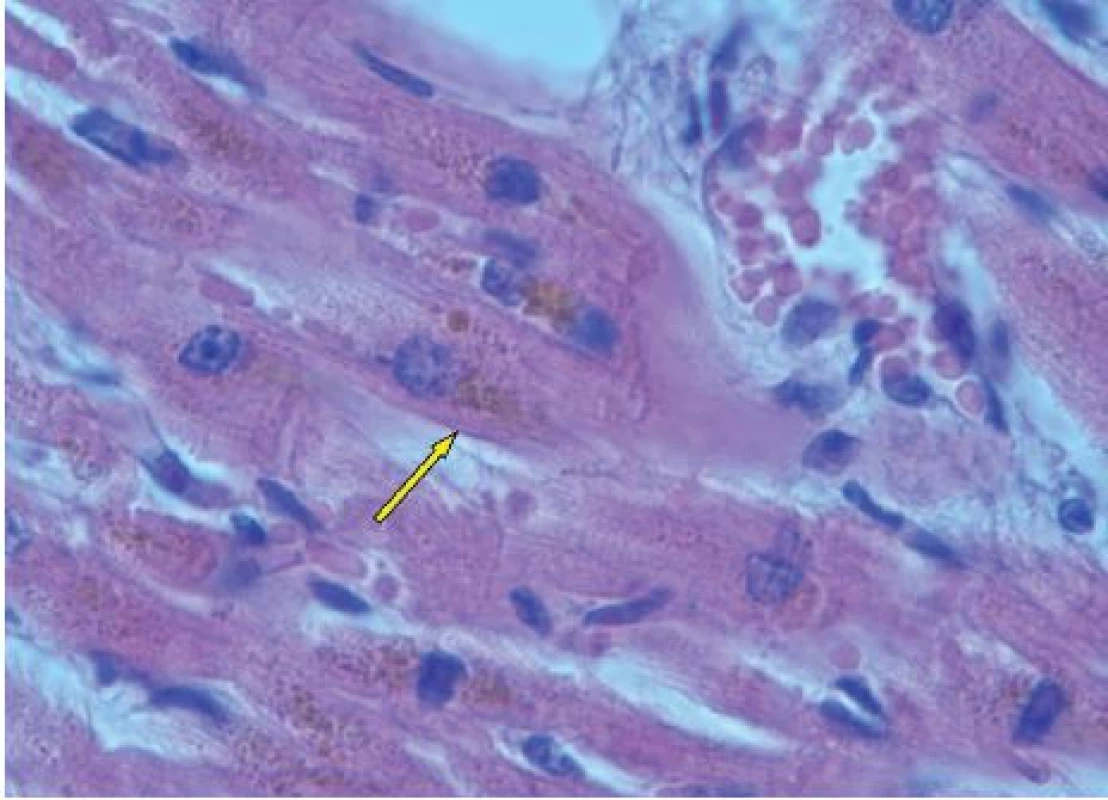
Obr. 4. Hemosiderinová depozita v lalůčku pankreatu (modrá elipsa) a steatóza pankreatu (žlutá šipka), hematoxylin-eosin 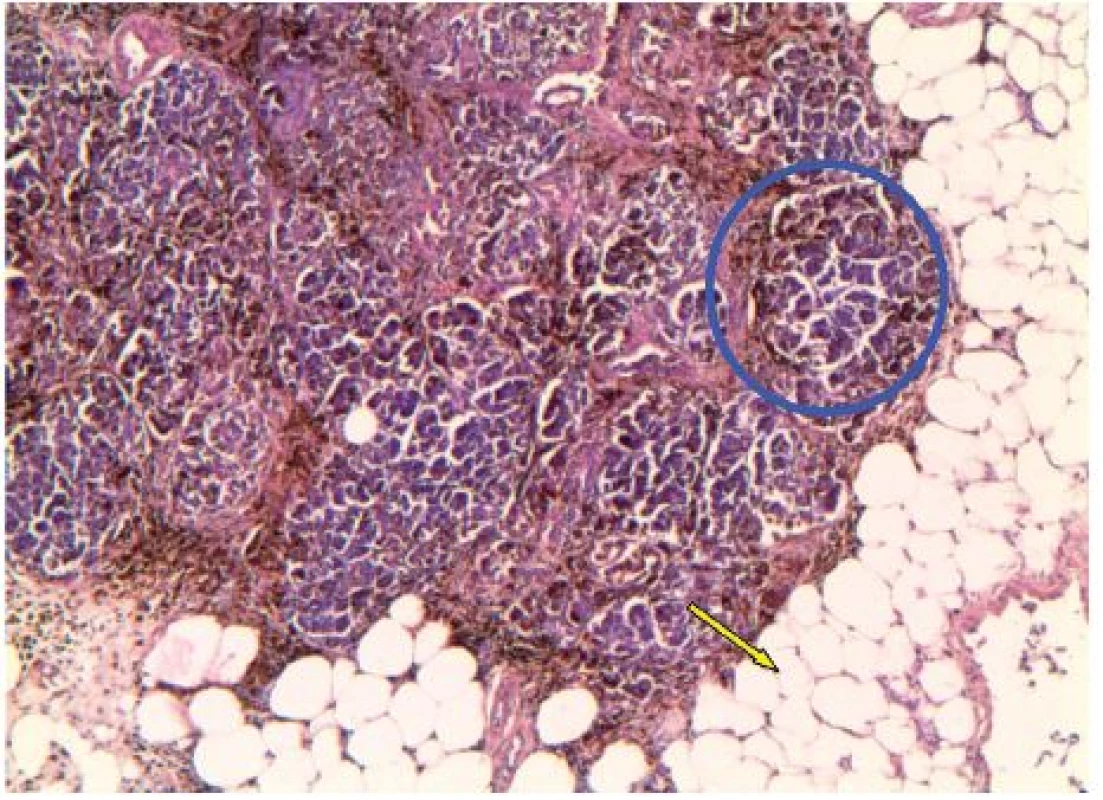
Obr. 5. Mohutná depozita hemosiderinu ve slezině, hematoxylin-eosin 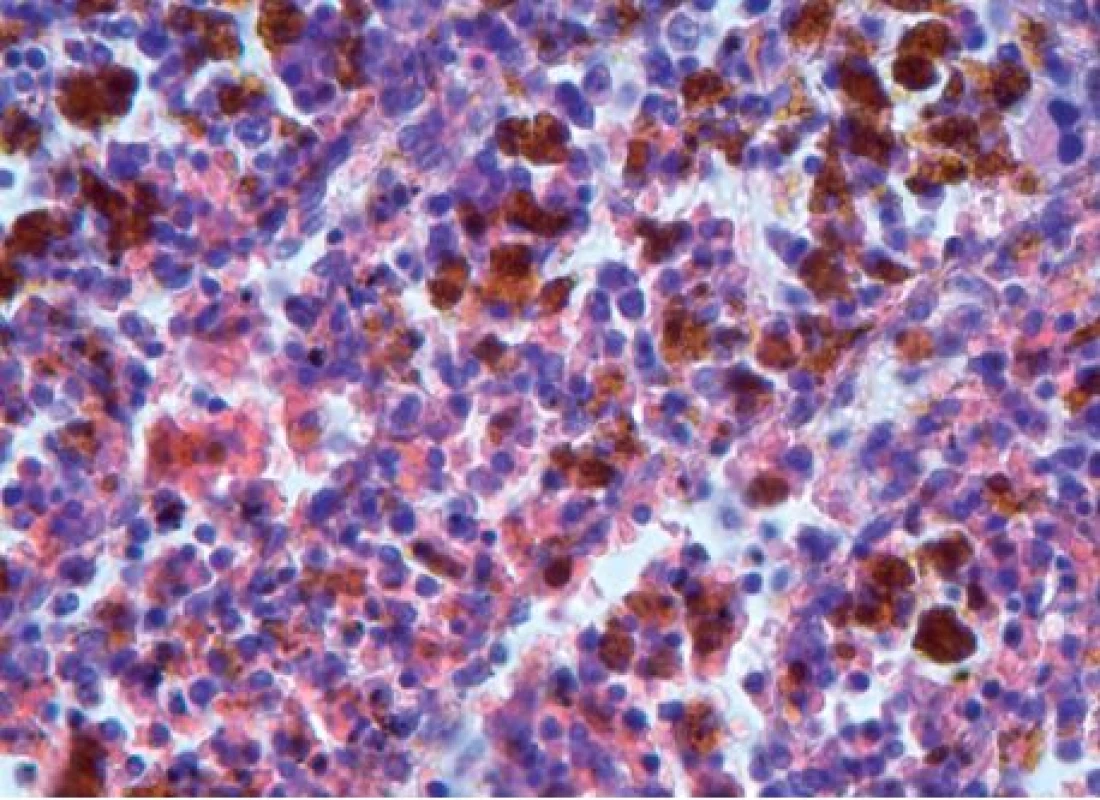
Nad rámec běžných literárních údajů jsou však naše snímky ledvinného glomerulu a tubulu s depozity hemosiderinu (obr. 6 a 7), které na první pohled korespondují s ledvinným selháním, jež figuruje jako jedna z příčin smrti v pitevní zprávě. Avšak vzhledem k tomu, že byly ledviny makroskopicky zcela intaktní, nabízí se jako další možná příčina selhání ledvin také hepatorenální syndrom, který je definován jako funkční selhání ledvin při jaterním onemocnění s portální hypertenzí [11]. Pro případný společný podíl diabetické a analgetické nefropatie na selhání ledvin našeho pacienta nemáme oporu v pitevním protokolu, chybí histopatologický průkaz.
Obr. 6. Ledvinný glomerulus s hnědými depozity hemosiderinu, hematoxylin-eosin 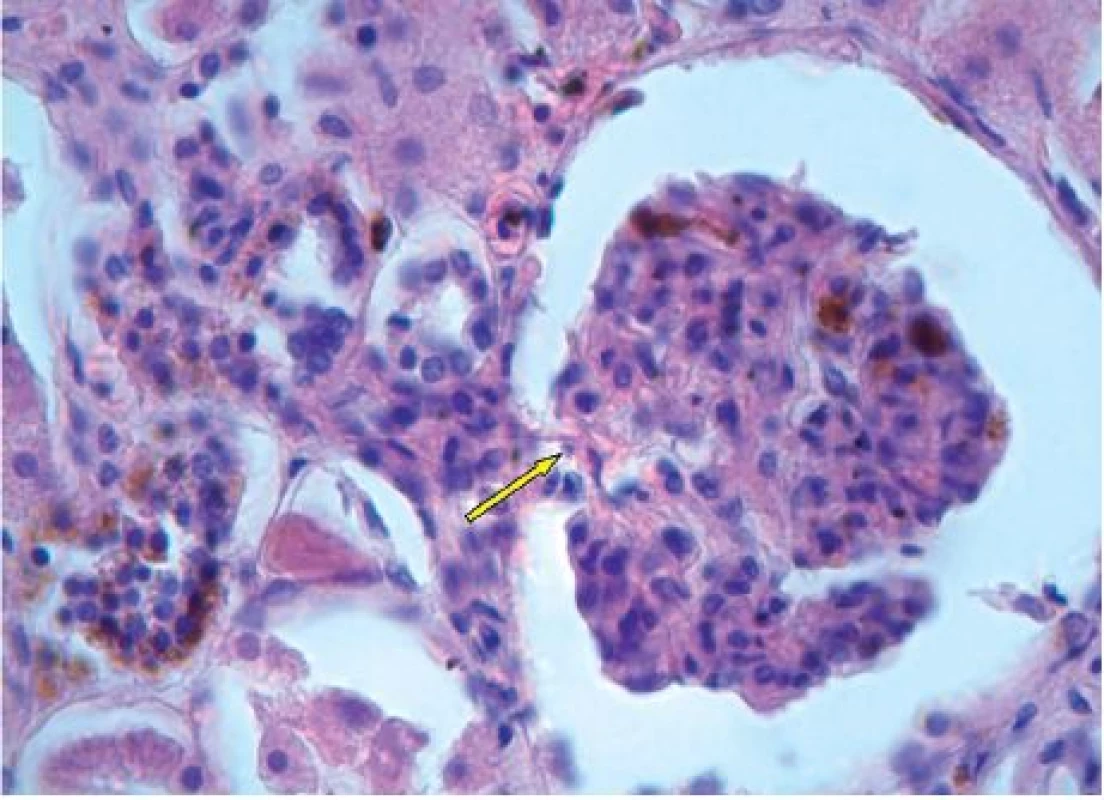
Obr. 7. Ledvinný kanálek s hemosiderinovými depozity, hematoxylineosin 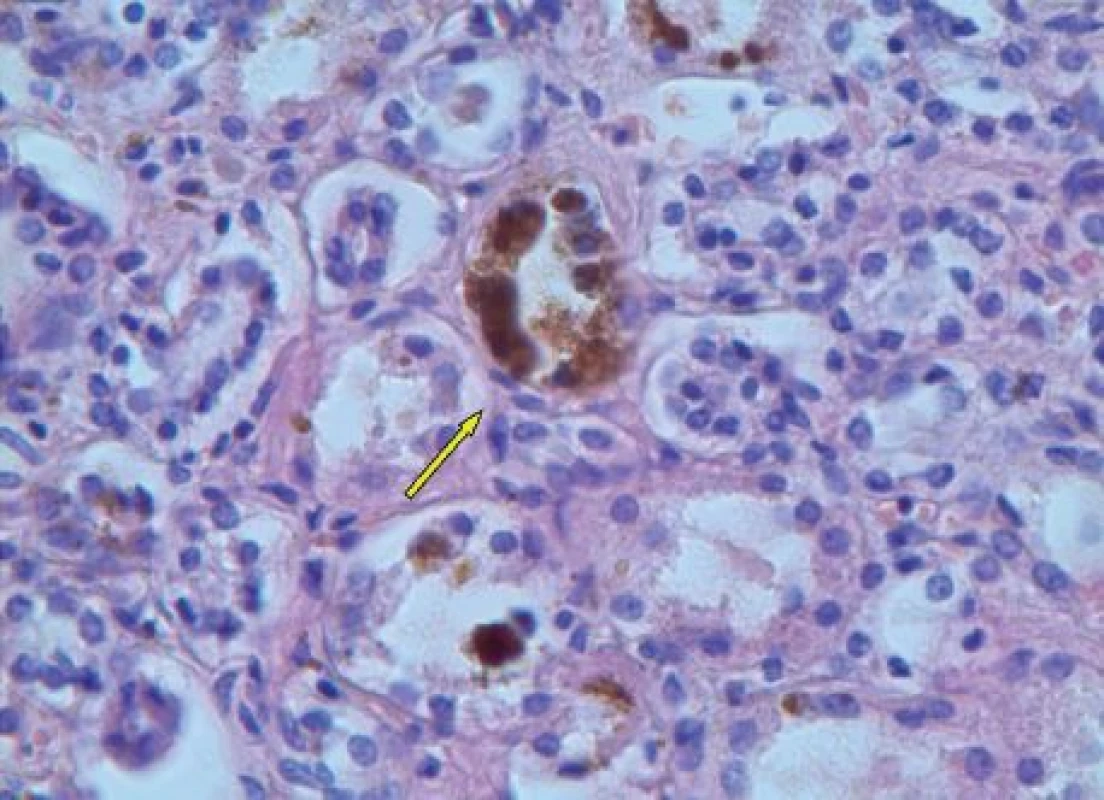
Nicméně, celá tato diskuse dokládá jednak nutnost včasné a účinné chelatace u transfuzně závislých MDS pacientů, jednak potřebu pokusit se tuto závislost zrušit účinnou léčbou. Léčba ESP (erytropoézu stimulující proteiny) je indikována u nemocných s hladinou hgb < 90 g/l nebo vyššími hodnotami při manifestních příznacích anémie, hladinou sérového erytropoetinu v séru < 500 IU/l (při čemž maximální efekt lze očekávat u nemocných s hladinou erytropoetinu < 150–200 IU/l) a transfuzní závislostí na ≤ 2 T. U. erytrocytů měsíčně [12]. Tato kritéria náš pacient nesplňoval, takže u něj nebyly ESP v léčbě nasazeny. Zásadním rozhodnutím pro našeho pacienta bylo zamítavé stanovisko pojišťovny k léčbě lenalidomidem, což se odehrálo v době, kdy měl pacient ještě dostatečnou hladinu trombocytů k zahájení léčby tímto preparátem, který mohl odstranit nebo zmírnit jeho závislost na transfuzích. Náš pacient měl v době diagnózy trombocytózu a počátek postupně progredující trombocytopenie spadá do období užívání deferipronu (viz tab. 1). Souhrn údajů o léčivém přípravku (SPC, summary of product characteristics) pro deferipron však trombocytopenii jako nežádoucí účinek neuvádí. Jestliže trombocytopenie nepatří do obrazu 5q - syndromu [2, 3], nabízí se v první řadě jako příčina poklesu destiček progrese do MDS typu RAEB. Náš pacient ale při trepanobioptickém a cytogenetickém vyšetření kostní dřeně, jež bylo provedeno až za 2 roky od započetí poklesu trombocytů, stále vykazuje pouze znaky MDS s nízkým rizikem. Takže za prolomením procesu efektivní megakaryopoézy u pacienta s 5q-syndromem mohly stát buď selhávající kostní dřeň a zhoršující se funkce jater při přetížení Fe, případně rozvoj anti HLA protilátek u polytransfundovaného pacienta, nebo také hypersplenismus, který je popisován jak při vyšetření zobrazovacími metodami, tak v pitevní zprávě.
ZÁVĚR
Náš pacient nezemřel na progresi MDS do akutní leukemie, ale v příčinné souvislosti se selháním životně důležitých orgánů, na jejichž poškození se výraznou měrou podílelo přetížení železem. Originálním pozorováním je fotograficky dokumentovaná těžká hemosideróza ledvin. Uvedená kazuistika dokládá nutnost účinné chelatace těch nízce rizikových, polytransfundovaných MDS pacientů, u kterých se nepodaří jejich závislost na transfuzích odstranit cílenou léčbou.
Seznam použitých zkratek
5-AZA – 5-azacytidin
ABL1 – gen Abelsonovy myší leukemie 1
ALP – alkalická fosfatáza
ALT – alanin amino-transferáza
AML – akutní myeloidní leukemie
aPTT-R – aktivovaný parciální trombinový čas – poměr
AST – aspartát amino-transferáza
BCR – brakepoint cluster region
BCR-ABL – fúzní gen a protein
CMV – cytomegalovirus
CT – počítačová tomografie
EBV – virus Ebsteina-Barrové
EF – ejekční frakce
ESP – erytropoézu stimulující proteiny
ETP – erytrocytové transfuzní přípravky
fbg – fibrinogen
Fe – železo
FISH – fluorescenční in situ hybridizace
GDF 15 – growth differentiation factor 15, růstový diferenciační faktor 15
GMT – gamaglutamyl-transferáza
HA KNTB – hematologická ambulance Hema-tologicko-transfuzního oddělení Krajské nemocnice T. Bati
HA VFN Praha – Hematologická ambulance Všeobecné fakultní nemocnice Praha
HAV, HCV – virus hepatitidy A, C
HbsAg – australský antigen
HTO KNTB Zlín – Hematologicko-transfuzní oddělení Krajské nemocnice T. Bati
INR – international normalized ratio, mezinárodní normalizovaný poměr pro vyjádření hodnoty Quickova koagulačního testu
IPSS – international Prognostic Scoring System, Mezinárodní prognostický skórovací systém
IPSS-R – Revidovaný mezinárodní prognostický systém
JAK-2 – gen pro Janusovu kinázu 2
KO – krevní obraz
MDS – myelodysplastický syndrom
MPO-T – myeloproliferativní onemocnění s trombocytózou
RAEB – refrakterní anémie s excesem blastů
ROS – reactive oxygen species, kyslíkové radikály
TGFβ1 – transformační růstový faktor beta 1
TIBC – total iron blood capacity, celková vazebná kapacita železa
v.s. – velmi suspektní
WPSS – WHO Prognostic Scoring System, WHO prognostický skórovací systém
Poděkování
Práce byla podpořena studentským grantem Univerzity Palackého IGA-LF-2015-001.
Podíl autorů na rukopisu
KE – vyšetřování a léčba pacienta, napsání rukopisu
NR – kontrola a revize rukopisu
SP – poskytnutí obrazové dokumentace a odborného komentáře k ní
ČL, JA – vyšetřování a léčba pacienta, poskytnutí dokumentace
Prohlášení autorů
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce: 16. 3. 2015
Přijato po recenzi: 12. 5. 2015
MUDr. Eva Kadlčková
Hematologicko-transfuzní oddělení Krajské nemocnice T. Bati
Havlíčkovo nábřeží 600
760 01 Zlín
e-mail: kadlckova@bnzlin.cz
Zdroje
1. Žídková M, Voglová J, Bělohlávková P, et al. Novinky v klasifikaci MDS a stanovení prognózy dle WPSS. Transfuze Hematol dnes, 2010;16(1):42–46.
2. Van den Berghe H, Cassiman JJ, David G, et al. Dicstinct haematological disorder with deletion of long arm of no. 5 chromosome. Nature 1974;251 : 437–438.
3. Neuwirtová R, Jonášová A, Čermák J, a kol. Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. choromozomu (del(5q)), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy. Transfuze Hematol dnes, 2009;15 : 204–209.
4. List A, Dewals G, Bennett J, et al. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Eng J Med, 2006;355(14):1456–1465.
5. Komrokji RS, List A. Lenalidomide for treatment of myelodysplastic syndromes. Curr Pharm Des, 2012;18 : 3198–3203.
6. Rose C, Brechignac S, Vassilief D, et al. Does iron chelation therapy improve survival in regularly transfused lower risk MDS patients? A multicenter study by the GFM (Groupe Francophone des Myelodysplasies). Leuk Res, 2010;34(7):864–870.
7. Čermák J. Přetížení železem – novinky v patogenezi a léčbě. Vnitřní lékařství: 90 let doc. MUDr. Dušana Mrkose, CSc., XXVIII. dny mladých internistů. Sborník abstrakt, 2009;55(Suppl 1):59–63.
8. Pospíšilová D. Současný přístup k léčbě přetížení železem. Farmakoterapie, 2010;6(1):84–90.
9. Wood JC, Enriquez C, Ghugre N, et al. Physiology and pathophy-siology of iron cardiomyopathy in thalassemia. Ann N Y Acad Sci, 2005;1054 : 386–395.
10. Penka M, Buliková A. Neonkologická hematologie: 2. doplněné a zcela přepracované vydání. 2. vyd. Praha: Grada Publishing, 2009, s. 25–38.
11. Wadei HM, Mai ML, Ahsan N, et al. Hepatorenal syndrome: pathophysiology and management. CJASN, 2006; 1(5):1066–1079.
12. Čermák J, Jonášová A. Doporučené diagnostické a léčebné postupy u nemocných s myelodysplastickým syndromem. Vydala Sekce pro myelodysplastický syndrom České hematologické společnosti ČLS JEP, Praha 2009.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2015 Číslo 3- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Léčba on-demand je jednoznačně neefektivní v prevenci vývoje hemofilické artropatie
-
Všetky články tohto čísla
- Protinádorové účinky klinicky používaných chelátorů železa – přehled literatury a vlastní zkušenosti
- Získaná uniparentální disomie v buňkách kostní dřeně nemocných s myelodysplastickými syndromy a komplexním karyotypem
- Kazuistika (ne)chelatovaného polytransfundovaného pacienta s 5q minus syndromem
- Nové testy pro screening syfilis u dárců krve
-
Diagnostika a léčba mnohočetného myelomu,
Doplněk č. 2 z 6/2015 - Role of allogeneic stem cell transplantation in adult patients with Ph-negative acute lymphoblastic leukemia
- Efficacy, safety, and survival with ruxolitinib in patients with myelofibrosis: results of a median 3-year follow-up of COMFORT-I
- Current Outcome Of HLA Identical Sibling Versus Unrelated Donor Transplants In Severe Aplastic Anemia: An EBMT Analysis
-
Přehled produkce transfuzní služby ČR za rok 2014
(transfuzní přípravky i plazma pro frakcionaci) - Autotransfuze v České republice v roce 2014
- Zemřel MUDr. Vladimír Kulich (20. 2. 1926 – 14. 5. 2015)
- Transfuzní služba 1950–1992
- Profesor Zdeněk Vodrážka in memoriam
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Nové testy pro screening syfilis u dárců krve
- Protinádorové účinky klinicky používaných chelátorů železa – přehled literatury a vlastní zkušenosti
- Získaná uniparentální disomie v buňkách kostní dřeně nemocných s myelodysplastickými syndromy a komplexním karyotypem
- Kazuistika (ne)chelatovaného polytransfundovaného pacienta s 5q minus syndromem
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



