-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
The cytomorphology and immunophenotype of mantle-cell lymphoma
Introduction:
Mantle-cell lymphoma (MCL) is a rare lymphoid neoplasm of B-cell origin characterized by over-expres-sion of cyclin D1 and it is usually associated with the chromosomal translocation t(11; 14). MCL may exhibit classical morphology or one of 4 morphological variants (small-cell, pleomorphic, blastoid and marginal zone lymphoma-like). The immunophenotype is characterized by the high expression of pan-B-cell markers - CD19, CD20, CD22, CD79, surface membrane immunoglobulins IgM, IgD including their light chains and CD5 antigen. The intranuclear expres-sion of cyclin D1 is specific for MCL. The surface membrane marker FMC7 is usually positive; CD43, CD38, bcl-2 and transcription factor SOX11 are regularly positive as well. The antigens CD23, CD10, CD11c, CD103, CD200 and bcl-6 are typically negative in MCL.Methods:
16 cases of newly diagnosed MCL were included in the study (samples included peripheral blood, bone marrow, lymph nodes and cerebrospinal fluid). The cytomorphology evaluation was done on samples of peripheral blood and bone marrow smears, lymph node imprints and cerebrospinal fluid cytospins using classical panoptic staining. This determined the cytomorphological subtype of MCL. The immunophenotype was then detected by flow cytometric analysis using the FACS Canto II flow cytometer (manufactured by Becton-Dickinson). Multiparameter analysis of surface membrane antigen expression included detecting positivity or negativity of CD19, CD20, CD22, CD79b, surface membrane light chains kappa and lambda, CD23, FMC7, CD5, CD10, CD25, CD35, CD38, CD11c, CD103 and CD200; the signal intensity of each CD marker expression (mean fluorescence intensity, MFI) was also measured by using a diagnostic panel of monoclonal antibodies.Results:
The study included 11 men and 5 women with a median age of 70 years. Cytomorphological features included 7 cases of classic MCL and 9 cases of variant types (4 small-cell, 3 pleomorphic, 1 blastoid, 1 „marginal zone lymphoma-like” form). Surface membrane cell markers CD19, CD20, CD22 and CD79b were constantly positive with high expression (the highest being CD20). Surface membrane light chains kappa and lambda expression were observed alternately in one half the cases (with prevalent lambda light chain intensity expression). The expression of CD5 was mostly high; two cases were CD5-negative. FMC7 was positive in 10 cases with variable expression of intensity. Variable expression of CD25 was observed and CD35 was positive in three-quarters of all patients, CD38 was positive in the majority of cases (high intensity of expression). CD23, CD11c and CD103 were negative, CD43 was also mostly negative. One CD10 positive case and two CD200 positive cases were found in our study. The variability of expression intensity was common even for CD markers with the highest intensity of expression.Conclusions:
Assessment of the immunocytological profile is one of the main components of MCL diagnosis. The cytomorphological and immunophenotypical variability of MCL is high. Accurate differential diagnosis of MCL, chronic lymphocytic leukaemia, marginal zone lymphoma and some cases of B-prolymphocytic leukaemia is necessary. The immunophenotypical panel used in our study is appropriate to diagnose most MCL cases.Key words:
mantle-cell lymphoma, cytology, immunophenotype
Autori: D. Starostka 1; D. Koláček 1; P. Mikula 1; M. Tichý 2,3
Pôsobisko autorov: Oddělení klinické hematologie, Nemocnice s poliklinikou Havířov, p. o. 1; Ústav klinické a molekulární patologie, Lékařská fakulta UP v Olomouci 2; CGB laboratoř, a. s. 3
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 4, p. 173-183.
Kategória: Souhrnné práce, původní práce, kazuistiky
Súhrn
Úvod:
Lymfom z plášťových buněk (MCL) je vzácná zralá B-lymfoidní neoplazie charakteristická nadměrnou expresí cyklinu D1 a většinou spojená s translokací t(11;14). MCL vykazuje klasickou morfologii nebo se vyskytuje v některé ze 4 morfologických variant (malobuněčná, pleomorfní, blastoidní a podobná lymfomu z marginální zóny). Imunofenotyp je charakteristický vysokou expresí pan-B-markerů CD19, CD20, CD22 a CD79, povrchových imunoglobulinů IgM, IgD včetně jejich lehkých řetězců a znaku CD5. Specifická je intranukleární exprese cyklinu D1. Povrchový FMC7 je většinou pozitivní, pravidelně je pozitivní také CD43, CD38, bcl-2 a transkripční faktor SOX11. Znaky CD23, CD10, CD11c, CD103, CD200 a bcl-6 jsou u MCL typicky negativní.Materiál a metody:
Soubor zahrnoval 16 případů nově diagnostikovaného MCL (vzorky periferní krve, kostní dřeně, lymfatické uzliny a cerebrospinálního likvoru). Cytomorfologické hodnocení se realizovalo v nátěrech periferní krve, kostní dřeně, imprintech lymfatické uzliny a cytospinu cerebrospinálního likvoru po klasickém panoptickém barvení se zařazením k jednotlivým cytomorfologickým formám MCL. Imunofenotyp byl stanoven imunofenotypizací na průtokovém cytometru FACS Canto II výrobce Becton-Dickinson po přípravných procedurách. Multiparametrová analýza povrchové exprese diagnostických markerů zahrnovala stanovení pozitivity či negativity znaků CD19, CD20, CD22, CD79b, povrchových lehkých řetězců kappa a lambda, CD23, FMC7, CD5, CD10, CD25, CD35, CD38, CD11c, CD103 a CD200 a intenzity jejich exprese (MFI, mean fluorescence intensity) s využitím vlastního diagnostického panelu.Výsledky:
V souboru bylo 11 mužů a 5 žen s mediánem věku 70 let. Cytomorfologické nálezy zahrnovaly 7 případů klasického MCL a 9 variantních forem (4krát malobuněčná, 3krát pleomorfní, 1krát blastoidní a 1krát podobná lymfomu z marginální zóny). Povrchové markery CD19, CD20, CD22 a CD79b byly konstantně pozitivní s vysokou úrovní exprese (nejvyšší intenzita exprese u CD20). Povrchové lehké řetězce kappa a lambda se vyskytly alternativně u poloviny případů (intenzita exprese lambda zřetelně převažovala). Znak CD5 měl většinou vysokou úroveň exprese, dva případy byly CD5-negativní. FMC7 byl pozitivní u 10 případů a vykazoval velmi variabilní úroveň exprese. Exprese CD25 byla variabilní, marker CD35 byl pozitivní u 3/4 nemocných, CD38 byl většinově pozitivní s vysokou intenzitou exprese. Negativní byly CD23, CD11c a CD103, většinově negativní byl také CD43. 1 případ byl CD10-pozitivní, 2 případy byly CD200-pozitivní. Variabilita intenzity exprese byla obvyklá i u znaků s vysokou mírou exprese.Závěr:
Stanovení imunocytologického profilu je jedním ze základních prvků diagnostiky MCL. Cytomorfologická a imunofenotypová variabilita MCL je značná. Je nutná pečlivá diferenciální diagnostika MCL, chronické lymfocytární leukemie, lymfomu z marginální zóny a některých případů B-prolymfocytární leukemie. Použitý imunofenotypizační panel je vhodný pro diagnostiku drtivé většiny případů MCL.Klíčová slova:
lymfom z plášťových buněk, cytologie, imunofenotypÚVOD
Lymfom z plášťových buněk (mantle-cell lymfom, MCL) je vzácná zralá B-lymfoidní neoplazie charakteristická nadměrnou expresí cyklinu D1 (eventuálně cyklinu D2 či D3) a většinou spojená s translokací t(11;14). MCL je nádor z malých až středně velkých B-lymfocytů podobných centrocytům. Má klasickou morfologii nebo se vyskytuje v některé ze 4 morfologických variant. Morfologický obraz nemoci je tedy značně variabilní: od malých zralých lymfocytů podobných těm u chronické lymfocytární leukemie (CLL) přes středně velké centrocytoidní lymfocyty s jadernými nepravidelnostmi (zářezy jádra, lobulizace) až k bizarním lymfoidním elementům podobným prolymfocytům či blastům s jemnou jadernou strukturou a nukleoly u blastoidní varianty MCL. Poměrně příznačný je výskyt „buttock cells“. Infiltrace kostní dřeně je přítomna u 2/3 případů, typicky je smíšená nodulární a paratrabekulární, méně často intersticiální nebo difuzní. V ostatních postižených tkáních je patrný naznačeně nodulární nebo difuzní způsob infiltrace. Vzácně je nádorová léze omezena na vnitřní plášťovou zónu („in situ“ MCL) [1–4]. Hlavní morfologické varianty MCL popisuje tabulka 1, raritně se vyskytuje také MCL s prolymfocytoidními rysy [1].
Tab. 1. Morfologické varianty MCL [1] ![Morfologické varianty MCL [1]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5b4cb1695a9708d922ce8529d730f682.png)
Z hlediska imunofenotypu vykazuje většina případů vysokou expresi pan-B-markerů CD19, CD20, CD22 a CD79, povrchových imunoglobulinů IgM, IgD, jejich lehkých řetězců (převažuje lehký řetězec lambda) a znaku CD5 (obr. 1). FMC7 je většinou pozitivní, pravidelně je pozitivní CD43, CD38 a bcl-2. Charakteristickým rysem je intranukleární exprese cyklinu D1. Negativní expresi mají znaky CD10, CD11c, CD23, CD25, CD103, CD200 a bcl-6. Proliferační aktivitu odráží exprese znaku Ki-67 [1, 3, 5]. Poměrně specifickým markerem MCL je transkripční faktor SOX11, jehož zvýšenou expresi lze prokázat imunohistochemicky nebo molekulárně geneticky [6].
Obr. 1. MCL, membránová pozitivita CD5, imunohistochemie, světelná mikroskopie, zvětšení 400krát (Publikováno se souhlasem CGB laboratoře a. s.) 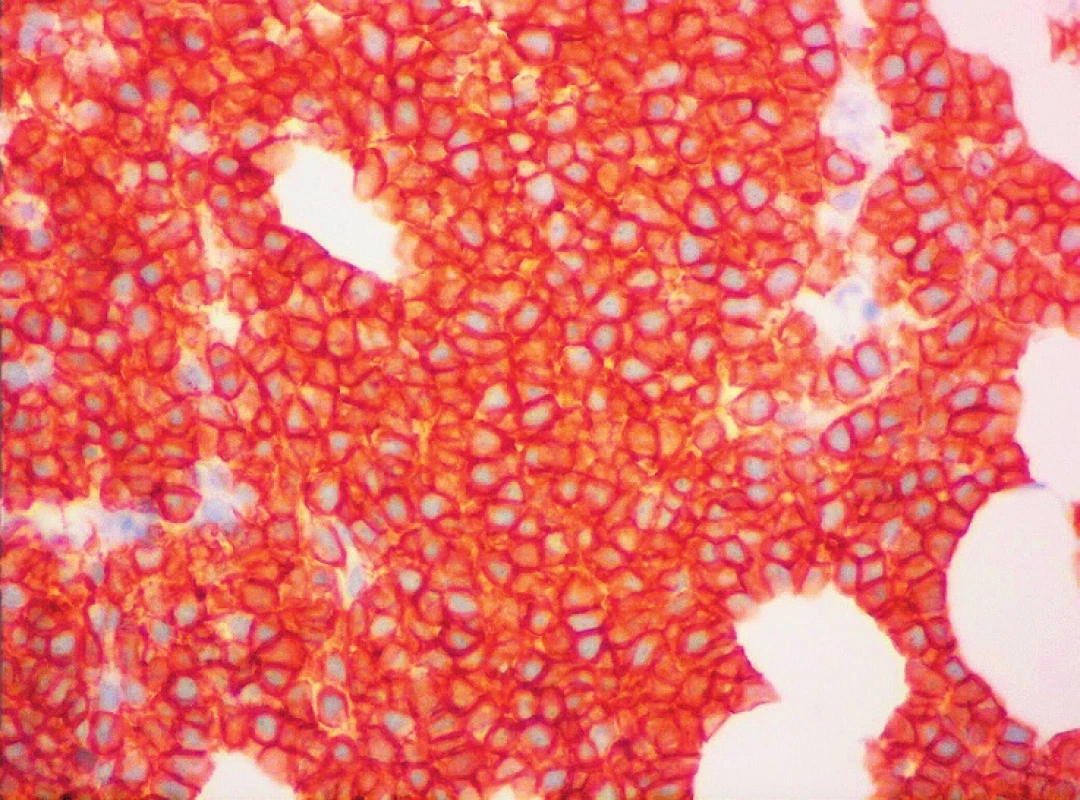
Z uvedeného vyplývá, že základem diagnózy MCL je pečlivé morfologické vyšetření (histologie a cytologie) a stanovení imunofenotypu nádorové populace (imunohistochemie a imunofenotypizace pomocí průtokové cytometrie). Úloha histologie s imunohistochemií je v tomto kontextu klíčová, zejména při průkazu CD5 a cyklinu D1.
K diagnóze významným způsobem přispívá genetická analýza. Je přítomna přestavba genu pro těžký imunoglobulinový řetězec, většinou v nemutované formě. Změny karyotypu jsou obvykle komplexní. Diagnostická je translokace t(11;14)(q13;q32) mezi geny pro IGH a cyklin D1 (CCND1) vedoucí k nadměrné expresi cyklinu D1 (obr. 2). Časté jsou změny v oblasti 11q22-23 (40–75 %) a del13q14 (43–51 %), ostatní aberace zahrnují změny v oblasti 3q26, 7p21, 8q24, 1p13-p31, 6q23-q27, 9p21, 13q11, 17p13 a trizomii 12. Případy pleomorfní a blastoidní varianty MCL mají často tetraploidii se zmnožením genu CCND1 nebo mutací genu TP53. Vzácné případy bez translokace t(11;14) exprimují cyklin D2 nebo D3 [1, 2, 3, 7].
Obr. 2. Lymfom z plášťových buněk, t(11; 14), FISH (sonda Kreatech ON BCL1/IGH t(11;14)Fusion), fúzní signály translokovaných chromozomů jsou vyznačeny šipkou (Publikováno se souhlasem CGB laboratoře a. s.) 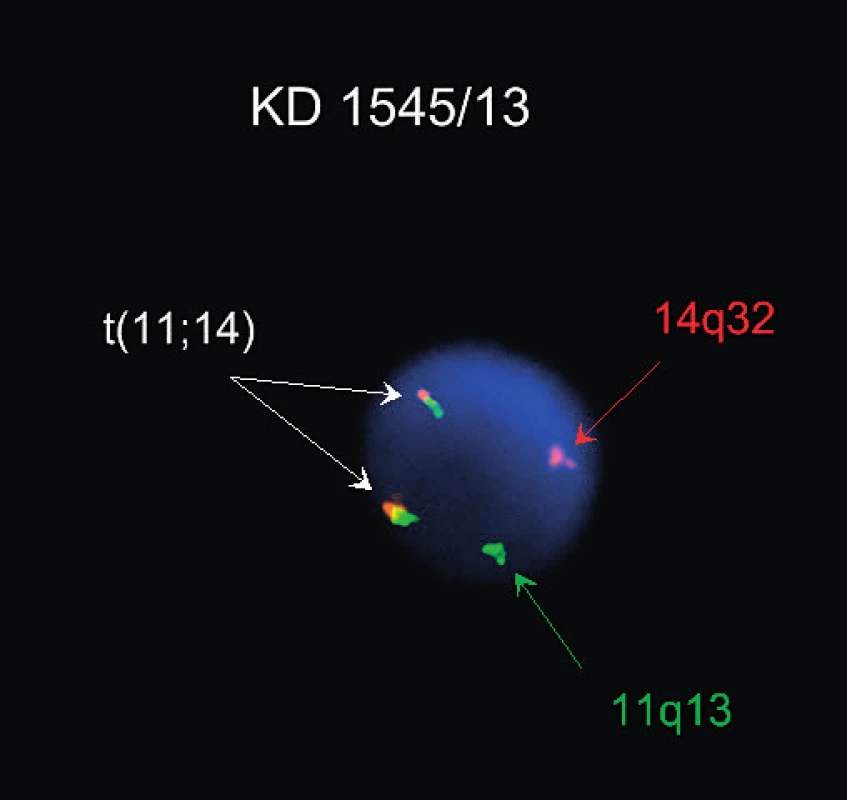
MATERIÁL A METODIKA
Vyšetřovaný soubor zahrnoval 16 případů histologicky verifikovaného lymfomu z plášťových buněk nově diagnostikovaného v letech 2013 a 2014. Histopatologická diagnóza byla ve všech případech považována za jistou, imunohistochemická analýza prokázala pozitivitu cyklinu D1 u všech případů. Analyzovaným materiálem bylo 31 vzorků periferní krve, kostní dřeně, lymfatické uzliny a cerebrospinálního likvoru.
Cytomorfologické hodnocení světelnou mikroskopií s využitím mikroskopu Nikon Eclipse (objektiv Plan Apo 100x/1.4 Oil NCG) se realizovalo v nátěrech periferní krve (14krát), kostní dřeně (14krát), imprintech lymfatické uzliny (2krát) a cytospinu cerebrospinálního likvoru (1krát) po klasickém panoptickém barvení (barviva May-Grünwald, Giemsa-Romanowski). Hodnocené detailní morfologické prvky při 1000násobném zvětšení zahrnovaly: velikost buněk, poměr cytoplazmy a jádra, tvar a lokalizace jádra, charakter jaderného chromatinu, přítomnost nukleolů, barvitelnost cytoplazmy, přítomnost intracytoplazmatických vakuol, granulí nebo inkluzí, výskyt anizocytózy a anizomorfie. Na základě většinového cytologického obrazu byly případy zařazeny k jednotlivým cytomorfologickým formám MCL (klasický MCL, varianta pleomorfní, malobuněčná, podobná lymfomu z marginální zóny a blastoidní).
Imunofenotyp jednotlivých případů byl stanoven metodou průtokové cytometrie ve vzorcích periferní krve (14krát), kostní dřeně (14krát), lymfatické uzliny (2krát) a cerebrospinálního likvoru (1krát). Imunofenotypizace pomocí průtokové cytometrie se prováděla v režimu „lyse-wash“ po přípravných procedurách, které zahrnovaly eventuální mechanickou dezintegraci (u lymfatických uzlin), filtraci a korekci celularity analyzované suspenze buněk. Inkubace s monoklonálními protilátkami trvala 15 minut. K lýze a promývání bylo použito zařízení LyseWash Assistant výrobce Becton-Dickinson. K multiparametrové analýze povrchové exprese diagnostických markerů sloužil průtokový cytometr FACS Canto II výrobce Becton-Dickinson s optimalizovaným nastavením technických parametrů (voltáž a kompenzace) a klinický software FACS Diva. Analýza exprese zahrnovala stanovení pozitivity či negativity jednotlivých znaků (cut-off hodnota exprese 30 % na B-lymfocytech) a intenzity jejich exprese (MFI, mean fluorescence intensity) na B-lymfocytech. U všech případů bylo stanoveno skóre pro chronickou lymfocytární leukemii (CLL-skóre) podle E. Matutes. Analýza probíhala na nejméně 5000 B-lymfocytů ve zkumavkách: CD45-PerCp-Cy5.5/CD3-FITC/CD4-PE-Cy7/CD8-APC-Cy7/CD16+56-PE/CD19-APC, CD19-PerCp-Cy5.5+kappa-FITC+lambda-PE/CD200-PE-Cy7/CD95-APC, CD19-PerCp-Cy5.5+CD23-PE+ FMC7-FITC/CD79b-APC/CD5-PE-Cy7, CD20-APC-Cy7/CD10-PE/CD43-APC/CD35-FITC/CD38-PE-Cy7 a CD20-PerCp-Cy5.5+CD22-PE+CD103-FITC/CD25-PE-Cy7/CD11c-APC. Všechny použité protilátky pocházely od firmy Becton-Dickinson. Negativní izotypové kontroly nebyly použity.
VÝSLEDKY
Věkové rozpětí nemocných bylo 48–88 let s věkovým mediánem 70 let, v souboru bylo 11 mužů a 5 žen.
Cytomorfologie
Sedm případů z celkového počtu 16 vykazovalo klasickou cytomorfologii. Malobuněčná varianta nemoci se vyskytla ve 4 případech, pleomorfní variantu MCL jsme pozorovali u 3 pacientů. Jeden z případů pleomorfní varianty byl charakteristický výskytem bilobárních jader. Vzácnější byly případy blastoidní varianty (1 případ) a varianty podobné lymfomu z marginální zóny (1 pacient). Cytologické rysy jednotlivých morfologických typů MCL dokumentují obrázky 3–10.
Obr. 3. MCL, klasická morfologie s převažujícími centrocyty, imprint lymfatické uzliny, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 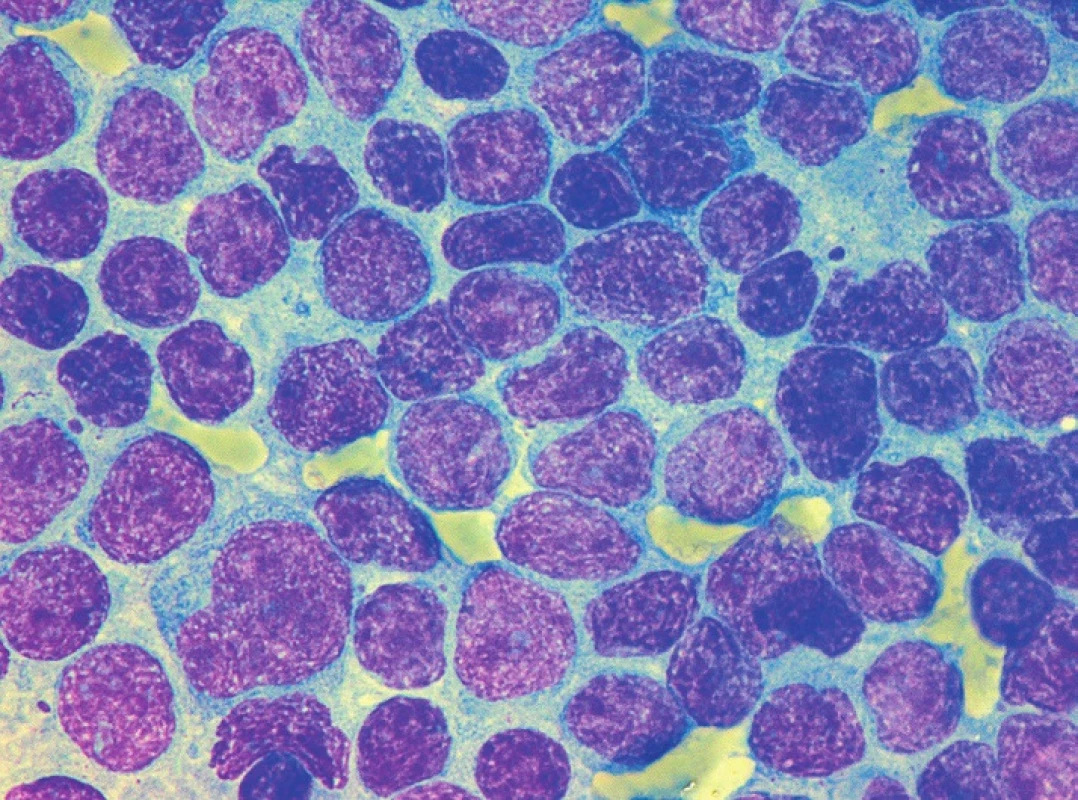
Obr. 4. MCL, klasická morfologie s převažujícími centrocyty a přítomností „buttock cells“, nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 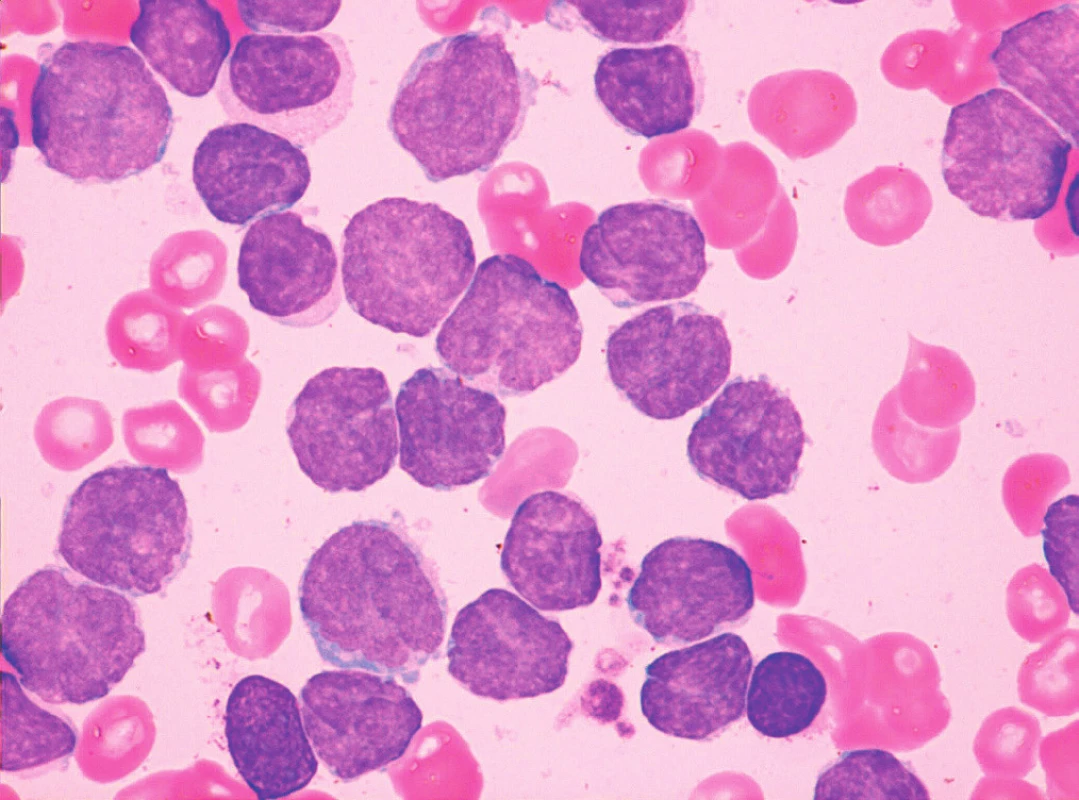
Obr. 5. MCL, malobuněčná („CLL-like“) varianta, převaha malých zralých lymfocytů, nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 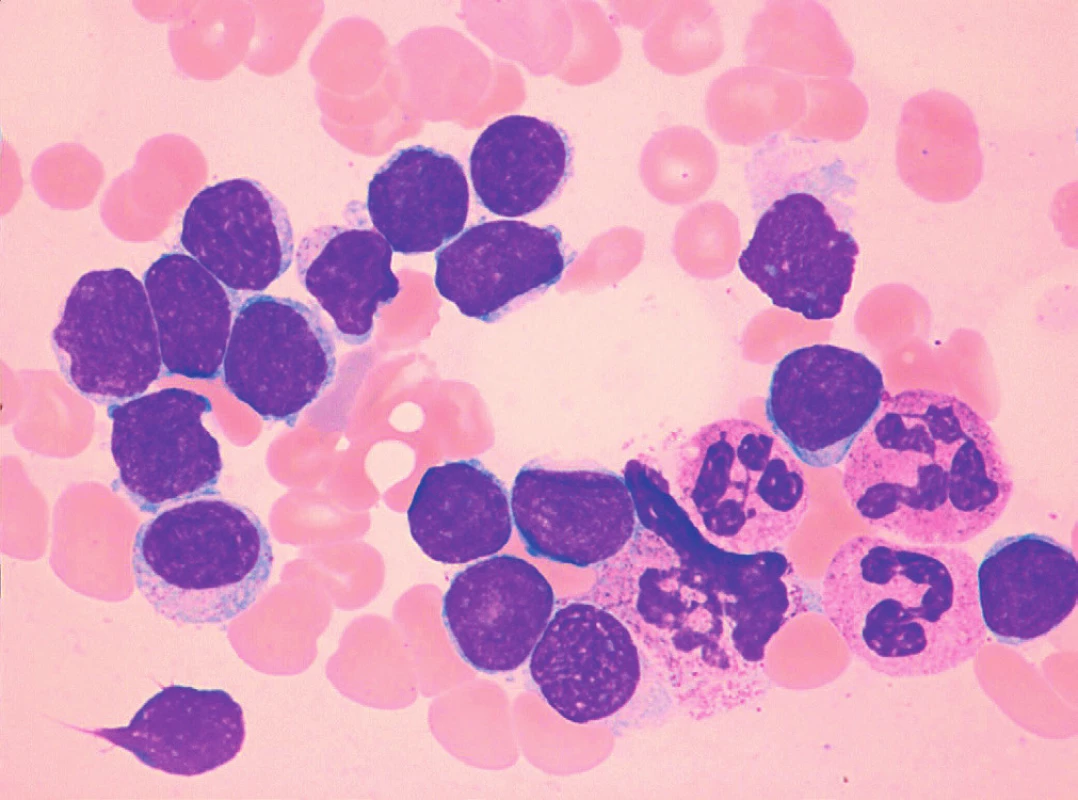
Obr. 6. MCL, pleomorfní varianta (anizocytóza, anizomorfie, jaderné atypie a přítomnost nukleolů), nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 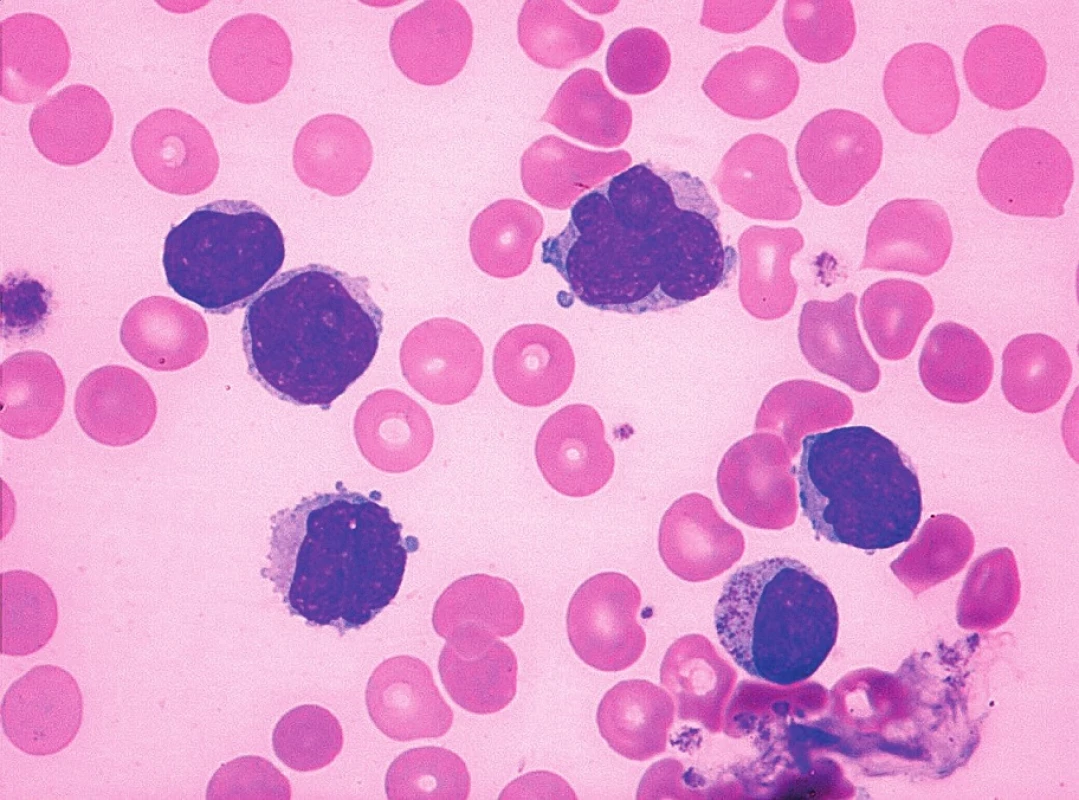
Obr. 7. MCL, pleomorfní varianta s prolymfocytoidními rysy (v popředí jaderné atypie), nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 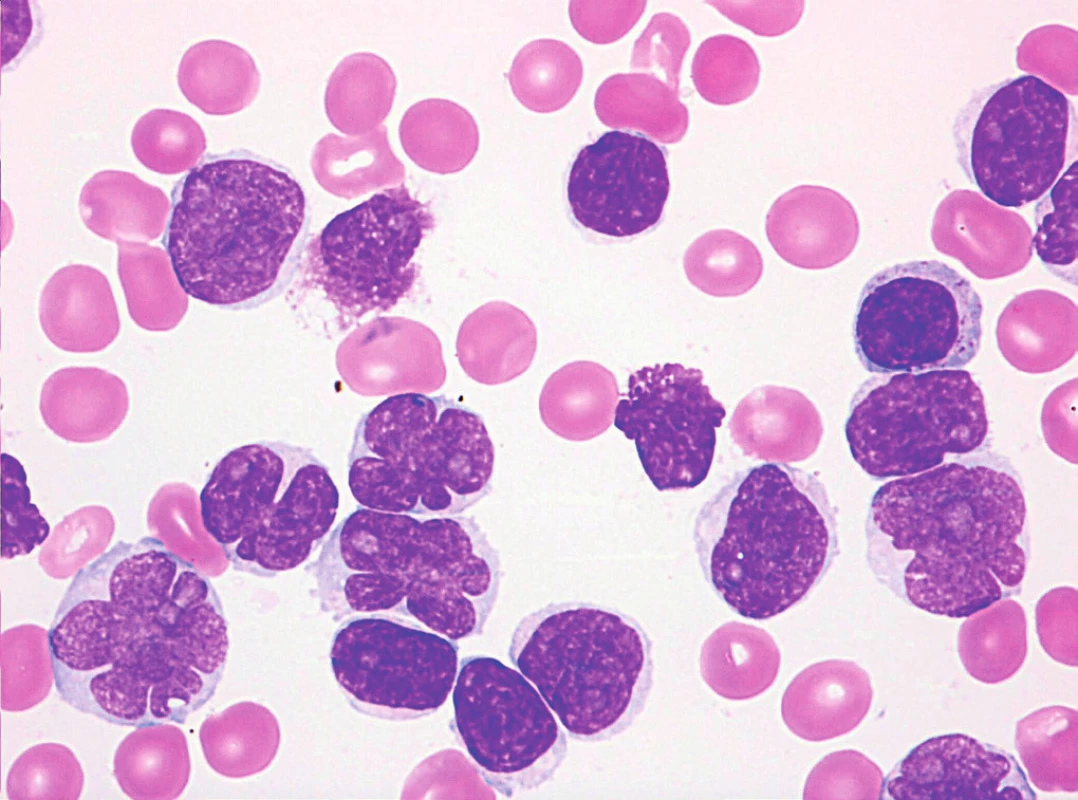
Obr. 8. MCL, pleomorfní varianta s bilobárními jádry, nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 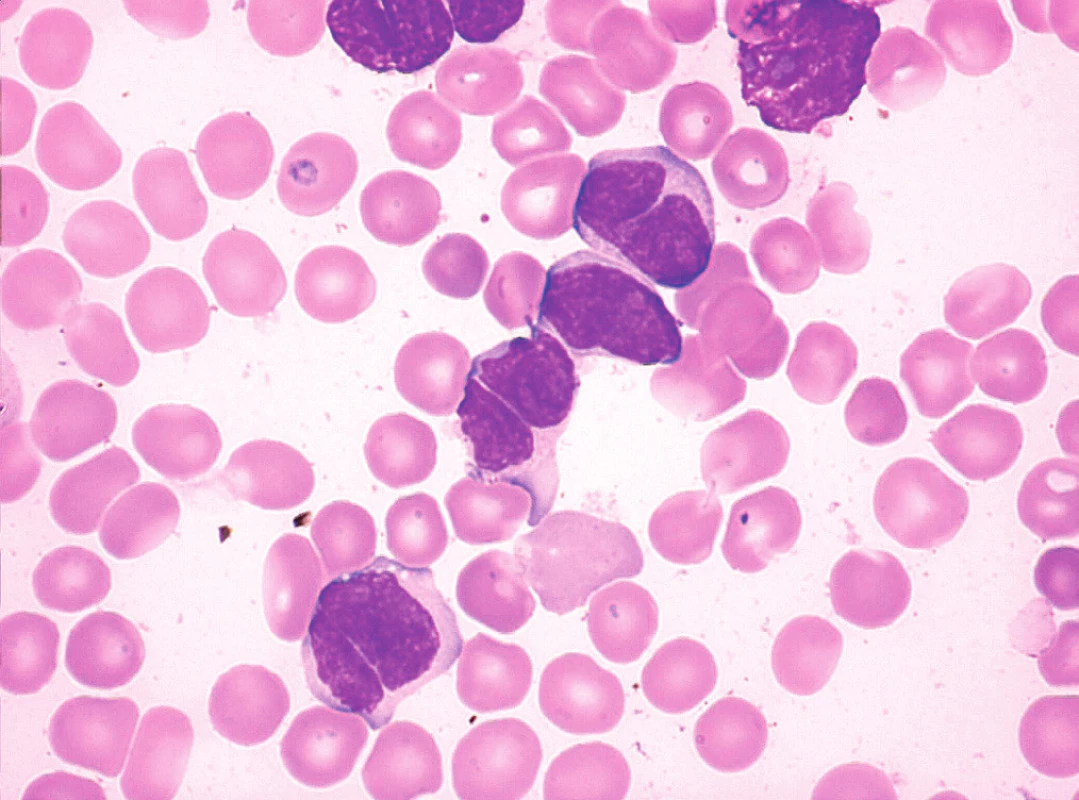
Obr. 9. MCL, blastoidní varianta, nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 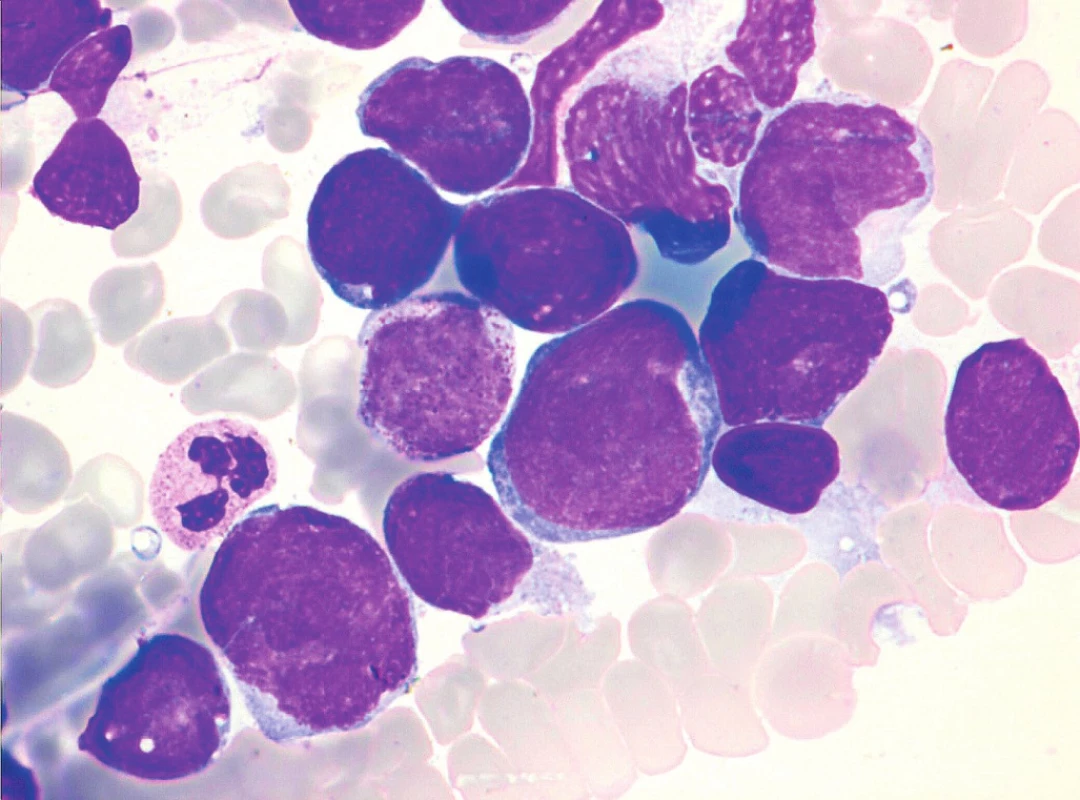
Obr. 10. MCL, varianta podobná lymfomu z marginální zóny, nátěr kostní dřeně, barvení May-Grünwald, Giemsa-Romanowski, světelná mikroskopie, zvětšení 1000krát 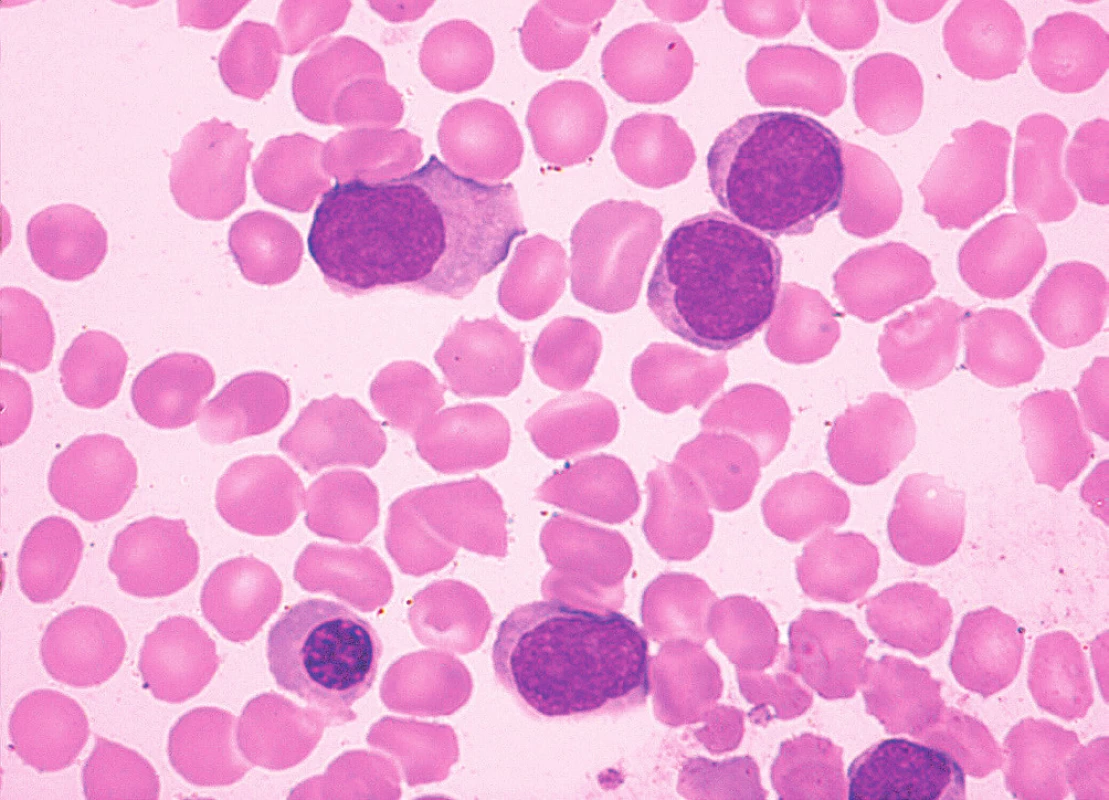
Imunofenotyp
Imunofenotypový profil souboru MCL popisuje tabulka 2. Tabulka shrnuje počet pozitivních a negativních případů pro jednotlivé vyšetřované diagnostické znaky a podává informace o kvantitativní charakteristice intenzity jejich exprese.
Tab. 2. Pozitivita a intenzita exprese diagnostických znaků u MCL* 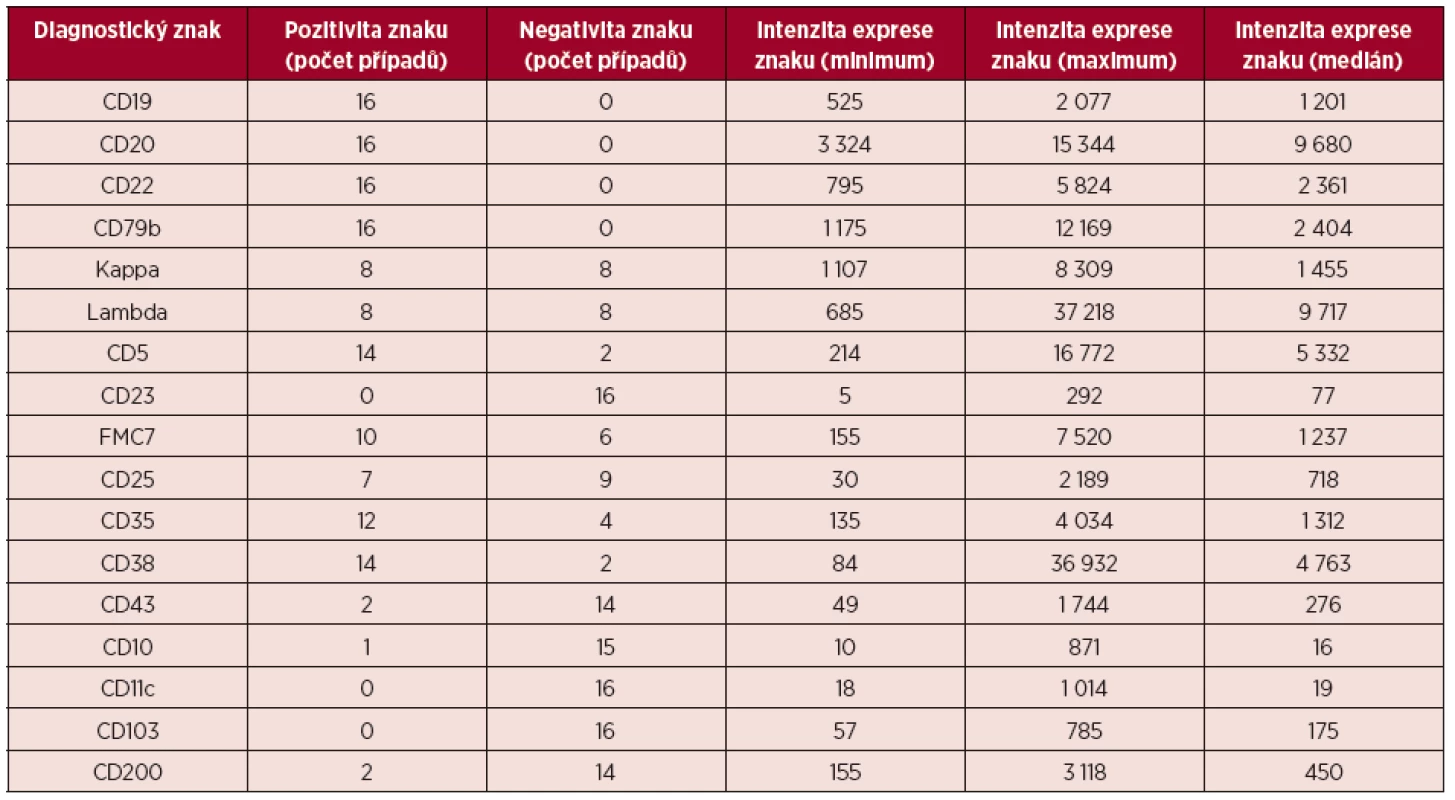
*Intenzita exprese je vyjádřena jako MFI na logaritmické škále, uvádí se minimum, maximum a medián MFI. Obr. 11. Variabilní exprese znaků CD20 a CD22, dvouparametrové dot plot diagramy, CD20 na vodorovné a CD22 na svislé ose, logaritmická škála exprese na obou osách 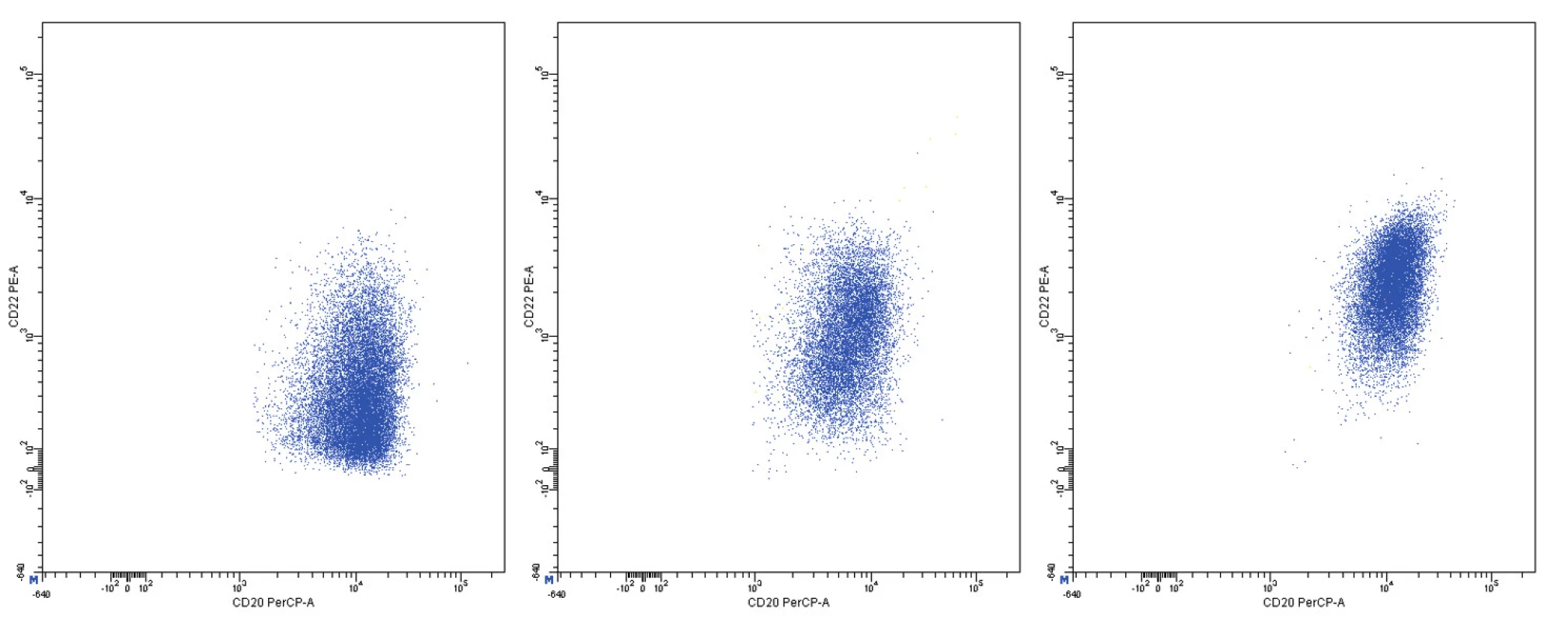
Obr. 12. Variabilní exprese znaku CD5, dvouparametrové dot plot diagramy, CD19 na vodorovné a CD5 na svislé ose, logaritmická škála exprese na obou osách 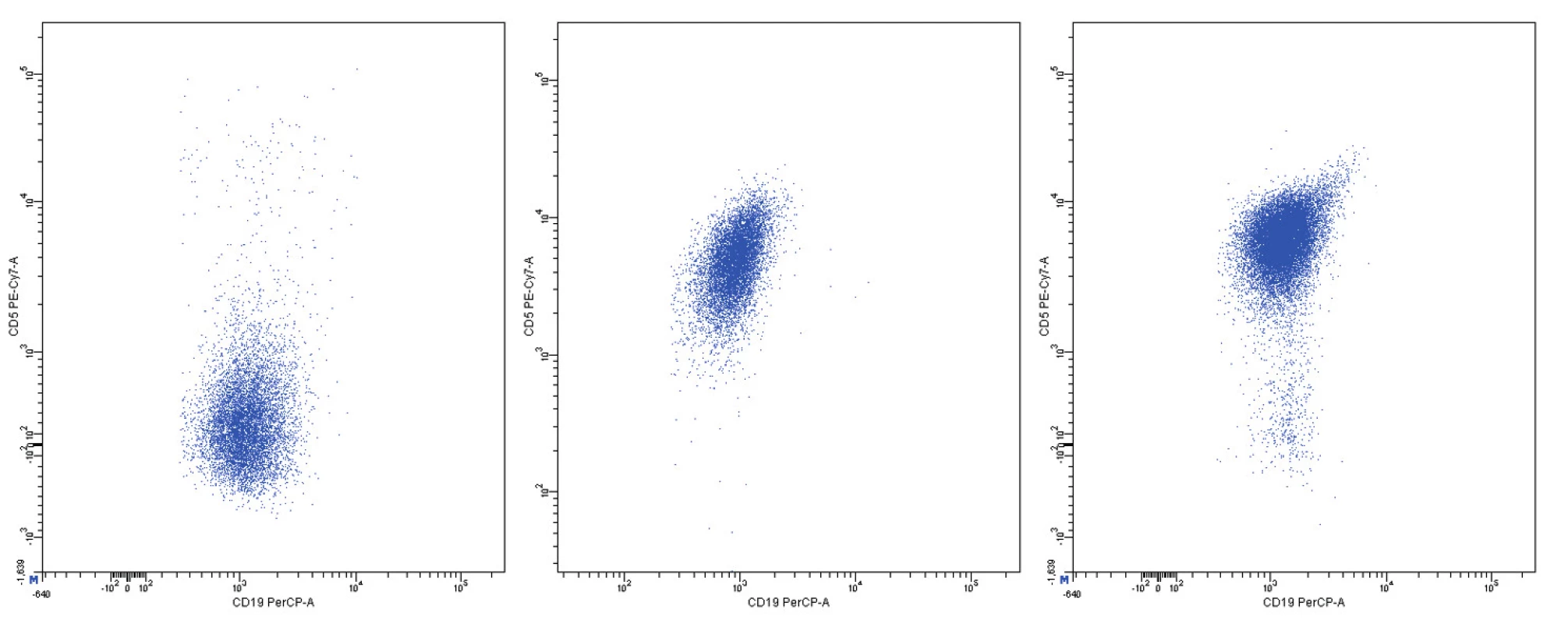
Obr. 13. Variabilní exprese znaků CD20 a CD38, dvouparametrové dot plot diagramy, CD20 na vodorovné a CD38 na svislé ose, logaritmická škála exprese na obou osách 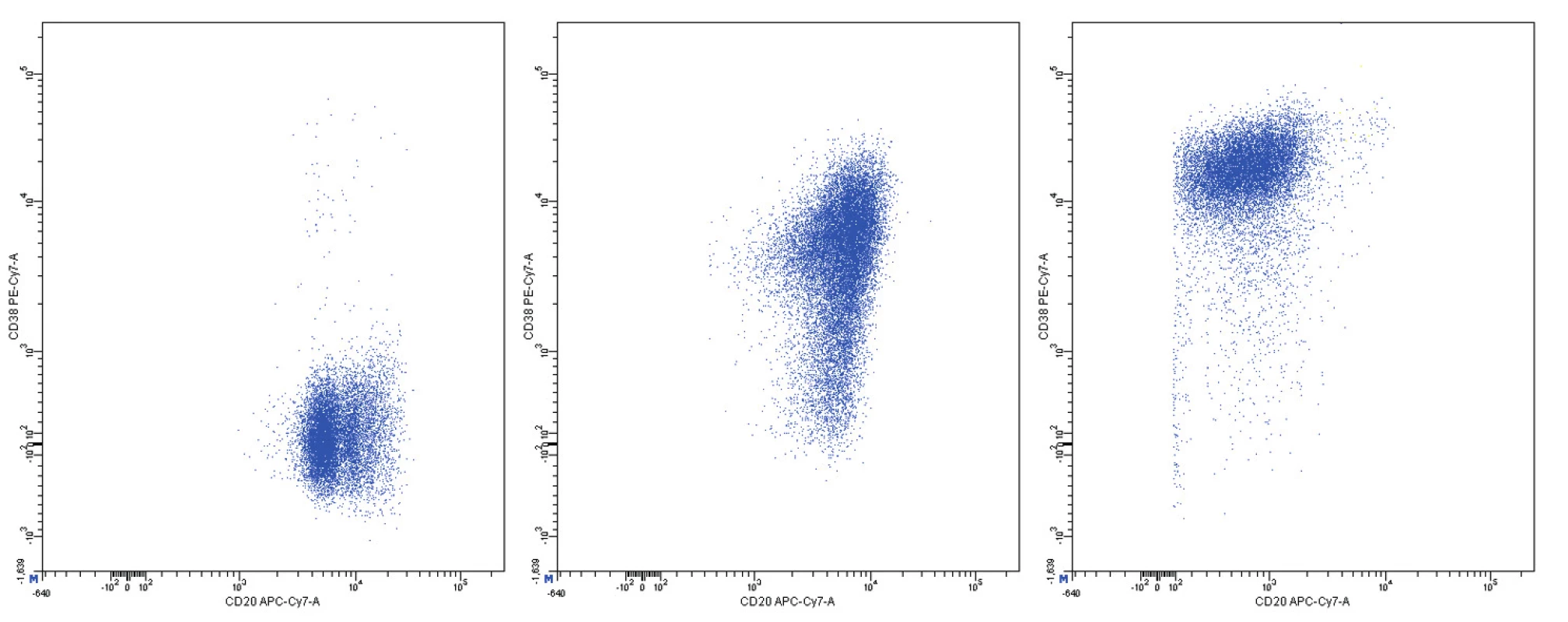
Pozitivita povrchové exprese pan-B markerů CD19, CD20, CD22 a CD79b s vysokou intenzitou exprese byla konstantním rysem všech analyzovaných případů MCL. Nejvyšší intenzitu exprese z nich vykazoval znak CD20 (medián MFI více než 4krát vyšší než u CD22 a CD79b a 8krát vyšší než u CD19). Povrchové lehké řetězce kappa a lambda se vyskytly shodně u poloviny případů, intenzita exprese lehkých řetězců lambda byla zřetelně vyšší než u lehkých řetězců kappa (7krát vyšší medián MFI). Znak CD5 měl většinou vysokou úroveň exprese, ovšem i v našem souboru jsme pozorovali dva CD5-negativní případy MCL. FMC7 byl pozitivní u 10 případů a vykazoval velmi variabilní úroveň exprese. Marker CD43 byl většinově negativní. Pozitivita znaku CD23 se nevyskytla u žádného pacienta, stejně tak tomu bylo i u znaků CD11c a CD103. Exprese CD25 byla variabilní, marker CD35 byl pozitivní u 3/4 nemocných (většinou nižší úroveň exprese). CD38 byl většinově pozitivní s vysokou intenzitou exprese. Vzácná byla pozitivita CD10 s nízkou úrovní exprese u jediného z případů. S pozitivitou CD200 jsme se setkali pouze u 2 případů (jeden případ s vysokou a jeden případ s nižší úrovní exprese). CLL skóre bylo následující: hodnota 0 – 2krát, hodnota 1 – 6krát, hodnota 2 – 7krát, hodnota 4 – 1krát. Z hodnocení exprese jednotlivých markerů vyplývá, že variabilita intenzity exprese byla obecným rysem i u silně exprimovaných znaků (obr. 11–13). Pozoruhodné bylo, že jeden z případů MCL vykazoval imunofenotyp příznačný pro CLL (CD19+CD5+CD23-CD79b-dimFMC7-CD200+lambda-dim), v jiném z případů byl imunofenotyp velmi blízký lymfomu z marginální zóny (MZL).
DISKUSE
MCL se řadí mezi CD5-pozitivní B-lymfoproliferace, které představují významnou skupinu definovaných diagnostických jednotek v rámci WHO klasifikace zralých B-lymfoidních neoplazií [8]. Za fyziologických okolností je antigen CD5 exprimován na povrchu většiny T-lymfocytů, u B-lymfocytů je jeho výskyt omezen na povrchovou expresi u minoritního B-lymfocytárního subsetu, tzv. B-1 buněk lymfatických uzlin, sleziny, pleurální a peritoneální dutiny. CD5 je ligandem CD72, účastní se v modulaci signálu z BCR a je mediátorem interakce mezi jednotlivými B-lymfocyty a B-lymfocyty a T-lymfocyty [8, 9]. Vzhledem k popsané minoritní expresi antigenu CD5 na fyziologických B-lymfocytech je jeho patologická přítomnost klíčovým diferenciálně diagnostickým rysem. Laboratorní diagnostika CD5-pozitivních B-lymfoproliferací je multidisciplinární a zahrnuje metody morfologické (cytologie a histologie), metody stanovení imunofenotypu (imunohistochemie a průtoková cytometrie) a metody cytogenetiky a molekulární cytogenetiky [8]. S jejich využitím lze mezi CD5-pozitivními B-lymfoproliferacemi vyčlenit jednotky s vysokou expresí CD5 u většiny případů (CLL, lymfom z malých lymfocytů a MCL), jednotky s expresí CD5 u významné menšinové části případů (B-prolymfocytární leukemie – B-PLL, splenický MZL) a jednotky s raritní expresí CD5 (ostatní typy MZL, difuzní velkobuněčný B-lymfom – DLBCL, folikulární lymfom – FL, lymfoplazmocytární lymfom – LPL a Burkittův lymfom) [8].
Cytomorfologické vyšetření a stanovení imunofenotypu průtokovou cytometrií má v rozpoznání MCL v rámci diferenciální diagnostiky CD5-pozitivních B-lymfoproliferací stejně důležité místo jako ostatní diagnostické modality, velkou výhodou je rychlost a všeobecná dostupnost těchto metodik. Imunofenotypizace průtokovou cytometrií navíc disponuje možností poměrně nekomplikované a multiparametrové analýzy širokým portfoliem monoklonálních protilátek.
Cytologické vyšetření může vést diagnostiku směrem k MCL v případě klasické centrocytové morfologie, při výskytu „buttock cells“ nebo u pleomorfní varianty MCL. Vzhledem k morfologické variabilitě MCL jsou ovšem možnosti cytologické diferenciální diagnostiky poměrně široké. U malobuněčné varianty MCL do ní vstupuje CLL, MZL, LPL a FL. Morfologický obraz pleomorfní varianty MCL může být obdobný jako u pleomorfní varianty atypické CLL, obtíže může činit také odlišení pleomorfní varianty MCL od DLBCL nebo prolymfocytoidní formy MCL od některých případů B-PLL [1, 8, 10]. Případy blastoidní varianty MCL mohou připomínat akutní leukemii nebo DLBCL [1, 10]. Nutné je také rozpoznat „MZL-like“ variantu MCL od MZL.
Tato obecná konstatování dokreslují údaje o cytomorfologii případů MCL v hodnoceném souboru. Téměř polovina z nich (7 z 16) byla zařazena k malobuněčné nebo pleomorfní variantě MCL, kde zejména odlišení od typické nebo atypické CLL bylo pouze na základě cytologie prakticky nemožné (viz obr. 5 a 6). Stejně tak tomu bylo v případě „MZL-like“ varianty MCL a MZL (viz obr. 10). Případ blastoidní varianty byl morfologicky velmi blízký imunoblastické formě DLBCL (viz obr. 9).
Některé literární zdroje potvrzují prognostický význam morfologických variant MCL. Případy pleomorfní a blastoidní varianty mají agresivnější průběh a vyžadují intenzivnější léčbu [11, 12, 13, 14], naopak malobuněčná varianta MCL je prognosticky příznivější [15].
Většinový imunofenotyp MCL je kromě pozitivní exprese cyklinu D1 charakteristický pozitivitou pan-B-markerů, CD5, FMC7 a CD38 a negativitou znaků CD23, CD10 a CD200. Variantní imunofenotyp MCL se vyznačuje atypickou expresí jednoho či více uvedených znaků [16]. V této souvislosti je třeba připomenout, že variabilita imunofenotypu může souviset kromě přirozené fenotypové pestrosti také s izotypem a klonem použité monoklonální protilátky a druhem konjugovaného fluorochromu.
Výskyt variantních imunofenotypových forem MCL není výjimečný, některé práce udávají jejich zastoupení až ve 40 % všech případů MCL [16]. CD5-negativní formy MCL mohou tvořit až 12 % všech případů MCL a jsou popsány u všech morfologických typů MCL [16–19]. V našem souboru se vyskytly 2 případy CD5-negativního MCL, u kterých byla negativita CD5 jednoznačně verifikována také imunohistochemicky. CD5-negativita byla u těchto lymfomů jedinou odchylkou od většinového imunofenotypu MCL. Exprese znaků CD23 a FMC7 je důležitým prvkem odlišení MCL a CLL v typických případech [20, 21, 22]. Pozitivita znaku CD23 se ovšem udává v rozmezí 0–45 % všech případů MCL [16, 20, 21, 22] a až 40 % případů MCL může být FMC7-negativní [20, 21, 22]. S pozitivitou CD23 jsme se v analyzovaném souboru nesetkali. FMC-7 byl v hodnoceném souboru negativní u 44 % případů MCL, což potvrzuje některé literární údaje a také naše dřívější pozorování. Vzácnou aberací imunofenotypu u MCL je pozitivita CD10, která je jinak typická pro FL a část DLBCL [23, 24, 25]. Tato atypie se vyskytuje u MCL až s 11% frekvencí a může se kombinovat s jinými variantami imunofenotypu, např. s CD5-negativitou [16, 25]. V našem souboru jsme pozorovali 1 případ CD10-pozitivního MCL, který byl současně FMC7-negativní. V souboru se také vyskytly 2 případy CD38-negativního MCL. V rozporu s literárními údaji byla většina vyšetřených případů MCL CD43-negativní, což může souviset s použitou monoklonální protilátkou. Literatura uvádí, že nebyla prokázána souvislost výskytu variantních imunofenotypových forem MCL a jeho morfologických variant [16], a ani my jsme tuto souvislost nepozorovali.
Z hlediska imunofenotypu je v diferenciální diagnostice MCL podstatné zejména odlišení od CLL, B-PLL a splenického MZL [1, 2, 8]. Případy CD5-pozitivního non-splenického MZL, DLBCL, FL a LPL jsou z hlediska diferenciální diagnostiky MCL marginální vzhledem k jejich raritnímu výskytu; drtivá většina těchto nádorů je totiž CD5-negativní.
CLL stojí na prvním místě diferenciální diagnostiky MCL vzhledem k tomu, že jde o nejčastější CD5-pozitivní lymfoproliferaci s širokým morfologickým překryvem, zejména u malobuněčných a pleomorfních variant MCL. Na rozdíl od MCL jsou pan-B-antigeny (CD19, CD20, CD22, CD79) u CLL slabě exprimovány stejně jako dominantní povrchové lehké řetězce kappa nebo lambda, sIgM a IgD. Stejně jako u MCL je pro CLL typická pozitivita CD5, CD43 a bcl-2. Variabilní expresi mají u CLL markery CD25, CD11c, CD38 a ZAP-70; negativní je FMC7, CD10, CD103 a cyklin D1 [1, 2, 5, 26, 27]. Robustním nástrojem při rozlišení MCL a CLL je stanovení skóre podle systému sestaveného Estellou Matutes již v roce 1994 (tab. 3). Většina případů CLL vykazuje skóre 4 nebo 5, pro valnou část MCL je příznačné skóre 1 nebo 2 [28]. V našem souboru mělo 15 případů z 16 skóre 0–2. U atypické CLL se setkáváme s vyšší expresí CD19, CD20, CD22 a CD79b a sIg včetně lehkých řetězců [1, 5, 28]. Zejména tyto atypické případy mohou činit obtíže při odlišení od MCL.
Tab. 3. Skórovací systém pro CLL podle Estelly Matutes [28] ![Skórovací systém pro CLL podle Estelly Matutes [28]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/01aea54346a9437ebaafe74226f6f20b.png)
Jako velmi užitečný se při rozlišení MCL a CLL jeví znak CD200, jeho vysoká exprese je v rámci CD5 + B-lymfoproliferací pro CLL poměrně specifická [29, 30, 31, 32]. CD200 je u CLL pozitivní prakticky ve všech případech včetně forem s atypickým imunofenotypem [29, 30, 31]. U MCL je pozitivita CD200 vzácná (výskyt do 10 %), navíc je CD200 nevýrazně exprimován [29, 30]. V hodnoceném souboru se vyskytly dva případy CD200-pozitivního MCL. Případ MCL imitující CLL s Matutes skóre 4 byl popsán výše. Druhý z případů měl méně intenzivní expresi CD200, navíc byl CD38-negativní, vykazoval nižší expresi CD5 a svým imunofenotypem se blížil MZL.
Pro úplnost je nutné uvést také potřebu diferenciální diagnostiky MCL, B-PLL a splenického MZL s leukemizací. B-PLL vykazuje CD5-pozitivitu až u třetiny případů, u splenického MZL je to až 25 % [1, 33, 34]. Obě tyto B-lymfoidní neoplazie mají také určitý morfologický a imunofenotypový překryv s MCL. V jejich odlišení od MCL má nezastupitelné místo stanovení cyklinu D1. V histologickém hodnocení je v rámci širší diferenciální diagnostiky považována exprese cyklinu D1 za klíčový diagnostický znak charakteristický pro většinu MCL [35, 36]. Jde o znak s vysokou specificitou pro MCL, i když byly popsány také případy jiných cyklin D1-pozitivních lymfomů [37].
ZÁVĚR
Stanovení imunocytologického profilu je jedním ze základních prvků diagnostiky MCL. Tento lymfom vykazuje pestrou morfologii s častým výskytem variantních forem a jeho imunofenotyp je taktéž značně variabilní. Pečlivá diferenciální diagnostika MCL, CLL, MZL a některých případů B-PLL či vzácně jiných lymfoproliferací vyžaduje komplexní multidisciplinární přístup. Z hlediska imunocytologické charakteristiky jsou klíčovými diferenciálně diagnostickými prvky při odlišení MCL od jiných CD5-pozitivních B-lymfoproliferací (zejména CLL) cytomorfologie, exprese pan-B-markerů a znaků CD5, CD23, CD79b, CD43, CD38, CD10, FMC7 a CD200. V tomto kontextu jsme potvrdili diagnostickou hodnotu pečlivého cytomorfologického vyšetření a také imunofenotypizačního panelu používaného na našem pracovišti. Existence CD5-negativních nebo cyklin D1 negativních případů či forem s netypickým morfologickým obrazem či variantním imunofenotypem může ztěžovat diagnostiku MCL i jiných B-lymfomů.
Podíl autorů na rukopisu
DS – diagnostika, evidence dat, statistika, příprava rukopisu
DK – diagnostika, evidence dat, statistika, příprava rukopisu
PM – diagnostika, revize rukopisu
MT – diagnostika, revize rukopisu
Čestné prohlášení autora
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce: 24. 6. 2015
Přijato po recenzi: 12. 8. 2015
MUDr. David Starostka
Oddělení klinické hematologie
Nemocnice s poliklinikou Havířov, p.o.
Dělnická 1132/24
736 01 Havířov-Město
e-mail: david.starostka@nsphav.cz
Zdroje
1. Swerdlow SH, Campo E, Lee Harris N, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Fourth Edition. IARC: Lyon 2008.
2. Kačírková P, Campr V, Karban J, Mikulenková D. Hematoonkologický atlas krve a kostní dřeně. Grada Publishing, a. s. Praha. 2007.
3. Dreyling M, Kluin-Nelemans HC, Bea S, et al. Update on the molecular pathogenesis and clinical treatment of mantle cell lymphoma: report of the 11th annual conference of the European Mantle Cell Lymphoma Network. Leuk Lymphoma 2013; 54 : 699–707.
4. Richard P, Vassallo J, Valmary S, Missoury R, Delsol G, Brousset P. „In situ-like“ mantle cell lymphoma: a report of two cases. J Clin Pathol 2006; 59 : 995–996.
5. Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms. Blood 2008; 111 : 3941–3967.
6. Mozos A, Royo C, Hartmann E, De Jong D, Baró C, Valera A. SOX11 expression is highly specific for mantle cell lymphoma and identifies the cyclin D1-negative subtype. Haematologica 2009; 94 : 1555–1562.
7. Rubio-Moscardo F, Climent J, Siebert R, et al. Mantle cell lymphoma genotypes identified with CGH to BAC microarrays define a leukemic subgroup of disease and predict patient outcome. Blood 2005; 105 : 4445–4454.
8. Starostka D, Mikula P. Možnosti diagnostiky CD5-pozitivních B-lymfoproliferací. Onkologie 2014; 8(3): 102–106.
9. Hardy RR. B-1 B Cell Development. J Immunol 2006; 177 : 2749–2754.
10. Sen R, Gupta S, Gill M, Kohli R, Gupta V, Verma R. Blastoid variant of mantle cell lymphoma – a rare case report. Am J Med Case Rep 2014; 2 : 161–163.
11. Jares P, Campo E. Advances in the understanding of mantle cell lymphoma. Br J Haematol 2008; 142(2): 149–165.
12. Räty R, Franssila K, Jansson SE, Joensuu H, Wartiovaara-Kautto U, Elonen E. Predictive factors for blastoid transformation in the common variant of mantle cell lymphoma. Eur J Cancer 2003; 39(3): 321-329.
13. Pittaluga S, Verhoef G, Criel A, et al. Prognostic significance of bone marrow trephine and peripheral blood smears in 55 patients with mantle-cell lymphoma. Leuk Lymphoma 1996, 21 : 115–125.
14. Bosch F, Lopez-Guillermo A, Campo E, et al. Mantle cell lymphoma: presenting features, response to therapy and prognostic factors. Cancer 1998, 82 : 567–575.
15. Schlette E, Lai R, Onciu M, Doherty D, Bueso-Ramos C, Medeiros J. Leukemic mantle cell lymphoma: clinical and pathologic spectrum of twenty-three cases. Mod Pathol 2001; 14(11): 1133–1140.
16. Gao J, Peterson L, Nelson B, Goolsby C, Chen YH. Immunophenotypic variations in mantle cell lymphoma. Am J Clin Pathol 2009; 132(5): 699–706.
17. Liu Z, Dong HY, Gorczyca W, et al. CD5 - mantle cell lymphoma. Am J Clin Pathol 2002; 118 : 216–224.
18. Seok Y, Kim J, Choi JR, et al. CD5-negative blastoid variant mantle cell lymphoma with complex CCND1/IGH and MYC aberrations. Ann Lab Med 2012; 32 : 95–98.
19. Hashimoto Y, Omura H, Tanaka T, Hino N, Nakamoto S. CD5-negative mantle cell lymphoma resembling extranodal marginal zone lymphoma of MALT: a case report. J Clin Exp Hematopathol 2012; 52 : 185–191.
20. Ahmad E, Garcia D, Davis BH. Clinical utility of CD23 and FMC7 antigen coexistent expression in B-cell lymphoproliferative disorder subclassification. Cytometry 2002; 50 : 1–7.
21. Garcia DP, Rooney MT, Ahmad E, et al. Diagnostic usefulness of CD23 and FMC7 antigen expression patterns in B-cell lymphoma classification. Am J Clin Pathol 2001; 115 : 258–265.
22. Gong JZ, Lagoo AS, Peters D, et al. Value of CD23 determination by flow cytometry in differentiating mantle cell lymphoma from chronic lymphocytic leukemia/small lymphocytic lymphoma. Am J Clin Pathol 2001; 116 : 893–897.
23. Zanetto U, Dong H, Huang Y, et al. Mantle cell lymphoma with aberrant expression of CD10. Histopathology 2008; 53 : 20–29.
24. Dong HY, Gorczyca W, Liu Z, et al. B-cell lymphomas with coexpression of CD5 and CD10. Am J Clin Pathol 2003; 119 : 218–230.
25. Morice WG, Hodnefield JM, Kurtin PJ, et al. An unusual case of leukemic mantle cell lymphoma with a blastoid component, showing loss of CD5 and aberrant expression of CD10. Am J Clin Pathol 2004; 122 : 122–127.
26. Hallek M, Cheson BD, Catovsky D, Caligaris-Cappio F, Döhner H. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia (IWCLL) updating the National Cancer Institute-Working Group (NCI-WG) 1996 guidelines. Blood 2008; 11 : 5446–5456.
27. Krober A, Seiler T, Benner A, et al. V(H) mutation status, CD38 expression level, genomic aberrations, and survival in chronic lymphocytic leukemia. Blood 2002; 100 : 1410–1416.
28. Matutes E, Owusu-Ankomah K, Morilla R, Garcia Marco J, Houlihan A, Que TH. The immunological profile of B-cell disorders and proposal of a scoring system for the diagnosis of CLL. Leukemia 1994; 8 : 1640–1645.
29. Alapat D, Coviello-Malle J, Owens R, et al. Diagnostic usefulness and prognostic impact of CD200 expression in lymphoid malignancies and plasma cell myeloma. Am J Clin Pathol 2012; 137(1): 93–100.
30. Palumbo GA, Parrinello N, Fargione G, et al. CD200 expression may help in differential diagnosis between mantle cell lymphoma and B-cell chronic lymphocytic leukemia. Leuk Res 2009; 33 : 1212–1216.
31. Spacek M, Karban J, Radek M, etal. CD200 expression improves differential diagnosis between chronic lymphocytic leukemia and mantle cell lymphoma. Blood 2014; 124(21): abstrakt 5637.
32. Dorfman DM, Shahsafaei A. CD200 (OX-2 membrane glycoprotein) expression in B cell-derived neoplasms. Am J Clin Pathol 2010; 134 : 726–733.
33. Matutes E, Oscier D, Montalban C, et al. Splenic marginal zone lymphoma proposals for a revision of diagnostic, staging and therapeutic criteria. Leukemia 2008; 22 : 487–495.
34. Baseggio L, Traverse-Glehen A, Petinataud F, Callet-Bauchu E, Berger F, Ffrench M. CD5 expression identifies a subset of splenic marginal zone lymphomas with higher lymphocytosis: a clinico-pathological, cytogenetic and molecular study of 24 cases. Haematologica 2010; 95 : 604–612.
35. Yatabe Y, Suzuki R, Tobinai K, et al. Significance of cyclin D1 overexpression for the diagnosis of mantle cell lymphoma: a clinicopathologic comparison of cyclin D1-positive MCL and cyclin D1-negative MCL-like B-cell lymphoma. Blood 2000; 95(7): 2253–2261.
36. Zhou DM, Chen G, Zheng XW, Zhu WF, Chen BZ. Clinicopathologic features of 112 cases with mantle cell lymphoma. Cancer Biol Med 2015; 12(1): 46–52.
37. Juskevicius D, Ruiz C, Dirnhofer S, Tzankov A. Clinical, morphologic, phenotypic, and genetic evidence of cyclin D1-positive diffuse large B-cell lymphomas with CYCLIN D1 gene rearrangements. Am J Surg Pathol 2014; 38(5): 719–727.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2015 Číslo 4- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Léčba on-demand je jednoznačně neefektivní v prevenci vývoje hemofilické artropatie
-
Všetky články tohto čísla
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Metabolismus železa u dárců krve
- Racionální algoritmus zobrazovacích vyšetření u mnohočetného myelomu v podmínkách České republiky
- Udržovací léčba s rituximabem u starších pacientů s Mantle cell lymfomem v první remisi – zkušenost centra
-
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků - Základy hematologické diagnostiky
- Alternative donor hematopoietic cell transplantation for Fanconi anemia
- Energy balance and fitness in adult survivors of childhood acute lymphoblastic leukemia
- Impact of allogeneic stem cell transplantation on survival of patients less than 65 years of age with primary myelofibrosis
- Obsah ročníku 21/2015
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle-
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků - Metabolismus železa u dárců krve
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



