-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Udržovací léčba s rituximabem u starších pacientů s Mantle cell lymfomem v první remisi – zkušenost centra
The role of rituximab maintenance in elderly patients with mantle cell lymphoma in first remission – single centre experience
Introduction:
Mantle cell lymphoma (MCL) is a rare and prognostically unfavourable malignancy. CD20 antigen expression on the surface of lymphoma cells enables the potential addition of anti-CD20 immunotherapy to therapeutic regimens in order to improve treatment outcome.Methods:
Analysis and comparison of time to relapse/progression (PFS) and overall survivor (OS) in patients with newly diagnosed MCL who completed initial induction therapy, achieved at least partial remission and who were given or not additional maintenance therapy with the anti-CD20 antibody rituximab (R) 375 mg/m2 q 3 months for a maximum 2 years. Patient sample: 25 patients diagnosed from 2001–2010, median age 73 (44–82) years, males 17/25 (68%), disease status after 1st line treatment: complete remission 17/25 (68%), partial remission 8/25 (32%).Results:
Median PFS and probability of 3-year PFS in the group without rituximab maintenance (n = 12) versus maintenance (n = 13) was: 16 months and 15% versus 59 months and 77% (p = 0.0007). Median OS and probability of 3-year OS in the group without rituximab maintenance vs. maintenance was: 25 months and 34% versus 65 months and 85% (p = 0.03). The significant difference in both PFS and OS between the two groups of patients was also observed when these parameters were calculated from the end of induction treatment.Conclusions:
Progression free survival and overall survival were significantly prolonged in patients who were not fit for intensified treatment, responded to initial induction therapy and who received maintenance therapy with rituximab. Given the advanced age of these patients and this clear extension of PFS and OS using a well-tolerated maintenance treatment, these results could be considered to have major clinical importance.Key words:
lymphoma, immunotherapy, maintenance treatment, rituximab
Autoři: S. Vokurka; A. Jungová; P. Jindra; V. Vozobulová; M. Schutzova; M. Pachner; D. Lysák; L. Mohammadová; K. Steinerová; M. Hrabětová
Působiště autorů: Hematologicko-onkologické oddělení, Fakultní nemocnice Plzeň
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 4, p. 206-213.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Mantle cell lymfom (MCL) je vzácná a prognosticky nepříznivá malignita. Exprese antigenu CD20 na povrchu lymfomové buňky poskytuje potenciál pro doplnění imunoterapie anti-CD20 do léčby s cílem zlepšit léčebné výsledky.Metody:
Analýza a porovnání doby do relapsu/progrese (PFS) a celkového přežití (OS) u pacientů s nově diagnostikovaným MCL, kteří dokončili úvodní sérii indukční léčby, dosáhli alespoň stavu parciální remise a byla u nich doplněna nebo nedoplněna udržovací léčba s protilátkou anti-CD20 rituximab (R) 375 mg/m2 á 3 měsíce po dobu maximálně 2 roky. Kritéria pro analýzu splnilo 25 pacientů s diagnózou onemocnění v r. 2001–2010, medián věku 73 roků (44–82 roků) se zastoupením mužů 17/25 (68 %), kompletní a parciální remisi po indukci dosáhlo 17/25 (68 %) a 8/25 (32 %) pacientů.Výsledky:
Medián PFS a pravděpodobnost PFS ve 3 letech ve skupině bez udržovací léčby (n = 12) vs. skupina s udržovací léčbou (n = 13): 16 měsíců a 15 % vs. 59 měsíců a 77 % (p = 0,0007). Medián OS a pravděpodobnost OS ve 3 letech ve skupině bez udržovací léčby vs. skupina s udržovací léčbou byl 25 měsíců a 34 % vs. 65 měsíců a 85 % (p = 0,03). Rozdíly ve sledovaných skupinách zůstaly signifikantně rozdílné i v případě sledování PFS a OS od ukončení indukční léčby.Závěr:
Udržovací léčba rituximabem signifikantně prodlužuje dobu do relapsu/progrese a celkové přežívání u pacientů, kteří nebyli z důvodu věku a komorbidit indikováni k intenzifikované léčbě, a kteří současně odpověděli na úvodní indukční léčbu. S ohledem na vyšší věk pacientů má takto zřetelné prodloužení PFS při dobře tolerované udržovací léčbě velký klinický význam.Klíčová slova:
lymfom, imunoterapie, udržovací léčba, rituximabÚVOD
Mantle cell lymfom (MCL) patří mezi vzácné a prognosticky nepříznivé malignity se střední dobou přežití kratší než 5 let. V rámci starších publikovaných dat registru Kooperativní lymfomové skupiny ČR zastupuje tento lymfom 6,5 % případů [1], v registrech International Lymphoma Study Group (ILSG) pak historicky 1,2 % [2] a podle registru SEER (Surveillance, Epidemiology, and End Results) zahrnoval v letech 1992–2004 celkem 2,8 % případů [3]. Nižší zastoupení MCL v registrech s historickými daty může být dáno nedostupností nyní běžných moderních diagnostických metodik (průtoková cytometrie, detekce cyklinu D1).
Histologicky je MCL charakterizován populací malých až středně velkých lymfoidních buněk s úzkým lemem cytoplazmy, typickým imunofenotypickým znakem je pozitivita CD(20)19, CD5, FMC7 a negativita CD23. Charakteristická je přítomnost translokace t(11;14) vedoucí k hyperexpresi cyklinu D1 a deregulaci buněčného cyklu [4]. Klinicky se MCL projevuje adenomegalií, často splenomegalií, velmi často infiltruje kostní dřeň, přibližně u třetiny pacientů leukemizuje, nezřídka infiltruje oblast Waldayerova okruhu a GIT. Postihuje především starší pacienty s mediánem věku 65–70 let a častěji muže [5].
Konvenční chemoterapií (CHOP, VAD-Chlorambucil) lze většinou dosáhnout dobrých léčebných odpovědí, ale dosažené remise nebývají příliš dlouhé s trváním maximálně pár desítek měsíců a celkové přežití 2–3 roky [6, 7]. Doplnění vysokodávkované chemoterapie s autologní transplantací krvetvorných buněk (TKB) v 1. linii vede k prodloužení doby do progrese/relapsu i celkovému přežívání okolo 5 let [7–10]. Intenzifikace v podobě šesti cyklů Hyper-CVAD alternující á 21 dní s rituximabem, vysokodávkovaným metotrexátem a cytarabinem umožní prodloužení PFS až na 54 měsíců a celkové přežití 82 % po 3 letech, a při mediánu sledování 8 let nebyl medián přežití stále dosažen [11, 12]. Další naději na zlepšení osudu pacientů s MCL pak přináší celkově velmi intenzifikované protokoly Nordic Lymphoma Group, které kombinují indukci rituximab-Maxi-CHOP s vysokodávkovaným cytosin-arabinosidem (Ara-C) a následně vysokodávkovanou chemoterapii s autologní TKB, kdy je dosahováno až 66% přežití bez progrese a 70% celkového přežití v 6 letech [13]. Rituximab přináší zlepšení léčebných výsledků indukční léčby [14–16], využívá se v rámci in vivo očištění (purgingu) před sklizní periferních krvetvorných buněk [17, 18], s výrazným efektem se uplatňuje v udržovací léčbě [19–22]. V případě MCL však jediný prokázaný kurativní potenciál nese zatím pouze alogenní TKB [10].
S cílem ověřit efekt a význam udržovací imunoterapie rituximabem u starších a k intenzivní léčbě neindikovaných pacientů s MCL jsme provedli analýzu prospektivně sledovaných a protokolárně léčených pacientů našeho oddělení.
SOUBOR A METODIKA
Do analýzy bylo zařazeno 25 pacientů s nově diagnostikovaným MCL v období 2001–2010, kteří na našem pracovišti podstoupili a plně dokončili úvodní indukční chemoterapii zahrnující rituximab, dosáhli alespoň stavu parciální remise nemoci bez časné progrese/relapsu během dvou měsíců po ukončení úvodní léčby, a u kterých nebyla doplněna vysokodávkovaná chemoterapie s autologní TKB. Pacienti byli zařazeni konsekutivně s tím, že skupina bez udržovací léčby byla skupina historicky starší s lymfomem diagnostikovaným v letech 2001–2006 (a ještě bez zavedené udržovací léčby v léčebném schématu), a naopak skupina s udržovací léčbou zahrnovala pacienty s lymfomem diagnostikovaným v období let 2007–2010. Diagnóza MCL byla stanovena podle kritérií REAL klasifikace [23], respektive WHO klasifikace [4]. U všech pacientů byla při vyšetření uzliny nebo kostní dřeně prokázána infiltrace elementy lymfomu s typickým imunofenotypem CD19/20 poz., CD5 poz., CD23 neg. a vždy byla prokázána přítomnost hyperexprese cyklinu D1. Biopsie byly odečteny zkušenými patology – konzultanty Kooperativní lymfomové skupiny [24, 25]. Analýza byla zaměřena na porovnání doby přežití bez progrese (progression-free survival, PFS) a doby celkového přežití (overall survival, OS) s ohledem na zajištění udržovací léčby s protilátkou anti-CD20 rituximab (MabThera: F. Hoffmann-La Roche Ltd, Basel, Switzerland).
Indukční léčba
V indukční léčbě bylo historicky postupně využito několik protokolů léčby: CHOP + R (n = 8): cyklofosfamid 750 mg/m2 i. v. 1. den, doxorubicin 50 mg/m2 i. v. 1. den, vinkristin 2 mg i. v., prednizon 60 mg/m2 p. o. 1.–5.den, v intervalu 21 dní s následnou sérií imunoterapie anti-CD20 rituximab ve čtyřech dávkách 375 mg/m2 v intervalu sedmi dní; R-CHOP (n = 11): rituximab 375 mg/m2 i.v. 1.den., cyklofosfamid 750 mg/m2 i.v. 1.den, doxorubicin 50 mg/m2 i. v. 1. den, vinkristin 2 mg i. v., prednizon 60 mg/m2 p. o. 1.–5.den, v intervalu 21 dní; R-COP (n = 6): rituximab 375 mg/m2 i. v. 1. den, cyklofosfamid 750 mg/m2 i. v. 1. den, vinkristin 2 mg i. v. 1. den, prednizon 60 mg/m2 p. o. 1.–5. den, v intervalu 21 dní.
Udržovací léčba
Rituximab byl podáván v dávce 375 mg/m2 i. v. každé tři měsíce se zahájením po ukončení celkového přešetření stavu přibližně 1–2 měsíce po úvodní indukční léčbě a s plánem maximální doby podávání celkem po dobu dvou let.
Rozdělení do skupiny bez udržovací léčby
Pacienti byli do sledování zařazeni konsekutivně a skupina pacientů bez udržovací léčby je historicky starší s lymfomem diagnostikovaným v letech 2001–2006 a bez zavedené udržovací léčby v léčebném schématu. Skupina s udržovací léčbou pak zahrnovala pacienty s lymfomem diagnostikovaným v letech 2007–2010.
Léčebná odpověď
PFS byla stanovena jako počet měsíců od stanovení diagnózy do první progrese/relapsu nebo úmrtí z jakékoliv příčiny, a dále pak byl navíc v rámci hodnocení doplněn i údaj pro tento parametr od ukončení indukční léčby. OS byla stanovena jako počet měsíců od stanovení diagnózy do úmrtí z jakékoliv příčiny, a dále pak byl v rámci hodnocení doplněn i údaj pro tento parametr od ukončení indukční léčby. Léčebná odpověď podle standardních kritérií [26] byla hodnocena vždy za 1–2 měsíce po ukončení indukční léčby. Analýza detekce a dynamiky minimální reziduální nemoci v kostní dřeni pomocí analýzy průtokové cytometrie a klonality B-buněk provedené z izolované DNA nebyla standardně prováděna.
Statistická analýza
Statistické analýzy byly provedeny s využitím programu STATISTICA 10 (firma StatSof). Kategorické hodnoty byly srovnávány s využitím Fisher’s Exact testu. Pro porovnání úrovně střední hodnoty spojitých veličin byl použit dvouvýběrový t-test, anebo v případě, kdy nebyl splněn předpoklad normality dat v obou výběrech, byl zvolen Mannův-Whitneyův test. Křivky pravděpodobnosti návratu nemoci a celkového přežití byly získány pomocí Kaplanovy-Meierovy metody, pro testování statistické významnosti odlišnosti křivek přežití byl použit logrankový test (Mantelův-Haenszelův). Významnost sledovaných rozdílů byla stanovena na hladině významnosti 5 % (p < 0,05).
VÝSLEDKY
Kritéria pro analýzu splnilo celkem 25 pacientů s MCL diagnostikovaným v letech 2001–2010. Medián věku souboru byl 73 roků (44–82 roků) s vyšším zastoupením mužů 17/25 (68 %). Stavu kompletní a parciální remise po indukční léčbě dosáhlo 17/25 (68 %) a 8/25 (32 %) pacientů. Bližší charakteristiky souboru jsou uvedeny samostatně v tabulce 1.
Tab. 1. Charakteristiky souboru pacientů s Mantle cell lymfomem 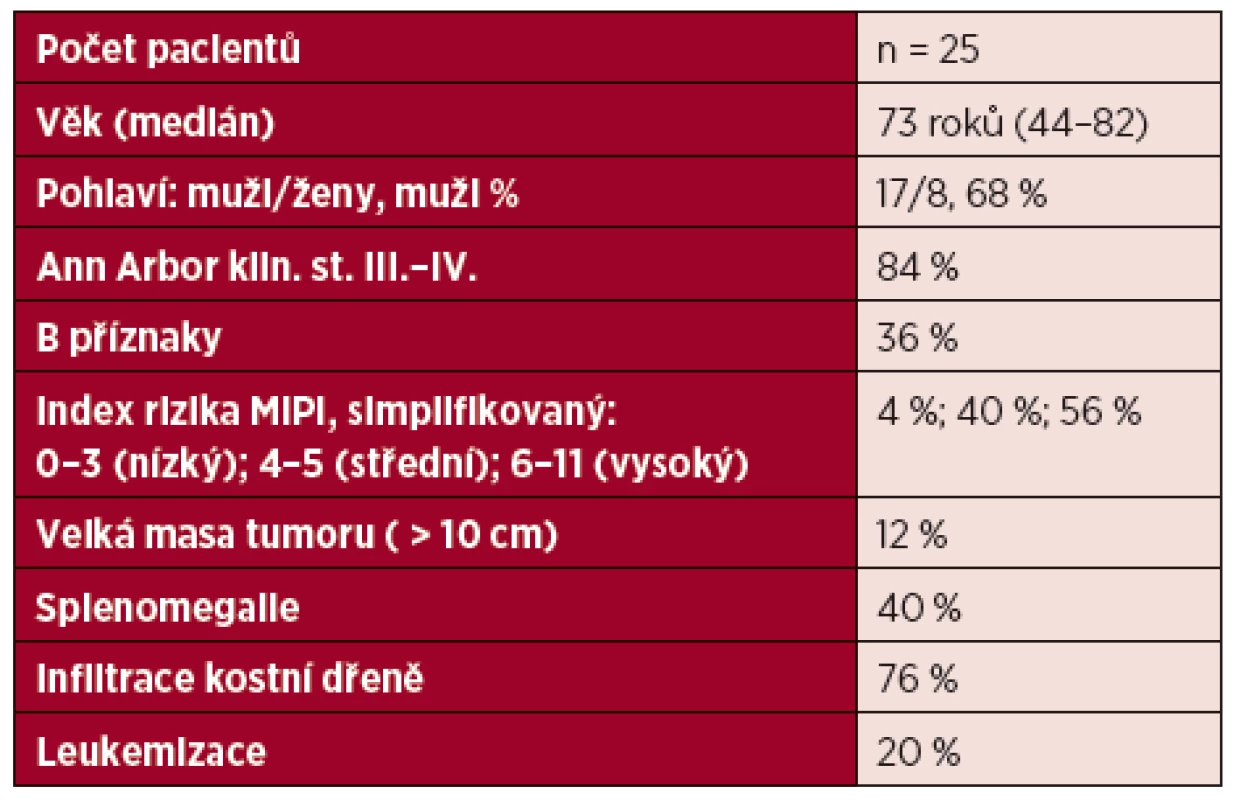
Při porovnání skupiny pacientů po dokončené indukční léčbě a bez následně doplněné udržovací léčby rituximabem oproti pacientům s doplněnou udržovací léčbou (tab. 2) nebyl prokázán signifikantní rozdíl v charakteristikách věku, indexu MIPI, ECOG, dosažení kompletních remisí v obou skupinách po indukční sérii a mediánu sledování. Více pacientů ve skupině bez udržovací léčby mělo v indukci protokol s doxorubicinem, více pacientů ve skupině s udržovací léčbou mělo v indukci protokol s více dávkami rituximabu. U jednoho pacienta ze skupiny bez následné udržovací léčby byla po skončení indukční léčby doplněna radioterapie do oblasti orofaryngu a regionálních uzlin v celkové dávce 50 Gy pro reziduální lymfomové postižení. V jiných případech nebyla postremisní radioterapie provedena.
Tab. 2. Porovnání skupin pacientů bez udržovací léčby a s udržovací léčbou rituximabem 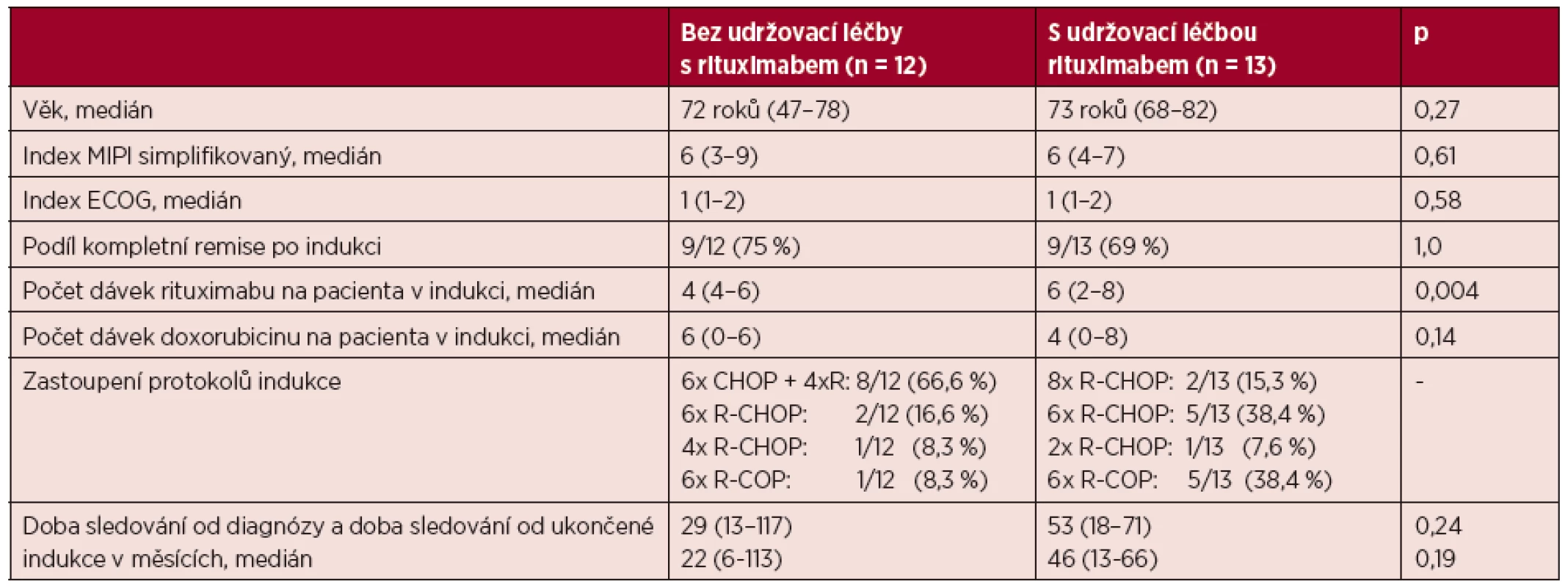
Medián počtu dávek rituximabu podaných pacientovi v intervalu à 3 měsíce v rámci udržovací léčby byl 6 (3–8), přičemž u pacientů bez relapsu/progrese v době udržovací léčby to bylo 7 (3–8). Plná plánovaná dávka byla podána celkem u 3/13 pacientů, k předčasnému ukončení z důvodu relapsu/progrese lymfomu došlo u 3/13 (po podání 3 dávek ve dvou případech a po podání 6 dávek v jednom případě), z důvodu zhoršení stavu pacienta při komorbiditách u 2/13, z jiných důvodů u 5/13 (prakticky vždy se jednalo o ukončení léčby u případů spadajících do přechodného období nejisté a negarantované úhrady léčby). U žádného pacienta nebylo nutno ukončit udržovací léčbu z důvodu komplikací vázaných k podávání rituximabu.
Medián PFS a pravděpodobnost PFS ve 3 letech ve skupině bez udržovací léčby vs. skupina s udržovací léčbou byl 16 měsíců a 15 % vs. 59 měsíců a 77 % (p = 0,0007) – graf 1. Medián OS a pravděpodobnost OS ve 3 letech ve skupině bez udržovací léčby vs. skupina s udržovací léčbou byl 25 měsíců a 34 % vs. 65 měsíců a 85 % (p = 0,03) – graf 2.
Graf 1. Pravděpodobnost přežití bez relapsu/progrese od stanovení diagnózy s ohledem na zajištění následné udržovací léčby s rituximabem u pacientů s Mantle cell lymfomem neindikovaných po konvenční indukci k intenzifikované léčbě 
Graf 2. Pravděpodobnost přežití od diagnózy s ohledem na zajištění následné udržovací léčby s rituximabem u pacientů s Mantle cell lymfomem neindikovaných po konvenční indukci k intenzifikované léčbě 
Medián PFS a pravděpodobnost PFS ve 3 letech od ukončené indukční léčby ve skupině bez udržovací léčby vs. skupina s udržovací léčbou byl 11 měsíců a 9 % vs. 55 měsíců a 64 % (p = 0,0004) – graf 3. Medián OS a pravděpodobnost OS ve 3 letech od ukončené indukční léčby ve skupině bez udržovací léčby vs. skupina s udržovací léčbou byl 17 měsíců a 16 % vs. 61 měsíců a 67 % (p = 0,026) – graf 4.
Graf 3. Pravděpodobnost přežití bez relapsu/progrese od ukončené indukční léčby s ohledem na zajištění následné udržovací léčby s rituximabem u pacientů s Mantle cell lymfomem neindikovaných po konvenční indukci k intenzifikované léčbě 
Graf 4. Pravděpodobnost přežití od ukončené indukční léčby s ohledem na zajištění následné udržovací léčby s rituximabem u pacientů s Mantle cell lymfomem neindikovaných po konvenční indukci k intenzifikované léčbě 
DISKUSE
Mantle cell lymfom je vzácnější, ale současně klinicky velmi významná malignita s ohledem na obecně poměrně prognosticky nepříznivé parametry. Na druhé straně však jde o onemocnění, u kterého může vhodně zvolená léčebná strategie nepříznivý osud pacienta zásadně ovlivnit. Zatímco klasická léčebná schémata standardní chemoterapie, jako je především CHOP, přináší šanci na celkové přežití okolo 2–3 let [6], pak možnost doplnit vysoko dávkovanou chemoterapii s autologní TKB vede k prodloužení doby do progrese/relapsu i celkovému přežívání okolo 5 let [7–10]. Velmi dobré výsledky jsou pak dosahovány u intenzivních moderních protokolů, které v indukčních protokolech zahrnují ještě cykly s vysokodávkovaným cytosin-arabinosidem (Ara-C) a rituximabem, jako např. Nordic Lymphoma Group, kde je dosahováno až 66% přežití bez progrese a 70% celkového přežití v 6 letech [11] nebo protokol MCL Younger designovaný European Mantle Cell Lymphoma Network [27]. Limitací podání takto intenzifikované léčby však bývá často vyšší věk nebo významné komorbidity pacientů. Volitelnými protokoly pak zde zůstávají především R-CHOP, alternativně R-B (rituximab-bendamustin) s dobrou účinností a bezpečnostním profilem [28], případně dále s menším efektem pak protokoly R-COP, R-FC, R-chlorambucil atp. [29, 30]. Jednou z cest k dosažení lepších výsledků i méně intenzivní indukční léčbou je zavedení udržovací léčby rituximabem [19–22]. V poměrně velké skupině starších pacientů s mediánem věku 70 let, kteří odpověděli na indukční léčbu protokolem R-CHOP, vedla udržovací léčba s rituximabem v dávce 375 mg/m2 à 2 měsíce až do doby progrese k významnému zlepšení celkového čtyřletého přežití 87 % ve srovnání s přežitím 63 % u pacientů na udržovací léčbě s interferonem alfa (p = 0,005) [21]. Na uvedenou udržovací léčbu pak odkazuje ve svých doporučeních i European Society for Medical Oncology (ESMO) [29]. Význam doplnění udržovací léčby s rituximabem po indukční léčbě nově diagnostikovaných nebo relabujících/refrakterních pacientů s MCL doložila i metaanalýza [31] tří randomizovaných studií [21, 32, 33], kde doplnění udržovací léčby vs. sledování (ve dvou případech) nebo udržovací léčba s interferonem (jeden případ) mělo zásadní přínos pro delší PFS. Přesnější definování role udržovací léčby rituximabem a její význam po autologní TKB v první linii je také náplní randomizované GOELAMS studie fáze III. „LYMA“, jejíž průběžné výsledky u sto devatenácti pacientů v každé srovnávané skupině (udržovací rituximab vs. sledování bez léčby) ukazují signifikantní rozdíl dvou let přežití bez události (úmrtí, relaps/progrese, těžká alergická reakce, těžká infekce) ve prospěch udržovací léčby: 93 % vs. 81 %, p = 0,01 [34].
V této analýze jsme se snažili shrnout naše poznatky a zkušenosti s léčbou u selektované skupiny starších pacientů s MCL, u kterých nebyla z důvodu věku nebo komorbidit indikována vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk. Charakteristiky skupiny odpovídaly obvyklým parametrům a klinickému obrazu postižení daným typem lymfomu – šlo především o muže, vždy bylo přítomno postižení lymfatických uzlin, dominovala klinická stadia III.–IV. s infiltrací kostní dřeně, nezřídka i leukemizace. Pacienti byli prospektivně sledováni s cílem analyzovat v budoucnu zaváděné léčebné postupy. V naší skupině jsou proto také v chronologické návaznosti zastoupeny protokoly indukce CHOP s doplněním série rituximabu, následně pak klasický protokol R-CHOP a později i zavedení udržovací léčby (tento fakt vysvětluje i důvod rozdělení pacientů v této analýze do skupiny bez doplněné a s doplněnou udržovací léčbou). Díky časovému omezení analýzy se zařazením posledních pacientů v r. 2010 jsou data týkající se PFS a OS již dostatečně „zralá“, i když omezená velikost souboru musí být samozřejmě brána na zřetel při celkovém hodnocení výsledků.
Primárním cílem analýzy bylo ověřit, zda udržovací léčba bude významně přispívat k prodloužení PFS, které je zde nutno považovat v kontextu s věkem pacientů za velmi důležitý klinický parametr. U pacientů ve vyšším věku s rizikem dalších komorbidit s potenciálem klinicky závažných následků (ICHS, IM, CMP atd.) má prodloužení doby života bez malignity a bez potřeby toxické léčby vždy výrazný význam. Výsledky v tomto smyslu ukázaly na jasný benefit doplněné udržovací léčby s rituximabem, a to i v případě celkového přežívání.
Jsme si vědomi, že s ohledem na velikost našeho souboru lze také jen spekulovat o tom, do jaké míry mohou být výsledky dále ovlivněny intervalem a počtem podaných dávek rituximabu v udržovací léčbě a samostatnou problematikou by jistě měl být i vliv indukčních protokolů a hloubka dosažené remise s analýzou minimální reziduální nemoci. Vzácnost lymfomu, navíc selektivita výběru a unicentrické zpracování jsou hlavním důvodem pro malou četnost našeho souboru, která limituje dosažené výsledky. Ty jsou však natolik výrazně odlišné mezi porovnávanými skupinami pacientů, že si s odkazem na srovnatelné parametry dosažených léčebných odpovědí po indukční léčbě v našich skupinách (četnost kompletní remise srovnatelná) dovolujeme tvrdit, že zásadním faktorem ovlivňujícím efekt prodloužení PFS a OS byla opravdu možnost doplnit po indukci udržovací léčbou s rituximabem.
Ve spojitosti s udržovací léčbou MCL rituximabem je nutno zmínit i fakt, že přes doložitelný a zřetelný efekt z řady významných pozorování [19–22, 31–34] a přes doporučení daná odbornými společnostmi nebyla dosud tato indikace zahrnuta do seznamu indikačních omezení Státního úřadu pro kontrolu léčiv (SÚKL) a pro zajištění úhrady rituximabu v této indikaci musí být hledány jiné cesty (např. individuální schválení revizním lékařem zdravotní pojišťovny, studie a granty, úhrada pacientem).
ZÁVĚR
U pacientů s MCL, kteří odpověděli na úvodní indukční léčbu, a kterým byla dále zajištěna udržovací terapie rituximabem bylo pozorováno významné prodloužení přežívání bez relapsu/progrese a celkového přežívání. U žádného pacienta nebylo nutno ukončit udržovací léčbu z důvodu komplikací vázaných k podávání rituximabu. S ohledem na vyšší věk pacientů má pozorované prodloužení při dobře tolerované udržovací léčbě velký klinický význam a je doložena oprávněnost udržovací léčby.
Podíl autorů na rukopisu
SV – příprava studie, léčba nemocných, provádění vyšetření, analýza dat, napsání rukopisu, kontrola, revize rukopisu.
AJ – příprava studie, léčba nemocných, provádění vyšetření, analýza dat, kontrola, revize rukopisu.
PJ – příprava studie, léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
VV – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
MS – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
MP – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
DL – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
MH – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
MP – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
LM – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
KS – léčba nemocných, provádění vyšetření, kontrola, revize rukopisu.
Potenciální konflikt zájmů: firma Roche podpořila v minulosti statistické analýzy a účast na kongresech a seminářích lékařů centra.
Doručeno do redakce: 12. 10. 2015
Přijato po recenzi: 16. 11. 2015
doc. MUDr. Samuel Vokurka, Ph.D.
Hematologicko-Onkologické oddělení
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Zdroje
1. Trněný M, Vášová I, Pytlík R, et al. Distribuce podtypů non-hodgkinského lymfomu v České republice a jejich přežití. Klin Onkol 2007; 20(5): 341–348.
2. Chan WC, Armitage JO, Gascoyne R, et al. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma. Blood 1997; 89 : 3909–3918.
3. Zhou Y, Wang H, Fang W, et al. Incidence trends of mantle cell lymphoma in the United States between 1992 and 2004. Cancer 2008;113 : 791–798.
4. Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of tumours of haematopoietic and lymphoid tissues, Fourth Edition, World Health Organization; 2008.
5. Adam Z, Král Z, Vorlíček J. Lymfom z plášťových buněk. In Adam Z, Vorlíček J, et al. Hematologie II – přehled maligních hematologických nemocí. 1.vyd., Praha, Grada Publishing 2001; 381–384.
6. Nickenig C, Dreyling M, Hoster E, et al. Combined cyclophosphamide, vincristine, doxorubicin, and prednisone (CHOP) improves response rates but not survival and has lower hematologic toxicity compared with combined mitoxantrone, chlorambucil, and prednisone (MCP) in follicular and mantle cell lymphomas: results of a prospective randomized trial of the German Low-Grade Lymphoma Study Group. Cancer 2006; 107 : 1014–1022.
7. Gressin R, Caulet-Maugendre S, Deconinck E, et al. Evaluation of the (R)VAD+C regimen for the treatment of newly diagnosed mantle cell lymphoma. Combined results of two prospective phase II trials from the French GOELAMS group. Haematologica 2010; 95 : 1350–1357.
8. Vokurka S, Koza V, Jindra P, et al. Význam imunoterapie anti-CD20 rituximab a vysokodávkované chemoterapie s autologní transplantací periferních krvetvorných buněk v první linii léčby mantle cell lymfomu – zkušenosti centra. Transfuze Hematol dnes 2006; 12 : 240–243.
9. Andersen NS, Pedersen L, Elonen E, et al. Primary treatment with autologous stem cell transplantation in mantle cell lymphoma: outcome related to remission pretransplant. Eur J Haematol 2003; 71 : 73–80.
10. Tam C, Bassett R, Ledesma C, et al. Mature results of the M. D. Anderson Cancer Center risk-adapted transplantation strategy in mantle cell lymphoma Blood 2009;113 : 4144–4152.
11. Romaguera J, Fayad L, Rodriguez M, et al. High rate of durable remissions after treatment of newly diagnosed aggressive mantle-cell lymphoma with rituximab plus hyper-CVAD alternating with rituximab plus high-dose methotrexate and cytarabine. J Clin Oncol 2005; 23 : 7013–7023.
12. Romaguera J, Fayad L, Feng L, et al. Ten-year follow-up after intense chemoimmunotherapy with Rituximab-HyperCVAD alternating with Rituximab-high dose methotrexate/cytarabine (R-MA) and without stem cell transplantation in patients with untreated aggressive mantle cell lymphoma. Br J Haematol 2010; 150 : 200–208.
13. Geisler Ch, Kolstad A, Laurell A, et al. Long-term progression-free survival of mantle cell lymphoma after intensive front-line immunochemotherapy with in vivo-purged stem cell rescue: a nonrandomized phase 2 multicenter study by the Nordic Lymphoma Group. Blood 2008; 112 : 2687–2693.
14. Schulz H, Bohlius J, Trelle S, et al. Immunochemotherapy with rituximab and overall survival in patients withi or mantle cell lymphoma: a systematic review and meta-analysis. J Natl Cancer Inst 2007; 99 : 706–714.
15. Lenz G, Dreyling M, Hoster E, et al. Immunochemotherapy with rituximab and cyclophosphamide, doxorubicin, vincristine and prednisone significantly improves response and time to treatment failure, but not long-term outcome in patients with previously untreated mantle cell lymphoma. J Clin Oncol 2005; 23 : 1984–1992.
16. Thieblemont C, Antal D, Lacotte-Thierry L, et al. Chemotherapy with rituximab followed by high dose therapy and autologous stem cell transplantation in patients with mantle cell lymphoma. Cancer 2005 : 104; 1434–1441.
17. Geisler Ch. Front-line treatment of mantle cell lymphoma. Haematologica 2010; 95 : 1241–1243.
18. Pott Ch, Hoster E, Delfau-Larue M, et al. Molecular remission is an independent predictor of clinical outcome in patients with mantle cell lymphoma after combined immunochemotherapy: a European MCL intergroup study. Blood 2010; 115 : 3215–3223.
19. Kahl B, Longo WL, Eickhoff JC, et al. Maintenance rituximab following induction chemoimmunotherapy may prolong progression-free survival in mantle cell lymphoma: a pilot study from the Wisconsin Oncology Network. Ann Oncol 2006; 17 : 1418–1423.
20. Kahl B, Li H, Smith M, et al. Mature results from ECOG study E1405 – a phase II study of VcR-CVAD with maintenance rituximab for previously untreated mantle cell lymphoma. Blood 2012; 120 : 153.
21. Kluin-Nelemans HC, Hoster E, Hermine O, et al. Treatment of older patients with mantle-cell lymphoma. N Engl J Med 2012; 367 : 520–531.
22. Kenkre VP, Long WL, Eickhoff JC, et al. Maintenance rituximab following induction chemo-immunotherapy for mantle cell lymphoma: long-term follow-up of a pilot study from the Wisconsin Oncology Network. Leuk Lymphoma 2011; 52 : 1675–1680.
23. Harris NL, Jaffe ES, Stein H, et al. Revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994; 84 : 1361–1392.
24. Boudová L, Kazakov D, Jindra P, et al. Primární kožní velkobuněčný anaplastický T-lymfom s koexpresí CD30 a CD56, bohatý na neutrofily a histiocyty. Popis raritního případu s přehledem literatury. Klin Onkol 2007; 20 : 260–263.
25. Fabian P, Boudová L. Poznámky ke 4. vydání klasifikace lymfomů WHO. Klinická onkologie 2009; 22 : 121–122.
26. Cheson B, Pfistner B, Juweid M, et al. Revised Response Criteria for Malignant Lymphoma. J Clin Oncol 2007; 25 : 579–586.
27. Hermine O, Hoster E, Walewski J, et al. Alternating courses of 3xCHOP and 3xDHAP plus rituximab followed by a high dose ARA-C containing myeloablative regimen and autologous stem cell transplantation (ASCT) increases overall survival when compared to 6 courses of CHOP plus rituximab followed by myeloablative radiochemotherapy and ASCT in mantle cell lymphoma: final analysis of the MCL Younger trial of the European Mantle Cell Lymphoma Network. Blood 2012; 120(21): 151.
28. Rummel MJ, Niederle N, Maschmeyer G, et al. Study Group Indolent Lymphomas (StiL). Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381 : 1203–1210.
29. Dreyling M, Geisler C, Hermine O, et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25(suppl 3): iii83-iii92.
30. Campo E, Rule S. Mantle cell lymphoma: evolving management strategies. Blood 2015; 125 : 48–55.
31. Vidal L, Gafter-Gvili A, Dreyling M, et al. Rituximab maintenance (MR) for patients with mantle cell lymphoma (MCL) – a systematic review and meta-analysis of randomized controlled trials (RCTs). Blood 2014; 124 : 4466–4466.
32. Forstpointner R, Unterhalt M, Dreyling M, et al. Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas: Results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 2006; 108 : 4003–4008.
33. Ghielmini M, Schmitz SF, Cogliatti S, et al. Effect of single-agent rituximab given at the standard schedule or as prolonged treatment in patients with mantle cell lymphoma: a study of the Swiss Group for Clinical Cancer Research (SAKK). J Clin Oncol 2005; 23 : 705–711.
34. Le Gouill S, Thieblemont C, Oberic L, et al. Rituximab maintenance versus wait and watch after four courses of R-DHAP followed by autologous stem cell transplantation in previously untreated young patients with mantle cell lymphoma: first interim analysis of the phase III prospective LYMA trial, a LYSA study. Blood 2014; 124 : 146.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2015 Číslo 4- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Léčba on-demand je jednoznačně neefektivní v prevenci vývoje hemofilické artropatie
-
Všetky články tohto čísla
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Metabolismus železa u dárců krve
- Racionální algoritmus zobrazovacích vyšetření u mnohočetného myelomu v podmínkách České republiky
- Udržovací léčba s rituximabem u starších pacientů s Mantle cell lymfomem v první remisi – zkušenost centra
-
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků - Základy hematologické diagnostiky
- Alternative donor hematopoietic cell transplantation for Fanconi anemia
- Energy balance and fitness in adult survivors of childhood acute lymphoblastic leukemia
- Impact of allogeneic stem cell transplantation on survival of patients less than 65 years of age with primary myelofibrosis
- Obsah ročníku 21/2015
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle-
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků - Metabolismus železa u dárců krve
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



