-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků
Autoři: Z. Gašová; J. Masopust; M. Písačka; P. Turek; D. Galuszková; J. Kracíková; M. Bohoněk; H. Bolcková; V. Řeháček
Vyšlo v časopise: Transfuze Hematol. dnes,21, 2015, No. 4, p. 214-234.
Kategorie: Doporučené postupy
*Pracovní skupina STL:
Spoluautorem doporučení jsou další odborné společnosti ČLS JEP:
Česká gynekologická a porodnická společnost
Česká onkologická společnost
Česká společnost anestezie, resuscitace a intenzivní medicíny
Konečné znění doporučení bylo schváleno a/nebo podpořeno výbory České chirurgické společnosti, České internistické společnosti, České neonatologické společnosti a České společnosti intenzivní medicíny ČLS JEP1 POJMY, DEFINICE A POUŽÍVANÉ ZKRATKY
Transfuzní přípravky. Za transfuzní přípravky se považují lidská krev a její složky zpracované pro podání člověku za účelem léčení nebo předcházení nemoci, pokud nejde o krevní deriváty; za lidskou krev se nepovažují krevní kmenové buňky a lymfocyty dárce krvetvorných kmenových buněk určené pro příjemce těchto buněk. Transfuzní přípravky se vyrábějí v zařízeních transfuzní služby za podmínek stanovených závaznými právními předpisy, zejména zákonem č. 378/2007 Sb. v platném znění (zákon o léčivech), zákonem č. 70/2013 v platném znění kterým se mění zákon č. 378/2007 Sb., o léčivech, a o změnách některých souvisejících zákonů (zákon o léčivech) a vyhláška č. 143/2008 Sb. (vyhláška o lidské krvi) v platném znění.
Zařízením transfuzní služby (ZTS) se rozumí poskytovatel zdravotních služeb, u kterého se provádí odběr a vyšetření lidské krve nebo jejích složek, pokud jsou určeny pro transfuzi nebo zpracování za jakýmkoliv účelem, a ve kterém se dále provádí zpracování lidské krve nebo jejích složek za účelem získání transfuzních přípravků nebo surovin pro další výrobu léčivých přípravků včetně kontroly a propouštění, dále jejich skladování a distribuce. Za zařízení transfuzní služby se nepovažuje krevní banka (zákon č. 70/2013 Sb., v platném znění).
Krevní bankou (KB) se rozumí organizační jednotka poskytovatele zdravotních služeb, ve které se skladují a vydávají transfuzní přípravky, a to výlučně pro použití u poskytovatele zdravotních služeb, popř. ve kterém se provádí předtransfuzní imunohematologické vyšetření. Postup pro výdej transfuzních přípravků stanoví prováděcí právní předpis (zákon č. 70/2013 Sb., v platném znění).
Transfuze je postup, při kterém se podává transfuzní přípravek do krevního oběhu pacienta (příjemce transfuzního přípravku, dále příjemce) obvykle do žíly pacienta.
Před podáním transfuzního přípravku transfuzí se posuzuje slučitelnost (kompatibilita) transfuzního přípravku s krví příjemce transfuzního přípravku. Za posouzení slučitelnosti transfuzního přípravku s krví příjemce odpovídá poskytovatel, který provádí transfuzi. Záznam o slučitelnosti transfuzního přípravku s krví pacienta je součástí zdravotnické dokumentace vedené o pacientovi, záznam podepíše zdravotnický pracovník, který slučitelnost transfuzního přípravku s krví příjemce ověřil (§ 32, zákon č. 373/2011 Sb., v platném znění).
Závažnou nežádoucí reakcí se rozumí nezamýšlená odezva dárce nebo pacienta související s odběrem krve nebo její složky nebo s podáním transfuzního přípravku, která má za následek smrt, ohrožení života, trvalé nebo významné poškození zdraví nebo omezení schopností pacienta nebo vyžaduje hospitalizaci nebo prodloužení probíhající hospitalizace.
Závažnou nežádoucí událostí se rozumí nepříznivá skutečnost související s odběrem krve nebo jejich složek, vyšetřením, zpracováním, skladováním a distribucí propuštěného transfuzního přípravku nebo suroviny pro další výrobu nebo výdejem transfuzního přípravku, která by mohla mít za následek smrt, ohrožení života, trvalé nebo významné poškození zdraví nebo omezení schopností pacienta.
„Near miss“ (téměř pochybení) – chyba, které bylo vědomě či nevědomě v poslední chvíli zabráněno. Bezděčnou akcí, či uvědoměním si nevhodného či nežádoucího jednání je zabráněno potencionálnímu nebo aktuálnímu poškození zdraví pacienta.
Klinicky významnými nepravidelnými protilátkami proti erytrocytům se rozumí protilátky proti jiným erytrocytovým antigenům, než jsou A a B, které mohou in vivo působit destrukci erytrocytů.
Použité zkratky
CMV – cytomegalovirus
DIC – diseminovaná intravaskulární koagulace, též diseminovaná intravaskulární koagulopatie
HBV – z anglického Hepatitis B Virus, virus hepatitidy B
HCV – z anglického hepatitis C Virus, virus hepatitidy C
HIV – z anglického Human Immunodeficiency Virus, virus lidské imunitní nedostatečnosti
HLA – z anglického Human leukocyte antigen, hlavní histokompatibilní systém člověka
HPA – z anglického Human platelet antigen, specifické antigeny na povrchu trombocytů
IgA – imunoglobulin A
IUT – intrauterinní (intraumbilikální) transfuze
KB – krevní banka
KS – krevní skupina
LDH – laktátdehydrogenáza
LCT – lymfocytotoxický test
PAT – přímý antiglobulinový test
TACO – z anglického Transfusion associated circulatory overload, oběhové přetížení v důsledku podání transfuzního přípravku – komplikace vzniklá v souvislosti s transfuzí
T.D. – terapeutická dávka; množství přípravku používané jako standardní dávka u dospělého (používá se zejména u trombocytů)
TP – transfuzní přípravky
TRALI – z anglického Transfusion related acute lung injury, akutní poškození plic způsobené transfuzí
T.U. – transfuzní jednotka, množství přípravku pocházející z jednoho standardního odběru plné krve (používá se zejména u erytrocytů a plazmy)
ZTS – zařízení transfuzní služby
2 CÍLEM STANDARDNÍHO POSTUPU JE DOPORUČENÍ
- Pro účelnou, účinnou a bezpečnou transfuzi
- Pro prevenci nežádoucích reakcí a nežádoucích událostí a
- Pro řešení nežádoucích reakcí a nežádoucích událostí pokud nastanou
K zajištění účinné a bezpečné hemoterapie jsou nezbytné:
- správná indikace transfuze lékařem,
- správné vystavení žádanky o transfuzní přípravek,
- správný odběr vzorku pro předtransfuzní vyšetření,
- správné provedení a správný výsledek imunohematologického předtransfuzního vyšetření,
- správná identifikace pacienta/příjemce (zákon č. 372/2011 Sb. § 53, odst. 2, vyhláška č. 98/2012 § 1, odst. 1, písm. b),
- správné provedení transfuze a postupů, které s ní souvisejí.
3 KOMPETENCE A ODPOVĚDNOST
Každý poskytovatel zdravotnických služeb má vypracované standardní postupy pro všechny fáze procesu transfuze. Personál má stanovené kompetence a je vyškolen v dodržování předepsaných postupů. Pracovníci, kteří se podílejí na podání transfuzních přípravků, jsou prokazatelně proškoleni a poučeni tak, aby si byli vědomi své odpovědnosti a důsledků případných opomenutí a omylů.
Lékař odpovídá za:
- indikaci transfuze na základě současného stavu znalostí, klinického stavu a laboratorního vyšetření pacienta;
- určení časové naléhavosti podání;
- výběr typu transfuzního přípravku, za podanou dávku transfuzního přípravku a za ověření účinnosti hemoterapie;
- informování pacienta a za jeho poučení o plánované transfuzi;
- zajištění písemného souhlasu pacienta s transfuzí;
- za podání transfuzního přípravku.
Odpovědnost nelékařských zdravotnických pracovníků (NLZP) je dána vyhláškou č. 55/2011 Sb. (vyhláška o činnostech zdravotnických pracovníků, v platném znění:
- sestra pro intenzivní péči (IP), dětská sestra pro IP a porodní asistentka pro IP (sestra a porodní asistentka se specializovanou způsobilostí) „může pod odborným dohledem lékaře aplikovat transfuzní přípravky“ (§ 55, 58 a 70);
- všeobecná sestra, porodní asistentka pod odborným dohledem lékaře „může spolupracovat při zahájení aplikace transfuzních přípravků a dále bez odborného dohledu na základě indikace lékaře ošetřuje pacienta v průběhu aplikace a ukončuje ji“[*].
* Podle zákona č. 96/2004 Sb. se za výkon povolání pod odborným dohledem považuje výkon činností, ke kterým je zdravotnický pracovník nebo jiný odborný pracovník způsobilý, nebo ke kterým způsobilost získává, při dosažitelnosti rady a pomoci zdravotnického pracovníka způsobilého k výkonu těchto činností bez odborného dohledu a v rozsahu, který tento zdravotnický pracovník určí. Odborný dohled může vykonávat také lékař v rozsahu své způsobilosti k výkonu zdravotnického povolání; rozsah těchto činností stanoví prováděcí právní předpis.
Lékař a/nebo sestra (dále NLZP – nelékařský zdravotnický pracovník), kteří podávají transfuzi, odpovídají za správné provedení transfuze a za správné provedení postupů, které s ní souvisejí, tj. za správné provedení a dodržení všech zásad bezpečnosti včetně ověření krevní skupiny u lůžka, za správnou rychlost podání transfuzních přípravků a za řešení a nahlášení případné potransfuzní reakce.
Transfuzní přípravky se aplikují se souhlasem pacienta (rozumí se příjemce transfuzního přípravku), s výjimkou případů, kdy souhlas pacienta není možné získat a transfuze je indikována z vitální indikace. Před zahájením transfuze musí být pacient poučen o významu transfuze, možných rizicích transfuze a možných důsledcích nepodání transfuze (zákon č. 372/2011 Sb., v platném znění,§ 34). V případě odmítnutí transfuze se postupuje podle zákona 372/2011 Sb., v platném znění, § 34).
Pro zajištění bezpečnosti transfuze je nezbytná jasná a jednoznačná komunikace a spolupráce: (a) mezi pracovníky klinických útvarů a pracovníky zařízení transfuzní služby/krevní banky, (b) mezi pracovníky klinických útvarů zúčastněnými na podání transfuzních přípravků (lékař, sestra a zdravotničtí pracovníci) a (c) mezi pracovníky klinických útvarů a pacientem. Je vhodné, aby poskytovatel zdravotnických služeb zajistil ověřování efektivity této spolupráce, např. prostřednictvím nemocniční transfuzní komise.
4 DOKUMENTACE SOUVISEJÍCÍ S TRANSFUZNÍ TERAPIÍ
V souvislosti s podáním transfuzních přípravků (TP) se používají a archivují dokumenty:
- a) požadavek na přípravu transfuzního přípravku (např. „žádanka“ o imunohematologické vyšetření, žádanka o transfuzní přípravek apod.),
- b) výsledek předtransfuzního vyšetření (např. výsledek „předtransfuzního imunohematologického vyšetření),
- c) požadavek na výdej transfuzního přípravku (např. žádanka o výdej TP);
- d) dokumentace k výdeji transfuzního přípravku (např. výdejka TP, průvodka TP, dodací list TP podle vnitřních postupů poskytovatele zdravotnických služeb; dodací list je účetně evidenčním dokumentem);
- e) záznam o transfuzi v dokumentaci pacienta.
Dokumenty a) až d) mohou být v závislosti na místních podmínkách ZTS/KB v různé míře sloučeny (např. společná žádanka o imunohematologické vyšetření a žádanka o výdej TP, výsledek předtransfuzního vyšetření a výdej TP na společném formuláři apod.) nebo vedeny v elektronické podobě (vyhláška č. 54/2008 Sb., v platném znění).
5 OBJEDNÁNÍ TRANSFUZNÍHO PŘÍPRAVKU
5. 1 Žádanka o transfuzní přípravek
Transfuzní přípravek je léčivým přípravkem. Pro jeho objednání je nutné vystavit lékařský předpis – „Žádanku o transfuzní přípravek“. Žádanka má náležitosti receptu a podepisuje ji ošetřující lékař. Ošetřující lékař posuzuje podle klinického stavu pacienta také naléhavost transfuze (vitální indikace, statim, plánovaná transfuze, plánovaný transfuzní přípravek do zálohy).
Žádanka o transfuzní přípravky obsahuje údaje (vyhláška č. 54/2008 Sb., v platném znění):
- název a identifikační údaje poskytovatele zdravotnických služeb (žadatele o TP), jeho identifikační číslo, pokud bylo přiděleno, název oddělení a identifikační číslo zdravotní pojišťovny (nejedná-li se o cizince a další pacienty bez pojištění);
- jméno pacienta/příjemce transfuzního přípravku, případně jména, příjmení, datum narození, identifikační číslo pacienta (pojištěnce, příjemce TP), eventuálně „náhradní identifikátor“, případně rodné číslo plánovaného příjemce transfuzního přípravku; v případě, že nejsou potřebné údaje známy, uvede se údaj jednoznačně identifikující příjemce (vhodný je údaj o pohlaví a pravděpodobném věku);
- důvod podání transfuzního přípravku nebo diagnózu pacienta;
- krevní skupinu (AB0 a RhD), pokud byla vyšetřena, informaci o dříve zjištěných nepravidelných protilátkách proti erytrocytům (uvést specificitu);
- transfuzní/imunohematologickou anamnézu obsahující informace o předchozích transfuzích, porodech, těhotenství, potransfuzních reakcích, hemolytickém onemocnění novorozence, případném výskytu imunohematologických komplikací v rodině apod.;
- druh (typ) jmenovitě uvedeného transfuzního přípravku, počet kusů, transfuzních jednotek nebo terapeutických dávek (Metodický pokyn „ Standard označování transfuzních přípravků. Štítky propuštěných přípravků“, Věstník MZČR, částka 7, 2013);
- otisk razítka poskytovatele;
- naléhavost požadavku (vitální – statim – plánovaná transfuze – přípravek do zálohy, den a hodinu podání);
- případné požadavky na další úpravu transfuzního přípravku (deleukotizace, ozáření, promytí, výběr podle HLA, HPA, CMV – negativita, inaktivace patogenů apod.);
- datum vystavení;
- jméno, případně jména, příjmení a podpis lékaře, který požaduje transfuzní přípravek.
V případě, že je současně požadováno imunohematologické vyšetření a je přiložen vzorek, na žádance na transfuzní přípravek se dále uvádí (vyhláška č. 54/2008 Sb., v platném znění):
- druh požadovaného vyšetření, kterým je např. vyšetření krevní skupiny, nepravidelných protilátek, zkouška slučitelnosti;
- datum a čas odběru vzorku;
- jméno, případně jména a příjmení osoby, která vzorek odebrala;
- číselný kód zdravotní pojišťovny příjemce transfuzního přípravku.
Vzorek k laboratornímu vyšetření se označí tak, aby nebyla možná jeho záměna, a správnost údajů se ověřuje podpisem osoby, která vzorek odebrala. Elektronické žádanky musí splňovat stejné minimální požadavky jako písemné, kromě podpisu lékaře; musí však být autorizovány (vyhláška č. 54/2008 Sb., v platném znění).
Písemnou žádanku může v určitých případech (v případě urgentního požadavku) předcházet telefonický požadavek, který musí být dokumentován v KB/ZTS a obsahuje údaje o identifikaci požadujícího lékaře a oddělení, identifikaci pacienta, typu a počtu přípravků, o datu a času, důvodu požadavku a identifikaci pracovníka laboratoře, který požadavek přijal).
5. 2 Vzorek krve pacienta (příjemce) k předtransfuznímu vyšetření
Poskytovatelé zdravotnických služeb mají vypracované postupy pro odběr a označení vzorku krve pacienta pro předtransfuzní vyšetření.
5.2. 1 Odběr vzorku krve pacienta
Vzorek krve pacienta (příjemce TP) se odebírá podle požadavku laboratorní příručky KB/ZTS (obvykle nesrážlivá krev v EDTA nebo sražená krev). Vzorek se odebírá do předem označené zkumavky (uvádí se jméno, příjmení, a identifikační číslo pacienta, případně rodné číslo pacienta). Po nalepení štítku na zkumavku se ověří identifikace jedince dotazem, z identifikačního náramku nebo ze zdravotnické dokumentace. Na žádance o transfuzní přípravek/předtransfuzní vyšetření se uvádí, kdo vzorek odebral, včetně jeho podpisu (viz 5. 1. „Žádanka o transfuzní přípravek“)
Pozn.: V některých situacích se nemusí vzorek krve odebírat. U požadavku na trombocyty či plazmu není nutné opakovaně vyšetřovat krevní skupinu příjemce, pokud je již jeho krevní skupina známa.
5.2. 2 Příjem vzorku krve a žádanky k předtransfuznímu vyšetření
Přijímající pracovník KB/ZTS:
- zkontroluje úplnost a shodu údajů na žádance a na štítku vzorku, vzhled vzorku a dále podle místních podmínek správnost časování odběru vzorku vzhledem k datu transfuze;
- u nedostatečně vyplněných žádanek a nedostatečně označených a nevhodných vzorků zajistí neprodleně nápravu na oddělení požadujícím vyšetření. Zjištěné závady je vhodné zaznamenávat a hlásit (např. nemocniční transfuzní komisi).
Chyba v dodržování správných postupů může mít za následek podání inkompatibilního transfuzního přípravku a ohrožení příjemce. Poskytovatelé zdravotnických služeb (KB/ZTS) mají vypracované vnitřní předpisy pro situace, kdy žádanka nebo vzorek krve od pacienta nejsou označeny odpovídajícím způsobem, nebo se údaje neshodují (např. požadavek KB/ZTS na nový vzorek a novou žádanku apod.).
5. 3 Předtransfuzní laboratorní vyšetření
Před podáním transfuzního přípravku je nutné provést předtransfuzní vyšetření.
KB/ZTS určuje a zveřejňuje v laboratorní příručce rozsah předtransfuzního vyšetření v závislosti na typu požadovaného přípravku, anamnéze, klinickém stavu pacienta a naléhavosti požadavku.
A. Před podáním erytrocytů a granulocytů
podává předtransfuzní vyšetření informace jak o transfuzním přípravku, tak i o jeho příjemci.
Před transfuzí erytrocytů a granulocytů se obvykle vyšetřují ze vzorku pacienta:
- krevní skupina AB0, RhD;
- screening nepravidelných protilátek proti erytrocytům;
- slučitelnost – test slučitelnosti (kompatibility) podávaných erytrocytů s plazmou/sérem příjemce.
Platnost testu kompatibility je nejdéle 72 hodin (počítáno od doby provedení odběru vzorku pacienta). V případě potřeby transfuze pro daného pacienta po uplynutí této lhůty je nutno provést test slučitelnosti z nového vzorku odebrané krve a na základě nové žádanky. Platnost testu kompatibility lze prodloužit na 7 dnů u pacientů, jimž nebyla prokazatelně v posledních 28 dnech podána transfuze erytrocytů nebo trombocytů. Tento anamnestický údaj musí být uveden na žádance jasnou formou.
Platnost testu kompatibility je stejná pro červenou i bílou řadu, tj. výsledek lymfocytotoxického testu (LCT) nebo jiného testu slučitelnosti v bílé řadě, má stejnou dobu platnosti jako test kompatibility před podáním erytrocytů.
Výsledek předtransfuzního vyšetření se musí vydat před prvním vydáním nebo s prvním vydávaným transfuzním přípravkem. Má obsahovat identifikaci pacienta (jméno a příjmení, identifikační číslo pacienta, případně rodné číslo pacienta), místo doručení (oddělení, operační sál aj.), krevní skupinu (AB0, RhD) pacienta, identifikaci transfuzního přípravku (číslo, krevní skupina, typ přípravku), datum provedení a výsledek předtransfuzního vyšetření, datum výdeje transfuzního přípravku, identifikaci laboratoře, identifikaci a podpis osoby provádějící vyšetření, odpovědné za interpretaci a vydání výsledku a transfuzního přípravku.
Další informace v Příloze 5 „ AB0/RhD slučitelnost transfuzních přípravků“ a v Příloze 6 „Zvláštní klinické situace“.
B. Před podáním plazmy nebo trombocytů
Před první transfuzí plazmy a trombocytů se odesílá vzorek krve pacienta k laboratornímu vyšetření krevní skupiny AB0, RhD. Při dalších transfuzích plazmy a trombocytů se již nemusí krevní skupina příjemce ověřovat v KB/ZTS. Před podáním plazmy nebo trombocytů se testy slučitelnosti v AB0 systému nevyžadují (Příloha 5 „AB0/RhD slučitelnost transfuzních přípravků“, zákon č. 373/2011 Sb., v platném znění, § 32). V případě potřeby (např. u pacientů refrakterních na podání trombocytů) lze vyšetření doplnit po dohodě KB/ZTS a klinického pracoviště o výběr přípravku podle kompatibility v systému HLA, HPA.
Nestandardní postupy
Do průvodní dokumentace k transfuzi se zřetelně zaznamená, pokud předtransfuzní vyšetření:
- nebylo provedeno,
- bylo redukováno nebo
- neposkytlo negativní výsledek.
6 ČASOVÁ NALÉHAVOST TRANSFUZE
Ošetřující lékař posuzuje časovou naléhavost transfuze podle klinického stavu pacienta.
6. 1 Vitální indikace
Transfuzní přípravek se vydá ihned bez provedení předtransfuzního laboratorního vyšetření:
- je-li krevní skupina AB0, RhD příjemce známa, vydávají se přednostně stejnoskupinové transfuzní přípravky;
- není-li krevní skupina AB0, RhD příjemce známa, vydává se transfuzní přípravek:
- erytrocyty: 0 RhD negativní, Kell negativní, 0 RhD pozitivní erytrocyty a Kell pozitivní erytrocyty jen v případě absolutního nedostatku jiných přípravků a přímého ohrožení života. Podání přípravku bez znalosti výsledku screeningu protilátek zvyšuje riziko potransfuzní hemolytické reakce;
- plazma: AB;
- trombocyty: bez ohledu na krevní skupinu AB0, RhD.
Za uvedených okolností nelze vyloučit vznik akutní potransfuzní hemolytické reakce (pacient může mít protilátku proti antigenům jiných skupinových systémů, protilátka se zjistí až při standardním předtransfuzním vyšetření)!
Upozornění
Spolu s požadavkem o transfuzní přípravek erytrocytů nebo následně hned, jak je to možné, se odesílá vzorek pro „předtransfuzní vyšetření“. Laboratorní vyšetření se provede bezodkladně a o jeho výsledku je dodatečně informováno klinické pracoviště. Naznačuje--li výsledek vyšetření, že by předběžně vydané přípravky mohly být inkompatibilní (nález nepravidelných protilátek, pozitivní test kompatibility), ihned se informuje klinické pracoviště s cílem podle možností zastavit transfuzi nevhodných přípravků a dosud nepodané nahradit vhodnými.
Vzorek krve je nutné odebrat zásadně před podáním transfuzního přípravku (pokud možno i jiných náhradních roztoků).
Další informace – Příloha 5 „AB0/RhD slučitelnost transfuzních přípravků a Příloha 6 „Zvláštní klinické situace“.
6. 2 Statim
Transfuzní přípravek je připraven k vydání co nejdříve po provedení kompletního předtransfuzního vyšetření v závislosti na typu a dostupnosti transfuzního přípravku a na počtu požadovaných jednotek či dávek.
V případě erytrocytových transfuzních přípravků se za obvyklou považuje doba vydání do 90 minut od doručení vzorku. V případě komplikovaného imunohematologického nálezu (např. kombinace protilátek nebo nález silných autoprotilátek) nelze v uvedené lhůtě garantovat zajištění vhodného přípravku. V takových situacích se postupuje po dohodě s ošetřujícím lékařem podle klinické situace – transfuze se odloží, nebo se vybere nejméně rizikový přípravek. Je nutné zvážit rizika podání takového přípravku.
6. 3 Plánovaná transfuze
Transfuzní přípravek je k dispozici podle data, eventuálně hodiny na žádance. V případě komplikovaného imunohematologického nálezu (např. kombinace protilátek nebo nález silných autoprotilátek) nelze v požadovaném termínu garantovat zajištění vhodného přípravku. V takových situacích se postupuje po dohodě s ošetřujícím lékařem podle klinické situace – transfuze se odloží, nebo se vybere nejméně rizikový přípravek. Je nutné zvážit rizika podání takového přípravku.
6. 4 Požadavek o erytrocytový transfuzní přípravek do zálohy (rezerva)
KB/ZTS provede z dodaného vzorku základní imunohematologické vyšetření (krevní skupina AB0, RhD a screening nepravidelných protilátek). V případě nekomplikovaného nálezu neprovádí další předtransfuzní vyšetření. Pouze ověří, zda jsou požadované přípravky k dispozici. Test kompatibility se provede až poté, kdy se požaduje podání transfuzního přípravku. Přípravek je dostupný do 60–90 minut od vyslovení požadavku na výdej (analogicky režimu statim, ale se zárukou, že přípravek bude k dispozici).
7 VÝDEJ A TRANSPORT TRANSFUZNÍCH PŘÍPRAVKŮ Z KREVNÍ BANKY
7. 1 Výdej transfuzních přípravků
Jakmile je rozhodnuto o provedení transfuze, ověří lékař klinického útvaru oprávněnost indikace k podání transfuzního přípravku. KB/ZTS vydává transfuzní přípravky pouze zdravotnickým pracovníkům, eventuálně řidičům poskytovatelů zdravotnických služeb pověřeným svozem biologického materiálu. Transfuzní přípravky se vydávají na základě písemného požadavku – žádanky indikujícího lékaře. Vydávaný transfuzní přípravek je opatřený průvodní dokumentací (viz bod 4).
7. 2 Transport transfuzních přípravků
Transfuzní přípravky se transportují v dezinfikovatelných a termostabilních boxech, které lze uzavřít. Různé typy transfuzních přípravků s rozdílnými teplotami uchovávání se transportují v samostatných transportních boxech. Během transportu je nutné dodržet podmínky pro uchovávání jednotlivých typů přípravků. Při transportu transfuzních přípravků potrubní poštou nebo jiným podobným automatizovaným systémem, musí být tento transport předem validován.
8 PŘÍJEM TRANSFUZNÍHO PŘÍPRAVKU NA ODDĚLENÍ K APLIKACI
Poskytovatelé zdravotnických zařízení mají vypracované postupy:
- pro výdej, převzetí a transport transfuzních přípravků ze ZTS/KB na klinická pracoviště;
- pro uchování transfuzních přípravků na klinických pracovištích před jejich aplikací;
- pro vracení a znehodnocení nepoužitých transfuzních přípravků.
9 TRANSFUZE
Jednotlivá pracoviště mají připravené a schválené postupy pro přípravu a provedení transfuze. Postupy platí také při výkonech, při nichž je nutno podat transfuzní přípravky (např. v průběhu operací, v průběhu terapeutických hemaferéz a dalších postupů).
Pracovníci, kteří odpovídají za provedení transfuzí, jsou zaškoleni v dodržování předepsaných postupů. Pacienti se v průběhu transfuzí pečlivě sledují. Pokud se nejedná o neodkladnou situaci, nemají se plánované transfuze podávat v nočních hodinách.
KB/ZTS mají k dispozici „specifikace transfuzních přípravků“, které obsahují informace o přípravě, složení, dávkách a podmínkách uchovávání jednotlivých typů transfuzních přípravků. Specifikace jsou přístupné pracovníkům zdravotnického zařízení. Pokyny pro uchovávání transfuzních přípravků lze také nalézt na štítku s transfuzním přípravkem.
Podání transfuzních přípravků se zahájí co nejdříve po jejich doručení na klinické pracoviště.
Transfuze se má ukončit nejdéle do 6 hodin (optimálně do 4 hodin) po vynětí transfuzního přípravku ze zařízení s kontrolovanou teplotou (snížené riziko mikrobiálního růstu). Je vhodné, aby časový interval mezi vynětím transfuzního přípravku ze zařízení s kontrolovanou teplotou a zahájením transfuze netrval déle než 30 minut.
Pokud nelze transfuzní přípravek podat v doporučeném časovém limitu, lze výjimečně (za předem jednoznačně definovaných postupů) přípravky co nejdříve vrátit na KB/ZTS.
Zmrazené transfuzní přípravky
Zmrazená plazma se má podat nejdéle do 6 hodin po rozmrazení za předpokladu, že se před podáním uchovává při teplotě 20–24 °C.
Rozmrazení se provádí při teplotě přibližně 37 °C za pomoci certifikovaných a pravidelně validovaných zařízení s monitorováním teploty rozmrazovací lázně. Pro potřeby substituce masivních krevních ztrát může být režim vydávané plazmy upraven podle místních podmínek a validovaných postupů (např. pohotovostní sklady plazmy na urgentních příjmových odděleních).
Kryokonzervované erytrocyty se po rozmrazení vydávají na základě doby použitelnosti a podle technologie zmrazení a rozmrazení. Pro transfuzi rozmrazených a rekonstituovaných erytrocytů platí stejné postupy jako pro ostatní erytrocytové přípravky.
Kryokonzervované trombocyty se po rozmrazení vydávají na základě doby použitelnosti a podle technologie zmrazení a rozmrazení. Pro transfuzi rozmrazených trombocytů platí stejné postupy jako pro ostatní trombocytové přípravky.
9. 1 Kontrolní postupy před zahájením transfuze
Před zahájením transfuze ověří lékař klinického útvaru správnost požadavku o podání transfuzního přípravku. Bezprostředně před zahájením transfuze provádějí pověření pracovníci kontrolní postupy u lůžka pacienta (příjemce transfuzního přípravku). Zkontrolovaný transfuzní přípravek se od lůžka pacienta (příjemce) neodnáší. V případě přemístění přípravku nebo pacienta (příjemce) je třeba před transfuzí znovu provést kontrolní postupy včetně ověření krevní skupiny přípravku a krevní skupiny příjemce u lůžka.
NLZP neprodleně informuje lékaře o jakékoli neshodě.
Pověřený pracovník před zahájením transfuze:
- provede identifikaci pacienta/příjemce transfuzního přípravku;
- ověří se totožnost příjemce (pozitivní identifikace-aktivní dotaz, ověření údajů na identifikačním náramku, z dokumentace – podle vnitřních předpisů poskytovatele zdravotnických služeb);
- ověří a případně zajistí písemný souhlas pacienta/příjemce s transfuzí (s výjimkou situací, kdy jej pacient nemůže poskytnout – zákon č. 372/2011 Sb., o zdravotních službách a podmínkách jejich poskytování (zákon o zdravotních službách);
- ověří správnost údajů uvedených na:
a) transfuzním přípravku a vzhled transfuzního přípravku
- údaje na transfuzním přípravku – typ přípravku (Metodický pokyn „Standard označování transfuzních přípravků. Štítky propuštěných přípravků“, Věstník MZČR, částka 7, 2013), identifikační číslo přípravku, krevní skupina (AB0 RhD), dávka/objem přípravku, datum exspirace, dodržení postupu pro uchování přípravku po jeho doručení na oddělení;
- vzhled transfuzního přípravku – zbarvení, nepřítomnost koagul a vířivý („swirling“) efekt u trombocytů, neporušenost vaku;
b) průvodní dokumentaci k transfuznímu přípravku („průvodka transfuzního přípravku“, výsledek laboratorního předtransfuzního vyšetření, výsledek a platnost testu kompatibility při podání erytrocytů a granulocytů, eventuálně trombocytů u refrakterních HLA/HPA imunizovaných pacientů ( 5. 3 “Předtransfuzní laboratorní vyšetření”, Příloha 5 “AB0/RhD slučitelnost transfuzních přípravků”, zákon č. 373/2011 Sb., v platném znění, § 32), shoda údajů v dokumentaci transfuzního přípravku a na vaku s transfuzním přípravkem (údaje na štítku);
- ověří krevní skupinu u lůžka bezprostředně před transfuzí:
- ověření krevní skupiny u lůžka se provádí za pomoci diagnostických sér anti-A a anti-B (např. „Sanguitest“ – „AB0 souprava k lůžku k ověření krevní skupiny transfuzního přípravku a krevní skupiny příjemce u lůžka“). Postupuje se podle návodu výrobce.
Pověřený pracovník s odpovědností za provedení transfuze provede zkoušku, vyhodnotí ji a její výsledek zaznamená do dokumentace příjemce. Souhlasí-li výsledek, lze zahájit podání transfuzního přípravku. Kartička s provedeným testem zůstává na oddělení po dobu transfuze. Po jejím ukončení se materiál znehodnotí v souladu s hygienicko-epidemiologickým řádem zdravotnického zařízení jako nebezpečný odpad.
a) Ověření krevní skupiny příjemce u lůžka se provádí vždy před každou transfuzí. Pokud se v průběhu transfuze podává série transfuzních přípravků, lze ověřit krevní skupinu příjemce před podáním prvního přípravku z každé série.
Ověření krevní skupiny příjemce lze ve zcela výjimečných situacích vynechat, např. při transfuzi z vitální indikace – při podání erytrocytů krevní skupiny 0 RhD negativních, Kell negativních, plazmy krevní skupiny AB a při podání trombocytů bez ohledu na krevní skupinu AB0, RhD (viz 6. 1. „Vitální indikace“, Příloha 5 „AB0/RhD slučitelnost transfuzních přípravků”).
V dokumentaci pacienta/příjemce bude záznam o tom, že krevní skupina příjemce nebyla ověřena.
Vzorek krve příjemce se odebere z kapilární krve, z venepunkce nebo za použití centrálního žilního vstupu před připojením transfuzní soupravy k žilnímu vstupu pacienta.
b) Ověření krevní skupiny transfuzního přípravku u lůžka se provádí před podáním každého přípravku erytrocytů a granulocytů. Před podáním trombocytů a plazmy se vyšetření z přípravku neprovádí.
Vzorek k ověření krevní skupiny přípravku lze odebrat buď z vaku s přípravkem, nebo ze segmentu, který je originálně připojený k vaku s transfuzním přípravkem.
Při odběru vzorku krve z vaku se při dodržení zásad asepse napojí transfuzní souprava na vak s přípravkem. Poté se kapací komůrka soupravy naplní z třetiny až poloviny a ze soupravy se odebere vzorek krve.
9. 2 Příprava pacienta k transfuzi
U příjemce se bezprostředně před zahájením transfuze (nejdéle 60 minut před zahájením transfuze) změří a zaznamenají hodnoty tlaku krve, tepové frekvence a tělesné teploty.
U pacientů v bezvědomí se doporučuje změření dechové frekvence. V situacích, kdy lze vyšetřit moč, se provede alespoň její orientační vyšetření (vizuální posouzení barvy moči).
9. 3 Technika transfuze
Transfuzní přípravky se aplikují za použití soupravy pro provedení transfuze (transfuzní souprava), která je opatřena standardním filtrem o průměru pórů 170 až 200 mikrometrů. Tento požadavek platí i pro podání transfuzních přípravků v průběhu terapeutických výkonů prováděných technikou hemaferézy, např. výměnná plazmaferéza, výměnná erytrocytaferéza apod. U dospělých pacientů se pro podání jednoho vaku s transfuzním přípravkem používá jedna transfuzní souprava.
Rychlost transfuze
K aplikaci transfuzního přípravku je zapotřebí funkční periferní nebo centrální žilní přístup. Dobrá funkce žilního přístupu umožňuje dostatečně rychlé a bezpečné podání přípravku s minimálním rizikem hemolýzy erytrocytů. Volba žilního přístupu závisí na zvolené rychlosti transfuze. U dospělých pacientů se obvykle používají periferní jehly nebo kanyly o průměru 18 G (gauge). Za nejmenší vhodný průměr se považují jehly nebo kanyly o průměru 23 G.
- Rychlost podání transfuzních přípravků lze vyjádřit buď v ml za minutu nebo za pomoci kapek za minutu. Jako převodní faktor se obvykle používá číslo 15, což znamená, že objem jednoho mililitru transfuzního přípravku odpovídá 15 kapkám (příklad: objem transfuzního přípravku je 240 ml, plánovaná doba jeho podání je 120 minut. Výpočet rychlosti podání přípravku v ml/minutu je 240/120, což se rovná 2 ml/minutu. Při vyjádření rychlosti podání v kapkách/minutu se výsledek 2 ml/minutu vynásobí převodním faktorem 15. Rychlost podání přípravku v kapkách/minutu se bude rovnat 30 kapkám/minutu.
Obvykle (nejedná-li se o zvláštní situace) se transfuzní přípravky podávají po dobu prvních 15 minut pomalou rychlostí, tj. 1–2 ml za minutu (odpovídá cca 15–30 kapkám za minutu). Pokud nedojde k nežádoucí reakci, může se rychlost podání zvýšit.
- Rychlost podání erytrocytů – erytrocyty se (po uplynutí prvních 15 minut pomalejšího podání) obvykle podávají rychlostí od 2 do 6 ml za minutu, což obvykle odpovídá jedné až dvěma hodinám (závisí na schopnosti pacienta tolerovat zvýšený intravaskulární objem).
Erytrocyty se mohou za určitých okolností podávat také přetlakem (masivní přetlaková transfuze). K transfuzi se používá zdravotnický prostředek s možností nastavení a kontroly tlaku. Transfuze přetlakem s sebou nese zvýšené riziko hemolýzy erytrocytů, poškození žíly pacienta s rizikem paravenózního podání a riziko vzduchové embolie. Většina současných systémů využívá maximálně tlak 300 mm Hg. Při vyšších hodnotách tlaku může dojít k ruptuře vaku s přípravkem. K podání lze použít centrální žilní katétr, obvykle o průsvitu 8–12 FR (French) nebo periferní kanylu o průsvitu alespoň 14 G (cca 6 FR).
- Rychlost podání trombocytů a plazmy – trombocyty a plazma se (po uplynutí prvních 15 minut pomalejšího podání) obvykle podávají rychlostí od 4 do 10 ml za minutu. Doba podání se pohybuje obvykle v rozmezí od 15 do 60 minut. Rychlost podání závisí na objemu transfuzního přípravku a na schopnosti pacienta tolerovat podávaný objem.
- Rychlost podání granulocytů – granulocyty se podávají pomalými rychlostmi po dobu 2–4 hodin.
Pokud se transfuzní přípravky podávají vyššími rychlostmi (např. při transfuzi přetlakem, u výměnných výkonů v průběhu hemaferéz – výměnná plazmaferéza, výměnná erytrocytaferéza apod.), doporučuje se v průběhu transfuze stálá přítomnost lékaře (viz 9. 4).
- Přítomnost lékaře a sestry během transfuze. Monitorování pa-cienta (příjemce transfuzního přípravku)“
Pokud je třeba podat transfuzi pomalu v delším časovém intervalu než 6 hodin, může ZTS předem rozdělit přípravek do několika menších dávek. Každá dávka může být podávána až po dobu 6 hodin. Předpokladem je manipulace s přípravkem v uzavřeném systému za použití sterilních svárů.
Biologická zkouška se neprovádí.
Biologická zkouška spočívala nejprve v rychlém podání cca 10–20 ml (asi 150–300 kapek) transfuzního přípravku. Poté se rychlost transfuze zpomalila na minimum po dobu 3–5 minut. Pokud u nemocného nedošlo k nežádoucí reakci, zkouška se ještě 1krát opakovala. V průběhu biologické zkoušky (10–15 min) byl pacient pod přímým dohledem lékaře a NLZP.
9. 4 Přítomnost lékaře a sestry během transfuze
Monitorování pacienta (příjemce transfuzního přípravku)
K závažným akutním nežádoucím reakcím dochází většinou v průběhu prvních 30 minut po zahájení transfuze.
Po zahájení transfuze zůstává pacient prvních 15 minut pod přímým dohledem lékaře nebo NLZP s kompetencemi pro provedení transfuze (s možností okamžité dostupnosti lékaře v případě komplikací). Doporučení je platné pro podání každé jednotky transfuzního přípravku, např. při podání série přípravků.
V dalším průběhu nekomplikované transfuze je zajištěna dostupnost lékaře a pacient zůstává pod dohledem NLZP, která/ý sleduje stav pacienta po dobu transfuze nejméně v 30minutových intervalech. Kontroly se bezprostředně zaznamenávají do dokumentace pacienta. Při jakýchkoli objektivních nebo subjektivních příznacích (nemocný se upozorní předem, aby je hlásil) NLZP přeruší transfuzi – ponechá jehlu v žilním vstupu a volá lékaře, který po posouzení situace rozhodne o dalším postupu. Pacient má k dispozici signalizační zařízení.
Zvýšený dohled lékaře se doporučuje po celou dobu transfuze v situacích:
- u transfuze prováděné z vitální indikace (nejsou dokončeny testy kompatibility),
- podle doporučení KB/ZTS na základě výsledků vyšetření kompatibility (výsledek nebyl negativní – např. nespecifické autoprotilátky a/nebo výběr antigen negativních přípravků z důvodu časové tísně a/nebo při technických komplikacích),
- u pacientů s opakovanými potransfuzními reakcemi,
- u pacientů v bezvědomí,
- u pacientů v celkové anestezii,
- u pacientů v průběhu terapeutických výměnných hemaferéz – výměnná plazmaferéza a výměnná erytrocytaferéza,
- u pacientů při transfuzi přetlakem.
Ukončení transfuze. Transfuze se ukončí v okamžiku, kdy ve vaku zbývá cca 5–10 ml přípravku. Ukončení transfuze se provede uzavřením tlačky soupravy. Pokud je nemocný bez obtíží a není zapotřebí odebírat vzorky k vyšetření, jehla se odstraní ze žíly a místo vpichu se ošetří obvyklým postupem. Je-li zapotřebí zachovat intravenózní vstup, zůstává jehla v žíle a nechá se prokapávat izotonickým roztokem NaCl.
- Vak s odpojenou transfuzní soupravou se uzavře (zatavením, tlačkou nebo za použití jiného postupu) tak, aby nedošlo ke kontaminaci zbývajícího množství přípravku. Vak se zbytkem přípravku se skladuje na klinickém pracovišti při teplotě 2–6 °C po dobu 24 hodin po ukončení transfuze (možnost dodatečného vyšetření v případě potransfuzní reakce). Po uplynutí 24 hodin se vak se zbytkem transfuzního přípravku znehodnotí v souladu s hygienicko-epidemiologickým řádem zdravotnického zařízení jako nebezpečný odpad.
Po ukončení transfuze. Bezprostředně po ukončení transfuze (nejdéle do 60 minut po ukončení transfuze) se změří a do dokumentace pacienta zaznamená tlak krve, tepová frekvence, tělesná teplota, dechová frekvence (doporučuje se u pacientů v bezvědomí) a provede se orientační vyšetření moči (eventuálně ověření zbarvení moči), pokud je lze provést nebo pokud se požaduje v standardních postupech.
Hospitalizovaný pacient se sleduje minimálně po dobu 2 hodin po ukončení transfuze. Výsledky kontrol se zaznamenávají do dokumentace pacienta. Veškeré změny zdravotního stavu pacienta hlásí NLZP lékaři.
Po ambulantně podané transfuzi se pacient sleduje v zdravotnickém zařízení minimálně 2 hodiny po ukončené transfuzi. Je-li bez obtíží a výsledky vyšetření vyhovují (tlak krve, tepová frekvence, tělesná teplota a vyšetření moči, eventuálně ověření zbarvení moči), může být propuštěn z ambulantního sledování. Výsledky kontrol a doba odchodu pacienta z ambulance se zaznamenávají do zdravotní dokumentace. Pacienta je třeba předem poučit o možném výskytu opožděné potransfuzní reakce. Nemocniční zařízení má vypracovaný systém s kontakty, na které se nemocný může obrátit v případě potransfuzní komplikace.
9. 5 Záznamy o transfuzi
Poskytovatel zdravotnických služeb má zavedené postupy pro dokumentaci každého individuálního transfuzního přípravku. Musí být zajištěna „dohledatelnost“ každého transfuzního přípravku od dárce k příjemci.
Každá transfuze se zaznamená do dokumentace pacienta. Záznam obsahuje:
- datum a čas zahájení a ukončení transfuze;
- identifikační číslo a typ podaného transfuzního přípravku;
- krevní skupinu přípravku (AB0 a RhD) a krevní skupinu příjemce;
- výsledek ověření krevní skupiny pacienta a transfuzního přípravku u lůžka;
- provedená vyšetření před transfuzí a po ní (tělesná teplota, krevní tlak, tepová frekvence, eventuálně vyšetření moče). U pacientů v bezvědomí se před transfuzí a po jejím ukončení změří a zaznamená také dechová frekvence;
- výsledky sledování pacienta v průběhu transfuze – podle typu podávaných přípravků a stavu pacienta (zaznamenává se celkový stav pacienta, krevní tlak, tepová frekvence a u pacientů v bezvědomí dechová frekvence);
- u ambulantně podaných transfuzí se zaznamená výsledek kontroly v odstupu dvou hodin po ukončení transfuze;
- případné komplikace a potransfuzní reakce. U pacien-tů, u nichž došlo k potransfuzní reakci, se změří a zaznamená také dechová frekvence.
Pokud u pacienta nastala reakce v souvislosti s transfuzí, lékař zajistí terapii komplikace a eviduje ji v dokumentaci. Zajistí potřebné odběry vzorků pacienta a odešle vzorky a nespotřebovaný transfuzní přípravek na KB/ZTS, které přípravek vydalo (dále viz 11. „Postup při potransfuzní reakci“).
Pracovníci, kteří podávali transfuzi, připraví záznamy a opatří je svými podpisy.
10 TECHNIKY POUŽÍVANÉ PŘI PROVEDENÍ TRANSFUZE
10. 1 Žilní přístup
K aplikaci transfuzního přípravku je zapotřebí zajištění funkčního periferního nebo centrálního žilního přístupu. Dobrá funkce žilního přístupu ovlivňuje rychlost a bezpečnost podání přípravku. Volba žilního přístupu závisí na zvolené rychlosti podávané transfuze.
10. 2 Filtry
Deleukotizační (leukoredukční) filtry se používají jak pro deleukotizaci plné krve, tak pro deleukotizaci erytrocytů, trombocytů a eventuálně i pro deleukotizaci plazmy. Preferuje se časná deleukotizace, která se provádí v ZTS v průběhu výroby. Deleukotizaci lze provádět také při transfuzi. Tento postup je však zatížený vyšším rizikem nežádoucích reakcí (anafylaktoidně-hypotenzní reakce u pacientů léčených ACE inhibitory) a rizikem nižší účinnosti.
Poznámka: Deleukotizační (leukoredukční) filtry se nemohou použít při podání granulocytů a krvetvorných buněk.
K deleukotizaci transfuzních přípravků nejsou vhodné filtry sloužící k odstranění mikroagregátů. Jejich využití se omezuje především na sběr krve z operační rány a u podávání autologní plné krve.
10. 3 Mísení léčiv s transfuzními přípravky
S transfuzními přípravky nelze při jejich podání mísit žádná léčiva ani roztoky (riziko tvorby koagul – roztoky s obsahem iontů kalcia mohou antagonizovat antikoagulaci krevních složek a vést k tvorbě koagul, riziko hemolýzy erytrocytů, obtížný odhad podané dávky léků při předčasně ukončené transfuzi a obtížné posouzení případné nežádoucí reakce).
10. 4 Ohřev krve
Použití ohřívačů se doporučuje při masivních transfuzích, při podání transfuzních přípravků rychlostí vyšší než 50 ml/minutu nebo rychlostí vyšší než 50 ml/kg/hodinu, při podávání transfuzních přípravků do velkých žil, při transfuzi přetlakem, u pacientů v hypotermii, v šokovém stavu, u pacientů s chorobou vyvolanou chladovými protilátkami, u pacientů v průběhu výměnné plazmaferézy a výměnné erytrocytaferézy, u novorozenců a kojenců při výměnné transfuzi; u dětí při transfuzi vyšší rychlostí než 15 ml/kg/hodinu.
Transfuzní přípravky se obvykle ohřívají na teplotu přibližně 37 °C.
K ohřívání transfuzních přípravků se používá výhradně certifikovaný a pravidelně validovaný zdravotnický prostředek. Ohřívací systém má být opatřen monitorováním teploty ohřívané krve. Krev se nesmí zahřát na teplotu, při níž je zvýšené riziko hemolýzy erytrocytů (teplota obvykle nepřevyšuje 42 °C). Jiný způsob ohřívání není povolen (např. ohřívání přípravků nebo rozmrazování plazmy pod tekoucí vodou) – hrozí riziko mikrobiální kontaminace přípravku a poškození přípravku.
10. 5 Dávkovače – pumpy
Transfuzní přípravky se mohou podávat také pomocí elektromechanických transfuzních „dávkovačů“. Lze použít jen certifikované a pravidelně validované zdravotnické prostředky, které nezpůsobují hemolýzu erytrocytů. Vždy je třeba ověřit u výrobce možnost bezpečného použití přístroje pro transfuze.
11 POSTUP PŘI POTRANSFUZNÍ REAKCI
V souvislosti s transfuzí mohou nastat komplikace vázané buď na podávaný transfuzní přípravek (záměna přípravku, parametry přípravku), nebo na klinický a imunitní stav pacienta.
Poskytovatel zdravotnických služeb má vypracované postupy pro případ vzniku nežádoucích reakcí a událostí v souvislosti s podáním transfuze (postup pro diagnostiku a léčbu pacienta, postup pro odběr vzorků a laboratorní vyšetření podle typu reakce a klinického stavu pacienta). Do ZTS/KB se odesílá vzorek čerstvě odebrané krve (z jiného žilního vstupu) se zbývajícím transfuzním přípravkem a transfuzní soupravou).
Poskytovatel zdravotnických služeb má vypracované postupy pro hlášení reakce nebo události a pro vyšetření její příčiny. Klinické pracoviště má povinnost nahlásit KB/ZTS všechny potransfuzní reakce a požadovat vyšetření příčiny reakce. Při vzniku potransfuzní reakce odesílá „hlášení o potransfuzní reakci“ včetně informací o průběhu reakce a podaných transfuzních přípravcích, nejlépe v časové návaznosti.
Poskytovatel zdravotnických služeb má vypracované postupy pro hlášení závažných nežádoucích reakcí a událostí vzniklých v souvislosti s provedením transfuzí. Vyhláška č. 143/2008 Sb., v platném znění (vyhláška o lidské krvi), uvádí administrativní postupy, které je třeba zajistit v souvislosti s výskytem závažné potransfuzní reakce nebo události.
Potransfuzní reakce může vzniknout akutně (v průběhu podání transfuzního přípravku až několika hodin po ukončené transfuzi), nebo opožděně (obvykle v odstupu několika dnů až týdnů, nejčastěji od 5. do 20. dne po transfuzi). Potransfuzní infekce HIV, HBV, HCV se může projevit i v delším časovém odstupu.
Při příznacích akutní potransfuzní reakce u příjemce se doporučuje:
- okamžité přerušení transfuze;
- zajištění funkčního i. v. přístupu – aplikace izotonického (0,9%) NaCl;
- kontrola vitálních funkcí pacienta (tlak krve, tepová frekvence, dechová frekvence a tělesná teplota) a vizuální kontrola moči;
- informování lékaře;
- ověření, zda byl správný transfuzní přípravek podán správnému pacientovi;
- ověření, zda eventuálně zaměněný transfuzní přípravek není aplikován jinému pacientovi;
- stanovení příčiny reakce a zajištění terapeutického postupu;
- informování KB/ ZTS.
11. 1 Nejzávažnější akutní potransfuzní reakce
11. 1. 1 Intravaskulární hemolytická reakce z imunitních příčin
- Symptomy: horečka, šok, DIC, dyspnoe, bolest na hrudi a v zádech, oligurie, hemoglobinemie, hemoglobinurie, zvýšení LDH.
- Obvyklá příčina: neslučitelnost AB0 nebo jiná protilátka, která vyvolává akutní intravaskulární hemolýzu.
- Doporučený postup: přerušení transfuze, stabilizace TK a komplexní léčba – vždy zvážit léčbu v podmínkách JIP.
- Prevence: odběr vzorků pro předtransfuzní vyšetření, kontrola dokumentace, identifikace příjemce.
11. 1. 2 Extravaskulární hemolytická reakce z imunitních příčin
- Symptomy: horečka, nepřímá hyperbilirubinemie, zvýšení LDH, urobilinogen v moči, pokles parametrů červeného krevního obrazu.
- Obvyklá příčina: nepravidelná antierytrocytová protilátka, která nevyvolává intravaskulární hemolýzu.
- Doporučený postup: sledování parametrů červeného krevního obrazu, hepatálních a renálních funkcí a koagulačního profilu; akutní terapie obvykle není nutná.
- Prevence: historie podaných transfuzí, odběry vzorků, identifikace příjemce, podání přípravků antigenně negativních, eventuálně intravenózních imunoglobulinů.
11.1. 3 Febrilní nehemolytická potransfuzní reakce
- Symptomy: horečka, třesavka.
- Obvyklá příčina: antileukocytové protilátky příjemce (zejména anti-HLA protilátky), pasivní infuze cytokinů.
- Doporučený postup: přerušení transfuze, antipyretika.
- Prevence: podání antipyretika před transfuzí, deleukotizace podávaných přípravků.
11. 1. 4 Alergická reakce
- Symptomy:
- kožní: pruritus, „raš“, urtika, angioedém;
- dechové: dušnost, zástava dechu;
- ardiovaskulární: hypotenze, bradykardie, zástava oběhu.
- Obvyklá příčina: protilátky příjemce proti plazmatickým bílkovinám nebo alergenům přítomným v transfuzním přípravku, např. anti IgA protilátka u IgA deficitních pacientů, protilátka proti haptoglobinu u haptoglobin deficitních pacientů (populace původem z Asie), protilátka proti C3/C4 nebo alfa-1-antitrypsinu.
- Doporučený postup – přerušení transfuze. U kožních projevů – antihistaminika, u těžších projevů – kortikosteroidy. Při dušnosti – beta-2 adrenergika inhalací. U anafylaktického šoku (v pořadí) – adrenalin i. m., i. v., tekutiny i. v., kyslík, antihistaminika, kortikosteroidy.
- Prevence: premedikace před transfuzí – antihistaminika, kortikosteroidy. V případě protilátek anti-IgA u IgA deficitních příjemců: promyté erytrocyty, trombocyty resuspendované v náhradních roztocích, eventuálně promyté, plazma od IgA deficitních dárců. U závažných reakcí kontrola IgA.
11. 1. 5 Hypotenze
- Symptomy: hypotenze, tachykardie.
- Obvyklá příčina: produkce bradykininu může být zesílena inhibitory ACE.
- Doporučený postup: přerušení transfuze, Trendelenburgova poloha.
- Prevence: neprovádět deleukotizaci u lůžka při transfuzi, eventuálně nepodávat inhibitory ACE.
11. 1. 6 Oběhové přetížení – TACO
(z anglického Transfusion associated circulatory overload)
- Symptomy: dyspnoe, hypertenze, plicní edém, arytmie.
- Obvyklá příčina: příliš rychlé podání transfuzního přípravku nebo podání velkého objemu transfuzních přípravků.
- Doporučený postup:kyslík, podpora diurézy, podpora kardiorespiračních funkcí.
- Prevence: nepodávat transfuzní přípravky rychle, nepodávat nadměrné objemy přípravků.
11. 1. 7 TRALI
(z anglického Transfusion related acute lung injury)
- Symptomy: dyspnoe, hypoxie, horečka, nekardiogenní plicní edém, hypotenze.
- Obvyklá příčina: protilátky (proti HLA nebo leukocytům) v transfuzním přípravku (od dárce), vzácněji protilátky příjemce proti leukocytům dárce. Asi 30 % reakcí nemá imunitní podklad.
- Doporučený postup: stabilizace TK, někdy intubace a umělá plicní ventilace.
- Prevence: deleukotizace transfuzních přípravků, příprava trombocytů do náhradních roztoků, vyšetření protilátek dárce. Plazma pro klinické použití připravená od dárců bez anamnézy těhotenství nebo transfuze. Trombocyty z aferézy od dárců s nižším rizikem výskytu protilátek proti leukocytům. Jsou-li trombocyty odebírány dárcům/dárkyním s potenciálním výskytem antileukocytových protilátek (anamnéza těhotenství nebo transfuze), je vhodné provádět výběr podle výsledku vyšetření protilátek proti leukocytům.
11. 1. 8 Septická reakce z mikrobiální kontaminace přípravku
- Symptomy: horečka, třesavka, šok (může nastat již v průběhu transfuze).
- Obvyklá příčina: kontaminovaný transfuzní přípravek.
- Doporučený postup: přerušení transfuze, stabilizace TK, antibiotika, kultivace transfuzního přípravku, eventuálně nepodaných zbývajících transfuzních přípravků z odběru od dárce, hemokultura z krve příjemce.
- Prevence: dodržení zásad správné výrobní praxe při odběru dárce, při zpracování a uchovávání krve a transfuzních přípravků. Cave: účinná dezinfekce místa venepunkce dárce! Cave: asymptomatická bakteriemie dárce!
PŘÍLOHY
Písemný souhlas pacienta s transfuzí Příloha 1
Revers – písemný nesouhlas pacienta s transfuzí Příloha 2
Aplikace transfuzních přípravků – dospělí pacienti Příloha 3
Aplikace transfuzních přípravků – novorozenci, kojenci a děti Příloha 4
AB0/RhD slučitelnost transfuzních přípravků Příloha 5
Zvláštní klinické situace Příloha 6
Právní předpisy/použitá literatura Příloha 7
PŘÍLOHA 1
Písemný souhlas pacienta/zákonného zástupce s transfuzí
Vážená paní, vážený pane,
transfuze bude součástí léčby Vašeho onemocnění (úrazu, operace). Transfuzí se rozumí podání transfuzního přípravku do žíly pomocí jednorázové transfuzní soupravy.
Transfuzní přípravky jsou vyráběny z krve dobrovolných dárců za dodržení zákonných podmínek, zejména zákona č. 378/2007 Sb., o léčivech, a vyhlášky č. 143/2008 Sb., o lidské krvi, v platném znění. Zásadou účelné hemoterapie (léčby krví) je podat pacientovi jen tu část krve, kterou nezbytně potřebuje. Podávají se proto následující transfuzní přípravky:
- červené krvinky (erytrocyty) – k léčbě chudokrevnosti (anémie) a krevních ztrát, kdy je nedostatečný přenos kyslíku do orgánů a tkání;
- krevní destičky (trombocyty) – k léčbě nebo prevenci krvácení, které je způsobeno nedostatkem vlastních destiček nebo poruchou jejich funkce;
- plazma – k léčbě poruch srážení krve;
- bílé krvinky (leukocyty) – k léčbě těžkých infekcí při nedostatku vlastních leukocytů.
Vlastní transfuze trvá, v závislosti na typu podávaného transfuzního přípravku a na zdravotním stavu příjemce, desítky minut až několik hodin.
Transfuze s sebou nese v 0–2 % případů podání riziko potransfuzní reakce nebo komplikace. Nejčastěji se vyskytují: alergická reakce (obvykle ve formě kožní vyrážky), zvýšená teplota nebo horečka, bolesti hlavy. Mezi vzácné reakce patří: rozpad červených krvinek (nejčastěji způsobený záměnou krevního vzorku nebo transfuzního přípravku), těžká alergická reakce, těžká plicní reakce s dechovými potížemi, tvorba protilátek proti krvi dárce, snížení počtu destiček po transfuzi s krvácením, šokový stav, přenos infekčních chorob (virů, bakterií, protozoí, prionů), přetížení krevního oběhu (zvláště u pacientů s nemocemi srdce nebo ledvin), reakce štěpu proti hostiteli, přetížení železem (u pacientů s četnými transfuzemi), podchlazení, ovlivnění hladiny vápníku a draslíku v krvi pacienta.
Jako alternativy k podání dárcovské krve se v některých situacích nabízejí:
- autotransfuze – transfuzní přípravek vyrobený z krve pacienta (krev se může odebírat před plánovanou operací, v úvodu do anestezie nebo sbírat z operační rány během operace) – lze uplatnit jen u některých plánovaných operací za předpokladu dobrých hodnot krevního obrazu pacienta a odpovídajícího vybavení zdravotnického zařízení;
- podávání léků nutných pro tvorbu červených krvinek (železo, kyselina listová, vitamin B12) – účinné pouze u některých chudokrevností, nástup účinku trvá týdny až měsíce;
- podávání léků (hormonálních přípravků), které povzbuzují kostní dřen ke krvetvorbě: nástup účinku trvá týdny, lze použít pouze pro některé chorobné stavy;
- podávání léků ke snížení krvácení: jejich účinek při stavění krvácení je omezený, slouží spíše jako doplněk k léčbě transfuzí.
Transfuze neléčí příčinu onemocnění, ale bez provedení transfuze by mohlo dojít k poškození zdraví či ke smrti pacienta. Pacient má právo odmítnout transfuzi a svobodně rozhodnout o dalším postupu při poskytování zdravotní péče.
PŘÍLOHA 2
Písemný nesouhlas pacienta s transfuzí
PŘÍLOHA 3
Aplikace transfuzních přípravků – dospělí příjemci
PŘÍLOHA 4
Aplikace transfuzních přípravků – novorozenci, kojenci a děti
PŘÍLOHA 5
AB0/RhD slučitelnost transfuzních přípravků
1 Erytrocyty
Při transfuzi se dává přednost podání přípravků shodných v AB0 a RhD systému.
Podání jinoskupinových přípravků je přípustné za předpokladu:
- dodržení kompatibility,
- upozornění klinického pracoviště na AB0 RhD neshodu (zvýšené riziko záměny na oddělení).
Podání jinoskupinové, kompatibilní transfuze nepřináší příjemci zvýšené riziko nežádoucích účinků.
Pro transfuzi z vitální indikace:
- není-li možnost vyšetřit krevní skupinu v AB0 a RhD, vydávají se erytrocyty 0 RhD negativní, Kell negativní (viz 6. 1 Vitální indikace).
Upozornění: Za uvedených okolností nelze vyloučit vznik akutní potransfuzní hemolytické reakce (pacient může mít protilátku proti antigenům jiných skupinových systémů, protilátka se zjistí až při standardním předtransfuzním vyšetření)!
*V život ohrožujících situacích (např. urgentní transfuze, masivní transfuze) nebo při kritickém nedostatku zásob RhD negativních transfuzních přípravků, lze podat neimunizovaným (tj. bez průkazu anti-D) RhD negativním příjemcům RhD pozitivní erytrocyty. V takovém případě by se mělo provést v odstupu 2–4 měsíců vyšetření plazmy/séra pacienta na přítomnost protilátek anti-D. Informaci o případném průkazu anti-D by měl mít pacient v dokumentované formě pro případné další transfuze.
2 Trombocyty
Trombocyty neobsahují viditelnou příměs erytrocytů. Testy slučitelnosti – kompatibility v AB0 systému se proto nevyžadují. Ve vymezených situacích (specifické protilátky u příjemce) se přípravky vybírají podle HLA nebo HPA antigenů.
AB0
Preferují se přípravky shodné v AB0, shodu ale není nezbytné dodržet. Přípravek se volí podle klinické situace, naléhavosti požadavku, HLA nebo HPA kompatibility, důvodu k podání (preventivní vs. terapeutické), pohlaví a vztahu aktuální dostupnost/naléhavost podání (vždy však nutno posoudit individuálně).
Pozn.: Vzhledem k tomu, že v některých situacích nelze podat trombocyty shodné v AB0 systému, je nutné podání „jinoskupinových“ trombocytů. Doposud neexistuje jednotný názor, zda přednostně uplatnit kompatibilitu antigenů či protilátek AB0 systému.
- Podání trombocytů neshodných v AB0 antigenech s příjemcem (s ohledem na AB0 protilátky u příjemce) má za následek zkrácení doby přežití podaných trombocytů v cirkulaci.
- Podání trombocytů resuspendovaných v plazmě, která obsahuje protilátky proti AB0 antigenům příjemce, může vést k hemolýze erytrocytů příjemce.
Vhodné je podání trombocytů krevní skupiny AB.
- Vhodnou alternativou je také podání trombocytů resuspendovaných v náhradním roztoku (snížení titru anti-A a anti-B) nebo podání trombocytů skupiny 0 s ověřeným nízkým titrem anti-A/anti-B (titr < 32).
RhD
Význam RhD při podávání trombocytových transfuzních přípravků není jednoznačně definován (stávající přípravky jsou velmi málo kontaminované erytrocyty).
Preferují se přípravky shodné v RhD, avšak RhD negativní trombocyty se mohou podat také RhD pozitivním pacientům. Je však vhodné vyhnout se riziku anti-D imunizace zejména při profylaktickém podání u dívek a žen ve fertilním věku.
RhD negativním dívkám či ženám ve fertilním věku lze do 72 hodin po transfuzi RhD pozitivních trombocytů podat imunoglobulin anti-D (125 µg pokryje na dobu 3 týdnů minimálně 10 terapeutických dávek RhD pozitivních trombocytů).
U urgentního krvácení je účinnost AB0/RhD jinoskupinových trombocytů srovnatelná (trombocyty se spotřebovávají při tvorbě primární zátky při snaze organismu zastavit krvácení, nestačí se projevit případný vliv anti-A či anti-B příjemce). V těchto případech se nehledí na RhD kompatibilitu.
3 Plazma, K-plazma, kryoprotein
Plazma, K-plazma ani kryoprotein by neměly obsahovat viditelnou příměs erytrocytů.
Testy kompatibility se nevyžadují.
AB0: dodržuje se AB0 kompatibilita.
RhD: přípravky se mohou transfundovat bez zřetele na RhD kompatibilitu.
Kryoprotein může být podán u dospělých pacientů bez ohledu na AB0 jen v případě, že byl vyroben jako směsný přípravek!
4 Granulocyty
Granulocyty jsou resuspendované v plazmě a obsahují významnou příměs erytrocytů. Při transfuzi granulocytů se dává přednost podání přípravků shodných v AB0 a RhD systému. Před podáním se vyžaduje test kompatibility.
Dále se může vyžadovat slučitelnost v HLA systému (např. provedení LCT testu) – aloimunizovaní pacienti.
PŘÍLOHA 6
Zvláštní klinické situace
1 Neonatologie, IUT, intrauterinní (intraumbilikální) transfuze erytrocytů
U novorozenců a dětí do 4 měsíců věku bez známek hemolytického onemocnění novorozence, bez pozitivity přímého antiglobulinového testu (PAT) při narození a při negativním screeningu protilátek není nutné provádět test slučitelnosti – kompatibility. Je-li však pochybnost o validitě výše uvedených údajů, je třeba provést iniciální vyšetření se vzorkem novorozence, respektive kojence. U novorozenců do jednoho měsíce po narození je vhodné odeslat k vyšetření též vzorek matky.
IUT, Intrauterinní (intraumbilikální) transfuze erytrocytů při léčbě HON – používají se erytrocyty krevní skupiny AB0 RhD kompatibilní, negativní pro antigen, proti němuž jsou protilátky v mateřském séru/plazmě (erytrocyty maximálně do 5 dnů po odběru, s hematokritem 0,70–0,85, deleukotizované a ozářené). Pokud po předchozí intrauterinní (intraumbilikální) transfuzi došlo ke změně krevní skupiny u plodu, použijí se přípravky skupinově shodné s předchozí intrauterinní (intraumbilikální) transfuzí.
2 AB0, eventuálně RhD-inkompatibilní transplantace krvetvorných buněk
Je nutno postupovat podle přítomnosti AB0 protilátek přítomných u příjemce, které mohou být podle dané kombinace buďto původního, dárcovského nebo obojího typu a s ohledem na stupeň změny skupiny:
a) „Velká neshoda“ = transplantace přináší „nové“ antigeny; erytrocytové transfuzní přípravky: skupina AB0 shodná s původní skupinou AB0 příjemce, dokud je tato krevní skupina prokazována a pokud je pozitivní PAT a/nebo trvá průkaz inkompatibilní AB0 protilátky; transfuzní přípravky s plazmou: skupina AB0 dárce od dne transplantace.
b) „Malá neshoda“ = transplantace přináší „nové“ protilátky; erytrocytové transfuzní přípravky: krevní skupina AB0 dárce s minimálním obsahem inkompatibilních protilátek, dokud jsou detekovány erytrocyty s původní skupinou; trans-fuzní přípravky s plazmou: skupina AB0 shodná s původní skupinou AB0 příjemce do vymizení erytrocytů s původní skupinou AB0.
c) „Kombinovaná neshoda“ – kombinace předchozích – erytrocytové transfuzní přípravky: skupiny 0 s minimálním obsahem inkompatibilních protilátek, dokud jsou detekovány erytrocyty s původní skupinou AB0; transfuzní přípravky s plazmou: skupiny AB do vymizení erytrocytů s původní skupinou AB0.
d) RhD pozitivní příjemce RhD negativního štěpu: podávat RhD negativní erytrocyty a trombocyty.3 AB0, eventuálně RhD nestejnoskupinová orgánová transplantace (tab. 1)
a) Situace, kdy příjemce má antigen A či B navíc proti štěpu (tj. nestejnoskupinová, kompatibilní transplantace – malá neshoda)
- v den transplantace a 48 hodin po ní se dodržuje krevní skupina příjemce;
- následující dny se vybírají přípravky kompatibilní jak s příjemcem, tak štěpem (viz tabulka).
Po nestejnoskupinové, kompatibilní transplantaci se sleduje případná tvorba AB0 imunních protilátek u příjemce (v podstatě reakce štěpu proti hostiteli). Vyšetření by se mělo provést nejméně na začátku 2. týdne a na konci 3. týdne (rozhoduje klinik podle klinického stavu). Vyšetření vždy zahrnuje PAT a stanovení volné imunní protilátky (anti-A či anti-B podle typu neshody; hledá se protilátka proti krevně skupinovému antigenu příjemce).
b) Situace, kdy příjemci chybí antigen A či B přítomný ve štěpu (tj. nestejnoskupinová, inkompatibilní transplantace – velká neshoda).
- před výkonem se u příjemce ověřuje titr protilátek proti příslušnému antigenu dárce a většinou se provádí plazmaferéza k jeho snížení (titr by měl být pod 32);
- od okamžiku výkonu se vybírají přípravky kompatibilní jak s příjemcem, tak štěpem (viz tabulka).
c) RhD neshoda
- u RhD negativních příjemců, kteří dostali RhD pozitivní orgán, se při podání erytrocytů dodržuje krevní skupina příjemce (podávají se RhD negativní erytrocytové transfuzní přípravky);
- u RhD pozitivních příjemců, kteří dostali RhD negativní orgán, se při podání erytrocytů dodržuje krevní skupina příjemce (podávají se RhD pozitivní přípravky) a pravidelně se vyšetřuje screening nepravidelných protilátek a PAT. V případě záchytu protilátek a jejich identifikaci jako anti-D (hrozí ve 2.–4. týdnu po transplantaci) se začnou podávat RhD negativní erytrocyty.
Trombocyty se vybírají jako plazma, v případě vitální indikace je ale možné podat „trombocyty v náhradním roztoku“ bez ohledu na krevní skupinu (viz Příloha 5).
Tab. 1. Výběr transfuzních přípravků při AB0 neshodné orgánové transplantaci 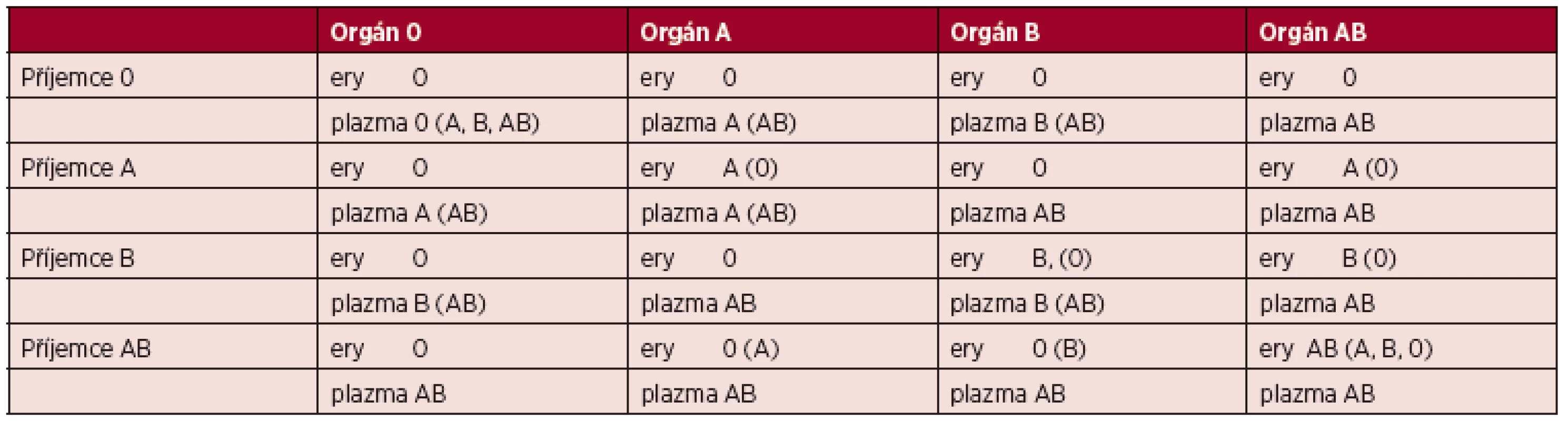
(Údaj v závorce: přípustná alternativa; ery = erytrocytový transfuzní přípravek.) PŘÍLOHA 7
Právní předpisy/použitá literatura
- zákon č. 70/2013 Sb. (kterým se mění zákon č. 378/2007 Sb., o léčivech a o změnách některých souvisejících zákonů) (zákon o léčivech).
- zákon č. 96/2004 Sb., o podmínkách získávání a uznávání způsobilosti k výkonu nelékařských zdravotnických povolání a k výkonu činností souvisejících s poskytováním zdravotní péče a změně některých souvisejících zákonů, ve znění pozdějších předpisů.
- zákon č. 258/2000 Sb., o ochraně veřejného zdraví, ve znění pozdějších předpisů.
- zákon č. 372/2011 Sb., o zdravotních službách a podmínkách jejich poskytování.
- zákon č. 373/2011 Sb., o specifických zdravotních službách.
- zákon č. 378/2007 Sb., zákon o léčivech.
- vyhláška č. 54/2008 Sb., o způsobu předepisování léčivých přípravků, údajích uváděných na lékařském předpisu a o pravidlech používání lékařských předpisů.
- vyhláška č. 55/2011 Sb., o činnostech zdravotnických pracovníků a jiných odborných pracovníků.
- vyhláška č. 84/2008 Sb., o správné lékárenské praxi, bližších podmínkách zacházení s léčivy v lékárnách, zdravotnických zařízeních a u dalších provozovatelů a zařízení vydávajících léčivé přípravky.
- vyhláška č. 143/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek (vyhláška o lidské krvi).
- vyhláška č. 195/2005 Sb., kterou se upravují podmínky předcházení vzniku a šíření infekčních onemocnění a hygienické požadavky na provoz zdravotnických zařízení a ústavů sociální péče.
- vyhláška č. 221/2010 Sb., o požadavcích na věcné a technické vybavení zdravotnických zařízení a o změně vyhlášky Ministerstva zdravotnictví č. 51/1995 Sb., kterou se mění a doplňuje vyhláška Ministerstva zdravotnictví ČR č. 49/1993 Sb., o technických a věcných požadavcích na vybavení zdravotnických zařízení, a mění vyhláška Ministerstva zdravotnictví ČR č. 434/1992 Sb., o zdravotnické záchranné službě (vyhláška o požadavcích na věcné a technické vybavení zdravotnických zařízení).
- Metodický pokyn „Standard označování transfuzních přípravků (Štítky propuštěných přípravků)“, Věstník MZČR, částka 7, 2013.
- Řeháček V, Masopust J, et al. Transfuzní lékařství. Praha: Grada, 2013.
- Harris AM, Atterbury LJ, Chaffe B et al. Guideline on the Administration of Blood Component, British Committee for Standards of Blood Components. December 2012.
- Petrides M. Practical Guide To Transfusion Medicine. 2nd edition, AABB, 2007.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2015 Číslo 4- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Metabolismus železa u dárců krve
- Racionální algoritmus zobrazovacích vyšetření u mnohočetného myelomu v podmínkách České republiky
- Udržovací léčba s rituximabem u starších pacientů s Mantle cell lymfomem v první remisi – zkušenost centra
-
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků - Základy hematologické diagnostiky
- Alternative donor hematopoietic cell transplantation for Fanconi anemia
- Energy balance and fitness in adult survivors of childhood acute lymphoblastic leukemia
- Impact of allogeneic stem cell transplantation on survival of patients less than 65 years of age with primary myelofibrosis
- Obsah ročníku 21/2015
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle-
Doporučení Společnosti pro transfuzní lékařství ČLS JEP
č. STL2015_12 ze dne 01. 09. 2015 verze 1
Doporučené postupy pro podání transfuzních přípravků - Metabolismus železa u dárců krve
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy









