-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dlouhodobé výsledky léčby chronické myelomonocytární leukemie ve vybraných hematologických centrech
Long-term treatment results of chronic myelomonocytic leukaemia in selected haematological centres
Backgrounds:
Chronic myelomonocytic leukaemia (CMML) is a relatively rare neoplastic disorder with features of both myelodysplastic and myeloproliferative diseases. The aim of this work is to provide information from an unselected group of patients treated in several haematological centres.Patients and Methods:
This retrospective analysis included the treatment results obtained in a cohort of 55 patients with CMML treated at 4 Czech haematological centres from 2000 to 2015.Results:
16 patients (29%) are still alive with median overall survival (OS) of 21 months (to the date 1st of June 2016). Patients undergoing allogeneic stem cell transplantation (alloSCT) demonstrated the best survival – 7 out of 14 allografted patients remain alive. 5-year OS in this unselected patient population was approx. 14 %. CPSS appears to be a suitable OS predictor (low risk vs. lower intermediate risk vs. higher intermediate risk, p = 0.04). In multivariate analysis combining patient age and comorbidities with CPSS, we did not see any further impact of these additional parameters on the OS. Disease progression was the most common cause of death (31%) followed by infections (24%). We evaluated the effects of BSC (best supportive care), hypomethylating agents (HMA) and alloSCT on OS. Transplanted patients appeared at least initially to benefit from this treatment (~ 2 years). It appears that treatment with 5-azacytidine (AZA) shows better results than BSC. However, these conclusions relate to a small patient cohort and also the subgroups are significantly heterogeneous with respect to other the predictors. The log-rank test did not confirm the statistical significance of different treatment approaches (p = 0.27).Conclusion:
Treatment results in CMML remain unsatisfactory. Introduction of new molecules into therapy and the shift of alloSCT to older age groups promises to improve patient survival and quality of life in the future.KEY WORDS:
chronic myelomonocytic leukaemia – overall survival – modern therapy
Autoři: P. Rohoň 1; P. Bělohlávková 2; E. Kadlčková 3; J. Vondráková 4; T. Fürst 5; J. Fürstová 5; R. Machová 1; Z. Rusiňáková 1; L. Raida 1; P. Žák 2; T. Papajík 1
Působiště autorů: Hemato-onkologická klinika, LF UP a FN Olomouc 1; IV. interní hematologická klinika, LF UK a FN Hradec Králové 2; Hematologicko-transfuzní oddělení, Krajská nemocnice T. Bati ve Zlíně, a. s. 3; Oddělení klinické hematologie, Nemocnice České Budějovice, a. s. 4; Katedra matematické analýzy a aplikací matematiky, PřF UP Olomouc 5
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 3, p. 127-133.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
Chronická myelomonocytární leukemie (CMML) je relativně vzácné nádorové onemocnění, které nese zároveň znaky myelodysplastických i myeloproliferativních chorob. Cílem práce je přinést informace z neselektovaného souboru pacientů léčených ve vybraných hematologických centrech.Pacienti a metodika:
Retrospektivní analýza obsahovala léčebné výsledky získané ze souboru 55 nemocných s diagnózou CMML ze 4 hematologických pracovišť v České republice v letech 2000–2015.Výsledky:
K datu analýzy 1. 6. 2016 žilo 16 pacientů (29 %) s mediánem celkového přežití (OS) 21 měsíců. Největší podíl dlouhodobě přeživších patří podle očekávání pacientům po alogenní transplantaci krvetvorných kmenových buněk (alloSCT) – žije 7 osob (celkově 14 transplantovaných). Pravděpodobnost 5letého OS v neselektované skupině pacientů je přibližně 14%. CPSS (CMML specifický prognostický skórovací systém) se jeví jako výhodný prediktor OS (nízké riziko vs. nižší střední riziko vs. vyšší střední riziko; p = 0,04). V multivariantní analýze při kombinaci věku nemocných nebo přidružených onemocnění jsme u CPSS nepozorovali dopad těchto parametrů na OS. Nejčastější příčinou úmrtí byla progrese onemocnění (31 %) a infekční komplikace (24 %). Ze základních léčebných modalit jsme hodnotili vliv BSC (nejlepší podpůrné léčby), hypometylačních látek (HMA) a alloSCT na OS. Transplantovaní pacienti mají z této léčby alespoň v úvodu (~ 2 roky) významný benefit. Zdá se, že léčba 5-azacytidinem (AZA) vykazuje lepší výsledky než BSC. Toto hodnocení je ale zkresleno malým počtem pacientů a navíc jsou definované skupiny výrazně heterogenní z pohledu ostatních prediktorů. Log-rank test nepotvrdil statistickou významnost jednotlivých léčebných modalit na OS (p = 0,27).Závěr:
Výsledky léčby CMML jsou neuspokojivé. Zavedení nových molekul do terapie a posun alloSCT do vyšších věkových skupin je určitým příslibem zlepšení přežití a kvality života pacientů do budoucnosti.KLÍČOVÁ SLOVA:
chronická myelomonocytární leukemie – celkové přežití – moderní léčbaÚVOD
Chronická myelomonocytární leukemie (CMML) je relativně vzácné, heterogenní nádorové onemocnění krvetvorné kmenové buňky s patofyziologickými i klinickými rysy myeloproliferativních neoplazií a myelodysplastického syndromu (MDS). CMML je charakterizována periferní monocytózou (≥ 1 x 109/l a ≥ 10 % monocytů v diferenciálním rozpočtu leukocytů), různým stupněm cytopenie spojenými s dysplazií dřeňových elementů a častou hepatosplenomegalií [1, 2]. Pravděpodobnost transformace onemocnění do akutní myeloidní leukemie (AML) se obecně pohybuje kolem 15–20 %, onemocnění postihuje především starší osoby s mediánem věku 65–75 let, častěji muže [3].
Klasifikace CMML podle FAB z roku 1994 byla založená hlavně na počtu leukocytů a rozlišovala „dysplastický“ (CMML-MD, leukocyty ≤ 13x109/l) a proliferativní podtyp (CMML-MP, leukocyty > 13 x 109/l). Toto rozdělení má v současnosti i molekulární podklad, protože MP podtyp vykazuje aberace v RAS/MAPK signální dráze [4]. Návrh revidované klasifikace WHO 2016 rozděluje CMML do 3 podskupin: CMML-0 (< 2 % blastů v periferii a < 5 % blastů v kostní dřeni), CMML-1 (2–4 % blastů v periferii a 5–9 % blastů v kostní dřeni) a konečně CMML-2 (5–19 % blastů v periferii a 10–19 % v kostní dřeni a/nebo přítomnost Auerových tyčí). Základ této klasifikace tkví v přesné morfologii blastů a promonocytů (ekvivalentů blastů) a implementaci nových poznatků z průtokové cytometrie, cytogenetiky a molekulární genetiky [5].
Etiologie CMML není zcela objasněná. Klonální změny jsou identifikovány asi u 20–40 % pacientů. V současnosti se předpokládá, že na rozvoji CMML se podílí tzv. časná klonální dominance s granulocytární a monocytární diferenciací nezralých progenitorů – klíčový podíl pro rozvoj onemocnění má zřejmě mutace TET2 genu. Terminální fenotyp je pak důsledkem kombinace poškození krvetvorné kmenové buňky (genetické a epigenetické mechanismy), změn dřeňového mikroprostředí a imunitní dysregulace [6, 7]. Význam mutací u CMML není zatím zcela jednoznačný: TET2 mutace se vyskytuje asi u 46 % pacientů a nemá pravděpodobně přímý vliv na prognózu nemoci; JAK2 mutace se vyskytuje především u CMML-MP. Mutace SRSF2 a ASXL1 zřejmě zhoršují prognózu CMML [8]. Mutační stav je i součástí některých skórovacích systémů [9]. Z klinického a biologického pohledu je nezřídka velmi obtížné přistupovat k MDS s monocytózou (často obraz CMML-MD s variabilní hladinou monocytů) s dobrou nebo částečnou odpovědí na terapii erytropoetinem (EPO) nebo hypometylačními látkami (HMA).
Léčba CMML je svízelná, její výsledky jsou i v současnosti neuspokojivé a souvisí s biologickou podstatou a výraznou heterogenitou nemoci. Zatím není jednoznačný konsenzus na indikačních kritériích pro zahájení terapie, obecně lze uvést: nárůst počtu leukocytů a blastů, prohloubení cytopenie, splenomegalii, B-příznaky, extramedulární infiltraci a často opomíjenou koagulopatii (nejčastěji fibrinolýzu). U mladších pacientů s CMML by měla být vždy, s přihlédnutím k přidruženým nemocem, zvažována alogenní transplantace krvetvorných kmenových buněk (alloSCT) jako jediná kurativní možnost léčby [10, 11]. U pacientů s CMML-0 nebo CMML-1 lze při symptomech podat hydroxyureu (MP podtyp) a u anémie EPO. V případě CMML-1 (MD podtyp) lze postupovat analogicky jako u MDS nižšího rizika (aplikace EPO, symptomatická léčba). Pro pacienty s CMML vyššího rizika (CMML-2) je v případě MD podtypu doporučeno podání HMA, u MPpodtypu lze využít hydroxyureu nebo AML-„like“ chemoterapii [11]. U vysoce rizikových pacientů lze zvážit zařazení do klinických studií. Pozitivní výsledky jsou uváděny u rigosertibu – multikinázový inhibitor, který je zacílený především na PI3K (fosfatidylinozitol-3-kinázu) a PLK (polo-like kinázu). Podává se i v kombinaci s 5-azacytidinem (AZA), se kterým vykazuje synergický účinek [12].
Naše práce sleduje dlouhodobé výsledky léčby CMML v několika hematologických centrech v ČR (fakultní pracoviště a hematologická oddělení krajských nemocnic) s cílem ukázat reálná data získaná z neselektovaných souborů pacientů.
PACIENTI A METODIKA
V našem souboru jsme provedli retrospektivní analýzu pacientů léčených v letech 2000–2015 ze 4 hematologických pracovišť v České republice (Olomouc, Hradec Králové, Zlín a České Budějovice). Do hodnocení bylo zahrnuto celkem 55 osob. V případě, že byli pacienti léčeni v rámci klinických studií, podepsali informovaný souhlas schválený příslušnou etickou komisí. Diagnóza CMML byla stanovena na základě morfologického nálezu v kostní dřeni v korelaci s opakovaně potvrzenou monocytózou (≥ 1 x 109/l a ≥ 10 % monocytů v diferenciálním rozpočtu leukocytů) podle kritérií FAB a revidovaných kritérií WHO z roku 2008 [13, 14]. Velikost sleziny byla hodnocena palpačně se stanovením přesahu pod žeberním obloukem v levé medioklavikulární čáře. Při diagnóze, před zahájením epigenetické léčby/ alloSCT nebo při progresi nemoci bylo obligatorně doplněno cytogenetické vyšetření (stanovení karyotypu G-pruhováním a interfázová FISH s provedením cíleného panelu vyšetření). U části pacientů byla provedena trepanobiopsie především s důrazem na zhodnocení stupně dřeňové fibrózy. CPSS skórovací systém (CMML – specific prognostic scoring system) sloužil pro prognostickou stratifikaci pacientů, tabulka 1 [15].
Tab. 1. CPSS skórovací systém 
Cytogenetika: nízke riziko (normální karyotyp, izolovaná delece Y) střední riziko (jiné změny) vysoké riziko (trizomie 8, komplexní karyotyp (≥ 3 změny), změny chromozomu 7) Transfuzní závislost: ≥ 1 TU erymasy v průběhu 8 týdnů v intervalu 4 měsíců Zhodnocení: 0 (nízké riziko), 1 (střední nižší riziko), 2–3 (střední vyšší riziko), 4–5 (vysoké riziko) Vysvětlivky: CPSS – CMML specifický skórovací systém, MD – myelodysplastický, MP – myeloproliferativní CPSS se jeví jako vhodný prognostický ukazatel a při porovnaní s IPSS nebo revidovaným IPSS využívaným v skórovaní MDS je pro účely CMML jednoduší a zahrnuje i transfuzní závislost. Při hodnocení léčebné odpovědi se v případě CMML-MD využila kritéria IWG pro MDS a pro CMML - -MP kritéria IWG pro primární myelofibrózu [16, 17].
Analýza celkového přežití (OS) byla provedena pomocí Kaplanovy-Meierovy metody. Působení různých faktorů (prediktorů) na OS bylo hodnoceno Coxovým modelem proporcionálních rizik.
Výsledkem Coxovy analýzy je HR (hazard ratio) neboli poměr rizik mezi základní skupinou a skupinou s danou hodnotou prediktoru. Do multivariantních analýz jsme zahrnuli ověřené skórovací systémy a jejich dopad na OS v kombinaci s často diskutovanými prediktory (např. věk nemocného, přidružené nemoci). S ohledem na významnou heterogenitu jednotlivých podskupin (např. léčebné modality) jsme vybrali výrazněji unifikované kohorty pro účely matched pairs analýzy OS. Pro všechny analýzy byla použita hladina statistické významnosti p ≤ 0,05. Statistické evaluace dat proběhla pomocí programu Statistica 9.0.
VÝSLEDKY
Charakteristika pacientů (tabulka 2)
Tab. 2. Charakteristika souboru pacientů s CMML 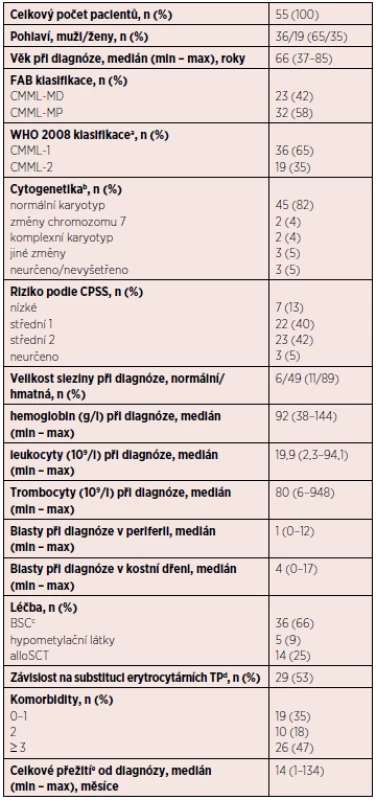
Vysvětlivky: alloSCT – alogenní transplantace krvetvorných kmenových buněk, BSC – nejlepší podpůrná léčba, CPSS – CMML specifický skórovací systém, dg. – diagnóza, EPO – erytropoetin, HU – hydroxyurea, MD – myelodysplastický, MP – myeloproliferativní, TP – transfuzní přípravek avyšší zastoupení MP podtypu u obou skupin bcytogenetické vyšetření zahrnuje G-pruhování a v indikovaných případech FISH cBSC zahrnuje podání HU (20 pacientů), etoposidu (2 pacienti), nízce dávkovaného cytosinarabinosidu (2 pacienti), EPO (3 pacienti). Izolované podání transfuzí bylo u 9 pacientů, v ostatních případech byla hemosubstituce kombinovaná s dalšími uvedenými modalitami. dtransfuzní závislost je definována jako ≥ 1 TU erymasy v průběhu 8 týdnů v intervalu 4 měsíců eu všech pacientů; k 1. 6. 2016 žilo 16 pacientů (29 %) s mediánem OS 21 měsíců V kohortě analyzovaných osob byla převaha mužů (2 : 1). Věkový medián byl 66 let. Medián celkového přežívání v souboru pacientů byl 14 měsíců od diagnózy, převládali pacienti s nižším počtem blastů v kostní dřeni i periferní krvi (CMML-1, respektive CMML-0/1 podle návrhu klasifikace WHO 2016). Ve většině případů (86 %) byl cytogeneticky potvrzený normální karyotyp.
U 2/3 pacientů byla v léčbě použita hemosubstituce, zřídkavě EPO. Pro cytoredukci se nejčastěji využívala hydroxyurea, ojediněle nízce dávkovaný cytosinarabinosid nebo etoposid – souhrnně označeno jako BSC (best supportive care). V ostatních případech byla podána terapie HMA (5 pacientů) nebo alloSCT (14 pacientů). Pro hypometylační léčbu se používal AZA v dávce 75 mg/m2 s. c. v průběhu 7 dnů (5-2-2) v opakovacím intervalu 28 dnů, v některých případech s nutností redukce dávky v dalších cyklech v důsledku neutropenie nebo trombocytopenie. Hodnocení léčebné odpovědi se realizovalo po podání 6 cyklů léčby, maximální počet léčebných cyklů byl 13. V současnosti žije pouze 1 pacient ze souboru léčených pomocí HMA. AZA byl podán jako součást přemosťující léčby (bridging) před aloSCT u 4 pacientů.
Celkové přežití pacientů
K 1. 6. 2016 žilo 16 pacientů (29 %), s mediánem OS 21 měsíců. Ve skupině osob léčených BSC (celkově 36) žilo 8 pacientů (medián OS 35 měsíců, dlouhodobě žijí pouze pacienti nízkého nebo středního nižšího rizika podle CPSS), HMA (celkově 5) žil 1 pacient a konečně po alloSCT (celkově 14) žilo 7 pacientů (medián OS 16 měsíců). Nejčastější příčinou úmrtí v celém souboru pacientů byla progrese onemocnění do akutní hemoblastózy (17 pacientů, 31 %), infekční komplikace – sepse, pneumonie (13 pacientů, 24 %), u 9 osob (16 %) nebyla příčina úmrtí přesně identifikována nebo byla jiná (embolizace do arteria pulmonalis, extramedulární relaps nemoci v orbitě). U většiny pacientů nebylo možné jednoznačně oddělit progresi CMML a infekční komplikace. Pravděpodobnost 3letého a 5letého OS v neselektovaném souboru pacientů je ~ 26 % a ~ 14 %, graf 1. V další části analýzy jsme sledovali vliv jednotlivých prediktorů na OS. Souhrn nejvýznamnějších prediktorů, které dosáhly v univariantní analýze statistické významnosti, je uveden v tabulce 3. Je zjevné, že CPSS je pravděpodobně nejlepším prediktorem OS. V multivariantní analýze jsme se zaměřili na efekt věku a komorbidit v kombinaci s CPSS. Věk jsme hodnotili jako spojitou veličinu nebo jsme provedli kategorizaci (≤ 65 let/> 65 let). Ani v jednom případě jsme neprokázali statisticky významný efekt (p = 0,4). Analogická situace se objevuje i při zohlednění komorbidit.
Graf 1. Celkové přežití pacientů s CMML 
Tab. 3. Vliv vybraných klasických prediktorů na celkové přežití pacientů s CMML 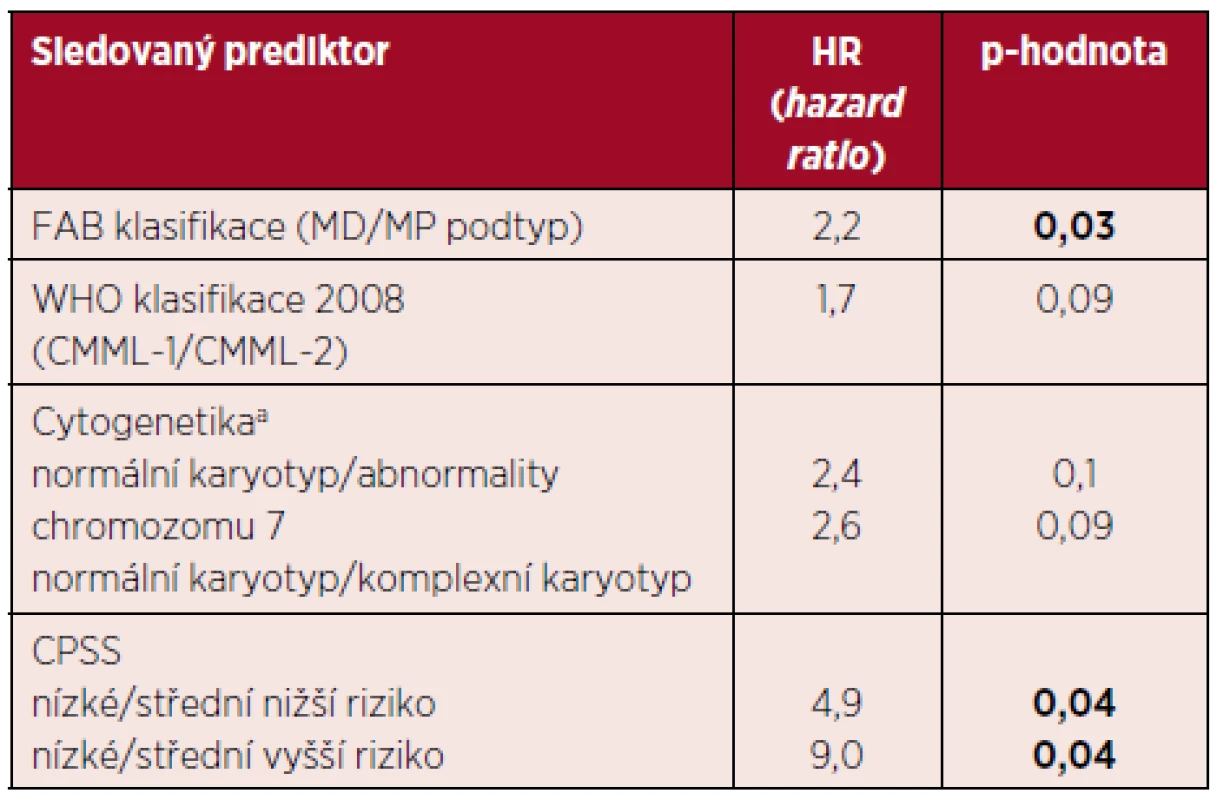
Coxův modelu proporcionálních rizik: jediným prediktorem přežití je vždy jeden konkrétní parametr. Výsledkem je HR (hazard ratio) neboli poměr rizik mezi základní skupinou (s nejnižší hodnotou prediktoru – baseline) a skupinou s danou hodnotou prediktoru. anerovnoměrná distribuce jednotlivých karyotypů, v celém souboru převažuje normální karyotyp (G-pruhování, ověřeno metodou FISH). Komplexní cytogenetické změny a monosomie/delece chromozomu 7 jsou nezávislým negativním prognostickým faktorem. Vysvětlivky: CPSS – CMML specifický skórovací systém, MD – myelodysplastický, MP – myeloproliferativní. Nakonec jsme prozkoumali vliv základních léčebných modalit na OS. Lze usuzovat, že transplantovaní pacienti z této léčby alespoň v úvodu (~ 2 roky) profitují v porovnání s jinými léčebnými postupy. Následně je dosaženo plateau s dlouhodobým přežitím pacientů. Tento efekt je ale důsledkem výběru pacientů pro alloSCT s přihlédnutím k věku a přidruženým nemocem. Taktéž se zdá, že efekt léčby AZA je lepší než BSC. Tyto jevy jsou ale zkresleny malým počtem pacientů a navíc jsou jednotlivé podskupiny výrazně heterogenní v ostatních prediktorech. Log-rank test nepotvrdil statistickou významnost tohoto efektu (p = 0,27), graf 2. Ani pomocí matched pairs analýzy při výběru více homogenních podskupin jsme neprokázali statisticky signifikantní rozdíl (p = 0,18) mezi jednotlivými léčebnými přístupy. Zjevný je ale trend ve zlepšení OS u pacientů léčených alloSCT a HMA.
Graf 2. Celkové přežití pacientů podle zvolené léčebné modality 
Vysvětlivky: alloSCT – alogenní transplantace krvetvorných kmenových buněk, BSC – nejlepší podpůrná léčba, 5-AZA – 5-azacitidin Doplňující údaje
U 6 pacientů (11 %) předcházel rozvoji CMML primární tumor (1krát karcinom ovaria, 1krát karcinom močového měchýře, 1krát adenokarcinom ledviny, 1krát karcinom štítné žlázy, 1krát karcinom prostaty a 1krát karcinom prsu). Extramedulární infiltrace byla klinicky dokumentována u 5 pacientů: ve 2 případech jako leukemická kožní infiltrace s částečnou regresí po podání HU, u 2 pacientů byla pozorována infiltrace tonzil s dobrou odpovědí na podání etoposidu a v 1 případě byla histologicky potvrzena infiltrace podčelistních uzlin bez léčebné odpovědi po podání HU. Kompletní remise nemoci byla pozorována u 8 pacientů (dominantně u pacientů po alloSCT). Ve většině případů docházelo k progresi nemoci. Téměř u poloviny všech pacientů bylo současně s CMML pozorováno 3 a více přidružených onemocnění.
DISKUSE
CMML je klonální hematologické onemocnění, které je charakterizováno periferní monocytózou s důrazem na skutečnost, že tento jev musí být trvalý s vyloučením reaktivních příčin. Onemocnění se téměř nevyskytuje u mladších pacientů a je typické u osob ve věku ~ 70 let. Patogenetické mechanismy vzniku CMML jsou již částečně identifikovány a lineární model ukazuje, že somatické mutace se částečně podílejí na variabilitě klinického fenotypu. Na druhé straně je zřejmé, že tyto mutace postihují kompartment hemopoetické kmenové buňky a jejich lineární akumulace podmiňuje klonální dominanci s granulocytární a monocytární diferenciací [18, 19]. Klinická a biologická charakteristika nemoci je variabilní a onemocnění může být diagnostikováno s velkou latencí od prvních příznaků [20]. Stratifikace nemoci je obvykle prováděna na základě cytogenetických nálezů s rozdělením do 3 kategorií, které jsou využity pro konstrukci CPSS skóre [15, 21]. V našem souboru jsme prokázali, že CPSS je pravděpodobně nejlepším prediktorem OS. Jistou limitací konvenční cytogenetiky je však skutečnost, že většina pacientů má normální karyotyp (v korelaci s daty z našeho souboru, kde změny chromozomu 7 a komplexní karyotyp podle předpokladů významně zhoršují OS pacientů), a je proto otevřenou otázkou využití molekulárních ukazatelů. Součástí nových skórovacích systémů je implementace mutací v genu ASXL1 (frameshift a nonsense) – jako nezávislého prediktoru zhoršení OS [22]. Moderní principy terapie CMML směřují k supresi/eradikaci iniciálního klonu s mutací/ mutacemi a obnovou normální krvetvorby. Toho lze dosáhnout pouze pomocí alloSCT. HMA v některých případech dokážou částečně restartovat normální krvetvorbu, zvyšují expresi tzv. immune checkpoint proteinů na povrchu buněk, ale nesnižují zastoupení mutovaných progenitorů – to naznačuje, že epigenetické změny se podílejí hlavně na terminálním fenotypu CMML. K rozvoji nemoci dále přispívá cytokinová dysregulace [23, 24]. Role mikroprostředí není zatím zcela objasněna [25]. Nové molekuly v léčbě CMML jsou odvozeny od klinických hodnocení u MDS. Základem je kombinace HMA s dalšími molekulami [26, 27]. V posledním období se objevují informace o použití guadecitabinu (dinukleotidu decitabinu a deoxyguanosinu), který je rezistentní k deaminaci. U části CMML pacientů jsou identifikovány mutace genů IDH1, IDH2 (jejich přítomnost koreluje se sérovou hladinou 2-hydroxyglutarátu) a jsou vhodným cílem IDH inhibitorů [28]. Pro pacienty nižšího rizika s dominující anémií se jeví jako výhodná aplikace modulátoru TGF-β (sotaterceptu).
ZÁVĚR
Vzhledem k tomu, že většina pacientů s CMML je v seniorském věku a má často přidružená onemocnění, vyžaduje tato skupina specifický léčebný přístup. Výsledky léčby CMML jsou i v současnosti neuspokojivé. V posledním období dochází k zpřesnění diagnostiky nemoci a k časnému odeslání pacientů do center hematologické péče, kde lze provést celé spektrum doplňujících vyšetření a rozhodnout o případné aplikaci nových molekul. I nám se podařilo potvrdit, že efekt věku a přidružených nemocí nepřevyšuje význam dopadu CPSS na celkové přežití pacientů. To je i důvod pro zařazení inovativních postupů a molekul do vyšších věkových kategorií. Dnes se uvažuje především o zařazení HMA do léčebných protokolů i v kombinaci s novými molekulami (např. rigosertib). Důvodem je skutečnost, že alloSCT jako léčebná modalita zůstává vyhrazena pro úzký okruh pacientů (v našem souboru je až 25 % podíl výrazně nadhodnocený).
Podíl autorů na přípravě rukopisu
PR, PB, EK, JV – napsání rukopisu, příprava analýz, léčba pacientů; společný podíl na přípravě rukopisu
RM, ZR, LR – léčba pacientů
TF, JF – statistické analýzy
PŽ, TP – revize rukopisu
Prohlášení autorů o konfliktu zájmů
PR, PB – Celgene, řečník, cestovní granty
RM, JV – Celgene, konzultant, cestovní granty
EK, LR, TF, PŽ, TP – autoři prohlašují, že nemají žádný relevantní konflikt zájmů
Poděkování
Poděkování patří paní K. Sičové, která se podílí na zpracování údajů z databáze pacientů s CMML, pracovníkům laboratoří cytogenetiky a morfologie.
Práce byla podpořena grantem IGA_LF_2017_007.
Doručeno do redakce dne 1. 7. 2017.
Přijato po recenzi dne 8. 8. 2017.
doc. MUDr. Peter Rohoň, Ph.D.
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: peter.rohon@fnol.cz
Zdroje
1. Itzykson R, Solary E. An evolutionary perspective on chronic myelomonocytic leukemia. Leukemia 2013;27(7):1441–1450.
2. Patnaik MM, Parikh SA, Hanson CA, et al. Chronic myelomonocytic leukaemia: a concise clinical and pathophysiological review. Br J Haemat 2014;165(3):273–286.
3. Dinmohamed AG, Brink M, Visser O, et al. Trends in incidence, primary treatment and survival in chronic myelomonocytic leukaemia: a population-based study of 1359 patients diagnosed in the Netherlands from 1989 to 2012. Br J Haemat 2015;171(3): 436–439.
4. Cervera N, Itzykson R, Coppin E, et al. Gene mutations differently impact the prognosis of the myelodysplastic and myeloproliferative classes of chronic myelomonocytic leukemia. Am J Hematol 2014;89(6):604–609.
5. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016;127(20): 2391–2405.
6. Bacher U, Haferlach T, Kern W, et al. Conventional cytogenetics of myeloproliferative diseases other than CML contribute valid information. Ann Hematol 2005;84(4):250–257.
7. I tzykson R, Kosmider O, Renneville A, et al. Clonal architecture of chronic myelomonocytic leukemias. Blood 2013;121(12):2186–2198.
8. Cui Y, Tong H, Du X, et al. Impact of TET2, SRSF2, ASXL1 and SETBP1 mutations on survival patients with chronic myelomonocytis leukemia. Experimental Hematology & Oncology. Blood 2015;4 : 14.
9. Itzykson R, Kosmider O, Renneville A, et al. Prognostic score including gene mutations in chronic myelomonocytic leukemia. J Clin Oncol 2013;31(19):2428–2436.
10. Liu HD, Ahn KW, Hu ZH, et al. Allogeneic hematopoietic cell transplantation for adult chronic myelomonocytic leukemia. Biol Blood Marrow Transplant 2017;23(5):767–775.
11. Guidelines for the diagnosis and treatment of Myelodysplastic Syndrome and Chronic Myelomonocytic Leukemia. Nordic MDS Group, 8th update, May 2017. Dostupné na www: www.nmds.org/ index.php/guidelines.
12. Garcia-Manero G, Fenaux P, Al-Kali A, et al. Rigosertib versus best supportive care for patients with high-risk myelodysplastic syndromes after failure of hypomethylating drugs (ONTIME): a randomised, controlled, phase 3 trial. Lancet Oncol 2016;17(4):496–508.
13. Swerdlow SH, Campo E, Harris NL. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues Lyon: IARC Press, 2008.
14. Bennett JM, Catovsky D, Daniel MT, et al. The chronic myeloid leukaemias: guidelines for distinguishing chronic granulocytic, atypical chronic myeloid, and chronic myelomonocytic leukaemia. Proposals by the French–American–British Cooperative Leukaemia Group. Br J Haemat 1994;87(4):746–754.
15. Such E, Germing U, Malcovati L, et al. Development and validation of a prognostic scoring system for patients with chronic myelomonocytic leukemia. Blood 2013;121(15):3005–3015.
16. Cheson BD, Greenberg PL, Bennett JM, et al. Clinical application and proposal for modification of the International Working Group (IWG) response criteria in myelodysplasia. Blood 2006;108(2):419–425.
17. Tefferi A, Barosi G, Mesa RA, et al. International Working Group (IWG) consensus criteria for treatment response in myelofibrosis with myeloid metaplasia, for the IWG for Myelofibrosis Research and Treatment (IWG-MRT). Blood 2006;108(5):1497–1503.
18. Elena C, Galli A, Such E, et al. Integrating clinical features and genetic lesions in the risk assessment of patients with chronic myelomonocytic leukemia. Blood 2016;128(10):1408–1417.
19. Itzykson R, Solary E. An evolutionary perspective on chronic myelomonocytic leukemia. Leukemia 2013;27(7):1441–1450.
20. Solary E, Itzykson R. How I treat chronic myelomocytic leukemia. Blood 2017; 130 : 126–136.
21. Such E, Cervera J, Costa D, et al. Cytogenetic risk stratification in chronic myelomonocytic leukemia. Haematologica 2011;96(3):375–383.
22. Itzykson R, Kosmider O, Renneville A, et al. Prognostic score including gene mutations in chronic myelomonocytic leukemia. J Clin Oncol 2013;31(19):2428–2436.
23. Patnaik MM, Barraco D, Lasho TL, et al. DNMT3A mutations are associated with inferior overal and leukemia-free survival in chronic myelomonocytic leukemia. Am J Hematol 2017;92(1):56–61.
24. Zhang Q, Zhao K, Shen Q, et al. TET2 is required to resolve inflammation by recruiting Hdac2 to specifically repress IL-6. Nature 2015;525(7569):389–393.
25. Zambetti NA, Ping Z, Chen S, et al. Mesenchymal inflammation drives genotoxic stress in hematopoietic stem cells and predicts disease evolution in human pre-leukemia. Cell Stem Cell 2016;19(5):613–627.
26. Yang H, Bueso-Ramos C, DiNardo C, et al. Expression of PD-L1, PD-L2, PD-1 and CTLA4 in myelodysplastic syndromes is enhanced by treatment with hypomethylating agents. Leukemia 2014;28(6):1280–1288.
27. Sekeres MA, Othus M, List AF, et al. Randomized phase II study of azacitidine alone or in combination with lenalidomide or with vorinostat in higher-risk myelodysplastic syndromes and chronic myelomonocytic leukemia: North American Intergroup Study SWOG S1117. J Clin Oncol 2017; publikováno elektronicky 9. května 2017; DOI: 10.1200/JCO.2015.66.2510.
28. Mondesir J, Willekens C, Touat M, et al. IDH1 and IDH2 mutations as novel therapeutic targets: current perspectives. J Blood Med 2016;7 : 171–180.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2017 Číslo 3- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Cytomorfologie zralých CD5- pozitivních B-lymfoidních neoplazií
- Dlouhodobé výsledky léčby chronické myelomonocytární leukemie ve vybraných hematologických centrech
- Nádor z blastických plazmocytoidních dendritických buněk: kazuistika a přehled literatury
- Získaný angioedém s deficitem C1 inhibitoru u pacientky s B-lymfomem nízké malignity a efekt léčby základního onemocnění na projevy angioedému
- Idarucizumab: skúsenosti jedného centra
- Doporučení ČHS pro diagnostiku a léčbu imunitní trombocytopenie (ITP)
- Výsledky čtenářské ankety o budoucnosti časopisu
- Prof. MUDr. Karel Indrák, DrSc., se dožívá 70 let
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Doporučení ČHS pro diagnostiku a léčbu imunitní trombocytopenie (ITP)
- Dlouhodobé výsledky léčby chronické myelomonocytární leukemie ve vybraných hematologických centrech
- Nádor z blastických plazmocytoidních dendritických buněk: kazuistika a přehled literatury
- Získaný angioedém s deficitem C1 inhibitoru u pacientky s B-lymfomem nízké malignity a efekt léčby základního onemocnění na projevy angioedému
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



