-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Epigenetické změny jako nový nástroj pro prognostickou stratifikaci pacientů s chronickou lymfocytární leukemií
Epigenetic changes as a novel tool for prognostic stratifying chronic lymphocytic leukaemia
Chronic lymphocytic leukaemia (CLL) is a clonal B lymphocyte malignancy with a highly heterogeneous course. Some patients remain asymptomatic and do not require treatment for many years, while patients with aggressive forms of the disease require therapy soon after diagnosis. Recently, evidence has been growing about the important role of methylations in natural evolution as well as in the development of various diseases including cancer. Whole genome sequencing has revealed that in CLL, similarly to other malignancies, aberrant methylations arise in the early phases of the disease. CLL patients have diverse methylation profiles and the methylation status of certain loci correlates with disease aggressiveness. In this brief report, we focus on methylation changes and their role in CLL prognosis.
Key words:
chronic lymphocytic leukaemia – CLL – epigenetics – methylations – prognosis – differentiation
Autoři: L. Poppová; K. Plevová; Š. Pospíšilová
Působiště autorů: CEITEC – Středoevropský technologický institut, Masarykova univerzita, Brno
Vyšlo v časopise: Transfuze Hematol. dnes,23, 2017, No. 4, p. 210-214.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Chronická lymfocytární leukemie (CLL) je klonální B lymfocytární malignita s velmi heterogenním průběhem. Někteří pacienti zůstávají asymptomatičtí řadu let a nevyžadují léčbu, oproti nim pacienti s agresivní formou nemoci podstupují léčbu brzy po diagnóze. V posledních letech je přikládán stále větší význam roli metylací nejen pro přirozený vývoj, ale také při vzniku a vývoji různých onemocnění včetně nádorových. Z výsledků celogenomových metylačních studií vyplývá, že u CLL, podobně jako u jiných malignit, vznikají aberantní změny v metylačním profilu v raných fázích nemoci. Metylační profily CLL pacientů se mezi sebou liší a metylační status některých míst je spojen s agresivnějším průběhem nemoci. V tomto přehledu se zaměřujeme na metylační změny a jejich roli v prognóze CLL.
Klíčová slova:
chronická lymfocytární leukemie – CLL – epigenetika – metylace – prognóza – diferenciaceÚVOD
Chronická lymfocytární leukemie (CLL) je nejčastější leukemií dospělých v Evropě a Severní Americe. Jedná se o klonální nádorové onemocnění, při kterém dochází ke kumulaci malých zrale vypadajících B lymfocytů s fenotypem CD5+ CD19+ [1, 2]. Pacienti jsou často diagnostikovaní náhodně v asymptomatické fázi nemoci. CLL má však velmi heterogenní průběh od indolentní formy, která dlouhodobě nevyžaduje léčbu, po agresivní formu s nutností časné léčebné intervence. Z toho důvodu je žádoucí stanovení rizika progrese nemoci, aby bylo možné rozpoznat, u kterých pacientů je riziko nepříznivého průběhu nejvyšší. K tomuto účelu u CLL slouží řada prognostických faktorů. Mezi nejvýznamnější a široce přijímané patří mutační status genu kódujícího variabilní oblast těžkého řetězce imunoglobulinu (IGHV) [3, 4] a chromozomové aberace [5], z nichž největší význam má delece 17p zahrnující nádorový supresorový gen TP53 [6]. Recentní práce však poukazují také na velký potenciál zhodnocení epigenetického stavu maligních buněk pro stanovení prognózy CLL.
EPIGENETIKA A METYLACE DNA
Epigenetika se zabývá studiem změn v genové expresi, při nichž nedochází ke změnám v sekvenci DNA. Nejčastějšími epigenetickými modifikacemi DNA jsou metylace, které se vyskytují především na cytosinu v dinukleotidech s guaninem (cytosin-fosfát-guanin; CpG) [7]. Většina CpG dinukleotidů je soustředěna v CpG ostrůvcích, které jsou často hypometylované a najdeme je hlavně v promotorech genů [8, 9]. Naopak CpG dinukleotidy nacházející se mimo CpG ostrůvky jsou velmi často metylovány a vyskytují se v promotorech tkáňově specifických genů a v repetitivních oblastech, kde je jejich funkcí umlčet repetitivní oblasti a zachovat integritu genomu.
Metylace umožňují tkáňově specifickou expresi, a tím i diferenciaci a morfogenezi buněk. Také při diferenciaci multipotentní hematopoetické kmenové buňky do B lymfocytu je na základě signálů z okolního prostředí měněn metylační profil buňky a s ním i genová exprese, což umožňuje vývoj B lymfocytu (obr. 1). Metylační profil je dědičný a díky DNA metyltransferázám je zachováván při dělení buňky i mezigeneračně [10]. Během diferenciace a stárnutí narůstá metylace některých CpG ostrůvků, zatímco celková hladina metylace klesá [11]. Podobný, ale výraznější efekt, byl pozorován u nádorových buněk, kde dochází k masivní globální hypometylaci spojené s nestabilitou genomu a zároveň k metylaci promotorů tumor-supresorových genů.
Obr. 1. Stadia buněčné diferenciace B-lymfocytu 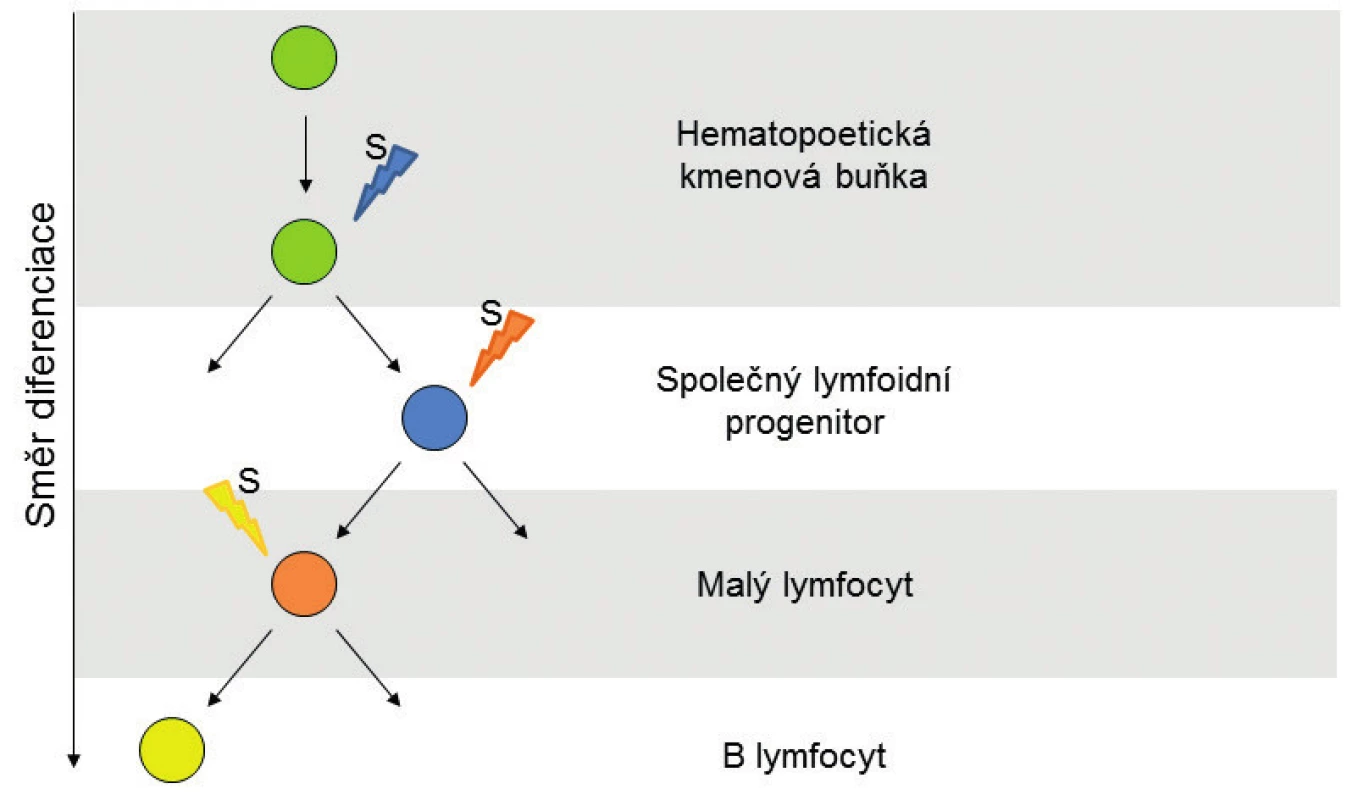
METYLACE DNA U CLL
U nádorů je metylační profil spojovaný nejen s deregulací genové exprese, ale také s buněčným původem a stadiem vývoje, což je u CLL velmi diskutované téma. Metylace výrazně ovlivňují normální vývoj B lymfocytů i jejich funkci [12]. Během zrání B lymfocytu dochází k výrazné celkové demetylaci a naopak k lokálním hypermetylacím. Některé z těchto procesů jsou přímo ovlivněny podněty z okolního prostředí, např. při aktivaci proliferace dochází k demetylaci některých promotorových oblastí a zesilovačů transkripce.
Skupina Martin-Subera identifikovala pomocí metod celogenomového bisulfitového sekvenování a vysokohustotních čipů 1649 CpG míst, jejichž míra metylace souvisí s buněčným původem CLL [13]. CLL buňky se nejvíce podobají dvěma stadiím vývoje lymfocytu: naivním buňkám, které se nepotkaly s antigenem a nedošlo u nich k hypermutacím imunoglobulinů, a paměťovým buňkám, které již prošly germinálním centrem a procesem hypermutace imunoglobulinů a přesmyku tříd. Z těchto 1 649 míst bylo vybráno pět CpG míst, která se nachází v genech B3GNTL1, CTBP2, TNF, v promotoru genu SCARF1 a v intergenové oblasti chromozomu 14. Pomocí těchto pěti CpG míst je možné rozdělit CLL pacienty do tří prognostických skupin [14].
První skupina pacientů „n-CLL“ (naive B-cell-like CLL) má leukemické buňky podobné naivním B lymfocytům, převažuje u ní vysoká míra metylace a prognóza pacientů z této skupiny je nejhorší vzhledem ke krátkému času do první terapie (TTFT) i kratšímu celkovému přežití (OS). Druhá skupina „m-CLL“ (memory B-cell-like CLL) vykazuje podobnosti k paměťovým B lymfocytům s nízkou mírou metylace a nejlepší prognózou. Kromě těchto dvou skupin byla identifikována ještě třetí skupina „i-CLL“ (intermediate CLL) vykazující střední hodnoty metylace i střední prognózu. Tyto tři prognostické skupiny se částečně překrývají s rozdělením podle procenta IGHV identity k nejbližší zárodečné sekvenci, avšak korelují lépe s TTFT než při rozdělení pacientů podle IGHV [14].
Bylo zjištěno, že skupiny pacientů definované na základě metylačních profilů mají také odlišné biologické charakteristiky. V souladu s nerovnoměrným zastoupením IGHV subgenů mezi pacienty s mutovaným a nemutovaným IGHV se liší jejich využití v jednotlivých skupinách podle metylačního profilu: u n-CLL je nejvýraznější IGHV1-69 (27 %) [4, 14]; u m-CLL IGHV4-34 (29 %); a u i-CLL skupiny IGHV3-23 (17 %) a IGHV1-18 (13 %) [1, 15]. O výskytu stereotypních subsetů ve skupinách definovaných na základě metylačních profilů dosud referuje pouze sdělení prezentované na konferenci Evropské hematologické asociace, které mimo jiné ukazuje, že stereotypní subset #2 s přestavbou IGHV3-21 tvoří jasně definovanou jednotku v rámci i-CLL [16]. Z hlediska chromozomových aberací a genových mutací u n-CLL převažují delece 11q, trizomie chromozomu 12 a mutace v genu NOTCH1, i-CLL má významné zastoupení delece 13q a zejména mutací v genu SF3B1 a u m-CLL je nejvýznamnější zastoupení delece 13q. Přes nesporný význam delecí 17p a mutací v genu TP53 dosud publikovaná data neukazují jejich asociaci s metylačními skupinami, což je dáno nízkou čestností defektů TP53 v testovaných kohortách [13, 14], a proto bude nutné tuto souvislost objasnit v budoucích studiích. Na obrázku 2 je schematicky znázorněn vztah jednotlivých skupin k přirozeným vývojovým stadiím B lymfocytu, úrovni celkové metylace, procentu IGHV identity a dalším faktorům.
Obr. 2. Schematické znázornění prognostických kategorií CLL definovaných na základě metylačního profilu a jejich vztahu k přirozeným vývojovým stadiím B lymfocytu, úrovni celkové metylace a klinickým faktorům 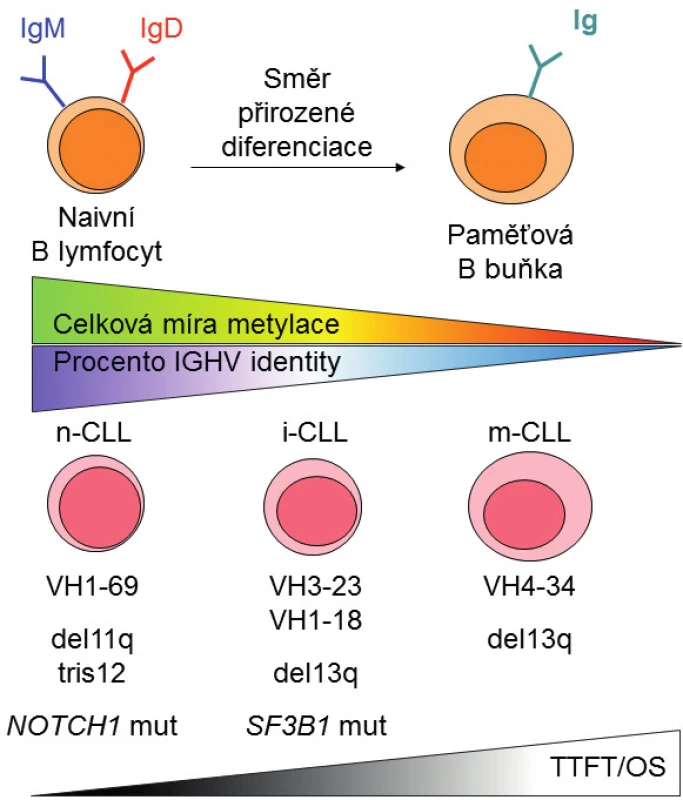
Existence tří metylačně odlišných prognostických skupin u CLL asociovaných k vývojovým stadiím zrání B lymfocytu byla nezávisle pozorována také dalšími autory [12], kteří analyzovali metylace spojené s procesem zrání B lymfocytu v místech vazby transkripčních faktorů. V průběhu zrání B lymfocytu dochází zejména k hypometylaci vazebných motivů a pouze lokální hypermetylaci CpG v transkripčně elongačních místech. Metylace vazebných míst pro transkripční faktory AP-1, EBF1 a RUNX3 spolu s profily hypermetylovaných CpG v transkripčně elongačních místech umožnily stratifikaci pacientů do tří prognostických skupin odpovídajících n-CLL, i-CLL a m-CLL [12, 14].
Mezi geny, které se významně liší v metylaci a zároveň v genové expresi u pacientů s mutovaným a nemutovaným IGHV, patří k nejvýznamnějším ZAP-70, PAX9 a CRY1 [13, 17, 18]. U těchto genů byla také potvrzena negativní korelace mezi hladinou metylace a genovou expresí.
Přibližně polovina míst aberantně metylovaných u CLL leží v nekódujících oblastech [19]. Subhash et al. detekovali dvě dlouhé nekódující RNA (lncRNA) s odlišně metylovanými promotory ve srovnání s kontrolními vzorky. Exprese těchto dvou lncRNA korelovala s expresí genů GDF7 a IRX5 zapojených do procesů podporujících nádorové bujení. Podobně jako u jiných malignit autoři zjistili výraznou hypometylaci v oblasti repetitivních elementů, která vede k nestabilitě genomu a umožňuje kumulaci genových mutací [11, 19].
Z hlediska stanovení prognózy CLL pacientů je důležité, že se metylační stav CLL při raných fázích nemoci a během jejího dalšího vývoje téměř nemění [12, 14, 20, 21]. Je také celkově stabilní i při srovnání hladin metylací u CLL pacientů před terapií a po ní [14]. Díky své stabilitě v čase a signifikanci, s jakou odlišuje pacienty s indolentní a agresivní formou nemoci, se stává dalším nástrojem umožňujícím stratifikaci CLL pacientů.
ZÁVĚR
Metylace DNA jsou epigenetickou modifikací, která významně ovlivňuje přirozený proces zrání B lymfocytu [12]. Při vývoji z naivního B lymfocytu k paměťové buňce dochází k celkové demetylaci. Při měření metylačního profilu CLL buněk se zjistilo, že metylační status CLL se konzervuje při raných fázích nemoci a během dalšího vývoje CLL se již téměř nemění. Byly publikovány různé studie, které se zaměřují na prognostický význam metylačních změn u CLL pacientů. Na základě postupu založeného na zhodnocení metylačního profilu výše uvedených pěti CpG míst lze CLL pacienty rozdělit do tří skupin s různou prognózou [14]. Dvě z těchto tří skupin vykazují významnou metylační podobnost s přirozenými vývojovými stadii B lymfocytu. Toto rozdělení není ovlivněno terapií a zároveň lépe koreluje s časem do první terapie než mutační status IGHV. Z hlediska klinické aplikace se tento postup do budoucna jeví jako využitelný při určování prognózy pacientů s CLL.
Seznam zkratek
- CLL – chronická lymfocytární leukemie
- CpG – cytosin-fosfát-guanin
- i-CLL – intermediateCLL
- IGHV – variabilní oblast těžkého řetězce imunoglobulinu
- lncRNA – dlouhé nekódující RNA
- m-CLL – memory B-cell-likeCLL
- n-CLL – naive B-cell-likeCLL
- OS – celkové přežití
- TTFT – čas do první terapie
Podíl autorů na přípravě rukopisu
LP – hlavní autor práce
KP – spoluautor práce
ŠP – korespondující autor, spoluautor práce
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů, a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Tato práce vznikla v rámci projektu CEITEC 2020 (LQ1601) za finančního přispění Ministerstva školství, mládeže a tělovýchovy české republiky v rámci účelové podpory z prostředků Národního programu udržitelnosti II.
Doručeno do redakce dne 8. 9. 2017.
Přijato po recenzi dne 25. 9. 2017.
prof. RNDr. Šárka Pospíšilová, Ph.D.
CEITEC – Středoevropský technologický institut
Kamenice 753/5
625 00 Brno
e-mail: pospisilova.sarka@fnbrno.cz
Zdroje
1. Dameshek W. Chronic lymphocytic leukemia – an accumulative disease of immunologically incompetent lymphocytes. Blood 1967;29(4): 566–584.
2. Caligaris-Cappio F, Ghia P. The normal counterpart to the chronic lymphocytic leukemia B cell. Best Pract Res Clin Haematol 2007;20(3): 385–397.
3. Damle BRN, Wasil T, Fais F, et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999;94(6): 1840–1847.
4. Hamblin BTJ, Davis Z, Gardiner A, Oscier DG, Stevenson FK. Unmutated Ig VH genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999;94(6): 1848–1854.
5. Doehner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000;343(26): 1910–1916.
6. Delgado J, Doubek M, Baumann T, et al. Chronic lymphocytic leukemia: A prognostic model comprising only two biomarkers (IGHV mutational status and FISH cytogenetics) separates patients with different outcome and simplifies the CLL-IPI. Am J Hematol; publikováno elektronicky 13. února 2017. DOI: 10.1002/ajh.24660.
7. Bird AP. CpG-rich islands and the function of DNA methylation. Nature 1986;321(6067): 209–213.
8. Saxonov S, Berg P, Brutlag DL. A genome-wide analysis of CpG dinucleotides in the human genome distinguishes two distinct classes of promoters. Proc Natl Acad Sci U. S. A. 2006;103(5): 1412–1417.
9. Illingworth RS, Bird AP. CpG islands – “A rough guide.” FEBS Lett 2009;583(11): 1713–1720.
10. Goll MG, Bestor TH. Eukaryotic cytosine methyltransferases. Ann Rev Biochem 2005;74(1): 481–514.
11. Liu L, Wylie RC, Andrews LG, Tollefsbol TO. Aging, cancer and nutrition: the DNA methylation connection. Mech Ageing Dev 2003;124(10–12): 989–998.
12. Oakes CC, Seifert M, Assenov Y, et al. DNA methylation dynamics during B cell maturation underlie a continuum of disease phenotypes in chronic lymphocytic leukemia. Nat Genet 2016;48(3): 253–264.
13. Kulis M, Heath S, Bibikova M, et al. Epigenomic analysis detects widespread gene-body DNA hypomethylation in chronic lymphocytic leukemia. Nat Genet 2012;44(11): 1236–1242.
14. Queirós AC, Villamor N, Clot G, et al. A B-cell epigenetic signature defines three biological subgroups of chronic lymphocytic leukemia with clinical impact. Leukemia 2015;29(29): 598–605.
15. Tobin G, Thunberg U, Karlsson K, et al. Subsets with restricted immunoglobulin gene rearrangement features indicate a role for antigen selection in the development of chronic lymphocytic leukemia. Blood 2004;104(9): 2879–2885; 2017;104(9): 2879–2886.
16. Bhoi S, Mansouri L, Castellano G, et al. DNA methylation profiling in chronic lymphocytic leukemia patients carrying stereotyped B-cell receptors: a different cellular origin for subset. Haematologica 2017;102(S2): 68(Abstract P244).
17. Corcoran M, Parker A, Orchard J, et al. ZAP-70 methylation status is associated with ZAP-70 expression status in chronic lymphocytic leukemia. Haematologica 2005;90 : 1078–1088.
18. Rani L, Mathur N, Gupta R, et al. Genome-wide DNA methylation profiling integrated with gene expression profiling identifies PAX9 as a novel prognostic marker in chronic lymphocytic leukemia. Clin Epigenetics 2017;9(1): 57.
19. Subhash S, Andersson P-O, Kosalai ST, et al. Global DNA methylation profiling reveals new insights into epigenetically deregulated protein coding and long noncoding RNAs in CLL. Clin Epigenetics 2016;8(1): 106.
20. Cortese D, Sutton L, Cahill N, et al. On the way towards a “CLL prognostic index”: focus on TP53, BIRC3, SF3B1, NOTCH1 and MYD88 in a population-based cohort. Leukemia 2014;28(3): 710–713.
21. Cahill N, Bergh A-C, Kanduri M, et al. 450K-array analysis of chronic lymphocytic leukemia cells reveals global DNA methylation to be relatively stable over time and similar in resting and proliferative compartments. Leukemia 2013;27(1): 150–158.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2017 Číslo 4- Nejasný stín na plicích – kazuistika
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Možnost ukončení terapie tyrozin-kinázovými inhibitory u nemocných s chronickou myeloidní leukemií a koncept „treatment-free remission“
- První perorální inhibitor proteazomu v léčbě relabujícího/refrakterního mnohočetného myelomu
- Epigenetické změny jako nový nástroj pro prognostickou stratifikaci pacientů s chronickou lymfocytární leukemií
- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- 25 let Českého národního registru dárců dřeně (ČNRDD) a Nadace pro transplantace kostní dřeně
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- Obsah ročníku 23/2017
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Angioimunoblastický T-lymfom: přehled problematiky, zkušenosti centra a kazuistika sekvenčního vzniku difuzního velkobuněčného B-lymfomu
- Sekvenování nové generace u akutní myeloidní leukemie: nový pohled na patogenezi a vývoj leukemických klonů
- Doc. MUDr. Radana Neuwirtová, CSc., se dožívá 90 let
- Prof. MUDr. Otto Hrodek, DrSc. – 95 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



