-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
Recommendations for chronic lymphocytic leukaemia diagnosis and therapy 2021
Chronic lymphocytic leukaemia (CLL) is a disease with a remarkably heterogeneous clinical course. The diagnostic procedures and therapeutic interventions need to be individually tailored according to patient age, comorbidities and therapeutic aims. We have seen crucial developments in prognostication and therapy in the recent years. The introduction of oral signalling pathway targeted inhibitors (ibrutinib, idelalisib and venetoclax) has resulted in revolutionary improvement of CLL patients’ fate. Results of novel clinical trials with direct impact on clinical practice are accumulating with hitherto unprecedented speed. Therefore, the Czech CLL Study Group, the working group of the Czech Haematological Society, has developed these updated guidelines to facilitate the decision-making process for diagnosis and treatment in routine practice. The guidelines are based on a comprehensive analysis of current literature and follow the principles of evidence-based medicine.
Keywords:
chronic lymphocytic leukaemia – diagnostics – prognostication – complications – treatment
Autori: L. Smolej 1; M. Špaček 2; Š. Pospíšilová 3; M. Jarošová 3; T. Papajík 4; R. Urbanová 4; M. Šimkovič 1; D. Lysák 5; M. Brejcha 6; M. Doubek 3
Pôsobisko autorov: IV. interní hematologická klinika LF UK a FN Hradec Králové 1; I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze 2; Interní hematologická a onkologická klinika LF MU a FN Brno 3; Hemato-onkologická klinika LF UP a FN Olomouc 4; Hematologicko-onkologické oddělení, FN Plzeň 5; Hematologické oddělení, Onkologické centrum Nový Jičín 6
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 1, p. 91-106.
Kategória: Doporučené postupy
doi: https://doi.org/10.48095/cctahd202191Súhrn
Chronická lymfocytární leukemie (CLL) je onemocnění s mimořádně různorodým klinickým průběhem. Diagnostiku a léčbu je nutno individualizovat s přihlédnutím k věku, celkovému stavu, přidruženým chorobám a cílům léčby. V posledních letech přibyly zásadní poznatky týkající se posouzení prognózy i léčby. Zavedení cílených perorálních inhibitorů signálních drah (ibrutinib, idelalisib a venetoklax) představuje revoluční zlepšení osudu nemocných s CLL; výsledky nových klinických hodnocení s dopadem na běžnou klinickou praxi přibývají dosud netušenou měrou. Proto sekce České hematologické společnosti ČLS JEP, Česká skupina pro CLL, vytvořila tato opětovně aktualizovaná doporučení k usnadnění rozhodování o diagnostických a léčebných postupech v rutinní praxi. Doporučení se zakládají na důkladné analýze současné literatury a vycházejí z principů medicíny založené na důkazech.
Klíčová slova:
chronická lymfocytární leukemie – diagnostika – prognóza – komplikace – léčba
1. STANOVENÍ DIAGNÓZY CLL
Diagnóza CLL je stanovena dle doporučení International Workshop on CLL (IWCLL) na základě vyšetření krevního obrazu s mikroskopickým rozpočtem a průtokové cytometrie periferní krve [1,2]. Diagnostika vyžaduje přítomnost minimálně 5×109/l B lymfocytů v periferní krvi s průkazem charakteristického imunofenotypu a klonality průtokovou cytometrií. V krevním nátěru jsou nacházeny převážně malé zralé lymfocyty s úzkým lemem cytoplazmy a kondenzovaným jádrem bez jadérka; může se vyskytovat příměs větších, atypických lymfocytů s naštípnutým jádrem nebo prolymfocytů, které mohou tvořit až 55 % všech leukemických buněk (tab. 1) [1,2]. Nález prolymfocytů nad 55 % vede společně s nálezem v průtokové cytometrii k diagnóze B-prolymfocytární leukemie (B-PLL) [1,2].
Tab. 1. Diagnostická kritéria CLL dle International Workshop on CLL (IWCLL) [1]. ![Diagnostická kritéria CLL
dle International Workshop on
CLL (IWCLL) [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/0c2a7ca5147b38fd8d1e45c9d67545b5.png)
CLL – chronická lymfocytární leukemie Buňky CLL mají charakteristický imunofenotyp definovaný koexpresí znaků CD5, CD19 a CD23. K cytometrické diagnóze CLL a diferenciální diagnostice je možno využít skórovací systém Royal Marsden založený na expresi pěti povrchových znaků nádorových lymfocytů (tab. 2) [2,3]. Většina případů CLL má vysoké skóre (4–5 bodů), ostatní B-lymfoproliferace mají skóre nízké (0–2 body). Diferenciálně diagnosticky je potřeba od CLL odlišit zejména leukemizovaný lymfom z plášťových buněk a B-prolymfocytární leukemii. K odlišení CLL od ostatních lymfoidních malignit může dobře posloužit znak CD200, který je u CLL silně exprimován, znak CD20, který je exprimován slabě, a dále znaky CD43, CD79b, CD81, CD10 a ROR1 [2–4].
Tab. 2. Royal Marsden (Matutes) skóre pro stanovení diagnózy CLL průtokovou cytometrií [3]. Většina případů CLL má vysoké skóre (4–5 bodů), ostatní B-lymfoproliferace mají typicky skóre nízké (0–2 body). ![Royal Marsden (Matutes)
skóre pro stanovení diagnózy
CLL průtokovou cytometrií
[3]. Většina případů CLL má
vysoké skóre (4–5 bodů), ostatní
B-lymfoproliferace mají typicky
skóre nízké (0–2 body).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/29c4c1f2962128bf2c2bc2586b75e3a9.png)
CLL – chronická lymfocytární leukemie Lymfom z malých lymfocytů (small lymphocytic lymphoma – SLL) má identický imunofenotyp jako CLL; nejzásadnějším rozdílem vůči CLL je nesplnění kritéria periferní lymfocytózy. Aktuální klasifikace Světové zdravotnické organizace uvádí CLL a SLL jako společnou jednotku CLL/SLL. Diagnóza SLL by v případě nepřítomnosti klonu v periferní krvi či kostní dřeni měla být potvrzena histologickým vyšetřením mízní uzliny, pokud je to možné [1,2]. Pokud je v rámci SLL přítomna cytopenie způsobená infiltrací kostní dřeně, mělo by onemocnění být podle nových doporučení IWCLL 2018 považováno za CLL bez ohledu na počet lymfocytů v periferní krvi [1–4].
Nález klonální B lymfocytózy < 5×109/l s imunofenotypem typickým pro CLL, ale bez současné lymfadenomegalie a organomegalie, cytopenie nebo B-příznaků definuje monoklonální B lymfocytózu (MBL), která je prekancerózou CLL. V 1–2 % případů ročně může MBL progredovat do CLL, která vyžaduje léčbu. Jde o případy MBL s vysokými počty lymfocytů (nad 500 lymfocytů/μl; tzv. high-count MBL) [5].
2. DOPORUČENÁ ZÁKLADNÍ VYŠETŘENÍ U NEMOCNÝCH S NOVĚ DIAGNOSTIKOVANOU CLL
Při diagnóze onemocnění se na základě fyzikálního vyšetření a vyšetření krevního obrazu stanovuje klinické stadium dle Raie nebo Bineta (tab. 3) [6,7]. Minimální sadu vyšetření doporučených v době diagnózy CLL shrnuje tab. 4 [8].
Tab. 3. Klinická stádia dle Raie et al. [6] a Bineta et al. [7]. ![Klinická stádia dle
Raie et al. [6] a Bineta et al. [7].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/ac01ef05c9b192c4c80cd5edfb735ec9.png)
* Skupiny uzlin: krční, podpažní, tříselné, slezina a játra. Oboustranné postižení je počítáno za jednu oblast. Tab. 4. Minimální doporučený rozsah vyšetření u nemocných s nově zjištěnou CLL [1,8]. ![Minimální doporučený
rozsah vyšetření u nemocných
s nově zjištěnou CLL [1,8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/b2de3b97556bbaf998cc6d728a453fd5.png)
CLL – chronická lymfocytární leukemie, LDH – laktátdehydrogenáza, B2M – beta 2-mikroglobulin 3. PROGNOSTICKÁ VYŠETŘENÍ U CLL
Vzhledem k mimořádné klinické variabilitě nemocných s CLL, a to i v rámci jednoho klinického stadia, je u nemocných, kteří jsou kandidáty intenzivní/cílené léčby, doporučeno zvážit vyšetření umožňující individuální prognózu zpřesnit. Mezi ně patří zejména: vyšetření genetických aberací fluorescenční in situ hybridizací (FISH – delece 13q, 11q, 17p, trisomie 12) [8,9], stanovení mutačního stavu genů pro variabilní část těžkého řetězce imunoglobulinu (IGHV) [10] a vyšetření mutací genu TP53 [8,11]. Tyto prognostické faktory mají zásadní vliv na délku období bez léčby, období do progrese a celkové přežití. V současné době je proto u nemocných léčených protokoly ovlivňujícími přirozený průběh CLL (kombinované fludarabinové či bendamustinové režimy, obinutuzumab-chlorambucil, inhibitory signálních drah B-buněčného receptoru [BCR], alemtuzumab či alogenní transplantace) doporučeno provést vyšetření chromozomálních abnormalit pomocí FISH, zejména deleci 17p a analýzu mutací TP53 před zahájením 1. linie léčby a také před každou novou linií léčby [12–14]. Význam nově objevených mutací genů BIRC3, NOTCH1, MYD88, SF3B1 a dalších je v současné době intenzivně zkoumán; vyšetření těchto mutací není v současné době vyžadováno pro běžnou praxi [15,16]. Stejně tak je diskutována role minoritních klonů s mutacemi TP53, které jsou zjistitelné metodou sekvenování nové generace (next generation sequencing – NGS) pro prognózu onemocnění [17]. NGS bude v budoucnosti pravděpodobně novým standardem pro vyšetřování mutací TP53 a dalších, nicméně v současnosti stále platí za standard klasické Sangerovo sekvenování. V posledních letech byla publikována data poukazující na negativní prognostický a prediktivní význam komplexního karyotypu (definovaného jako 3 a více chromozomových změn) [18–21]. I když zatím nemáme in extenso publikovaná prospektivní data, je vhodné u nemocných s CLL provádět kromě FISH rovněž vyšetření karyotypu periferní krve po stimulaci mitogeny (např. CpG oligonukleotidy a interleukinem-2) a výsledky vyhodnotit podle doporučení a platné cytogenetické nomenklatury [19,20]. Význam prognostických (ovlivňují celkové přežití) a prediktivních (predikují výsledky terapie) genetických faktorů u pacientů s CLL shrnuje tab. 5. Za účelem definování nejvýznamnějších faktorů bylo pro CLL pacienty vytvořeno několik prognostických skórovacích systémů. Mezinárodní tým vedený prof. Hallekem publikoval metaanalýzu zahrnující data z 8 randomizovaných klinických studií, která identifikovala 5 nezávislých prognostických faktorů: delece a/nebo mutace TP53 genu, přítomnost somatických hypermutací IGHV, hladina sérového b2-mikroglobulinu, klinické stadium a věk [22]. Tento Mezinárodní prognostický index (International Prognostic Index – IPI) tak zahrnuje klinické, biochemické i genetické faktory (tab. 6). Pro nemocné diagnostikované v časném stadiu Binet A lze využít k odhadu výše rizika progrese k léčbě prognostický index IPS-E [23], který využívá jako prognostické faktory mutační stav IGHV, přítomnost hmatných uzlin a absolutní počet lymfocytů > 15×109/l, či upravenou verzi AIPS-E (Adjusted IPS-E) využívající kombinaci mutačního stavu IHGV, přítomnosti delece 11q / delece 17p při vyšetření FISH a absolutní počet lymfocytů > 15×109/l [24]. Prognostický index pro nemocné v časném stadiu je uveden v tab. 7.
Tab. 5. Význam prognostických a prediktivních genetických faktorů u pacientů s chronickou lymfocytární leukemií. Podle Pospíšilová et al. [114]. ![Význam prognostických a prediktivních genetických faktorů u pacientů s chronickou lymfocytární leukemií.
Podle Pospíšilová et al. [114].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/d0e47b872dd3afa6e25239571bd03244.png)
BcR – B-buněčný receptor, FCR – fl udarabine, cyklofosfamid, rituximab, IGHV – gen pro těžký řetězec imunoglobulinu Tab. 6. Mezinárodní prognostický index (International Prognostic Index – IPI) chronické lymfocytární leukemie [22]. ![Mezinárodní prognostický index (International Prognostic Index –
IPI) chronické lymfocytární leukemie [22].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/dafe8f116c75d47dd4c0ca2739833625.png)
IGHV – gen pro těžký řetězec imunoglobulinu Tab. 7. Prognostický index IPS-E pro nemocné diagnostikované v časném stádiu Binet A [23]. ![Prognostický index IPS-E pro nemocné diagnostikované v časném
stádiu Binet A [23].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/e202c7d99599212c048029ae5aec36c0.png)
4. VYŠETŘENÍ ZOBRAZOVACÍMI METODAMI U CLL
Zobrazovací vyšetření u CLL nabývají na větším významu vzhledem k častému výskytu nitrobřišní lymfadenopatie a léčbě inhibitory BCR/Bcl-2. Proto je vhodné v rámci stanovení rozsahu onemocnění před léčbou a při hodnocení léčebné odpovědi provádět přinejmenším ultrasonografii břicha a RTG hrudníku, u mladších nemocných je pak ke zvážení CT hrudníku a břicha [1,8,25–27]. Vyšetření pozitronovou emisní tomografií (PET; PET/CT, PET/MR) je u CLL indikováno jen v případě podezření na Richterovu transformaci [1,9]. Viz kapitola 5.9.
5. LÉČBA CLL
Léčba nemocných s CLL mimo klinické studie je individuální s přihlédnutím ke všem okolnostem aktuálního stavu nemocného, přidruženým onemocněním, přáním apod. Vzhledem k tomu, že pouze klinický výzkum vede ke zlepšování výsledků léčby, měla by být každému vhodnému nemocnému s CLL nabídnuta účast v některé z klinických hodnocení probíhajících v České republice. Zásadní je dobrá komunikace mezi regionálními hematologickými pracovišti a centry vysoce specializované hematoonkologické péče pro dospělé. Velice důležité je do těchto center včas odeslat mladší nemocné s vysoce nepříznivým průběhem CLL ke zvážení alogenní transplantace krvetvorných kmenových buněk.
5.1. Indikace k léčbě CLL
Řídíme se dle mezinárodně uznávaných kritérií IWCLL 2018 [1,2]. Nemocní s pokročilým onemocněním (stadium III a IV dle Raie nebo stadium C dle Bineta) jsou indikováni k zahájení léčby. Pouze u malé skupiny nemocných se stabilní mírnou anémií či trombocytopenií je možno léčbu nezahajovat a pečlivě monitorovat. U nemocných se středně pokročilým onemocněním (Rai I/II či Binet B) by měla být léčba zahájena pouze při průkazu aktivity CLL [1,2].
K definici aktivního onemocnění a zahájení léčby je nutné splnit nejméně jedno z následujících kritérií:
1. Průkaz progresivního selhání kostní dřeně, které se projevuje rozvojem nebo zhoršením anémie a/nebo trombocytopenie.
2. Masivní (tj. > 6 cm pod levým žeberním obloukem) nebo progresivní nebo symptomatická splenomegalie.
3. Masivní lymfadenopatie (tj. > 10 cm v nejdelším průměru) nebo progresivní nebo symptomatická lymfadenopatie.
4. Progresivní lymfocytóza se vzestupem > 50 % během 2 měsíců nebo doba zdvojnásobení počtu lymfocytů (LDT) kratší než 6 měsíců. Zejména u nemocných s úvodní lymfocytózou pod 50×109/l je třeba vyloučit jiné faktory, které mohou přispívat k lymfocytóze nebo lymfadenopatii, např. infekce. Progrese lymfocytózy se může u některých nemocných zpomalit, proto je vhodné zejména při absenci ostatních známek aktivity CLL pečlivě sledovat klinický vývoj.
5. Autoimunitní anémie a/nebo trombocytopenie špatně odpovídající na kortikosteroidy nebo jinou standardní léčbu.
6. Nejméně jeden z následujících systémových příznaků souvisejících s onemocněním:
a. nechtěný úbytek hmotnosti ≥ 10 % v průběhu předchozích 6 měsíců;
b. významná únava (tj. výkonnostní stav dle ECOG 2 nebo horší, nemožnost pracovat nebo provádět obvyklé činnosti);
c. horečky nad 38 °C po dobu 2 nebo více týdnů bez průkazu infekce;
d. noční pocení po dobu delší než 1 měsíc bez průkazu infekce.
Autoimunní hemolytická anémie a autoimunní trombocytopenie nejsou indikací k cytoredukční léčbě, nejsou-li současně splněna jiná kritéria aktivity CLL. Nemocní s autoimunními cytopeniemi by měli být léčeni imunosupresivní léčbou, např. kortikoterapií. Hypogamaglobulinémie nebo monoklonální/oligoklonální paraproteinémie není sama o sobě důvodem zahájení léčby. U nemocných s CLL může být značně zvýšený počet leukocytů, avšak u CLL jsou příznaky z leukostázy velmi vzácné. Proto by neměl být absolutní počet leukocytů používán jako samostatný indikátor léčby u asymptomatických nemocných. Samotná přítomnost nepříznivých prognostických faktorů (nemutované IGHV geny, delece 17p apod.) bez klinické aktivity CLL není indikací k zahájení léčby [1,2,25].
5.2. Vyšetření před léčbou
Před zahájením léčby je vhodné provést tato vyšetření:
1) Stanovení rozsahu onemocnění: fyzikální vyšetření a ultrasonografie břicha + rentgenový snímek hrudníku, u mladších nemocných event. CT hrudníku a břicha. Vyšetření kostní dřeně je nutné zejména u nemocných s anémií či trombocytopenií k posouzení etiologie. Dále je doporučeno provést vyšetření FISH, zejména delece 17p a mutační analýzu TP53, jejichž přítomnost může ovlivnit volbu léčby [1,8]
2) Vyšetření nutná ke stanovení bezpečnosti léčby: kromě základních biochemických ukazatelů zejména Coombsův (antiglobulinový) test + uka - zatele hemolýzy (bilirubin, laktátdehydrogenáza, retikulocyty, haptoglobin) [1,8]. U nemocných s aktivní autoimunitní hemolýzou není zpravidla použití fludarabinu doporučováno. Samotná pozitivita Coombsova testu bez aktivní hemolýzy však není důvodem fludarabin nepoužít. Dále vyšetřujeme sérologie virových hepatitid k vyloučení chronické hepatitidy B a C (HBsAg, anti-HBs, anti-HBc total a IgM, anti-HCV); u mladších nemocných je vhodné vyšetření sérologie HIV, před chemoimunoterapií či léčbou novými inhibitory též vyšetření sérologie cytomegaloviru (CMV) [8]. Velmi důležité je stanovení funkce ledvin vzhledem k renálnímu vylučování řady cytostatik, např. fludarabinu a cyklofosfamidu. Lze použít např. vypočtenou clearance kreatininu dle Cockcroftovy a Gaultovy rovnice [28].
3) Posouzení celkového stavu a přidružených onemocnění je velice důležité pro stanovení cílů léčby [29]. Významná část nemocných s CLL má již v době diagnózy významná přidružená onemocnění, jejichž počet či závažnost ovlivňují celkové přežití [29–31]. Důležitější než kalendářní je biologický věk. Stanovujeme výkonnostní stav dle ECOG, vhodné je však také posoudit počet a závažnost přidružených onemocnění. Je možno využít např. systém Cumulative Illness Rating Scale (CIRS) [32,33].
Základním způsobem lze rozdělit nemocné do tří skupin:
a) nemocní v dobrém stavu bez závažných přidružených onemocnění („fit“). V klinických studiích je používána hranice CIRS ≤ 6 bodů k definici této skupiny;
b) nemocní s významnými přidruženými onemocněními, ale v uspokojivém stavu („unfit/less fit“), CIRS 7–18 bodů;
c) nemocní ve špatném stavu s těžkými komorbiditami („extremely frail“): CIRS > 18 bodů [25].
Ke stanovení intenzity a typu léčby je v současné době nejdůležitější pečlivé individuální posouzení nemocného.
4) Zásadní je také vzít v úvahu přání nemocného. Cíle a představy lékaře a nemocného se nemusí vždy shodovat, proto je důležité s nemocným prodiskutovat všechny vhodné možnosti léčby a podrobně vysvětlit výhody a nevýhody jednotlivých postupů.
5.3. Hodnocení léčebné odpovědi
Řídí se doporučeními IWCLL [1,2]. Hodnocení léčebné odpovědi je vhodné provést po 2–3 měsících od ukončení léčby z důvodu umožnění regenerace v krevním obraze po myelotoxických režimech typu FCR. V případě léčby inhibitory BCR a Bcl-2, kdy je léčba dlouhodobá, je zapotřebí opakované posouzení léčebné odpovědi během léčby. Hodnocení léčebné odpovědi se opírá o fyzikální vyšetření a vyšetření krevního obrazu s diferenciálním rozpočtem leukocytů. Tato vyšetření mohou být doplněna o vyšetření kostní dřeně a vyšetření zobrazovacími metodami. Ideálním cílem léčby je dosažení kompletní remise (CR). Jednotlivé kategorie léčebné odpovědi a jejich definice jsou shrnuty v tab. 8. Vzhledem k tomu, že nové preparáty zasahující do signalizace B-buněčného receptoru (ibrutinib, idelalisib) způsobují redistribuci maligních lymfocytů z mízních uzlin do periferní krve s následnou lymfocytózou, která může být přechodná v úvodu léčby, ale také může trvat i řadu měsíců, byla navržena nová kategorie „částečná odpověď s lymfocytózou“ (PR-L) [34]. Jde o případ, kdy nemocný nesplní kritérium PR z důvodu lymfocytózy vyvolané léčbou. Tato kategorie slouží zejména k tomu, aby nemocným v léčbě inhibitory BCR nebyla předčasně ukončena léčba; PR s lymfocytózou by neměla být považována za progresi CLL [34].
Tab. 8. Hodnocení léčebné odpovědi u CLL, upraveno podle [1]. ![Hodnocení léčebné odpovědi u CLL, upraveno podle [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/29298517e98dc0a20af76b3871cf97cb.png)
* oproti vstupnímu stavu před léčbou, ** v důsledku CLL, *** aniž by se některá z uzlin zvětšila (povolenou výjimkou je zvětšení u malých uzlin do průměru 2 cm o maximálně 25 %)
CLL – chronická lymfocytární leukemie, ALC – absolutní počet lymfocytů, ANC – absolutní počet neutrofi lůDefinice kompletní remise (CR): splněna veškerá kritéria skupiny A i B a nemocný nesmí mít systémové příznaky spojené s CLL. Vyšetření kostní dřeně není nezbytně nutné pro hodnocení kompletní remise mimo klinické studie.
Definice parciální remise (PR): splněna nejméně 2 kritéria ze skupiny A + nejméně jedno kritérium ze skupiny B.
Definice stabilní choroby (SD): nedosažení léčebné odpovědi (tedy CR či PR), zároveň nejsou splněna kritéria progresivní choroby.
Definice progresivní choroby (PD): splněno nejméně jedno z kritérií skupiny A či B.
Pro splnění definice CR a PR musí být hodnocené parametry stabilní nejméně 2 měsíce.
Kompletní remise s neúplnou restitucí krevního obrazu (CRi) je definována stejně jako CR, je však přítomna reziduální cytopenie po léčbě (snížený absolutní počet neutrofilů – ANC – a/nebo hemoglobin a/nebo trombocyty).
Pokud bylo dosaženo PR na základě hodnocení krevního obrazu a organomegalie, je vyšetření kostní dřeně irelevantní, neboť nezmění kategorii léčebné odpovědi.
Do kategorie „progresivní choroba“ se řadí také transformace do lymfoproliferace vyšší malignity (Richterův syndrom).
Relaps je stav, kdy u nemocného, jenž dosáhl po léčbě CR nebo PR, dojde za ≥ 6 měsíců od skončení léčby k progresi nemoci (viz definice PD). Refrakterní onemocnění je definováno jako nedosažení CR nebo PR či relaps/progrese do 6 měsíců od ukončení léčby.
5.4. Léčba 1. linie
5.4.1 Obecné principy
Je vhodné u každého nemocného s indikací k léčbě zvážit zařazení do prospektivní klinické studie, je-li k dispozici. Vzhledem k výsledkům randomizovaných klinických studií CLL8, CLL10, CLL14, ALLIANCE, ECOG/ACRIN a dalších je i v současné době vhodnou volbou chemoimunoterapie u nemocných bez poruchy genu TP53, kteří mají mutovaný IGHV gen, neboť u těchto nemocných lze očekávat dlouhé období bez progrese [35–39]. Pro pacienty s nemutovaným IGHV se jeví jako nejvhodnější volbou léčby cílené perorální inhibitory. Chemoimunoterapie je pro tyto nemocné alternativou léčby inhibitory mimo jiné z důvodu platných úhradových podmínek cílených perorálních inhibitorů v České republice [25]. Přehled možností pro 1. linii léčby CLL shrnuje tab. 9.
Tab. 9. Přehled možností pro 1. linii léčby CLL. 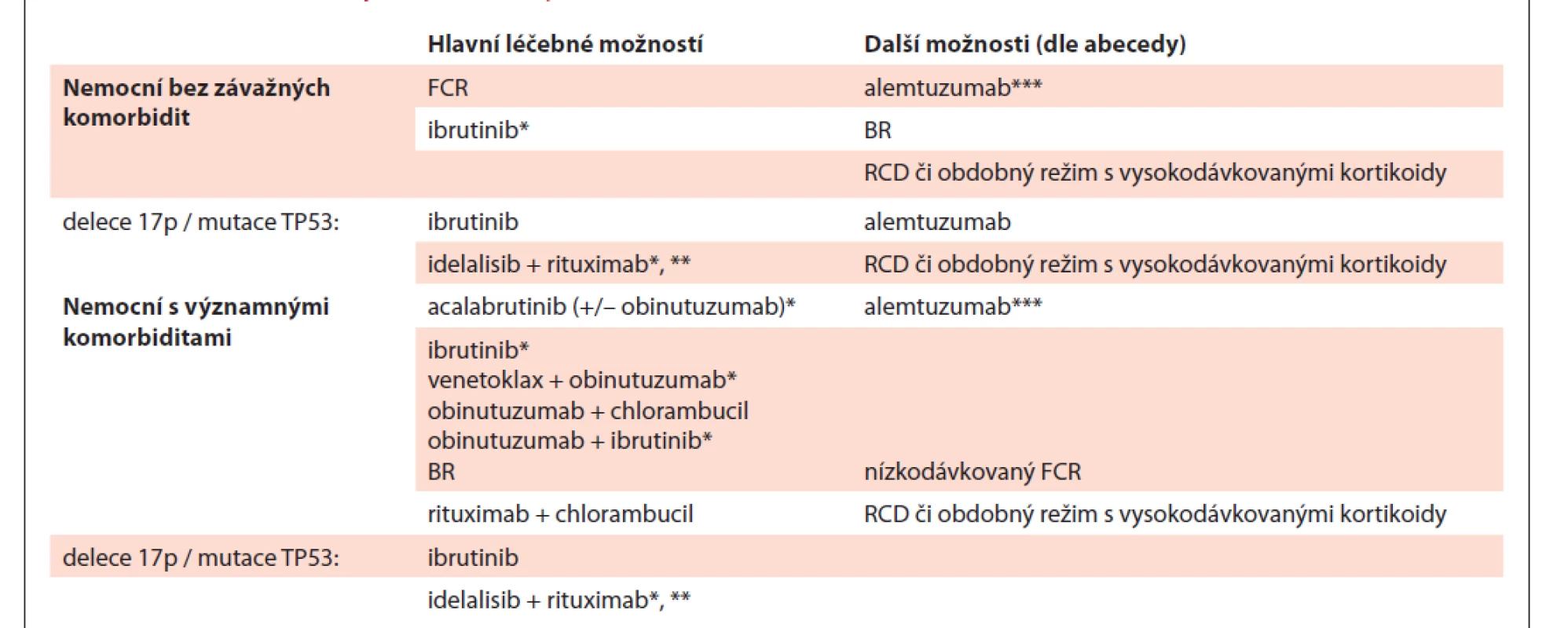
* režim nemá t.č. stanovenu úhradu, nutno žádat o schválení revizního lékaře, ** v případě nevhodnosti jakékoliv jiné léčby, *** přípravek dostupný pouze v rámci specifi ckého léčebného programu
CLL – chronická lymfocytární leukemie, FCR – fl udarabin + cyklofosfamid + rituximab, BR – bendamustin + rituximab, BO – bendamustin + ofatumumab, RCD – rituximab + cyklofosfamid + dexametazon5.4.2 Léčba 1. linie u nemocných bez významných přidružených onemocnění
Vzhledem ke klinické variabilitě u nemocných s CLL je často nutno léčbu individualizovat. Na základě výsledků randomizované studie CLL8 je režim FCR (fludarabin, cyklofosfamid, rituximab) považován za hlavní léčebnou možnost u nemocných v dobrém stavu bez závažných přidružených onemocnění a s normální funkcí ledvin [8,35,40] zejména u nemocných s mutovaným IGHV genem, kde lze očekávat dlouhé období remise. V případě přítomnosti delece 17p / mutace TP53 je indikován ibrutinib, který v této indikaci má t.č. jako jediný preparát úhradu [8,41]. Na základě výsledků randomizovaných studií Resonate – 2 [42] a ECOG-ACRIN [39] je v léčbě 1. linie možno použít rovněž ibrutinib také u nemocných bez defektu TP53, v tomto případě je však nutno žádat o schválení revizního lékaře. Dále viz kapitola 5.4.3. Idelalisib je možno použít v kombinaci s rituximabem pouze u nemocných s delecí či mutací TP53 při nevhodnosti jakékoli jiné léčby; podléhá též schválení revizního lékaře [43]. Vzhledem k výsledkům dvou randomizovaných klinických studií, které neprokázaly významné zlepšení léčebné účinnosti při kombinaci ibrutinibu s rituximabem vůči monoterapii ibrutinibem [38,44], je doporučeno podávat ibrutinib bez rituximabu [25,45].
Další léčebné možnosti (řazeno abecedně):
- alemtuzumab (není pro léčbu CLL registrován, je dostupný v ČR v rámci specifického léčebného programu) * [46];
- bendamustin + rituximab (BR) jako alternativa k režimu FCR u nemocných ≥ 65 let věku, zejména v případě vysokého rizika infekcí či předchozích závažných infekcí [40,47];
- rituximab, cyklofosfamid, dexametazon (RCD) či obdobné režimy s vysokodávkovanými kortikoidy [48,49], zejména pokud je progrese CLL provázena autoimunitní cytopenií (autoimunitní hemolytická anémie, imunitní trombocytopenie).
5.4.3. Léčba 1. linie u nemocných s významnými přidruženými chorobami
U nemocných s významnými komorbiditami (např. skóre komorbidit CIRS > 6) či clearance kreatininu < 70 ml/min., kteří tedy nejsou vhodní k léčbě plnodávkovaným protokolem FCR, jsou k dispozici tyto hlavní možnosti (v abecedním pořadí):
- acalabrutinib (event. acalabrutinib + obinutuzumab) * [50];
- ibrutinib [42];
- ibrutinib + obinutuzumab* [51];
- obinutuzumab + chlorambucil [52,53];
- rituximab + bendamustin (BR) [54];
- rituximab + chlorambucil [53–55];
- venetoklax + obinutuzumab* [56,57].
* Tyto režimy nemají v současnosti stanovenou úhradu, je nutno žádat revizního lékaře.
U starších/komorbidních nemocných může být v léčbě 1. linie vhodnou léčebnou možností chemoimunoterapie (zejména režimy BR či obinutuzumab + chlorambucil) v případě přítomnosti mutovaného IGHV genu, neboť ve studiích ALLIANCE ani CLL14 nebylo prokázáno prodloužení období do progrese u této podskupiny nemocných s příznivou prognózou [37,38].
Podle SPC přípravku a na základě studií Resonate-2 a ALLIANCE a ILLUMINATE je v léčbě 1. linie u pacientů bez defektu TP53 možno použít rovněž ibrutinib v monoterapii či v kombinaci s obinutuzumabem (v obou případech podléhá schválení revizním lékařem) [58]. Na základě studie CLL14 se jeví jako vysoce účinná kombinace venetoklaxu s obinutuzumabem, mezi jejíž výhody patří vysoká pravděpodobnost eradikace minimální reziduální nemoci (MRN) a také časové omezení léčby na 12 měsíců ve srovnání s podáváním ibrutinibu, jenž je užíván do progrese či závažné toxicity. U nemocných s delecí 17p / mutací TP53 nevhodných k léčbě chemoimunoterapií je vhodné použít ibrutinib [8]. Idelalisib v kombinaci s rituximabem je možno použít u nemocných s delecí či mutací TP53 při nevhodnosti jakékoli jiné léčby (podléhá schválení revizním lékařem) [43].
Nedávno publikovaná data studie ELEVATE TN rovněž ukázala účinnost monoterapie acalabrutinibem či kombinace acalabrutinib + obinutuzumab v léčbě starších nemocných s CLL či u nemocných se snížením renálních funkcí či komorbiditami [50].
Další možnosti léčby (v abecedním pořadí):
- alemtuzumab (není pro léčbu CLL registrován, v ČR je dostupný v rámci specifického léčebného programu) [47];
- FCR se sníženými dávkami chemoterapie („low-dose“ FCR) [59];
- rituximab, cyklofosfamid, dexametazon (RCD) či obdobné režimy s vysokodávkovanými kortikoidy [49,60,61];
- ofatumumab, ať již v kombinaci s chlorambucilem či bendamustinem, nemá v podmínkách ČR stanovenou úhradu, v praxi proto není využíván.
U těžce komorbidních nemocných, u kterých lze očekávat krátké přežití z důvodu přidružených onemocnění, je cílem léčby ovlivnění symptomů CLL s minimem nežádoucích účinků. Lze využít např. nízkodávkovaný chlorambucil v monoterapii, nízkodávkovaný cyklofosfamid v monoterapii či nízkodávkovanou kortikoterapii.
5.5. Léčba relapsu/ refrakterní CLL
Volba vhodného léčebného režimu je dána celkovým stavem a věkem pacienta a také odpovědí na předchozí léčbu a délkou jejího trvání. Pacienti s pozdním relapsem po chemoimunoterapii, u nichž léčebná odpověď trvala déle než 3 roky, mohou profitovat z opakované aplikace chemoimunoterapie [8,25]. V případě časných relapsů (do 3 let), refrakterní choroby či přítomnosti delece 17p / mutace TP53 je nutné změnit léčebný přístup a použít cílenou léčbu inhibitory BCR či Bcl-2 [8,25]. Možnosti léčby relapsu/refrakterní CLL shrnuje tab. 10.
Tab. 10. Možnosti léčby relapsu/refrakterní CLL. 
* úhrada při relapsu do 24 měsíců či při poruše genu TP53, **hrazeno u nemocných s poruchou TP53 po selhání či při nevhodnosti léčby inhibitorem BCR, či u nemocných bez aberace TP53 po selhání chemoimunoterapie i léčby BCR inhibitorem, *** přípravek dostupný pouze v rámci specifi ckého léčebného programu, ****off -label indikace, podléhá žádost reviznímu lékaři
CLL – chronická lymfocytární leukemie, BR – bendamustin + rituximab, FCR – fl udarabin + cyklofosfamid + rituximab, LDFCR – nízkodávkovaný FCR, RCD – rituximab + cyklofosfamid + dexametazon5.5.1. Léčba relapsu/refrakterní CLL u nemocných bez významných přidružených onemocnění
Hlavní léčebné možnosti (řazené dle abecedy):
- acalabrutinib [62];
- ibrutinib [63–65];
- idelalisib + rituximab [66,67];
- venetoklax [68,69];
- venetoklax + rituximab [70–72].
Kombinace venetoklax + rituximab (VR) skýtá několik výhod pro léčbu 2. linie u nemocných s relapsem/refrakteritou na chemoimunoterapii. Má vysokou účinnost ve smyslu častého dosažení negativity minimální reziduální nemoci; léčba venetoklaxem je navíc omezena 2 roky v porovnání s léčbou ibrutinibem či kombinací idelalisib + rituximab, kde je nutná dlouhodobá kontinuální léčba do progrese (či nepřijatelné toxicity), což zvyšuje riziko nežádoucích účinků, poklesu lékové compliance a možnost selekce rezistentního klonu [21,25]. Venetoklax v monoterapii (kontinuální léčba do progrese či nepřijatelné toxicity) je indikován a má úhradu: a) pro léčbu nemocných s delecí 17p či mutací TP53 po selhání či při nevhodnosti léčby inhibitorem BCR; b) pro léčbu nemocných bez delece či mutace TP53 po selhání chemoimunoterapie a léčby BCR inhibitorem. Venetoklax tedy představuje hlavní možnost po selhání léčby ibrutinibem či idelalisibem [68,69]. Kombinace režimu BR a inhibitoru BCR ibrutinibu [73] či BR + idelalisib [74] nepřináší zásadní přínos v porovnání s monoterapií ibrutinibem či kombinací rituximab + idelalisib; v praxi proto nejsou využívány.
Další možnosti léčby (řazení dle abecedy):
- alemtuzumab [75,76];
- BR (bendamustin + rituximab) – bendamustin v léčbě relapsu/refrakterní CLL nemá indikaci dle souhrnu údajů o přípravku („off-label“ indikace); nutno žádat revizního lékaře o schválení [77,78];
- FCR [79–81];
- RCD (rituximab, cyklofosfamid, dexametazon) či obdobné režimy s vysokodávkovanými kortikoidy, zejména u refrakterních nemocných [49,60,61];
- kombinace rituximabu s intenzivními platinovými režimy (např. R-DHAP) u refrakterních nemocných mladšího věku ve velmi dobrém stavu bez závažných komorbidit [82];
- ofatumumab u nemocných refrakterních na fludarabin i alemtuzumab má omezenou účinnost [83] a nemá v ČR stanovenu úhradu, v praxi tedy již není používán.
5.5.2. Léčba relapsu/refrakterní CLL u nemocných s významnými přidruženými onemocněními
Hlavní možnosti (řazeno dle abecedy):
- acalabrutinib [62];
- ibrutinib [63–65];
- idelalisib + rituximab [66];
- venetoklax [67,68];
- venetoklax + rituximab [68,69].
Další možnosti (řazeno dle abecedy):
- alemtuzumab [75,76];
- BR (bendamustin + rituximab) – bendamustin v léčbě relapsu/refrakterní CLL nemá indikaci dle souhrnu údajů o přípravku („off-label“ indikace), nutno žádat o úhradu revizního lékaře [77,78];
- FCR v redukovaných dávkách („low dose“ FCR) [84];
- RCD (rituximab, cyklofosfamid, dexametazon) či obdobné režimy s vysokodávkovanými kortikoidy, zejména u refrakterních nemocných [49,60,61];
- ofatumumab u nemocných refrakterních na fludarabin i alemtuzumab má omezenou účinnost [81] a nemá v ČR stanovenu úhradu, není tedy již v praxi používán.
U relabujících nemocných s nepříznivou genetikou (delece 17p / mutace TP53) by mělo být i v případě pozdního relapsu indikováno podání ibrutinibu či idelalisibu, které nabízí lepší kontrolu nemoci v porovnání s ostatní dosud dostupnou léčbou, s výjimkou alogenní transplantace krvetvorných kmenových buněk. U nemocných po selhání inhibitoru BCR se nabízí dvě hlavní možnosti: a) venetoklax v monoterapii; b) výměna za alternativní inhibitor BCR (ibrutinib ® R-idelalisib a naopak) [85,86].
Nemocní s refrakterní CLL by měli být včas konzultováni v některém z center vysoce specializované hematoonkologické péče pro dospělé, která by měla řídit další strategii léčby, ideálně v rámci klinických studií případně indikovat léčbu moderními molekulami či monoklonálními protilátkami a také zvážit provedení alogenní transplantace krvetvorných buněk.
5.6. Minimální reziduální nemoc
Moderní léčebné protokoly vedou u významné části nemocných ke snížení leukemického klonu pod úroveň detekce běžnými metodami; zbytkové leukemické elementy (minimální reziduální nemoc – MRN) mohou být zjistitelné pouze velmi citlivými metodami. V literatuře přibývá důkazů o prodloužení přežití bez progrese a celkového přežití u nemocných, u kterých bylo dosaženo negativity MRN [87,88]. Prognostický dopad MRN navíc není závislý na podané léčbě či na jiných rizikových faktorech (mutační stav IGHV, chromozomové aberace apod.). Vyšetření MRN v periferní krvi či kostní dřeni metodami s citlivostí minimálně 10-4 (pomocí 4–8barevné průtokové cytometrie, PCR s individuálně připravenými primery či pomocí NGS) je vhodné zvážit u nemocných po léčbě, která prokazatelně dosahuje negativity MRN (např. kombinované fludarabinové a bendamustinové režimy, kombinace založené na obinutuzumabu či venetoklaxu; alemtuzumab, alogenní transplantace) [88,89]. Dosud se nejedná o vyšetření povinné [7], ale význam analýz MRN v budoucnu pravděpodobně významně vzroste s tím, jak bude pomocí nových léčebných kombinací narůstat počet dosažených negativit MRN. Vhodné je především u pacientů po alogenní transplantaci krvetvorných buněk.
5.7. Transplantace krvetvorných buněk
Alogenní transplantace krvetvorných buněk by měla být včas zvažována u každého mladšího fit nemocného s vysoce rizikovou CLL (refrakterita či časný relaps po chemoimunoterapii, zejména v kombinaci s delecí 17p / mutací TP53) [89,90]. Podle Evropské výzkumné iniciativy pro CLL (ERIC) a Evropské společnosti pro transplantaci krve a kostní dřeně (EBMT) lze nemocné vysokého rizika rozdělit na dvě skupiny: high-risk-I (refrakterita na chemoimunoterapii s defektem TP53, ale s plnou odpovědí na léčbu BCR nebo Bcl-2 inhibitory) a high-risk-II (refrakterita na chemoimunoterapii s defektem TP53, bez odpovědi na léčbu BCR nebo Bcl-2 inhibitorem). K alogenní transplantaci jsou indikováni především pacienti skupiny high-risk-II při zvážení rizik, která pro konkrétního pacienta alogenní transplantace přináší [90,91].
Nemocní indikováni k transplantaci by měli být včas konzultováni v některém z center vysoce specializované hematoonkologické péče pro dospělé vzhledem k tomu, že transplantace by měla být provedena včas, dříve, než je onemocnění kompletně refrakterní a pacient masivně předléčený.
Alogenní transplantace je jedinou léčebnou metodou pro CLL s prokázaným kurativním potenciálem a nabízí dlouhodobou kontrolu nemoci. Významná část nemocných dosahuje negativity na úrovni minimální reziduální nemoci a výsledek transplantace není nepříznivě ovlivněn negativními genetickými rizikovými faktory (delece 17p / mutace TP53). Transplantace je ovšem zatížena cca 15–30% mortalitou v důsledku infekcí nebo toxicity v prvních dvou letech a až u 25 % pacientů omezuje jejich kvalitu života chronická reakce štěpu proti hostiteli (GVHD) [91].
Nové molekuly (inhibitory BCR/Bcl-2) změnily doporučení pro indikaci a zejména pro načasování alogenní transplantace. Transplantaci není v současné době nutné provádět u CLL s aberací TP53 v první remisi, s ohledem na to, že je velká šance na dosažení druhé remise novými molekulami. Indikace je nyní prakticky výhradně u relapsu / refrakterního onemocnění a kandidáty transplantace se stávají nemocní s nedostatečnou odpovědí na cílené perorální inhibitory [91]. Přímé porovnání alogenní transplantace s inhibitory BCR či Bcl-2 ale není k dispozici a je málo pravděpodobné, že prospektivní randomizované studie na toto téma budou provedeny vzhledem k zřetelnému rozdílu v náročnosti těchto léčebných metod. Pacientům s vysoce rizikovou CLL by měl být v současné době nabídnut některý z cílených perorálních inhibitorů, nejlépe v rámci klinických studií [8]. Po dosažení odpovědi může být zvažována konsolidace alogenních transplantací nebo pokračující léčba cíleným inhibitorem do progrese onemocnění [91,92]. Transplantační přístup by měl být upřednostňován u relabující / refrakterní CLL s delecí 17p / mutací TP53 při progresi na některém z cílených inhibitorů, a to především u mladších pacientů s dobře shodným dárcem [91,94]. Netransplantační cesta je naopak vhodnější pro starší nemocné s komorbiditami, zejména při absenci nepříznivé genetiky a nedostupnosti vhodného dárce.
Pro alogenní transplantaci se v současné době volí nejčastěji použití nemyeloablativního přípravného režimu, který přináší nižší peritransplantační mortalitu a možnost provést transplantaci u nemocných do 65 (výjimečně 70) let. Tato metoda je v současné praxi upřednostňována před klasickým myeloablativním přístupem [91].
5.8 Autoimunitní cytopenie
Autoimunitní cytopenie patří k typickým komplikacím u CLL v důsledku dysregulace imunitního systému působením leukemického klonu [95]. Nejčastěji se setkáme s autoimunitní hemolytickou anémií (AIHA), která se vyskytuje cca u 5–11 % nemocných [96]. Diagnostika je založena na zpravidla rychlém poklesu hemoglobinu se vzestupem středního objemu erytrocytů, retikulocytózou a příznaky autoimunitní hemolýzy: zvýšeným nekonjugovaným bilirubinem a laktátdehydrogenázou, naopak sníženým až nedetekovatelným haptoglobinem. V aspirátu kostní dřeně (není-li zároveň přítomna masivní infiltrace při CLL) nacházíme aktivovanou erytropoézu. Autoimunitní původ anémie prokáže silná pozitivita přímého antiglobulinového (Coombsova) testu nejčastěji v oblasti tepelných protilátek (IgG), méně často jde o chladové aglutininy [97]. Sekundární imunitní trombocytopenická purpura (ITP) se vyskytuje u 2–5 % případů [96]; je charakterizována rychlým izolovaným poklesem trombocytů až na hodnoty pod 10×109/l. V aspirátu kostní dřeně je megakaryopoéza zpravidla zachována či zvýšena (není-li masivní infiltrace při CLL). V krevním obraze je typicky zvýšen ukazatel IPF (immature platelet fraction, nezralá frakce trombocytů) [97]. Kombinace AIHA a ITP je označována jako Evansův syndrom. Čistá aplázie červené řady (pure red cell aplasia – PRCA) a autoimunitní neutropenie (autoimmune granulocytopenia – AIG) jsou vzácné; vyskytují se u < 1 % případů. PRCA je charakterizována zpravidla závažnou izolovanou normocytární normochromní anémií s těžkou retikulocytopenií, absencí známek hemolýzy, negativním antiglobulinovým testem a chyběním prekurzorů červené řady v aspirátu / biopsii dřeně, kdy zároveň není přítomna masivní infiltrace při CLL. Kromě autoimunitního původu může být PRCA způsobena též infekcí parvovirem B19, proto vyšetřujeme PCR a sérologii z periferní krve [96]. Autoimunitní neutropenie je velice vzácná; jde o izolovaný rozvoj neutropenie se snížením až chyběním granulopoézy v cytologii/histologii kostní dřeně; mohou být přítomny protilátky proti granulocytům. Léčí se zpravidla symptomaticky podávání granulocytového kolonie-stimulujícího faktoru (G-CSF). Léčba 1. linie u AIHA, ITP i PRCA spočívá v kortikoterapii, pokud není zároveň indikována CLL k cytoredukční léčbě. Je-li indikace k léčbě CLL a zároveň AIHA či ITP, je vhodné použít chemoimunoterapii založenou na vysokodávkovaném kortikoidu (R-dex či RCD), po utlumení autoimunitní cytopenie poté přejít na klasický režim chemoimunoterapie či perorálního inhibitoru. Chemoimunoterapie založená na rituximabu a kortikoidech je též indikována v případě selhání kortikoterapie v léčbě AIHA či ITP [1,2]
5.9. Transformace CLL (Richterův syndrom – RS)
Transformace CLL do jiné lymfoproliferace, nejčastěji difúzního velkobuněčného lymfomu (DLBCL), vzácně Hodgkinova lymfomu, je prognosticky vysoce nepříznivý jev. K transformaci dochází u 2–10 % pacientů v průběhu jejich onemocnění, s pravděpodobností 0,5–1 % za rok [99–101]. Na transformaci CLL je nutno pomýšlet při následujících nálezech: významné zvýšení LDH, progrese lymfadenopatie, zejména asymetrické v jedné oblasti, rozvoj B-příznaků, progrese při terapii. Při podezření na Richterův syndrom je možné využít vyšetření PET/CT. Maximální SUV (standardized uptake volume) < 5 má vysokou negativní prediktivní hodnotu (92–97 %), což značí velmi nízkou pravděpodobnost RS. Při SUV 5–10 se jedná o střední pravděpodobnost RS a SUV ≥ 10 znamená vysokou pravděpodobnost transformace [102]. K potvrzení Richterovy transformace je rozhodující exstirpace mízní uzliny s histologickým vyšetřením [100]. U nemocných s Richterovým syndromem je indikována léčba pro agresivní lymfomy, tzn. chemoimunoterapie využívající rituximab (R-CHOP a další režimy), vč. léčby transplantační. Hlavním faktorem, který určuje prognózu pacienta s RS, je klonální příslušnost DLBCL k přítomné CLL. Na základě sekvenování IGHV genu lze odlišit, že kolem 20 % případů transformace představuje nově vzniklý DLBCL, bez klonálního vztahu k CLL [100]. Prognóza tohoto RS je stejná jako u de novo vzniklého DLBCL; léčí se proto stejným způsobem, nejčastěji protokolem R-CHOP. Při nedosažení kompletní remise je indikována záchranná léčba následovaná autologní transplantací. V 80 % případů Richterovy transformace do DLBCL jde o onemocnění vzniklé klonálně z původní CLL s výrazně nepříznivou prognózou (medián přežití 8–14 měsíců). Jako úvodní léčba je opět vhodný režim R-CHOP a při odpovědi na chemoimunoterapii se zvažuje transplantační léčba. Alogenní transplantace je preferována u mladších nemocných v dobrém celkovém stavu a vhodným dostupným dárcem. Autologní transplantace pro Richterův syndrom lze zvážit u nemocných, kteří nejsou kandidáty alogenní transplantace z důvodu věku či komorbidit. V případě transformace do Hodgkinova lymfomu se použije chemoterapie určená k léčbě tohoto onemocnění (např. ABVD) [100].
5.10. Podpůrná léčba
Nemocní s CLL mají vysoké riziko infekčních komplikací, které souvisí jak s defekty buněčné i protilátkové imunity v důsledku působení choroby samotné, tak i v důsledku imunosuprese navozené léčbou. Podpůrná léčba je tedy cílena zejména na prevenci a včasnou léčbu širokého spektra infekcí vč. oportunních nákaz. U každého nemocného léčeného protokoly obsahujícími fludarabin či kortikoidy by měla být zvážena protiinfekční profylaxe (sulfametoxazol/trimetoprim, antivirotika, event. antimykotika). Prevence pneumocystové pneumonie pomocí kombinace sulfametoxazol / trimetoprim či vhodné alternativy je nutná u všech nemocných na léčbě idelalisibem [43]. Kombinace sulfametoxazol / trimetoprim + antivirotika je povinná u protokolů obsahujících alemtuzumab či vysokodávkované kortikoidy [103,104]. Při léčbě alemtuzumabem či idelalisibem je dále nutná pravidelná klinická a laboratorní monitorace CMV reaktivace. V případě klinicky významné reaktivace CMV je nutné přerušení terapie a zahájení antivirotické léčby (ganciclovir, valganciklovir) [103,104]. Pokud se u nemocného na dlouhodobé cílené léčbě (ibrutinib, idelalisib, venetoklax) (tab. 11) rozvine infekce, je nutno nasadit příslušnou antimikrobiální léčbu a zvážit přerušení cílené léčby v případě závažné infekce; v případě podezření na bakteriální infekci zpravidla nasazujeme empiricky širokospektrá antibiotika po předchozím odběru kultivací. Stejně tak je nutno léčbu novými preparáty přerušit při jakékoli jiné závažné komplikaci a neprodleně kontaktovat centrum, kde je nemocný léčen.
Tab. 11. Hlavní charakteristiky cílených perorálních preparátů v léčbě CLL. 
CLL – chronická lymfocytární leukemie Podpůrná terapie při léčbě venetoklaxem: použití venetoklaxu bylo v časných klinických studiích spojeno s rozvojem syndromu z rozpadu nádoru (tumor lysis syndrome – TLS). Proto je nutné dodržet dávkovací schéma podle doporučení pro venetoklax [105], dle kterých je první dávka 20 mg a postupně se dávka postupně zvyšuje v týdenních intervalech na 50, 100 a 200 až na cílových 400 mg denně. Během tohoto období je nutné pečlivé monitorování biochemických parametrů zaměřených na známky TLS a vyšetřování krevního obrazu. Před zahájením léčby venetoklaxem by měl být nemocný masivně hydratován, měl by mu být podán allopurinol, případně rasburikáza. Za hospitalizace je doporučeno zahájení léčby venetoklaxem, zejména u nemocných s vysokou nádorovou náloží [106,107].
U nemocných s opakovanými bakteriálními infekcemi a sníženou sérovou koncentrací IgG pod 5 g/l by měla být vedle antimikrobiální profylaxe dále individuálně zvážena i substituce nitrožilními či podkožními imunoglobuliny [8,25,108,109]. U pacientů s CLL je dále doporučováno i každoroční očkování proti chřipce a pravidelné očkování proti pneumokokům (upřednostňována je konjugovaná vakcína; očkování je možné i u pacientů léčených cílenými léky) [110]. Je nutné mít na paměti, že pacienti s CLL mají nižší odpověď na očkování a v době chřipkové sezóny se doporučuje zvýšená pozornost i u těch nemocných, kteří očkování podstoupili. Pacienti léčení rituximabem by měli být očkováni až poté, co dojde k regeneraci B lymfocytů. Pacientům s CLL se nesmí podávat živé vakcíny. Imunosupresivní terapie může vést také k reaktivaci hepatitidy B nebo C, proto by pacienti před léčbou CLL měli být vyšetřeni na hepatitidy B a C (HBsAg, anti-HBs, anti-HBc total a IgM, anti-HCV) [8] a v případě průkazu proběhlé infekce je vhodné pacienta dále konzultovat s hepatologem či infektologem. V některých případech je nutná antivirotická profylaxe nebo terapie. U pacientů s CLL léčených chemoterapií, imunoterapií či imunochemoterapií, u kterých dojde k rozvoji anémie, je vhodná léčba erytropoézu-stimulujícími proteiny (erytropoetin, darbepoetin) v souladu s mezinárodními doporučeními [111]. U nemocných, kteří jsou těžce imunosuprimováni, zejména po léčbě fludarabinem či alemtuzumabem, u nemocných zahajujících přípravu k alogenní transplantaci a rovněž u těch po alogenní transplantaci by měly být používány ozářené transfúzní přípravky vzhledem ke zvýšenému riziku rozvoje reakce štěpu proti hostiteli spojené s transfúzí [108]. Vzhledem k tomu, že intenzivní léčebné protokoly, zejména protokoly obsahující fludarabin či alemtuzumab, jsou spojeny s vysokým rizikem febrilní neutropenie, je vhodné na základě individuálního rizika zvážit primární profylaxi febrilní neutropenie pomocí granulocytového kolonie stimulujícího faktoru (G-CSF) v souladu s doporučeními mezinárodních společností [112]. Toto je velice vhodné zejména u režimu FCR, kdy lze očekávat vysoký výskyt neutropenie 4. stupně [47]; opatrnosti je též zapotřebí u režimů BR a RCD. V případě výskytu febrilní neutropenie při léčbě je vhodné podat G-CSF v dalších cyklech léčby jako sekundární profylaxi febrilní neutropenie.
Nemocní s CLL mají 2–5× vyšší riziko vzniku sekundárních malignit. Časté jsou zejména kožní nádory, dále karcinom prostaty, plicní a kolorektální karcinom [113]. Proto je vhodné myslet u těchto nemocných ve spolupráci s praktickým lékařem na pravidelný onkologický screening:
1) vyšetření stolice na okultní krvácení;
2) kontroly PSA u mužů;
3) gynekologické vyšetření a mamografie u žen;
4) dermatologické vyšetření [108,113].
5.11. Léčebný výhled do budoucna
Léčiva a léčebné kombinace, které budou registrovány v příštích 1–2 letech, nebo v té době získají úhradu plátci zdravotní péče, shrnuje tab. 12.
Tab. 12. Nová léčiva a léčebné kombinace pro chronickou lymfocytární leukemii. 
BCRi – inhibitory signalizace B buněčného receptoru, R/R: relaps/refrakterní choroba 6. COVID-19 U CLL
Pandemie novým koronavirem SARS-CoV-2 (onemocnění COVID-19) ukázala, že pacienti s CLL patří vzhledem k významné komplexní imunosupresi způsobené CLL a případnou léčbou k silně ohroženým skupinám, u nichž lze čekat závažný průběh onemocnění. Analýza Evropské výzkumné skupiny pro CLL (ERIC) zjistila závažný průběh COVID-19 (nutnost oxygenoterapie a/nebo pobytu na JIP) u 79 % ze 190 hodnocených nemocných s CLL s mediánem věku v době diagnózy COVID-19 72 let. Rizikovým faktorem závažné infekce COVID-19 byl věk ≥ 65 let. Jen 39,7 % nemocných se závažnou infekcí COVID-19 dostávalo léčbu CLL v období do 12 měsíců před infekcí. Pacienti léčení ibrutinibem měli nižší výskyt závažné COVID-19 infekce než nemocní léčení jinými terapiemi nebo než pacienti bez terapie. Věk a komorbidity neměly vliv na mortalitu COVID-19 [121]. Obdobná mezinárodní analýza 198 nemocných (50 % z pracovišť v USA) ukázala, že pacienti s CLL potřebovali hospitalizaci až v 90 % případů. Medián věku nemocných s CLL a diagnózou COVID-19 byl 70,5 roku. Podle této studie bylo 45 % nemocných s COVID-19 aktivně léčeno pro CLL. Dalších 16 % nemocných terapii CLL dostávalo v minulosti. Při mediánu sledování 16 dní byla mortalita infekce COVID-19 u CLL 33 %. Podle této analýzy podávání inhibitorů BCR nemělo pozitivní ani negativní vliv na mortalitu COVID-19; tuto terapii bylo možné i přes infekci COVID-19 stále podávat [122]. Na základě dosud známých informací týkajících se CLL a infekce COVID-19 a v souladu s doporučeními mezinárodních expertů [123–126] ČSCLL doporučuje pro období pandemie COVID-19 opatření shrnutá v tab. 13.
Tab. 13. Doporučení ČSCLL ohledně infekce COVID-19 u nemocných s CLL. 
CLL – chronická lymfocytární leukemie UPOZORNĚNÍ
Tato doporučení jsou pouze návodem, jak je možno u nemocných s CLL postupovat. Autoři nenesou žádnou právní zodpovědnost za obsah těchto doporučení ani volbu konkrétního postupu u konkrétního nemocného – ta je plně zodpovědností ošetřujícího lékaře.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
SL, ŠpM, DM – podíleli se na napsání manuskriptu, provedli jeho revizi a konečnou úpravu k tisku; PŠ, PT, JM, UR, ŠiM, LD, BM – podíleli se na napsání manuskriptu a provedli jeho revizi.
PROHLÁŠENÍ O SPOLUPRÁCI S FARMACEUTICKÝMI SPOLEČNOSTMI
L. Smolej – AstraZeneca, Gilead, Janssen-Cilag, Roche, AbbVie (honoráře za přednáškovou činnost a konzultace, cestovní granty).
M. Špaček – AtraZeneca, AbbVie, Gilead, Janssen-Cilag, a Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
M. Brejcha – Celgene, Gilead, Novartis (honoráře za přednáškovou činnost, cestovní granty).
R. Urbanová – Roche (honoráře za přednáškovou činnost, cestovní granty).
M. Šimkovič – AbbVie, Gilead, Janssen-Cilag, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
D. Lysák – AbbVie, Gilead, Janssen-Cilag, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
T. Papajík – AbbVie, Gilead, Janssen-Cilag, Novartis, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
M. Doubek – AstraZeneca, AbbVie, Angelini, AOP Orphan, Gilead, Janssen-Cilag, Novartis, Roche (honoráře za přednáškovou činnost a konzultace, cestovní granty).
PODĚKOVÁNÍ
Tato práce byla podpořena grantem PROGRES Q40/08, RVO (00179906, FNHK).
Doručeno do redakce dne 20. 12. 2020.
prof. MUDr. Michael Doubek, Ph.D.
Interní hematologická a onkologická klinika LF MU a FN
Jihlavská 20
625 00 Brno
Zdroje
1. Hallek M, Cheson BD, Catovsky D, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018; 131 : 2745–2760.
2. Doubek M, Špaček M, Pospíšilová Š, et al. Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie (CLL) – 2018. Transfuze Hematol. Dnes 2018; 24 : 208–220.
3. Moreau EJ, Matutes E, A‘Hern RP, et al. Improvement of the chronic lymphocytic leukemia scoring system with the monoclonal antibody SN8 (CD79b). Am J Clin Pathol. 1997; 108 : 378–382.
4. Rawstron AC, Kreuzer KA, Soosapilla A, et al. Reproducible diagnosis of chronic lymphocytic leukemia by flow cytometry: An European Research Initiative on CLL (ERIC) & European Society for Clinical Cell Analysis (ESCCA) Harmonisation project. Cytometry B Clin Cytom. 2018; 94 : 121–128.
5. Strati P, Shanafelt TD. Monoclonal B-cell lymphocytosis and early-stage chronic lymphocytic leukemia: diagnosis, natural history, and risk stratification. Blood. 2015; 126 : 454–462.
6. Rai KR, Sawitsky A, Cronkite EP, Chanana AD, Levy RN, Pasternack BS. Clinical staging of chronic lymphocytic leukemia. Blood. 1975; 46 : 219–234.
7. Binet JL, Auquier A, Dighiero G, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer. 1981; 48 : 198–206.
8. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up (dagger). Ann Oncol. 2020; S0923-7534 (20) 42469-X.
9. Dohner H, Stilgenbauer S, Benner A, et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med. 2000; 343 : 1910–1916.
10. Ghia P, Stamatopoulos K, Belessi C, et al. ERIC recommendations on IGHV gene mutational status analysis in chronic lymphocytic leukemia. Leukemia. 2007; 21 : 1–3.
11. Malcikova J, Tausch E, Rossi D, et al. ERIC recommendations for TP53 mutation analysis in chronic lymphocytic leukemia-update on methodological approaches and results interpretation. Leukemia. 2018; 32 : 1070–1080.
12. Pospisilova S, Gonzalez D, Malcikova J, et al. ERIC recommendations on TP53 mutation analysis in chronic lymphocytic leukemia. Leukemia. 2012; 26 : 1458–1461.
13. Brejcha M, Stoklasova M, Brychtova Y, et al. Clonal evolution in chronic lymphocytic leukemia detected by fluorescence in situ hybridization and conventional cytogenetics after stimulation with CpG oligonucleotides and interleukin-2: a prospective analysis. Leuk Res. 2014; 38 : 170–175.
14. Malcikova J, Tausch E, Rossi D, et al. ERIC recommendations for TP53 mutation analysis in chronic lymphocytic leukemia-update on methodological approaches and results interpretation. Leukemia 2018; 32 (5): 1070–1080.
15. Pospisilova S, Gonzalez D, Malcikova J, et al. ERIC recommendations on TP53 mutation analysis in chronic lymphocytic leukemia. Leukemia. 2012; 26 : 1458–1461.
16. Baliakas P, Hadzidimitriou A, Sutton LA, et al. Recurrent mutations refine prognosis in chronic lymphocytic leukemia. Leukemia. 2015; 29 : 329–336.
17. Malcikova J, Pavlova S, Kozubik KS, Pospisilova S. TP53 mutation analysis in clinical practice: lessons from chronic lymphocytic leukemia. Hum Mutat. 2014; 35 : 663–671.
18. Baliakas P, Iskas M, Gardiner A, et al. Chromosomal translocations and karyotype complexity in chronic lymphocytic leukemia: a systematic reappraisal of classic cytogenetic data. Am J Hematol. 2014; 89 : 249–255.
19. Stevens-Kroef M, Simons A, Rack K, Hastings RJ. Cytogenetic nomenclature and reporting. Methods Mol Biol. 2017; 1541 : 303–309.
20. Hastings RJ, Cavani S, Bricarelli FD, Patsalis PC, Kristoffersson U, Co-ordinators EP. Cytogenetic guidelines and quality assurance: a common European framework for quality assessment for constitutional and acquired cytogenetic investigations. Eur J Hum Genet. 2007; 15 : 525–527.
21. Baliakas P, Jeromin S, Iskas M, et al. Cytogenetic complexity in chronic lymphocytic leukemia: definitions, associations, and clinical impact. Blood. 2019; 133 : 1205–1216.
22. International CLLIPIwg. An international prognostic index for patients with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of individual patient data. Lancet Oncol. 2016; 17 : 779–790.
23. Condoluci A, Terzi di Bergamo L, Langerbeins P, et al. International prognostic score for asymptomatic early-stage chronic lymphocytic leukemia. Blood. 2020; 135 : 1859–1869.
24. Smolej L, Turcsányi P, Kubová Z, et al. External validation of International Prognostic Score for asymptomatic early-stage chronic lymphocytic leukaemia and proposal of an alternative score. Br J Haematol. 2020; doi: 10.1111/bjh.17074. Online ahead of print.
25. Eichhorst B, Robak T, Montserrat E, et al. Chronic lymphocytic leukaemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-updagger. Ann Oncol. 2020; S0923-7534 (20) 42469-X.
26. Furstenau M, Bahlo J, Fink AM, et al. Residual abdominal lymphadenopathy after intensive frontline chemoimmunotherapy is associated with inferior outcome independently of minimal residual disease status in chronic lymphocytic leukemia. Leukemia. 2020; 34 : 924–928.
27. Al-Sawaf O, Bazeos A, Robrecht S, et al. Mode of progression after first line treatment correlates with outcome of chronic lymphocytic leukemia (CLL). Am J Hematol. 2019; 94 : 1002–1006.
28. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976; 16 : 31–41.
29. Thurmes P, Call T, Slager S, et al. Comorbid conditions and survival in unselected, newly diagnosed patients with chronic lymphocytic leukemia. Leuk Lymphoma. 2008; 49 : 49–56.
30. Extermann M, Overcash J, Lyman GH, Parr J, Balducci L. Comorbidity and functional status are independent in older cancer patients. J Clin Oncol. 1998; 16 : 1582–1587.
31. Goede V, Cramer P, Busch R, et al. Interactions between comorbidity and treatment of chronic lymphocytic leukemia: results of German Chronic Lymphocytic Leukemia Study Group trials. Haematologica. 2014; 99 : 1095–1100.
32. Parmelee PA, Thuras PD, Katz IR, Lawton MP. Validation of the cumulative illness rating scale in a geriatric residential population. J Am Geriatr Soc. 1995; 43 : 130–137.
33. Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc. 2008; 56 : 1926–1931.
34. Cheson BD, Byrd JC, Rai KR, et al. Novel targeted agents and the need to refine clinical end points in chronic lymphocytic leukemia. J Clin Oncol. 2012; 30 : 2820–2822.
35. Fischer K, Bahlo J, Fink AM, et al. Long-term remissions after FCR chemoimmu - notherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood. 2016; 127 : 208–215.
36. Eichhorst B, Fink AM, Busch R, et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016; 17 (7): 928–942.
37. Fischer K, Al-Sawaf O, Bahlo J, et al. Venetoclax and obinutuzumab in patients with CLL and coexisting conditions. N Engl J Med. 2019; 380 : 2225–2236.
38. Woyach JA, Ruppert AS, Heerema NA, et al. Ibrutinib Regimens versus chemoimmunotherapy in older patients with untreated CLL. N Engl J Med. 2018; 379 : 2517–2528.
39. Shanafelt TD, Wang XV, Kay NE, et al. Ibrutinib-rituximab or chemoimmunotherapy for chronic lymphocytic leukemia. N Engl J Med. 2019; 381 : 432–443.
40. Hallek M, Fischer K, Fingerle-Rowson G, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet. 2010; 376 : 1164–1174.
41. Farooqui MZ, Valdez J, Martyr S, et al. Ibrutinib for previously untreated and relapsed or refractory chronic lymphocytic leukaemia with TP53 aberrations: a phase 2, single-arm trial. Lancet Oncol. 2015; 16 : 169–176.
42. Burger JA, Barr PM, Robak T, et al. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia. 2020; 34 : 787–798.
43. Singh M, Mealing S, Baculea S, Cote S, Whelan J. Impact of novel agents on patient-relevant outcomes in patients with previously untreated chronic lymphocytic leukemia who are not eligible for fludarabine-based therapy. J Med Econ. 2017; 20 : 1066–1073.
44. Burger JA, Sivina M, Jain N, et al. Randomized trial of ibrutinib vs ibrutinib plus rituximab in patients with chronic lymphocytic leukemia. Blood. 2019; 133 : 1011–1019.
45. Wierda WG, Byrd JC, Abramson JS, et al. Chronic lymphocytic leukemia/small lymphocytic lymphoma, version 4.2020, NCCN clinical practice guidelines in oncology. J Natl Compr Canc Netw. 2020; 18 : 185–217.
46. Hillmen P, Skotnicki AB, Robak T, et al. Alemtuzumab compared with chlorambucil as first-line therapy for chronic lymphocytic leukemia. J Clin Oncol. 2007; 25 : 5616–5623.
47. Eichhorst B, Fink AM, Bahlo J, et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016; 17 : 928–942.
48. Zelenetz AD, Gordon LI, Wierda WG, et al. Chronic lymphocytic leukemia/small lymphocytic lymphoma, version 1. 2015. J Natl Compr Canc Netw. 2015; 13 : 326–362.
49. Michallet AS, Rossignol J, Cazin B, Ysebaert L. Rituximab-cyclophosphamide-dexamethasone combination in management of autoimmune cytopenias associated with chronic lymphocytic leukemia. Leuk Lymphoma. 2011; 52 : 1401–1403.
50. Sharman JP, Egyed M, Jurczak W, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet. 2020; 395 : 1278–1291.
51. Moreno C, Greil R, Demirkan F, et al. Ibrutinib plus obinutuzumab versus chlorambucil plus obinutuzumab in first-line treatment of chronic lymphocytic leukaemia (iLLUMINATE): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol. 2019; 20 : 43–56.
52. Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014; 370 : 1101–1110.
53. Goede V, Fischer K, Engelke A, et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: updated results of the CLL11 study. Leukemia. 2015; 29 : 1602–1604.
54. Michallet AS, Aktan M, Hiddemann W, et al. Rituximab plus bendamustine or chlorambucil for chronic lymphocytic leukemia: primary analysis of the randomized, open-label MABLE study. Haematologica. 2018; 103 : 698–706.
55. Hillmen P, Gribben JG, Follows GA, et al. Rituximab plus chlorambucil as first-line treatment for chronic lymphocytic leukemia: Final analysis of an open-label phase II study. J Clin Oncol. 2014; 32 : 1236–1241.
56. Fischer K, Al-Sawaf O, Fink AM, et al. Venetoclax and obinutuzumab in chronic lymphocytic leukemia. Blood. 2017; 129 : 2702–2705.
57. Al-Sawaf O, Zhang C, Tandon M, et al. Venetoclax plus obinutuzumab versus chlorambucil plus obinutuzumab for previously untreated chronic lymphocytic leukaemia (CLL14): follow-up results from a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21 : 1188–1200.
58. Sinha R, Redekop WK. Cost-effectiveness of ibrutinib compared with obinutuzumab with chlorambucil in untreated chronic lymphocytic leukemia patients with comorbidities in the United Kingdom. Clin Lymphoma Myeloma Leuk. 2018; 18: e131–e142.
59. Smolej L. Therapy of elderly/comorbid patients with chronic lymphocytic leukemia. Curr Pharm Des. 2012; 18 : 3399–3405.
60. Simkovic M, Motyckova M, Belada D, et al. Five years of experience with rituximab plus high-dose dexamethasone for relapsed/refractory chronic lymphocytic leukemia. Arch Med Sci. 2016; 12 : 421–427.
61. Smolej L, Doubek M, Panovska A, et al. Rituximab in combination with high-dose dexamethasone for the treatment of relapsed/refractory chronic lymphocytic leukemia. Leuk Res. 2012; 36 (10): 1278-82.
62. Ghia P, Pluta A, Wach M, et al. ASCEND: Phase III, randomized trial of acalabrutinib versus idelalisib plus rituximab or bendamustine plus rituximab in relapsed or refractory chronic lymphocytic leukemia. J Clin Oncol. 2020; 38 : 2849–2861.
63. Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med. 2013; 369 : 32–42.
64. Byrd JC, Brown JR, O‘Brien S, et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med. 2014; 371 : 213–223.
65. Byrd JC, Furman RR, Coutre SE, et al. Three-year follow-up of treatment-naive and previously treated patients with CLL and SLL receiving single-agent ibrutinib. Blood. 2015; 125 : 2497–2506.
66. Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med. 2014; 370 : 997–1007.
67. Sharman JP, Coutre SE, Furman RR, et al. Final results of a randomized, phase III study of rituximab with or without idelalisib followed by open-label idelalisib in patients with relapsed chronic lymphocytic leukemia. J Clin Oncol. 2019; 37 : 1391–1402.
68. Roberts AW, Davids MS, Pagel JM, et al. Targeting BCL2 with venetoclax in relapsed chronic lymphocytic leukemia. N Engl J Med. 2016; 374 : 311–322.
69. Stilgenbauer S, Eichhorst B, Schetelig J, et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, open-label, phase 2 study. Lancet Oncol. 2016; 17 : 768–778.
70. Seymour JF, Mobasher M, Kater AP. Venetoclax-rituximab in chronic lymphocytic leukemia. N Engl J Med. 2018; 378 : 2143–2144.
71. Seymour JF, Kipps TJ, Eichhorst BF, et al. Four-year analysis of Murano study confirms sustained benefit of time-limited venetoclax-rituximab (VenR) in relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL). Blood. 2019; 134 : 355–355.
72. Kater AP, Wu JQ, Kipps T, et al. Venetoclax plus rituximab in relapsed chronic lymphocytic leukemia: 4-year results and evaluation of impact of genomic complexity and gene mutations from the MURANO phase III study. J Clin Oncol. 2020; 38 (34): 4042-4054.
73. Chanan-Khan A, Cramer P, Demirkan F, et al. Ibrutinib combined with bendamustine and rituximab compared with placebo, bendamustine, and rituximab for previously treated chronic lymphocytic leukaemia or small lymphocytic lymphoma (HELIOS): a randomised, double-blind, phase 3 study. Lancet Oncol. 2016; 17 : 200–211.
74. Zelenetz AD, Barrientos JC, Brown JR, et al. Idelalisib or placebo in combination with bendamustine and rituximab in patients with relapsed or refractory chronic lymphocytic leukaemia: interim results from a phase 3, randomised, double-blind, placebo-controlled trial. Lancet Oncol. 2017; 18 : 297–311.
75. Keating MJ, Flinn I, Jain V, et al. Therapeutic role of alemtuzumab (Campath-1H) in patients who have failed fludarabine: results of a large international study. Blood. 2002; 99 : 3554–3561.
76. Stilgenbauer S, Zenz T, Winkler D, et al. Subcutaneous alemtuzumab in fludarabine-refractory chronic lymphocytic leukemia: clinical results and prognostic marker analyses from the CLL2H study of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2009; 27 : 3994–4001.
77. Fischer K, Cramer P, Busch R, et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2011; 29 : 3559–3566.
78. Cuneo A, Follows G, Rigolin GM, et al. Efficacy of bendamustine and rituximab as first salvage treatment in chronic lymphocytic leukemia and indirect comparison with ibrutinib: a GIMEMA, ERIC and UK CLL FORUM study. Haematologica 2018; 103 (7): 1209–1217.
79. Robak T, Dmoszynska A, Solal-Celigny P, et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol. 2010; 28 : 1756–1765.
80. Badoux XC, Keating MJ, Wang X, et al. Fludarabine, cyclophosphamide, and rituximab chemoimmunotherapy is highly effective treatment for relapsed patients with CLL. Blood. 2011; 117 : 3016–3024.
81. Awan FT, Hillmen P, Hellmann A, et al. A randomized, open-label, multicentre, phase 2/3 study to evaluate the safety and efficacy of lumiliximab in combination with fludarabine, cyclophosphamide and rituximab versus fludarabine, cyclophosphamide and rituximab alone in subjects with relapsed chronic lymphocytic leukaemia. Br J Haematol. 2014; 167 : 466–477.
82. Durot E, Michallet AS, Lepretre S, Le QH, Leblond V, Delmer A. Platinum and high-dose cytarabine-based regimens are efficient in ultra high/high-risk chronic lymphocytic leukemia and Richter‘s syndrome: results of a French retrospective multicenter study. Eur J Haematol. 2015; 95 : 160–167.
83. Wierda WG, Kipps TJ, Mayer J, et al. Ofatumumab as single-agent CD20 immunotherapy in fludarabine-refractory chronic lymphocytic leukemia. J Clin Oncol. 2010; 28 : 1749–1755.
84. Smolej L, Brychtova Y, Doubek M, et al. Low-dose FCR is a safe and effective treatment option for elderly/comorbid patients with chronic lymphocytic leukemia/small lymphocytic lymphoma. updated results of project Q-Lite by Czech CLL Study Group. Blood. 2014; 124 : 4670.
85. Mato AR, Hill BT, Lamanna N, et al. Optimal sequencing of ibrutinib, idelalisib, and venetoclax in chronic lymphocytic leukemia: results from a multicenter study of 683 patients. Ann Oncol. 2017; 28 : 1050–1056.
86. Mato AR, Roeker LE, Jacobs R, et al. Assessment of the efficacy of therapies following venetoclax discontinuation in CLL reveals BTK inhibition as an effective strategy. Clin Cancer Res. 2020; 26 : 3589–3596.
87. Bottcher S. Minimal residual disease quantification in chronic lymphocytic leukemia: clinical significance and flow cytometric methods. Methods Mol Biol. 2019; 1881 : 211–238.
88. Del Giudice I, Raponi S, Della Starza I, et al. Minimal residual disease in chronic lymphocytic leukemia: a new goal? Front Oncol. 2019; 9 : 689.
89. Logan AC, Zhang B, Narasimhan B, et al. Minimal residual disease quantification using consensus primers and high-throughput IGH sequencing predicts post-transplant relapse in chronic lymphocytic leukemia. Leukemia. 2013; 27 : 1659–1665.
90. Dreger P, Corradini P, Kimby E, et al. Indications for allogeneic stem cell transplantation in chronic lymphocytic leukemia: the EBMT transplant consensus. Leukemia. 2007; 21 : 12–17.
91. Dreger P, Schetelig J, Andersen N, et al. Managing high-risk CLL during transition to a new treatment era: stem cell transplantation or novel agents? Blood. 2014; 124 : 3841–3849.
92. Dreger P, Michallet M, Bosman P, et al. Ibrutinib for bridging to allogeneic hematopoietic cell transplantation in patients with chronic lymphocytic leukemia or mantle cell lymphoma: a study by the EBMT Chronic Malignancies and Lymphoma Working Parties. Bone Marrow Transplant. 2019; 54 : 44–52.
93. Schetelig J, Chevallier P, van Gelder M, et al. Idelalisib treatment prior to allogeneic stem cell transplantation for patients with chronic lymphocytic leukemia: a report from the EBMT Chronic Malignancies Working Party. Bone Marrow Transplant 2020; doi: 10.1038/s41409-020-01069-w. Online ahead of print.
94. Dreger P, Ghia P, Schetelig J, et al. High-risk chronic lymphocytic leukemia in the era of pathway inhibitors: integrating molecular and cellular therapies. Blood. 2018; 132 : 892–902.
95. Vitale C, Montalbano MC, Salvetti C, et al. Autoimmune complications in chronic lymphocytic leukemia in the era of targeted drugs. Cancers (Basel). 2020; 12 (2): 282.
96. D‘Arena G, Guariglia R, La Rocca F, et al. Autoimmune cytopenias in chronic lymphocytic leukemia. Clin Dev Immunol. 2013; 2013 : 730131.
97. Fattizzo B, Barcellini W. Autoimmune cytopenias in chronic lymphocytic leukemia: focus on molecular aspects. Front Oncol. 2019; 9 : 1435.
98. Jeon K, Kim M, Lee J, et al. Immature platelet fraction: A useful marker for identifying the cause of thrombocytopenia and predicting platelet recovery. Medicine (Baltimore). 2020; 99: e19096.
99. Rossi D, Gaidano G. Richter syndrome: molecular insights and clinical perspectives. Hematol Oncol. 2009; 27 : 1–10.
100. Parikh SA, Kay NE, Shanafelt TD. How we treat Richter syndrome. Blood. 2014; 123 : 1647–1657.
101. Parikh SA, Shanafelt TD. Risk factors for Richter syndrome in chronic lymphocytic leukemia. Curr Hematol Malig Rep. 2014; 9 : 294–299.
102. Mauro FR, Chauvie S, Paoloni F, et al. Diagnostic and prognostic role of PET/CT in patients with chronic lymphocytic leukemia and progressive disease. Leukemia. 2015; 29 : 1360–1365.
103. Osterborg A, Foa R, Bezares RF, et al. Management guidelines for the use of alemtuzumab in chronic lymphocytic leukemia. Leukemia. 2009; 23 : 1980–1988.
104. Smolej L, Prochazka V, Spacek M, et al. Doporučení pro léčbu alemtuzumabem u chronické lymfocytární leukemie. Vnitr Lek 2012; 58 : 232–236.
105. Moia R, Diop F, Favini C, Kodipad AA, Gaidano G. Potential of BCL2 as a target for chronic lymphocytic leukemia treatment. Expert Rev Hematol. 2018; 11 (5): 391-402.
106. Gribben JG. Practical management of tumour lysis syndrome in venetoclax-treated patients with chronic lymphocytic leukaemia. Br J Haematol. 2020; 188 : 844–851.
107. Tambaro FP, Wierda WG. Tumour lysis syndrome in patients with chronic lymphocytic leukaemia treated with BCL-2 inhibitors: risk factors, prophylaxis, and treatment recommendations. Lancet Haematol. 2020; 7: e168–e176.
108. Oscier D, Dearden C, Eren E, et al. Guidelines on the diagnosis, investigation and management of chronic lymphocytic leukaemia. Br J Haematol. 2012; 159 : 541–564.
109. Dhalla F, Lucas M, Schuh A, et al. Antibody deficiency secondary to chronic lymphocytic leukemia: should patients be treated with prophylactic replacement immunoglobulin? J Clin Immunol. 2014; 34 : 277–282.
110. Shanafelt T. Treatment of older patients with chronic lymphocytic leukemia: key questions and current answers. Hematology Am Soc Hematol Educ Program. 2013; 2013 : 158–167.
111. Bokemeyer C, Aapro MS, Courdi A, et al. EORTC guidelines for the use of erythropoietic proteins in anaemic patients with cancer: 2006 update. Eur J Cancer. 2007; 43 : 258–270.
112. Aapro MS, Bohlius J, Cameron DA, et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer. 2011; 47 : 8–32.
113. Tsimberidou AM, Wen S, McLaughlin P, et al. Other malignancies in chronic lymphocytic leukemia/small lymphocytic lymphoma. J Clin Oncol. 2009; 27 : 904–910.
114. Pospisilova S, Jarosova M, Doubek M. Chronická lymfocytární leukemie – současné využití moderních prognostických a prediktivních faktorů v diagnostice. Transfuze Hematol dnes. 2019; 25; 66–71.
115. Flinn IW, Hillmen P, Montillo M, et al. The phase 3 DUO trial: duvelisib vs ofatumumab in relapsed and refractory CLL/SLL. Blood. 2018; 132 : 2446–2455.
116. Rogers KA, Huang Y, Ruppert AS, et al. Phase 1b study of obinutuzumab, ibrutinib, and venetoclax in relapsed and refractory chronic lymphocytic leukemia. Blood. 2018; 132 : 1568–1572.
117. Banerji V, Anglin P, Christofides A, Doucette S, Laneuville P. Updates from the American Society of Hematology 2019 annual meeting: practice-changing studies in treatment-naive chronic lymphocytic leukemia. Curr Oncol. 2020; 27: e231–e245.
118. Tam CS, Robak T, Ghia P, et al. Zanubrutinib monotherapy for patients with treatment naive chronic lymphocytic leukemia and 17p deletion. Haematologica. 2020; doi: 10.3324/haematol.2020.259432, online ahead of print.
119. Porter DL, Hwang WT, Frey NV, et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med. 2015; 7 : 303ra139.
120. Mato AR, Thompson MC, Nabhan C, Svoboda J, Schuster SJ. Chimeric antigen receptor T-cell therapy for chronic lymphocytic leukemia: a narrative review. Clin Lymphoma Myeloma Leuk. 2017; 17 : 852–856.
121. Scarfo L, Chadzikonstantinou T, Rigolin GM, et al. COVID-19 severity and mortality in patients with chronic lymphocytic leukemia: a joint study by ERIC, the European Research Initiative on CLL, and CLL Campus. Leukemia. 2020; 34 (9): 2354–2363.
122. Mato A, Roeker LE, Lamanna N, et al. Outcomes of COVID-19 in patients with CLL: a multicenter international experience. Blood. 2020; 136 (10): 1134–1143.
123. Rossi D, Shadman M, Condoluci A, et al. How we manage patients with chronic lymphocytic leukemia during the SARS-CoV-2 pandemic. Hemasphere. 2020; 4 (4): e432.
124. NICE 2020. COVID-19 rapid guideline: delivery of systemic anticancer treatments. www.nice.org.uk/guidance/ng161. Last updated 9 November 2020.
125. Jazieh AR, Chan SL, Curigliano G, et al. Delivering cancer care during the COVID-19 pandemic: recommendations and lessons learned from ASCO global webinars. JCO Glob Oncol. 2020; 6 : 1461–1471.
126. ASH. COVID-19 and CLL: Frequently Asked Questions. https: //www.hematology.org/covid-19/covid-19-and-cll. Version 4.0; last updated November 17, 2020.
Štítky
Hematológia Interné lekárstvo Onkológia
Článok vyšiel v časopiseTransfuze a hematologie dnes
Najčítanejšie tento týždeň
2021 Číslo 1- Nejasný stín na plicích – kazuistika
- Těžké menstruační krvácení může značit poruchu krevní srážlivosti. Jaký management vyšetření a léčby je v takovém případě vhodný?
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
-
Všetky články tohto čísla
- EDITORIAL
- Heparinem indukovaná trombocytopenie
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
- Jaké dávky inhibitorů tyrozinkináz jsou v léčbě pacientů s chronickou myeloidní leukemií optimální?
- Von Willebrandova choroba – porovnanie dvoch metód analýzy multimérov von Willebrandovho faktora
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Bolesti svalů jako vzácný autoimunitní projev při monoklonální IgM gamapatii – popis případu a přehled autoimunitních projevů monoklonálních imunoglobulinů
- Inhibítory faktora VIII – Výsledky imunotolerančnej indukcie v Národnom hemofi lickom centre a nové možnosti a prvé skúsenosti s liečbou bišpecifi ckou protilátkou (emicizumab) u pacientov s inhibítormi na Slovensku
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro diagnostiku a léčbu pacientů s hemofilií, vydání 3., rok 2021
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
-
Doc. MUDr. Miroslav Tomíška, CSc.,
slaví sedmdesáté životní jubileum - Zemřel profesor Jan Evangelista Dyr
- ZMĚNY V IMUNITNÍM SYSTÉMU U NELÉČENÝCH NEMOCNÝCH S CHRONICKOU LYMFOCYTÁRNÍ LEUKEMIÍ – ČÁST 2: NESPECIFICKÁ IMUNITA.
- Transfuze a hematologie dnes
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Heparinem indukovaná trombocytopenie
- Nález dimorfní populace erytrocytů na analyzátorech krevních buněk
- Doporučení pro diagnostiku a léčbu chronické lymfocytární leukemie 2021
- Nově používané molekuly v cílené léčbě akutní myeloidní leukemie – jejich nežádoucí účinky, komplikace terapie a významné lékové interakce
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



