-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 2)
Autori: T. Kälble; M. Lucan; G. Nicita; R. Sells; F. J. Burgos Revilla; M. Wiesel
Vyšlo v časopise: Urol List 2009; 7(2): 63-84
Kategória: Guidelines
OBSAH
4. TRANSPLANTAČNÍ TECHNIKY
- 4.1 Transplantace ledviny
- 4.1.1 Příprava transplantace
- 4.1.1.1 Ledvina
- 4.1.1.2 Žíla
- 4.1.1.3 Arterie
- 4.1.1.4 Ureter
- 4.1.2 Techniky užívané u dospělých pacientů
- 4.1.2.1 Přístup
- 4.1.2.2 Cévní anastomóza
- 4.1.2.3 Ureterální anastomóza
- 4.1.3 Speciální případy
- 4.1.3.1 Ledviny odebrané dětem o hmotnosti < 15 kg
- 4.1.3.2 Závislost na vaskulárním systému příjemce
- 4.1.3.3 Dětský pacient
- 4.1.4 Časné komplikace
- 4.1.4.1 Abscesy stěny
- 4.1.4.2 Močové píštěle
- 4.1.4.3 Arteriální trombóza
- 4.1.4.4 Žilní trombóza
- 4.1.5 Pozdní komplikace
- 4.1.5.1 Ureterální stenóza
- 4.1.5.2 Refluxní a akutní pyelonefritida
- 4.1.5.3 Nefrolitiáza
- 4.1.5.4 Stenóza renální arterie
- 4.1.5.5 Arterio-venózní nebo arterio-kaly-ceální píštěle po biopsii ledviny
- 4.1.5.6 Lymfokéla
- 4.1.6 Literatura
- 4.1.1 Příprava transplantace
- 4.2 Transplantace ledviny u pacientů s abnormálními močovými
cestami
- 4.2.1 Literatura
5. PŘIŘAZENÍ DÁRCE A PŘÍJEMCE
- 5.1 Přiřazení příjemce na základě histokompatibility
(HLA)
- 5.1.1 Praktické aspekty testování HLA
- 5.2 Křížová zkouška
- 5.3 Preexistující specifické protilátky proti HLA
- 5.4 Alokace na základě systému krevních skupin ABO
- 5.5 Virové onemocnění
- 5.5.1 Cytomegalovirus (CMV)
- 5.5.2 Hepatitida typu B (HBV) a typu C (HCV)
- 5.6 Literatura
6. IMUNOSUPRESE PO TRANSPLANTACI LEDVINY
- 6.1 Úvod
- 6.2 Primární profylaxe imunosupresivy
- 6.2.1 Cyklosporin A
- 6.2.2 Tacrolimus
- 6.2.3 Mykofenolát mofetil
- 6.2.4 Sirolimus
- 6.3 Literatura
7. KOMPLIKACE
- 7.1 Imunologické komplikace
- 7.1.1 Úvod
- 7.1.2 Hyperakutní rejekce (HAR)
- 7.1.2.1 Diagnostika
- 7.1.2.2 Léčba
- 7.1.2.3 Prevence
- 7.2 Akutní rejekce alograftu
- 7.2.1 Akutní rejekce vyvolaná prostřednictvím T-lymfocytů
- 7.2.1.1 Diagnostika
- 7.2.1.2 Léčba
- 7.2.2 Rejekce vyvolaná prostřednictvím protilátek (akutní humorální rejekce)
- 7.2.2.1 Diagnostika a léčba
- 7.2.3 Křížová zkouška
- 7.2.1 Akutní rejekce vyvolaná prostřednictvím T-lymfocytů
- 7.3 Chronická rejekce alograftu (CAR,
humorální či
neznámá patogeneze)
- 7.3.1 Úvod
- 7.3.2 Diagnostika a léčba
- 7.4 Literatura
- 7.5 Maligní onemocnění
- 7.5.1 Dřívější maligní onemocnění příjemce
- 7.5.1.1 Recidiva neoplazie
- 7.5.1.2 Latentní asymptomatická neoplazie
- 7.5.2 Přenos neoplazie z dárce na příjemce
- 7.5.3 Vznik nového tumoru po transplantaci
- 7.5.4 Každoroční screening příjemce orgánu
- 7.5.4.1 Dermatologické vyšetření
- 7.5.4.2 Vyšetření lymfatických uzlin
- 7.5.4.3 Gynekologické vyšetření
- 7.5.4.4 Vyšetření prostatické žlázy
- 7.5.4.5 Vyšetření na okultní krvácení ve stolici
- 7.5.4.6 Cytologické vyšetření moči
- 7.5.4.7 Ultrazvukové vyšetření ledviny
- 7.5.4.8 RTG vyšetření hrudníku
- 7.5.5 Závěr
- 7.5.1 Dřívější maligní onemocnění příjemce
- 7.6 Literatura
8. PŘEŽITÍ PACIENTA A GRAFTU
- 8.1 Zemřelí a žijící dárci
- 8.1.1 Přežití graftu
- 8.1.2 Přežití pacienta
- 8.2 Věk příjemce a dárce
- 8.2.1 Věk dárce
- 8.2.2 Věk příjemce
- 8.3 Shoda v HLA systému
- 8.4 Imunosuprese
- 8.4.1 Počet transplantací
- 8.4.2 Doba trvání studené ischemie
- 8.4.3 Abnormalita dolních urogenitálních cest
- 8.5 Literatura
9. ZKRATKY UŽITÉ V TEXTU
4. TRANSPLANTAČNÍ TECHNIKY
4.1 Transplantace ledviny
4.1.1 Příprava transplantace
- připravíme „backtable“ se sterilní ledovou tříští o teplotě 4 °C
4.1.1.1 Ledvina
- odstraníme perirenální tuk
- renální tuk bychom měli udržet kolem hilu ledviny a močovodu
- ujistíme se o absenci tumorů ledviny
- ledvinu propláchneme (prostřednictvím renální arterie) sérem o teplotě 4 °C
4.1.1.2 Žíla
- na „backtable“ provedeme odběr ledviny spolu s infrarenální dolní dutou žílou, kterou použijeme k prodloužení renální žíly [1,3,14,17]
- provedeme podvaz kolaterál
4.1.1.3 Arterie
- zachováme terčík aorty
- v případě, že je v ostiu přítomen aterom, terčík aorty odstraníme
- v případě většího počtu arterií bez terčíku provedeme na „backtable“ korekci s cílem zkrátit délku trvání vaskulární anastomózy [4,8,35]
4.1.1.4 Ureter
- přesvědčíme se, zda není přítomen zdvojený močovod
- peripyelický a periureterální tuk obsahující cévní zásobení ponecháme na svém místě
4.1.2 Techniky užívané u dospělých pacientů
4.1.2.1 Přístup
- extraperitoneální přístup k jedné fossa iliaca
- upřednostňujeme transplantaci do kontralaterální fossa iliaca, čímž zajistíme, že renální žíla a ureter zůstanou na povrchu a nedojde k jejich kompresi
- abychom předešli vzniku lymfokély, je nezbytné pečlivé provedení lymfostázy pomocí klipů a ligatur
4.1.2.2 Cévní anastomóza
- žílu implantujeme k zevní iliacké žíle
- arterii implantujeme k zevní (nebo společné) iliacké arterii. Pokusíme se vyhnout ateromatózním plakům.
- ujistíme se, že cévy, které se chystáme transplantovat, se v těle příjemce nacházejí v dobré poloze
- obě anastomózy provedeme pomocí dvou polovin nevstřebatelné monofilamentózní sutury (5 × 0 nebo 6 × 0)
- interní iliackou arterii ponecháme nedotčenu, poranění arterie může vést ke vzniku erektilní dysfunkce [21]
4.1.2.3 Ureterální anastomóza
- metodou volby je ureterovezikální implantace provedená extravezikálně na anteriorní povrch vertexu močového měchýře pomocí antirefluxní Lich-Gregoirovy techniky [22]
- močovod přišijeme ke sliznici močového měchýře pomocí dvou polovin pokračovací vstřebatelné 5 × 0 sutury
- tato technika umožňuje dosáhnout lepších výsledků než otevřená implantace do močového měchýře (tj. Leadbetter-Politano ureteroneocystostomie) [43,45]
- s cílem usnadnit a ochránit anastomózu můžeme zavést 16cm, 6F nebo 7F double-stent. Zavedení stentu doporučujeme zvláště v případě obtížné anastomózy, např. při transplantaci dětského orgánu. Řada transplantačních týmů zavádí stent zcela rutinně [6,7,34, 36,46]. Stent musí být odstraněn během 4–6 týdnů po transplantaci.
- s výjimkou speciálních případů uretero-ureterální anastomózu neprovádíme, pokud se snažíme zachovat močovod (v případě operačních komplikací nebo u třetí transplantace)
4.1.3 Speciální případy
4.1.3.1 Ledviny odebrané dětem o hmotnosti < 15 kg
V tomto případě je vhodné provedení en-bloc transplantace, která zahrnuje následující postup:
- proximální část aorty uzavřeme pomocí sutury, její distální část implantujeme k zevní iliacké arterii
- distální část vena cava inferior uzavřeme přešitím a její proximální část připevníme pomocí anastomózy k zevní iliacké žíle
- alternativní metodou je vložení dárcovy aorty do zevní iliacké arterie (v případě, že jsou cévy kongruentní) a terčíku vena cava inferior k zevní iliacké žíle
- oba močovody připojíme anastomózou do močového měchýře pomocí jednoho tunelu podle Lich-Gregoirovy techniky
4.1.3.2 Závislost na vaskulárním systému příjemce
V případě, že není možné iliacké arterie zasvorkovat:
- před anastomózou provedeme endarterektomii všech iliackých tepen a fixujeme intimu pomocí sutury ve tvaru písmene U
- v případě, že provedení endarterektomie není možné, provedeme přemostění pomocí arterie ze stejného dárce nebo pomocí protézy [38]
- pokud byla dříve použita protéza, provedeme reimplantaci renální arterie do této protézy resekcí malého segmentu její stěny [20]
- pokud nemáme z důvodu přítomnosti anomálie nebo trombózy k dispozici normální vena cava inferior, můžeme pro venózní anastomózu použít gonadální žílu nebo původní renální žílu příjemce
4.1.3.3 Dětský pacient
Nepoměrný rozdíl mezi velikostí transplantátu a velikostí dítěte-příjemce může představovat mimořádné problémy. Větší ledvinu je nutné umístit výše, směrem k bederní jámě, renální arterii připojíme pomocí anastomózy k aortě a renální žílu k vena cava příjemce. Obecně však lze při transplantaci ledviny u dětí použít také fossa iliaca [18,26].
4.1.4 Časné komplikace
4.1.4.1 Abscesy stěny
Incidence abscesů stěny je vyšší u obézních a starších pacientů [27]. Vzniku abscesu lze předejít pomocí následujících opatření:
- profylaktickou aplikací antibiotik
- podkožní aspirační drenáží u obézních pacientů
- pečlivým uzavřením podkožní vrstvy
4.1.4.2 Močové píštěle
Močové píštěle představují nejčastější časnou komplikaci. Píštěle vznikají u 3–5 % pacientů, u nichž nebyl zaveden double-J stent. Píštěl může být lokalizovaná v močovodu, močovém měchýři nebo kalichu:
- v močovodu představuje nejčastější příčinu píštěle nekróza močovodu, způsobená ischemií, virovou komplikací (BK, CMV) [24], rejekcí nebo dehiscencí anastomózy
- v močovém měchýři vzniká píštěl následkem nevodotěsného uzavření
- v kalichu vzniká píštěl následkem nekrózy způsobené podvazem polární arterie [39]
Léčba: Močové píštěle lze léčit pomocí otevřené nebo perkutánní operace.
- otevřená operace – znovuotevřeme incizi provedenou při transplantaci. Močovod protneme a s použitím původního pacientova močovodu provedeme uretero-ureterální anastomózu se zavedením double-J stentu [10,19].
- perkutánní léčba – v případě, kdy je možné píštěl lokalizovat, doporučujeme pokusit se o nefrostomii a/nebo zavedení katétru do močového měchýře a double-J stentu
- vezikální píštěl lze řešit zavedením suprapubického nebo transuretrálního katétru. Pokud je píštěl lokalizovaná v kalichu, zavedeme pacientovi nefrostomii nebo katétr do močového měchýře a double-J stent. V případě selhání tohoto postupu můžeme přistoupit k resekci pólu ledviny [23].
Doporučení
- Doporučujeme užít krátký segment močovodu a periureterální tuk po-nechat kolem hilu a ureterálních cév [41].
- Vzhledem k riziku nekrózy parenchymu a vzniku píštěle je vhodné vyhnout se podvazu dolní polární arterie.
- Doporučujeme zavedení double-J stentu a katétru do močového měchýře.
4.1.4.3 Arteriální trombóza
Riziko arteriální trombózy během prvního týdne po transplantaci je 0,5 %. Rizikové faktory zahrnují:
- rupturu intimy nebo špatnou techniku sutury
- příliš vysokou vaskulární rezistenci
- pediatrickou transplantaci
Léčba: V tomto případě doporučujeme agresivní léčbu, tj. v případě trombózy transplantované ledviny je třeba provést opakovanou operační revizi, protože transplantovaná ledvina může být vaskularizovaná retrográdním průtokem žilní krve.
Doporučení
- Zachováme terčík aorty.
- Před provedením anastomózy se ujistíme, zda nedošlo k ruptuře intimy.
- Vyhneme se provedení plikace arterie.
- V případě absence terčíku aorty provedeme širokou anastomózu k zevní iliacké arterii, kterou otevřeme pomocí „punch“ perforátoru.
4.1.4.4 Žilní trombóza
Žilní trombóza představuje vzácně se vyskytující komplikaci, která se vyskytuje u přibližně 0,5 % pacientů po transplantaci ledviny. Agresivní léčba, tj. trombektomie, má pouze nízkou šanci na úspěch, ve výjimečných případech může být přesto účinná. Ve většině případů se transplantát odstraní.
Doporučení
- Abychom předešli anastomóze pod tahem, prodloužíme na pravé straně renální žílu pomocí infrarenální vena cava.
- Provedeme širokou žilní anastomózu; v případě, že je renální žíla při odstraňování svorek příliš napjatá, provedení žilní anastomózy opakujeme.
4.1.5 Pozdní komplikace
4.1.5.1 Ureterální stenóza
Kalichy ledviny i ledvinná pánvička jsou dilatované, často dochází ke zvýšení hladiny kreatininu. Tato stenóza vzniká u 5 % transplantátů a může se manifestovat až později – po jednom až deseti letech po transplantaci [29]. Ureterální stenóza může být způsobena následujícími třemi příčinami:
- Ureterální dilatace způsobená vysokým vezikálním tlakem, při zesílené stěně močového měchýře nebo močovou retencí.
- Vezikorenální reflux.
- Ureterovezikální stenóza vyvolaná zjizvením a/nebo špatnou operační technikou. Tento druh stenózy představuje 80 % všech případů ureterální stenózy.
Léčba: Stenózu lze léčit endoskopic-ky – transuretrálně nebo perkutánně. Dilatace dosahuje lepšího výsledku, pokud se stenóza vyskytuje časně po transplantaci a je lokalizována distálně [2,5,28,37,42]. Další možností je provedení otevřené operace pomocí uretero-ureterální anastomózy nebo vezikopyelostomie. Městnání moči u gravidních pacientek je vhodné řešit zavedením perkutánní nefrostomie nebo přechodným zavedením double-J katétru.
Doporučení
- Doporučujeme použít krátký ureter s dobrým cévním zásobením, který je obklopen periureterálním tukem.
- V poslední fázi sutury svaloviny se snažíme vyhnout stenóze anasto-mózy.
- Frekvenci ureterální stenózy mini-malizujeme zavedením double-J sten-tu.
4.1.5.2 Refluxní a akutní pyelonefritida
- akutní pyelonefritida představuje vzácnou komplikaci, incidence refluxu je vyšší
- reflux v renální dutině se vyskytuje až u 30 % pacientů podstupujících transplantaci pomocí reimplantace dle Leadbettera a u 80 % pacientů podstupujících transplantaci pomocí Lich-Gregoirovy techniky, pokud je tunel krátký, a v 10 % případů, pokud je dlouhý
- u pacientů s infekcí dolních cest močových je riziko akutní pyelonefritidy 80 % (za přítomnosti refluxu) a 10 % (při absenci refluxu) [31,32]
Léčba: U pacientů s refluxem komplikovaným akutní pyelonefritidou se doporučuje následující léčba:
- uretero-ureterální anastomóza (v případě, že původní ureter není refluxní), nebo
- ureterovezikální reimplantace s vy-tvořením dlouhého tunelu (v případě, že původní ureter je refluxní nebo nepouži-telný)
Doporučení
- Submukózní tunel ureterovezikální anastomózy by měl být 3–4 cm dlouhý.
- Za nezbytné se považuje předejít vzniku infekce dolních cest močových.
4.1.5.3 Nefrolitiáza
Nefrolitiáza může představovat komplikaci spojenou s transplantací ledviny – renální konkrementy mohou být transplantovány spolu s ledvinou, nebo se mohou vytvořit až po transplantaci graftu. Riziko vzniku nefrolitiázy u transplantovaného graftu je < 1 % [30]. Přítomnost nefrolitiázy se projevuje hematurií nebo obstrukcí [11]. Renální konkrementy lze léčit pomocí následujících alternativ:
- u některých konkrementů dojde ke spontánnímu vyloučení
- v naléhavém případě (pokud konkrementy způsobují obstrukci nebo anurii) je třeba zavést retrográdním způsobem double-J katétr nebo pod ultrazvukovou kontrolou perkutánní nefrostomii
- konkrementy lokalizované v kalichu ledviny a konkrementy o menší velikosti je vhodné odstranit pomocí extrakorporální litotrypse (ESWL)
- větší konkrementy lokalizované v kalichu ledviny odstraníme pomocí perkutánní nebo otevřené nefrolitotomie [13,16,25]
- ureterolitiáza vyžaduje provedení ESWL nebo ureteroskopie [9,12]
Doporučení
- U potenciálního příjemce je třeba léčit hyperparathyroidismus.
- Při anastomóze močových cest použijeme vstřebatelnou suturu.
- Dále je třeba vyléčit močovou obstrukci a infekci.
4.1.5.4 Stenóza renální arterie
Stenóza renální arterie se vyskytuje u přibližně 10 % pacientů. Toto onemocnění diagnostikujeme pomocí dopplerovské sonografie a arteriografie, které umožní identifikovat stenózu u pacientů s arteriální hypertenzí a/nebo zvýšenou hladinou kreatininu. Léčba zahrnuje následující možnosti:
- intervenční léčba není vždy nutná. U řady pacientů zabírá medikamentózní léčba, v některých případech může dojít k samovolné regresi stenózy.
- indikace pro intervenční léčbu závisí na stupni stenózy. Intervence je indikována v případě > 70% stenózy.
- transluminální dilatace je spojena s horšími výsledky než operační incize, díky svému snadnému provedení představuje transluminální dilatace léčbu první volby distální stenózy [33]
- otevřená operace je vyhrazena pro případy plikace nebo anastomotické stenózy a zahrnuje resekci s přímou implantací. Při korekci není vhodné užívat vena saphena.
Doporučení
- U dárce odstraníme arteriální terčík, který následně implantujeme při transplantaci [17].
- Zkontrolujeme intimu arterie, fixujeme ji a v případě přítomnosti léze arterii znovu incidujeme.
- Ledvinu umístíme před provedením anastomózy. V případě, že ledvinu transplantujeme do dolní části fossa iliaca, použijeme žílu, která je o 1–2 cm delší než arterie, ponecháme původní délku levé renální žíly, a abychom předešli ohnutí arterie, pravou renální žílu prodloužíme pomocí segmentu vena cava – arterie musí být přímá.
- Anastomóza nesmí být příliš těsná. V tomto případě excidujeme malý kousek stěny arterie a provedeme opakovanou anastomózu.
4.1.5.5 Arterio-venózní nebo arterio-kalyceální píštěle po biopsii ledviny
Tato komplikace se vyskytuje u přibližně 10 % případů. U většiny pacientů dojde ke spontánní regresi, v případě, že píštěl přetrvává, doporučujeme provedení embolizace.
Doporučení
Biopsie by neměla zasahovat příliš hluboko do hilu ledviny.
4.1.5.6 Lymfokéla
Lymfokéla vzniká jako následek nedostatečné lymfostázy iliackých cév nebo lymfatické sekrece v transplantované ledvině.
Léčba: Mírná lymfokéla (která nezpůsobuje kompresi iliackých cév nebo močovodu) nevyžaduje žádnou léčbu. Pokud je léčba nutná, provádíme marsupializaci otevřenou nebo laparoskopickou operací.
4.1.6 Literatura
1. Barry JM, Fuchs EF. Right renal vein extension in cadaver kidney transplantation. Arch Surg 1978; 113(3):300.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=346002&dopt= Abstract&itool=iconabstr
2. Benoit G, Alexandre L, Moukarzel M, Yataghene Y, Charpentier B, Jardin A. Percutaneous antegrade dilation of ureteral strictures in kidney transplants. J Urol 1993;150(1):37-39.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8510271&dopt= Abstract&itool=iconabstr
3. Benoit G, Hammoudi Y, Bellamy J, Besandoun H, Hiesse C, Charpentier B, Fries D, Jardin A. [Value of procuring the right kidney with the infrarenal inferior vena cava for transplantation.] Presse Med 1988; 17(24):1264. [French.]
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2969569&dopt= Abstract&itool=iconnoabstr
4. Benoit G, Hammoudi Y, Moukarzel M, Bellamy J, Bensadoun H, Charpentier B, Fries D. Renal transplant reparative ex vivo surgery: prevention of vascular complications. Clin Transplantation 1989;3 : 190-193.
5. Benoit G, Icard P, Bensadoun H, Charpentier B, Moukarzel M, Jardin A, Fries D. Value of antegrade ureteral dilation for late ureter obstruction in renal transplants. Transplant Int 1989;2(1):33-35.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2669802&dopt= Abstract&itool=iconabstr
6. Benoit G, Blanchet P, Eschwege P, Alexandre L, Bensadoun H, Charpentier B. Insertion of a double pigtail ureteral stent for the prevention of urological complications in renal transplantation: a prospective randomized study. J Urol 1996;156(3):881-884.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8709353&dopt= Abstract&itool=iconabstr
7. Bergmeijer JH, Nijman R, Kalkman E, Nauta J, Wolff ED, Molenaar JC. Stenting of the ureterovesical anastomosis in pediatric renal transplantation. Transplant Int 1990;3(3):146-148.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2271086&dopt= Abstract&itool=iconabstr
8. Brekke IB. Management of multiple renal transplant arteries. Transplant Int 1990;3(4):241.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2076175&dopt= Abstract&itool=iconnoabstr
9. Caldwell TC, Burns JR. Current operative management of urinary calculi after renal transplantation. J Urol 1988;140(6):1360-1363.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3057222&dopt= Abstract&itool=iconabstr
10. Campbell SC, Streem SB, Zelch M, Hodge E, Novick AC. Percutaneous management of transplant ureteral fistulas: patient selection and long-term results. J Urol 1993;150(4):1115-1117.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8371367&dopt= Abstract&itool=iconabstr
11. Caralps A, Lloveras J, Masramon J, Andreu J, Brulles A, Gil-Vernet JM. Urinary calculi after renal transplantation Lancet 1977;1(8010):544.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=65637&dopt= Abstract&itool=iconnoabstr
12. Cho DK, Zackson DA, Cheigh J, Stubenbord WT, Stenzel KH. Urinary calculi in renal transplant recipients. Transplantation 1988;45(5):899-902.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3285534&dopt= Abstract&itool=iconabstr
13. Minon Cifuentes J, Garcia Tapia E, Garcia de la Pena E, Vela Navarrete R, Alda A, Plaza J, Alferez C. Percutaneous nephrolithotomy in transplanted kidney. Urology 1991;38(3):232-234.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1887537&dopt= Abstract&itool=iconabstr
14. Corry RJ, Kelley SE. Technique for lengthening the right renal vein of cadaver donor kidneys. Am J Surg 1978;135(6):867.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=352170&dopt= Abstract&itool=iconnoabstr
15. Duepree HJ, Fornara P, Lewejohann JC, Hoyer J, Bruch HP, Schiedeck TH. Laparoscopic treatment of lymphoceles in patients after renal transplantation. Clin Transplant 2001;15(6):375-379.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11737112&dopt= Abstract&itool=iconabstr
16. Francesca F, Felipetto R, Mosca F, Boggi U, Rizzo G, Puccini R. Percutaneous nephrolithotomy of transplanted kidney. J Endourol 2002;16(4):225-227.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12042104&dopt= Abstract&itool=iconabstr
17. Fung LC, McLorie GA, Khoury AE, Churchill BM. Donor aortic cuff reduces the rate of anastomotic arterial stenosis in pediatric renal transplantation. J Urol 1995;154(2 Pt 2):909-913.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7609210&dopt= Abstract&itool=iconabstr
18. Furness PD 3rd, Houston JB, Grampsas SA, Karrer FM, Firlit CF, Koyle MA. Extraperitoneal placement of renal allografts in children weighing less than 15 kg. J Urol 2001;166(3):1042-1045.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11490294&dopt= Abstract&itool=iconabstr
19. Gallentine ML, Wright FH Jr. Ligation of the native ureter in renal transplantation. J Urol 2002; 167(1): 29-30.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11743268&dopt= Abstract&itool=iconabstr
20. George P, Tan HP, Beebe H, Ratner LE. Successful renal transplantation after endovascular bifurcated stent graft repair of an abdominal aortic aneurysm. Transplantation 2001;72(3):533-534.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11502990&dopt= Abstract&itool=iconabstr
21. Gittes RF, Waters WB. Sexual impotence: the overlooked complication of a second renal transplant. J Urol 1979;121(6):719-720.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=379364&dopt= Abstract&itool=iconabstr
22. Gregoir W. The Lich Gregoir operation. In: Eckstein HB. (ed.) Surgical pediatric urology. Philadelphia: WB Saunders, 1977, pp. 46, 265-267.
23. Gutierrez-Calzada JL, Ramos-Titos J, Gonzalez-Bonilla JA, Garcia-Vaquero AS, Martin-Morales A, Burgos-Rodriguez R. Caliceal fistula formation following renal transplantation: management with partial nephrectomy and ureteral replacement. J Urol 1995; 153(3 Pt 1):612-614.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7861495&dopt= Abstract&itool=iconabstr
24. Hricko GM, Birtch AG, Bennett AH, Wilson RE. Factors responsible of urinary fistula in the renal transplant recipient. Ann Surg 1973;178(5):609-615.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4583946&dopt= Abstract&itool=iconnoabstr
25. Hulbert JC, Reddy P, Young AT, Hunter DW, Castaneda-Zuniga W, Amplatz K, Lange PH. The percutaneous removal of calculi from transplanted kidneys. J Urol 1985;134(2):324-326.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3894698&dopt= Abstract&itool=iconabstr
26. Humar A, Arrazola L, Mauer M, Matas AJ, Najarian JS. Kidney transplantation in young children: should there be a minimum age? Pediatr Nephrol 2001; 16(12):941-945.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11793077&dopt= Abstract&itool=iconabstr
27. Humar A, Ramcharan T, Denny R, Gillingham KJ, Payne WD, Matas AJ. Are wound complications after a kidney transplant more common with modern immunosuppression? Transplantation 2001;72(12): 1920-1923.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11773889&dopt= Abstract&itool=iconabstr
28. Jones JW, Hunter DW, Matas AJ. Percutaneous treatment of ureteral strictures after renal transplantation. Transplantation 1993;55(5):1193-1195.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8497901&dopt= Abstract&itool=iconnoabstr
29. Kinnaert P, Hall M, Janssen F, Vereestraeten P, Toussaint C, Van Geertruyden J. Ureteral stenosis after kidney transplantation: true incidence and long-term followup after surgical correction. J Urol 1985; 133(1):17-20.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3880584&dopt= Abstract&itool=iconabstr
30. Lu HF, Shekarriz B, Stoller ML. Donor-gifted allograft urolithiasis: early percutaneous management Urology 2002;59(1):25-27.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11796274&dopt= Abstract&itool=iconabstr
31. Mastrosimone S, Pignata G, Maresca MC, Calconi G, Rabassini A, Butini R, Fandella A, Di Falco G, Chiara G, Caldato C, et al. Clinical significance of vesicoureteral reflux after kidney. Clin Nephrol 1993;40(1):38-45.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8358874&dopt= Abstract&itool=iconabstr
32. Nghiem DD, Goldman MH, Mendez GP, Lee HM. Significance of vesicoureteral reflux in renal transplantation. Urology 1981;18(6):542-545.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7032035&dopt= Abstract&itool=iconnoabstr
33. Nicita G, Villari D, Marzocco M, Li Marzi V, Trippitelli A, Santoro G. Endoluminal stent placement after percutaneous transluminal angioplasty in the treatment of post-transplant renal artery stenosis. J Urol 1998;159(1):34-37.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9400431&dopt= Abstract&itool=iconabstr
34. Nicol DL, P’Ng K, Hardie DR, Wall DR, Hardie IR. Routine use of indwelling ureteral stents in renal transplantation. J Urol 1993;150(5 Pt 1):1375-1379.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8411403&dopt= Abstract&itool=iconabstr
35. Oesterwitz H, Strobelt V, Scholz D, Mebel M. Extracorporeal microsurgical repair of injured multiple donor kidney arteries prior to cadaveric allotransplantation. Eur Urol 1985;11(2):100-105.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3891354&dopt= Abstract&itool=iconabstr
36. Ohl DA, Konnak JW, Campbell DA, Dafoe DC, Merion RM, Turcotte JG. Extravesical ureteroneocystostomy in renal transplantation. J Urol 1988 : 139(3): 499-502.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3278129&dopt= Abstract
37. Oosterhof GO, Hoitsma AJ, Debruyne FM. Antegrade percutaneous dilation of ureteral strictures after kidney transplantation. Transpl Int 1989; 2(1): 36-39.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2669803&dopt= Abstract&itool=iconabstr
38. Pampaloni F, Sanchez LJ, Bencini L, Taddei G. Simultaneous aortoiliac reconstruction and renal transplantation: is it safe? Chir Ital 2002;54(1):115-120.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11942002&dopt= Abstract&itool=iconabstr
39. Prompt CA, Manfro RC, Ilha De O, Koff WJ. Caliceal-cutaneous fistula in renal transplantation: successful conservative management. J Urol 1990; 143(3):580-581.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2304175&dopt= Abstract&itool=iconabstr
40. Ratner LE, Bender JS. A novel approach to the drainage of loculated perirenal allograft lymphoceles. Dual scope laparoscopy. Transplantation 1994;58(8): 961-964.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7940746&dopt= Abstract&itool=iconnoabstr
41. Salvatierra O Jr, Olcott C 4th, Amend WJ Jr, Cochrum KC, Freduska NJ. Urological complications of renal transplantation can be prevented or controlled. J Urol 1977;117(4):421-424.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=321807&dopt= Abstract&itool=iconabstr
42. Streem SB, Novick AC, Steinmuller DR, Zelch MG, Risius B, Geisinger MA. Long-term efficacy of ureteral dilation for transplant ureteral stenosis. J Urol 1988;140(1):32-35.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3288774&dopt= Abstract&itool=iconabstr
43. Thrasher JB, Temple DR, Spees EK. Extravesical versus Leadbetter-Politano ureteroneocystostomy: a comparison of urological complications in 320 renal transplants. J Urol 1990;144(5):1105-1109.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2231880&dopt= Abstract&itool=iconabstr
44. Tie ML, Rao MM, Russell C, Burapa K. Transperitoneal guide-wire or drainage catheter placement for guidance of laparoscopic marsupialization of lymphocoeles post-renal transplantation. Nephrol Dial Transplant 2001;16(5):1038-1041.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11328913&dopt= Abstract&itool=iconabstr
45. Waltke EA, Adams MB, Kauffman HM Jr, Sampson D, Hodgson NB, Lawson RK. Prospective randomized comparison of urologic complications in end-to-side versus Politano-Leadbetter ureteroneocystostomy in 131 human cadaver renal transplant. J Urol 1982; 128(6):1170-1172.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6759687&dopt= Abstract&itool=iconnoabstr
46. Witzel O. Extra-peritoneale ureterocystostomie nut schragkanalbildung. Zentralbl Gynaek 1896;20 : 289-293.
4.2 Transplantace ledviny u pacientů s abnormálními močovými cestami
Doporučení (úroveň důkazu: C)
- Technika implantace močovodu transplantované ledviny užívaná u pacientů s augmentovaným močovým měchýřem nebo vytvořeným konduitem je stejná jako u vlastních močovodů pacienta např. po cystektomii, u pacientů s karcinomem močového měchýře (Bricker, Wallace). Při augmentaci močového měchýře nebo při vytváření kontinentního rezervoáru jsou močovody implantovány pomocí tunelové techniky (Goodwin-Hohenfellner) nebo extravezikálně pomocí Lich-Gregoirovy, Matthisenovy nebo Leadbetterovy metody (tento přístup je upřednostňován u většiny pacientů) [1,2].
- Při ureterocystoplastice je možné provedení uretero-ureterostomie pomocí jednoho z pacientových močovodů [1].
- U pacientů s kontinentním ileocekálním rezervoárem s ubmilikálním stomatem nebo ileocystoplastikou/ileální neovezikou je nutné ledvinu transplantovat na kontralaterální levou stranu tak, aby transplantovaný močovod křížil dutinu břišní pod sigmoideem [2].
4.2.1 Literatura
1. Koo HP, Bunchman TE, Flynn JT, Punch JD, Schwartz AC, Bloom DA. Renal transplantation in children with severe lower urinary tract dysfunction. J Urol 1999;161(1):240-245.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10037414&dopt= Abstract&itool=iconabstr
2. Riedmiller H, Gerharz EW, Kohl U, Weingartner K. Continent urinary diversion in preparation for renal transplantation: a staged approach. Transplantation 2000;70(12):1713-1717.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11152102&dopt= Abstract&itool=iconabstr
5. PŘIŘAZENÍ DÁRCE A PŘÍJEMCE
Doporučení (úroveň důkazu: A a B)
U všech potenciálních kandidátů na transplantaci ledviny je nutné stanovit krevní skupinu ABO a HLA-A, -B a -DR fenotypy.
Abychom předešli hyperakutní rejekci transplantátu, je nutné před každou transplantací ledviny provést křížovou zkoušku (cross-matching).
5.1 Přiřazení příjemce na základě histokompatibility (HLA)
Testování na shodu v systému HLA (histokompatibilita) hraje při transplantaci ledvin významnou roli [4].
Výsledek transplantace odpovídá počtu neshod v systému HLA. Tyto neshody mají za následek proliferaci a aktivaci CD4+ a CD8+ T-buněk příjemce s následnou aktivací tvorby aloprotilátek produkovaných B-buňkami, což vede k buněčné a humorální rejekci graftu.
HLA antigeny vykazují značný polymorfismus [3]. HLA testování by mělo být zaměřeno zejména na HLA antigeny, které se podílejí na rejekci graftu po transplantaci. U všech potenciálních příjemců i dárců je nezbytné testovat následující fenotypy: HLA-A, HLA-B a HLA-DR. Ledviny z kadaverózních dárců je vhodné alokovat potenciálním dárcům s nejmenším počtem neshod v těchto HLA lokusech.
Stejný postup platí i pro transplantaci ledvin od žijících dárců, ačkoliv HLA-kompatibilita zde má méně významný dopad na výsledek než při transplantaci kadaverózních orgánů. Tento fakt může být způsoben tím, že při transplantaci orgánu od žijícího dárce lze další rizikové faktory pro rejekci graftu (např. dobu studené ischemie) minimalizovat.
5.1.1 Praktické aspekty testování HLA
- laboratoře, které zajišťují transplantačnímu centru HLA testování a křížovou zkoušku, musejí splňovat náročná kritéria (akreditační standardy) zaručující přesnost a spolehlivost výsledků
- buňky nutné pro testování HLA by měly pocházet z periferní krve dárce s vhodným antikoagulantem (např. kyselina ethylendiamintetraoctová – EDTA – nebo kyselina citrónová s dextrózou – ACD)
- testování je třeba provádět pomocí reagens umožňujících detekci všech běžně se vyskytujících antigenů v příslušném etniku
- technika typologie DNA se v současné době běžně užívá. Uvádění HLA antigenů by mělo odpovídat nejnovější WHO terminologii [5].
5.2 Křížová zkouška
Abychom zabránili hyperakutní rejekci T-buněk v transplantované ledvině, je nezbytné před každou transplantací provést křížovou zkoušku (cross-match). Křížová zkouška umožňuje detekci HLA-aloprotilátek v séru příjemce působících proti lymfocytům potenciálního dárce. Pro tyto účely se běžně užívá esej pro stanovení lymfocytotoxicity (detekce lymfocytotoxicity závislé na komplementu). Dále se provádí křížová zkouška na T - a B-buňky – křížová zkouška na B-buňky je senzitivnější na antigeny II. třídy (HLA-DR antigeny).
Je třeba si uvědomit možnost výskytu falešně pozitivních výsledků křížové zkoušky, zejména u pacientů s autoimunitním onemocněním, u nichž jsou často přítomny cirkulující auto-antigen protilátky IgM třídy. Tyto protilátky se nepodílejí na akutní rejekci, ve většině případů se jedná o non-HLA protilátky. Deaktivace IgM protilátek pomocí aplikace dithiothreitolu (DTT) a inkubací při 37 °C může minimalizovat výskyt falešně pozitivních výsledků křížové zkoušky.
Pro potvrzení pozitivních výsledků křížové zkoušky lze užít flow cytometrii. Tento postup je vhodný zejména u příjemců s vysokým rizikem akutní rejekce, jako jsou děti a pacienti s preexistujícími protilátkami [1].
5.3 Preexistující specifické protilátky proti HLA
U pacientů s transplantátem je nutné každé 3 měsíce pravidelně kontrolovat cirkulující hladinu anti-HLA protilátek [2]. Ke vzniku preexistujících HLA-protilátek mohlo u potenciálního příjemce dojít při krevní transfuzi, dřívější transplantaci orgánu nebo v průběhu těhotenství. Výsledná hodnota testování HLA-protilátek v séru příjemce se vyjadřuje jako panel reaktivních protilátek (v procentech – % PRA) a jako HLA specifita, proti níž reagují.
Při standardním CDC testu (lymfotoxicita závislá na komplementu) se obvykle užívá panel lymfocytů pokrývající většinu nejčastějších HLA-alel v dárcovské populaci. Běžně užívaný cytotoxický test je málo senzitivní na detekci anti-HLA protilátek II. třídy. „Noncomplement“ protilátky (např. IgG2) nejsou při tomto testu detekovány vůbec. Pro testování HLA-protilátek byly tedy vyvinuty specifičtější a senzitivnější testy (např. flow cytometrie a metody založené na enzymové imunoanalýze s enzymem vázaným na imunoabsorbent – metody ELISA).
U vysoce senzitivních pacientů (PRA > 80 %) na čekací listině je nezbytné provést pečlivou analýzu HLA protilátek, která umožní výběr vhodného schématu HLA u potenciálního dárce (odpovídající antigeny a přijatelné neshody) zajišťujícího negativní výsledek křížové zkoušky.
5.4 Alokace na základě systému krevních skupin ABO
Shoda na základě systému rozlišení antigenů krevních skupin ABO má při transplantaci ledviny nesmírný význam. Vzhledem k tomu, že ABO antigeny se chovají jako silné transplantační antigeny (tj. exprese v renálním vaskulárním endotelu), nesmí dojít k neshodě systému ABO, která způsobuje časnou hyperakutní rejekci.
Ledviny potenciálních dárců s krevní skupinou 0 lze teoreticky (navzdory zvýšenému riziku vzniku hemolytického onemocnění, které je vyvoláno B-buňkami dárce) transplantovat také pacientům s krevní skupinou A, B nebo AB. Abychom však zabránili zvětšujícímu se nepoměru mezi poptávkou a nabídkou kadaverózních orgánů u příjemců s krevní skupinou 0, je nezbytné zjistit ABO identitu.
Při transplantaci orgánů od žijících dárců je ABO kompatibilita stejně přijatelná jako ABO identita.
5.5 Virové onemocnění
Doporučení (úroveň důkazu: B a C)
Testování na přítomnost CMV infekce je nezbytné ke stanovení rizika vznikajícího CMV onemocnění u příjemce a navržení profylaktické léčby.
5.5.1 Cytomegalovirus (CMV)
CMV infekce představuje nejčastější virovou infekci vyskytující se u pacientů po transplantaci ledviny. Toto onemocnění může mít závažný klinický vliv na morbiditu pacienta a mortalitu a přežití graftu. Mezi CMV infekcí a příhodou akutní rejekce byla prokázána zcela zřejmá souvislost.
Před transplantací je nutné jak u dárce, tak u příjemce zhodnotit pomocí testu na protilátky IgG ELISA stav CMV infekce, což umožní stanovit riziko CMV u příjemce a v případě nutnosti navrhnout profylaktickou léčbu.
Příjemce s negativními protilátkami IgG CMV, kterému je transplantována ledvina od CMV pozitivního dárce, má velmi vysoké riziko vzniku primární CMV infekce, která je obvykle detekována 4–5 týdnů po transplantaci. U těchto příjemců tedy doporučujeme vhodnou profylaxi pomocí gangcykloviru.
U příjemců s pozitivními CMV protilátkami může dojít následkem reaktivace latentní virové infekce nebo nového kmene CMV ke vzniku sekundární CMV infekce.
5.5.2 Hepatitida typu B (HBV) a typu C (HCV)
Potenciální dárci s povrchovým antigenem hepatitidy B (HBsAg) musí být vyloučeni. Příjemci transplantátu s pozitivní HBsAg infekcí musí být velmi pečlivě monitorováni (testování funkce jater a měření replikace viru HBV DNA).
Pacienti s pozitivním testem hepatitidy C by měli být po transplantaci pečlivě monitorováni (pravidelné monitorování replikace viru HCV RNA a jaterních enzymů). Snížení imunosuprese (pokud je to možné) má u těchto pacientů pozitivní dopad na dlouhodobou funkci jater. Vzhledem k obavám týkajícím se dlouhodobé morbidity a mortality zůstává otázka transplantace HCV pozitivních orgánů HCV pozitivním příjemcům stále předmětem diskuze.
5.6 Literatura
1. EBPG (European Expert Group on Renal Transplantation; European Renal Association (ERA-EDTA); European Society for Organ transplantation (ESO). European best practice guidelines for renal transplantation (Part 1). Neprol Dial Transplant 2000; 15(Supp 7):1-85.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11286185&dopt =Abstract&itool=iconfft
2. Kasiske BL, Ramos EL, Gaston RS, Bia MJ, Danovitch GM, Bowen PA, Lundin PA, Murphy KJ. The evaluation of renal transplant candidates: clinical practice guidelines. Patient Care and Education Committee of the American Society of Transplant Physicians. J Am Soc Nephrol 1995;6(1):1-34.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7579061&dopt= Abstract&itool=iconnoabstr
3. Krensky AM, Clayberger C. Transplantation immunology. Pediatr Clin North Am 1994;41(4):819-839.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8047371&dopt= Abstract&itool=iconabstr
4. Opelz G, Wujciak T, Dohler B. Is HLA matching worth the effort? Collaborative Transplant Study Transplant Proc 1999;31(1-2):717-720.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10083307&dopt= Abstract&itool=iconnoabstr
5. Robinson J, Marsh SG. The IMGT/HLA sequence database Rev Immunogenet 2000;2(4):518-531.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12361093&dopt= Abstract&itool=iconabstr
6. IMUNOSUPRESE PO TRANSPLANTACI LEDVINY
Doporučení
- Profylaxe imunosupresivy by měla být indikována na dobu neurčitou, ačkoliv protokol může vyžadovat (a často vyžaduje) určitou úpravu z důvodu změny jednotlivých složek. Pacienti by měli být před transplantací důkladně informováni o nezbytnosti kompliance a účinku zvoleného režimu imunosuprese s ohledem na přežití graftu a riziko pro pacienta. Dále je nutné všechny pacienty informovat o riziku infekce, vzniku kardiovaskulárního nebo maligního onemocnění, jejichž incidence se při aplikaci současných imunosupresivních preparátů zvyšuje.
- Počáteční udržovací profylaxe na bázi cyklosporinu nebo tacrolimu představuje v současné době (alespoň do uvedení dlouhodobých výsledků novějších preparátů) nejlepší možnost. Abychom předešli nedostatečné imunosupresi (zvýšené riziko rejekce) nebo vyšší koncentraci preparátu v krvi zvyšující riziko výskytu chronických vedlejších výsledků, zejména nefrotoxicity, je nutné při aplikaci obou výše uvedených preparátů monitorovat jejich hladiny v krvi.
- Nemáme k dispozici žádné přesvědčivé důkazy,
že je možné aplikaci steroidů v rámci
makrolidové imunosuprese bezpečně vysadit; u pacientů, u nichž nedošlo k akutní
rejekci však lze jejich aplikaci po 6 měsících bezpečně ukončit. Mykofenolát
mofetil vzhledem k lepší účinnosti, přijatelnému terapeutickému indexu a hlavně
tím, že není nefrotoxický, prakticky nahradil azathioprin. Ve vhodných případech
lze u pacientů užívajících MMF a cyklosporin snížit dávkování cyklosporinu i prednisolonu nebo vysadit steroidy.
U pacientů užívajících MMF je nutné pravidelně monitorovat funkci kostní dřeně. - Doposud nemáme k dispozici dlouhodobé údaje týkající se přežití pacienta a graftu u pacientů užívajících tacrolimus plus MMF, které by nám umožnily posoudit bezpečnost a účinnost této léčby z hlediska dlouhodobého přežití graftu. Účinnost sirolimu, jehož aplikace snižuje výskyt časné rejekce, byla hodnocena v prospektivních kontrolovaných studiích po dobu déle než tři roky. Dostupnost pěti poměrně bezpečných a účinných preparátů však významně zvyšuje schopnost lékaře navrhnout pacientovi režim přesně „na míru“ podle jeho individuálních potřeb.
- Užívání polyklonálních nebo monoklonálních anti-T-buněčných biologických indukčních terapií je spojeno s určitým rizikem, zejména u pacientů, kteří nejsou přirozeně imunní vůči EBV nebo CMV. Tato terapie by neměla být rutinně indikována u pacientů s nízkým rizikem, kteří podstoupili první transplantaci. Před zahájením indukční terapie je nezbytné pacienta upozornit na rizika vzniku virového onemocnění a karcinomu.
- Lidské protilátky s vysokou afinitou nebo chimerické monoklonální protilátky (daclizumab, basiliximab) představují nákladnou léčbu, ale mohou být bezpečně indikovány v rámci indukční léčby spolu s makrolidovými imunosupresivy. Aplikace těchto preparátů pravděpodobně sníží frekvenci časné rejekce.
6.1 Úvod
Základní princip účinné imunosuprese spočívá v dosažení „rovnováhy přežití“ – tj. úkolem lékaře je zvolit dostatečnou dávku preparátu, který potlačí rejekci transplantátu, aniž by přitom ohrozil zdraví a život příjemce.
Lepší porozumění mechanismům, které se podílejí na imunitní rejekci, umožnilo vyvinout modernější a bezpečnější imunosupresiva, jejichž účinek spočívá přímo v potlačení aktivity senzitizovaných lymfocytů zacílené proti transplantátu. Před zavedením moderních preparátů však byla situace odlišná. Do roku 1962 docházelo po transplantaci k rejekci transplantovaných alograftů buď okamžitě, nebo v průběhu 6 měsíců, a to navzdory aplikaci vysokých dávek neselektivních imunosupresiv, jako jsou například vysoké dávky steroidů, ozařování celého organismu nebo drenáž hrudního duktu. V letech 1962–1982 byla zavedena léčba azathioprinem (Imuran) a prednisolonem, představující středně účinnou a levnou léčbu, která vedla u kadaverózních transplantátů k 60% přežití graftu během 1 roku.
Tato léčba však byla spojena s vysokým rizikem krvácení, sepse a metabolických poruch. Objev cyklosporinu A – inhibitoru T-buněk, který nepotlačoval kostní dřeň – zahájil novou éru bezpečnější a účinnější imunosuprese pro příjemce transplantátu. Dvě pilotní studie provedené v letech 1979–1983 poskytly jednoznačné důkazy o tom, že imunosuprese založená na aplikaci cyklosporinu umožňuje signifikantně lepší přežití graftu po 3 letech než imunosuprese založená na aplikaci azathioprinu. Co je však důležitější, imunosuprese založená na aplikaci cyklosporinu má lepší terapeutický index, protože umožňuje snížit dávku prednisolonu, a tak zabránit toxicitě kostní dřeně. Aplikace cyklosporinu a dalšího běžně užívaného makrolidu a inhibitoru kalcineurinu, tacrolimu, je spojena s výskytem závažných vedlejších účinků, které představují riziko jak pro transplantát, tak pro jeho příjemce. U většiny pacientů má cyklosporin nefrotoxické účinky a jeho dlouhodobá aplikace může vést k chronické nefropatii alograftu. Dále může způsobovat hypercholesterolemii, hypertenzi, hypertrofii dásní, hirsutismus a akné. Tacrolimus je silnější imunosupresivum, jeho aplikace je však spojena se vznikem diabetu, neurologických poruch a poruch rovnováhy elektrolytů a s nefrotoxicitou (ačkoliv méně než cyklosporin). Většina lékařů v letech 1983–1995 přesto nadšeně uvítala cyklosporin vzhledem k jeho lepší účinnosti a absenci toxicity kostní dřeně. Důsledkem tohoto „cyklosporinového období“ bylo ukázkové zlepšení přežití transplantátu při transplantaci ledviny a následně také při transplantacích pankreatu, srdce, jater a plic.
Současné přístupy usilují o dosažení přežití graftu po dobu 10 let. Farmaceutické firmy se pokoušejí vyvinout non-nefrotoxické, ale přesto silné selektivní imunosupresivum, které by mohlo být indikováno u pacientů po transplantaci. Mezi nováčky na trhu patří mykofenolát mofetil (MMF) – CellCept. Jedná se o „zkonstruovaný“ preparát, vytvořený na základě kyseliny mykofenolové – agens užívaném v sedmdesátých letech při léčbě revmatické artritidy. Jeho účinek spočívá v inhibici inosin monofosfát dehydrogenázy, a následně tedy inhibici rychlosti syntézy guanosinu monofosfátu v de novo purinové dráze, na níž závisí funkce a proliferace lymfocytů. Tento preparát není nefrotoxický, ve velké dávce (> 2 g denně) však způsobuje inhibici funkce kostní dřeně a až u 15 % pacientů může způsobovat průjem. Aplikace MMF v kombinaci s prednisolonem a cyklosporinem nebo tacrolimem umožnila snížit dávkování jednotlivých složek a přitom snížit míru rejekce graftu. Nový imunosupresivní preparát sirolimus (Rapamune) potlačuje proliferaci a diferenciaci lymfocytů. Dále inhibuje kalciové i nekalciové dráhy a blokuje signalizaci cytokinů na proliferaci T-buněk. Podobný účinek má sirolimus i na B-buňky. Bylo prokázáno, že v kombinaci s cyklosporinem lze sirolimus užít jako prevenci proti rejekci transplantátu, jeho aplikace je však v závislosti na velikosti dávky spojena s výskytem vedlejších účinků, jako jsou například trombocytopenie a hypercholesterolemie. O přežití graftu a pacienta při aplikaci těchto novějších preparátů máme k dispozici údaje prospektivních randomizovaných studií v délce trvání do tří let.
Při aplikaci cyklosporinu a tacrolimu byla prokázána dlouhodobá účinnost a bezpečnost. Sirolimus se užívá častěji, ale v Evropě nebyl doposud licencován pro běžné užívání.
Profylaktická imunosuprese byla v osmdesátých letech minulého století zejména v USA ve znamení zavedení „indukční“ terapie na bázi biologických agens, jako je například antithymocyt globulin (ATG). Výhoda těchto terapií spočívá v možnosti ukončit aplikaci cyklosporinu během deseti dnů poté, co dojde k obnově graftu od ischemického poškození, kdy po ukončení redukovaného cyklu byla zahájena terapie trojkombinací. Tato terapie obvykle zahrnovala aplikaci cyklosporinu, azathioprinu a prednisolonu, v poslední době bývá azathioprin nahrazen MMF. Indukční terapie je obvykle spojena s nižší mírou rejekce graftu, neexistují však žádné důkazy, které by u pacientů podstupujících indukční léčbu prokazovaly benefit s ohledem na dlouhodobé přežití graftu. Riziko vzniku pooperační virové infekce a karcinomu (potransplantační lymfoproliferativní onemocnění) je u pacientů s vyšším rizikem podstupujících indukční terapii vyšší než u pacientů, kteří indukční terapii nepodstoupili. Od roku 1997 bývá polyklonální (ATG) nebo monoklonální (OKT3) indukční terapie nahrazována monoklonálními protilátkami s vysokou afinitou anti-IL-2 receptoru (daclizumab a basiliximab). Tyto preparáty jsou indikovány v krátkém cyklu hned po transplantaci, jejich aplikace je bezpečná. Randomizované kontrolované studie prokázaly, že snižují prevalenci akutní buněčné rejekce o přibližně 50 % [13,14].
6.2 Primární profylaxe imunosupresivy
6.2.1 Cyklosporin A
Moderní terapie jsou založeny na aplikaci cyklosporinu A v kombinaci s novějšími preparáty, jako je například MMF (místo azathioprinu). Většina lékařů stále považuje prednisolon za základní součást primární imunosuprese, ačkoliv je možné prednisolon vysadit.
Dvě prospektivní randomizované studie provedené na počátku osmdesátých let minulého století prokázaly, že terapie založená na aplikaci cyklosporinu umožňuje dosáhnout lepší doby přežití 3 roky po transplantaci. První, kanadská studie (Canadian Multicentre Trial Group, 1983), srovnávala cyklosporinovou terapii v kombinaci s terapií trojkombinací (s nebo bez indukční terapie ALG/ATG) se stejnou terapií bez aplikace cyklosporinu.
European Multi-Centre Trial Group v roce 1983 publikovala výsledky kontrolované randomizované studie testující účinnost cyklosporinové monoterapie versus terapie na bázi aplikace azathioprinu a prednisolonu. V obou studiích byly užity poměrně vysoké dávky (20 mg/den) cyklosporinu, aplikované ve formě Sandimmunu (kapsle obsahující cyklosporin ve formě prášku). Během prvních 5 let nebylo ani v jedné ze studií prováděno monitorování hladiny cyklosporinu v krvi. V obou studiích bylo zaznamenáno velmi vysoké procento vysazení cyklosporinu z důvodu toxicity (přibližně 80 % v obou studiích). Výsledky týkající se přežití pacientů v obou skupinách jsou uvedeny v tab. 7 [1,2].
Tab. 1. Randomizované kontrolované studie aplikace cyklosporinu A. 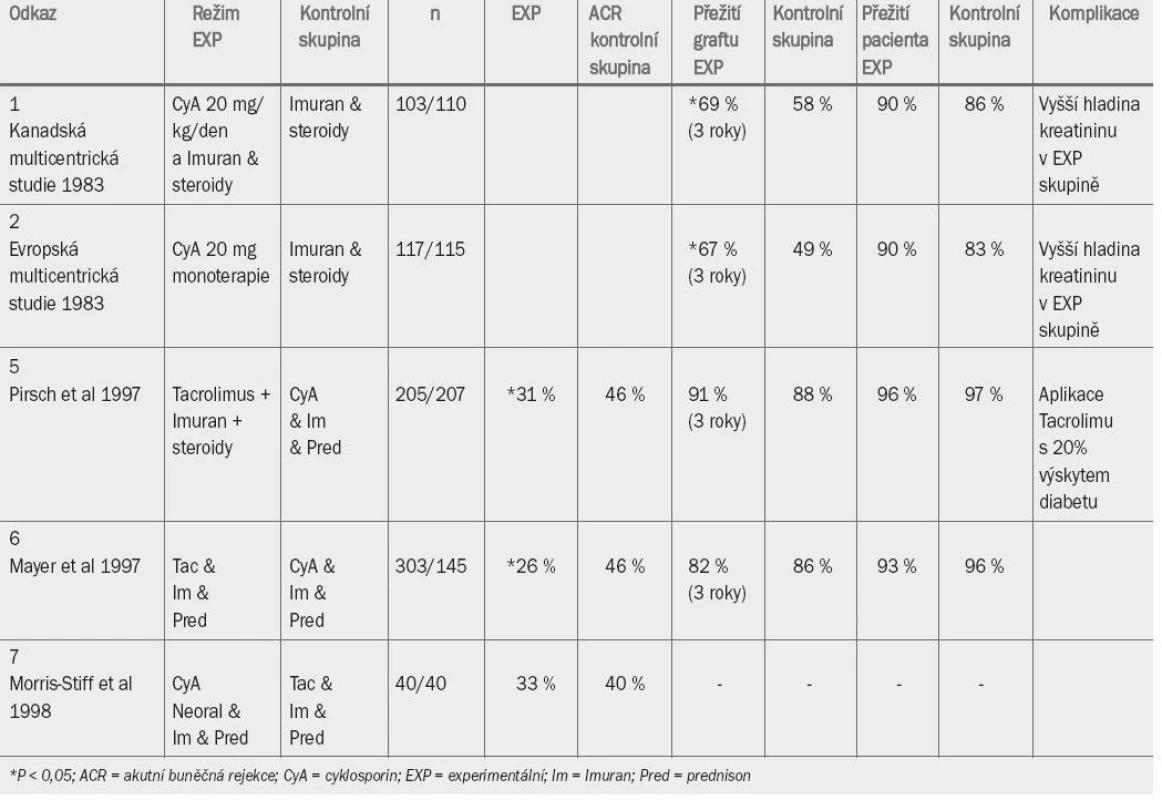
Zlepšení míry přežití graftu, které bylo spočteno na základě „intention to treat“ (10 % po 3 letech v kanadské studii a 22 % po 3 letech v evropské studii), bez zvýšení mortality následkem aplikace cyklosporinu, bylo velmi povzbuzující. Křivky vyjadřující přežití graftu se však v obou studiích přibližně po deseti letech přibližují. Při zpětném hodnocení se zdá pravděpodobné, že většina pozdějších selhání transplantátu v experimentálních skupinách byla zapříčiněna toxicitou cyklosporinu nebo příliš brzkým přesunutím pacientů z experimentální do kontrolní skupiny.
Cyklosporin A mikro-emulze (Neoral) má lepší farmakokinetický profil a zřejmě je pro pacienty přijatelnější. Co je však důležitější, oblast pod absorpční křivkou byla vyšší u Neoralu než u Sandimmunu, což umožnilo snížení dávky cyklosporinu bez omezení jeho účinnosti. Toto zjištění bylo potvrzeno v randomizované kontrolované studii z roku 1997 [3]. Bylo prokázáno, že aplikace Neoralu je spojena se snížením míry rejekce jeden rok po transplantaci – 34% míra při aplikaci Neoralu a 47% míra při aplikaci Sandimmunu [4].
6.2.2 Tacrolimus
Na počátku devadesátých let se tacrolimus stal hlavním konkurentem cyklosporinu A. Jedná se o inhibitor kalcineurinu (stejně jako cyklosporin A), aplikace tohoto preparátu je tedy taktéž spojena s nefrotoxicitou, ačkoliv méně často než aplikace cyklosporinu. Při aplikaci obou preparátů je tedy nutné monitorovat jejich hladinu v krvi, abychom předešli předávkování, které způsobuje nefrotoxicitu, anebo naopak aplikaci nedostatečné dávky, která může způsobit rejekci graftu. Aplikace tacrolimu a cyklosporinu byla srovnávána v prospektivních randomizovaných studiích (viz tab. 7) [5,6]. Pirsch et al [5], kteří ve své studii užili cyklosporin ve formě Sandimmunu, zaznamenali v obou skupinách prakticky srovnatelnou míru přežití graftu i přežití pacienta po třech letech. Aplikace tacrolimu je však spojena s 20% prevalencí diabetu ve srovnání s 4% prevalencí při aplikaci cyklosporinu.
Údaje této studie týkající se 5leté doby přežití [15] (intention-to-treat analysis) prokazují ve všech větvích studie přetrvávající srovnatelné výsledky přežití graftu a pacienta. Incidence selhání byla signifikantně nižší ve skupině pacientů užívajících tacrolimus (43,8 %) než ve skupině pacientů užívajících cyklosporin (56,3 %, p = 0,008). Zkřížení mezi jednotlivými větvemi studie týkající se rejekce graftu nebo výskytu vedlejších účinků bylo signifikantně vyšší u pacientů randomizovaných k aplikaci cyklosporinu (27,5 %) než u pacientů užívajících tacrolimus (9,3 %, p < 0,001). Celkové přežití graftu po pěti letech bylo ve všech skupinách stejné, ačkoliv u pacientů randomizovaných k aplikaci cyklosporinu byl častější výskyt hypercholesterolemie a zvýšení hladiny kreatininu > 150 umol/l (17,4 % a 62,0 %) ve srovnání se skupinou pacientů užívajících tacrolimus (4,7 %, p = 0,0008 a 40,4 %, p = 0,0017).
Ve druhé komparativní studii testující účinek tacrolimu vs. cyklosporin [6] autoři také zvolili cyklosporin ve formě Sandimmunu. Mayer et al [6] zaznamenali u pacientů randomizovaných k aplikaci tacrolimu snížení incidence rejekce transplantátu, míra přežití graftu a pacienta byla v obou skupinách srovnatelná. V nedávné době provedená studie srovnávala účinnost cyklosporinu ve formě emulze (Neoral), který představuje v současné době obecně dostupnou formu cyklosporinu, a tacrolimu [7], výsledky jsou uvedeny v tab. 7. Tato malá studie provedená pouze v jednom centru prokázala, že účinnost cyklosporinu Neoralu je minimálně s ohledem na zlepšení míry rejekce po jednom roce srovnatelná s účinkem tacrolimu.
6.2.3 Mykofenolát mofetil
V několika velkých, multicentrických, randomizovaných, prospektivních a kontrolovaných studiích bylo jasně prokázáno, že MMF snižuje incidenci akutní rejekce po transplantaci, která byla prokázána pomocí biopsie [8–11]. Evropská studie [8] testovala aplikaci 2 g/den a 3 g/den MMF v kombinaci s cyklosporinem a steroidy. MMF v obou dávkách významně snížila míru rejekce graftu po jednom roce (17 % při aplikaci 2 g, 14 % při aplikaci 3 g MMF versus 46 % v placebo skupině).
Americká studie [9] zaznamenala podobné výsledky. Tato studie také testovala aplikaci 2 g a 3 g/den MMF v kombinaci s cyklosporinem a steroidy a ATG indukční terapii versus cyklosporin, prednisolon a azathioprin.
Po třech letech se však v evropské studii míry přežití graftu a přežití pacientů mezi jednotlivými třemi skupinami významně nelišily.
V „Tricontinental“ studii [10], v níž byl azathioprin nahrazen 2 g a 3 g/den MMF v kombinaci s cyklosporinem a prednisolonem ve všech třech skupinách, byla incidence akutní rejekce 20 % při aplikaci 2 g MMF a 16 % při aplikaci 3 g MMF versus 35 % u kontrolní skupiny (azathioprin). Srovnání incidence akutní rejekce v placebo skupině v evropské studii [8] vs. skupině užívající azathioprin v „Tricontinental“ studii [10] neprokázalo žádný signifikantní rozdíl. Vzhledem k tomu, že obě skupiny pacientů užívaly cyklosporin i steroidy a selekční kritéria byla shodná, lze vyvodit závěr, že terapie založená na aplikaci Imuranu ztratila v moderní imunosupresivní terapii své tradiční místo. V mnoha centrech se MMF v současné době užívá v rámci léčby první nebo druhé volby místo azathioprinu. Aplikace azathioprinu je v současné době indikována pouze u pacientů, kteří nesnesou MMF.
V retrospektivní studii z USA zahrnující 66 000 pacientů bylo srovnáváno přežití graftu po 4 letech u skupiny pacientů užívajících azathioprin vs. MMF. Bylo zjištěno, že ve srovnání s azathioprinem MMF snižuje míru chronické rejekce graftu o 27 %, tento účinek nijak nesouvisel se snížením akutní buněčné rejekce u pacientů s MMF [12]. Míra přežití pacientů byla v obou skupinách stejná [12].
V nedávné době publikované údaje nasvědčují tomu, že aplikace MMF v kombinaci s cyklosporinem (s nebo bez prednisolonu) umožňuje snížit dávku makrolidu, nebo jej úplně vysadit [16]. Multicentrická, randomizovaná, kontrolovaná studie zahrnující 187 pacientů s transplantovanou ledvinou, kteří byli léčeni pomocí terapie trojkombinací (cyklosporin, 2 g/ den MMF a steroidy) srovnávala clearanci kreatininu, míru rejekce a hladinu cholesterolu v séru 6 měsíců po vysazení cyklosporinu v experimentální skupině. Po ukončení aplikace cyklosporinu došlo u osmi pacientů k mírné a u jednoho pacienta k vážné rejekci (ve všech případech bylo možné rejekci zvrátit) ve srovnání s dvěma případy rejekce v kontrolní skupině (p = 0,03). Po vyloučení případů rejekce byla u pacientů, kteří vysadili cyklosporin, zaznamenána vyšší průměrná clearance kreatininu (+7,5 ml/min, p = 0,02). V „intention-to-treat“ populaci bylo vysazení cyklosporinu spojeno s nižší hladinou celkového cholesterolu v séru a lipoproteinu nízké density (p = 0,015). Musíme doufat, že terapie umožňující snížení aplikace makrolidu povedou ke snížení výskytu chronické nefropatie graftu.
6.2.4 Sirolimus
FDA schválila sirolimus pro klinickou aplikaci v roce 1999, v Evropě byl tento preparát schválen jako doplněk k cyklosporinové terapii v roce 2002. Bylo prokázáno, že tento non-nefrotoxický, reaktivní anti-proliferativní preparát má stejný účinek jako cyklosporin a má synergický efekt. Aplikace sirolimu je spojena s výskytem reverzibilní trombocytopenie a hypercholesterolemie, jejichž výskyt závisí na velikosti dávky [17]. První velká, multicentrická, randomizovaná a kontrolovaná studie srovnávající účinnost sirolimu (Rapamune) a azathioprinu u pacientů po transplantaci ledviny, kteří byli léčeni pomocí cyklosporinu, prokázala následující výsledky [18]: Ačkoliv léčba vedla ke snížení frekvence a závažnosti rejekce, u pacientů užívajících azathioprin byla po jednom roce zaznamenána lepší renální funkce. Tento účinek nijak nesouvisel s hladinou cyklosporinu v krvi. Menší randomizovaná kontrolovaná studie testující účinnost sirolimu vs. cyklosporinu v rámci primární suprese (pacienti ve všech skupinách užívali azathioprin a steroidy) prokázala v obou skupinách srovnatelnou míru rejekce, ve skupině pacientů užívajících sirolimus však byla po jednom roce zaznamenána lepší renální funkce [19]. Podobná studie [20] srovnávala účinnost sirolimu a cyklosporinu u pacientů užívajících také MMF. Míra rejekce byla v obou skupinách srovnatelná, ve skupině pacientů užívajících sirolimus byla zaznamenána signifikantně nižší hladina kreatininu v séru.
Velká mezinárodní randomizovaná kontrolovaná studie [17] testovala účinnost a bezpečnost vysazení cyklosporinu po 3 měsících udržovacího režimu cyklosporin + sirolimus ve srovnání se stejným režimem bez vysazení cyklosporinu. Ačkoliv po vysazení cyklosporinu se signifikantně zvýšila frekvence rejekce (9,8 % vs. 4,2 %, p = 0,035), bylo v této skupině pozorováno zlepšení renální funkce a krevního tlaku, v kontrolní skupině byla zaznamenána vyšší incidence virové infekce. Malá randomizovaná kontrolní studie provedená v jediném centru [21] prokázala, že primární imunosuprese založená na aplikaci kombinace basilixmabu, MMF a sirolimu dosahuje podobných výsledků jako terapie založená na aplikaci cyklosporinu. Ve všech těchto kontrolovaných studiích byla v obou skupinách (cyklosporin i sirolimus) zaznamenána jeden rok po transplantaci srovnatelná míra přežití graftu, mortality a infekce. U pacientů užívajících sirolimus nemáme doposud k dispozici dlouhodobé výsledky sledování. Ačkoliv jeho účinnost v rámci prevence časné rejekce je působivá, není zatím zřejmé, zda dlouhodobá aplikace sirolimu povede ke snížení CAR.
6.3 Literatura
1. Canadian Multi-Centre Trial Group. A randomised clinical trial of cyclosporine in cadaveric renal transplantation. N Engl J Med 1983;309(14):809-815.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6350878&dopt= Abstract&itool=iconabstr
2. European Multi-Centre Trial Group. Cyclosporine in cadaveric renal transplantation: one-year follow-up of a multi-centre trial. Lancet 1983;2(8357):986-989.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=6138592&dopt= Abstract&itool=iconabstr
3. Pescovitz MD, Barone G, Choc MG Jr, Hricik DE, Hwang DS, Jin JH, Klein JB, Marsh CL, Min DI, Pollak R, Pruett TL, Stinson JB, Thompson JS, Vasquez E, Waid T, Wombolt DG, Wong RL. Safety and tolerability of cyclosporine micro-emulsion versus cyclosporine: two-year data in primary renal allograft recipients: a report of the Neoral Study Group. Transplantation 1997;63(5):778-780.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9075853&dopt= Abstract&itool=iconabstr
4. Pollard SG, Lear PA, Ready AR, Moore RH, Johnson RW. Comparison of micro-emulsion and conventional formulations of cyclosporine A in preventing acute rejection in de novo kidney transplant patients. The UK Neoral Renal Study Group. Transplantation;1999; 68(9):1325-1331.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10573071&dopt= Abstract&itool=iconabstr
5. Pirsch JD, Miller J, Deierhoi MH, Vincenti F, Filo RS. A comparison of tacrolimus (FK506) and cyclosporine for immunosuppression after cadaveric renal transplantation. FK506 Kidney Transplant Study Group. Transplantation 1997;63(7):977-983.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9112351&dopt= Abstract&itool=iconabstr
6. Mayer AD, Dmitrewski J, Squifflet JP, Besse T, Grabensee B, Klein B, Eigler FW, Heemann U, Pichlmayr R, Behrend M, Vanrenterghem Y, Donck J, van Hooff J, Christiaans M, Morales JM, Andres A, Johnson RW, Short C, Buchholz B, Rehmert N, Land W, Schleibner S, Forsythe JL, Talbot D, Pohanka E, et al. Multicenter randomised trial comparing tacrolimus (FK506) and cyclosporine in the prevention of renal allograft rejection: a report of the European Tacrolimus Multicentre Renal Study Group. Transplantation 1997;64(3):436-443.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9275110&dopt= Abstract&itool=iconabstr
7. Morris-Stiff G, Ostrowski K, Balaji V, Moore R, Darby C, Lord R, Jurewicz WA. Prospective randomised study comparing tacrolimus (Prograf) and cyclosporine (Neoral) as primary immunosuppression in cadaveric renal transplant at a single institution: interim report of the first 80 cases. Transplant Int 1998;11(Suppl 1):S334-S336.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9665010&dopt= Abstract&itool=iconabstr
8. The European Mycophenolate Mofetil Co-operative Study Group. Placebo controlled study of Mycophenolate Mofetil combined with cyclosporine and corticosteroids to the prevention of acute rejection. Lancet 1995;345(8961):1321-1325.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7752752&dopt= Abstract&itool=iconabstr
9. Sollinger HW. Mycophenolate mofetil for the prevention of acute rejection in primary cadaveric allograft recipients. US Renal Transplant Mycophenolate Mofetil Study Group Transplantation 1995;60(3):225-232.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7645033&dopt= Abstract&itool=iconabstr
10. The Tricontinental Mycophenolate Mofetil Renal Transplantation Study Group. A blinded, randomized clinical trial of mycophenolate mofetil for the prevention of acute rejection in cadaveric renal transplantation. Transplantation 1996;61 : 1029-1037.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8623181&dopt= Abstract&itool=iconabstr
11. The European Mycophenolate Mofetil Co-operative Study Group. Mycophenolate mofetil in renal transplantation: three-year results from the pla-cebo-controlled trial. Transplantation 1999;68(3):391-396.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10459543&dopt= Abstract&itool=iconabstr
12. Ojo OA, Meier-Kriesche HU, Hanson JA, Leichtman AB, Cibrik D, Magee JC, Woolfe RA, Agodoa LY, Kaplan B. Mycophenolate mofetil reduces late renal allograft loss independent of acute rejection. Transplantation 2000;69(11):2405-2409.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10868649&dopt= Abstract&itool=iconabstr
13. Vincenti F, Kirkman R, Light S, Bumgardner G, Pescovitz M, Halloran P, Neylan J, Wilkinson A, Ekberg H, Gaston R, Backman L, Burdick J. Interleukin-2-receptor blockage with daclizumab to prevent acute rejection in renal transplantation. Daclizumab Triple Therapy Study Group. N Engl J Med 1998;338(3):161-165.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9428817&dopt= Abstract&itool=iconabstr
14. Kahan BD, Rajagopalan PR, Hall M. Reduction of the occurrence of acute cellular rejection among renal allograft recipients treated with basiliximab, a chimeric anti-interleukin-2-receptor monoclonal antibody. United States Simulect Renal Study Group. Transplantation 1999;67(2):276-284.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10075594&dopt= Abstract&itool=iconabstr
15. Vincenti F, Jensik SC, Filo RS, Miller J, Pirsch J. A long-term comparsion of tacrolimus (FK506) and cyclosporine in kidney transplantation: evidence for improved allograft survival at 5 years. Transplantation 2002;73(5):775-782
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11907427&dopt= Abstract&itool=iconabstr
16. Abramowicz D, Manas D, Lao M, Vanrenterghem Y, Del Castillo D, Wijngaard P, Fung S; Cyclosporine Withdrawal Study Group. Cyclosporine withdrawal from a MMF - containing immunosuppressive regimen in stable kidney transplant recipients: a randomised controlled study. Transplantation 2002;74(12):1725-1734.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12499889&dopt= Abstract&itool=iconabstr
17. Johnson RW, Kreis H, Oberbauer Brattstrom C, Claesson K, Eris J, Sirolimus allows early cyclosporine withdrawal in renal transplantation resulting in improved renal function and lower blood pressure. Transplantation 2001;72(5):777-786.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11571437&dopt= Abstract&itool=iconabstr
18. Kahan B. Efficacy of sirolimus compared with azathioprine for reduction of acute renal allograft rejection: a randomised multicentre study. The Rapamune US Study Group. Lancet 2000; 356 (9225):194-202.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10963197&dopt= Abstract&itool=iconabstr
19. Groth CG, Backman L, Morales JM, Calne R, Kreis H, Lang P, Touraine JL, Claesson K, Campistol JM, Durand D, Wramner L, Brattstrom C, Charpentier B. Sirolimus (rapamycin)-based therapy in human renal transplantation: similar efficacy and different toxicity compared with cyclosporine. Sirolimus European Renal Transplant Study Group. Transplantation 1999;67(7):1036-1042.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10221490&dopt= Abstract&itool=iconabstr
20. Kreis H, Cisterne JM, Land W, Wramner L, Squifflet JP, Abramowicz D, Campistol JM, Morales JM, Grinyo JM, Mourad G, Berthoux FC, Brattstrom C, Lebranchu Y, Vialtel P. Sirolimus in association with mycophenolate mofetil induction for the prevention of acute graft rejection in renal allo-graft recipients. Transplantation 2000;69(7):1252-1260.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10798738&dopt= Abstract&itool=iconabstr
21. Flechner SM, Goldfarb D, Modlin C, Feng J, Krishnamurthi V, Mastroianni B, Savas K, Cook DJ, Novick AC. Kidney Transplantation without calcineurin inhibitor drugs: a prospective, randomised trial of sirolimus versus cyclosporine. Transplantation 2002; 74(8):1070-1076.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12438948&dopt=Abstract&itool=iconabstr
7. KOMPLIKACE
7.1 Imunologické komplikace
Doporučení
- Dárce a příjemce nesmí být v žádném případě ABO nekompatibilní.
- U každého pacienta na čekací listině by měl být proveden profil PRA (panel reaktivních protilátek).
Ve státech, kde existuje program pro sdílení ledvin, by měl být PRA profil součástí detailů uvedených v charakteristice pacienta, což by usnadnilo rychlý přístup v případě, že by byl k dispozici potenciální dárce.
7.1.1 Úvod
Imunologická rejekce představuje nejčastější příčinu časné a pozdní dysfunkce transplantátu. V rychlosti a závažnosti příhod rejekce a odpovědi na léčbu existují velké rozdíly. Mezi hlavní faktory ovlivňující tyto proměnné patří senzitizace na HLA měřená na základě PRA a anamnéza rejekce, stupeň neshody HLA systému (zejména u senzitivních pacientů) [1], nerespektování imunosupresivní terapie a některé virové infekce, např. CMV. Hlavní druhy imunologických reakcí zahrnují:
- hyperakutní rejekce (HAR): je vyvolána preexistujícími anti-HLA nebo anti-AB (krevní skupina) protilátkami. Tento typ rejekce se však v současné době vzhledem k respektování shody ABO mezi dárcem a příjemcem a rutinnímu provádění křížové zkoušky mezi buňkami dárce a sérem příjemce vyskytuje pouze vzácně.
- akutní buněčná rejekce (ACR): tento typ rejekce se vyskytuje daleko častěji, přibližně ve 40–70 % případů. K ACR může dojít nejdříve 5 dní po operaci nebo v pozdějším intervalu, nejčastěji se však vyskytuje v průběhu prvních tří měsíců, přestože se může vyskytovat i později.
- chronická rejekce (CAR): tato pomalá, progresivní destrukce graftu je způsobena fibrózou a arteriosklerózou, etiologie této poruchy nebyla doposud prokázána. Představuje patrně nejčastější příčinu selhání graftu, k němuž dojde 10 let po transplantaci. Chronická rejekce postihuje až 25 % graftů [2].
Jak uvádíme dále, za zlatý standard v rámci diagnostiky ACR a CAR je považována biopsie transplantátu. Prognóza i léčba se stanovuje na základě jednotných kritérií, označovaných jako Banffova kritéria (tab. 8).
Tab. 2. Patologická klasifikace lézí vznikajících v alogenním transplantátu ledviny [3]. ![Patologická klasifikace lézí vznikajících v alogenním transplantátu ledviny [3].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/850eb0d9be3145bdef699ce89ac08f5e.jpeg)
7.1.2 Hyperakutní rejekce (HAR)
Tento typ rejekce představuje nejdramatičtější a nejdestruktivnější imunologický útok na transplantát. Je vyvolán cirkulující komplement-fixační protilátkou IgG, která specificky reaguje proti nekompatibilnímu antigenu dárce, který napadá a likviduje vaskulární endotel.
K HAR dochází u většiny ABO nekompatibilních graftů následkem přítomnosti preexistujících IgM izoprotilátek proti antigenům krevních skupin. U transplantátů s odpovídající ABO skupinou je HAR zprostředkována antidárcovskými HLA IgG protilátkami.
7.1.2.1 Diagnostika
Hyperakutní rejekce představuje vzácně se vyskytující komplikaci, k níž obvykle dochází během operace. Během několika minut nebo hodin vaskularizace se ledvina pokryje skvrnami, ztmavne a ochabne. Histologické vyšetření prokáže celkový infarkt transplantátu [4]. V průběhu jednoho týdne po transplantaci může dojít k opožděné HAR, která se proje-vuje anurií, horečkou a otokem transplantátu.
7.1.2.2 Léčba
Léčba hyperakutní rejekce spočívá v provedení nefrektomie.
7.1.2.3 Prevence
Nejlepší prevencí vzniku HAR je vyvarování se transplantace ABO nekompatibilního transplantátu. U všech pacientů čekajících na transplantaci ledviny je nutné provést screening séra na přítomnost anti-HLA protilátek, které se vyskytují zejména po těhotenství, rejekci transplantátu a transfuzi krve. Po rejekci transplantátu v případě, že je graft odstraněn a imunosupresivní terapie ukončena, dochází ke zvýšení senzitizace [5].
V národním programu pro transplantaci ledvin umožňuje identifikace specifity anti-HLA protilátek u vysoce senzitivních pacientů spolu s křížovou zkouškou detekovat u dárce přijatelné a nepřijatelné antigeny. Tuto informaci je nutné zdůraznit v rámci pacientovy charakteristiky v transplantační databázi, čímž lze zabránit zbytečnému převozu ledvin k transplantaci příjemcům s vysokou senzitivitou protilátek.
7.2 Akutní rejekce alograftu
Akutní rejekce alograftu může být způsobena T-buňkami (akutní buněčná rejekce, ACR) nebo protilátkami (akutní humorální rejekce) – viz tab. 9.
Tab. 3. Akutní buněčná rejekce (ACR) vyvolaná T-buňkami. 
Doporučení
- Lékaři provádějící transplantaci si musí být neustále vědomi rizika akutní rejekce, zejména v průběhu prvních šesti měsíců po transplantaci ledviny.
- Během hospitalizace je nutné každý den odebírat vzorek krve a moči na vyšetření renálních funkcí a hematologické vyšetření, pacient by měl být pravidelně vyšetřován.
- U každého pacienta, který trpí horečkou, citlivostí transplantátu a nižším výdejem moči, je nutné počítat s rizikem (vysoký index rizika) rejekce.
- Lékař by měl mít běžně k dispozici biopsii pod ultrazvukovou kontrolou. Patologické oddělení by mělo disponovat zkušenými patology, kteří jsou schopni stanovit přesnou diagnózu rejekce nebo jiného typu dysfunkce transplantátu.
- Personál a vybavení transplantační jednotky by měly umožňovat okamžitou hospitalizaci pacienta s akutní rejekcí s cílem poskytnutí okamžité diagnostiky a léčby pacienta.
- U pacientů s ACR je nutné pomocí CDC křížové zkoušky co nejdříve testovat potenciální přítomnost anti-HLA IgG protilátek reaktivních s graftem.
- Všechna transplantační centra provádějící transplantaci ledviny by měla mít k dispozici elektivní sérologický profil všech potenciálních a aktuálních příjemců na čekací listině, který umožní stanovit procento a specifitu PRA a jejich izotypů IgG nebo IgM.
- Laboratoř by měla poskytovat 24hodinovou službu provádění křížové zkoušky u dárců/příjemců, poskytující operatérovi informaci týkající se výsledku CDC křížové zkoušky před transplan-tací kadaverózního orgánu (během 5 hodin).
7.2.1 Akutní rejekce vyvolaná prostřednictvím T-lymfocytů
7.2.1.1 Diagnostika
V průběhu několika měsíců po transplantaci (nejčastěji 7 dní až 3 měsíce) mohou pacienti pociťovat bolest v transplantátu. Během vyšetření je pacient v horečnatém stavu, graft může být zvětšený a citlivý.
U pacientů klesá objem moči, dále dochází ke snižování exkrece a clearance kreatininu. Pokles hladiny exkrece sodíku je doprovázen zvýšením hladiny kreatininu v séru. Dopplerovské ultrazvukové vyšetření ledviny může prokázat zvýšený rezistenční index, který souvisí se snížením diastolického průtoku („tight kidney“). Specifitu a senzitivitu tohoto testu jako neinvazivního indikátoru rejekce je nutné teprve posoudit.
Za zlatý standard při diagnostice ACR je považována biopsie transplantátu, nejlépe pod ultrazvukovou kontrolou pomocí automatického bioptického systému (např. tru-cut, bioptická pistole).
7.2.1.2 Léčba
Parenterální methylprednisolon (500 mg – 1 g) se podává intravenózně ve formě tří pulzů denně.
Přítomnost anurie nebo prudké zvýšení kreatininu v séru indikuje rejekci refrakterní na aplikaci steroidů, která vyžaduje další tři dny aplikace pulzní methylprednisolonové terapie nebo aplikaci anti-T-buněčných biologických agens, jako je například ALG (anti-lymfocyt globulin) nebo OKT3 (anti-CD3 monoklonální protilátky). V případě aplikace biologických agens je třeba ukončit aplikaci dalších imunologických supresivních preparátů; pomocí každodenního monitorování T-buněk minimalizujeme dávku biologického agens.
7.2.2 Rejekce vyvolaná prostřednictvím protilátek (akutní humorální rejekce)
Tento typ rejekce lze rozdělit do dvou kategorií: kapilární nebo arteriální rejekce.
- kapilární (peritubulární +/ – glomelurální): při pooperační humorální rejekci dochází ke vzniku protilátek proti antigenu endotelu dárce. Ve 20–25 % případů mohou být tyto protilátky detekovány v séru během rejekce [9]. Humorální rejekce bývá nedostatečně diagnostikována [10]. Při biopsii je detekován otok a krvácení s fokální nekrózou. Není překvapující, že prognóza je v tomto případě horší než u pacientů, u nichž se vyskytuje pouze ACR. Ve všech případech je při histologickém vyšetření přítomna C4d frakce komplementu.
- arteriální: v těchto případech je poranění rozsáhlejší a postihuje větší arterie, což může vyvolat fibrinoidní nekrózu
7.2.2.1 Diagnostika a léčba
Humorální rejekce obvykle provází ACR a prezentuje se stejnými klinickými znaky. Stejně jako u ACR je rejekce diagnostikována pomocí biopsie transplantátu. Léčba nebyla doposud stanovena.
7.2.3 Křížová zkouška
Díky zjištění, že preformované anti-HLA cytotoxické protilátky vyvolávají rejekci [11,12], a díky zavedení křížové zkoušky [13] se HAR stala extrémně neobvyklou komplikací.
Test CDC (na komplementu závislá toxicita) se v současné době provádí ve všech transplantačních centrech, sérum příjemce je uloženo do inkubátoru spolu s periferními lymfocyty, slezinnými lymfocyty nebo lymfocyty z lymfatických uzlin dárce po dobu jedné hodiny. Za poškození vyvolané většinou anti-HLA protilátek je zodpovědná IgG. V případě, že tyto protilátky nejsou vyloučeny pozitivní křížovou zkouškou, dojde u příjemců s IgG protilátkami specifickými pro inkompatibilní antigen dárce k HAR.
Křížová zkouška může umožnit také detekci IgM, kterou lze potvrdit pomocí fluorescenční křížové zkoušky, které jsou obvykle non-HLA a nezpůsobují žádné poškození [14]. Dichlordifenyltrichloretan test umožňuje rutinní rozlišení IgG od IgM, a přispívá tedy k jednoznačnosti výsledku křížové zkoušky [15].
Jsou činěny pokusy zdokonalit senzitivitu a spolehlivost křížové zkoušky.
Bylo prokázáno, že rozšířený dvouhodinový CDC test nepřináší žádný benefit [16]. Technika anti-human globulin augmentace a užívání imunomagnetických částic jsou v některých centrech oblíbeny, tyto postupy však vyžadují validaci.
Fluorescenční test na protilátky je senzitivnější než CDC vzhledem k tomu, že selhání graftu je vyšší při FAT pozitivním testu [17–20].
Míra falešně pozitivních a falešně negativních výsledků křížové zkoušky je však > 15 %, křížová zkouška za pomoci fluorescence je stále ve fázi hodnocení [19].
7.3 Chronická rejekce alograftu (CAR, humorální či neznámá patogeneze)
Doporučení
- Po transplantaci je nutné pravidelně monitorovat sekreci proteinů, hladinu kreatininu v séru a clearanci kreatininu.
- V případě, že dojde v průběhu času ke změně těchto parametrů, je vhodné zvážit hospitalizaci pacienta a provedení renální biopsie.
- V případě, že je potvrzena diagnóza CAR, je nutné zahájit vhodnou medikamentózní léčbu (např. kontrolu hypertenze a acidózy, s aplikací ACE inhibitorů).
7.3.1 Úvod
U 25 % pacientů dojde následkem chronické nefropatie ke ztrátě transplantátu, u podstatného (ačkoliv nedefinovaného) procenta těchto pacientů dojde k chronické rejekci alograftu (CAR) [2].
Chronická rejekce se vyvíjí řadu měsíců až let. První známkou CAR je proteinurie a hypertenze se současným, nebo opožděným zvýšením hladiny kreatininu v séru. Hlavní diferenciální diagnózou je chronická nefropatie alograftu, která je častá u pacientů užívajících inhibitory kalcineurinu, a chronická nefropatie u marginálních dárců. Při histologickém vyšetření je identifikována fibróza, fibroplazie intimy nebo větších arterií s dilatací kapilár a zesílení rozštěpených bazálních membrán. Kortikální atrofie je v pokročilém stadiu, u pacienta může být přítomna kalcifikace [21].
7.3.2 Diagnostika a léčba
CAR je diagnostikována prostřednictvím renální biopsie. Existují důkazy, které potvrzují [22], že u pacientů, u nichž je CAR diagnostikována v časném stadiu, může aplikace ACE inhibitoru (např. lisinoprilu) v kombinaci s orální aplikací bikarbonátu zamezujícího vzniku acidózy zpomalit rychlost dekompenzace ledviny. Tato léčba má však pouze vyčkávací charakter – pacient musí v konečném stadiu podstoupit další transplantaci, pokud jeho zdravotní stav umožňuje zařazení na čekací listinu, nebo dialyzační léčbu. Je pravděpodobné, že CAR se vyskytuje častěji u pacientů, u nichž došlo k časnému výskytu ACR [23]. Tento fakt potvrzuje význam prevence akutní buněčné rejekce.
7.4 Literatura
1. Morris PJ, Johnson RJ, Fuggle SV, Belger MA, Briggs JD. Analysis of factors that affect outcome of primary cadaveric renal transplantation in the UK. HLA Task Force of the Kidney Advisory Group of the United Kingdom. Transplant Support Service Authority (UKTSSA). Lancet 1999;354(9185):1147-1152.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10513707&dopt= Abstract&itool=iconabstr
2. Hostetter TH. Chronic transplant rejection. Kidney Int 1994;46(1):266-279.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7933845&dopt= Abstract&itool=iconnoabstr
3. Mauiyyedi S, Baid S, Pascual M, et al. Chronic allograft glomerulopathy related to hepatitis C virus infection. Mod Pathol 2000 : 13 : 176.
4. Gaber LW, Gaber AO, Vera SR, Braxton F, Hathaway D. Successful reversal of hyperacute renal allograft rejection with the anti-CD3 monoclonal OKT3. Transplantation 1992;54(5):930-932.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1440862&dopt= Abstract&itool=iconnoabstr
5. Welsh KI, Bunce M. HLA typing, matching and cross matching in renal transplantation. In: Morris PJ. (ed.) Kidney transplantation-principals and practice. 5th edn. Philadelphia: WB Saunders, 2000, pp. 135-157.
6. Charney DA, Nadasdy T, Lo AW, Racusen LC. Plasma cell-rich acute renal allograft rejection. Transplantation 1999;68(6):791-797.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10515379&dopt= Abstract&itool=iconabstr
7. Bates WD, Davies DR, Welsh K, Gray DW, Fuggle SV, Morris PJ. An evaluation of the Banff classification of early renal allograft biopsies and correlation with outcome. Nephrol Dial Transplant 1999;14(10):2364-2369.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10528659&dopt= Abstract&itool=iconfft
8. Cosio FG, Roche Z, Agarwal A, Falkenhain ME, Sedmak DD, Ferguson RM. Prevalence of Hepatitis C in patients with idiopathic glomerulonepathies in native and transplant kidneys. Am J Kidney Dis 1996;28(5): 752-758.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9158216&dopt= Abstract&itool=iconabstr
9. Lobo PI, Spencer CE, Stevenson WC, Pruett TL. Evidence demonstrating poor kidney graft survival when acute rejections are associated with IgG donor-specific lymphocytotoxin. Transplantation 1995; 59(3):357-360.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7871565&dopt= Abstract&itool=iconabstr
10. Collins AB, Schneeberger EE, Pascual MA, Saidman SL, Williams WW, Tolkoff-Rubin N, Cosimi AB, Colvin RB. Complement activation in acute humoral renal allograft rejection: diagnostic significance of C4d deposits in peritubular capillaries. J Am Soc Nephrol 1999;10(10):2208-2214.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10505698&dopt= Abstract&itool=iconabstr
11. Kissmeyer-Nielsen F, Olsen S, Petersen VP, Fjeldborg O. Hyperacute rejection of kidney allografts associated with pre-existing humeral antibodies against donor cells. Lancet 1966;2(7465):662-665.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4162350&dopt= Abstract&itool=iconnoabstr
12. Starzl TE, Marchioro TL, Holmes JH, Hermann G, Brittain RS, Stonington OH, Talmage DW, Waddel WR. Renal homografts in patients with major donor-recipient blood group incompatibilities. Surgery 1964; 55 : 195.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=14121762&dopt= Abstract&itool=iconnoabstr
13. Terasaki PI, Marchioro TL, Starzl TE. Sero-typing of human lymphocyte antigens: preliminary trials on long-term kidney homograft survivors histocompatibility testing. Russell PS, et al. (eds.) Washington DC: National Academy of Scientists, 1965, p. 83.
14. Chapman JR, Taylor CJ, Ting A, Morris PJ. Immunoglobulin class and specificity of antibodies causing positive T cell cross matches. Relationship to renal transplant outcome. Transplantation 1986; 42(6): 608-613.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3538548&dopt= Abstract&itool=iconabstr
15. Pirofsky B, Rosner ER. DTT test: a new method to differentiate IgM and IgE erythrocyte antibodies. VOX Sang 1974;27(5):480-488.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=4609181&dopt= Abstract&itool=iconnoabstr
16. Jeannet M, Benzonana G, Arni I. Donor-specific B and T lymphocyte antibodies and kidney graft survival. Transplantation 1981;31(3):160-163.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7015609&dopt= Abstract&itool=iconabstr
17. Garovoy MR, Rheinschmidt MA, Bigos M, et al. Flow cytometry analysis: a high technology cross match technique facilitating transplantation. Transplant Proc 1983;15 : 1939.
18. Iwaki Y, Cook DJ, Terasaki PI, Lau M, Terashita GY, Danovitch G, Fine R, Ettenger R, Mendez R, Kavalich A, et al. Flow cytometry crossmatching in human cadaver kidney transplantation. Transplant Proc 1987;19(1 Pt 1):764-766.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=3274866&dopt= Abstract&itool=iconnoabstr
19. Mahoney RJ, Ault KA, Given SR, Adams RJ, Breggia AC, Paris PA, Palomaki GE, Hitchcox SA, White BW, Himmelfarb J, et al. The flow cytometric crossmatch and early renal transplant loss. Transplantation 1990;49(3):527-535.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2138366&dopt= Abstract&itool=iconabstr
20. Talbot D, Givans AL, Shenton BK, Stratton A, Proud G, Taylor RM. The relevance of a more sensitive cross match assay to renal transplantation. Transplantation 1989;47(3):552-555.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=2646784&dopt= Abstract&itool=iconabstr
21. Porter KA, Owen K, Mowbray JF. Obliterative vascular changes in four human kidney homo transplants. Br Med J 1963;2(5358):639.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=14046168&dopt= Abstract&itool=iconnoabstr
22. Rustom R, Paraoan MT, Sells RA, Jackson MJ, Hammad A, Bakran A, Brown M, Ahmad RA, Williams PS, Bell GM, Sharma A, Bone JM. Effects of angiotensin-converting-enzyme inhibitors on progression to end-stage renal failure in chronic vascular rejection. Transplant Proc 2001;33(1-2):1175-1176.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11267244&dopt= Abstract&itool=iconnoabstr
23. Matas AJ, Gillingham KJ, Payne WD, Dunn DL, Gruessner RW, Sutherland DE, Schmidt W, Najarian JS. A third kidney transplant: cost-effective treatment for end-stage renal disease? Clin Transplant 1996; 10(6 Pt 1):516-520.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8996772&dopt= Abstract&itool=iconabstr
7.5 Maligní onemocnění
Incidence neoplazie u pacientů s transplantovanou ledvinou je vyšší než incidence v normální populaci a představuje významnou příčinu morbidity a mortality [1] (úroveň důkazu: B). Přítomnost neoplazie u příjemce transplantátu může být způsobena následujícími faktory:
- Dříve se vyskytující malignita u příjemce: prokázaná či latentní.
- Přenos neoplazie z dárce na příjemce.
- Vznik nového tumoru u příjemce.
7.5.1 Dřívější maligní onemocnění příjemce
Tato situace může být zapříčiněna následujícím:
- relapsem dříve se vyskytující neoplazie
- latentní asymptomatickou neoplazií
7.5.1.1 Recidiva neoplazie
U příjemců s aktivní neoplazií je transplantace ledviny z důvodu rizika vzniku metastáz a diseminace kontraindikována. Anamnéza karcinomu nemusí vždy nutně vylučovat možnost transplantace. Při absenci aktivního onemocnění však může být obtížné posoudit vhodnou dobu pro transplantaci.
Riziko recidivy závisí na druhu tumoru a délce intervalu mezi léčbou karcinomu a transplantací ledviny. V případě, že je tento interval < 2 roky, je riziko relapsu 53 %. Pokud od léčby uplynulo více než 5 let, riziko se snižuje na 13 %. Při intervalu 2–5 let je riziko recidivy 34 %.
U většiny tumorů by se čekací doba měla pohybovat kolem dvou let, existují však určité výjimky [2,4,5,7,11,12] (úroveň důkazu: C).
Méně než dva roky:
- karcinom kůže z bazálních buněk
- absolutně excidovaný karcinom ze skvamózních buněk
- náhodně detekovaný karcinom z renálních buněk (RCC)
- in-situ karcinom děložního čípku
- karcinom močového měchýře nízkého grade nebo in-situ karcinom močového měchýře
- malá samostatná a fokální neoplasmata
Více než dva roky:
- symptomatický nebo velký RCC
- invadující karcinom močového měchýře
- karcinom prostaty
- karcinom prsu
- maligní melanom
- kolorektální karcinom
- invadující karcinom děložního čípku
K recidivě tumoru v průběhu dvou let dochází u Wilmsova tumoru, symptomatického RCC, karcinomu močového měchýře a karcinomu kůže (kromě melanomu). Ačkoliv by pětiletá čekací doba umožnila eliminovat většinu případů recidivy, tento postup není moc praktický, zejména u starších pacientů [8]. Dvouletá čekací doba by umožnila eliminovat 91 % případů recidivy Wilmsova tumoru, 64 % případů recidivy karcinomu močového měchýře a 61 % případů recidivy symptomatického RCC. Během této doby by však došlo k omezení pouze 13 % případů kolorektálního karcinomu, 19 % případů recidivy karcinomu prsu a 40 % případů recidivy karcinomu prostaty [3,7,12,15].
Rizika recidivy preexistujících malignit po transplantaci ledviny jsou uvedena v tab. 10.
Tab. 4. Riziko recidivy preexistujícího maligního onemocnění po transplantaci ledviny. 
Imunosuprese může stimulovat růst latentních metastáz a vyvolat tak recidivu tumorů léčených více než 5 let před transplantací. Ačkoliv řada center vyžaduje, aby mezi vyléčením karcinomu a transplantací ledviny uběhly alespoň dva roky, délka čekacího intervalu by měla být upravena na základě konkrétního typu tumoru. Kratší čekací doba může být dostatečná, u některých typů tumoru přináší delší čekací doba (> 1 rok) minimální benefit. U karcinomů s horší prognózou se doporučuje vyčkat po dobu 5 let [4,11].
Pacienti, kteří jsou na čekací listině po delší časový úsek, by měli každý rok podstoupit pečlivé vyšetření umožňující vyloučení případné recidivy maligního onemocnění, která by mohla zabránit transplantaci nebo ji oddálit.
7.5.1.2 Latentní asymptomatická neoplazie
Pacienti s renálním onemocněním v terminálním stadiu, kteří jsou na čekacím listu pro transplantaci ledviny, stárnou, a jsou tedy vystaveni vyššímu potenciálnímu riziku aktivace latentní neoplazie po transplantaci ledviny. U kandidátů na transplantaci ledviny, zejména u pacientů starších 50 let, je vhodné provést screening ověřující přítomnost preexistujícího karcinomu. Vyšetření musí zahrnovat:
- vyčerpávající anamnézu a fyzikální vyšetření, včetně dermatologického vyšetření
- gynekologické vyšetření: vaginální cytologické vyšetření a kolposkopii, bez ohledu na věk
- mamografii u žen starších 40 let nebo u žen s anamnézou karcinomu prsu
- vyšetření prostaty: hladina PSA (prostatického specifického antigenu) a DRE (digitální rektální vyšetření) u mužů starších 50 let
- test okultního krvácení do stolice
- RTG hrudníku
- abdominální vyšetření umožňující vyloučit RCC
Pravděpodobnost vzniku ACKD (získaného onemocnění ledvin) se zvyšuje v závislosti na délce trvání dialyzační léčby:
- 10–20 % (1–3 roky)
- 40–60 % (3 roky)
- 90 % (5–10 let)
Prevalence RCC u pacientů s ACKD je 3–4 %. Tato míra je 4–100krát vyšší než hodnota uváděná pro normální populaci (0,04 %). Nezbytnost provádět ultrazvukové vyšetření ledviny v rámci hodnocení kandidátů na transplantaci je rozporuplná. The American Society of Transplant Physicians tento postup z důvodu časté regrese ACKD po transplantaci nedoporučuje.
7.5.2 Přenos neoplazie z dárce na příjemce
Penn zaznamenal více než 250 případů přenosu karcinomu z dárce na příjemce transplantátu. Nejčastěji byl zaznamenán přenos RCC, za ním následovaly karcinom plic, maligní melanom, choriokarcinom a karcinom prsu. Melanom a choriokarcinom představují nejagresivnější maligní onemocnění přenesená z dárce na příjemce (75 % a 90 %).
V nedávné době provedená studie United Network for Organ Sharing (UNOS) Transplant Tumor Registry (USA) hodnotila 650 pacientů, kterým byla transplantována ledvina od 157 dárců s anamnézou aktivního maligního karcinomu [6,11,12,13].
Za potenciální dárce nelze považovat jedince s aktivním karcinomem nebo anamnézou neoplazie. Osoby s karcinomem kůže nízkého grade (ne melanomového typu) a vybranými tumory centrálního nervového systému, které nepodstoupily operační manipulaci s těmito tumory, lze považovat za potenciální dárce, zejména pokud uplynula dostatečná doba od výskytu karcinomu. Dále byly zaznamenány případy přenosu meduloblastomu, gliomu multiforme a maligních gliálních neoplasmat. Riziko vzniku extrakraniální metastázy je 0,5 % u pacientů s astrocytomy a glioblastomy a 4,5 % u meduloblastomů. Riziko přenosu se zvyšuje při intrakraniální operaci, zejména při ventrikulo-atriálních nebo ventrikulo-peritoneálních zkratech. Metastázy tumoru do mozku mohou být v některých případech považovány za primární tumor mozku či krvácení do mozku – detekce metastáz je nezbytná, protože představuje kontraindikaci pro dárcovství orgánu.
Ve vybraných případech byly pacientům transplantovány orgány od dárců s RCC. Podmínkou pro transplantaci však byl tumor malé velikosti ohraničený na kapsulu, bez známek diseminace. V případě transplantace orgánu od dárce s větším nebo invazivním tumorem dojde u příjemce k rozsáhlé diseminaci. V některých případech byly po provedení tumorektomie transplantovány ledviny s malými tumory. V případě transplantace ledviny s nevizualizovaným tumorem je nezbytné provedení nefrektomie graftu a ukončení imunosuprese.
U ostatních typů tumoru je riziko přenosu po 5–10 letech (kdy je tumor klinicky neaktivní) nízké. Pen však uvádí případ přenosu karcinomu prsu a kolon po 5 a 8 letech (bez klinické aktivity tumoru).
7.5.3 Vznik nového tumoru po transplantaci
Prevalence karcinomu po transplantaci ledviny se pohybuje v rozmezí 3–26 % a je 4–5krát vyšší než prevalence v normální populaci. Cincinnati Registry v USA [4,6] zaznamenala do listopadu roku 1998 celkem 9508 karcinomů u 8868 příjemců transplantátu v následujícím složení:
- karcinom kůže, 40 %
- lymfoproliferativní onemocnění, 11 %
- karcinom plic, 5 %
- karcinom ledviny, 5 %
- Kaposiho sarkom, 4 %
- karcinom čípku, 4 %
- karcinom vulvy a perinea, 3 %
Je důležité poznamenat, že u normální populace nedošlo ke zvýšení prevalence neoplazie (karcinom plic, prsu, prostaty a kolon). Vyšší prevalence karcinomu u pacientů s transplantátem souvisí s následujícími faktory:
- expozice UV paprskům: karcinom kůže [16]
- zneužívání analgetik: uroteliální karcinom
- renální onemocnění způsobené dialyzační léčbou: renální karcinom
- imunosupresiva, jako je například cyklosporin A a anti-CD3 monoklonální protilátky (OKT3): narušená imunitní obrana
- virové infekce: EBV, lymfoproliferativní onemocnění, virus herpes 8, Kaposiho sarkom, lidský papilomavirus, karcinom čípku a anogenitální karcinom, HBV nebo HCV, hepatokarcinom
- chronická antigenní imunostimulace
U pacientů s aktivním karcinomem je transplantace z důvodu vyššího rizika vzniku metastáz a diseminace tumoru následkem imunosupresivní terapie kontraindikována.
7.5.4 Každoroční screening příjemce orgánu
Každoročně prováděný screening umožňující detekci karcinomu u pacientů na čekací listině zahrnuje níže uvedená vyšetření.
7.5.4.1 Dermatologické vyšetření
Pacienti s transplantovanou ledvinou mají vyšší riziko karcinomu kůže. Tento typ karcinomu představuje 40–60 % všech tumorů vznikajících po transplantaci ledviny. Prevalence karcinomu kůže se v průběhu času zvyšuje, stejně je tomu u incidence – 16 % 10 let po transplantaci a 52 % 20 let po transplantaci – a úzce souvisí s vystavením slunečnímu a UV záření, s přítomností antigenu HLA-B27 a stupněm imunosuprese. Pacienti s transplantovanou ledvinou by měli každý rok podstoupit dermatologické vyšetření a užívat ochranné opalovací prostředky.
7.5.4.2 Vyšetření lymfatických uzlin
Zavedení cyklosporinu, anti-lymfocytárního globulinu (ALG) a OKT3 souvisí se zvýšením incidence lymfoproliferativního onemocnění (1–2,5 %) [14]. Tato onemocnění se obvykle manifestují během prvního roku po transplantaci. Ve většině případů se jedná o non-Hodgkinovy lymfomy a lymfomy z B-buněk. Léčba vyžaduje omezení nebo zastavení imunosupresivní terapie, míra remise se pohybuje kolem 50–68 %. V některých případech může být účinná aplikace antivirotik (acyklovir, ganciklovir).
7.5.4.3 Gynekologické vyšetření
Incidence karcinomu čípku je u pacientek s transplantátem 3–16krát vyšší než u pacientek v normální populaci, v 70 % případů odpovídá in-situ intraepiteliální neoplazii čípku (CIN). U pacientek po transplantaci je nutné jednou za rok provést kolposkopii a cytologické vyšetření. Etiologie karcinomu čípku pravděpodobně souvisí s infekcí čípku vyvolanou pohlavně přenosnými onkogenními kmeny lidského papilomaviru (HPV). Zvýšení rizika vzniku karcinomu čípku u pacientek s transplantátem je zapříčiněno reaktivací latentního HPV nebo deficitem pacientky užívající imunosupresiva. Prevalence HPV čípku je u pacientek s transplantátem téměř 45 %, ačkoliv toto procento v současné době klesá. Stejný trend je pozorován u prevalence CIN [9]. U těchto pacientek je vhodné pravidelné provádění mamografie a gynekologického ultrazvukového vyšetření.
7.5.4.4 Vyšetření prostatické žlázy
Prevalence adenokarcinomu prostaty se u pacientů po transplantaci ledviny pohybuje v rozmezí 0,3–1,8 %. Toto procento se zvyšuje v závislosti na věku příjemce a v případě, že se u pacientů provádí screening PSA, může dosáhnout až 5,8 %. U všech příjemců starších 50 let je nezbytné každoroční provedení screeningu PSA a DRE. Transplantace ledviny nemá navíc žádný vliv na hladinu PSA, většina karcinomů prostaty detekovaných u pacientů s transplantátem je tedy diagnostikována v lokalizovaném stadiu (84 %) [7,10].
7.5.4.5 Vyšetření na okultní krvácení ve stolici
Spojitost mezi transplantací ledviny a vznikem karcinomu kolon je mnohem rozporuplnější, ačkoliv bylo zaznamenáno zvýšení rizikového faktoru o 2,6. Do roku 1998 bylo popsáno 386 případů karcinomu kolon u 10 667 příjemců transplantátu. Je však obtížné posoudit, zda při absenci dalších faktorů indikujících vyšší riziko vzniku karcinomu kolon lze považovat kolonoskopii za nejvhodnější metodu screeningu. Běžně užívaný screeningový test na bázi měření sérových markerů (CEA, CA 125, CA 15-3, CA 19-9) není u pacientů s transplantátem vzhledem ke své nízké senzitivitě a specifitě užitečný [15].
7.5.4.6 Cytologické vyšetření moči
Incidence uroteliálních tumorů je u pacientů s transplantátem třikrát vyšší než u normální populace. Obvykle se jedná o neoplazie z přechodných buněk, ačkoliv incidence adenokarcinomu močového měchýře a nefrogenního adenomu se také postupně zvyšuje. Provedení cytologického vyšetření moči je povinné u pacientů s makroskopickou nebo mikroskopickou hematurií, analgetickou nefropatií nebo anamnézou karcinomu urotelu [2].
7.5.4.7 Ultrazvukové vyšetření ledviny
Karcinom z renálních buněk se obvykle vyskytuje v pacientově vlastní ledvině, může však být lokalizován také v graftu. Prevalence tohoto onemocnění se pohybuje v rozmezí 0,5–3,9 %, což je 10–100násobně více než v normální populaci.
Mezi rizikové faktory patří:
- ACKD
- anamnéza RCC
- Von Hippel Lindauovo onemocnění
- (případně) polycystická ledvina
Jednou za rok je vhodné provedení ultrazvukového vyšetření pacientovy vlastní ledviny.
7.5.4.8 RTG vyšetření hrudníku
U pacientů s transplantátem doporučujeme provádět jednou za rok RTG vyšetření hrudníku.
7.5.5 Závěr
Riziko vzniku karcinomu je u pacientů s transplantátem několikanásobně vyšší než u obecné populace. Karcinom představuje u pacientů po transplantaci významnou příčinu morbidity a mortality.
7.6 Literatura
1. Buell JF, Trofe J, Hanaway MJ, Lo A, Rosengard B, Rilo H, Alloway R, Beebe T, First MR, Woodle ES. Transmission of donor cancer into cardiothoracic transplant recipients. Surgery 2001;130(6):660-666; discussion, 666-668.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11602897&dopt =Abstract
2. Buzzeo BD, Heisey DM, Messing EM. Bladder cancer in renal transplant recipients. Urology 1997;50(4): 525-528.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9338726&dopt= Abstract
3. Danpanich E, Kasiske BL. Risk factors for cancer in renal transplant recipients. Transplantation 1999; 68(12):1859-1864.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10628765&dopt=Abstract
4. EPBG (European Expert Group on Renal Transplantation); European Renal Association (ERA-EDTA); European Society for Organ Transplantation (ESOT). European best practice guidelines for renal transplantation (part 1). Nephrol Dial Transplant 2000;15(Supl 7):1-85.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11286185&dopt= Abstract
5. Gulanikar AC, Daily PP, Kilambi NK, Hamrick-Turner JE, Butkus DE. Prospective pretransplant ultrasound screening in 206 patients for acquired renal cysts and renal cell carcinoma. Transplantation 1998;66(12): 1669-1672.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9884257&dopt=Abstract
6. Kauffman H, McBride MA, Delmonico FL. First report of the United Network for Organ Sharing Transplant Tumour Registry: donors with a history of cancer. Transplantation 2000;70(12):1747-1751.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11152107&dopt= Abstract
7. Konety BR, Tewari A, Howard RJ, Barry JM, Hodge EE, Taylor R, Jordan ML. Prostate cancer in the post-transplant population. Urologic Society for Transplantation and Vascular Surgery. Urology 1998;52(3):428-432.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9730455&dopt= Abstract
8. Sola R, Rodriguez S, Guirado L, Lopez-Navidad A, Caballero F, Diaz M, Baro E, Paredes D. Renal transplant for recipients over 60 years old. Transplantation 2000;69(11):2460-2461.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10868662&dopt= Abstract
9. Morrison EA, Dole P, Sun XW, Stern L, Wright TC Jr. Low prevalence of human papillomavirus infection of the cervix in renal transplant recipients. Nephrol Dial Transplant 1996;11(8):1603-1606.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8856219&dopt= Abstract
10. Oberbauer R, Banyai S, Schmidt A, Kornek G, Scheithauer W, Mayer G. Serum tumour markers after renal transplantation. Transplantation 1996;62(10): 1506-1509.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8958280&dopt= Abstract
11. Penn I. The effect of immunosuppression on pre-existing cancers. Transplantation 1993;55(4):742-747.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=8475546&dopt= Abstract
12. Penn I. Primary kidney tumours before and after renal transplantation. Transplantation 1995; 59(4): 480-485.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7878750&dopt= Abstract
13. Penn I. De novo malignancies in pediatric organ transplant recipients. Pediatr Transplant 1998; 2(1): 56-63.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10084762&dopt= Abstract
14. Sheil AG, Disney AP, Mathew TH, Livingston BE, Keogh AM. Lymphoma incidence, cyclosporine, and the evolution and major impact of malignancy following organ transplantation. Transplant Proc 1997; 29(1-2):825-827.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9123543&dopt= Abstract
15. Trivedi MH, Agrawal S, Muscato MS, Metzler MH, Marshall JB. High grade, synchronous colon cancer after renal transplantation: were immunosuppressive drugs to blame? Am J Gastroenterol 1999;94(11): 3359-3361.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10566744&dopt= Abstract
16. Webb MC, Compton F, Andrews PA, Koffman CG. Skin tumours posttransplantation: a retrospective analysis of 28 years’ experience at a single centre. Transplant Proc 1997;29(1-2):828-830.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9123544&dopt= Abstract
8. PŘEŽITÍ PACIENTA A GRAFTU
Doporučení týkající se přežití pacienta a graftu (úroveň důkazu: B)
- Míra přežití graftu po neselekční transplantaci ledviny by měla být následující: minimálně 80 % po jednom roce, 60 % po 5 letech a 45 % po 10 letech [2,4, 10,14,18] (schéma 1)
- Míra přežití pacienta po neselekční transplantaci ledviny by měla být následující: minimálně 90 % po jednom roce, 80 % po 5 letech a 60 % po 10 letech [2,4,10,14,18]
Schéma 1. Přežití graftu po transplantaci ledviny (s laskavým svolením prof. Dr. G. Opelze, Heidelberg). 
Celkový výsledek transplantace ledviny závisí na řadě kritérií, která uvádíme v další části dokumentu.
8.1 Kadaverózní a žijící dárci
8.1.1 Přežití graftu
Transplantace ledviny ze žijícího dárce je spojena s lepší mírou přežití graftu než transplantace kadaverózního orgánu. Míra přežití graftu po jednom roce je minimálně 95 % u sourozenců s identickou HLA a 90 % v případě, že je dárcem rodinný příslušník příjemce s 1 identickým haplotypem. Při transplantaci kadaverózního orgánu je míra přežití graftu po jednom roce 80 %.
Míra přežití graftu po třech letech je minimálně 90 % u sourozenců s identickou HLA, 80–85 % v případě, že je dárcem rodinný příslušník příjemce s 1 identickým haplotypem, 85 % v případě, že je dárcem manžel/manželka, a minimálně 80 % v případě, že je dárcem žijící jedinec, kterého s příjemcem nepojí žádný příbuzenský vztah. Při transplantaci kadaverózního orgánu je míra přežití graftu po třech letech 70 %.
Při transplantaci ledviny ze žijícího dárce, kterého s příjemcem nepojí žádný příbuzenský vztah, závisí míra přežití graftu na shodě HLA systému pouze nevýznamně, < 10% rozdíl mezi 0–6 neshodami (schéma 1) [14,15]. V případě, že je dárcem manžel nebo manželka příjemce, jsou výsledky transplantace prakticky srovnatelné – 87% míra přežití po třech letech, v případě, že žena-příjemce nebyla před transplantací gravidní. V opačném případě je míra přežití přibližně o 10 % nižší [17].
Míra přežití graftu po pěti letech je přibližně 84 % u sourozenců, 77 % u neselektovaných žijících dárců a 63–66 % u kadaverózních dárců (schéma 1) [4]. Míra přežití graftu po deseti letech je při transplantaci ledviny ze žijících dárců s identickou HLA 78 % u pacientů s polycystickým onemocněním ledviny a 60 % u pacientů s diabetem [18].
8.1.2 Přežití pacienta
Míra přežití pacienta je v případě transplantace ledviny ze žijícího dárce 95 % po jednom roce a 90 % po pěti letech. V případě transplantace kadaverózního orgánu je výsledek horší – 90% míra přežití pacienta po jednom roce a 80% míra po pěti letech [2,4,10,14,15].
8.2 Věk příjemce a dárce
8.2.1 Věk dárce
Věk dárce se významně podílí na výsledku transplantace ledviny. Spolu se zvyšujícím se věkem dárce (s výjimkou transplantace u dětí) dochází ke zhoršení původní funkce, dlouhodobé funkce a míry přežití. Míra přežití graftu po 5 letech je při transplantaci od kadaverózního dárce ve věku 18–30 let o 25 % vyšší než při transplantaci od kadaverózního dárce > 70 let (schéma 1) [3,4,13].
Při transplantaci orgánu od dárců starších 65 let je opoždění funkce o 20 % vyšší než při transplantaci orgánů od dárců mladších 20 let [4]. Věk dárce je obzvláště významný zejména při transplantaci, kdy je mezi dárcem a příjemcem šest neshod. V USA je míra přežití graftu po pěti letech při transplantaci orgánu od dárce ve věku 20–30 let 81 % vs. 39 % u dárců starších 60 let [4,17,18].
Transplantace kadaverózních orgánův případě, kdy je příjemci staršímu 20 let transplantována ledvina od dárce mladšího 10 let, nebo v případě, kdy je příjemci staršímu 18 let transplantována ledvina od dárce mladšího 6 let, je spojena s výrazně horší mírou přežití graftu než transplantace ledviny od dárce staršího 10 let. Při transplantaci ledviny od kadaverózních dárců ve věku 11–40 let však není v míře přežití graftu zaznamenán žádný rozdíl. Při transplantaci orgánů od žijících dárců je výsledek transplantace ledviny od dárců > 65 let pouze nevýznamně horší než při transplantaci ledviny od dárců < 65 let (schéma 1) [12,14,18].
8.2.2 Věk příjemce
Také věk příjemce má významný dopad na výsledek transplantace [13]. Míra přežití graftu po 5 letech je u příjemců ve věku 18–50 let 65 %. Tento výsledek je lepší než u 50 % příjemců transplantátu starších 70 let (schéma 1). Ve francouzském transplantačním systému je míra přežití graftu u příjemců starších 50 let, jimž byla transplantována ledvina od dárců o ≥10 let starších, pouze 61 %.
Míra přežití graftu po třech letech u příjemců ve věku 17–45 let je naopak 75 %, bez ohledu na věk dárce [3].
Transplantace ledviny od starších dárců starším příjemcům je však proveditelná a je spojena s vysokou mírou úspěšnosti. Doposud však nebylo jednoznačně prokázáno, jaký význam má v této populaci „starších dárců i příjemců“ testování shody v HLA systému [19].
8.3 Shoda v HLA systému
Jak studie Collaborative Transplant Study (schéma 1), HLA Task Force of the Kidney Advisory Group of the United Kingdom Transplant Support Service Authority (UKTSSA), tak United Network for Organ Sharing (UNOS) jasně prokázaly vliv shody v HLA systému na výsledek transplantace – přibližně o 10 % lepší míra přežití graftu při 0 vs. 6 neshod – a to při transplantaci orgánů od kadaverózních i žijících dárců [13,14,15].
Dokonce i v době „moderních“ imunosupresivních preparátů, jako jsou tacrolimus (FK 506), MMF (CellCept), sirolimus, rapamycin nebo protilátky receptoru interleukin-2 (IL-2), má testování na shodu v systému HLA svůj význam [7]. Zvláště významná je shoda HLA-DR; u pacientů s 0 vs. 2 neshodami HLA-DR byl zaznamenán téměř 10% rozdíl v míře přežití graftu [14,15].
8.4 Imunosuprese
Údaje CTS jasně prokazují benefit imunosuprese na bázi cyklosporinu A. Míra přežití graftu při aplikaci cyklosporinu A je přibližně o 15 % vyšší než při imunosupresivní terapii bez aplikace cyklosporinu (schéma 2). Význam aplikace tohoto preparátu je výrazný zejména při transplantaci druhé ledviny – v případě transplantace orgánu od příbuzného dárce s jedním identickým haplotypem se míra přežití po pěti letech zvyšuje přibližně o 20 % [14]. Jak již bylo uvedeno, aplikace „moderních“ imunosupresivních preparátů v různých kombinacích dosud nevede k významnému zlepšení výsledků.
Schéma 2. Vliv imunosuprese založené na aplikaci cyklo spo rinu A po transplantaci ledviny (s laskavým svolením prof. Dr. G. Opelze, Heidelberg). 
8.4.1 Počet transplantací
Míra přežití graftu po 5 letech se mezi první–druhou, druhou–třetí a třetí–čtvrtou transplantací snižuje přibližně o 5 %. Míra přežití graftu po 5 letech při první transplantaci z kadaverózního dárce je 65 % vs. 58 % při druhé, 52 % při třetí a 45 % při čtvrté a další transplantaci. U žijících dárců je zhoršení funkce graftu mezi první a druhou transplantací méně výrazné (přibližně 2 %), mezi první a druhou transplantací ledviny s jedním identickým holotypem není signifikantní rozdíl (schéma 2) [4].
8.4.2 Doba trvání studené ischemie
Dobrý výsledek transplantace ledviny od žijícího (nepříbuzného) dárce je podmíněn krátkým trváním studené ischemie. Překvapivě bylo zjištěno, že nejkratší doba trvání studené ischemie (0–6 hod.) nebyla spojena s nejlepším výsledkem v CTS – ve skutečnosti byla míra přežití graftu významně horší než při transplantaci orgánu po 7–12 nebo 13–24 hodinách studené ischemie. Tento výsledek byl zapříčiněn významně vyšším počtem neshod u pacientů s 0–6hodinovou dobou trvání studené ischemie, což jasně ukazuje na význam HLA testování, přestože je tento postup spojen s delším trváním doby studené ischemie. V případě adekvátní shody v HLA systému však platí, že čím kratší je doba trvání studené ischemie, tím lepší je míra přežití graftu [6].
8.4.3 Abnormalita dolních urogenitálních cest
Příjemci s abnormálním močovým měchýřem, kterým byla transplantována ledvina po nahrazení uretrální chlopně, mají až 60% riziko vzniku močové infekce a míru přežití graftu o 5–15 % nižší než pacienti s normálním močovým měchýřem [1,5,8,11]. Míra přežití pacienta i graftu po transplantaci ledviny u pacientů s derivací moči (např. cystoplastika, konduit nebo pouch) je srovnatelná s mírou přežití u pacientů s normálním močovým měchýřem. Je však třeba mít na paměti, že tento závěr byl vyvozen na základě pouze menšího počtu důkazů týkajících se transplantace ledviny pacientům s derivací moči (ve srovnání s transplantací pacientům s normálním močovým měchýřem) [5,9,11,16].
8.5 Literatura
1. Adams J, Gudemann C, Mohring K, Mehls O, Wiesel M. Renal transplantation in children with malformations of the urinary tract. Transplantation Proc 2002;34(2):726-727.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=12009680&dopt= Abstract
2. British Transplantation Society. Towards standards for organ and tissue transplantation in the United Kingdom. 1998 : 25. Published by the British Transplantation Society, London, United Kingdom, 1988, p. 25.
3. Busson M, Benoit G. Is matching for sex and age beneficial to kidney graft survival? Societe Francaise de Transplantation and Association France . Clin Transplant 1997;11(1):15-18.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9067688&dopt= Abstract
4. Cecka JM. The UNOS Scientific Renal Transplant Registry. Clin Transpl 1998 : 1-16.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10503082&dopt= Abstract&itool=iconabstr
5. Crowe A, Cairns HS, Wood S, Rudge CJ, Woodhouse CR, Neild GH. Renal transplantation following renal failure due to urological disorders. Nephrol Dial Transplant 1998;12(8):2065-2069.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9719166&dopt= Abstract&itool=iconfft
6. CTS Collaborative Transplant Study. Newsletter 2002; 1 (March).
http://cts.med.uni-heidelberg.de/public/newsletters. shtml#2002
7. CTS Collaborative Transplant Study. Newsletter 2001; 3 (September).
http://cts.med.uni-heidelberg.de/public/newsletters. shtml#2002
8. CTS Collaborative Transplant Study. First cadaver kidney transplants 1985-2000. CTS-K-75501, Oct 2002.
9. Ebert A, Boswald M, Schott G, Rosch W.H. Transplantation in children with congenital anomalies of the lower urinary tract. Akt Urol 2001;32 : 266-272.
10. EBPG (European Expert Group on Renal Transplantation); European Renal Association (ERA-EDTA); European Society for Organ Transplantation (ESOT) European best practice guidelines for renal transplantation (part 1). Nephrol Dial Transpl 2000;15(Suppl 7):1-85.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11286185&dopt =Abstract&itool=iconfft
11. Hatch DA, Koyle MA, Baskin LS, Zaontz MR, Burns MW, Tarry WF, Barry JM, Belitsky P, Taylor RJ. Kidney transplantation in children with urinary diversion or bladder augmentation. J Urol 2001; 165(6 Pt 2): 2265-2268.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11371960&dopt =Abstract&itool=iconabstr
12. Ivanovski N, Popov Z, Kolevski P, Cakalaroski K, Spasovski G, Stankov O, Stojceva-Taneva O, Paneva-Masin J. (Kidney transplantation using living donors over age 65.) Ann Urol (Paris) 2000;34(5):302-305. (French.)
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11144716&dopt= Abstract&itool=iconabstr 62
13. Morris PJ, Johnson RJ, Fuggle SV, Belger MA, Briggs JD. Analysis of factors that affect outcome of primary cadaveric renal transplantation in the UK. HLA Task Force of the Kidney Advisory Group of the United Kingdom Transplant Support Service Authority (UKTSSA) Lancet 1999;354(9185):1147-52.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=10513707&dopt= Abstract&itool=iconabstr
14. Opelz G. Collaborative Transplant Study - 10-year report. Transplant Proc 1992;24(6):2342-2355.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=1465795&dopt= Abstract&itool=iconnoabstr
15. Opelz G. Impact of HLA compatibility on survival of kidney transplants from unrelated live donors. Transplantation 1997;64(10):1473-1475.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=9392314&dopt= Abstract&itool=iconabstr
16. Riedmiller H, Gerharz EW, Kohl U, Weingartner K. Continent urinary diversion in preparation for renal transplantation: a staged approach. Transplantation 2000;70(12):1713-1717.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11152102&dopt =Abstract&itool=iconabstr
17. Terasaki PI, Cecka JM, Gjertson DW, Takemoto S. High survival rates of kidney transplants from spousal and living unrelated donors. New Engl J Med 1995; 333(6):333-336.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7609748&dopt= Abstract&itool=iconabstr
18. Terasaki PI. The HLA-matching effect in different cohorts of kidney transplant recipients. Clin Transpl 2000;497-514.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11512361&dopt= Abstract&itool=iconabstr
19. Voiculescu A, Schlieper G, Hetzel GR, Hollenbeck M, Ivens K, Willers R, Sandmann W, Grabensee B. Kidney transplantation in the elderly: age-matching as compared to HLA-matching: a single center experience. Transplantation 2002;73(8):1356-1359.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list_uids=11981438&dopt =Abstract&itool=iconabstr
9. ZKRATKY UŽITÉ V TEXTU
ACD kyselina citronová s dextrózou ACE angiotensin konvertující enzym ACKD získané cystické onemocnění ledvin ACR akutní buněčná rejekce ADPKD autosomálně-dominantní polycystické onemocnění ledvin AHG anti-human globulin ALG, ATG anti-lymfocytární globulin CAR chronická rejekce alograftu CDC test na cytotoxicitu závislou na komplementu CMV cytomegalovirus CT počítačová tomografie CTS Collaborative Transplant Study CyA cyklosporin A DDT dithiothreitol (test) DRE digitální rektální vyšetření EBV Epstein-Barr vitus EC roztok EuroCollins EDTA kyselina ethylendiamintetraoctová EDHEP European Donor Hospital Education Program ELISA enzyme-linked immunosorbent assay ESWL extrakorporální litotrypse rázovou vlnou GFR míra glomerulární filtrace HAR hyperakutní rejekce HbA1C glykosylovaný hemoglobin HBcAb protilátky hepatitis B HBsAg povrchový antigen hepatitidy B HBV virus hepatitidy B hCG lidský chorionický gonadotropin HCV virus hepatitidy C HDV virus hepatitidy D HIV virus lidského imunodeficitu HLA antigeny humánních leukocytů, antigen histokompatibility HTK histidin-tryptofan-ketoglutarát IL-2 nterleukin-2 IVIG intravenózní imunoglobulin LLDN laparoskopická nefrektomie u žijícího dárce LURD žijící nepříbuzný dárce MMF mykofenolát mofetil MR magnetická rezonance MRT tomografie magnetickou rezonancí NHBD dárce bez srdeční ozvy OKT3 anti-CD3 monoklonální protilátky PBS PBS pufr PRA protilátky proti panelu PSA prostatický specifický antigen RCC karcinom z renálních buněk UW roztok UW – University of Wisconsin
Štítky
Detská urológia Urológia
Článek Ze zahraničních periodikČlánek Úvodní slovo
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2009 Číslo 2- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Symptomy dolních cest močových u dětí: současné hodnocení a léčba
- Léčba hyperaktivity močového měchýře (OAB) u mužů
- Inkontinence u pacientů po prostatektomii: patofyziologie a léčba
- TOT – nový „zlatý standard“ v řešení ženské stresové inkontinence?
- Úvodní slovo
- Využití tkání získaných pomocí bioinženýrských metod při rekonstrukci urogenitálního systému
- Botulinum toxin: Jaký je jeho význam při léčbě dolních cest močových?
- Právní úprava vazektomie z antikoncepčních důvodů v České republice
- Ze zahraničních periodik
- GUIDELINES EAU PRO TRANSPLANTACI LEDVINY (část 2)
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- TOT – nový „zlatý standard“ v řešení ženské stresové inkontinence?
- Symptomy dolních cest močových u dětí: současné hodnocení a léčba
- Léčba hyperaktivity močového měchýře (OAB) u mužů
- Inkontinence u pacientů po prostatektomii: patofyziologie a léčba
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



