-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Guidelines EAU pro karcinom penisu
Autoři: G. Pizzocaro; F. Algaba; E. Solsona; S. Tana; H. Van Der Poel; N. Watkin; S. Horenblas
Vyšlo v časopise: Urol List 2010; 8(4): 67-82
Kategorie: Guidelines
OBSAH
- Úvod
- METODOLOGIE
2.1 Literatura - DEFINICE KARCINOMU PENISU
- EPIDEMIOLOGIE
4.1 Literatura - RIZIKOVÉ FAKTORY A PREVENCE
5.1 Literatura - TNM KLASIFIKACE A PATOLOGIE
6.1 TNM klasifikace
6.1.1 Literatura
6.2 Patologie
6.2.1 Biopsie penisu
6.2.2 Patologická klasifikace
6.2.3 Histologické vyšetření a riziko vzniku metastáz
6.2.4 Literatura - DIAGNOSTIKA A URČENÍ STADIA
7.1 Primární léze
7.2 Regionální lymfatické uzliny
7.2.1 Lymfatická drenáž penisu
7.2.2 Nehmatné uzliny
7.2.3 Rizikové faktory a detekce metastáz
7.2.4 Hmatné uzliny
7.3 Vzdálené metastázy
7.4 Guidelines pro diagnostiku karcinomu penisu
7.5 Literatura - LÉČBA
8.1 Primární tumor
8.1.1 Tumory Tis, Ta a T1a
8.1.2 Tumory T1b glans s hlubší infiltrací (> 1 mm)
8.1.3 Tumory T2 (ohraničené na glans)
8.1.4 Lokální recidiva onemocnění po konzervativní léčbě
8.1.5 Tumory T2 s invazí do corpus cavernosum
8.1.6 Tumory T3 a T4
8.1.7 Radioterapie
8.1.8 Guidelines pro léčbu karcinomu penisu
8.2 Regionální lymfatické uzliny
8.2.1 Sledování
8.2.2 Léčba pacientů s nehmatnými inguinálními uzlinami
8.2.3 Léčba pacientů s hmatnými inguinálními uzlinami
8.2.4 Adjuvantní chemoterapie
8.2.5 Léčba pacientů s fixovaným a recidivujícím postižením inguinálních uzlin
8.2.6 Význam radioterapie
8.2.7 Guidelines pro léčbu metastáz zasahujících do lymfatických uzlin
8.3 Literatura - SLEDOVÁNÍ
9.1 Jak provádět sledování
9.2 Kdy provádět sledování
9.3 Primární tumor
9.4 Regionální recidiva
9.5 Guidelines pro sledování pacientů s karcinomem penisu
9.6 Literatura - KVALITA ŽIVOTA
10.1 Sexualita a fertilita po léčbě karcinomu penisu
10.1.1 Sexuální život a kvalita života po léčbě karcinomu penisu pomocí laserové terapie
10.1.2 Sexuální funkce po léčbě karcinomu penisu pomocí parciální resekce penisu
10.2 Genitální mutilace, recidiva a úmrtí
10.3 Literatura - ZKRATKY UŽITÉ V TEXTU
1. ÚVOD
Skupina „Guidelines Group on Penile Cancer“ v rámci Evropské urologické asociace (EAU) vytvořila tento dokument s cílem pomoci lékařům při léčbě karcinomu penisu. Tato guidelines nabízejí podrobné a nejnovější informace vycházející z posledních poznatků v oblasti léčby spinocelulárního karcinomu penisu (SCC). Je třeba zdůraznit, že tato guidelines prezentují aktualizovaný, ovšem nikoli standardizovaný přístup pro léčbu tohoto onemocnění. Tento dokument poskytuje rady a doporučení, ovšem bez právní záruky.
Historie dokumentu: guidelines pro léčbu karcinomu penisu byla poprvé uveřejněna v roce 2001. Původní verze byla aktualizována v roce 2004 a poté v roce 2009. Literatura sloužící jako podklad pro poslední verzi z roku 2009 pokrývá období od října 2004 do prosince 2008. Důvodem pro publikaci další aktualizované verze ve velmi krátkém časovém intervalu je zejména uveřejnění nové TNM klasifikace v roce 2009. Až do roku 2009 se totiž pro popis karcinomu penisu užívala původní verze klasifikace z roku 1987. Tato aktualizace rovněž zahrnuje odkazy na nejnovější publikace v této oblasti.
2. METODOLOGIE
Členové pracovní skupiny „Guidelines EAU Group on Penile Cancer“ provedli systematický průzkum literatury zahrnující období od října roku 2004 do prosince 2008. Každému členu bylo na počátku projektu přiděleno jedno nebo dvě témata v souladu s jejich odbornou specializací. Každý z členů rovněž hodnotil jinou sekci svého kolegy. Členové panelu se rozhodli nezahrnovat vzácně se vyskytující onemocnění a guidelines omezit pouze na SCC. Na základě nových poznatků, které byly uveřejněny v průběhu prvních tří let, byl v roce 2008 vytvořen první koncept dokumentu, který byl dále přezkoumán a aktualizován. Finální verze byla uveřejněna ve vydání EAU guidelines v roce 2009 a jeho zkrácená (kapesní) verze byla k dispozici na kongresu EAU ve Stockholmu.
Tato verze guidelines z roku 2010 obsahuje vedle aktualizovaného průzkumu pro účely vědecké publikace [1] zahrnujícího období prosinec 2008–prosinec 2009 i další průzkum publikací uveřejněných do března 2010.
V současné době existuje pouze jediná recenzovaná publikace založená na důkazech „Penile Cancer Treatment“ (verze pro odborníky), kterou vydal National Cancer Institute, National Institutes of Health (Bethesda, MD, USA) [2]. Doposud nebyla publikována žádná randomizovaná kontrolovaná studie ani hodnocení v Cochranově databázi.
Informace uvedené v tomto dokumentu byly na základě vědecké úrovně (tab. 1) a doporučení klasifikovány (tab. 2) podle Oxfordského systému (úroveň důkazu podle medicíny založené na důkazech) [3]. Cílem klasifikace jednotlivých doporučení je zpřehlednit souvislost mezi dostupnými důkazy a doporučeními. Vzhledem k nedostatku randomizovaných studií mají úrovně důkazů i stupně doporučení uváděné v tomto dokumentu nízkou hodnotu.
Tab. 1. Úroveň důkazu. Upraveno podle Sacketta et al [1]. ![Úroveň důkazu. Upraveno podle Sacketta et al [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/94216ef4d871bfaf3d9bf7564abd4eaf.png)
Tab. 2. Stupně doporučení. Upraveno podle Sacketta et al [1]. ![Stupně doporučení. Upraveno podle Sacketta et al [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/912d0fd83767d8132feb1ac99300d7f9.png)
K dispozici je rovněž rychlý průvodce citovanou literaturou. Všechny texty lze stáhnout pro osobní užití na webové stránce EAU: http://www.uroweb.org/professional-resources/guidelines/.
2.1 Literatura
1. Pizzocaro G, Algaba F, Horenblas S et al. Eur Urol 2010; [Epub ahead of print]
http://www.ncbi.nlm.nih.gov/pubmed/20163910.
2. National Cancer Institute. Penile Cancer Treatment (PDQ). Health Professional Version. US National Institutes of Health 2008 : 1–13.
http://www.cancer.gov/cancertopics/pdq/treatment/penile/healthprofessional/allpages.
3. Oxford Centre for Evidence-based Medicine Levels of Evidence (May 2001). Produced by Bob Phillips, Chris Ball, Dave Sackett et al since November 1998. http://www.cebm.net/index.aspx?o=1025 [Access date February 2009].
3. DEFINICE KARCINOMU PENISU
Karcinom penisu představuje poměrně vzácný typ karcinomu ze skvamózních buněk, který obvykle vzniká v epitelu vnitřního listu předkožky a glans penisu. Karcinom penisu svou patologickou charakteristikou a přirozeným vývojem připomíná SCC orofarynxu, ženského genitálu (čípku, vaginy a vulvy) a anu. Za hlavní rizikové faktory lze považovat fimózu, špatnou hygienu a kouření. Byla provedena typizace pro lidský papilomavirus (HPV), který je zodpovědný za pohlavní přenos genitálních bradavic, condyloma acuminata a SCC.
Lepší porozumění přirozenému průběhu onemocnění, časnější diagnostika, novější technologie, spolupráce mezinárodních skupin a soustředění pacientů do specializovaných center umožnily zvýšení míry vyléčení karcinomu penisu z 50 % (v devadesátých letech minulého století) na současných 80 %.
4. EPIDEMIOLOGIE
V západním světě je výskyt primárního maligního karcinomu penisu poměrně vzácný – v Evropě i USA je incidence nižší než 1/100 000 mužů [1,2]. V rámci Evropy však přesto existují významné geografické rozdíly (schéma 1), v některých státech byla zaznamenána incidence vyšší než 1/100 000 mužů [3]. V Severní Americe je incidence výrazně ovlivněna rasou a etnikem [1]: nejvyšší incidence karcinomu penisu byla zjištěna u Hispánců-bělochů (1,01/100 000), obyvatel Aljašky, amerických indiánů (0,77/100 000), afroameričanů (0,62/100 000) a Hispánců--nebělochů (0,51/100 000).
Schéma 1. Roční míra incidence (standardizována podle světových měřítek) v evropských státech/regionech*. Převzato od Parkin et al (2003) [3]. ![Schéma 1. Roční míra incidence (standardizována podle světových měřítek) v evropských státech/regionech*. Převzato od Parkin et al (2003) [3].](https://pl-master.mdcdn.cz/media/image/6d1d49851e5c377c7bc301087a11cc3c.jpg?version=1537794490)
Naopak mimo západní svět je výskyt karcinomu penisu mnohem častější – může představovat až 10–20 % všech maligních onemocnění u mužské populace. Incidence přizpůsobená věku se pohybuje od 0,7–3/ /100 000 případů v Indii až po 8,3/100 000 případů v Brazílii. Ještě daleko vyšší míra incidence byla zaznamenána v Ugandě, kde toto onemocnění představuje nejčastěji diagnostikovaný karcinom.
Mezi významné rizikové faktory patří společenské a kulturní zvyklosti a rovněž hygienické návyky a náboženské praktiky [4]. Výskyt karcinomu penisu je velmi vzácný v komunitách, které praktikují obřízku u novorozenců a dětí před pubertou (židé, muslimové a národnostní skupina v Nigérii – Ibové). Obřízka prováděná v dětském věku snižuje riziko karcinomu penisu 3–5krát. Obřízka, která se provádí u dospělých mužů, však žádnou ochranu před karcinomem nepředstavuje.
Ve Spojených státech došlo v letech 1973–2002 k významnému poklesu incidence (přizpůsobené věku): z 0,84/ /100 000 v letech 1973–1982 na 0,69/100 000 v 1983–1992 a na dalších 0,58/100 000 v období 1993–2002 [1]. V evropských státech byla incidence tohoto onemocnění v osmdesátých/devadesátých letech minulého století poměrně stabilní, s mírným nárůstem [2]. Incidence karcinomu penisu se zvyšuje spolu s věkem [2], mimo západní svět však byl výskyt onemocnění zaznamenán i u mladších mužů a dokonce u dětí [3].
4.1 Literatura
1. Barnholtz-Sloan JS, Maldonado JL, Pow-sang J et al. Incidence trends in primary penile cancer. Urol Oncol 2007; 25(5): 361–367.
http://www.ncbi.nlm.nih.gov/pubmed/17826651.
2. ENCR (European Network of Cancer Registries). Eurocim version 4.0. European incidence database V2.2 (1999). Lyon, France: IARC, 2001.
3. Parkin DM, Whelan SL, Ferlay J et al (eds). Cancer Incidence in Five Continents. Vol. VIII. IARC Scientific Publications. No. 155. Lyon, France: IARC, 2002.
http://www.iarc.fr/en/Publications/PDFs-online/ Cancer-Epidemiology/IARC-Scientific-
Publication-No.-155.
4. Misra S, Chaturvedi A, Misra NC. Penile carcinoma: a challenge for the developing world. Lancet Oncol 2004; 5(4): 240–247.
http://www.ncbi.nlm.nih.gov/pubmed/15050955
5. RIZIKOVÉ FAKTORY A PREVENCE
Vědci z Karolinska institutu identifikovali při průzkumu literatury v databázi Medline (publikace za období 1966–2001) rizikové faktory pro vznik karcinomu penisu [1]. V kazuistikách byly identifikovány následující významné rizikové faktory (OR > 10) (úroveň důkazu 2a):
- fimóza
- chronické zánětlivé stavy, např. balanopostitida, lichen sclerosus a atroficus (balanitis xerotica obliterans)
- užívání sporalenu a fotochemoterapie pomocí ultrafialových A paprsků
Sexuální anamnéza (větší počet partnerek, zahájení pohlavního života v brzkém věku) a výskyt kondylomat jsou spojeny s 3–5násobně vyšším rizikem vzniku karcinomu penisu. Dalším rizikovým faktorem je kouření. Mezi karcinomem čípku u žen a vznikem karcinomu penisu u jejich partnerů nebyla prokázána konzistentní spojitost.
Celá řada kazuistik uvádí výskyt HPV DNA u 70–100 % pacientů s intraepiteliální neoplazií a u 40–50 % pacientů s invazivním karcinomem penisu. Tyto výsledky byly potvrzeny v populačních kontrolovaných studiích [2]. V populaci mužů, kteří nebyli v dětství obřezáni, byla prokázána úzká spojitost mezi fimózou a vznikem invazivního karcinomu penisu (OR: 11,4; 95% CI: 5,0–25,9). Kouření souviselo s 4,5násobným zvýšením rizika (95% CI: 2,0–10,1). HPV DNA byla detekována v 80 % vzorcích tumoru, 69 % bylo pozitivních na HPV-16 (úroveň důkazů: 2A). Bylo prokázáno, že smegma nemá žádný karcinogenní účinek [3]. Pacienti s condyloma acuminata mají vyšší riziko karcinomu vulvy, vaginy, penisu a anu [4] (úroveň důkazu: 2b).
Bylo prokázáno, že virus HPV-16 a HPV-18 je příčinou karcinomu čípku, vaginy a anu u 70 % pacientek a příčinou karcinomu vulvy, penisu a orofarynxu u 40–50 % pacientů. K progresi infekce HPV do stadia karcinomu je však pravděpodobně nutná přítomnost dalších faktorů [5]. U verukózního karcinomu nebyla prokázána žádná souvislost s infekcí HPV [6].
V červnu roku 2006 udělil Úřad pro kontrolu potravin a léčiv (FDA) licenci pro první vakcínu k prevenci karcinomu čípku a dalších onemocnění vyvolaných virem HPV u ženské populace [7]. Tato vakcína poskytuje ochranu proti infekci viry HPV-6, 11, 16 a 18, které jsou zodpovědné za 70 % případů karcinomu čípku a 90 % případů genitálních bradavic.
Virus HPV je vysoce přenosný, nejvyšší incidence byla zaznamenána u jedinců krátce po zahájení pohlavního života. Doporučovaný věk pro vakcinaci u dívek je 11–12 let [8], nejpozději ve věku 13–26 let.
Vakcinace však nepředstavuje náhradu za běžný screening na karcinom čípku a dokonce i očkované ženy by měly být dále vyšetřovány na přítomnost karcinomu čípku. Vakcinace proti viru HPV se doporučuje i u mužů [9]. Jedna ze studií uvádí, že zatímco většina žen ve věku ≥ 25 let souhlasí s vakcinací [10], v mužské populaci mělo zájem o vakcínu proti viru HPV pouze 33 % jedinců, 27 % jedinců neprojevilo zájem a 40 % jedinců nemělo vyhraněný názor [11]. Bylo dosaženo konsenzu, že s vakcinací proti viru HPV u mužů je třeba vyčkat až do vyhodnocení výsledků vakcinace u ženské populace [12].
Je zajímavým zjištěním, že přítomnost vysoce rizikové HPV DNA u pacientů s karcinomem penisu nijak nezhoršuje prognózu.
Jedna z prvních studií neprokázala mezi pacienty s negativním/pozitivním výsledkem na HPV DNA žádný rozdíl ve výskytu metastáz do lymfatických uzlin ani v době přežití 10 let [13]. Novější studie uvádí u pacientů s negativním výsledkem na HPV DNA 78% míru přežití 5 let specifickou pro onemocnění a 93% míru u pacientů s pozitivním výsledkem na HPV DNA (p = 0,03). Tento výsledek by nasvědčoval tomu, že přítomnost vysoce rizikového viru HPV přináší u pacientů s karcinomem penisu jistý benefit v době přežití. Virus HPV hraje díky interakci s onkogeny a tumor supresorovými geny (geny P53 a Rb) rovněž významnou roli v onkogenezi [15].
5.1 Literatura
1. Dillner J, von Krogh G, Horenblas S et al. Etiology of squamous cell carcinoma of the penis. Scand J Urol Nephrol Suppl 2000; (205): 189–193.
http://www.ncbi.nlm.nih.gov/pubmed/11144896
2. Daling JR, Madeleine MM, Johnson LG et al. Penile cancer: importance of circumcision, human papillomavirus and smoking in situ and invasive disease. Int J Cancer 2005 Sep; 116(4): 606–616.
http://www.ncbi.nlm.nih.gov/pubmed/15825185.
3. Van Howe RS, Hodges FM. The carcinogenicity of smegma: debunking a myth. Eur Acad Dermatol Venereol 2006; 20(9): 1046–1054.
http://www.ncbi.nlm.nih.gov/pubmed/16987256.
4. Nordenvall C, Chang ET, Adami HO et al. Cancer risk among patients with condylomata acuminata. Int J Cancer 2006; 119(4): 888–893.
http://www.ncbi.nlm.nih.gov/pubmed/16557590
5. Munoz N, Castelisague X, de Gonzalez AB et al. HPV in the etiology of human cancer. Vaccine 2006 Aug;24(Suppl 3):S3/1-10.
http://www.ncbi.nlm.nih.gov/pubmed/16949995.
6. Stankiewicz E, Kudahetti SC, Prowse DM et al. HPV infection and immunochemical detection of cell-cycle markers in verrucous carcinoma of the penis. Mod Pathol 2009; 22 : 1160–1168.
http://www.ncbi.nlm.nih.gov/pubmed/19465901.
7. Huang CM. Human papillomavirus and vaccination. Mayo Clin Proc 2008; 83(6): 701–706.
http://www.ncbi.nlm.nih.gov/pubmed/18533087.
8. Markowitz LE, Dunne EF, Saraiya M et al; Centers for Disease Control and Prevention (CDC); Advisory Committee on Immunization Practices (ACIP). Quadrivalent Human Papillomavirus Vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2007; 56(RR-2): 1–24.
http://www.ncbi.nlm.nih.gov/pubmed/17380109
9. Giuliano AR. Human papillomavirus vaccination in males. Gynecol Oncol 2007; 107(2 Suppl 1): S24–S26.
http://www.ncbi.nlm.nih.gov/pubmed/17938015.
10. Ferris DG, Waller JL, Owen A et al. Midadult women’s attitudes about receiving the prophylactic human papillomavirus vaccine. J Low Genit Tract Dis 2007; 11(3): 166–172.
http://www.ncbi.nlm.nih.gov/pubmed/17596762.
11. Ferris DG, Waller JL, Miller J et al. Men’s attitudes toward receiving the human papillomavirus vaccine. J Low Genit Tract Dis 2008; 12(4): 276–281.
http://www.ncbi.nlm.nih.gov/pubmed/18820541
12. Gerend MA, Barley J. Human papillomavirus vaccine acceptability among young adult men. Sex Transm Dis 2009; 36 : 58–62.
http://www.ncbi.nlm.nih.gov/pubmed/18830138.
13. Bezerra AL, Lopes A, Santiago GH et al. Human papillomavirus as a prognostic factor in carcinoma of the penis: analysis of 82 patients reated with amputation and bilateral lymphadenectomy. Cancer 2001; 91(12): 5–21.
http://www.ncbi.nlm.nih.gov/pubmed/11413520
14. Lont AP, Kroon BK, Horenblas S et al. Presence of high risk human papilllomavirus DNA in penile carcinoma predicts favorable outcome in survival. Int J Cancer 2006; 119(5): 1078–1081.
http://www.ncbi.nlm.nih.gov/pubmed/16570278.
15. Kayes O, Ahmed HU, Arya M et al. Molecular and genetic pathways in penile cancer. Lancet Oncol 2007; 8(5): 420–429.
http://www.ncbi.nlm.nih.gov/pubmed/17466899.
6. TNM KLASIFIKACE A PATOLOGIE
6.1 TNM klasifikace
Nová TNM klasifikace karcinomu penisu z roku 2009 [1] obsahuje změnu v kategorii T1 (tab. 3). Tato verze bude vyžadovat další modifikaci definice pro kategorii T2*. Dvě nové studie prokázaly, že prognóza tumoru invadujícího do corpus spongiosum je mnohem příznivější než u onemocnění, které invaduje do corpora cavernosa [2,3].
Tab. 3. TNM klasifikace karcinomu penisu z roku 2009. 
Rees et al [2] hodnotili 72 pacientů s tumorem ve stadiu T2. Po průměrné době sledování 3 roky zaznamenali u pacientů s karcinomem invadujícím do tuniky nebo kavernózních těles vyšší míru lokální recidivy (35 vs 17 %) i mortality (30 vs 21 %) než u pacientů s karcinomem invadujícím pouze žalud (úroveň důkazu: 2b). Autoři tedy doporučují kategorii T2 dále dělit na stadium T2a – tumor invadující pouze do corpus spongiosum a T2b – tumor invadující do tuniky nebo corpus cavernosum.
Retrospektivní analýza záznamů 513 pacientů, kteří byli léčeni v letech 1956–2006, potvrdila výše popsaný rozdíl mezi invazí corpus spongiosum a invazí corpus cavernosum [3]. Dále neprokázala žádný rozdíl v dlouhodobé míře přežití mezi pacienty s tumory ve stadiu T2 a T3 a žádný signifikantní rozdíl mezi pacienty s tumory ve stadiu N1 a N2 (na základě TNM klasifikace 1987–2002) (úroveň důkazu: 2a).
V nové UICC TNM klasifikaci z roku 2009 [1] je invaze onemocnění do retroperitoneálních lymfatických uzlin správně a přesně definována jako invaze mimo regionální uzliny a vzdálené metastázy. Rozdíl mezi invazí corpus spongiosum a corpora cavernosa není zohledňován.
6.1.1 Literatura
1. Sobin LH, Gospodariwics M, Wittekind C (eds). TNM Classification of Malignant Tumors. UICC International Union Against Cancer 7th edition, Willy-Blackwell 2009 : 239–242.
2. Rees RW, Freeman A, Borley N et al. PT2 penile squamous cell carcinomas: cavernosus vs. spongiosus invasion. Eur Urol Suppl 2008; 7(3): 111 (abstract #163).
3. Leijte JA, Gallee M, Antonini N et al. Evaluation of current (2002) TNM classification of penile carcinoma. J Urol 2008; 180(3): 933–938; discus-sion 938.
http://www.ncbi.nlm.nih.gov/pubmed/18635216
6.2 Patologie
Spinocelulární karcinom (SCC) tvoří více než 95 % případů všech maligních onemocnění penisu. Maligní melanomy a karcinomy z bazálních buněk se vyskytují mnohem méně často. Není známo, jak často předchází spinocelulární karcinom premaligní léze [1–4]. Přestože je SCC nejčastější neoplazií penisu, vyskytuje se v několika různých typech s různým charakterem růstu (tab. 4,5) [5–7].
6.2.1 Biopsie penisu
Provedení biopsie není nutné v případě, že:
- neexistují žádné pochyby o stanovené diagnóze a/nebo
- léčba lymfatických uzlin je odložena až po léčbě primárního tumoru a/nebo po provedení histologického vyšetření sentinelových uzlin
Provedení histologického vyšetření je nutné v případě, že:
- existují pochybnosti o přesné povaze léze (např. metastázy nebo melanom) a/nebo
- léčba lymfatických uzlin je založena na výsledku předoperačního histologického vyšetření (strategie přizpůsobená riziku)
Ve výše uvedených případech se doporučuje provedení biopsie, je však třeba zohlednit výsledky studie zabývající se velikostí odebíraného vzorku. Při vyšetřování vzorku o průměrné velikosti 0,1 cm byly zjištěny následující komplikace:
- potíže při hodnocení hloubky šíření nádoru v 91 % případů
- stanovení odlišného grade u vzorku získaného při biopsii a vzorku excidovaného karcinomu ve 30 % případů
- neschopnost detekovat karcinom ve 3,5 % případů [1]
Ačkoli u pacientů s povrchovou lézí může být dostačující provedení „punch“ biopsie, doporučuje se provedení biopsie pomocí excize.
6.2.2 Patologické kategorie
Spinocelulární karcinom se zpravidla dělí na povrchový nebo invazivní karcinom. Cubilla et al [5] ovšem navrhují následující klasifikaci karcinomu penisu:
- superficiální šíření
- vertikální šíření
- verukózní
- multicentrické
Karcinomy s různými charakteristikami růstu mají odlišnou prognózu [10] a rovněž vykazují odlišný způsob diseminace. Rozsah parciální chirurgické resekce je tedy nutné stanovit na základě růstové charakteristiky karcinomu určené ze vzorku biopsie „nazmrzlo“ [11]. Pakliže stanovíme šířku chirurgických okrajů na základě těchto kritérií (včetně tkáně močové trubice a periuretrální tkáně), lze za negativní okraj považovat pouhé 3–4 mm nekarcimatózní tkáně [12]. Bazaloidní SCC je vysoce agresivní podtyp karcinomu penisu, který jsme schopni v současné době identifikovat lépe než v minulosti.
6.2.3 Histologické vyšetření a riziko vzniku metastáz
Různé histologické typy karcinomu jsou spojeny s různým rizikem invaze metastáz do lymfatických uzlin:
- kondylomatózní tumor: 18,2 %
- SCC: 56,7 %
- sarkomatoidní karcinom: 89 %
Perineurální [14] a lymfovaskulární invaze [14,15] je spojena se vznikem metastáz do lymfatických uzlin: 23,1 % pozitivních lymfatických uzlin vykazuje nodulární a 64,6 % infiltrační charakter. Perineurální invaze, lymfovaskulární invaze a vysoký histologický grade představují nejvýznamnější negativní patologické prognostické faktory, spojené až s 80% mortalitou [15].
6.2.4 Literatura
1. Velazquez EF, Barreto JE, Rodriguez I et al. Limitations in the interpretation of biopsies in patients with penile squamous cell carcinoma. Int J Surg Pathol 2004; 12(2): 139–146.
http://www.ncbi.nlm.nih.gov/pubmed/15173919.
2. Velazquez EF, Cubilla AL. Lichen sclerosus in 68 patients with squamous cell carcinoma of the penis: frequent atypias and correlation with special carcinoma variants suggests a precancerous role. Am Surg Pathol 2003; 27 : 1448–1453.
http://www.ncbi.nlm.nih.gov/pubmed/14576478.
3. Teichman JM, Thompson IM, Elston DM. Non infectious penile lesions. Am Fam Physician 2010; 81(2): 167–174.
http://www.ncbi.nlm.nih.gov/pubmed/20082512.
4. Renand-Vilmer C, Cavelier-Balloy B, Verola O et al. Analysis of alterations adjarent to invasive squamous cell carcinoma of the penis and their relationship with associated carcinoma. J Am Acad Dermatol 2010; 62(2): 284–290.
http://www.ncbi.nlm.nih.gov/pubmed/20115951.
5. Cubilla AL, Barreto J, Caballero C et al. Pathologic features of epidermoid carcinoma of the penis. A prospective study of 66 cases. Am J Surg Pathol 1993; 17(8): 753–763.
http://www.ncbi.nlm.nih.gov/pubmed/8338190.
6. Chaux A, Soares F, Rodriguez I et al. Papillary squamous cell carcinoma, not otherwise specified (NOS) of the penis: clinical pathologic features differential diagnosis and outcome of 35 cases. Am J Surg Pathol 2010; 34(2): 223–230.
http://www.ncbi.nlm.nih.gov/pubmed/20061934.
7. Ranganath R, Singh SS, Sateeshan B. Sarcomatoid carcinoma of the penis: clinico pathological features. Indian J Urol 2008; 24(2): 267–268.
http://www.ncbi.nlm.nih.gov/pubmed/19468412.
8. Broders AC. Squamous cell epithelioma of the skin: A study of 256 cases. Ann Surg 1921; 73(2): 141–160.
http://www.ncbi.nlm.nih.gov/pubmed/17864409.
9. Maiche AG, Pyrhönen S, Karkinen M. Histological grading of squamous cell carcinoma of the penis: a new score system. Br J Urol 1991; 67(5): 522–526. http://www.ncbi.nlm.nih.gov/pubmed/1710163.
10. Villavicencio H, Rubio-Briones J, Regalado R et al. Grade, local stage and growth pattern as prognostic factors in carcinoma of the penis. Eur Urol 1997; 32(4): 442–447.
http://www.ncbi.nlm.nih.gov/pubmed/9412803
11. Velazquez EF, Soskin A, Bock A et al. Positive resection margins in partial penectomies: sites of involvement and proposal of local routes of spread of penile squamous cell carcinoma. Am J Surg Pathol 2004; 28(3): 384–389.
http://www.ncbi.nlm.nih.gov/pubmed/15104302.
12. Minhas S, Kayes O, Hegarty P et al. What surgical resection margins are required to achieve oncological control in men with primary penile cancer? BJU Int 2005; 96(7): 1040–1043.
http://www.ncbi.nlm.nih.gov/pubmed/16225525.
13. Cubilla AL, Reuter V, Velazquez E et al. Histologic classification of penile carcinoma and its relation to outcome in 61 patients with primary resection. Int J Surg Pathol 2001; 9(2): 111–120.
http://www.ncbi.nlm.nih.gov/pubmed/11484498.
14. Cubilla AL. The role of pathologic prognostic factors in squamous cell carcinoma of the penis. World J Urol 2009; 27 : 169–177.
http://www.ncbi.nlm.nih.gov/pubmed/18766352.
15. Chaux A, Reuter V, Lezcano G et al. Comparison of morphologic features and outcome of resected recurrent and non recurrent squamous cell carcinoma of the penis. A study of 81 cases. Am J Surg Pathol 2009; 33(9): 1299–1306.
http://www.ncbi.nlm.nih.gov/pubmed/19471153
7. DIAGNOSTIKA A STANOVENÍ STADIA
Podmínkou pro indikaci nejvhodnější léčby je stanovení správného stadia primárního tumoru a regionálních lymfatických uzlin.
7.1 Primární léze
Fyzikální vyšetření pacienta s karcinomem penisu zahrnuje zhodnocení následujících faktorů:
- průměr léze na penisu nebo podezřelých oblastí
- lokalizaci léze na penisu
- počet lézí
- morfologie léze, zda je papilární, nodulární, ulcerózní, nebo plochá
- vztah s ostatními strukturami (např. submukóza, tunica albuginea, močová trubice)
- corpus spongiosum a cavernosum
- barva a ohraničení léze
- délka penisu
Podmínkou pro stanovení nejvhodnější léčby je přesná histologická diagnóza a stanovení stadia primárního tumoru a regionálních lymfatických uzlin [1]. Výsledky malých studií nasvědčují tomu, že samotné fyzikální vyšetření je při hodnocení infiltrace onemocnění do corpora cavernosa spolehlivější než ultrazvukové vyšetření [2]. Navození umělé erekce pomocí prostaglandinu E1 (alprostadil) v kombinaci s MRI je užitečné pro vyloučení invaze tumoru do corpora cavernosa a posouzení vhodnosti šetřící operace (např. glansektomie) [3,4].
7.2 Regionální lymfatické uzliny
7.2.1 Lymfatická drenáž penisu
Primární lymfatická drenáž karcinomu penisu zasahuje inguinální uzliny. Nejnovější studie zabývající se emisní počítačovou tomografií [5] prokázala, že všechny sentinelové uzliny byly lokalizovány v horní a centrální části inguinálních uzlin, kdy většina se nacházela uprostřed horní zóny. Nebyla prokázána žádná lymfatická drenáž z penisu do dvou inferiorních oblastí třísel, ani přímá drenáž do pánevních uzlin. Výsledky této studie potvrzují poznatky starších publikací [6–8].
7.2.2 Nehmatné lymfatické uzliny
Nezbytné je provedení pečlivého fyzikálního vyšetření inguinální oblasti. Při absenci jakýchkoli abnormalit může inguinální ultrazvukové vyšetření (7,5 MHz) odhalit přítomnost abnormálního nálezu a rovněž lze užít jako navigaci při aspirační biopsii tenkou jehlou (FNAB) [9,10].
Biopsie sentinelové lymfatické uzliny (SNB) [8] se vzhledem k vysoké míře falešně negativních výsledků (25 %, rozpětí 9–50 % [11]) až do začátku tohoto století nedoporučovala. Moderní studie však prokazují, že dynamická biopsie sentinelové lymfatické uzliny (DSNB) s užitím izosulfanové modři a/nebo 99mTc-koloidní síry zlepšuje oproti vyčkávacímu přístupu (wait-and-see) délku přežití pacientů (úroveň důkazu: 3) a ve srovnání s inguinální lymfadenopatií (LAD) snižuje výskyt vedlejších účinků [12,13].
Prospektivní studie potvrdila 100% specifitu a 95% senzitivitu DNSB [14–18] (úroveň důkazu: 2b). Vzhledem k tomu, že analýza výsledků dynamické SNB závisí na zkušenosti operatéra [19], je tato technika dostupná pouze v některých centrech. Hodnocení DNSB ve dvou centrech však ukazují, že tato technika má krátkou dobu procesu učení [20].
Metastázy do iliackých lymfatických uzlin nejsou nikdy přítomny bez zasažení inguinálních uzlin [19], provedení CT pánve tedy není u pacientů bez známek metastáz do inguinálních uzlin nutné.
Běžné CT ani MRI neumožňují detekci mikrometastáz [21]. Doposud nebyly provedeny žádné další studie, které by potvrdily slibné výsledky zaznamenané při užívání MRI s nanočásticemi [22]. Pozitronová emisní tomografie (PET)/CT však umožňuje detekovat pánevní a vzdálené metastázy [23].
7.2.3 Rizikové faktory a detekce metastáz
Pacienti s onemocněním ve stadiu T1G1 nevyžadují po lokální terapii žádnou další léčbu. Naopak u 13–29 % pacientů s tumory T1G2 může dojít ke vzniku metastáz do lymfatických uzlin [23,24]. Riziko zasažení lymfatických uzlin lze hodnotit pomocí kategorií T a G na základě parametrů tumoru.
Rizikové faktory identifikované v retrospektivních studiích zahrnují následující patologické parametry: perineurální invazi, lymfovaskulární invazi, hloubku infiltrace tumoru a jeho tloušťku, anatomickou lokalizaci, velikost a charakter růstu, infiltrační charakter invaze, pozitivní chirurgické okraje a invazi do močové trubice [25]. Několik velkých studií prokázalo, že mezi nejvýznamnější rizikové faktory patří samotná lymfovaskulární invaze, lymfovaskulární invaze bez známek koilocytózy, lymfovaskulární invaze s hmatnými inguinálními uzlinami a histologický grade v kombinaci s perineurální invazí [26–28].
Za nejméně příznivý patologický prognostický faktor lze považovat lymfovaskulární invazi a vysoký histologický grade [28].
Prediktivní hodnota klinických a patologických indikátorů se určuje na základě nomogramů [23–30], které však dosahují maximálně 80% míry predikce [23–30].
Šanci na detekci časných a vzdálených metastáz lze zvýšit jedině pomocí PET/CT scanu s aplikací 18fluorodeoxyglukózy (FDG) [31].
7.2.4 Hmatné lymfatické uzliny
U hmatných lymfatických uzlin je vhodné hodnotit následující parametry:
- konzistenci uzlin
- lokalizaci uzliny
- průměr lymfatické uzliny nebo rezistence
- uni - nebo bilaterální lokalizaci
- počet lymfatických uzlin identifikovaných v každé inguinální oblasti
- mobilní nebo fixované lymfatické uzliny nebo rezistence
- souvislost (infiltrace nebo perforace) s ostatními strukturami, jako je kůže nebo Cooperův vaz
- přítomnost edému na dolní končetině a/nebo šourku
Metastázy do hmatných lymfatických uzlin lze diagnostikovat pomocí perkutánní FNAB (cytologické vyšetření a/nebo histologické vyšetření). Ve chvíli, kdy bude karcinom penisu diagnostikován, bude až 50 % hmatných inguinálních uzlin reaktivních v důsledku současně se vyskytují infekce spíše než v důsledku metastáz. Na druhou stranu téměř 100 % zvětšených lymfatických uzlin, které jsou odhaleny při sledování, je metastatických (úroveň důkazu: 2b) [32].
Regionální lymfatické uzliny by tedy měly být hodnoceny až několik týdnů po léčbě primárního tumoru, aby mohla zánětlivá reakce odeznít. Histologická diagnóza je podle preference patologa stanovena s pomocí aspirační biopsie jemnou jehlou, biopsie vzorku tkáně jehlou nebo otevřené biopsie (úroveň důkazu: 2b) [32,33]. V případě negativního výsledku biopsie a klinicky podezřelých lymfatických uzlin by měla být provedena opakovaná biopsie nebo excizní biopsie.
Závěr
Zobrazovací techniky (např. počítačová tomografie, MRI) jsou běžně indikovány. Jejich význam je však omezen pouze na centrimetrické metastázy a metastázy do lymfatických uzlin o velikosti ≥ 1 cm. Žádná ze v současné době dostupných zobrazovacích technik však neumožňuje identifikaci mikroskopické invaze. Zobrazovací vyšetření 18FDG-PET/CT mají jistá omezení (0,5 cm) [31]. Molekulární biologické techniky jsou stále v experimentálním stadiu.
7.3 Vzdálené metastázy
Hodnocení vzdálených metastáz by se mělo provádět pouze u pacientů s prokázanými pozitivními inguinálními uzlinami (úroveň důkazu: 2b). Spolehlivou metodou pro identifikaci pánevních a vzdálených metastáz u pacientů s pozitivními inguinálními metastázami je PET/CT [31].
Obvykle je indikováno rovněž RTG vyšetření hrudníku a rozbor krve, ačkoli mají oba testy pouze omezený význam a výskyt metastáz do plic je velmi ojedinělý. Role antigenu SCC jako pomůcky pro stanovení stadia nebyla doposud prokázána, a v běžné praxi se tedy nedoporučuje [37]. Biologické studie jsou doposud v experimentálním stadiu [38–41].
Postup pro diagnostiku onemocnění je shrnut níže.
7.4 Guidelines pro diagnostiku a staging karcinomu penisu
(tabulka)
7.5 Literatura
1. Solsona E, Iborra I, Rubio J et al. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol 2001; 165(5): 1506–1509.
http://www.ncbi.nlm.nih.gov/pubmed/11342906.
2. Horenblas S. The accuracy of ultrasound in squamous cell carcinoma. In: The Management of Penile Squamous Cell Carcinoma. A Retrospective and Prospective Study. Thesis. Amsterdam Zoetermeer: BV Export drukkerij 1993 : 71–83.
3. Kayes O, Minhas S, Allen C et al. The role of magnetic resonance imaging in the local staging of penile cancer. Eur Urol 2007; 51(5): 1313–1318.
http://www.ncbi.nlm.nih.gov/pubmed/17113213.
4. Lont AP, Besnard AP, Gallee MP et al. A comparison of physical examination and imaging in determining the extent of primary penile carcinoma. BJU Int 2003; 91(6): 493–495.
http://www.ncbi.nlm.nih.gov/pubmed/12656901.
5. Leijte JA, Valdés Olmos RA, Nieweg OE et al. Anatomical mapping of lymphatic drainage in penile carcinoma with SPECT-CT: implications for the extent of inguinal lymph node dissection. Eur Urol 2008; 54(4): 885–890.
http://www.ncbi.nlm.nih.gov/pubmed/18502024.
6. Daseler EH, Anson BJ, Reimann AF. Radical excision of the inguinal and iliac lymph glands: a study based upon 450 anatomical dissections and upon supportive clinical observations. Surg Gynecol Obstet 1948; 87(6): 679–694.
http://www.ncbi.nlm.nih.gov/pubmed/18120502.
7. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1977; 39(2): 456–466. http://www.ncbi.nlm.nih.gov/pubmed/837331.
8. Catalona WJ. Modified inguinal lymphadenectomy for carcinoma of the penis with preservation of saphenous veins: technique and preliminary results. J Urol 1988; 140(4): 306–310.
http://www.ncbi.nlm.nih.gov/pubmed/3418818.
9. Saisorn I, Lawrentschut N, Leewansangtong S et al. Fine-needle aspiration cytology predicts inguinal lymph node metastases without antibiotic pretreatment in penile carcinoma. BJU Int 2006; 97(6): 1125–1128.
http://www.ncbi.nlm.nih.gov/pubmed/16686716.
10. Kroon BK, Horenblas S, Deurloo EE et al. Ultrasonography-guided fine-needle aspiration cytology before sentinel node biopsy in patients with penile carcinoma. BJU Int 2005; 95(4): 517–521. http://www.ncbi.nlm.nih.gov/pubmed/15705071.
11. Pettaway CA, Pisters LL, Dinney CPN et al. Sentinel lymph node dissection for penile carcinoma: the MD Anderson Cancer Center Experience. J Urol 1995; 154(6): 1999–2003.
http://www.ncbi.nlm.nih.gov/pubmed/7500444.
12. Horenblas S. Surgical management of carcinoma of the penis and scrotum. In: Petrovich Z, Baert L, Brady LW (eds). Medical Radiology. Diagnostic Imaging and Radiation Oncology. Carcinoma of the Kidney and Testis, and Rare Urologic Malignancies. Berlin: Springer-Verlag, 1999 : 341–354.
13. Pettaway CA, Jularbal FA, Babaian RJ et al. Intraoperative lymphatic mapping to detect inguinal metastases in penile carcinoma: results of a pilot study. J Urol 1999;161 : 159 (abstr #612).
14. Akduman B, Fleshner NE, Ehrlich L et al. Early experience in intermediate-risk penile cancer with sentinel node identification using the gamma probe. Urology 2001; 58(1): 65–68.
http://www.ncbi.nlm.nih.gov/pubmed/11445481.
15. Perdonà S, Gallo L, Claudio L et al. [Role of crural inguinal lymphadenectomy and dynamic sentinel lymph node biopsy in lymph node staging in squamous-cell carcinoma of the penis. Our experience.] Tumori 2003 Jul–Aug; 89(4 Suppl): 276–279. [article in Italian].
http://www.ncbi.nlm.nih.gov/pubmed/12903620.
16. Tanis PJ, Lont AP, Meinhardt W et al. Dynamic sentinel node biopsy for penile cancer: reliability of a staging technique. J Urol 2002; 168(1): 76–80. http://www.ncbi.nlm.nih.gov/pubmed/12050496.
17. Wawroschek F, Vogt H, Bachter D et al. First experience with gamma probe guided sentinel lymph node surgery in penile cancer. Urol Res 2000; 28(4): 246–249.
http://www.ncbi.nlm.nih.gov/pubmed/11011963
18. Lont AP, Horenblas S, Tanis PJ et al. Management of clinically node negative penile carcinoma: improved survival after the introduction of dynamic sentinel node biopsy. J Urol 2003; 170(3): 783–786. http4://www.ncbi.nlm.nih.gov/pubmed/12913697.
19. Leijte JA, Kroon BK, Valdés Olmos RA et al. Reliability and safety of current dynamic sentinel node biopsy for penile carcinoma. Eur Urol 2007; 52(1): 170–177.
http://www.ncbi.nlm.nih.gov/pubmed/17316967.
20. Leijte JA, Hughes B, Graafland NM et al. Two-center evaluation of dynamic sentinel node biopsy for squamous cell carcinoma of the penis. J Clin Oncol 2009; 27 : 3325–3329.
http://www.ncbi.nlm.nih.gov/pubmed/19414668.
21. Mueller-Lisse UG, Scher B, Scherr MK et al. Functional imaging in penile cancer: PET/computed tomography, MRI, and sentinel lymph node biopsy. Curr Opin Urol 2008; 18(1): 105–110.
http://www.ncbi.nlm.nih.gov/pubmed/18090498.
22. Tabatabaei S, Harisinghani M, McDougal WS. Regional lymph node staging using lymphotropic nanoparticle enhanced magnetic resonance imaging with ferumoxtran-10 in patients with penile cancer. J Urol 2005; 174 : 923–927; discussion 927.
http://www.ncbi.nlm.nih.gov/pubmed/16093989.
23. Schelenker B, Tieki A, Gratzke C et al. Intermediate differentiated invasive (pT1G2) penile cancer oncological outcome and follow-up. Urol Oncol 2009 Nov 26. [Epub ahead of print].
http://www.ncbi.nlm.nih.gov/pubmed/19945307.
24. Hughes BE, Leijte JA, Kroon BK et al. Lymph Node Metastasis in Intermediate-Risk Penile Squamous Cell Cancer: A Two-Centre Experience. Eur Urol 2009. [Epub ahead of print].
http://www.ncbi.nlm.nih.gov/pubmed/19647926.
25. Lopes A, Hidalgo GS, Kowalski LP et al. Prognostic factors in carcinoma of the penis: multivariate analysis of 145 patients treated with amputation and lymphadenectomy. J Urol 1996; 156(5): 1637–1642.
http://www.ncbi.nlm.nih.gov/pubmed/8863559.
26. Ornellas AA, Nóbrega BL, Wei Kin Chin E et al. Prognostic factors in invasive squamous cell carcinoma of the penis: analysis of 196 patients treated at the Brazilian National Cancer Institute. J Urol 2008; 180(4): 1354–1359.
http://www.ncbi.nlm.nih.gov/pubmed/18707720.
27. Velazquez EF, Ayala G, Liu H et al. Histologic grade and perineural invasion are more important than tumor thickness as predictor of nodal metastasis in penile squamous cell carcinoma invading 5 to 10 mm. Am J Surg Pathol 2008; 32(7): 974–979. http://www.ncbi.nlm.nih.gov/pubmed/18460979
28. Cubilla AL. The role of pathologic prognostic factors in squamous cell carcinoma of the penis. World J Urol 2009; 27(2): 169–177.
http://www.ncbi.nlm.nih.gov/pubmed/18766352.
29. Chaux A, Caballero C, Soares F et al. The prognostic index: a useful pathologic guide for prediction of nodal metastases and survival in penile squamous cell carcinoma. Am J Surg Pathol 2009; 33(7): 1049–1057.
http://www.ncbi.nlm.nih.gov/pubmed/19384188.
30. Ficarra V, Zattoni F, Artibani W et al, GUONE Penile Cancer Project Members. Nomogram predictive of pathological inguinal lymph nodes involvement in patients with squamous cell carcinoma of the penis. J Urol 2006; 175(6): 2103–2108.
http://www.ncbi.nlm.nih.gov/pubmed/16697813.
31. Graafland NM, Leijte JA, Valdes Olmos RA et al. Scanning with 18F.FDG-PET/TC for detection of pelvic nodal involvement in inguinal node positive penile carcinoma. Eur Urol 2009; 56(2): 339–345.
http://www.ncbi.nlm.nih.gov/pubmed/19477581.
32. Horenblas S, Van Tinteren H, Delamarre JFM et al. Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes. J Urol 1993; 149(3): 492–497.
http://www.ncbi.nlm.nih.gov/pubmed/8437253.
33. Ornellas AA, Seixas AL, Marota A et al. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. J Urol 1994; 151(5): 1244–1249.
http://www.ncbi.nlm.nih.gov/pubmed/7512656.
34. Pizzocaro G, Piva L, Nicolai N. Treatment of lymphatic metastasis of squamous cell carcinoma of the penis: experience at the National Tumor Institute of Milan. Arch Ital Urol Androl 1996; 68(3): 169–172. http://www.ncbi.nlm.nih.gov/pubmed/8767505.
35. Senthil Kumar MP, Ananthakrishnan N, Prema V. Predicting regional node metastasis in carcinoma of the penis: a comparison between fine-needle aspiration cytology, sentinel lymph node biopsy and medial inguinal lymph node biopsy. Br J Urol 1998; 81(3): 453–457.
http://www.ncbi.nlm.nih.gov/pubmed/9523669.
36. Skoog L, Collins BT, Tani E et al. Fine-needle aspiration cytology of penile tumors. Acta Cytol 1998; 42(2): 1336–1340.
http://www.ncbi.nlm.nih.gov/pubmed/9568135.
37. Laniado ME, Lowdell C, Mitchell H et al. Squamous cell carcinoma antigen: a role in the early identification of nodal metastases in men with squamous cell carcinoma of the penis. BJU Int 2003; 92(3): 248–245.
http://www.ncbi.nlm.nih.gov/pubmed/12887477.
38. Lopez A, Bezena AL, Pinto CA et al. p53 as a new prognostic factor for lymph node metastasis in penile carcinoma: analysis of 82 patients treated with amputation and bilateral lymphadenectomy. J Urol 2002; 168(1): 81–86.
http://www.ncbi.nlm.nih.gov/pubmed/12050497
39. Kayes O, Ahmed HU, Arya M et al. Molecular and genetic pathways in penile cancer. Lancet Oncol 2007; 8(5): 420–429.
http://www.ncbi.nlm.nih.gov/pubmed/17466899.
40. Zhu Y, Zhang SL, Ye DW et al. Predicting pelvic lymph node metastases in penile cancer patients: a comparison of computed tomography, Cloquet’s node, and disease burden of inguinal lymph nodes. Onkologie 2008; 31(1–2): 37–41.
http://www.ncbi.nlm.nih.gov/pubmed/18268397.
41. Zhu Y, Zhou XY, Yao XO et al. The prognostic significance of p53, Ki-67, epithelial cadherin and matrix metallo proteinase-9 in penile squamous cell carcinoma treated with surgery. BJU Int 2007; 100(1): 204–208.
http://www.ncbi.nlm.nih.gov/pubmed/17433031.
8. LÉČBA
Primární tumor a regionální lymfatické uzliny jsou obvykle léčeny odděleně. Ačkoli je třeba předcházet indikaci nadbytečné léčby (která může vést ke ztrátě tkáně na penisu a vedlejším účinkům spojeným se zbytečným prováděním lymfadenopatie), je naprosto nezbytné odstranit všechnu karcinomatózní tkáň se zachováním zdravých okrajů.
8.1 Primární tumor
Guidelines pro léčbu primární léze karcinomu penisu jsou shrnuta v tab. 6. Při léčbě malých lézí se doporučuje technika se zachováním tkáně penisu (stupeň doporučení: B). Existuje celá řada léčebných modalit, jejichž účinnost nebyla dosud srovnávána pomocí vědeckých metod, což znesnadňuje jejich klasifikaci.
Tab. 6. Léčba karcinomu penisu. 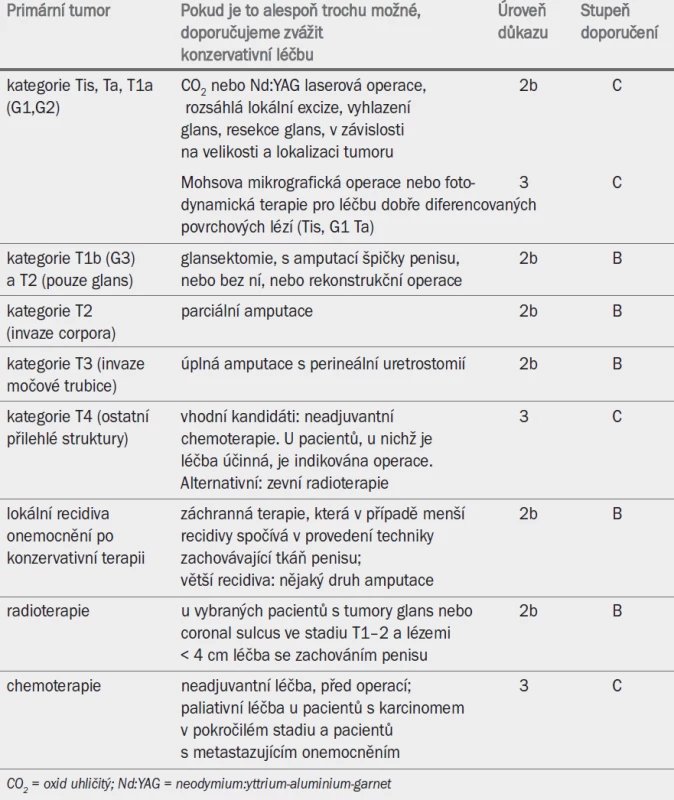
Volba léčby je podmíněna velikostí tumoru, jeho lokalizací na glans nebo corpora cavernosa a rovněž zkušeností urologa. Mezi operační léčbou, laserovou terapií a radioterapií nebyl zaznamenán žádný rozdíl s ohledem na míru lokální recidivy. Ačkoli konzervativní operace zlepšuje kvalitu života pacienta, riziko lokální recidivy je vyšší než po ablační terapii (27 vs 5 %). Pro zabezpečení negativních operačních okrajů je nutné provedení patologického vyšetření [1]. Přítomnost pozitivních okrajů nevyhnutelně vede k lokální recidivě. Úplné odstranění glans (glansektomie) a předkožky dosahuje mezi modalitami pro léčbu malých lézí penisu nejnižší míry recidivy (2 %) [2].
8.1.1 Tumory Tis, Ta a T1a
(tabulka)
8.1.2 Tumory T1b glans penisu s hlubší infiltrací (> 1 mm)
(tabulka)
Tumory T1b glans penisu s hlubší infiltrací (> 1 mm). 
Konzervativní léčba může být méně vhodná u pacientů s multifokálními lézemi, které tvoří 15 % všech případů recidivy. Abychom předešli vícečetné recidivě, doporučuje se odstranění celkové tkáně povrchu glans spolu s obřízkou (stupeň doporučení: C) [3].
Při užívání technik se zachováním tkáně penisu je nezbytné zajištění negativních chirurgických okrajů. Doporučuje se provedení patologického vyšetření vzorku chirurgických okrajů (stupeň doporučení: C). Okraj o šířce 3 mm lze obecně považovat za bezpečný [1].
8.1.3 Tumory T2 (tumor ohraničený na glans)
Doporučuje se provedení celkové glansektomie, s rekonstrukcí povrchu proximálních částí kavernózních těles, nebo bez ní (úroveň důkazu: 2b, stupeň doporučení: B) [8,10]. Další z možností je radioterapie (viz kapitola 8.1.7). U pacientů, kteří nejsou vhodnými kandidáty pro konzervativní rekonstrukční operaci, se doporučuje parciální amputace (stupeň doporučení: C) [11].
8.1.4 Lokální recidiva po konzervativní operační léčbě
V případě, že nedošlo k invazi corpus cavernosum, se doporučuje provedení druhé konzervativní operace (stupeň doporučení: C) [2–8]. Pakliže se však jedná o rozsáhlejší nebo hlouběji infiltrující recidivu, je parciální nebo úplná amputace nevyhnutelná (stupeň doporučení: B) [11]. V tomto případě je vhodné zvážit úplnou rekonstrukci penisu [12,13].
8.1.5 Tumor T2 s invazí do corpus cavernosum
Standardní léčba spočívá v parciální amputaci se zajištěním negativních chirurgických okrajů (stupeň doporučení: B) [11]. Okraj o šířce 5–10 mm lze obecně považovat za bezpečný [1]. Rekonstrukční operace může pacientovi pomoci vyrovnat se s pocitem mutilace [10,12,13].
8.1.6 Tumory T3 a T4
Výskyt tumorů v této kategorii je velmi vzácný (např. 5 % v Evropě, 13 % v Brazílii) [13]. Standardní léčba spočívá v celkové penektomii s provedením perineální uretrostomie (stupeň doporučení: B) [14]. Spatulací močové trubice lze předejít vzniku stenózy. U pacientů s onemocněním v pokročilejším stadiu (T4) se doporučuje neoadjuvantní chemoterapie. U pacientů, u nichž je terapie účinná, je následně indikována operační léčba (stejně jako při léčbě pacientů s fixovaným nebo recidivujícím nádorem nebo recidivou v inguinálních uzlinách (viz kapitola 8.2.4) (stupeň doporučení: B). V ostatních případech je vhodná adjuvantní chemoterapie nebo radioterapie (stupeň doporučení: C) (viz kapitoly 8.2.3 a 8.1.7).
8.1.7 Radioterapie
Ozařování primárního tumoru představuje další alternativní přístup umožňující zachování tkáně penisu, který dosahuje u vybraných pacientů s onemocněním T1–2 o průměru < 4 cm velmi dobrých výsledků (úroveň důkazu: 2b) [15–18]. Nejlepších výsledků lze dosáhnout v kombinaci s brachyterapií, kdy se míra lokální kontroly onemocnění pohybuje v rozmezí 70–90 % [15,17]. Pro brachyterapii nejsou vhodnými kandidáty pacienti s lézemi o velikosti > 4 cm.
Při ozařování zevním paprskem se užívá minimální dávka 60 Gy v kombinaci s brachyterapií nebo pouze brachyterapie [15–18]. Tkáň penisu zůstává po radioterapii zachována u přibližně 80 % pacientů. Míra lokálního selhání po radioterapii je vyšší než po parciální penektomii, lokální kontrolu však lze obnovit pomocí záchranné operace [16]. Mezi nejčastější komplikace patří stenóza močové trubice (20–35 %), nekróza glans (10–20 %) a pozdní fibróza corpora cavernosa (úroveň důkazu: 3) [18].
Nemáme k dispozici žádné vědecky podložené doporučení, které by upřednostňovalo operační přístup před radioterapií, nebo naopak. Důležitou roli při volbě terapie hrají zkušenosti a dostupné technologie.
8.1.8. Guidelines pro léčbu karcinomu penisu
Tab. 6 uvádí přehled možností léčby, včetně úrovní důkazu, z nichž vychází jednotlivá doporučení.
8.2 Regionální lymfatické uzliny
V sekci 8.2.7 je shrnut postup pro léčbu metastáz do lymfatických uzlin. Léčbou první volby pro pacienty s metastázami do inguinálních lymfatických uzlin je lymfadenektomie (stupeň doporučení: B). Tato technika spočívá v pečlivém vytvoření kožního laloku, pečlivé preparaci lymfatických uzlin, profylaxi antibiotiky. Pacient po zákroku nosí kompresní punčochy. Brzy po zákroku je nutné kontrolní vyšetření. U 30–70 % pacientů může docházet k dlouhodobému úniku lymfy, vzniku lymfedému dolních končetin a skrota, nekróze kožního laloku a infekci rány (úroveň důkazu: 2b) [14]. Nejnovější studie ukazují snížení míry výskytu komplikací, což poukazuje na význam toho, aby tuto techniku prováděl pouze zkušený operatér [19].
8.2.1 Pozorování
Pozorování lze doporučit pouze u pacientů s tumory Tis Ta a T1G1 [14,19,20].
8.2.2 Léčba pacientů s nehmatnými inguinálními uzlinami
Všechna v současné době dostupná neinvazivní diagnostická vyšetření neumožňují detekovat přibližně 20 % mikroskopických metastáz. Ani senzitivita publikovaného nomogramu nepřevyšuje 80 % (úroveň důkazu: b) [21]. Při klasifikaci pacientů s negativními lymfatickými uzlinami pro indikaci lymfadetektomie jsou užitečné nejrůznější rizikové faktory (úroveň důkazů: 2b) [14,19–21]. Tento přístup je doporučován při léčbě pacientů s klinicky negativními uzlinami ve verzi guidelines z roku 2004 [22]. V centrech, která nemají k dispozici diagnostické techniky pro vyšetření sentinelových uzlin, je toto doporučení stále opodstatněné. Podle nejnovější analýzy je třeba tumory T1G2 považovat za onemocnění se středním rizikem [23]. Výsledky brazilské studie lze považovat za zlatý standard pro míru přežití, které lze dosáhnout pouze pomocí operace [14,19]. Lepší senzitivity lze dosáhnout pouze po‑mocí DSNB (94 %) (úroveň důkazu: 2b) [24].
Podmínkou pro spolehlivou identifikaci sentinelových uzlin je předoperační mapování. Den před operací je pacientovi aplikována nanokoloidní látka Tc99m, injikována sulfanová modř, a při operaci je užita detekční sonda s g-paprsky. U pacientů s pozitivním výsledkem se provádí úplná inguinální LAD. V současné době užívaný protokol dosahuje 95% senzitivity [24]. Tato technika má krátkou učební křivku (stupeň doporučení: B) [25].
Vzhledem k ojedinělému výskytu tohoto onemocnění a možným zlepšením v diagnostice i léčbě se doporučuje odkázat pacienty do specializovaných center. Díky soustředění pacientů s SCC do deseti center po celé Velké Británii došlo v několika uplynulých letech ke zvýšení míry vyléčení tohoto onemocnění [26].
8.2.3 Léčba pacientů s hmatnými inguinálními uzlinami
FNAB představuje pod ultrazvukovou kontrolou vynikající, rychlý a snadný způsob pro detekci metastáz v lymfatických uzlinách (úroveň důkazu: 3) [27]. U pacientů s negativním výsledkem, u nichž máme podezření na přítomnost tumoru, je k dispozici celá škála technik: 1. aplikace antibiotik; 2. opakovaná FNAB; 3. chirurgické odstranění podezřelých uzlin a 4. LAD inguinálních uzlin. DSNB (dynamická biopsie sentinelových uzlin) se nedoporučuje u pacientů s hmatnými podezřelými uzlinami vzhledem k nespolehlivému výsledku (úroveň důkazu: 3) [28]. Tuto techniku je možné užít pro stranu nezasaženou tumorem, na zasažených místech se provádí LAD, která by vzhledem k významné morbiditě měla být vyhrazena pouze na pozitivní oblasti.
U pacientů s onemocněním v pokročilejším stadiu může být nezbytné provedení rekonstrukční operace s uzavřením primární rány [29]. Modifikovaná inguinální LAD je spojena s menší morbiditou, zmenšení preparované oblasti však zvyšuje pravděpodobnost falešně-negativních výsledků. Nejnovější poznatky týkající se lymfatické drenáže penisu ukazují, že je třeba preparovat alespoň centrální a obě horní Daselerovy zóny (úroveň důkazu: 3) [30,31].
Vzhledem k tomu, že z tumoru do pánevních lymfatických uzlin [30] nevede přímá lymfatická drenáž, není provedení pánevní LAD nezbytné (pakliže nejsou zasaženy inguinální uzliny, nebo je přítomna pouze jediná metastáza) (úroveň důkazu: 3) [14,19].
Naopak LAD se doporučuje při zasažení Cloquetovy uzliny nebo dvou (či více) dalších inguinálních uzlin. U pacientů s více než dvěma pozitivními lymfatickými uzlinami byla zjištěna 23% míra pozitivních pánevních uzlin, zatímco u pacientů s více než třemi pozitivními inguinálními uzlinami a u pacientů, u nichž došlo u alespoň jedné uzliny k rozšíření mimo kapsulu, 56% míra (úroveň důkazu: 2b) [14,19]. Jako sekundární technika může být indikována pánevní LAD.
V případě, že je indikována bilaterální preparace, je možné užít suprapubickou extraperitoneální incizi ve střední čáře. S provedením LAD není vhodné vyčkávat [31]. Laparoskopický přístup není pro radikální operaci vhodný.
8.2.4 Adjuvantní chemoterapie
Několik menších nesourodých studií popisuje provedení adjuvantní chemoterapie po resekci metastáz do lymfatických uzlin. Autoři z National Cancer Institute v italském Miláně zaznamenali u 25 po sobě jdoucích pacientů, kteří podstoupili 12 cyklů adjuvantní chemoterapie VBM (vinblastin, bleomycin, methotrexát) v letech 1979–1990, 84% míru dlouhodobého přežití bez recidivy (DFS) [32,33]. Tento výsledek je v rozporu s 39% mírou DFS u 38 po sobě jdoucích pacientů, kteří podstoupili LAD (s doplňující radioterapií nebo bez ní) v období 1960–1978 [32].
Od roku 1991 podstoupili pacienti s onemocněním pN2–3 tři cykly adjuvantní chemoterapie (s cisplatinou) a 5-FU s nižší toxicitou a lepším výsledkem než VBM (úroveň důkazu: 2b) [33].
8.2.5 Léčba pacientů s fixovanými nebo recidivujícími inguinálními lymfatickými uzlinami
Přímá operace se v tomto případě vzhledem k nepravděpodobnosti vyléčení, krátké době přežití a destrukčním následkům výkonu nedoporučuje (stupeň doporučení: B). Přímá chemoterapie s následným chirurgickým výkonem má slibné výsledky, tento typ léčby by však měl provádět pouze tým složený ze zkušených onkologů a operatérů [14,32,33].
Protokol sestávající z více druhů léčebných režimů byl vyzkoušen pouze u malého procenta pacientů. Kombinace cisplatiny, methotrexátu a bleomycinu (BMP), kterou zkoušeli vědci z Memorial Sloan-Kettering Cancer Center (NY), ukázala slibné výsledky, jiná studie od Southwest Oncology Group však prokázala nepřijatelnou toxicitu a pouze skromný výsledek [34].
Leijte et al publikovali studii zahrnující 20 pacientů, kteří podstoupili pět různých protokolů neoadjuvantní chemotera-pie v letech 1972–2005 [36]. Pacienti, u nichž byla léčba účinná, podstoupili po skončení chemoterapie operační léčbu s 37% dlouhodobou mírou přežití. Lékaři z MD Anderson Cancer Center testovali u sedmi pacientů kombinaci paclitaxelu, karboplatiny nebo paclitaxelu, cisplatiny a ifosfamidu s následnou operační léčbou [37]. U čtyř pacientů byla zaznamenána dlouhodobá míra přežití (48–84 měsíců), u žádného ze tří zbývajících pacientů však nebylo dosaženo významnější remise.
Předběžná studie testující kombinaci taxolu, cisplatiny a 5-FU prokázala signifikantní účinek u pěti ze šesti pacientů s fixovanými nebo recidivujícími inguinálními uzlinami. Trvalé remise však bylo dosaženo pouze u tří pacientů, kteří po chemoterapii podstoupili ještě operační léčbu [38].
Závěr
U pacientů s tumory pN2–3 se doporučuje adjuvantní chemoterapie (stupeň doporučení: C) [33], zatímco u pacientů, u nichž není možné provést resekci lymfatických uzlin, a pacientů s recidivujícím onemocněním je vhodná neoadjuvantní chemoterapie s radikální operací (stupeň doporučení: C) [36–38].
8.2.6 Význam radioterapie
Profylaktická radioterapie se u pacientů s tumory ve stadiu N0 nedoporučuje (stupeň doporučení: C) z následujících důvodů [39]:
- neschopnost prevence vzniku metastáz do lymfatických uzlin
- komplikace při radioterapii
- obtížnější sledování v důsledku fibrotických změn
Adjuvantní radioterapie může zlepšit lokoregionální kontrolu u pacientů s rozsáhlými metastázami a/nebo metastázami zasahujícími mimo uzlinu, ovšem za cenu závažných vedlejších účinků v podobě otoku a bolesti (stupeň doporučení: C).
8.2.7 Guidelines pro léčbu metastáz do lymfatických uzlin
(tabulka)
Guidelines pro léčbu metastáz do lymfatických uzlin. 
8.3 Literatuara
1. Minhas S, Kayes O, Hegarty P. What surgical resection margins are required to achieve oncologic control in man with primary penile cancer? BJU Int 2005; 96(7): 1040–1044.
http://www.ncbi.nlm.nih.gov/pubmed/16225525.
2. Hadway P, Corbishley CM, Watkin NA. Total glans resurfacing for premalignant lesions of the penis: initial outcome data. BJU Int 2006; 98(3): 532–536. http://www.ncbi.nlm.nih.gov/pubmed/16925748.
3. Bandieramonte G, Colecchia M, Mariani L et al. Peniscopically controlled CO2 laser excision for conservative treatment of in situ and T1 penile carcinoma: report on 224 patients. Eur Urol 2008; 54(4): 875–882.
http://www.ncbi.nlm.nih.gov/pubmed/18243513.
4. Windalh T, Andersson SO. Combined laser treatment for penile carcinoma: results after long-term follow up. J Urol 2003; 169(6): 2118–2121.
http://www.ncbi.nlm.nih.gov/pubmed/12771731
5. Schlenker B, Tilki D, Seitz M et al. Organ-preserving neodymium-yttriumaluminium-garnet laser therapy for penile carcinoma: a long-term follow-up. BJU Int 2010; [Epub ahead of print].
http://www.ncbi.nlm.nih.gov/pubmed/20089106.
6. Shindel AW, Mann MW, Lev RY et al. Mohs micrographic surgery for penile cancer: management and long-term followup. J Urol 2007; 178(5): 1980–1985. http://www.ncbi.nlm.nih.gov/pubmed/17869306.
7. Paoly J, Ternesten Bratel A, Löwhagen GB et al. Penile intraepithelial neoplasia: results of photodynamic therapy. Acta Derm Venereal 2006; 86(5): 418–421.
http://www.ncbi.nlm.nih.gov/pubmed/16955186.
8. Smith Y, Hadway P, Biedrzycki O et al. Reconstructive surgery for invasive squamous cell carcinoma of the glans penis. Eur Urol 2007; 52(4): 1179–1185. http://www.ncbi.nlm.nih.gov/pubmed/17349734.
9. Morelli G, Pagni R, Mariani C et al. Glansectomy with split-thickness skin graft for the treatment of penile cancer. Int J Impot Res 2009; 21(5): 311–314. http://www.ncbi.nlm.nih.gov/pubmed/19458620.
10. Palminteri E, Berdondini E, Lazzari M et al. Resurfacing and reconstruction of the glans penis. Eur Urol 2007; 52(3): 893–898.
http://www.ncbi.nlm.nih.gov/pubmed/17275169.
11. Gotsadze D, Matveev B, Zak B et al. Is conservative organsparing treatment of penile carcinoma justified? Eur Urol 2000; 38(3): 306–312.
http://www.ncbi.nlm.nih.gov/pubmed/10940705.
12. Garaffa G, Raheem AA, Christopher NA et al. Total phallic reconstruction after penile amputation for carcinoma. BJU Int 2009; 104(6): 852–856.
http://www.ncbi.nlm.nih.gov/pubmed/19239449.
13. Salgado CJ, Licata L, Fuller DA et al. Glans penis coronaplasty with palmaris longus tendon following total penile reconstruction. Ann Plast Surg 2009; 62(6): 690–692.
http://www.ncbi.nlm.nih.gov/pubmed/19461287.
14. Ornellas AA, Kinchin EW, No´brega BL et al. Surgical treatment of invasive squamous cell carcinoma of the penis: Brazilian National Cancer Institute long-term experience. J Surg Oncol 2008; 97(6): 487–495.
http://www.ncbi.nlm.nih.gov/pubmed/18425779.
15. deCrevoisier R, Slimane K, Sanfilippo N et al. Long term results of brachytherapy for carcinoma of the glans (N - or N+). Int J Radiol Biol Phys 2009; 74(4): 1150–1156.
http://www.ncbi.nlm.nih.gov/pubmed/19395183
16. Azrif M, Logue GP, Swindell R et al. External-beam radiotherapy in T1-2 N0 penile carcinoma. Clin Oncol (R Coll Radiol) 2006; 18(4): 320–325.
http://www.ncbi.nlm.nih.gov/pubmed/16703750.
17. Crook J, Esche B, Pond G. Penile brachytherapy: results for 60 patients. Brachytherapy 2007; 6 : 82–92.
18. Zouhair A, Coucke PA, Jeanneret W et al. Radiation therapy alone or combined surgery and radiation therapy in squamous-cell carcinoma of the penis? Eur J Cancer 2001; 37(2): 198–203.
http://www.ncbi.nlm.nih.gov/pubmed/11166146.
19. Ornellas AA, Seixas AL, Marota A et al. Surgical treatment of invasive squamous cell carcinoma of the penis: retrospective analysis of 350 cases. J Urol 1994; 151(5): 1244–1249.
http://www.ncbi.nlm.nih.gov/pubmed/7512656.
20. Protzel C, Alcatraz A, Horenblas S et al. Lymphadenectomy in the surgical management of penile cancer. Eur Urol 2009; 55(5): 1075–1088 http://www.ncbi.nlm.nih.gov/pubmed/19264390.
21. Cattan MW, Ficarra V, Artibani W et al. GUONE Penile Cancer Project Members. Nomogram predictive of cancer specific survival in patients undergoing partial or total amputation for squamous cell carcinoma of the penis. J Urol 2006; 175(6): 2103–2108. http://www.ncbi.nlm.nih.gov/pubmed/16697813.
22. Solsona E, Algaba F, Horenblas S et al. EAU guidelines on penile cancer. Eur Urol 2004; 46(1): 1–8. http://www.ncbi.nlm.nih.gov/pubmed/15183542.
23. Hughes BE, Leijte JAP, Kroon BK et al. Lymph node metastasis in intermediate-risk penile squamous cell cancer: a two-centre experience. Eur Urol 2009. [Epub ahead of print].
http://www.ncbi.nlm.nih.gov/pubmed/19647926.
24. Leijte JAP, Kroon BK, Valde´s Olmos RA et al. Reliability and safety of current dynamic sentinel node biopsy for penile carcinoma. Eur Urol 2007; 52(1): 170–177.
http://www.ncbi.nlm.nih.gov/pubmed/17316967.
25. Leijte JA, Hughes B, Graafland NM et al. Two-center evaluation of dynamic sentinel node biopsy for squamous cell carcinoma of the penis. J Clin Oncol 2009; 27(20): 3325–3329.
http://www.ncbi.nlm.nih.gov/pubmed/19414668.
26. Lucky MA, Rogers B, Parr NJ. Referrals into a dedicated British penile cancer centre and sources of possible delay. Sex Transm Infect 2009; 85(7): 527–530.
http://www.ncbi.nlm.nih.gov/pubmed/19584061.
27. Saisorn I, Lawrentschut N, Leewansangtong S et al. Fineneedle aspiration cytology predicts inguinal lymph node metastases without antibiotic pretreatment in penile carcinoma. BJU Int 2006; 97(6): 1125–1128.
http://www.ncbi.nlm.nih.gov/pubmed/16686716.
28. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 1: diagnosis of lymph node metastasis. BJU Int 2001; 88 : 467–472.
http://www.ncbi.nlm.nih.gov/pubmed/11589659.
29. Leijte JAP, Valde´s Olmos RA, Nieweg OE et al. Anatomical mapping of lymphatic drainage in penile carcinoma with SPECT-CT: implications for the extent of inguinal lymph node dissection. Eur Urol 2008; 54(4): 885–890.
http://www.ncbi.nlm.nih.gov/pubmed/18502024.
30. Daseler EH, Anson BJ, Reimann AF. Radical excision of inguinal and iliac lymph glands: a study based upon 450 anatomical dissections and upon supportive clinical observations. Surg Gynecol Obstet 1948; 87(6): 679–694.
http://www.ncbi.nlm.nih.gov/pubmed/18120502.
31. Horenblas S. Lymphadenectomy for squamous cell carcinoma of the penis. Part 2: the role and technique of lymph node dissection. BJU Int 2001; 88(5): 473–483.
http://www.ncbi.nlm.nih.gov/pubmed/11589660.
32. Pizzocaro G, Piva L. Adjuvant and neoadjuvant vincristine, bleomycin, and methotrexate for inguinal metastases from squamous cell carcinoma of the penis. Acta Oncol 1988; 27(6b): 823–824.
http://www.ncbi.nlm.nih.gov/pubmed/2466471.
33. Pizzocaro G, Piva L, Bandieramonte G, Tana S. Up-to-date management of carcinoma of the penis. Eur Urol 1997; 32(1): 5–15.
http://www.ncbi.nlm.nih.gov/pubmed/9266225.
34. Dexeus F, Logothetis C, Sella A et al. Combination chemotherapy with methotrexate, bleomycin and cisplatin for advanced squamous cell carcinoma of the male genital tract. J Urol 1991; 146(5): 1284–1287. http://www.ncbi.nlm.nih.gov/pubmed/1719241.
35. Haas G, Blumenstein B, Gagliano R et al. Cisplatin, methotrexate and bleomycin for the treatment of carcinoma of the penis: a Southwest Oncology Group study. J Urol 1999; 161(6): 1823–1825.
http://www.ncbi.nlm.nih.gov/pubmed/10332445.
36. Leijte JAP, Kerst JM, Bais E et al. Neoadjuvant chemotherapy in advanced penile carcinoma. Eur Urol 2007; 52(2): 488–494.
http://www.ncbi.nlm.nih.gov/pubmed/17316964.
37. Barmejo C, Busby JK, Spiess PE et al. Neoadjuvant chemotherapy followed by aggressive surgical consolidation for metastatic penile squamous cell carcinoma. J Urol 2007; 177(4): 1335–1338.
http://www.ncbi.nlm.nih.gov/pubmed/17382727.
38. Pizzocaro G, Nicolai N, Milani A. Taxanes in combination with cisplatin and fluorouracil for advanced penile cancer: preliminary results. Eur Urol 2009; 55(3): 546–551.
http://www.ncbi.nlm.nih.gov/pubmed/18649992.
39. Kulkarni JN, Kamat MR. Prophylactic bilateral groin node dissection versus prophylactic radiotherapy and surveillance in patients with N0 and N(1-2A) carcinoma of the penis. Eur Urol 1994; 26(2): 123–128. http://www.ncbi.nlm.nih.gov/pubmed/7957466.
9. SLEDOVÁNÍ
Sledování pacientů s karcinomem penisu je důležité hned z několika důvodů:
- umožňuje včasnou detekci recidivy, což má nesmírný význam, neboť většinu případů lokální a/nebo lokoregionální recidivy lze potenciálně vyléčit
- představuje jediný způsob pro zhodnocení výsledku léčby a umožňuje předvídat výskyt časných i pozdních komplikací
- má význam pro edukaci pacienta i lékaře
Pro stanovení racionálního sledovacího protokolu je nutné porozumět principu recidivy. V ideálním případě je vhodné sledování zahájit v rámci kontrolované studie. Na základě výsledků retrospektivní studie byl uveřejněn protokol pro sledování pacientů s karcinomem penisu [1].
9.1 Jak provádět sledování?
Cílem sledování je detekce lokální a/nebo regionální recidivy, které lze ve většině případů vyléčit. Naopak vzdálené metastázy jsou téměř vždy fatální [2]. Užitečnou pomůckou je stratifikace recidivy na základě rizika. Klasické metody sledování zahrnují pohled a fyzikální vyšetření. Vhodným doplňkem k tradičním metodám je moderní ultrazvukové vyšetření a zobrazovací vyšetření jako CT/PET, které prokazují slibné výsledky [3].
9.2 Kdy provádět sledování?
Interval a strategie sledování u pacientů s karcinomem penisu přímo souvisí s počáteční léčbou primární léze a regionálních lymfatických uzlin.
Ve výše zmiňované multicentrické studii [1] byly během prvních dvou let sledování zjištěny následující výsledky:
- 74,3 % případů recidivy celkem
- 66,4 % případů lokální recidivy
- 86,1 % případů regionální recidivy
- 100 % případů vzdálené recidivy
92,2 % všech případů recidivy se vyskytlo během prvních pěti let [1]. Ve všech případech recidivy, k nimž došlo po pěti letech, se jednalo o lokální recidivu nebo vznik nových primárních lézí. Během prvních dvou let se tedy doporučuje intenzivní sledování, po uplynutí dvou let je možné přejít na méně intenzivní sledovací program. U dobře poučených a motivovaných pacientů lze sledování po pátém roce ukončit, ačkoli by pacienti sami měli nadále provádět samovyšetření.
9.3 Primární tumor
Vznik lokální recidivy je pravděpodobnější u pacientů, kteří byli léčení pomocí jakéhokoli typu lokální penis šetřící terapie (tj. lokální resekce, laserové terapie, brachyterapie, Mohsovy procedury, související terapie) [1,4]. Na rozdíl od regionální recidivy nemá lokální recidiva žádný vliv na přežití pacienta [1,4].
Přítomnost lokální recidivy může snadno odhalit sám pacient, jeho partnerka nebo lékař. Poučení pacienta představuje nedílnou součást sledování. Pacienta je třeba motivovat k tomu, aby v případě, že shledá jakékoli změny, navštívil odborníka. Ačkoli byly zaznamenány i případy pozdní lokální recidivy, doporučuje se sledování po pěti letech ukončit s podmínkou, že pacient nahlásí jakékoli případné změny [5]. Tento postup je možný díky skutečnosti, že lokální recidiva nijak neohrožuje život pacienta. Hlavní důraz je třeba klást na samovyšetření. U pacientů, u nichž je nepravděpodobné, že se budou sami vyšetřovat, může být nezbytné dlouhodobé sledování.
U pacientů, kteří podstoupili léčbu se zachováním tkáně penisu, se doporučuje provádět sledování každé tři měsíce po dobu dvou let, poté v šestiměsíčních intervalech za podmínky, že pacient a jeho partnerka byli poučeni o nutnosti provádět pravidelné vyšetření penisu a kontaktovat specialistu v případě, že objeví jakoukoli abnormalitu. Pacientovi je nutné zdůraznit nezbytnost pravidelného provádění samovyšetření i po skončení sledování po pěti letech. Po amputaci penisu se doporučuje méně časté sledování, v intervalu šesti měsíců. Riziko lokální recidivy je v tomto případě maximálně 5 % [1,4].
9.4 Regionální recidiva
Během prvních dvou let po výkonu se doporučuje důkladné sledování vzhledem k tomu, že se v tomto období vyskytuje většina případů regionální recidivy, ať již byl pacient zařazen do programu „wait-and-see“, podstoupil SNB, nebo inguinální LAD.
Dřívější doporučení se týkala především fyzikálního vyšetření inguinální oblasti. Zkušenosti s přístupem „wait-and-see“ a DSNB však prokázaly, že regionální recidiva se i navzdory intenzivnímu sledování může objevit i naprosto nepředvídatelně [6]. Ultrazvukové vyšetření a okamžitá FNAB dosahují při detekci okultních metastáz [6,7] povzbudivých výsledků, zdá se tedy opodstatněné ultrazvukové vyšetření zahrnout do protokolu fyzikálního vyšetření.
Pacienti, u nichž byl zvolen přístup „wait-and-see“, mají vyšší riziko recidivy (9 %) než pacienti, u nichž bylo stadium onemocnění stanoveno chirurgicky (2,3 %) bez ohledu na to, zda byla užita technika LAD, nebo DSNB. Toto zjištění se však týká pouze pacientů s histologicky prokázanými metastázami do lymfatických uzlin.
Pacienti, kteří podstoupili operační léčbu z důvodu metastáz do lymfatických uzlin, mají vyšší riziko recidivy (19 %) [1]. Na základě těchto zjištění byla navržena změna sledovacího protokolu.
Pacienti, u nichž byl zvolen přístup „wait-and-see“, a pacienti, kteří podstoupili z důvodu prokázaných metastáz do lymfatických uzlin LAD, by měli být sledováni každé tři měsíce. Sledování by mělo zahrnovat ultrazvukové vyšetření třísel. Během prvních dvou let, kdy je pravděpodobnost recidivy nejvyšší, by měl být indikován intenzivní sledovací protokol. CT scan byl nahrazen ultrazvukovým vyšetřením s okamžitou FNAB. U pacientů s rizikem regionální recidivy a vzniku vzdálených metastáz se užívá PET/CT. Kostní scan a další vyšetření se doporučují pouze u symptomatických pacientů.
9.5 Guidelines pro sledování pacientů s karcinomem penisu
V tab. 7 je shrnut program pro sledování pacientů s karcinomem penisu, včetně stupně doporučení.
Tab. 7. Program pro sledování pacientů s karcinomem penisu. 
9.6 Literatura
1. Leijte JAP, Kirrander P, Antonini N et al. Recurrence patterns of squamous cell carcinoma of the penis: recommendations for follow-up based on a two-centre analysis of 700 patients. Eur Urol 2008; 54(1): 161–168.
http://www.ncbi.nlm.nih.gov/pubmed/18440124.
2. Horenblas S, van Tinteren H, Delamarre JFM et al. Squamous cell carcinoma of the penis. III. Treatment of regional lymph nodes. J Urol 1993; 149(3): 492–497.
http://www.ncbi.nlm.nih.gov/pubmed/8437253.
3. Lont AP, Gallee MP, Meinhardt W et al. Penis conserving treatment for T1 and T2 penile carcinoma: clinical implications of a local recurrence. J Urol 2006 Aug;176(2):575–580; discussion 580.
http://www.ncbi.nlm.nih.gov/pubmed/16813892.
4. Horenblas S, Newling DW. Local recurrence tumour after penis-conserving therapy. A plea for longterm follow-up. Br J Urol 1993; 72(6): 976–979.
http://www.ncbi.nlm.nih.gov/pubmed/8306171.
5. Kroon BK, Horenblas S, Lont AP et al. Patients with penile carcinoma benefit from immediate resection of clinically occult lymph node metastases. J Urol 2005; 173(3): 816–819.
http://www.ncbi.nlm.nih.gov/pubmed/15711276.
6. Kroon BK, Horenblas S, Deurloo EE et al. Ultrasonography-guided fine-needle aspiration cytology before sentinel node biopsy in patients with penile carcinoma. BJU Int 2005; 95(4): 517–521.
http://www.ncbi.nlm.nih.gov/pubmed/15705071.
7. Krishna RP, Sistla SC, Smile R et al. Sonography: An underutilized diagnostic tool in the assessment of metastatic groin nodes. Clin Ultrasound 2008; 36(4): 212–217.
http://www.ncbi.nlm.nih.gov/pubmed/17960822.
10. KVALITA ŽIVOTA
10.1 Sexualita a fertilita po léčbě karcinomu penisu
Spolu se zvyšujícím se procentem pacientů, u nichž léčba karcinomu penisu umožní dlouhodobé přežití, jsou sexuální dysfunkce a infertilita stále častěji vnímány jako negativní důsledek léčby, který má dopad na kvalitu života pacienta [1].
10.1.1 Sexuální aktivita a kvalita života po léčbě karcinomu penisu pomocí laserové terapie
Švédská retrospektivní studie založená na strukturovaném osobním pohovoru s pacienty zahrnovala muže, kteří v letech 1986–2000 podstoupili laserovou léčbu lokalizovaného karcinomu penisu [2]. Léčbu podstoupilo celkem 67 pacientů, z nichž 58 (průměrný věk 63 let) bylo ještě v roce 2006 naživu. 46 (79 %) z nich se zúčastnilo pohovoru. Téměř všichni pacienti byli schopni si vybavit první symptom, 37 % z nich uvedlo, že odkládali návštěvu lékaře po > 6 měsíců. Dotazovaní pacienti měli větší počet sexuálních partnerek a vyšší prevalenci pohlavně přenosných chorob než muži v normální švédské populaci. Po laserové terapii uvádějí pacienti významné snížení provádění některých sexuálních praktik jako např. manuální stimulace, dráždění nebo felace. Celková spokojenost dotazovaných pacientů byla srovnatelná s obecnou populací.
Závěrem lze říci, že někteří pacienti oddalují návštěvu lékaře po dlouhou dobu i přesto, že jsou si vědomi prvních lokálních symptomů. Muži, kteří podstoupili laserovou léčbu lokalizovaného karcinomu penisu, obnovili po terapii do značné míry svůj sexuální život. S výjimkou somatických potíží byli pacienti spokojeni se svým životem celkově i s ostatními hodnocenými oblastmi, včetně sexuálního života.
10.1.2 Sexuální funkce po léčbě karcinomu penisu pomocí parciální penektomie
Pro účely srovnání sexuální funkce a spokojenosti před parciální penektomií a po ní se 18 brazilských pacientů zúčastnilo osobního pohovoru a vyplnilo dotazník IIEF (Index of Erectile Fiction) hodnotící erektilní funkci, orgazmickou funkci, sexuální touhu, spokojenost s pohlavním stykem a celkovou spokojenost se sexuálním životem [3]. Střední věk pacientů byl 52 let. Střední délka penisu po parciální penektomii byla 4 cm v ochablém stavu. 55,6 % pacientů uvedlo dostatečnou erektilní funkci pro uskutečnění pohlavního styku.
Jako hlavní důvod pro sexuální abstinenci uvedlo 50 % abstinujících pacientů pocit studu z malé velikosti penisu, který je navíc bez glans penis. U 33,3 % těchto mužů byly na vině rovněž komplikace spojené s operací. 66,7 % pacientů pociťovalo sexuální touhu stejně často jako před operací, 72,7 % pacientů ejakulovalo a dosáhlo orgazmu při každé sexuální stimulaci nebo pohlavním styku. Pouze 33,3 % pacientů si však udrželo stejnou čestnost pohlavního styku jako před operací a pociťovalo celkovou spokojenost se sexuálním životem se svou partnerkou a sexuálním životem celkově. Závěrem lze říci, že ve všech doménách sexuální funkce bylo po parciální penektomii zaznamenáno statistické zhoršení.
10.2 Genitální mutilace, recidiva a úmrtí
V dnešní době lze karcinom penisu vyléčit u téměř 80 % pacientů. Zkušenost lékaře s léčbou tohoto vzácně se vyskytujícího tumoru je velmi užitečná [4], doporučuje se tedy pacienta odkázat do specializovaného centra. Psychologická podpora hraje u pacientů s tímto onemocněním významnou roli. Operace se zachováním tkáně penisu poskytuje pacientovi přirozeně lepší kvalitu života než amputace penisu, tuto techniku je tedy vhodné upřednostnit, pakliže je to jen trochu možné.
10.3 Literatura
1. Schover LR. Sexuality and fertility after cancer. Hematology Am Soc Hematol Educ Program 2005; 523–527.
http://www.ncbi.nlm.nih.gov/pubmed/16304430.
2. Skeppner E, Windahl T, Andersson S et al. Treatment-seeking, aspects of sexual activity and life satisfaction in men with laser-treated penile carcinoma. Eur Urol 2008; 54(3): 631–639.
http://www.ncbi.nlm.nih.gov/pubmed/18788122.
3. Romero FR, Romero KR, Mattos MA et al. Sexual function after partial penectomy for penile cancer. Urology 2005; 66(6): 1292–1295.
http://www.ncbi.nlm.nih.gov/pubmed/16360459.
4. Leijte JA, Gallee M, Antonini N et al. Evaluation of current TNM classification of penile carcinoma. J Urol 2008; 180(3): 933–938.
http://www.ncbi.nlm.nih.gov/pubmed/18635216.
11. ZKRATKY UŽITÉ V TEXTU
Seznam neobsahuje nejběžnější zkratky.
5-FU 5-fluorouracil
BMP ‑cisplatina, methotrexát, bleomycin
CT počítačová tomografie
DSNB ‑dynamická biopsie sentinelové uzliny
EAU Evropská urologická asociace
FDA ‑Úřad pro kontrolu potravin a léčiv (USA)
FNAB aspirační biopsie jemnou jehlou
HPV lidský papilomavirus
LAD lymfadenektomie
MRI ‑zobrazovací vyšetření magnetickou rezonancí
Nd-YAG ‑Neodynium:Yttrium-Aluminum-Garnet
PET pozitronová emisní tomografie
PF cisplatina a fluorouracil
PGE1 prostglandin E1 (alprostadil)
SCC karcinom ze skvamózních buněk
SNB biopsie sentinelové uzliny
TNM ‑Tumour Node Metastasis (tumor, uzlina, metastáza)
VBM ‑vinblastin, bleomycin, methotrexát
Štítky
Detská urológia Urológia
Článek Úvodní slovoČlánek Ze zahraničních periodik
Článok vyšiel v časopiseUrologické listy
Najčítanejšie tento týždeň
2010 Číslo 4- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Léčba tumoru varlete v časném stadiu
- Karcinom penisu v populaci nigerijských mužů
- Současné přístupy k inguinální lymfadenektomii při léčbě karcinomu penisu
- Karcinom penisu: terapeutická výzva
- Substituční terapie testosteronem po léčbě karcinomu prostaty: nové koncepty v současné urologické praxi
- Infertilní pár z perspektivy urologa: diagnostické vyšetření a medikamentózní léčba
- Úvodní slovo
- Moderní endokrinologické vyšetření infertilního muže
- Možnosti léčby Peyronieho choroby
- Co je považováno za erotické v neverbální komunikaci
- Léčba lokoregionálního onemocnění karcinomu penisu
- Vyšetřování a medikamentózní léčba benigní hyperplazie prostaty: přehledový článek
- Význam inhibice RANK ligandu v léčbě kostních komplikací u pacientů s metastazujícím karcinomem prostaty
- Ze zahraničních periodik
- Guidelines EAU pro karcinom penisu
- Urologické listy
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Co je považováno za erotické v neverbální komunikaci
- Léčba lokoregionálního onemocnění karcinomu penisu
- Možnosti léčby Peyronieho choroby
- Substituční terapie testosteronem po léčbě karcinomu prostaty: nové koncepty v současné urologické praxi
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy







